Method Article
Visualizzazione di cellule Multiciliated in Zebrafish attraverso un protocollo combinato di tutta Monte fluorescente ibridazione In Situ e immunofluorescenza
In questo articolo
Riepilogo
Sviluppo di ciglia è vitale per l'organogenesi corretto. Questo protocollo descrive un metodo ottimizzato per etichettare e visualizzare le cellule ciliate di zebrafish.
Abstract
Negli ultimi anni, l'embrione di zebrafish è emerso come un modello popolare per studiare biologia inerente allo sviluppo a causa di caratteristiche quali la ex utero lo sviluppo dell'embrione e trasparenza ottica. In particolare, l'embrione di zebrafish è diventato un organismo importante per studiare l'organogenesi renale vertebrati, nonché lo sviluppo delle cellule multiciliated (MCC). Per visualizzare MCCs nel rene embrionale zebrafish, abbiamo sviluppato un protocollo combinato di ibridazione del intero-supporto fluorescente in situ (FISH) e montare tutto immunofluorescenza (IF) che permette l'imaging ad alta risoluzione. Questo manoscritto descrive la nostra tecnica per la co-localizzazione di trascritti di RNA e proteine come strumento per comprendere meglio la regolamentazione dei programmi di sviluppo attraverso l'espressione di vari fattori di lignaggio.
Introduzione
Nel corso degli ultimi decenni, il pesce zebra (Danio rerio) è emerso come un organismo il primo modello per studiare biologia inerente allo sviluppo. Gli embrioni si sviluppano di fuori della madre e sono otticamente trasparenti. Inoltre, la formazione di organi vitali come l'occhio, il rene e il proencefalo si verifica rapidamente, con strutture formate da solo 24 h post fertilizzazione (hpf). D'importanza, il genoma di zebrafish è altamente conservato con mammiferi1,2,3. Inoltre, zebrafish e organi mammiferi hanno simili anatomia e fisiologia. Il rene embrionale di zebrafish, o pronephros, dimostra il valore del sistema modello per l'esame di funzione del gene durante primi nefrogenesi e determinazione di destino delle popolazioni di cellule epiteliali conservata del nefrone vertebrati4, 5 , 6 , 7 , 8 , 9 , 10. allo stesso modo, l'embrione di zebrafish è diventato sempre più importante nell'esaminare l'ontogenesi di MCCs11,12,13,14,15, 16 , 17.
Come suggerisce il loro nome, MCCs sono cellule epiteliali, caratterizzate da un fascio di ciglia mobili situato sulla superficie apicale17. In zebrafish, MCCs funzionare in flusso di fluido e sono disperse in un "sale e pepe" come la moda in tutta la metà di ogni nefrone dei pronephros da 24 hpf11,12,13,14, 15 , 16 , 17. anche se essi sono stati notati solo in una manciata di rene umano malattia casi18,19,20,21, MCCs sono prevalenti in altri tessuti di mammiferi come il cervello e trachea22,23,24, che pone una serie di sfide per il disegno sperimentale. Elegante in vari modelli vertebrati compreso zebrafish hanno dimostrato una via conservata del destino MCC, con la tacca via di segnalazione come inibitore di MCC sviluppo12,17,25 ,26,27. Di conseguenza, i pronephros zebrafish fornisce un modello facilmente accessibile per studiare i meccanismi genetici di MCC sviluppo in vivo11,12,13,14, 15 , 16 , 17.
Trasparenza e facile manipolazione genetica degli embrioni di zebrafish hanno dimostrato di essere tratti inestimabile quando si studia le vie genetiche e molecolari che regolano il destino delle cellule, la crescita dei tessuti e lo sviluppo del primo embrione1,2 ,3. Come tali, tecniche tradizionali per visualizzare trascrizioni del gene e della proteina, quali ibridazione in situ e intero monte se, sono stati applicati a e ottimizzato per il Danio rerio16,28,29, 30,31,32,33,34,35,36,37,38. Combinando i più diffusi protocolli per pesce e se, è possibile aggiungere etichette e analizzare MCCs in vivo16,28,37,38.
Protocollo
Il seguente protocollo utilizza zebrafish adulti tenuto e curato dal centro per la ricerca di Zebrafish presso l'Università di Notre Dame. Tutti i metodi per l'utilizzo di embrioni e zebrafish adulti sono stati approvati dal comitato di uso e cura degli animali istituzionale.
1. embrione fissazione
- Raccogliere gli embrioni di zebrafish utilizzando metodi precedentemente descritti39,40. Alle 24 hpf, aggiungere 500 µ l di soluzione di miscela di proteasi aspecifiche (50 mg/mL) per l'E3 in un embrione piatto Incubare a temperatura ambiente (TA).
- Una volta che gli embrioni iniziano a scoppiare di chorion, rimuovere tutto il liquido dal piatto dell'embrione.
- Lavare gli embrioni 2 - 3 volte con E3 fresco aggiungendo circa 20 mL di E3, agitando delicatamente la E3 nel piatto, e quindi decantare il liquido in un recipiente di scarico liquido.
- Per eutanasia gli embrioni prima del fissaggio, aggiungere 2 mL di tricaina 0,2% per l'E3.
- Trasferire gli embrioni in un flaconcino di vetro da 5 mL utilizzando una pipetta Pasteur di plastica. Rimuovere la maggior parte della soluzione tricaina/E3 con la pipetta dopo gli embrioni hanno depositato sul fondo del flaconcino.
- Difficoltà 24 embrioni hpf con 5 mL di paraformaldeide al 4% (PFA) per 2-4 h a RT, senza agitazione.
Attenzione: PFA è tossico e soluzioni PFA dovranno essere gestiti sotto una cappa chimica, mentre il ricercatore indossa un camice da laboratorio, guanti e occhiali di protezione. Preparazione del fissativo PFA dalla polvere granulata di PFA dovrebbe essere effettuato con cura eccezionale, come il granulato PFA tende a disperdere attraverso carica statica.
Nota: Gli embrioni possono risolvere in 4% PFA durante la notte a 4 ° C. Preparare 4% PFA riscaldando 1x tamponato fosfato salino (PBS) ad ebollizione rimestando continuamente la soluzione per sciogliere completamente il granulato PFA. Una volta che la soluzione è raffreddata giù per RT, il 4% PFA è filtro sterilizzato facendolo passare attraverso un sistema monouso di 0,45 µm per filtrazione sotto vuoto, quindi e aliquotati in porzioni di 15 mL o 50 mL per la conservazione a-20 ° C. - Rimuovere il 4% PFA e gli embrioni di lavare due volte con 1 tampone fosfato X salino con 0.1% Tween-20 (PBST) a RT. lavare gli embrioni una volta con 5 mL di metanolo al 100% (MeOH) a RT. aggiungere 5 mL di fresco 100% MeOH agli embrioni e incubare a-20 ° C per almeno 20 min.
Nota: Gli embrioni possono essere memorizzati in 100% MeOH a-20 ° C fino al momento per la preparazione di embrione.
2. ibridazione e preparazione embrione
- Reidratare gli embrioni con il lavaggio una volta in 5 mL di 50% MeOH in 1 x PBST per 5 min a RT. continua reidratazione lavando gli embrioni in 5 mL di 30% MeOH in 1 x PBST per 5 min a RT. lavare gli embrioni in 5 mL di 1 x PBST due volte per 5 minuti ciascuno, a RT.
- Permeabilize gli embrioni di incubarle in 5 mL di una soluzione di 1:1,000 proteinasi K (pK) (10 mg/mL) in 1 x PBST per 2 minuti a TA.
Nota: Più vecchi embrioni possono essere incubati più di 2 min con la concentrazione di pK indicata sopra, tuttavia meno di 2 minuti di tempo di una concentrazione di 5 mg/mL e l'incubazione è suggerito per gli embrioni più giovani di 24 hpf. - Rimuovere la soluzione di pK e lavare immediatamente in 5 mL di 1x PBST due volte a RT. Difficoltà gli embrioni in 5 mL di 4% PFA a temperatura ambiente per almeno 20 min.
Nota: Gli embrioni possono risolvere in 4% PFA durante la notte a 4 ° C. - Rimuovere PFA e lavare due volte in 5 mL di 1 x PBST a TA.
- Trasferire gli embrioni in 5 mL di 1 x PBST nelle provette microcentrifuga fondo piatto posizionato verticalmente in un rack microcentrifuga a RT per facilitare le interazioni tra ciascun embrione e la soluzione di ibridazione successive.
- Lavare gli embrioni due volte in 1,5 mL di soluzione di ibridazione (IBRID +) a RT. aggiungere 1,5 mL di fresco Hyb + e incubare gli embrioni a 70 ° C in un forno di ibridazione per 4-6 h.
- Sostituire i 1,5 mL di ibrid + con un volume di soluzione della sonda (10 µ l RNA sonda/500 µ l Hyb +) sufficiente a coprire completamente gli embrioni.
Nota: Sintetizzare antisenso sonda RNA usando precedentemente descritto metodi39. - Ibridare la sonda pernottamento in forno a 70 ° C l'ibridazione con il montante di tubi singoli posizionati nel rack microcentrifuga, senza agitazione.
3. caldo lavaggi e blocco
Nota: Lavaggi caldi vengono eseguite mettendo la soluzione appropriata sugli embrioni e incubando poi in forno a 70 ° C. ibridazione Per mantenere le soluzioni di lavaggio a 70 ° C, mettere le provette da 50 mL di ciascuna soluzione in forno ibridazione quando la sonda / IBRID + miscela viene aggiunto.
- Rimuovere la sonda. Lavare gli embrioni due volte a 70 ° C in 1,5 mL di 50% formammide/2 x tampone salino-sodio citrato (SSC) per 20-30 minuti ciascuno.
Nota: La sonda può essere memorizzata nella Hyb + a-20 ° C e ri-utilizzata in un secondo momento. - Lavare gli embrioni una volta a 70 ° C in 1,5 mL di 2 x SSC per 15 min. lavare gli embrioni due volte a 70 ° C in 1,5 mL di 0,2 X SSC per 20-30 minuti ciascuno. Sostituisci 0.2 x SSC con 1,5 mL di reagente bloccante e incubare per una notte a 4 ° C.
Nota: È possibile incubare reagente bloccante a RT per 4 h invece di pernottamento.
4. anticorpo incubazione e acido maleico Buffer lavaggi
Nota: Conservare gli embrioni protetti dalla luce ambientale.
- Sostituire il Reagente Bloccante con 0,2 mL di anti-DIG-POD nel Reagente Bloccante con un rapporto di 1:1,000 e incubare per 3 h in lamina o un'altra luce di blocco coperchio a TA.
Nota: In alternativa, l'anticorpo può incubare overnight a 4 ° C. - Dopo 3 h, lavare gli embrioni in 1,5 mL di tampone acido maleico 2 - 4 volte per 10-15 minuti ciascuno, a RT. Incubare gli embrioni durante la notte a 4 ° C in 1,5 mL di tampone fresco acido maleico.
Nota: Non è necessario Incubare per una notte nel buffer di acido maleico, ma facendo così diminuisce la sonda sfondo.
5. sonda di rilevamento e rimozione di perossidasi
Nota: Conservare gli embrioni protetti dalla luce ambientale.
- Tampone acido maleico di rimuovere e sostituire con 1,5 mL di PBS 1X. Lavare gli embrioni due volte in 1,5 mL di PBS 1X per 5 min a RT. Incubare embrioni in 0,2 mL di Cy3 fluorescente macchiatura soluzione per 60 minuti a TA.
Nota: Il tempo di incubazione può variare per diverse sonde. - Lavare gli embrioni una volta con 1,5 mL della seguente percentuale MeOH in 1X PBS per 10 min a RT: 30% MeOH, 50% MeOH, 75% MeOH e 100% MeOH.
- Incubare gli embrioni con 1,5 mL di 1% H2O2 in MeOH per 30 min a RT. Wash gli embrioni una volta con 1,5 mL di MeOH seguenti soluzioni in 1X PBS per 10 min a RT: 75% MeOH, 50% MeOH e 30% MeOH. Lavare gli embrioni due volte per 5 minuti ciascuno a RT in 1,5 mL di PBS 1X.
Nota: Gli embrioni possono essere memorizzati in PBS durante la notte a 4° C.
6. immunofluorescenza
Nota: Conservare gli embrioni protetti dalla luce ambientale.
- Lavare gli embrioni in 1,5 mL di ddH2O per 5 min a RT. Wash gli embrioni in 1,5 mL di acetone pre-refrigerati (conservato a-20 ° C) per 7 min a RT. lavare gli embrioni una volta in 1,5 mL di ddH2O per 5 min a RT. Wash gli embrioni una volta in 1.5 mL di 1 x PBST con 1% DMSO (PBDT) per 5 minuti a TA.
- Incubare gli embrioni in 1,5 mL di PBDT + 10% siero bovino fetale (FBS) su un agitatore meccanico a temperatura ambiente per 2 h.
- Rimuovere PBDT + FBS e sostituirli con 1,5 mL di anticorpi primari, anti-acetilato tubulina (prodotto da mouse) e anti-γ-tubulina (prodotto da coniglio), diluito insieme a 1: 400 in PBDT + 1% FBS. Incubare gli embrioni durante la notte a 4 ° C.
Nota: Tempi di incubazione possono variare a seconda l'anticorpo primario. Test di diversi intervalli di tempo potrebbe essere necessario ottimizzare l'etichettatura.
7. secondaria dell'anticorpo
Nota: Conservare gli embrioni protetti dalla luce ambientale.
- Per rimuovere l'eccesso anticorpo non legato da embrioni, lavare in 1,5 mL di PBDT + 1% FBS + 0,1 M NaCl per 1 min a RT su un agitatore meccanico.
- Lavare gli embrioni 5 volte in 1,5 mL di PBDT + 1% FBS + 0,1 M NaCl per 30 minuti ciascuno, su un rocker RT. lavare gli embrioni in 1,5 mL di PBDT + 1% FBS per 30 min a RT su un agitatore meccanico.
- Incubare gli embrioni durante la notte a 4 ° C a 200 µ l di anticorpi secondari, Alexa 488 capra anti-topo IgG e Alexa 647 capra anti-coniglio IgG, diluito insieme a PBDT a 1: 500.
8. DAPI macchiatura
Nota: Conservare gli embrioni protetti dalla luce ambientale.
- Lavare gli embrioni rapidamente a RT in 1,5 mL di PBDT due volte. Sostituire PBDT con 1,5 mL di DAPI, diluito 1:15000 in 1 X PBST e incubare per 15 min a RT su un agitatore meccanico.
- Lavare gli embrioni in 1,5 mL di PDBT + 1% FBS + 0,1 M NaCl tre volte a RT per 15-20 minuti ciascuno. Conservare gli embrioni in 1,5 mL di PBDT a 4 ° C fino al momento di montare e immagine.
9. montaggio e Imaging per Zebrafish Pronephros
- Embrione laici laterale su vetrino in un piccolo volume, circa 10 µ l, di PBDT.
- Spremere l'embrione dietro gli occhi con una coppia di una pinzetta per rimuovere la testina e alcuni della palla tuorlo.
- Utilizzare una pinzetta per raschiare delicatamente la palla di tuorlo rimanente dal corpo dell'embrione. Rimuovere il tuorlo dissociata e liquido supplementare dal vetrino con un tessuto sottile.
- Aggiungere una goccia di montaggio supporto alla coda rimanente dell'embrione e posizionare in modo che la coda è disposto lateralmente. Porre un coprivetrino in cima alla coda per appiattire il campione, quindi inserire in una casella di scivolo coperto.
- Ciglia di rene a 60 ingrandimenti su un microscopio confocale utilizzando i seguenti canali di immagine: DAPI in blu (set presso 408,0 laser nm), FITC in verde (set presso 488.0 laser nm), Cy3 tingere-contrassegnati in rosso (set alle 561.0 laser nm) e Alexa 680 in bianco (set a 637.0 laser nm).
Risultati
Embrioni di zebrafish di selvaggio-tipo sono stati fissati alle 24 hpf e immediatamente preparato come descritto sopra. Figura 1 illustra un flusso di lavoro sperimentale, insieme ad alcune fasi illustrate. Il flusso di lavoro descritto nei passaggi 1-8 comprende i processi di approvvigionamento campione, fissazione e la manipolazione del tessuto fisso per etichettare le trascrizioni endogene con riboprobes antisenso seguita dall'immunofluorescenza per etichetta proteina di interesse. Passaggio 9 del flusso di lavoro si riferisce specificatamente progettati per ottimizzare la visualizzazione del tronco embrionali zebrafish tecniche di imaging ed il montaggio. Nei disegni che accompagnano il passaggio 9, illustriamo il metodo di manipolazione per il posizionamento del tessuto su un vetrino. In questo passaggio, la palla di testa e tuorlo di embrione vengono rimossi, lasciando la coda per essere posizionato lateralmente tra una lastra di vetro e il vetrino coprioggetti. Rimozione della sfera di tuorlo e la testa è suggerito per la migliore immagine della popolazione residente MCC in pronephros, come la palla di tuorlo reagisce in auto e ostacola il processo di montaggio.
Immagini rappresentative ottenute utilizzando un microscopio confocale sono fornite in Figura 2, che mostra l'embrione stesso di selvaggio-tipo a 60x e uno zoom digitale allo stesso ingrandimento. I pannelli superiori forniscono immagini di ogni singolo canale, mentre i due pannelli di fondo sono la sovrapposizione composita di questi dati di imaging. La scatola bianca (nell'immagine colonna sinistra) delinea l'area che è al centro dello zoom digitale (l'immagine della colonna di destra). Evidenziata nel riquadro finale dello zoom digitale, i nuclei sono stati etichettati in DAPI e MCCs sono stati rilevati basato su un ribosonde antisenso progettato per riconoscere odf3b, dove gli anticorpi a γ-tubulina denotano i corpi basali e α-tubulina denota le ciglia. Nello zoom digitale della sovrapposizione composito, il cerchio con tratteggio giallo indica il perimetro di un MCC, che è stato identificato dovuto il possesso di odf3b trascrizioni, più corpi basali e ciglia. La cella adiacente mono-ciliated, etichettata con un cerchio giallo punteggiato, è stata identificata basata sul fenotipo di possedere un singolo corpo basale e un singolo Cilio.
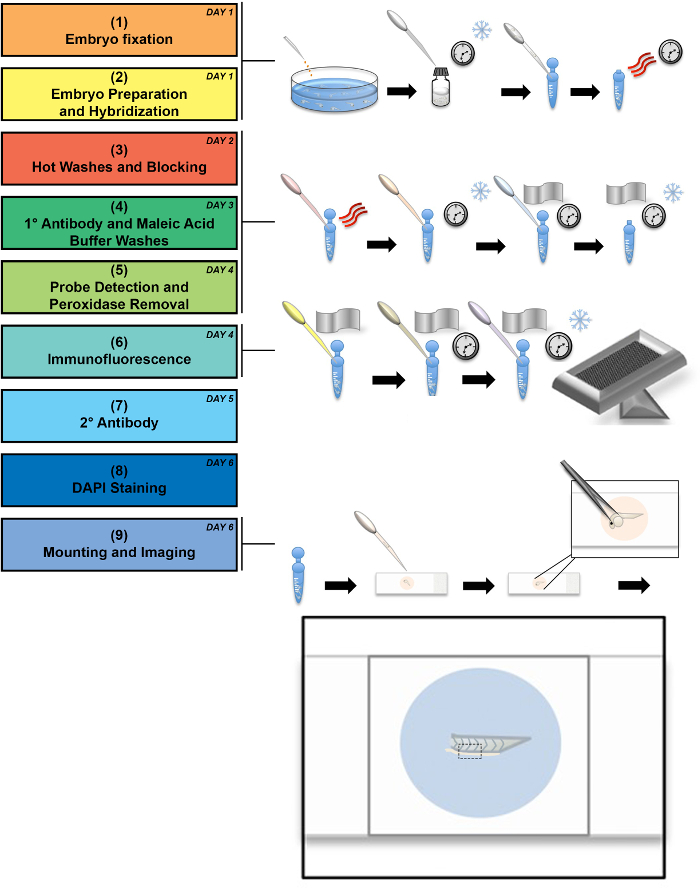
Figura 1: schema di diagramma di flusso sperimentale. Questo diagramma di flusso Mostra un flusso di lavoro sperimentale, corredato da illustrazioni di fasi critiche in cui il fiocco di neve indica freddo incubazione, le tre linee curve rappresentano il calore e l'orologio rappresenta tempi lunghi di incubazione. Il flusso di lavoro possa essere eseguito in un minimo di 6 giorni (Vedi il numero del giorno nell'angolo superiore destro di ogni fase del processo), tuttavia alcuni passaggi possono essere eseguiti su più lunghi periodi di tempo, come indicato nel protocollo. Una rappresentazione dettagliata del processo di montaggio è tirata fuori, dimostrando la coda finale dell'embrione montato tra il vetrino e il vetrino coprioggetti. Una casella tratteggiata nera delinea l'area che è imaged 60 ingrandimenti. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: rappresentante risultati per la visualizzazione di MCCs dei pronephros zebrafish. Proiezioni di massima dell'immagine di un embrione di zebrafish di selvaggio-tipo hpf 24 a 60 X ingrandimento, come pure uno zoom digitale sul confocale a 60 ingrandimenti dell'embrione stesso. Le caselle bianche indicano l'area incentrata su per lo zoom. Le macchie individuali di DAPI (nuclei), odf3b (MCCs), γ-tubulina (corpi basali) e α-tubulina (ciglia) sono etichettate e quindi fuse insieme nei pannelli di fondo due. Lo zoom digitale, forniamo approssimazioni delle posizioni delle cellule come segue: un MCC è delineato dal cerchio con tratteggio giallo, e il cerchio giallo punteggiato delinea una cella mono-ciliati. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo descritto sopra è ottimizzato per l'etichettatura MCCs in pronephros con odf3b trascrizioni e α-tubulina in embrioni di zebrafish 24 hpf. Per ottenere risultati ottimali, si consiglia di utilizzare embrioni appena fissi e preparati. Gli embrioni che sono stati corretti e immagazzinati in MeOH o IBRID + a-20 ° C per più di una settimana possono essere utilizzati, ma la probabilità di sfondo indesiderati macchiatura aumenta con il tempo che gli embrioni sono conservati in deposito.
Le modifiche e la risoluzione dei problemi di questa tecnica sono necessarie per adattare questo metodo per altre suite di particolari marcatori, ad es. altri riboprobes antisenso e altri anticorpi. Molti metodi per regolare i parametri delle fasi del processo intero supporto ibridazione in situ sono stati documentati in precedenza dal nostro gruppo ed altri31,34,36,38, 39. Allo stesso modo, ogni anticorpo proteina richiederà alcuni risoluzione dei problemi in termini di tempi di trattamento, e approssimative gamme di diluizioni e tempi di incubazione per ogni anticorpo primario migliori sono stimate dalla valutazione di risultati documentati28, 35. per gli embrioni di età inferiore ai 24 hpf, pK trattamento dovrebbe essere inferiore a 2 min, dove oltre 24 anni di embrioni hpf devono essere trattati con pK per più di 2 min. Inoltre, gli embrioni oltre 24 hpf dovrebbe essere sbiancato di pigmento prima del trattamento di pK.
Dopo colorazione con la soluzione colorante fluorescente, è fondamentale per rimuovere qualsiasi restante macchia, anticorpo e perossidasi eseguendo la serie di lavaggi di metanolo e perossido di idrogeno. I lavaggi di PBS immediatamente successivi sono vitali per rimuovere il metanolo in eccesso da embrioni. Importante, prima di procedere con gli anticorpi se, abbiamo trovato che l'acetone e risciacqui con acqua deionizzata rendono gli embrioni meno tendono ad aderire l'un l'altro e/o le provette da centrifuga. Nella nostra esperienza, gli anticorpi per specifici fattori di trascrizione e di altri geni, anche se potrebbero funzionare in modo efficiente macchie occidentali, non funzionano bene per se in zebrafish. Tuttavia, proteine altamente conservate e abbondanti, come α-tubulina e β-catenina, funzionano bene in zebrafish per se16,37.
Con il pesce, è possibile visualizzare trascrizioni del RNA dei geni che non hanno ancora gli anticorpi specifici in zebrafish. Combinando il pesce con se, come dimostrato dal presente protocollo, co-localizzazione di trascritti di RNA e proteine può essere visto in vivo (Figura 2). La natura flessibile del protocollo consente la rapida risoluzione dei problemi per la visualizzazione dei vari trascritti di RNA e proteine in numerosi tessuti e intervalli di tempo. Quando combinato con i tratti già rispettati di embrioni di zebrafish, questo protocollo di pesce + se fornisce un altro strumento per esplorare l'espressione di geni e proteine importanti per via dello sviluppo.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato in parte dalla concessione R01DK100237 R.A.W e il National Science Foundation Graduate ricerca Fellowship No. DGE-1313583 di Raffaele Ringraziamo anche il College di Scienze Undergraduate Research Fellowship programma estivo per supporto per M.U. Vorremmo ringraziare il centro per la ricerca di Zebrafish presso l'Università di Notre Dame per la loro cura dedicato del nostro zebrafish. Vorremmo anche ringraziare il dipartimento di scienze biologiche, come pure i membri del nostro laboratorio per tutte le loro supporto e informazioni preziose.
Materiali
| Name | Company | Catalog Number | Comments |
| non-specific protease mixture solution | Roche | 11459643001, pronase from Streptomyces griseus | Dilute in E3 without methylene blue to make 50mg/mL stock solution; store at -20°C |
| E3 solution | Dilute 50X E3 (250 mM NaCl, 8.5 mM KCl, 16.5 mM CaCl2, 16.5 mM MgSO4 in distilled water) in distilled water; add 1 x 10-5 M methylene blue (sigma M9140) to inhibit contamination | ||
| tricaine (ethyl 3-aminobenzoate methanesulfonate) | Fluka | A5040-250G | To make a 0.2% stock solution, dissolve 1 g of tricaine powder in 10 mL Tris, pH 9.5 and distilled water up to 500 mL |
| embryo dishes | VWR | 351029 | |
| 5 mL glass vials | Wheaton | 225012 | |
| disposable plastic Pasteur pippettes | VWR | 414004-004 | |
| 4% paraformaldehyde (PFA) solution | Electron Microscopy Services | 19210 | Dissolve 4% PFA in 1X PBS and bring to a boil under a fume hood. Cool and aliquot, then store at -20°C. Do not refreeze once thawed for use. |
| 10X PBS | American Bioanalytical | AB11072 | Dilute in distilled water to make a 1X stock |
| Tween-20 stock | American Bioanalytical | AB02038 | Make a 0.1% Tween-20 stock by diluting in distilled water. |
| 1X phosphate buffered saline with 0.1% Tween 20 (PBST) | Sigma | P9416 | 0.1% Tween-20 in 1X PBS |
| methanol (MeOH) | Sigma | 34860-4L | |
| proteinase K | Roche | 3115879001 | Dissolve in distilled water to make a 10 mg/mL stock; aliquot and store at -20°C |
| flat bottom microcentrifuge tubes | VWR | 87003-300; 87003-298 | |
| formamide | American Bioanalytical | AB00600 | store at -20°C |
| hybridization solution (HYB+) | 50% formamide, 5X SSC, 0.1% Tween-20, 5 mg/mL yeast torula RNA, 50 μg/μL heparin; store at -20°C | ||
| hybridization oven | Fisher Scientific | 13-247-10Q | |
| 20X saline-sodium citrate (SSC) buffer solution | American Bioanalytical | AB13156 | dilute in distilled water to make 2X and 0.2X stocks |
| blocking reagent solution | Roche | 11096176001 | dilute in maleic acid buffer to make a 10% stock solution; store at 4°C |
| maleic acid buffer solution | Sigma | M0375 and S7653 | 150mM maleic acid, 100mM NaCl (pH 7.5) |
| anti-Digoxigenin-POD, Fab fragments | Roche | 11207739910 | store at 4°C |
| Cy3 fluorescent staining solution | PerkinElmer, Inc. | NEL744001KT, TSA Plus Cyanin3 system | store at 4°C; prepare staining solution fresh by making a 1:50 dilution of TSA reagent (dissolved in 60 uL of DMSO) in the kit buffer |
| Hydrogen peroxide (H2O2) | Sigma | H1009-500mL | store at 4°C |
| molecular grade distilled water (ddH2O) | Mediatech | 25-055-CM | |
| acetone | American Bioanalytical | AB00636-01000 | store an aliquot at -20°C |
| DMSO | American Bioanalytical | AB00435-01000 | |
| fetal bovine serum (FBS) | Gibco | 10438-034 | aliquot and store at -20°C |
| monoclonal anti-acetylated tubulin clone 6-11B-1 | Sigma-Aldrich | T6793 | aliquot and store at -20°C |
| anti-γ-tubulin anitbody produced in rabbit | Sigma-Aldrich | T5192 | aliquot and store at -20°C |
| odf3b cDNA clone MGC:63985 | OpenBiosystems | IMAGE:6792478 | store bacterial glycerol stock at -80°C |
| NaCL | American Bioanalytical | AB01915-05000 | |
| Alexa flour 647 goat anti-rabbit IgG | Life Technologies | A21245 | store at 4°C; protect from light |
| Alexa fluor 488 goat anti-mouse IgG | Life Technologies | A11029 | store at 4°C; protect from light |
| DAPI | Life Technologies | D1306 | aliquot and store at -20°C |
| glass slide | Thermo-Fisher | 4445 | |
| glass coverslip | Thermo-Fisher | 12-540A | 18 x 18 mm |
| fine forceps | Roboz | RS-1050 | Dumont Tweezers Pattern #55 |
| mounting media | Polysciences, Inc. | 18606, Aqua-Poly/Mount | store at 4°C |
| confocal microscope and associated software | We use a Nikon C2plus Confocal Microscope with NIS-elements AR software | ||
| rocker | Bio-Rad | 1660710EDU |
Riferimenti
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8, 353-367 (2007).
- Goldsmith, J. R., Jobin, C. Think small: zebrafish as a model system of human pathology. J Biomed Biotechnol. 2012, 817341(2012).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Drummond, I. A. Kidney development and disease in the zebrafish. J Am Soc Nephrol. 16, 299-304 (2005).
- Wingert, R. A., et al. The cdx genes and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, 1922-1938 (2007).
- Wingert, R. A., Davidson, A. J. The zebrafish pronephros: a model to study segmentation. Kindey Int. 73 (10), 1120-1127 (2008).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- Chambers, B. E., Wingert, R. A. Renal progenitors: roles in kidney disease and regeneration. World J Stem Cells. 8 (11), 367-375 (2016).
- Drummond, B. E., Wingert, R. A. Insights into kidney stem cell development and regeneration using zebrafish. World J Stem Cells. 8 (2), 22-31 (2016).
- Poureetezadi, S. J., Wingert, R. A. Little fish, big catch: zebrafish as a model for kidney disease. Kidney Int. 89 (6), 1204-1210 (2016).
- Kramer-Zucker, A. G., Olale, F., Haycraft, C. J., Yoder, B. K., Schier, A. F., Drummond, I. A. Cilia-driven fluid flow in the zebrafish pronephros, brain and Kupffer's vesicle is required for normal organogenesis. Development. 132, 1907-1921 (2005).
- Liu, Y., Narendra, P., Kramer-Zucker, A., Drummond, I. A. Notch signaling controls the differentiation of transporting epithlelia and multiciliated cells in the zebrafish pronephros. Development. 134, 1111-1122 (2007).
- Ma, M., Jiang, Y. J. Jagged2a-Notch signaling mediates cell fate choice in the zebrafish pronephric duct. PLoS Genetics. 3, e18(2007).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom, and Notch signaling. Dev Biol. 386 (1), 111-122 (2014).
- Wang, L., et al. miR-34b regulates multiciliogenesis during organ formation in zebrafish. Development. 140, 2755-2764 (2013).
- Marra, A. N., Wingert, R. A. Epithelial cell fate in the nephron tubule is mediated by the ETS transcription factors etv5a and etv4 during zebrafish development. Dev Biol. 411 (2), 231-245 (2016).
- Marra, A. N., Li, Y., Wingert, R. A. Antennas of organ morphogenesis: the roles of cilia in vertebrate kidney development. Genesis. 54 (9), 457-469 (2016).
- Duffy, J. L., Suzuki, Y. Ciliated human renal proximal tubular cells. Observations in three cases of hypercalcemia. Am J Pathol. 53, 609-616 (1968).
- Katz, S. M., Morgan, J. J. Cilia in the human kidney. Ultrastruct Pathol. 6, 285-294 (1984).
- Hassan, M. O., Subramanyan, S. Ciliated renal tubular cells in crescentic glomerulonephritis. Ultrastruct Pathol. 19, 201-203 (1995).
- Ong, A. C., Wagner, B. Detection of proximal tubular motile cilia in a patient with renal sarcoidosis associated with hypercalcemia. Am J Kidney Dis. 45, 1096-1099 (2005).
- Worthington, W. C., Cathcart, R. S. III Ependymal cilia: distribution and activity in the adult human brain. Science. 139, 221-222 (1963).
- Cowan, M. J., Galdwin, M. T., Shelhamer, J. H. Disorders of ciliary motility. Am J Med Sci. 321, 3-10 (2001).
- Jain, R., et al. Temporal relationship between primary and motile ciliogenesis in airway epithelial cells. Am J Respir Cell Mol Biol. 43, 731-739 (2010).
- Stubbs, J. L., Vladar, E. K., Axlerod, J. D., Kitner, C. Multicilin promotes centriole assembly and ciliogenesis during multiciliate cell differentiation. Nat Cell Biol. 14, 140-147 (2012).
- Tan, F. E., et al. Myb promotes centriole amplification and later steps of the multiciliogenesis program. Development. 140, 4277-4286 (2013).
- Zhou, F., Narasimhan, V., Shboul, M., Chong, Y. L., Reversade, B., Roy, S. Gmnc is a master regulator of the multiciliated cell differentiation program. Curr Biol. 25, 3267-3273 (2015).
- Jowett, T. Analysis of Protein and gene expression. Methods Cell Biol. 59, 63-85 (1999).
- Schulte-Merker, S. Chapter 2: Looking at Embryos. Zebrafish: A practical approach. 261, 39-58 (2002).
- Brend, T., Holley, S. A. Zebrafish whole mount high-resolution double fluorescent in situ hybridization. J Vis Exp. (25), (2009).
- Lauter, G., Soll, I., Hauptmann, G. Two-color fluorescent in situ hybridization in the embryonic zebrafish brain using differential detection systems. BMC Dev Biol. 11, (2011).
- Drummond, B. E., Li, Y., Marra, A. N., Cheng, C. N., Wingert, R. A. The tbx2a/b transcription factors direct pronephros segmentation and corpuscle of Stannius formation in zebrafish. Dev Biol. 421 (1), 52-66 (2017).
- Jaffe, K. M., Thiberge, S. Y., Bisher, M. E., Burdine, R. D. Imaging cilia in zebrafish. Methods Cell Biol. 97, 415-435 (2010).
- Lauter, G., Soll, I., Hauptmann, G. Multicolor fluorescent in situ hybridization to define abutting and overlapping gene expression in the embryonic zebrafish brain. Neural Dev. 6, (2011).
- Sorrells, S., Toruno, C., Stewart, R. A., Jette, C. Analysis of apoptosis in zebrafish embryos by whole-mount immunofluorescence to detect activated caspase 3. J Vis Exp. (82), e51060(2013).
- Schumacher, J. A., Zhao, E. J., Kofron, M. J., Sumanas, S. Two-color fluorescent in situ hybridization using chromogenic substrates in zebrafish. Bio Techniques. 57, 254-256 (2014).
- Julich, D., et al. beamter/deltaC and the role of Notch ligands in the zebrafish somite segmentation, hindbrain neurogenesis and hypochord differentiation. Dev Biol. 286, 391-404 (2005).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, (2014).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat Mount Preparation for Observation and Analysis of Zebrafish Embryo Specimens Stained by Whole Mount In situ Hybridization. J Vis Exp. (89), e51604(2014).
- Poureetezadi, S. J., Donahue, E. K., Wingert, R. A. A Manual Small Molecule Screen Approaching High-throughput Using Zebrafish Embryos. J Vis Exp. (93), e52063(2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon