Method Article
Misura flessibile dei reporter bioluminescenti utilizzando un automatizzato Luciferase longitudinale Imaging ottimizzato di Gas e temperatura registratore (ALLIGATOR)
In questo articolo
Riepilogo
Luciferasi codificato geneticamente sono un popolare reporter non invasiva dell'espressione genica. Utilizzo di un automatizzato luciferasi longitudinale imaging ottimizzato di gas e temperatura registratore (ALLIGATOR) consente la registrazione longitudinale da cellule bioluminescenti nell'ambito di una vasta gamma di condizioni. Qui vi mostriamo come alligatore possono essere utilizzati nel contesto della ricerca di ritmi circadiani.
Abstract
Basato su luciferase reporter dell'espressione genica cellulare sono nell'uso molto diffuso per entrambi longitudinale ed End-Point saggi di attività biologica. Nella ricerca di ritmi circadiani, ad esempio, fusioni del gene dell'orologio con luciferasi firefly danno luogo a ritmi robusti in bioluminescenza cellulare che persistono per molti giorni. Limiti tecnici associati con tubi di fotomoltiplicatore (PMT) o metodi basati su microscopia convenzionali per la quantificazione di bioluminescenza in genere hanno richiesto che cellule e tessuti essere mantenuto in condizioni abbastanza non-fisiologica durante registrazione, con un compromesso tra sensibilità e velocità effettiva. Qui, segnaliamo un affinamento dei metodi precedenti che permette la formazione immagine a lungo termine bioluminescenza con alta sensibilità e velocità effettiva che supporta una vasta gamma di condizioni di coltura, tra cui gas variabile e controllo di umidità, e che accetta molti differenti piatti e piastre di coltura del tessuto. Questo luciferasi longitudinale automatizzati formazione immagine ottimizzata di gas e temperatura registratore (ALLIGATOR) inoltre permette l'osservazione delle variazioni spaziali nell'espressione di luciferase attraverso un monostrato di cellule o tessuto, che non può essere osservato facilmente dal tradizionale metodi. Si evidenzia come l'alligatore fornisce molto maggiore flessibilità per la rilevazione di attività luciferasica se confrontato con i metodi esistenti.
Introduzione
L'uso della luciferasi come reporter di espressione genica e attività della proteina è diventata una tecnica popolare nella ricerca di biologia molecolare e cellulare. Questo è vero nel campo circadiano, dove la cinetica di firefly luciferase sintesi e inattivazione catalitico sono particolarmente adatti alla segnalazione i longitudinali cambiamenti nell'espressione genica che si presentano durante il ciclo circadiano h circa 24. Come tale, luciferasi sono impiegato come un reporter circadiano attraverso una vasta gamma di organismi, tra cui funghi, piante, mosche e mammiferi1,2,3,4.
Nel quantificare gene circadiano espressione in vitro, un fotomoltiplicatore (PMT) è comunemente utilizzato per registrare il segnale bioluminescente. Le misure basate su PMT hanno limitata flessibilità tuttavia, essendo di solito limitato a una dimensione predeterminata di vassoio o piatto. Inoltre, non è possibile raccogliere tutte le informazioni spaziali di campioni monitorati utilizzando un PMT, che può portare a una perdita di informazioni quando i campioni che mostrano la variazione spaziale nell'espressione di luciferase di imaging. Inoltre, come la PMT ed elettronica associata è inclini a malfunzionamenti quando esposta all'ambiente umidificato di un'incubatrice di cultura cellulare standard, registrazione longitudinale luciferasi utilizzando PMTs viene sempre eseguita in incubatrice non umidificati. Di conseguenza, piastre di coltura delle cellule devono essere sigillati ermeticamente per evitare la perdita di umidità attraverso evaporazione e terreni di coltura devono pertanto essere memorizzati nel buffer con 3-(N- morfolino) acido propansulfonico (MOPS) o 4-(2-idrossietil) -1- acido piperazineethanesulfonic (HEPES), piuttosto che la CO2/bicarbonate sistema che funzioni in vivo ed è usato ordinariamente nella coltura del tessuto dei mammiferi di buffering.
A causa di queste limitazioni, misurazione della bioluminescenza di PMTs posti solitamente severe restrizioni alle condizioni in cui le cellule sono mantenute durante gli esperimenti. Per superare questi problemi e anche per aumentare la gamma delle possibili condizioni sperimentali, usiamo un CO2/n2 170 L coltura tissutale incubatore standard che è stato adattato con l'aggiunta di acqua refrigerata elettrone-moltiplicatore charge coupled device (EMCCD) fotocamera con ottica anti-appannamento e controllo digitale dei livelli di temperatura e di gas. Questo è stato soprannominato un automatico longitudinale Luciferase Imaging Gas e Temperature-Optimized registratore o alligatore. L'alligatore consente flessibilità sostanzialmente aumentata di imaging bioluminescenti, entrambi per l'imaging di alto-rendimento delle piastre di coltura del tessuto standard (fino a 6 x 96 o 384 pozzetti piastre contemporaneamente) e anche per i sistemi di coltura del tessuto non standard, tali come irrorate cellule cresciute in dispositivi microfluidici. Questo strumento consente inoltre di imaging per verificarsi condizioni umidificata e con controllo variabile di CO2 e pressione parziale di O2 sia temperatura.
Il protocollo sottostante descrive un metodo per la registrazione bioluminescente della cellula di mammiferi e sistemi di coltura del tessuto usando un alligatore (d'ora in poi denominato 'incubatore di bioluminescenza'). Dovrebbe essere notato, tuttavia, che il sistema sarebbe ben si adatta all'imaging bioluminescenti e anche, con alcune modifiche, fluorescente di imaging, in un certo numero di altri sistemi biologici e contesti.
Protocollo
1. semina e trascinamenti di temperatura delle cellule
Nota: Questo protocollo è stato rigorosamente testato usando i fibroblasti primari e immortalata del mouse che esprimono la proteina di fusione PERIOD2::LUCIFERASE (PER2::LUC)4. Modifiche potrebbero essere necessario prevedere gli esperimenti usando altre linee cellulari.
- Prima di iniziare la coltura cellulare, inserire quanto segue in un bagno di acqua di 37 ° C per riscaldare: tampone fosfato salino (PBS) (pH 7.4), PBS, completati con l'acido etilendiamminotetracetico 0.68 mM, pH 7,2 (PBS + EDTA), terreni di coltura di cella appropriata, ad esempio, Medium (DMEM dell'Aquila per volta di Dulbecco) completati con 10% siero bovino fetale (FBS), 100 U/mL di penicillina e 100 µ g/mL di streptomicina e 0,25% soluzione di tripsina.
- Rapporto di diluizione 1:3 di tripsina con soluzione PBS + EDTA pre-riscaldato e tornare a bagno d'acqua.
- Prendere un pallone da2 cm 125 di luciferasi-esprimendo le cellule che sono 70-90% confluenti. Aspirare i media. Aggiungere 10 mL di PBS preriscaldata.
- Aspirare il PBS. Aggiungere 2,5 mL pre-riscaldato tripsina-EDTA e tornare il matraccio in un incubatore a 37 ° C per 5 min.
- Rimuovere le cellule dall'incubatore e vista al microscopio. Una volta che la maggioranza delle cellule è staccate dal fondo del matraccio, continuare al passaggio successivo. Se la maggior parte delle cellule rimangono attaccata al fondo del matraccio, restituirlo nell'incubatore fino a quando la maggior parte delle cellule sono in sospensione.
- Aggiungere altri 7,5 mL di mezzo di coltura cellulare standard al pallone. Facoltativamente, rimuovere 1 mL di questo ulteriore passaggio delle cellule, come richiesto.
- Contare la densità delle cellule rimanenti utilizzando un emocitometro e blu di trypan. Diluire le cellule più ulteriormente, come appropriato per tale linea cellulare.
Nota: Per gli esperimenti qui sotto, PERIOD2::LUC fibroblasti sono stati seminati tra 6 x 103 cellule/cm2 e 1 x 104 cellule/cm2 in piastre da 96 pozzetti, piatti di 35mm o diapositive di canale. - Cellule di seme sulla coltura di tessuti piatti o piastre che verranno utilizzati per la registrazione.
Nota: Neri bifacciale, con fondo chiaro piastre si consiglia come questo permette cultura salute essere valutati prima di iniziano le registrazioni mentre riducendo l'interferenza tra pozzetti durante la registrazione. Dove sono estremamente bassi livelli di bioluminescenza, piatti/piatti bianchi dovrebbe essere utilizzati per ottimizzare il rilevamento della luce, anche se per favore nota che la fosforescenza può portare a aumentato segnale di fondo che persiste per diverse ore. - Riporre le piastre nell'incubatore e consentire gli strati monomolecolari raggiungere 100% confluenza (circa 7 giorni).
Nota: Una volta confluenti, linee cellulari che inibiscono il contatto possono essere mantenute per fino a tre settimane prima della sperimentazione purché i media viene aggiornato regolarmente (ogni 5-7 giorni). - Una volta confluenti, sincronizzare cellulari ritmi utilizzando cicli di temperatura applicata (12 h a 32 ° C, 12 ore a 37 ° C) per un minimo di 72 ore immediatamente prima della sperimentazione5,6 (utilizzando un incubatore ciclismo pre-programmato, controllata da un computer connesso nell'incubatore attraverso una porta seriale RS-232).
Nota: Il numero di cicli di temperatura necessari per la sincronizzazione dei ritmi cellulari può variare tra le linee di cellule e pertanto potrebbe essere necessario essere ottimizzato per altre linee cellulari. Stimolo farmacologico acuto usando forskolin o desametasone inoltre è stato utilizzato in precedenza per sincronizzare il cellulare ritmi7,8.
2. NS21 preparazione
Nota: NS21 è un integratore privo di siero per la manutenzione delle colture delle cellule di un neurone e altri. È un perfezionamento di un simile integratore noto come B27, che è commercialmente disponibile e può essere utilizzato come sostituto del siero durante circadiano bioluminescenza registrazioni9. Qualsiasi supplemento possa essere utilizzato indifferentemente nei supporti di registrazione per i protocolli sperimentali descritti di seguito. È abbastanza fattibile e conveniente per rendere NS21 in-House, come Chen et al. 10e come descritto qui.
- Equilibrare tutti i componenti descritti nella tabella 1 a temperatura ambiente per 1 h prima di iniziare.
- Sciogliere il albumina bovina 50g in sostanza basale 324 mL (ad es., neurobasal) sul ghiaccio. Mescolare il meno possibile.
- Aggiungere tutti gli altri componenti, mescolando minimamente dopo ogni componente ma ancora assicurandosi di miscelare. Mirano a sciogliere tutti i componenti all'interno di 90 min di avviamento.
- Aliquotare la miscela finale e conservare a-20 ° C fino a quando richiesto. Evitare cicli ripetuti di congelamento-scongelamento.
Nota: La miscela è troppo viscosa per filtrare in questa fase, ma sarà sterile filtrata quando diluito con media prima di aggiungerlo alle cellule.
3. registrazione Media preparazione
Nota: Dei principali vantaggi dell'incubatore bioluminescenza sopra altre apparecchiature per la registrazione longitudinale bioluminescenza è che, in virtù di essere in grado di umidificare l'incubatrice e variare le pressioni parziali di CO2e O2 , è possibile utilizzare una vasta gamma di condizioni di supporto per registrazione bioluminescenza — comprese le condizioni che più strettamente approssimano la nicchia fisiologica occupata dalla cella diversa tipi in vivo. Qui di seguito descriviamo la formulazione di registrazione multimediale adattato da Hastings et al. 9, che abbiamo usato ordinariamente con colture di fibroblasti e altri tipi di cellule. Il primo è per condizioni di coltura sigillati (senza scambio di gas), e il secondo è per condizioni fisiologicamente rilevanti e dovrebbe essere usato in condizioni umidificate con 5% CO2.Molte altre variazioni sono sia possibile e opportuno, a seconda dell'esatta applicazione e il tipo delle cellule.
- Preparazione di terreni di tampone MOPS alto glucosio
Nota: Stock soluzione (1 L): polvere di DMEM (8,3 g/L), glucosio 5 mg/mL di 0,35 mg/mL il bicarbonato di sodio, , 0,02 M MOPS, 100 U/mL penicillina, 100 µ g/mL di streptomicina.- Sciogliere la polvere DMEM 8,3 g in 900 mL di acqua ultrapura in un cilindro graduato 1.000 mL e mescolare per 30 min fino a quando tutte le particelle sono dissolti.
- Aggiungere 50 mL di soluzione di glucosio (100 g/L), 20 mL di MOPS (1 M, pH 7.6), 10 mL di soluzione di penna/strep: 100x e mescolare per ulteriori 10 minuti.
- Aggiungere la soluzione di bicarbonato di sodio 7,5% 4,7 mL e mescolare per ulteriori 5 minuti.
- Regolare il pH di media a 7,6 (se a temperatura ambiente) o 7.4 (37 ° C) con HCl/NaOH.
- Aggiungere acqua ultrapura per produrre un volume finale di 1.000 mL.
- Sterilizzare mediante filtrazione attraverso un 0,22 µm filtro e conservare a 4 ° C fino a quando richiesto.
- Prima della sperimentazione, integrare un appropriato volume della soluzione di riserva con 10% siero, 2mm L-alanil-L-Glutammina, luciferina 2% NS21 e 1 mM per fare un lavoro di magazzino. Passare questo stock attraverso un filtro sterile da 0,22 µm.
- Misurare il osmolality del supporto utilizzando un Osmometro.
- Accendere l'Osmometro.
- Calibrare l'Osmometro, prima con acqua ultrapura. Aggiungere 50 µ l acqua per il fondo di un recipiente di misura. Assicurarsi che non vi siano nessun bolle nel liquido. Agganciare la nave sopra la sonda. Premere 'Zero' e abbassate il braccio Osmometro al punto più basso. Attendere fino a quando la lettura è completa e verde 'risultato' spia sia accesa prima di sollevamento del braccio e rimuovere il recipiente.
- Ripetere la procedura per calibrare l'Osmometro a 300 mOsmol/kg utilizzando standard di calibrazione 50 µ l. Premere 'Cal' prima di abbassare il braccio.
- Misurare il osmolality campione aggiungendo 50 µ l di media sul fondo di un recipiente di misura ed misura come sopra. Premere 'esempio' prima di abbassare il braccio di Osmometro.
- Regolare il osmolality di 350 mOsmol utilizzando 5 M NaCl.
- HCO3-tamponata preparazione media (medium di perfusione) glucosio basso
Nota: Stock soluzione (1 L): polvere di DMEM (8,3 g/L), 3,7 mg/mL bicarbonato di sodio, glucosio 1 mg/mL, 100 U/mL di penicillina e 100 µ g/mL di streptomicina.- Sciogliere la polvere DMEM 8,3 g in 900 mL di acqua ultrapura in un cilindro graduato 1.000 mL e mescolare per 30 min fino a quando tutte le particelle sono dissolti.
- Aggiungere 50 mL di soluzione di glucosio (100 g/L), 10 mL di soluzione di penna/strep x 100 e mescolare per ulteriori 10 minuti.
- Aggiungere mL 49,4 7,5% soluzione di bicarbonato di sodio e mescolate per ulteriori 5 minuti.
- Regolare il pH di media a 7,6 (a temperatura ambiente) o 7.4 (37 ° C) con HCl/NaOH.
- Aggiungere acqua ultrapura per dare un volume finale di 1.000 mL.
- Filtrare la soluzione attraverso un 0,22 µm filtro sterile e conservare a 4 ° C fino all'utilizzo.
- Prima della sperimentazione, integrare un appropriato volume della soluzione di riserva con 2% di siero 2 mM L-alanil-L-Glutammina, 2% NS21 e luciferina di 1 mM per fare un lavoro di magazzino. Passare questo stock attraverso un filtro sterile da 0,22 µm.
- Misurare e regolare il osmolality di 350 mOsmol utilizzando 5 M di NaCl, per quanto riguarda il media tampone MOPS.
Nota: Luciferina concentrazione deve essere determinata empiricamente per ogni tipo di cellula e il contesto. Per ulteriori informazioni vedere Feeney et al. Concentrazioni di 11 siero e NS21 (o B27 se usato) possono essere variate a seconda dell'applicazione. Tuttavia, si consiglia che, se non empiricamente testati per dimostrare il contrario, siero e NS21 (o alternativo privo di siero supplemento) essere usato, come questi promuovono allegato e sopravvivenza delle cellule. In linee cellulari che non siano a contatto inibiscono bene, può essere necessario abbassare la concentrazione nel siero nei supporti di registrazione per prevenire gli effetti confondenti di proliferazione, che è promosso anche dal siero.
4. registrazione
- Prima di iniziare la registrazione, è possibile posizionare lo stock di media di lavoro appropriato (dal punto 3.1 o 3.2 a seconda dell'esperimento) in un bagno di acqua di 37 ° C per riscaldare.
- Mentre i media si sta riscaldando, mettere a fuoco la fotocamera nell'incubatrice bioluminescenza.
- Svitare il filtro a densità neutra impermeabile all'acqua, riscaldata e mettere da parte.
- Impostare il software per registrare un video con una velocità di acquisizione elevata. Fare clic su "acquisizione | Setup di acquisizione". Impostare 'Tempo di esposizione' a 0,2 s e tempo di ciclo cinetica a 0,3 secondi. Assicurarsi che il guadagno di EM è spento.
- Chiudere la finestra 'Acquisizione Setup' e fare clic sull'icona di "prendere il video".
- Utilizzando il cilindro di messa a fuoco, ruotare l'obiettivo della fotocamera fino a elementi sullo scaffale all'altezza da registrare sono chiaramente a fuoco nel video.
- Interrompere il video cliccando sull'icona 'stop video'.
- Avvitare il filtro a densità neutra riscaldata in posizione; in caso contrario si tradurrà in danni per l'EM-CCD telecamera e/o appannamento dell'obiettivo a causa della condensa.
- Impostare O2, CO2e temperatura desiderata delle condizioni sperimentali utilizzando il pannello di controllo sulla parte anteriore dell'incubatore di bioluminescenza.
Nota: Se si esegue irrorato coltura cellulare procedere direttamente alla sezione 5 in questa fase. - Rimuovere le celle dalla coltura del tessuto incubatore e aspirato disattivare il supporto. Sostituire il supporto con stock di lavoro pre-riscaldato.
- Se l'incubatrice di bioluminescenza è di non essere umidificati durante l'esperimento, quindi sigillare i piatti e le piastre con una guarnizione impermeabile a gas.
Nota: L'umidificazione avviene riempiendo la vaschetta dell'acqua alla base dell'incubatore.
- Fare clic su "acquisizione | Setup di acquisizione".
- Nel pannello 'Configurazione delle telecamere', impostare: 'Modalità di acquisizione' a 'Cinetica'; 'Tempo di esposizione' al tempo di esposizione, desiderato in secondi (Vedi nota sotto); 'Accumulazioni' a 1; 'Lunghezza di serie kinetic' al numero di cicli di acquisizione desiderato; 'Tempo di ciclo cinetico' intervallo imaging desiderato (assicurarsi che questo sia maggiore del tempo di esposizione); 'Shift velocità' a 4,33 µsecs; 'Gain' a 1; e li guadagno ' per il desiderato livello (Vedi nota sotto)
- Nel pannello 'Autosave', impostare il tipo di file sif o. TIF. Fornire un nome di file e salvataggio posizione del caso.
- Nel pannello 'Spooling', impostare il tipo di file da tiff. Fornire un nome di file e salvataggio posizione del caso. Chiudere la finestra di setup di acquisizione.
Nota: Come l'incubatore di bioluminescenza può essere utilizzato per un gran numero di cellulari diversi e tipi di tessuto, ognuno dei quali avrà diversi livelli di bioluminescenza, il tempo di esposizione necessario per raccogliere un appropriato segnale bioluminescente varierà tra esperimenti. È anche possibile variare il guadagno (EM) moltiplicazione di elettrone di imaging al fine di aumentare l'ampiezza del segnale raccolto. Per le nuove applicazioni di luminosità sconosciuto, ti consigliamo prima prendendo una singola immagine con un tempo di esposizione relativamente breve (circa 10 min) senza guadagno di EM e successivamente regolando sia tempo di esposizione ed EM guadagno finché non sono state le condizioni di registrazione desiderata raggiunto. Nella maggior parte dei casi, un segnale medio di 10-20% dell'intensità massima possibile del pixel per la macchina fotografica è un buon livello di puntare per. Una volta raggiunta un set di parametri di registrazione appropriato, è necessario avviare longitudinale acquisizione delle immagini, come descritto sopra.
5. irrorato coltura tissutale (opzionale)
Nota: Come descritto nell'introduzione, l'incubatore di bioluminescenza è adatto per l'imaging dei sistemi di coltura del tessuto non standard. Questo è esemplificato nello sviluppo di un sistema di coltura cellulare irrorato.
- Seme le cellule sul singolo canale scorre con connettori Luer con una profondità di canale di 0,6 o 0,8 mm, in DMEM con 10% FBS e pen/strep, come descritto nella sezione 1. Fai il media di aspersione come descritto al punto 3.2.
- Prima della registrazione, preparare tubi per il sistema di perfusione richiesto utilizzando 1 mm di diametro interno (I.D.) Tubazione di ETFE e tubazione del silicone di 1 mm di diametro, raccordi Luer gomito, maschio e femmina, come mostrato nella Figura 2A.
Nota: La maggior parte della lunghezza del tubo è tubazione di ETFE, con sezioni di 2 cm di tubo in silicone utilizzato per collegare i tubi di ETFE ai raccordi Luer, che successivamente si collegano nelle slitte del canale. - Sterilizzare il tubo mediante flussaggio con etanolo al 70%, seguita da PBS sterile.
- Rimuovere le colture cellulari in diapositive canale dall'incubatrice. Aspirare i media e sostituire con i media di perfusione pre-riscaldato.
- Riempire una siringa da 20 mL con il supporto di perfusione pre-riscaldato.
- Collegare il tubo al buffer piastrina (Vedi Figura 2) ma non alla diapositiva che contiene delle cellule e sciacquare il tubo e far scorrere con media di aspersione (3-5 mL).
- Collegare la diapositiva che contiene cellule e lavare l'intero sistema con un ulteriore 1 mL di media per rimuovere eventuali bolle d'aria.
- Trasferire l'intero sistema nell'incubatore di bioluminescenza.
- Misura le siringhe piene di media alla siringa senza scollegare dal tubo della pompa e svuotare un ulteriore 1 mL di media attraverso l'intero sistema utilizzando la pompa per garantire non ci sono bolle d'aria nel sistema.
- Impostare il diametro della pompa a quella della siringa viene utilizzata.
Nota: Per le siringhe da 20 mL usate qui, il diametro è 19,13 mm. - Impostare la portata della pompa a 50 µ l/h e avviare l'esecuzione.
- Assicurarsi che non ci sono bolle in diapositive o tubazione prima dell'inizio della registrazione, come queste influenzeranno la espressione di luciferase quando passano attraverso il monostrato cellulare. Se necessario, sciacquare ulteriormente media attraverso le cellule per raggiungere questo obiettivo.
- Chiudere lo sportello dell'incubatore bioluminescenza e continuare come al punto 4.7 per iniziare la registrazione.
6. trattamento durante la registrazione
Nota: A volte è auspicabile per il trattamento di midway di cellule attraverso una registrazione, sia con agenti farmacologici o ormonali. In tali casi, è imperativo che le cellule sono maneggiate con cura per evitare l'oscillazione cellulare dalla reimpostazione durante il trattamento. Per questo motivo, è di particolare importanza che le cellule siano mantenute a temperatura costante, come questo è un grande spunto spingimento per cellulare ritmi circadiani5,6.
- Preparare tutti i componenti del trattamento prima dell'arresto della registrazione.
- Preparare un pad chimico isotermo a 37 ° C.
- Interrompere la registrazione del dispositivo, rimuovere i piatti per essere trattati e posizionare sul termoforo isotermica.
- Trattare le culture come richiesto e ritorno per l'incubatore di bioluminescenza nella stessa posizione come prima.
- Ri-avviare la registrazione.
7. analisi
Nota: L'incubatore di bioluminescenza produce dati sotto forma di una serie di singole immagini.Abbiamo principalmente utilizzare Fiji12 per gestire queste immagini e quindi esportare i dati di intensità media pixel per ogni area di interesse (ROI) per ulteriori analisi.
- Aprire lo stack di immagine in Fiji e regolare la luminosità e il contrasto facendo clic su "immagine | Regolare | Luminosità/contrasto"e le barre di scorrimento di regolazione fino a quando le immagini sono entro limiti appropriati per la visualizzazione del segnale bioluminescente.
- Selezionare le aree di interesse utilizzando il gestore di ROI disponibile sotto "Analyze | Strumenti | ROI Manager".
- Esportazione di segnale medio per l'area selezionata facendo clic su "gestione ROI | Più | Multilaterali".
- Copiare i dati risultanti nel software di analisi.
- Regolare manualmente l'orario di base di dati per l'intervallo di tempo di formazione immagine, (cioè, 15, 30 o 60 min intervalli, designati come 0,25, 0,5 o 1 h), anziché il numero di immagine fornito da Fiji.
Nota: Ulteriore analisi può ora essere eseguita, ad esempio determinazione del periodo. Per questo, la seguente equazione viene utilizzata per eseguire l'analisi di regressione non lineare:

dove y è il segnale, x il tempo corrispondente, m è la pendenza della linea di tendenza, c è l'intercetta su y della linea di tendenza, l'ampiezza è l'altezza del picco della forma d'onda sopra la linea di tendenza, k è la costante di decadimento o tasso di smorzamento (tale che 1 /k è l'Half-Life), fase è lo spostamento in x dell'onda coseno e il periodo è il tempo impiegato per un ciclo completo di13. R2 valore viene utilizzato come un indicatore della bontà di adattamento. Sono possibili anche altri metodi di analisi. Le prime 24 ore dell'acquisizione dovrebbe essere esclusi dall'analisi, come bioluminesence cellulare può esibire cambiamenti transitori, non circadiano durante questo tempo. Questo è il risultato di una risposta acuta al cambiamento di media.
Risultati
Questo articolo descrive un protocollo per l'imaging bioluminescente di cellule di mammifero usando un alligatore (incubatore di bioluminescenza). Questa tecnica consente flessibilità di configurazione fisica e condizioni extracellulari quando bioluminescenti sistemi di imaging. Vengono descritti metodi per coltura del tessuto statico semplice (Figura 1, complementare Video 1) e la coltura cellulare irrorato (Figura 2, complementare Video 2), ma molte altre configurazioni potrebbero essere imaged usando questo sistema. Tutti i dati sono stati quantificati utilizzando i metodi descritti nella sezione 7.
Figura 1A Mostra un esempio dei video di una registrazione da 6 x 96 pozzetti piastre contenenti PER2::LUC fibroblasti4di bioluminescenza. I pozzi più esterno non contengono cellule come questi non sono stati richiesti per questo esperimento. Le cellule hanno subito trascinamenti di temperatura differenziale, per cui subiscono sia ciclo di temperatura di 12 h, a 32 ° C, seguita da 12 h 37 ° C per 72 h o il contrario (12 ore, a 37 ° C, seguita da 12 ore, a 32 ° C per 72 h), prima che si terrà a costante di 37 ° C per la registrazione. 60 min esposizioni sono state scattate ogni ora. Due di queste condizioni sono quantificati in Figura 1B.
La Figura 2A Mostra un disegno schematico dell'installazione di un sistema di coltura del tessuto irrorato. Si tratta di due scivoli di canale collegati con la tubazione. Media è guidato attraverso le cellule da una pompa a siringa. La prima di queste diapositive agisce come una trappola di gas permeabile bolla (diapositiva buffer) e non contiene nessun cellule, con il secondo contenente le celle da cui è registrata la bioluminescenza. Un rappresentante di registrazione video da questo sistema è illustrato nella Figura 2B. 15 min esposizioni sono state scattate ogni 15 min. Qui, le cellule sono mantenute in condizioni standard di aspersione o in presenza di inibitore di caseina chinasi PF670462, che precedentemente è stato indicato per allungare il periodo circadiano e ridurre l'ampiezza dei ritmi di espressione genica orologio in coltura cellule di mammifero14. L'effetto sull'espressione di PER2::LUC è mostrato in Figura 2 (pannello superiore) contro le cellule trattate con la stessa concentrazione di farmaco in condizioni di coltura cella statica standard illustrato nella Figura 2 (pannello inferiore), con quantificazione del periodo mostrato in Figura 2D. È chiaro da questo che il trattamento con PF670462 influenza l'espressione di PER2::LUC sotto entrambi gli insiemi di condizioni. Tuttavia, mentre le cellule trattate con PF670462 sotto condizioni irrorate Visualizza periodo allungamento di circa 3 h (3 h di ±0.9), le cellule in condizioni statiche, trattate con il farmaco mostrano allungamento periodo sostanzialmente maggiore per un periodo di > 48 h. Questo può essere in forma per un coseno smorzato, come descritto nella sezione 7, (extra-somma dei quadrati F prova contro una linea retta, p < 0,0001). È interessante notare che, la grandezza del periodo allungamento sotto perfusione è molto più vicina a quella osservata in vivo14.
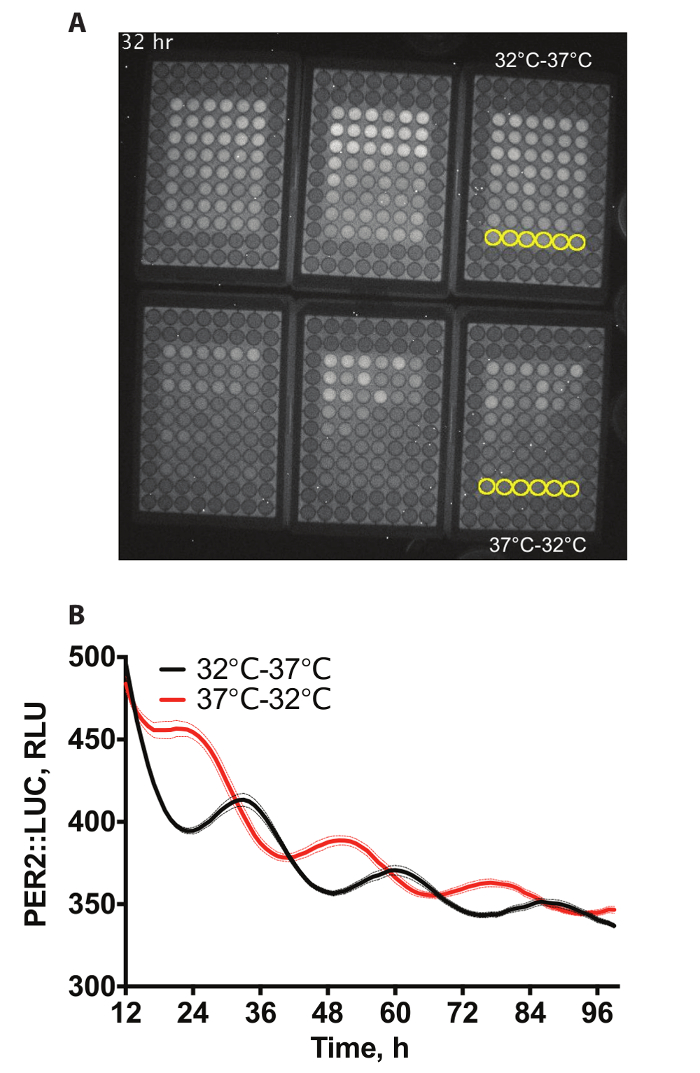
Figura 1: esempio di dati. (A) esempio istantanea video di bioluminescenza da PER2::LUC immortalata in 6 x 96 pozzetti nell'incubatrice bioluminescenza. Pozzi per essere quantificati sono stati evidenziati in giallo nel supplementare Video 1. (B) quantificazione della bioluminescenza A. Due set di 3 piastre delle cellule erano trascinato utilizzando cicli di temperatura (12 h, a 32 ° C; 12 ore a 37° C) che erano anti-fasiche a vicenda per produrre fronte fasi dell'espressione della proteina PER2 (n = 6, media ± SEM). Clicca qui per visualizzare una versione più grande di questa figura.
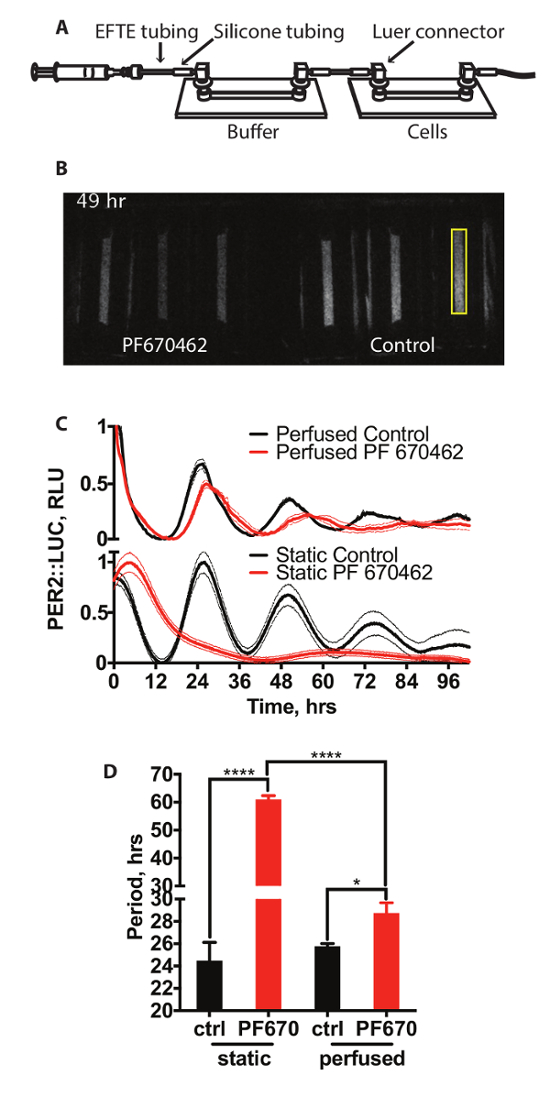
Figura 2: aspersione con inibitori di CK1δ. (A) schema del sistema di perfusione. (B) esempio istantanea video di una registrazione da PER2::LUC di bioluminescenza cellule sotto perfusione. Un'area campione di quantificazione è evidenziata in giallo. (C) quantificazione della bioluminescenza dei fibroblasti PER2::LUC sotto l'aspersione e in condizioni statiche con e senza inibitore di 3 µM CK1 PF670462 (n = 3, media ± SEM). Bioluminescenza è stata normalizzata a valori minimi e massimi. (D) analisi del periodo (Two-way ANOVA, test comparazioni multiple di Holm-Sidak).Clicca qui per visualizzare una versione più grande di questa figura.
| Componente | Concentrazione media finale (μM) | Stock (mg/mL) | Per NS21 400 mL |
| Albumina bovina | 37 | - | 50 g |
| Catalasi | 0,01 | - | 50 mg |
| Glutatione | 3.2 | - | 20 mg |
| Insulina | 0.6 | 10 | 8 mL |
| Superossido dismutasi | 0,077 | - | 50 mg |
| Holo-transferrina | 0,062 | - | 100 mg |
| T3 (triiodo-L-tironina) | 0,0026 | 2 | 20 Μ l |
| L-carnitina | 12 | - | 40 mg |
| Etanolammina | 16 | Liquido (1 g/ml) | 20 Μ l |
| D (+)-galattosio | 83 | - | 300 mg |
| Putrescina | 183 | - | 322 mg |
| Selenito di sodio | 0,083 | 1 | 280 Μ l |
| Corticosterone | 0,058 | 2 | 0,2 mL |
| Acido linoleico | 3.5 | 100 | 0,2 mL |
| Acido linolenico | 3.5 | 100 | 0,2 mL |
| Acido lipoico | 0.2 | 4.7 | 0,2 mL |
| Progesterone | 0,02 | 3.2 | 0,04 mL |
| Retinolo acetato | 0.2 | 20 | 0,1 mL |
| Retinolo, tutti trans | 0.3 | 10 | 0,2 mL |
| S, L-alfa-tocoferolo | 2.3 | 100 | 0. 2 mL |
| S, L-alfa-tocoferolo acetato | 2.1 | 100 | 0,2 mL |
Tabella 1: NS21 preparazione.
Complementare 1 Video: video di esempio di bioluminescenza da piatti ben. Istantanea video esempio di bioluminescenza da PER2::LUC immortalata in 6 x 96 pozzetti nell'incubatrice bioluminescenza. Pozzi da quantificare sono evidenziati in giallo. Per favore clicca qui per scaricare questo file.
Supplementare Video 2: l'istantanea video esempio di una registrazione da PER2::LUC di bioluminescenza cellule sotto aspersione. Un'area campione di quantificazione è evidenziata in giallo. Per favore clicca qui per scaricare questo file.
Discussione
Il protocollo descritto qui è per la coltura di cellule di mammifero, sia in condizioni statiche e irrorate. Tuttavia, il coccodrillo può essere facilmente adattato ad altri sistemi di modello. Infatti, già ha dimostrato di fornire una piattaforma eccellente per il monitoraggio simultaneo di locomozione, sonno e ritmi di espressione di gene periferico in Drosophila melanogaster mantenuto sotto costante oscurità15. Si è anche notato che, a seconda dell'applicazione, tipi di fotocamera diverso da quello indicato qui possono essere appropriati. Prevediamo che con i filtri appropriati, una versione modificata del programma di installazione corrente potrebbe in linea di principio essere usata per la quantificazione di fluorescenza.
Le uniche applicazioni per le quali l'alligatore potrebbe non essere appropriato sono quelli per cui è richiesta, come l'imaging dell'organizzazione spazio-temporale dell'espressione PER2::LUC a fette organotypic della cellula umana particolarmente elevata risoluzione spaziale nucleo soprachiasmatico, o altre fettine di tessuto piccolo.
L'alligatore consente molti esperimenti da eseguire che finora non sono state prontamente realizzabili dalle tecniche di registrazione convenzionali. Rispetto agli attuali metodi per la misurazione della bioluminescenza, l'alligatore fornisce una maggiore flessibilità in sia il tipo di piastra di coltura delle cellule o diapositiva che può essere utilizzato, le condizioni di supporti esterni, sensibilità e processivity.
Ciò è particolarmente rilevante in un momento quando c'è un allontanamento da modelli della coltura cellulare 2D standard verso sistemi di coltura organoid e flusso 3D. Come tale, si prevede che l'alligatore fornirà un metodo adattabile che può essere misurata bioluminescenza sopra molti giorni e settimane nell'ambito di una vasta gamma di condizioni.
Divulgazioni
Nessun conflitto di interessi esiste.
Riconoscimenti
Vorremmo ringraziare Cairn ricerca per lavorare con noi per sviluppare questo sistema, in particolare Mark Henson, Jeremy Graham e Joao Correia. Ringraziamo anche David Welsh e Akhilesh Reddy per discussione importante durante la fase di progettazione, così come Peter Laskey (precedentemente di Hamamatsu) per organizzare il prestito di una macchina fotografica demo e David Wong per il suo contributo critico al manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM (1x) + GlutaMAX | Gibco | 31966-021 | |
| Hyclone FetalClone III Serum | GE Healthcare | SH30109.03 | |
| Neurobasal medium | Thermofisher | 21103049 | basal medium |
| Bovine Serum Albumin | Sigma | A4919 | |
| Catalase | Sigma | C40 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I1882 | |
| Superoxide Dismutase | Sigma | S5395 | |
| Holo-transferrin | Calbiochem | 616424 | |
| T3 (triiodo-L-thyronine | Sigma | T6397 | |
| L-Carnitine | Sigma | C7518 | |
| Ethanolamine | Sigma | E9508 | |
| D (+)-Galactose | Sigma | G0625 | |
| Putrescine | Sigma | P5780 | |
| Sodium Selenite | Sigma | S9133 | |
| Corticosterone | Sigma | C2505 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| Lipoic Acid | Sigma | T1395 | |
| Progesterone | Sigma | P8783 | |
| Retinol Acetate | Sigma | R7882 | |
| Retinol, all trans | Sigma | 95144 | |
| D,L-alpha-Tocopherol | Sigma | 95240 | |
| D,L-alpha-Tocopherol acetate | Sigma | T3001 | |
| Sodium Bicarbonate Solution | Sigma | S8761-100ML | |
| GlutaMAX (100x) | Gibco | 35050-038 | |
| Penicillin-Streptomycin | Sigma | P4333 | |
| Galaxy 170R incubator | Eppendorf | CO17301001 | |
| Luciferin | Biosynth | L-8220 | |
| D -(+)-Glucose solution | Sigma | G8644-100ML | |
| DMEM powder | Sigma | D5030 | |
| MOPS | Sigma | PHG0007 | |
| 1 mm I.D. silicone tubing | GE Healthcare | 19-4692-01 | |
| Elbow luer connector | Ibidi | 10802 | |
| Male luer fittings | Ibidi | 10826 | |
| Female luer fittings | Ibidi | 10825 | |
| µ-slide luer I 0.6 | Ibidi | 80196 | |
| BD plastipak 20ml syringe | Becton Dickinson | 300613 | |
| 1mm I.D. ETFE tubing | GE Healthcare | 18-1142-38 | |
| PF670462 | Sigma | SML0795 | |
| B27 Supplement (50x) | ThermoFisher | 17504044 | |
| iXon Ultra EMCCD camera | Andor | iXon 888 | |
| Fiji | ImageJ | N/A | |
| Prism 7.0 | Graphpad Software | N/A | |
| Trypan blue | Sigma | T8154 | |
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Heated neutral density filter | Cairn Research | Custom item | |
| Osmomat 030 | Gonotech | Discontinued | |
| 300 mOsmol/kg calibration standard | Gonotech | 30.9.0020 | |
| Measuring vessel | Gonotech | 30.9.0010 | |
| Focusing cylinder | Cairn Research | Custom item | |
| NE-1600 programmable syringe pump | Pump Systems inc. | NE-1600 | |
| Andor Solis Software | Andor | N/A |
Riferimenti
- Morgan, L. W., Greene, A. V., Bell-Pedersen, D. Circadian and light-induced expression of luciferase in Neurospora crassa. Fungal Genet. and Biol. 38 (3), 327-332 (2003).
- Millar, A. J. A Novel Circadian Phenotype Based on Firefly Luciferase Expression in Transgenic Plants. Plant Cell Online. 4 (9), 1075-1087 (1992).
- Yu, W., Hardin, P. E. Use of Firefly Luciferase Activity Assays to Monitor Circadian Molecular Rhythms In Vivo and In Vitro. Circadian Rhythms: Methods and Protocols. , 465-480 (2007).
- Yoo, S. -. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci. 101 (15), 5339-5346 (2004).
- Buhr, D. E., Yoo, S. -. H., Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science. 330 (6002), 379-385 (2010).
- Brown, S. A., Zumbrunn, G., Fleury-Olela, F., Preitner, N., Schibler, U. Rhythms of mammalian body temperature can sustain peripheral circadian clocks. Current Biology. 12 (18), 1574-1583 (2002).
- Balsalobre, A., et al. Resetting of circadian time in peripheral tissues by glucocorticoid signaling. Science. 289 (5488), 2344-2347 (2000).
- Balsalobre, A., Marcacci, L., Schibler, U. Multiple signaling pathways elicit circadian gene expression in cultured Rat-1 fibroblasts. Curr. Biol. CB. 10 (20), 1291-1294 (2000).
- Hastings, M. H., Reddy, A. B., McMahon, D. G., Maywood, E. S. Analysis of circadian mechanisms in the suprachiasmatic nucleus by transgenesis and biolistic transfection. Methods Enzymol. 393, 579-592 (2005).
- Chen, Y., Stevens, B., Chang, J., Milbrandt, J., Ba Barres, ., Hell, J. W. NS21: re-defined and modified supplement B27 for neuronal cultures. J. Neurosci Methods. 171 (2), 239-247 (2008).
- Feeney, K. A., Putker, M., Brancaccio, M., ONeill, J. S. In-depth Characterization of Firefly Luciferase as a Reporter of Circadian Gene Expression in Mammalian Cells. J. Biol. Rhythms. 31 (6), 540-550 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hirota, T., Lewis, W. G., Liu, A. C., Lee, J. W., Schultz, P. G., Kay, S. A. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc Natl Acad Sci. 105 (52), 20746-20751 (2008).
- Meng, Q., Maywood, E. S., Bechtold, D. A., Lu, W., Li, J., Gibbs, J. E. Entrainment of disrupted circadian behavior through inhibition of casein kinase 1 ( CK1 ) enzymes. Proc Natl Acad Sci. 1, 1-6 (2010).
- Khabirova, E., Chen, K. -. F., O'Neill, J. S., Crowther, D. C. Flyglow: Single-fly observations of simultaneous molecular and behavioural circadian oscillations in controls and an Alzheimer's model. Sci. Rep. 6, 33759 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon