È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In Vivo EPR valutazione di pH, pO2, lo stato Redox e le concentrazioni di fosfato e glutatione nel microambiente tumorale
In questo articolo
Riepilogo
Risonanza paramagnetica elettronica di basso campo (banda L, 1.2 GHz) usando le sonde nitrossidi e trityl solubile è dimostrata per la valutazione dei parametri fisiologicamente importanti nel microambiente tumorale in modelli murini di cancro al seno.
Abstract
Questo protocollo dimostra le capacità di risonanza paramagnetica elettronica di basso campo (EPR)-basato su tecniche in combinazione con sonde paramagnetiche funzionale a fornire informazioni quantitative sul microambiente tumorale chimica (TME), tra cui p O2, lo stato redox, pH, concentrazioni di fosfato inorganico interstiziale (Pi) e intracellulare del glutatione (GSH). In particolare, un'applicazione di una sonda sviluppata di recente solubile trityl multifunzionale offre opportunità insuperabile per in vivo misure simultanee di pHe pO2 Pi a E spazio inases (sonda di speranza). Le misure dei tre parametri utilizzando una singola sonda permettono per le loro analisi di correlazione indipendente di distribuzione sonda e ora delle misurazioni.
Introduzione
Un ruolo chiave della TME nella progressione del cancro e nella terapia è sempre più apprezzato1. Tra le importanti parametri fisiologici della TME in tumori solidi, di ipossia del tessuto2, acidosi3,4, alta riduzione capacità5, elevate concentrazioni di GSH intracellulare6,7, e interstiziale Pi8 sono ben documentati. Valutazioni di2, pH, Pi, GSH e redox non invasiva in vivo pO forniscono intuizioni uniche i processi biologici nella TME e aiutano anticipo strumenti per lo screening pre-clinico di farmaci anti-cancro e strategie terapeutiche mirate TME. Una radiofrequenza ragionevole profondità di penetrazione nei tessuti da formazione immagine a risonanza magnetica (MRI) e tecniche basate su EPR a basso campo li rende gli approcci più appropriati per la valutazione non invasiva di questi parametri TME. MRI si basa in gran parte su imaging protoni di acqua ed è ampiamente usato nelle regolazioni cliniche fornire risoluzione anatomica ma manca funzionale ad alta risoluzione. Le misure di risonanza magnetica nucleare di fosforo-31 (31P-NMR) di extracellulare Pi concentrazione e pH basato su un segnale da fosfato endogeno sono potenzialmente interessanti per la caratterizzazione di TME, ma normalmente sono mascherate da diverse volte superiore intracellulare Pi concentrazioni9,10. Al contrario, misure EPR si basano sulla spettroscopia e imaging del appositamente progettato sonde paramagnetiche per fornire la risoluzione funzionale. Nota che esogeno EPR sonde hanno un vantaggio su esogeno NMR sonde dovuto la sensibilità intrinseca molto più elevata di EPR e assenza di segnali EPR sfondo endogeno. Il recente sviluppo di una duplice funzione pH e redox nitrossidi sonda11 e multifunzionale trityl sonda12 fornisce opportunità insuperabile per in vivo misure simultanee di diversi parametri di TME e loro analisi di correlazione indipendente sulla sonda distribuzione e tempo di misura. A nostra conoscenza, non ci sono nessun altri metodi disponibili per valutare simultaneamente in vivo fisiologicamente importanti parametri TME chimici in soggetti viventi, come pO2, pHe, Pi, redox e GSH.
Sonde per In Vivo Misure funzionali:
La figura 1 Mostra strutture chimiche delle sonde paramagnetiche utilizzate per accedere ai parametri TME, che comprendono le sonde del particolato e solubile. Alta sensibilità funzionale, stabilità nel tessuto vivente e tossicità minima sono alcuni vantaggi che fanno del particolato sonde preferiti sopra solubile sonde per in vivo ossimetria EPR. Ad esempio, sonde di particolato sono aumentati tempi di ritenzione al sito di impianto del tessuto rispetto alle sonde solubile che permette di misurare longitudinale del tessuto pO2 sopra parecchie settimane. D'altra parte, sonde solubile sovraperformare particolati sonde fornendo misurazioni spaziali risolto utilizzando basati su EPR tecniche di imaging nonché consentendo analisi concomitante da molteplici funzionalità (pO2, pH, Pi, redox, e GSH).

Figura 1. Strutture chimiche delle sonde paramagnetiche che assemblare analisi valutazione TME. Questo include il particolato pO2 sonda, LiNc-BuO (R = - O (CH2)3CH3) e sonde solubile: sonda di pH e redox di funzione dual, NR; Sonda di GSH-sensibili, Simonerasetti; e multifunzionale pO2, pH e sonda di Pi del microambiente extracellulare, la sonda di speranza. La sintesi di queste sonde è stato descritto nei riferimenti forniti 11,12. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
Tutto il lavoro animale è stato eseguito conformemente al protocollo WVU IACUC approvato.
1. sintesi e calibrazione della sonda
- Particolato pO2-sensibili LiNc-BuO sonda
Nota: LiNc-BuO microcristalli vengono sintetizzati e preparate come descritto nel riferimento13. Sono molto stabili e possono essere conservati a temperatura ambiente per anni. L'EPR linewidth della sonda del particolato LiNc-BuO è un pO2-parametro sensibile. LiNc-BuO microcristalli dimostrano ideale dipendenza lineare di linewidth sulla concentrazione di ossigeno nella gamma da condizioni anossiche fino a 760 mmHg di pressione parziale2 pO13, con i valori di linewidth intrinseco in assenza di ossigeno e la pendenza della dipendenza di ossigeno (misurata in mG/mmHg) leggermente diverse per diversi lotti della preparazione microcrystal. Di conseguenza, calibrazione è necessaria per ogni particolare lotto.- Pesare 60 mg di microcristalli di LiNc-BuO.
- Per la calibratura di sensibilità di ossigeno, sospendere microcristalli in 3 mL di medium per volta Eagle Media (DMEM) di Dulbecco (a una concentrazione di 20 mg/mL) e trattare con ultrasuoni per 5 minuti sul ghiaccio con un sonicatore sonda a 20 kHz utilizzando 7 W di potenza in un tubo di turno-fondo di vetro da 5 mL.
- Posizionare 1 mL dei lisati mediante microcristalli in un vetro del tubo nel risonatore bobina di superficie dello spettrometro EPR banda L (1,2 GHz) e acquisire spettri EPR onde continue (CW) alla temperatura fisiologica di 37 ° C e ossigeno concentrazioni di 0, 1, 2, 4, 8 e il 20,9%. Mantenere la concentrazione di ossigeno dalla bollitura la soluzione con miscela di gas trasportato da un controller di gas e mantenere la temperatura usando un bagno di acqua collegato ad un termostato. Utilizzare i seguenti parametri di acquisizione spettrometro EPR: modulazione di ampiezza, 100 mG; frequenza di modulazione, 100 kHz; larghezza di spazzata, 5 G; tempo, 60 s.
- Per ottenere un migliore rapporto segnale-rumore (SNR), utilizzare un valore di ampiezza di modulazione del 60% il linewidth (ad esempio, utilizzare un'ampiezza di modulazione G 0,6 per il linewidth di 1 G).
- Procedura di calibrazione semplificata alternativa: registrare gli spettri EPR in aria-gorgogliare e anossici soluzioni14. In quest'ultimo caso, è necessario mantenere anossia nei campioni con l'aggiunta di glucosio di 10 mM e 100 U/mL glucosio ossidasi a soluzioni sonda 1 mL secondo riferimento14.
- Montare gli spettri EPR con la funzione lorentziana per trovare lo spessore della linea, LW. Valutare la sensibilità di microcristalli a pO2 come un pendio della dipendenza di LW pO2, vale a dire come un valore di (LWaria−LWanossia) /pO2air, dove LWaria e LWanossia sono spettri linewidth in condizioni di aria e anossia, rispettivamente; p O2air = 152 mm Hg.
- Funzione doppia sonda di pH e redox, NR
Nota: La sonda NR è sintetizzata come descritto nel riferimento11. È stabile a temperatura ambiente come un solido sia in soluzioni acquose. La sonda NR sintetizzata è conservata a 4 ° C. Il splitting iperfine dell'azoto, unaNe il tasso di decadimento di ampiezza di segnale sono i parametri spettrali della sonda NR che sono sensibili al pH (sonda pKun = 6,6 a 37 ° C, gamma di sensibilità di pH da 5,6 a 7.6) e per la capacità di riduzione della sonda microambiente, rispettivamente.- Rimuovere il NR dal freezer e lasciare il contenitore a temperatura ambiente (10-15 min). Pesare 6,34 mg della NR, scioglierli in 1 mL di soluzione salina e regolare il pH a 7,2 con piccole aliquote di HCl o NaOH utilizzando un pH-metro. Utilizzare la soluzione preparata di NR (10 mM) come una soluzione di riserva.
- Eseguire la calibrazione del pH della sonda NR come segue (Vedi riferimento11). In primo luogo, aggiungere 0,1 mL della soluzione madre NR 0,9 mL di tampone Na-fosfato di 2 mM, 150 mM NaCl. Titolare la soluzione ottenuta 1 mM NR con aliquote di HCl o NaOH al pH richiesto utilizzando un pH-metro. Controllare la temperatura usando un bagno di acqua collegato ad un termostato.
- Registrare gli spettri EPR dei campioni in microcentrifuga da 1,5 mL utilizzando lo spettrometro EPR banda L. Utilizzare i seguenti parametri di acquisizione spettrometro EPR: modulazione di ampiezza, 2,5 G; frequenza di modulazione, 100 kHz; larghezza di spazzata, 60 G; tempo, 20 s.
- Misurare hyperfine spaccare costante (unaN) pari alla metà della distanza tra i componenti di basso e alto-campo degli spettri EPR e trama contro il pH, per fornire la curva di taratura per misure in banda L EPR di pH.
- Sonda Simonerasetti GSH-sensibile
Nota: La sonda Simonerasetti viene sintetizzata come descritto nel riferimento15. Conservare la sonda NR sintetizzata a 4 ° C. Il biradical di bisolfuro Simonerasetti lipofilico composto si diffonde facilmente attraverso la membrana cellulare di reagire con GSH intracellulare e fornire un approccio affidabile per determinare GSH in vivo utilizzando EPR16,17. Questo metodo si basa sui tassi di reazione alta del pool intracellulare predominante dei tioli GSH con la sonda Simonerasetti. La reazione della biradical Simonerasetti con spaccature GSH relativo bisolfuro di legame (Vedi schema 1) con conseguente cancellazione dello scambio di spin tra due frammenti radicale e che si manifesta in una diminuzione delle componenti spettrali biradical e corrispondente aumento delle componenti monoradical. Per la sonda di Simonerasetti biradical, il tasso di aumento dell'ampiezza del componente monoradical è proporzionale alla concentrazione di GSH ed è un parametro di spettrali sensibili al GSH EPR conveniente. Per valutare la concentrazione di GSH dalle misurazioni di EPR in vivo , la taratura precedente del tasso di reazione Simonerasetti con GSH la corrispondente temperatura e pH deve essere eseguita come segue.- Rimuovere il Simonerasetti dal freezer e lasciare il contenitore a temperatura ambiente (10-15 min). Pesare 4,05 mg della NR e dissolverlo in 1 mL di soluzione di DMSO. Utilizzare la soluzione preparata Simonerasetti (10 mM) come una soluzione di riserva.
- Determinare il valore del tasso costante, k diobs, della reazione di Simonerasetti con GSH la temperatura desiderabile e a pH come segue.
- In primo luogo, aggiungere 20 µ l di soluzione madre Simonerasetti (10 mM) a 0,98 mL di buffer di 1 mM Na-fosfato, pH 7,2, 150 mM NaCl, per ottenere un 0,2 mM Simonerasetti sonda soluzione.
- Preparare soluzioni di concentrazioni di 1, 2 e 5 mM di GSH in tampone di Na-fosfato 0,1 M a pH 7,2. Per valutare con precisione la concentrazione di GSH nelle cellule dell'organo mirata dalle misurazioni in vivo , la taratura in vitro deve essere eseguita a un pH vicino al valore del pH intracellulare.
- Mescolare volumi uguali di soluzione Simonerasetti 0,2 mM e una delle soluzioni GSH preparate al punto 1.3.4. per una concentrazione finale della sonda a 0,1 millimetri e di GSH a 0,5, 1 o 2,5 mM.
- Subito dopo Simonerasetti e GSH soluzione di miscelazione, il campione viene posto nel risonatore EPR e registrare gli spettri EPR ogni 12 secondi per 10 minuti. Quindi calcolare la cinetica dell'aumento dell'ampiezza spettrale monoradical. Utilizzare i seguenti parametri di acquisizione spettrometro EPR: modulazione di ampiezza, 1 G; frequenza di modulazione, 100 kHz; larghezza di spazzata, 60 G; tempo di sweep, 10-60 s.
- Montare la cinetica EPR misurata per il monoexponents e calcolare la costante di tempo della cinetica esponenziale, τ. La regressione lineare (1/τ = k ×obs [GSH]) fornisce il valore della costante tasso osservato della reazione tra GSH e Simonerasetti (ad es., 34 ° C e a pH 7,2, kobs = 2,8 ± 0,2 M-1s-1)11.
- Sonda di speranza multifunzionale per pO2, pH e valutazione Pi
Nota: Il trityl monophosphonated speranza sonda è sintetizzato come descritto nel riferimento12 e viene mantenuto a 4 ° C. Gli spettri EPR CW di speranza al pH << pKa (una - forma acida) e pH >> pKa (B - forma di base) sono rappresentati da doppietti a causa di fosforo hyperfine spaccare, unP. Le impostazioni dello strumento tipico sono i seguenti: modulazione di ampiezza, 37,5 mG; frequenza di modulazione, 100 kHz; larghezza di spazzata, 0,9 G; tempo di sweep, 20-60 s. A pH intermedi (5 < pH < 8) lo spettro EPR di speranza sonda è caratterizzato da un quartetto quando entrambi A e B Stati sono presenti. Il linewidth EPR individuali della speranza è un indicatore di2 pO (precisione, ≈ 1 mmHg; p O2 range, 1-100 mmHg). La frazione di protonata speranza (una forma) è un indicatore di pH nell'intervallo da 6 a 8.0 (precisione, ± 0,05). Il valore del tasso di cambio del protone (espresso in mG) con Pi estratte mediante simulazione di spettri è un marcatore di Pi (precisione, ± 0,1 mM, gamma, 0.1-20mm). Le procedure di calibrazione vengono eseguite a temperatura fisiologica (37 ° C), forza ionica soluzione (NaCl, 150 mM) e concentrazione di sonda di speranza di 0,2 mM, come precedentemente descritto in riferimenti12,18e descritto di seguito.- Rimuovere la sonda di speranza dal freezer e lasciare il contenitore a temperatura ambiente (10-15 min).
- Pesare 10,7 mg della sonda speranza, scioglierli in 1 mL di soluzione salina e regolare il pH a 7,4. Aggiungere 20 µ l della soluzione preparata stock della speranza (10 mM) a 0,98 mL della soluzione salina per ottenere un 0,2 mM speranza soluzione sonda.
- Per la calibrazione della sonda del pH, titolare 0,2 mM di soluzione della sonda la speranza con l'aggiunta di un piccolo volume di NaOH o HCl, con la diluizione finale del campione inferiore all'1%. Misurare il pH con un elettrodo di pH tarato a 37 ° C, utilizzando i valori di pH per la soluzione di riferimento raccomandata da Bureau Nazionale di standard (US). Utilizzare un becher rivestito reazione associato a un circolatore per mantenere la temperatura di riferimento e soluzioni titolate attentamente nelle misure di pH. Mantenere le condizioni anossiche con l'aggiunta di 10 millimetri di glucosio e ossidasi di glucosio 100 U/mL per le soluzioni di sonda.
- Acquisire gli spettri EPR delle forme A e B ≤ pH 5 e pH ≥ 8, rispettivamente, in condizioni di anossia in assenza del fosfato.
- Utilizzare gli spettri corrispondenti per ottenere parametri spettrali intrinseci. Vale a dire, è possibile simulare la linea spettrale come la convoluzione della funzione lorentziana con la funzione gaussiana che approssima la struttura iperfine super irrisolta della sonda speranza. Il raccordo degli spettri EPR calcolati per gli spettri sperimentali fornisce i valori diP e Lorentzian linewidth (ΔLpp), determinati dal tasso di rilassamento trasversale, 1/T2 (dove 1/T2 = (√ 3/2) Lpp per il derivato misurato della linea assorbimento RF in CW EPR) e il linewidth della distribuzione gaussiana, G.
Nota: I seguenti sono i parametri ottenuti dallo spettro misurato alle condizioni specificate al punto 1.4.2: unP(A) = 3,63 G, unP(B) = 3,37 G; 1/T2(A) = 23,6 mG; 1/T2(B) = 9 mG; G(A) = 40 mG; G(B) = 45 mG (Vedi riferimento8). - Acquisire gli spettri EPR della speranza a pH intermedi (5 < pH < 8). Simulare il componente ad alta-archiviato degli spettri EPR acquisiti utilizzando la teoria dello scambio tra diversi siti in sistemi non-accoppiato o loosely-coupled adattati da riferimento19 come descritto in precedenza18. Uso i parametri intrinseci ottenuti per la A e B (Vedi punto 1.4.5) per diminuire il numero di variabili. Montare gli spettri calcolati a quelli sperimentali per trovare i valori della frazione un p (A) e tracciare la dipendenza delvalore p sul pH. Utilizzare la dipendenza di pA sul pH in ulteriori studi come una curva di calibrazione del pH.
Nota: La dipendenza di pH di p,A , con una curva di titolazione standard di montaggio fornisce il valore della dissociazione costante, pKun (spero) = 6,98. Negli studi in vivo , l'acquisizione di spettri EPR completo della sonda speranza è impraticabile a causa del tempo supplementare necessario per acquisire il divario tra i componenti di basso e alto-campo del fosforo hyperfine spaccare nello spettro EPR. Pertanto, in ulteriori studi esemplificati solo il componente archiviato alta dello spettro EPR ha misurato e analizzato. - Per la calibrazione della sonda di pO2, acquisire spettri EPR della sonda speranza a varie concentrazioni di ossigeno.
- Controllo il pO2 valori delle soluzioni dalla bollitura con miscela di gas trasportato da un controller di gas. Controllare la temperatura della soluzione (37 ° C) usando un bagno di acqua collegato ad un termostato.
- Simulare gli spettri EPR e farli stare a quelli sperimentali, come descritto al punto 1.4.6 per determinare i valori delle velocità di rilassamento indotto da ossigeno.
Nota: I valori delle velocità di rilassamento indotto da ossigeno erano 0,49 mG/mmHg entrambi per la A e forme B della speranza della sonda come misurato a 37 ° C8. - Per la calibrazione della sonda di [Pi], acquisire spettri EPR della sonda speranza a varie concentrazioni di fosfato. Utilizzare la soluzione radicale di speranza con un pH vicino a pKun (pKun = 6,9 a 37 ° C)18 e titolare con varie concentrazioni di fosfato. Mantenere la composizione di gas e di temperatura come descritto nei passaggi precedenti.
- Simulare gli spettri EPR e farli stare a quelli sperimentali, come descritto al punto 1.4.6 per determinare i valori del tasso di cambio Pi-indotta.
Nota: La dipendenza del tasso di cambio Pi-indotto [Pi] è usata come calibrazione in ulteriori studi.
2. Mouse modelli di cancro al seno
- Modello di MMTV-PyMT spontanea del tumore
- Utilizzare 4-8 settimana-vecchio amico virus tipo B suscettibilità/NIH (FVB/N) topo tumore mammario virus promotore (MMTV) polyoma medio-T antigene (PyMT +) i topi femminili con i tumori mammari spontaneamente formati per in vivo studi di EPR.
- Per il confronto di microambienti di tessuto delle ghiandole mammarie normali e dei tumori, utilizzare le femmine di pari età littermate carenti nel PyMT dell'oncogene (PyMT−, "wild type")20.
- Sottoporre i topi alla spettroscopia EPR banda L una volta alla settimana per quattro settimane durante l'anestesia isoflurano (vedere sonda consegna qui sotto).
- Anestetizzare il mouse usando una miscela di aria-isoflurano (3% isoflurano) e posizionare il mouse su un tavolo regolabile in posizione laterale destra con il tumore (ghiandole mammarie) vicino il risonatore di bobina di superficie.
- Dopo il posizionamento del mouse, amministrare la sonda di iniezione di intratissual (i.t.), ottimizzare lo spettrometro EPR e acquisire gli spettri EPR per 5-10 min.
- Misura 2-3 tumori mammari (da MMTV-PyMT + mouse) o del non tumore cuscinetto ghiandole mammarie (da topi PyMT−) durante la stessa sessione EPR.
- Modello del tumore orthotopic MET-1
- Crescere cellule di cancro mammario murino sfondo Met-1 FVB/N a 37 ° C, 5% CO2e 95% di umidità relativa in DMEM contenente 10% siero bovino fetale (FBS), 10 µ g/mL insulina, rhEGF 5 ng/mL e 1% PSA (penicillina G sodica, solfato di streptomicina e amfotericina B) a ~ 80% confluenza in una boccetta di T175.
- Aspirare i media e sciacquare le celle aderenti con 10 mL di PBS (1,54 millimetri KH2PO4, 155 mM NaCl e 2,71 mM Na2HPO4-7h2O senza cloruro di calcio o cloruro di magnesio, pH = 7.4).
- Staccare le cellule aggiungendo 5 mL di soluzione di tripsina-EDTA di 0,25% e a dondolo il pallone. Quando le cellule sono disconnessi, aggiungere 10 mL DMEM contenente 10% FBS al pallone e raccogliere le cellule.
- Centrifugare la sospensione cellulare a 132 x g per 10 min a 4 ° C. Contare le celle utilizzando un emocitometro e risospendere a 1 x 106 cellule per 100 µ l minimo DMEM.
- Usando una siringa da insulina (ago 29 1/2), iniettare lentamente 100 µ l di sospensione cellulare del tumore nel pad grasso mammario numero 4 del 8-settimana-vecchi topi femminili di wild-type FVB/N.
- Monitorare l'inizio del tumore tramite la palpazione (appaiono dopo circa 2-3 settimane), crescita (visivo) e del mouse heath (visual) ogni altro giorno.
- Misurare le dimensioni del tumore una volta alla settimana utilizzando pinze e determinare volumi del tumore usando l'equazione:
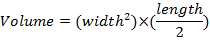
3. consegna della sonda per misure di funzionale In Vivo
- Sonda di LiNc-BuO particolato uso (protocollo I) per misurazioni2 pO in modelli di tumore ortotopici impiantando le cellule del tumore con interiorizzato LiNc-BuO microcristalli come precedentemente descritto14,21 e descritto di seguito.
- Nel caso del modello di tumore di MET-1, per internalizzazione di LiNc-BuO microcristalli nelle cellule MET-1, sospendere i microcristalli di LiNc-BuO in DMEM ad una concentrazione di 20 mg/mL e Sonicare con un sonicatore sonda a 20 kHz utilizzando 7 W di potenza in un tubo di turno-fondo 5 mL vetro per 5 min sul ghiaccio.
- Aggiungere 100 µ l (2 mg di LiNc-BuO) della sospensione in un pallone da T75 con 10 mL di coltura contenenti cellule MET-1 (circa 30% confluenti). Tutte le procedure avvengono in un armadio di sicurezza biologica e il supporto contiene penicillina e streptomicina per minimizzare la potenziale infezione.
- Incubare le cellule a 37 ° C per 72 h o fino a quando raggiungono ~ confluency di 80%.
- Aspirare i media. Lavare le cellule cinque volte con 10 mL di PBS. Staccare le cellule con 5 mL di tripsina-EDTA. Raccogliere le cellule. Centrifuga come descritto sopra al punto 2.2.4. Macchia di un campione di cellule con tintura di esclusione per determinare la quantità e la vitalità cellulare.
- Sospendere le cellule ad una concentrazione di 1 x 106 a 100 µ l minimo DMEM.
- Utilizzando una siringa da insulina, iniettare lentamente 100 µ l di sospensione cellulare contenente i microcristalli di LiNc-BuO interiorizzato nell'adiposità mammaria numero 4 dei topi wild-type FVB/N 8-settimana-vecchio femminili come descritto nel passaggio 2.2.5.
- Monitorare la crescita e l'inizio del tumore come descritto nei passaggi 2.2.6 e 2.2.7.
- Sonda di LiNc-BuO particolato uso (protocollo II) in uno spontaneo o Modelli ortotopici. Iniettare LiNc-OBu microcristalli presso il sito di interesse, ad esempio, in ghiandole mammarie normali o tumori mammari, utilizzando una siringa da insulina.
- Sonde solubile
- Anestetizzare i topi da inalazione di una miscela di aria-isoflurano (portata fino a 1,0 L/min e 2-3% di isoflurane) utilizzando un'anestesia macchina e metterli nella fessura dello spettrometro EPR.
- Accordare lo strumento, quindi iniettare il NR (10-30 µ l, 10 mM), la sonda di speranza (10−30 µ l, 0,5-2 mM) in soluzione fisiologica, pH 7,2 o sonda Simonerasetti nelle soluzioni di DMSO (10 µ l, 10 mM) (i.t.).
4. in Vivo misure funzionali
- Per misure spettroscopiche di EPR, anestetizzare i topi per inalazione della miscela aria-isoflurano utilizzando una macchina per anestesia come descritto al punto 3.3.1.
- Eseguire misurazioni funzionali mediante spettrometro EPR banda L (1,2 GHz) come segue.
- Posizionare il risonatore di bobina di superficie su una normale della ghiandola mammaria o un tumore mammario e sintonizzare lo spettrometro.
- Acquisire gli spettri EPR dalla sonda del particolato impiantato per 5−10 min sopra parecchie settimane dopo l'impianto. Nel caso di sonde solubile, è necessario acquisire gli spettri EPR immediatamente dopo l'iniezione di sonda per 5-10 min.
- Analizzare gli spettri EPR della sonda NR per trovare il hyperfine spaccare, unaNe l'ampiezza del segnale, i (t). Consente di convertire il valore di unN il valore di pH utilizzando la curva di calibrazione ottenuta al passaggio 1.2.4. Analizzare la velocità di decadimento dell'ampiezza del segnale i (t) come variazione relativa dall'ampiezza iniziale, I(t = 0), calcolata in unità arbitrarie al secondo (s-1).
- Adattare l'aumento della componente monoradical dello spettro EPR della sonda di GSH sensibili Simonerasetti a monoexponents per ottenere la costante di tempo della cinetica esponenziale per calcolare la concentrazione di GSH.
- Montare gli spettri EPR ad alto campo componente della sonda speranza multifunzionale a quelli sperimentali come descritto in (punto 1.4.5) per produrre i valori di pH, pO2 e Pi.
5. elaborazione statistica
- Eseguire l'elaborazione dati e analisi statistiche. Utilizzare test di correlazione di Pearson, una r (per set di dati distribuiti normalmente) e Rank ordine correlazione di Spearman (per set di dati con rifiutati normalità della distribuzione dei dati) per analisi di correlazione.
Risultati
Tessuto p O 2 Sonde di valutazione utilizzando il LiNc-BuO:
Utilizzando la procedura descritta nella sezione passaggio 1.1, abbiamo effettuato la taratura della sospensione di microcristalli LiNc-BuO preparati al momento. Figura 2 Mostra la dipendenza di ossigeno tipico di linewidth della sonda L...
Discussione
I metodi presentati consentono per la valutazione non invasiva in vivo dei parametri critici della TME chimica, vale a dire pO2, pH, stato redox e le concentrazioni di GSH intracellulare e interstiziale Pi. Tecniche di risonanza magnetica, quali MRI e basso campo EPR, sono i metodi di scelta per non invasiva in vivo profilatura di questi parametri TME. MRI Visualizza le strutture anatomiche, ma manca di sensibilità funzionale. In contrasto con MRI, EPR tecniche forniscono sensibilit...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato parzialmente sostenuto da NIH concede CA194013, CA192064 e U54GM104942. Il WVCTSI è riconosciuto per start-up a VVK, AB e TDE. Gli autori ringraziano il Dr. M. Gencheva e K. Steinberger per l'assistenza con gli esperimenti illustrativi. Il contenuto è di esclusiva responsabilità degli autori e non rappresentano necessariamente il punto di vista ufficiale del NIH.
Materiali
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Riferimenti
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon