È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Spettrometria di massa di elettroforesi capillare di microsonda per cella singola metabolomica in embrioni di rana Live (Xenopus laevis)
In questo articolo
Riepilogo
Descriviamo i passaggi che permettono il campionamento veloce in situ di una piccola parte di una singola cella con alta precisione e l'invasione minima utilizzando micro-campionamento basato sul capillare, per facilitare la caratterizzazione chimica di uno snapshot di attività metabolica in vivere gli embrioni utilizzando una piattaforma di spettrometria di massa e di elettroforesi capillare su misura singola cella.
Abstract
La quantificazione di piccole molecole in singole cellule genera nuove potenzialità per comprendere meglio i processi di base che sottendono lo sviluppo embrionale. Per abilitare unicellulare indagini direttamente in embrioni dal vivo, nuovi approcci analitici sono necessari, specialmente quelli che sono sensibile, selettiva, quantitativa, robusta e scalabile per celle di diverse dimensioni. Qui, presentiamo un protocollo che consente l'analisi in situ di metabolismo in singole cellule liberamente lo sviluppo di embrioni di Rana artigliata dell'africano del Sud (Xenopus laevis), un potente modello in biologia cellulare e dello sviluppo. Questo approccio utilizza una microsonda capillare per aspirare una porzione definita da singole cellule identificate nell'embrione, lasciando le cellule vicine intatto per la successiva analisi. Il contenuto della cella raccolti è analizzato da un interfaccia su microscala elettroforesi capillare electrospray ionizzazione (CE-ESI) accoppiato ad uno spettrometro di massa ad alta risoluzione tandem. Questo approccio è scalabile a vari formati di cella e compatibile con la struttura tridimensionale complessa dell'embrione in via di sviluppo. Ad esempio, dimostriamo che microsonda che unicellulare CE-ESI-MS consente la delucidazione di eterogeneità metabolica delle cellule che si dispiega come una cellula del progenitor dà luogo a discendenti durante lo sviluppo dell'embrione. Oltre a cellulare e biologia dello sviluppo, i protocolli di analisi unicellulare descritti qui sono suscettibili di altre celle di dimensioni, tipi cellulari o modelli animali.
Introduzione
Una comprensione globale dello sviluppo embrionale richiede la caratterizzazione di tutti i cambiamenti molecolari che si dipanano in ogni cellula dell'organismo in via di sviluppo. Mentre la Next-Generation Sequencing con amplificazione molecolare permette profonda misura di singola cellula trascrittomi1 in sviluppo sistemi2,3, considerevolmente di meno è conosciuto circa la suite di molecole più piccole prodotta in singole cellule embrionali, tra cui proteine e, soprattutto, metaboliti (massa molecolare < Da ~ 1.500). Con una risposta veloce e dinamica agli eventi intrinseci ed estrinseci, il metaboloma serve come un potente descrittore dello stato molecolare di una cella. Il metaboloma unicellulare, pertanto, aumenta il potenziale di seguire l'evoluzione spaziale e temporale delle eterogeneità cellulare nell'embrione precoce e di identificare nuove molecole per studi funzionali. Tuttavia, senza amplificazione molecolare disponibile per queste molecole, rilevamento del metaboloma esige sensibilità eccezionale utilizzando la spettrometria di massa (MS), che è la tecnologia scelta per analisi del metabolita.
Cella singola MS è un insieme di tecnologie con sufficiente sensibilità per misurare i metaboliti in singole cellule (Vedi recensioni 4,5,6,7,8,9 ,10,11,12,13,14,15). Riproducibile campionamento delle cellule ed efficiente estrazione di metaboliti sono essenziali per l'individuazione dei metaboliti in singole cellule. La dissezione della intero-cellula delle cellule identificate da embrioni di Xenopus ha permesso la caratterizzazione di piccole molecole e peptidi16. Altri approcci utilizzano micropipette a campione singole celle dal vivo seguite da rilevamento tramite ionizzazione electrospray (ESI) MS. Ad esempio, i metaboliti sono stati misurati in pianta o cellule di mammifero di cella singola video MS17, pressione sonda18, singola sonda19e microscopia forza fluidico20, fra le altre tecniche21, 22,23,24. Inoltre, incorporazione di separazione chimica prima ionizzazione nel flusso di lavoro MS unicellulare semplifica in modo efficiente il metaboloma, attenuando le potenziali interferenze durante la generazione di ioni prima del rilevamento. D'importanza, separazione fornisce anche informazioni specifiche del composto per assistere in identificazioni molecolari. Elettroforesi capillare (CE) è stato utilizzato per rilevare metaboliti nei neuroni2726 o microsampled singoli dissecata25,, acquisizione della piccolo-molecola differenze tra fenotipi del neurone. Abbiamo recentemente adattato CE a tandem ESI MS per abilitare il rilevamento del livello di traccia di centinaia di metaboliti in singole celle che sono stati sezionati da primi embrioni di Xenopus laevis16,28. Questi studi hanno rivelato sorprendenti differenze metaboliche tra cellule embrionali in una fase iniziale di sviluppo e ha portato alla scoperta di metaboliti con precedentemente sconosciuto inerente allo sviluppo impatti16.
Qui forniamo un protocollo che abilitato il rilevamento dei metaboliti in singole cellule direttamente in un embrione di vertebrati dal vivo usando della microsonda unicellulare CE-ESI-MS29,30. L'organismo di modello scelto è la 8-32-cellula dell'embrione X. laevis , anche se l'approccio è applicabile anche alle successive fasi di sviluppo e altri tipi di organismi modello. Questo protocollo utilizza capillari affilati con il controllo traduzionale multiasse sotto la Guida di un sistema di imaging ad alta risoluzione per aspirare un ~ 10 nL parte delle cellule identificate in situ nell'embrione di sviluppo morfologicamente complessa. Questa microsonda è scalabile a celle più piccole e opera in pochi secondi, che è sufficientemente veloce per tenere traccia di stirpi delle cellule nell'embrione. Dopo l'estrazione polare o piccole molecole apolari, quali metaboliti e peptidi, dal campione prelevato in ~ 4-5 µ l di soluzione estrazione, un ~ 10 nL dell'estratto risultante viene analizzata in una piattaforma CE fuoriserie sillabata ad uno spettrometro di massa ESI. Costruzione e funzionamento della piattaforma CE-ESI-MS sfrutta i protocolli descritti altrove. 31 , 32 l'interfaccia CE-ESI co-axial è costruito come descritto altrove. 31 questa piattaforma è mantenuta in regime di spruzzatura getto a cono per raggiungere livello di traccia sensibilità con una capacità per quantificazione sopra una gamma dinamica (relativo28,29,30 Registro-ordine di 4-5 o assoluto16). La piattaforma di CE-ESI-MS offre un limite inferiore di 60-amol di rilevamento con 8% deviazione standard relativa (RSD) nella quantificazione sopra una gamma testata di 10 nM a 1 µM per piccole molecole16, che sono sufficienti per caratterizzare metaboliti endogeni in X. laevis cellule. Microprobed cellule continuano a dividersi il progredire dell'embrione attraverso sviluppo30, consentendo analisi temporalmente e spazialmente risolto del metabolismo cellulare. Infatti, la cella singola CE-ESI-MS può essere utilizzato per trovare differenze metaboliche tra cellule che occupano il dorso-ventrale16,29, animale-vegetale16e sinistra-destra28 assi dello sviluppo così come le cellule che formano il tessuto neurale fated lignaggio dorsale da una cellula progenitrice comune in X. laevis30. Oltre a una query su differenze metaboliche tra le singole celle embrionali nelle diverse fasi dello sviluppo dell' embrione X. laevis 30, prevediamo che i protocolli descritti qui sono applicabili a una vasta gamma di biomolecole e microsampled di cellule singole da diversi stadi di sviluppo embrionale, così come altri tipi di cellule e organismi modello. Inoltre, la microsonda potrebbe essere utilizzata per Microcampionamento, mentre un'altra piattaforma compatibile con minuscoli campioni potrebbe essere usata per separazione e/o caratterizzazione di biomolecole.
Protocollo
Tutti i protocolli relativi alla manutenzione e gestione di Xenopus laevis sono stati approvati dal comitato di uso alla George Washington University e istituzionali Animal Care (IACUC no. A311).
1. preparazione del campionamento strumenti, Media, solventi e degustazione di piatti
- Preparare la soluzione di Steinberg (SS) 1x sciogliendo i seguenti sali in acqua ultrapura (~18.2 MΩ.cm a 25 ° C) nel seguente ordine e alle concentrazioni indicate seguendo uno standard di protocollo33: cloruro di sodio (58,2 mM), cloruro di potassio ( 0,67 mM), nitrato di calcio (0,34 mM), solfato di magnesio (0,83 mM), Tris-cloridrato (4,19 mM) e Tris base (0,66 mM). Fare 0,5 x SS di duplice e 0,1 x SS diluendo dieci volte, 1 x SS utilizzando acqua ultrapura.
- Preparare piatti di campionamento di agarosio al 2% che fa prima 1 x SS. Autoclave a 120 ° C per 20 min a dissolversi. Mentre ancora liquido, rivestire il fondo delle capsule di Petri di 60mm con la soluzione. Una volta che il gel dell'agarosi è raffreddato e solidificato, fiamma alla fine di una pipetta di Pasteur di sei pollici fino a quando forma una palla e toccare leggermente l'estremità riscaldata per impronta 5-10 pozzi, ~ 1 mm di profondità, in agarosio.
Nota: Questi pozzi sono utilizzati per immobilizzare gli embrioni durante il campionamento. - Preparare il solvente di estrazione del metabolita. Personalizzare le proprietà fisico-chimiche del solvente (ad es., polarità e pH) per le classi di molecole che sono di interesse nello studio.
Nota: ad esempio, usiamo metanolo a 40% e 40% acetonitrile in LC-MS-grade acqua come un approccio di scoperta di target metaboliti principalmente polari e apolari alcuni metaboliti e peptidi28. - Creare cicli di capelli con capelli puliti e una pipetta di Pasteur come descritto altrove33 per spostare delicatamente gli embrioni nei piatti Petri con minima perturbazione.
- Fabbricare Micropipette punta affusolata come mostrato in Figura 1a.
- In primo luogo, tirare capillari borosilicato (1.000/500 µm diametro interno/esterno) in un estrattore capillare fiammeggiante-Brown-tipo con le seguenti impostazioni: calore = 355; tirare = 65, velocità = 80; tempo = 150.
- Successivamente, spezzare la punta della micropipetta tirata utilizzando una coppia di una pinzetta tagliente per ottenere un suggerimento capillare e diametro esterno di ~ 20 µm. eseguire questo passaggio sotto un microscopio stereoscopico per aiutare la precisione e la riproducibilità.
Nota: Capillari con una piccola mancia sono inclini a intasamento durante l'aspirazione del citoplasma viscoso. Mentre i capillari con una punta più grande sicuramente aiutano a evitare intasamenti e aspirare più del contenuto cellulare, di grosso calibro capillari possono pongono sfide durante il campionamento di cellule più piccole e possibilmente danneggiare la cella per il campionamento successivo. La regolazione della pressione e tempo di aspirazione può alleviare parzialmente queste sfide. Troviamo le micropipette con ~ 20 µm di diametro esterno ideale per il lavoro qui presentato.
2. Microcampionamento singole cellule e metabolita estrazione
- Ottenere embrioni (fecondati) tramite accoppiamento naturale gonadotropina-indotta di adulto Xenopus laevis o tramite fecondazione in vitro , come descritto altrove protocolli33,34.
Nota: Accoppiamento naturale assicura che le fasi di sviluppo embrionale sono sfalsate mentre embrioni ottenuti da fecondazione in vitro sono più affidabili nella fornitura. Tuttavia, fecondazione in vitro è necessario sacrificare la rana maschio adulta. - Appena preparare 2% cisteina dejellying soluzione dissolvendo 4G di cisteina in 200 mL di acqua ultrapura e regolare goccia a goccia la soluzione a pH 8 utilizzando la soluzione di idrossido di sodio 10 N.
- Rimuovere gli strati di gelatina che circondano gli embrioni come cominciano a fendere nella fase 2-cella come segue: embrioni riposare nella soluzione dejellying per 2 min, poi roteare delicatamente li per altri 2 min per impediscono l'aderenza alla superficie di raccolta di embrioni piatto.
- Versare delicatamente il piatto contenuto in un bicchiere pulito e rapidamente decantare la soluzione dejellying da Becher. Coprire immediatamente le uova con 0,1 x SS per lavare via il restante dejellying soluzione, agitare delicatamente e quindi decantare la soluzione. Ripetere questo passaggio quattro volte lavare accuratamente gli embrioni.
Nota: Limitare l'esposizione degli embrioni alla soluzione dejellying a 4 min per garantire redditività. Protocolli completi per rimuovere gli strati di gelatina sono disponibili altrove33. - Trasferire gli embrioni dejellied in 1 x SS in una capsula di Petri. Per ridurre al minimo affollamento all'interno delle piastre, posizionare gli embrioni di ~ 100 per 100 mm piatto33.
Nota: Piatti contenenti gli embrioni possono essere conservati tra 14-18 ° C per rallentare lo sviluppo e ottenere embrioni durante le fasi di sviluppo sfalsate dagli stessi genitori. Altri orientamenti sulla dipendenza di temperatura di crescita e sviluppo sono pubblicati su Xenbase e altrove33,35,36,37. - Sorta di sfaldatura embrioni allo stadio di 2-cellule in un piatto separato in cui pigmentazione stereotipata con fiducia segna l'asse dorso-ventrale, con riferimento di cella stabilito destino mappe38,39,40.
- Identificare correttamente che fende embrioni assicurando che taglia in due il primo solco di clivaggio, che delimita il piano sagittale, la scuro (ventrale) e leggermente pigmentato (dorsale) Polo animale tale che le due metà sono immagini speculari41.
- Montare una micropipetta fabbricata su un micromanipolatore multi-asse (manuale o controllata in remoto). Collegare la micropipetta a un microinjector.
- Utilizzare una pipetta di trasferimento in plastica per aspirare ~ 5 degli embrioni 8 celle e trasferirli nel piatto campionamento contenente 0,5 x SS.
Nota: Identificare le cellule basate sulla pigmentazione e posizione nell'embrione, con riferimento di cella destino mappe38,39,40.
Nota: per esempio, abbiamo regolarmente aspirare ~ 10-15 volume nL dalla cella applicando ~ 3 impulsi di-30 psi a capillare. Questa fase dura ~ 5 s per aspirazione30.
- Richiudere bene il flacone per evitare l'evaporazione e posizionare la cuvetta nuovamente dentro il secchiello del ghiaccio di 4 ° C fino a quando il campionamento è completo. Scartare la micropipetta usata in un contenitore per oggetti appuntiti per evitare il pericolo di ferite da aghi.
Nota: Per determinare il volume del contenuto della cella aspirato, iniettare l'aspirato in olio minerale, dove ottiene una forma sferica. Il diametro di questa sfera può essere misurato usando un microscopio. Calcolare il volume aspirato: V = 4/3 π r3, dove V è il volume, e r è il raggio della sfera.
3. misura CE-ESI-MS
- Preparazione degli standard e soluzioni per CE-ESI-MS
- Preparare l'elettrolita di sfondo (BGE) composto da 1% di acido formico in acqua di grado di LC-MS.
- Preparare la soluzione di guaina per contenere metanolo al 50% in grado di LC-MS acqua e 0,1% acido formico.
- Preparare 50 nM acetilcolina soluzione nella soluzione guaina per valutazione giornaliera delle prestazioni del sistema CE-ESI-MS.
- Preparare la soluzione di cloruro di sodio 150 mM come massa-taratura standard per la gamma bassa m/z in modalità ioni positivi. Una precisione di massa (m/z) di < consiglia di 10 ppm. Seguire le istruzioni del fornitore di uno spettrometro di massa per eseguire questo passaggio.
Nota: In alternativa, altri standard con valori noti m/z può essere utilizzato per massa-calibrare lo spettrometro di massa.
- Costruzione della piattaforma CE-ESI
- Costruire una piattaforma di iniezione CE capace di traduzione rapida verticale di una fase che tiene il flaconcino BGE e l'esempio di caricamento microprovetta. Per la costruzione e il funzionamento della piattaforma, fare riferimento ai dettagli in riferimento31.
- Assemblare l'interfaccia CE-ESI (Figura 1C) come segue. Montare l'emettitore di metallo electrospray (130/260 µm interno/esterno diametro e ~ 35 mm lunghezza) in una 3-porta T-Unione. Nutrire il capillare di separazione CE (40/105 µm interno/esterno diametro e ~ 100 cm lunghezza) attraverso l'emettitore di electrospray lasciandola sporgere ~ 40-100 µm oltre la punta dell'emettitore. Lavorare sotto un microscopio stereoscopico per aiutare la precisione.
- Collegare il capillare di soluzione guaina (75/360 µm interno/esterno diametro e ~ 100 cm lunghezza) alla porta rimanente per fornire la soluzione di electrospray. Utilizzare adeguate maniche e serrare le connessioni per il funzionamento senza perdite dell'interfaccia CE-ESI. Fare riferimento a precedenti protocolli31,32 per informazioni dettagliate sull'assemblaggio e Trouble-Shooting di questa interfaccia.
Nota: Dimensioni capillare influenzano il rapporto segnale-rumore (S/N) e la durata della separazione. Ad esempio, stretto-alesaggio e brevi capillari facilitano veloce separazioni utilizzando maggiore separazione tensioni42,43. Inoltre, a seconda dei tipi di molecole che sono di interesse in uno studio, capillari di separazione possono essere rivestiti per minimizzare/evitare indesiderati molecola-capillare parete interazioni44.
- Collegare il capillare di soluzione guaina (75/360 µm interno/esterno diametro e ~ 100 cm lunghezza) alla porta rimanente per fornire la soluzione di electrospray. Utilizzare adeguate maniche e serrare le connessioni per il funzionamento senza perdite dell'interfaccia CE-ESI. Fare riferimento a precedenti protocolli31,32 per informazioni dettagliate sull'assemblaggio e Trouble-Shooting di questa interfaccia.
- Utilizzando un portatarga, montare l'interfaccia CE-ESI su un palcoscenico di tre assi traduzione e posizionare la punta di emettitore electrospray ~ 2 mm dall'orifizio spettrometro di massa (Figura 1C).
- Per pulire componenti dell'interfaccia, sciacquare, fornendo la soluzione di guaina electrospray attraverso l'emettitore di electrospray a 1 µ l/min e la BGE attraverso la separazione di CE capillare. Utilizzare pompe a siringa per nutrire i solventi a una velocità costante.
- Sciacquare il capillare di separazione CE prima di ogni misurazione collegando una siringa alla fine aspirazione capillare. Usare siringhe sufficientemente grande per minimizzare il rabbocco e adescamento delle linee di approvvigionamento solvente.
Nota: Gli esperimenti in genere utilizzano siringhe a tenuta di gas da 1 mL per fornire il solvente di guaina electrospray e una siringa 500 µ l per irrigare il capillare di separazione.
- Convalida della piattaforma CE-ESI-MS e misurazione dei metaboliti
Nota: L'obiettivo di questa fase è quello di confermare la sensibilità analitica dello strumento CE-ESI-MS al giorno prima analisi unicellulare estratti.
- Dopo il risciacquo la separazione capillare per ~ 5 min, trasferire suo ingresso nella soluzione BGE situata in un flaconcino di acciaio inox.
- Posizionare la punta di emettitore electrospray ~ 2 mm dall'orifizio spettrometro di massa e regolare con precisione questa distanza utilizzando una fase di traduzione per generare electrospray in regime di getto a cono stabile mentre lo spray utilizzando un microscopio stereoscopico di monitoraggio (vedere riferimenti 31,45). Monitorare la stabilità dello ione totale corrente (TIC) per circa 30-45 min per garantire un funzionamento stabile.
- Applicare ~ 20 kV al flaconcino BGE gradualmente arrampicandosi il potenziale oltre ~ 15 s, tipicamente generando ~7.5 µA di corrente attraverso il capillare di separazione utilizzando acido formico 1% come il BGE. Prima di ogni misurazione, garantire la stabilità del sistema monitorando il profilo TIC di ~ 5-10 min e poi graduale abbassare il potenziale di separazione (CE) a 0 V (terra).
Nota: Per semi-automatizzare questo processo, usiamo un software personalizzato per controllare in remoto la CE ad alta tensione alimentazione fornitura31. Se la piattaforma di CE-ESI-MS è instabile, attentamente valutare la fonte di instabilità testando la piattaforma CE-ESI-MS prima in modalità di sola ESI e poi in modalità operativa CE-ESI come consigliato altrove31. Brevemente, per testare la piattaforma in modalità di sola ESI, spegnere l'alta tensione CE e monitorare il TIC per ~ 30 min in regime di spruzzatura di getto a cono. Se necessario, per errori di indirizzo procedere come segue: (i) controllare le connessioni per perdite; (ii) pulire l'emettitore di electrospray con acqua, isopropanolo, acqua e metanolo; (iii) de-gas solventi; (iv) svuotare l'emettitore per ~ 25 min prima di testare nuovamente. Se la piattaforma di CE-ESI è trovata stabile in modalità di sola ESI ma diventa instabile durante la separazione di CE, ispezionare il sistema di riscaldamento di Joule e/o elettrolisi: (i) Sciacquare il capillare di separazione con BGE per ~ 25 min e ripetere l'esperimento; (ii) utilizzare potenziali più bassi di separazione per mantenere una risposta lineare ohmica (cioè, lineare CE attuale vs curva di tensione di separazione); (iii) ispezionare il capillare CE per potenziali danni, come ad esempio crepe ed eventualmente sostituire il capillare. - Analizzare ~ 6 nL del campione come segue:
- Pipettare 1 µ l della soluzione standard di acetilcolina nel flaconcino.
- Trasferire il capillare di separazione dal flaconcino BGE nella fiala di iniezione.
- Sollevare la fase di iniezione CE 15cm in 1s.
- Tenere il palco con privilegi elevati per 60 s per iniettare idrodinamicamente ~ 6 nL del campione nella separazione capillare.
- Successivamente, tradurre la fase e ritorno al livelli (in linea con la presa capillare).
- Spostare delicatamente l'estremità di aspirazione capillare nel BGE.
- Subito dopo, dilagare la tensione CE per avviare la separazione elettroforetica.
- Acquisizione di dati di avvio MS.
Nota: Le prestazioni del sistema possono essere caratterizzata utilizzando qualsiasi chimico standard. La consegna di CE-ESI-MS unicellulare abbassare i limiti di rilevazione a ~ 10 nM (~ 60 amol) per acetilcolina, metionina e istidina16. Il volume iniettato (Vinj), nel capillare in nL, dipende la differenza di altezza (H, cm) durante l'iniezione, densità (ρ, g cm-3) e viscosità (η, kg m-1s-1) di BGE, lunghezza (L, m) e il raggio (r, µm) della CE capillare e durata di iniezione (tinj, s). Questa relazione è espressa dalla seguente formula, dove g (m s-2) è l'accelerazione gravitazionale:
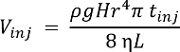
- Una volta che lo standard è stato rilevato, smettere di acquisizione dati, abbassare la tensione di separazione graduale a 0 V (terra), quindi recuperare l'emettitore a 2 cm dall'orifizio. Sciacquare il capillare di separazione per 5 min prima di analizzare l'Estratto delle cellule.
- Misura 10 nL della singolo-cella estrarre ripetendo i passaggi 3.3.1-3.3.5 utilizzando 90 s idrodinamicamente iniettare il campione.
Nota: L'obiettivo del trattamento dei dati è quello di identificare e quantificare i composti tra singole cellule. Il protocollo CE-ESI-MS di singola cellula genera picchi di stretta electropherographic con larghezze di base tipiche di pochi secondi. Eseguendo l'analisi di dati semi-manualmente, è possibile trovare caratteristiche molecolari (valori unici m/z con tempi di migrazione unica) attenendosi alla seguente procedura. Rappresentante separazione è indicato per selezionare metaboliti identificati nella Figura 2a.
- File di dati raw massa-Calibra post acquisizione dati.
Nota: Usiamo segnali da sodio formiato i cluster che vengono generati durante la separazione degli ioni sodio abbondante dal campione, che nativamente presente nelle cellule sono estratti da terreni di coltura dell'embrione. L'obiettivo di questa fase è di aumentare l'identificazione dei metaboliti nei passaggi successivi garantendo una precisione elevata massa (m/z), preferibilmente < 5 mDa, o < 10 ppm, tra m/z 50-1, 000. Qui, calibrazione di acquisizione dati post rende possibile ottenere ordinariamente accuratezza di massa < 1 mDa, o < 2 ppm per m/z 50-500. - Utilizzando uno script di elaborazione, ricerca per caratteristiche molecolari su tutta la gamma di massa rilevata. Media di spettri di massa attraverso ogni picco per determinare la massa accurata e annotare i loro tempi di migrazione corrispondenti. Per l'identificazione dei metaboliti di bassa massa nell'intervallo m/z 50-500, utilizzare una finestra di passaggio di 500 mDa per monitorare le caratteristiche molecolari con S/N > 3.
- Integrare il picco zona-sotto-il-curva per ogni funzione molecolare manualmente o automaticamente. I valori risultanti di zona sono utilizzati come una misura dell'abbondanza di metabolita.
- Identificare le caratteristiche molecolari di interesse con elevata fiducia come segue (Vedi fig.
- In primo luogo, confrontare la massa accurata delle caratteristiche molecolari su un database di metabolita (ad es., Metlin46 e HMDB47) con una precisione di 10 ppm per ottenere un elenco di presunte partite di massa.
- Successivamente, valutare queste partite massa confrontando il loro spettro di massa tandem ottenuto dalla cella estratti con dati disponibili nel database il metabolita o lo spettro di massa tandem misurato per il corrispondente prodotto chimico standard.
- Ultima, convalidare queste assegnazioni confrontando il tempo di migrazione delle caratteristiche molecolari registrata in estratti delle cellule con relativi standard chimici analizzati dallo strumento stesso CE-ESI-MS.
Nota: Per migliorare la velocità di trasmissione sperimentale, identifichiamo in genere solo le caratteristiche molecolari che sono statisticamente significativamente differenti fra condizioni sperimentali o tipi cellulari. Rappresentante identificazioni sono mostrati nella Figura 2. Per identificare i metaboliti con alta accuratezza di massa, si consiglia di calibrare esternamente lo spettrometro di massa ogni giorno, eseguire ricalibrazione in tempo reale durante ogni misurazione utilizzando uno standard interno, e/o esternamente massa-calibrare ogni misurazione acquisizione di post-dati file (ad esempio, per i cluster di formiato di sodio qui) sono raccomandati.
Nota: Nei nostri esperimenti, di piattaforme software online47 sono stati utilizzati per eseguire tutte le operazioni successive analisi dei dati, inclusi i seguenti passaggi: io) filtraggio delle caratteristiche molecolari con l'avvenimento in almeno il 50% di ogni set di esempio (ad es., cell tipo); II) la normalizzazione dei dati; III) statistica (ad esempio, t-test) e analisi multivariata dei dati, quali analisi delle componenti principali (PCA) e analisi dei cluster gerarchica (HCA). Usiamo p < 0.05 (dello studente t-test) per contrassegnare la significatività statistica e piega-cambiamento ≥ 1.5 notare significato biologico.
Risultati
Abbiamo recentemente impiegato della microsonda unicellulare CE-ESI-MS per la caratterizzazione di metaboliti in singole cellule identificate nello sviluppo liberamente di Xenopus laevis embrioni29,30. La microsonda consente il veloce (~ 5 sec/cell), in situ aspirazione di ~ 10 nL da una singola cella, le aspirazioni multiple della stessa cella o più celle diverse entro la stesse o versioni successive fasi dello...
Discussione
MicroProbe CE-ESI-MS consente la caratterizzazione diretta dei metaboliti in singole cellule in vivo, liberamente lo sviluppo di embrioni. Nel cuore dell'approccio sono due tecniche sottocomponenti, vale a dire in situ capillare microcampionamento e ad alta sensibilità CE-ESI-MS. rispetto alla dissezione di cellule intere, Microcampionamento capillare ha il vantaggio di funzionamento veloce (pochi secondi vs 5 min / cella di dissezione), compatibilità con la complessa morfologia tridimensionale di embrioni e s...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato da istituti nazionali di salute sovvenzioni GM114854 (a P.N.) e CA211635 (a P.N.), Arnold e Mabel Beckman Foundation Beckman Young Investigator concedere (a P.N.), il premio DuPont giovane professore (a P.N.), la società americana per la massa Premio ricerca spettrometria (a P.N.) e COSMOS Club Fondazione borse di studio (per R.M.O. ed E.P.P). Le opinioni e conclusioni espresse in questa pubblicazione sono unicamente quelle degli autori e non rappresentano necessariamente il punto di vista ufficiale delle fonti di finanziamento.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents for Embryo Culture Media | |||
| Potasium chloride | Fisher Scientific | BP 366-1 | |
| Magnesium sulfate | Fisher Scientific | M 65-3 | |
| Calcium nitrate | Sigma Aldrich | C1396 | |
| Cysteine | MP Biomedicals | 101444 | |
| Trizma hydrochloride | Sigma Aldrich | T3253 | |
| Trizma base | Sigma Aldrich | T1503 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Name | Company | Catalog Number | Comments |
| Metabolite Extraction Solvents | |||
| Acetonitrile (LC-MS-grade) | Fisher Scientific | A955 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Name | Company | Catalog Number | Comments |
| Solvents and Standards for CE-ESI-MS | |||
| Formic acid (LC-MS-grade) | Fisher Scientific | A11710X1-AMP | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456-4 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Acetylcholine chloride | Acros Organics | 159170050 | |
| Name | Company | Catalog Number | Comments |
| Microprobe Fabrication Setup | |||
| Micropippette puller | Sutter Instrument Co. | P-1000 | |
| Borosilicate capillaries | Sutter Instrument Co. | B100-50-10 | |
| Fine sharp forceps: Dumont #5, Biologie/Dumoxel | Fine Science Tools (USA) Inc | 11252-30 | Corrosion resitant and autoclavable. |
| Name | Company | Catalog Number | Comments |
| Microprobe Sampling Setup | |||
| Micromanipulator | Eppendorf, Hauppauge, NY | TransferMan 4r | |
| Stereomicroscope | Nikon | SMZ18 | Should be vibrationally isolated. |
| Illuminator e.g. Goosenecks | Nikon | C-FLED2 | |
| Microinjector | Warner Instrument, Handem, CT | PLI-100A | |
| Transfer pipettes (Plastic, disposable) | Fisher Scientific | 13-711-7M | |
| Petri dish 60 mm and 80 mm | Fisher Scientific | S08184 | |
| Glass Pasteur Pipets ( Borosilicate, disposable) | Fisher Scientific | 13-678-20A | |
| Centrifuge | Thermo Scientific | Sorvall Legend X1R | |
| Name | Company | Catalog Number | Comments |
| CE-ESI-MS Setup | |||
| High voltage power supply | Spellman | CZE1000R | The HVPS may be controlled remotely using a low-voltage program generated by a personal computer. Caution: High voltage presents electrical shock hazard; all connective parts must be grounded or carefully shielded to prevent users from accidental exposure. |
| Syringe pumps (2) | Harvard Apparatus | 704506 | |
| Stereomicroscope | Amscope | SM-3BZZ | Stereomicroscope capable of 4.5× magnification, equipped with an illuminator to monitor the spraying mode of the CE-ESI interface. |
| XYZ translation stage | Thorlabs | PT3 | |
| XYZ translation stage | Custom-built | This platform is capable of loading nanoliter-amounts of sample into the separation capillary via hydrodynamic injection and supplying the BGE for CE. Both interfaces described in this work were able to inject 6–10 nL of sample within 1 min into a 1 m separation capillary | |
| Stainless steel sample vials | Custom-built | ||
| Stainless steel BGE vial | Custom-built | ||
| Fused silica capillary (40 µm/105 µm ID/OD; 100 cm) | Polymicro technologies | TSP040105 | |
| Fused silica capillary (75 µm/360 µm ID/OD; 100 cm) | Polymicro technologies | TSP075375 | |
| Stainless steel emitter with blunt tips (130/260 µm ID/OD) | Hamilton Co. | 21031A | For better performance, laser-cleave and fine-polish the emitter tip. |
| Syringes (gas-tight): 500 - 1000 µL | Hamilton Co. | 1750TTL | |
| Digital multimeter | Fluke | Fluke 117 | |
| High-resolution Mass Spectrometer | Bruker Daltonics | Maxis Impact HD | High-resolution tandem mass spectrometer equipped with an atmospheric-pressure interface configured for ESI |
| Tunning mixture for mass spectrometer calibration | Agilent technologies | ESI-L G1969-85000 | |
| Data Analysis ver. 4.3 software | Bruker Daltonics | ||
| Name | Company | Catalog Number | Comments |
| Ancillary Equipment | |||
| Vacuum concentrator capable of operation at 4–10°C | Labconco | 7310022 | |
| Analytical microbalance (XSE105DU) | Fisher Scientific | 01911005 | |
| Freezer (-20 °C) | Fisher Scientific | 97-926-1 | |
| Freezer (-80 °C) | Fisher Scientific | 88300ASP | |
| Refrigerated Incubator | Fisher Scientific | 11475126 | |
| Vortex-mixer | Benchmark | BS-VM-1000 |
Riferimenti
- Tang, F. C., Lao, K. Q., Surani, M. A. Development and applications of single-cell transcriptome analysis. Nat. Methods. 8 (4), S6-S11 (2011).
- Veselovska, L., et al. Deep sequencing and de novo assembly of the mouse oocyte transcriptome define the contribution of transcription to the DNA methylation landscape. Genome Biol. 16 (209), (2015).
- Tran, D. A., Bai, A. Y., Singh, P., Wu, X. W., Szabo, P. E. Characterization of the imprinting signature of mouse embryo fibroblasts by RNA deep sequencing. Nucleic Acids Res. 42 (3), 1772-1783 (2014).
- Wang, D. J., Bodovitz, S. Single cell analysis: the new frontier in 'omics'. Trends Biotechnol. 28 (6), 281-290 (2010).
- Svatos, A. Single-cell metabolomics comes of age: new developments in mass spectrometry profiling and imaging. Anal. Chem. 83 (13), 5037-5044 (2011).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nat. Methods. 8 (4), S20-S29 (2011).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat. Biotechnol. 30 (9), 858-889 (2012).
- Rubakhin, S. S., Lanni, E. J., Sweedler, J. V. Progress toward single cell metabolomics. Curr. Opin. Biotechnol. 24 (1), 95-104 (2013).
- Kleparnik, K., Foret, F. Recent advances in the development of single cell analysis: A review. Anal. Chim. Acta. 800, 12-21 (2013).
- Zenobi, R. Single-cell metabolomics: Analytical and biological perspectives. Science. 342 (6163), 1243259 (2013).
- Gholipour, Y., Erra-Balsells, R., Nonami, H. In situ pressure probe sampling and UV-MALDI MS for profiling metabolites in living single cells. Mass Spectrom (Tokyo). 1 (1), A0003 (2012).
- Comi, T. J., Do, T. D., Rubakhin, S. S., Sweedler, J. V. Categorizing cells on the basis of their chemical profiles: progress in single-cell mass spectrometry. J. Am. Chem. Soc. 139 (11), 3920-3929 (2017).
- Lombard-Banek, C., Portero, E. P., Onjiko, R. M., Nemes, P. New-generation mass spectrometry expands the toolbox of cell and developmental biology. Genesis. 55, e23012 (2017).
- Yang, Y. Y., et al. Single-cell analysis by ambient mass spectrometry. Trac-Trends Anal. Chem. 90, 14-26 (2017).
- Lanni, E. J., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry imaging and profiling of single cells. J. Proteomics. 75 (16), 5036-5051 (2012).
- Onjiko, R. M., Moody, S. A., Nemes, P. Single-cell mass spectrometry reveals small molecules that affect cell fates in the 16-cell embryo. Proc. Natl. Acad. Sci. U. S. A. 112 (21), 6545-6550 (2015).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass Spectrom. 43 (12), 1692-1700 (2008).
- Nakashima, T., et al. Single-cell metabolite profiling of stalk and glandular cells of intact trichomes with internal electrode capillary pressure probe electrospray ionization mass spectrometry. Anal. Chem. 88 (6), 3049-3057 (2016).
- Pan, N., et al. The single-probe: A miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Guillaume-Gentil, O., et al. Single-cell mass spectrometry of metabolites extracted from live cells by fluidic force microscopy. Anal. Chem. 89 (9), 5017-5023 (2017).
- Saha-Shah, A., Green, C. M., Abraham, D. H., Baker, L. A. Segmented flow sampling with push-pull theta pipettes. Analyst. 141 (6), 1958-1965 (2016).
- Hu, J., et al. Synchronized polarization induced electrospray: Comprehensively profiling biomolecules in single cells by combining both positive-ion and negative-ion mass spectra. Anal. Chem. 88 (14), 7245-7251 (2016).
- Zhang, L. W., Vertes, A. Energy charge, redox state, and metabolite turnover in single human hepatocytes revealed by capillary microsampling mass spectrometry. Anal. Chem. 87 (20), 10397-10405 (2015).
- Zhang, L. W., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Lapainis, T., Rubakhin, S. S., Sweedler, J. V. Capillary electrophoresis with electrospray ionization mass spectrometric detection for single-cell metabolomics. Anal. Chem. 81 (14), 5858-5864 (2009).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis electrospray ionization mass spectrometry. Anal. Chem. 83 (17), 6810-6817 (2011).
- Aerts, J. T., et al. Patch clamp electrophysiology and capillary electrophoresis mass spectrometry metabolomics for single cell characterization. Anal. Chem. 86 (6), 3203-3208 (2014).
- Onjiko, R. M., Morris, S. E., Moody, S. A., Nemes, P. Single-cell mass spectrometry with multi-solvent extraction identifies metabolic differences between left and right blastomeres in the 8-cell frog (Xenopus) embryo. Analyst. 141 (12), 3648-3656 (2016).
- Onjiko, R. M., Plotnick, D. O., Moody, S. A., Nemes, P. Metabolic comparison of dorsal versus ventral cells directly in the live 8-cell frog embryo by microprobe single-cell CE-ESI-MS. Anal. Methods. , (2017).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. In situ microprobe single-cell capillary electrophoresis mass spectrometry: Metabolic reorganization in single differentiating cells in the live vertebrate (Xenopus laevis) embryo. Anal. Chem. 89, 7069-7076 (2017).
- Nemes, P., Rubakhin, S. S., Aerts, J. T., Sweedler, J. V. Qualitative and quantitative metabolomic investigation of single neurons by capillary electrophoresis electrospray ionization mass spectrometry. Nat. Protoc. 8 (4), 783-799 (2013).
- Knolhoff, A. M., Nemes, P., Rubakhin, S. S., Sweedler, J. V., Wevers, R., Lutz, N., Sweedler, J. V. . Methodologies for Metabolomics. , 119-139 (2013).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: a laboratory manual. , (2000).
- Moody, S. A. Cell lineage analysis in Xenopus embryos. Methods Mol Biol. 135, 331-347 (2000).
- Bowes, J. B., et al. Xenbase: a Xenopus biology and genomics resource. Nucleic Acids Res. 36, D761-D767 (2008).
- Karpinka, J. B., et al. Xenbase, the Xenopus model organism database; new virtualized system, data types and genomes. Nucleic Acids Res. 43 (D1), D756-D763 (2015).
- James-Zorn, C., et al. Xenbase: expansion and updates of the Xenopus model organism database. Nucleic Acids Res. 41 (D1), D865-D870 (2013).
- Moody, S. A. Fates of the blastomeres of the 16-cell stage Xenopus embryo. Dev. Biol. 119 (2), 560-578 (1987).
- Moody, S. A. Fates of the blastomeres of the 32-cell-stage Xenopus embryo. Dev. Biol. 122 (2), 300-319 (1987).
- Dale, L., Slack, J. M. W. Fate map for the 32-cell stage of Xenopus laevis. Development. 99 (4), 527-551 (1987).
- Klein, S. L. The first cleavage furrow demarcates the dorsal-ventral axis in Xenopus embryos. Dev. Biol. 120 (1), 299-304 (1987).
- Rollman, C. M., Moini, M. Ultrafast capillary electrophoresis/mass spectrometry of controlled substances with optical isomer separation in about a minute. Rapid Commun. Mass Spectrom. 30 (18), 2070-2076 (2016).
- Moini, M., Martinez, B. Ultrafast capillary electrophoresis/mass spectrometry with adjustable porous tip for a rapid analysis of protein digest in about a minute. Rapid Commun. Mass Spectrom. 28 (3), 305-310 (2014).
- Huhn, C., Ramautar, R., Wuhrer, M., Somsen, G. W. Relevance and use of capillary coatings in capillary electrophoresis-mass spectrometry. Anal. Bioanal. Chem. 396 (1), 297-314 (2010).
- Nemes, P., Marginean, I., Vertes, A. Spraying mode effect on droplet formation and ion chemistry in electrosprays. Anal. Chem. 79 (8), 3105-3116 (2007).
- Zhu, Z. J., et al. Liquid chromatography quadrupole time-of-flight mass spectrometry characterization of metabolites guided by the METLIN database. Nat. Protoc. 8 (3), 451-460 (2013).
- Wishart, D. S., et al. HMDB 3.0 The Human Metabolome Database in 2013. Nucleic Acids Res. 41 (D1), D801-D807 (2013).
- Liu, J. X., Aerts, J. T., Rubakhin, S. S., Zhang, X. X., Sweedler, J. V. Analysis of endogenous nucleotides by single cell capillary electrophoresis-mass spectrometry. Analyst. 139 (22), 5835-5842 (2014).
- Hubrecht, L., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin). A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1967).
- Grant, P. A., Herold, M. B., Moody, S. A. Blastomere explants to test for cell fate commitment during embryonic development. J. Vis. Exp. (71), (2013).
- Sellick, C. A., Hansen, R., Stephens, G. M., Goodacre, R., Dickson, A. J. Metabolite extraction from suspension-cultured mammalian cells for global metabolite profiling. Nat. Protoc. 6 (8), 1241-1249 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon