Method Article
Visualizzazione e quantificazione del potenziale di differenziazione delle cellule mesenchimali adipogenico con un Marker specifico lignaggio
In questo articolo
Riepilogo
Metodi tradizionali di valutazione adipogenico differenziazione sono economici e facili da usare, ma non sono specifici di cambiamenti nell'espressione genica. Abbiamo sviluppato un test per quantificare la differenziazione delle cellule mesenchimali in adipociti maturi con un pennarello specifico lignaggio. Questo test ha diverse applicazioni attraverso la ricerca di base e della medicina clinica.
Abstract
Diversi coloranti sono attualmente disponibili per uso nella rilevazione della differenziazione delle cellule mesenchimali in adipociti. Coloranti, come Oil Red O, sono a buon mercato, facile da usare e ampiamente utilizzato dai laboratori analizzando il potenziale adipogenico delle cellule mesenchimali. Tuttavia, essi non sono specifici di modifiche nella trascrizione genica. Abbiamo sviluppato un test di differenziazione di gene-specifico per analizzare quando una cellula mesenchymal ha cambiato il suo destino a un lignaggio adipogenico. Immuno-etichettatura contro acidi grassi binding protein-4 (FABP4), un indicatore di lineage-specifici di differenziazione adipogenico, abilitata visualizzazione e quantificazione delle cellule differenziate. La capacità di quantificare adipogenico potenziale di differenziazione delle cellule mesenchimali in un formato di micropiastre ben 96 ha implicazioni promettenti per un numero di applicazioni. Centinaia di studi clinici implicano l'uso di cellule stromali mesenchimali adulte ed è attualmente difficile da correlare i risultati terapeutici all'interno e soprattutto tra tali sperimentazioni cliniche. Questo semplice test FABP4 ad alta velocità fornisce un'analisi quantitativa per la valutazione del potenziale di differenziazione delle cellule derivate dal paziente ed è un robusto strumento per confrontare diversi metodi di isolamento ed espansione. Ciò è particolarmente importante dato il crescente riconoscimento dell'eterogeneità delle cellule viene somministrato ai pazienti nei prodotti delle cellule mesenchimali. Il saggio ha anche potenziale utilità in screening di stupefacenti throughput elevato, specialmente nella ricerca di obesità e pre-diabete.
Introduzione
Uno dei requisiti fondamentali stabiliti dalla società internazionale per la terapia cellulare (ISCT) per definire una cella stromale mesenchimale multipotente è che le cellule devono avere la capacità di differenziarsi in adipogenico, osteogenico e lignaggi condrogenica 1. metodi di differenziazione in queste tre stirpi di misura convenzionali si basano sulla rilevazione di prodotti macromolecolari utilizzando coloranti chimici1. Coloranti ad esempio Oil Red O (che le macchie di goccioline di grasso nelle cellule che hanno subito il adipogenesis), sono a buon mercato e facile da usare; Tuttavia non riescono a rilevare i cambiamenti specifici nell'espressione genica che si verificano quando le cellule mesenchimali differenziarsi in ogni rispettivo lineage2. Qui, abbiamo sviluppato un test di differenziazione che quantifica l'espressione della proteina per un indicatore di stirpe-specific adipogenico, associazione di acido grasso protein-4 (FABP4)3,4,5. FABP4 è stato inizialmente trovato in murini 3T3-L1 adipocytes3 e più successivamente è stato scoperto per essere espresso nel tessuto adiposo sottocutaneo umano6. È una proteina citosolica, che agisce come chaperon per guidare l'assorbimento degli acidi grassi dalle cellule ed è coinvolta nel processo di lipolisi4.
Le cellule del precursore utilizzate per le analisi di differenziazione erano cellule stromali mesenchimali derivate adiposa (ASCs)7,8. ASC condividono molte proprietà con derivate da midollo osseo cellule staminali mesenchimali (BM-MSCs), una popolazione di cellule staminali mesenchimali principali in adulti8,9. ASC offrono parecchi vantaggi sopra BM-MSCs in un'applicazione clinica, come una maggiore resa delle cellule può essere isolata dal tessuto più facilmente accessibili fonti8,9. Una popolazione isolata delle cellule deve soddisfare determinati criteri per essere definito come ASC. In primo luogo, devono mostrare aderenza ai recipienti di plastica tessuto coltura in condizioni di coltura standard1. Inoltre devono mostrare l'antigene di superficie specifica espressione1. Uncultured ASCs sono caratterizzate dall'espressione dell'antigene di superficie positivo di CD34, CD73, CD90, bassa espressione di CD105 ed espressione negativa di CD45 e HLA-DR10. ASC purificato mediante coltura su plastica per 28 giorni (aderente purificato ASCs) mostrano espressione positiva di CD73, CD90 e CD105 ed espressione negativa di CD34, CD45 e HLA-DR10. Infine, le cellule devono conservare la capacità di differenziarsi in vari lignaggi1,7,8.
Protocolli di differenziazione adipogenico inducono notevole upregulation dell'espressione FABP4 tra altri geni di lignaggio del adipocyte, così abbiamo usato immunochimica per visualizzare FABP4 proteine all'interno delle cellule e poi quantificato FABP4 espressione a livello di singola cellula utilizzando un microscopio di screening ad alto contenuto fluorescente automatizzato. Questo metodo è vantaggioso sopra coloranti tradizionali, in quanto consente altamente specifica conferma di differenziazione del adipocyte-stirpe. Tali dosaggi di stirpe specifico gene combinati con alto contenuto di metodi di screening anche permettono una quantificazione della percentuale di cellule all'interno di una preparazione eterogenee delle cellule che sono in grado di differenziazione verso il basso un particolare lignaggio. Nei nostri studi abbiamo usato l'analisi FABP4 per confermare la perdita del potenziale di differenziazione adipogenico di recente isolate ASCs dopo coltura cellulare.
Protocollo
1. preparazione ASCs per saggi di differenziazione
- Preparare i reagenti di coltura di tessuti e cellule vive in un cappuccio sterili per coltura di gestire.
- Preparare il supporto di A0: Dulbecco per volta Eagle Medium e di prosciutto F12 Medium (DMEM/F12), 1 x glutamax, 1 x penicillina/streptomicina.
- Preparare completo supporto di ASC: DMEM/F12, 1 x glutamax, 1 x penicillina/streptomicina, 10% siero bovino fetale.
- Aderente uso purificato ASCs, ampliato in un matraccio di cultura T75. Confermare la purezza del ASCs tramite fluorescenza-attivato delle cellule (FACS)10di ordinamento.
- Staccare le cellule rimuovendo tutte le medie nel matraccio di cultura T75 e aggiungere 2 mL di enzima di dissociazione della cellula.
- Lasciare il matraccio di cultura nell'incubatrice (37 ° C, umidificare, 5% CO2) per 5-10 min. Prendere il matraccio di cultura fuori l'incubatrice e picchiettare con decisione il lato del pallone. Verifica se le cellule hanno staccato dalla beuta cultura utilizzando un microscopio invertito.
- Aggiungere 13 mL di terreno di A0 un matraccio di cultura T75.
- Trasferimento da 15 mL in una provetta da centrifuga da 15 mL e centrifugare a 400 x g per 5 min.
- Scartare il surnatante e risospendere il pellet cellulare in 1 mL di terreno completo di ASC.
- Eseguire un conteggio delle cellule usando un emocitometro.
- Diluire la sospensione delle cellule ad una concentrazione di 25.000 cellule mL-1 in terreno completo di ASC.
- Aggiungere 200 µ l di terreno di A0 ai pozzetti periferia della piastra ben 96 (fondo piatto). Ciò riduce il tasso di evaporazione dei pozzetti contenenti cellule nel centro.
- Trasferire 200 µ l di sospensione cellulare di una piastra microtiter di raggiungere una densità di cella finale di 5 x 103 cellule per pozzetto. Quattro pozzi sono necessari per ogni gruppo di trattamento (triplice copia tecniche ripetizioni e un nessun controllo di anticorpo primario per immunocitochimica (ICC)).
- Lasciare piastra microtiter nell'incubatrice (37 ° C, umidificare, 5% CO2) fino alle cellule portata confluenza (3-4 giorni).
2. induzione della differenziazione delle ASCs
- Preparare mezzo di differenziazione adipogenico arricchendo completa ASC terreno con 1 µM dexamethasome, insulina µM 10 e 200 µM indometacina. Il mezzo di differenziazione completa è stabile a 4 ° C per 1 mese, quindi solo fare come richiesto per l'analisi di 1. Negozio a 4 ° C e quando è necessario riscaldare un'aliquota a 37 ° C in bagnomaria.
- Dopo 3-4 giorni, prendere la piastra microtiter fuori incubatore e sostituire metà del terreno di coltura con adipogenico mezzo di differenziazione.
- Eseguire un cambiamento medio ogni 2-3 giorni.
Nota: Differenziazione ottimale adipogenico richiede 14 giorni di cultura in mezzo di differenziazione. Le cellule differenziate sono analizzate utilizzando la tintura tradizionale basato su macchie e macchie di gene-specifico.
3. colorazione per differenziazione - tintura tradizionale ha basato le macchie
- Preparare la soluzione di formaldeide 4% da diluire 16% formaldeide con PBS. Diluire solo la quantità necessaria per l'esperimento e negozio ben sigillato in una provetta da centrifuga.
Attenzione: La formaldeide è un potenziale cancerogeno e può causare irritazione di naso, gola e polmoni su inalazione. Eseguire tutte le procedure relative alla formaldeide in una cappa aspirante. - Preparare soluzione stock Oil Red O sciogliendo 300 mg in 100 mL di isopropanolo.
- Prendere la piastra microtiter fuori dell'incubatrice. Le seguenti operazioni possono essere eseguite in un ambiente non sterile.
- Rimuovere tutte le medie da pozzi e fissare le cellule con formaldeide al 4% per 30 min.
- Durante il tempo di incubazione, preparare Oil Red O soluzione. Soluzione di lavoro comprende 6 parti di scorta Oil Red O con 4 parti di acqua distillata acqua (dH2O). Mescolate bene e lasciate riposare a temperatura ambiente per 20 minuti, prima del filtraggio utilizzando unità di filtro 0,2 µm. Soluzione di lavoro solo è stabile per 2 h.
- Rimuovere tutti i formaldeide dai pozzi di pipettaggio.
- Lavare le cellule una volta con 60% isopropanolo e lasciare che i pozzetti asciugare completamente prima di procedere.
- Aggiungere 50 µ l di soluzione di lavoro Oil Red O ad ogni pozzetto e incubare a temperatura ambiente per 10 min.
- Rimuovere Oil Red O soluzione e aggiungere immediatamente dH2O. Wash con dH2O 4 volte prima di vedere sotto il microscopio chiaro.
4. colorazione per differenziazione - Gene specifico anticorpi
- Preparare una soluzione madre di Tris buffered saline (TBS) sciogliendo 80 g di NaCl, 2 g di KCl e 30 g di Tris Base a 1 L di dH2O (pH 8). Preparare soluzione diluendo 01:10 utilizzando dH2O. Store a temperatura ambiente.
- Preparare immunobuffer (IB) (1% siero bovino fetale (FBS) in TBS). Etichettare la provetta da centrifuga da 15 mL con data e conservare a 4 ° C. IB può essere utilizzato per 1 settimana dalla data.
- Preparare blocker di 0,25% caseina da sciogliere 0,5 g di caseina e 0,195 g di sodio azide in 200 mL di tampone fosfato salino (PBS). Sciogliere bene gli ingredienti mescolando durante la notte. Aliquota in provette per centrifuga da 15 mL e conservare in un congelatore a-20 ° C. Caseina scongelati soluzioni possono essere conservati a 4 ° C per 1 mese.
- Preparare soluzione DAPI diluendo stock 1: 200 DAPI in TBS. Store a 4 ° C, al riparo dalla luce.
- Preparare soluzione stock timerosal (mg 10 mL-1) sciogliendo thimerosal in PBS sterile. Conservare a 4 ° C e diluire appropriata quantità di 0,4 mg mL-1 per l'uso.
- Difficoltà e permeabilize le cellule con metanolo ghiacciato (piastra ben 96) per le celle di lavaggio 5 min una volta con 200 µ l di TBS.
- Bloccare con 50 µ l di caseina 0,25% a temperatura ambiente per 10 min e lavare una volta con TBS.
- Aggiungere 50 µ l di anticorpo primario diluito in IB (Vedi tabella 1 per i dettagli dell'anticorpo) e incubare con coperchio chiuso per 1 h.
- Lavare una volta con 200 µ l di TBS e poi 3 volte con TBS per 5 min con dolce dondolio.
- Aggiungere 50 µ l di anticorpi secondari diluito in IB (Vedi tabella 2 per i dettagli dell'anticorpo) con 1: 2000 DAPI in ciascuno, incubare con coperchio chiuso per 1 h. coprire la piastra con un foglio per evitare foto-candeggio.
- Lavare una volta con TBS e poi due volte con TBS per 15 min con dolce dondolio.
- Rimuovere tutti i TBS e aggiungere 200 µ l di soluzione di thimerosal.
- Conservare la piastra a 4 ° C, al riparo dalla luce fino a formazione immagine.
5. imaging delle cellule usando un microscopio di High-Throughput
- Analizzare le cellule colorate con fluoroforo e gene anticorpi specifici anticorpi secondari coniugati (immunofluorescenza) utilizzando un microscopio di alta selezione contenuto controllato con software di accompagnamento.
- Caricare la piastra microtiter nel tavolino del microscopio. Il controllo di acquisizione di piastra, selezionare immagine a ingrandimento medio (obiettivo obiettivo 10x). Assicurarsi che immagini sono prese dal centro di ogni bene, con 50 µm spaziatura tra ogni sito per garantire che una cella non viene visualizzato in due campi adiacenti.
- Selezionare i pozzi per l'immagine.
- Selezionare combinazioni di canale appropriato, tempo di esposizione e i parametri z-offset. Riferimento alla tabella 3 per informazioni più dettagliate di ogni filtri (complementare tabella 2).
- Acquisire il dosaggio utilizzando la procedura guidata di acquisizione (immagini vengono memorizzati automaticamente al server di Database).
- Utilizzare combinazioni di canale alternativo per acquisire piastre macchiati con olio rosso O. (complementare tabella 3).
6. analizzare l'immagine acquisita
Nota: Accesso remoto al database server consente di rapida e facile valutazione delle immagini acquisite e utilizzare il software di analisi di immagine.
- Modulo cellulare segnando aperto sul software di analisi.
- Rilevare i nuclei delle cellule usando canale DAPI (marcatore nucleare) e nuclei di segmento di interesse con i parametri definiti dall'utente per dimensione e intensità sopra priorità bassa del segnale.
- Rilevare il segnale di FABP4 utilizzando il canale FITC. Segmento di cellule differenziate con parametri definiti dall'utente per intensità di segnale e dimensioni sopra sfondo per selezionare tutte le regioni di FABP4 positive in ogni immagine.
- Aprire il modulo Transfluor del software di analisi per analizzare piastre macchiati con olio rosso O.
- Specificare la dimensione e l'intensità di Oil Red O macchiato regioni come 'pozzi'.
Risultati
In questo studio, il potenziale di differenziazione adipogenico di ASCs con 3 diversi metodi sono stati misurati. Etichettatura immunofluorescente dei FABP4, ha mostrato che questo marcatore localizzato nel citoplasma di cellule differenziate e l'etichettatura sovrapposta con nuclei DAPI-etichettati (Figura 1A). Analisi dell'immagine automatizzata ha rivelato un aumento 24,6 volte % di FABP4 cellule positive nel gruppo differenziato in cellule di passaggio precoce rispetto ad aumento di 6,9 volte tardo cellule di passaggio (Figura 1B). Olio rosso O macchiatura è stata localizzata alle goccioline di grasso sparpagliate nel citosol delle cellule differenziate, e raramente l'etichettatura sovrapposti con DAPI-etichettati i nuclei; Tuttavia dal controllo visivo, ci sono meno nuclei cellulari associati con goccioline di grasso Oil Red O nelle cellule del passaggio tardivo rispetto alle cellule di passaggio precoce (Figura 2A). Analisi dell'immagine automatizzata ha rivelato un aumento di 11,1 piega nella zona di Oil Red O macchiatura per cellulare in cellule di passaggio precoce e un aumento di 53,9 piega nella macchiatura di zona per la cellula in cellule di passaggio tardo (Figura 2B). Imaging di entrambe le macchie è stato effettuato e poi quantificato utilizzando cellule segnando (FABP4) o Transfluor (Oil Red O) modulo del software (complementare figura 1, complementare tabella 2-5). Il upregulation dell'espressione FABP4 è stato confermato da analisi Western blot (Figura 3, complementare figura 5). Tutti i metodi di analisi 3 ha rivelato che presto passaggio ASCs hanno maggiore differenziazione adipogenico potenziale più tardi cellule di passaggio. La differenziazione di adipogenico non ha colpito il numero totale delle cellule per pozzetto (complementare nella figura 2, 3). Tuttavia, la dimensione di nuclei di cellule differenziate FABP4-positive era significativamente più piccola rispetto alle cellule di controllo per tardi passaggio ASCs solo (complementare figura 3).
Abbiamo dimostrato che, come le cellule sono state espanse in coltura, o attraversate, la percentuale di cellule all'interno della cultura capace di differenziazione adipogenico in diminuzione, coerenza con i dati precedentemente pubblicati11. È importante notare che fattori quali l'età, indice di massa corporea o precedente storia medica12 non potrebbero essere controllate per in questo studio e probabilmente ha contribuiti alla variabilità osservata fra campioni di donatori diversi (complementare tabella 1).

Figura 1 : FABP4 immunolabelling dimostra che presto le cellule di passaggio hanno una maggiore differenziazione potenziale rispetto a cellule di passaggio successive. A) immagini rappresentative di passaggio precoce e tardivo, controllo e cellule differenziate etichettate con DAPI (macchia nucleare) e FABP4 sono indicati a fianco di Unione e la segmentazione di immagini. La segmentazione di immagini visualizzare differenziato cellule con una sovrapposizione di verde e le cellule non differenziate con una sovrapposizione di colore rosso. B) un aumento significativo in FABP4 che esprimono le cellule è stato osservato con adipogenico differenziazione in cellule del passaggio precoce e tardiva, tuttavia, cellule di passaggio precoce ha dimostrato aumento significativamente maggior nel differenziamento di cellule di passaggio tardo (Mann Whitney prova * denota P < 0.05 e * * * denota P < 0,001). I dati riportati sono la media attraverso passaggio precoce (p4; n = 8) o tardi passaggio (p10; n = 4) campioni di donatori, ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Oil Red O macchiatura dimostra che presto le cellule di passaggio hanno una maggiore differenziazione potenziale rispetto a cellule di passaggio successive. A) le immagini rappresentative di DAPI (macchia nucleare) e Oil Red O (grigio, macchia di gocciolina del lipido) sono indicate a fianco di Unione e la segmentazione di immagini. Le immagini di segmentazione raffigurano tutti i nuclei con sovrapposizione verde e Oil Red O macchiato le goccioline del lipido con una sovrapposizione di colore rosso. B) un aumento significativo nell'area colorazione Oil Red O è stato osservato con adipogenico differenziazione. Cellule di passaggio precoce ha mostrate una maggiore area di macchia Oil Red O per cella rispetto al tardo cellule di passaggio. L'area di Oil Red O macchiatura per cella (μm2) viene utilizzato qui come una misura del potenziale adipogenico differenziativo. I dati riportati sono la media attraverso passaggio precoce (p4; n = 8) o tardi passaggio (p10; n = 4) campioni di donatori, ± SEM (test di Mann Whitney * denota P = < 0.05 e * * * denota P = < 0.001). Clicca qui per visualizzare una versione più grande di questa figura.
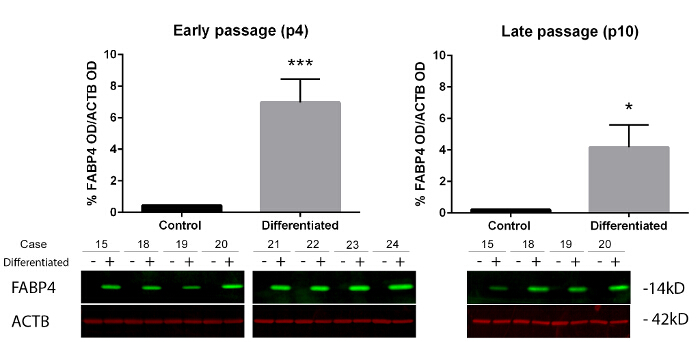
Figura 3 : Analisi di Western blot di FABP4 livello di espressione della proteina di passaggio differenziato presto e tardivo ASCs. Analisi semi-quantitativa della densità ottica di FABP4 band come un rapporto di controllo carico di proteine totali, beta actina (ACTB), ha mostrato che immunolabelling FABP4 è stata aumentata significativamente nel passaggio precoce e ad un minore grado fine passaggio differenziato cellule. I dati riportati sono la media attraverso passaggio precoce (p4; n = 8) o tardi passaggio (p10; n = 4) campioni di donatori, ± SEM (test di Mann Whitney * denota P = < 0.05 e * * * denota P = < 0.001). Clicca qui per visualizzare una versione più grande di questa figura.
| Antigene bersaglio | Isotype (clone) | Specie | Diluizione |
| FABP4 | Policlonali | Coniglio | 1: 100 |
Tabella 1: Anticorpo primario
| Anticorpo di targeting | Fluoroforo etichetta | Specie | Diluizione |
| IgG di coniglio | Fluoro Alexa 488 | Capra | 1: 200 |
Tabella 2: Anticorpo secondario
Complementare figura 1: Panoramica dell'ambiente virtuale analisi immagine. Le cellule marcate erano imaged utilizzando un microscopio fluorescente automatizzato, ad alta produttività per evitare qualsiasi fonte di pregiudizio. Immagini acquisite utilizzando ImageXpress Micro XLS, sono stati salvati direttamente nel database di gestione dati MDCStore e reso disponibile per la visualizzazione tramite connessioni a desktop virtuali, che gli utenti utilizzano per ottimizzare e testare i loro parametri di analisi specifica. Immagini sono stati analizzati con un'istanza di dedicato 'autorun' che consente a più utenti diversi inviare 'lavori' alla coda di autorun. Gli utenti possono recuperare i dati tramite l'istanza virtuale al termine di loro 'lavoro'. Per favore clicca qui per scaricare questa figura.
Complementare figura 2: confronto del totale delle cellule totali per pozzetto di controllo e differenziato pozzi per passaggio precoce e tardivo ASCs, utilizzando FABP4 macchiato piastra. I dati riportati sono la media attraverso passaggio precoce (p4; n = 8) o tardi passaggio (p10; n = 4) campioni di donatori, ± SEM Non c'era differenza statisticamente significativa tra controllo e cellule differenziate per passaggio sia precoce e tardiva ASC. C'erano altre cellule per pozzetto per cellule di passaggio precoce rispetto al tardo cellule di passaggio. Per favore clicca qui per scaricare questa figura.
Complementare figura 3: confronto del totale delle cellule totali per pozzetto di controllo e differenziato pozzi per passaggio precoce e tardivo ASCs, utilizzando Oil Red O macchiato piastra. I dati riportati sono la media attraverso passaggio precoce (p4; n = 8) o tardi passaggio (p10; n = 4) campioni di donatori, ± SEM Non c'era differenza statisticamente significativa tra controllo e cellule differenziate per passaggio sia precoce e tardiva ASC. Per favore clicca qui per scaricare questa figura.
Complementare figura 4: in passaggi successivi, cellule differenziate che erano FABP4 positivo erano significativamente più piccola zona di nuclei di cellule nei pozzetti di controllo. Non c'era differenza statisticamente significativa nell'area di nuclei tra controllo e cellule differenziate nel primo passaggio. I dati riportati sono la media attraverso passaggio precoce (p4; n = 8) o tardi passaggio (p10; n = 4) campioni di donatori, ± SEM. (test t spaiato. * * * denota P = < 0.001). Media ± SEM sono visualizzate). Per favore clicca qui per scaricare questa figura.
Complementare figura 5: immagini di Western blot gel. Canale rosso raffigura beta-actina. Canale verde raffigura FABP4 immunolabelling. Per favore clicca qui per scaricare questa figura.
Complementare tabella 1: informazioni clinicopatologiche dei donatori Per favore clicca qui per scaricare questa tabella.
Complementare tabella 2: Imaging impostazioni (FABP4) Per favore clicca qui per scaricare questa tabella.
Complementare tabella 3: Imaging impostazioni (Oil Red O) Per favore clicca qui per scaricare questa tabella.
Complementare tabella 4: tabella dei parametri di analisi utilizzato (FABP4). Modulo di Scoring di cella. Per favore clicca qui per scaricare questa tabella.
Complementare tabella 5: tabella dei parametri di analisi utilizzato (Oil Red O). Modulo Trans Fluor. Per favore clicca qui per scaricare questa tabella.
Discussione
Questa carta dimostra l'utilità e i vantaggi di FABP4 immunolabelling accuratamente rilevare e quantificare adipocytes maturi derivato dalle cellule stromali mesenchimali. FABP4 è in grado di rilevare cambiamenti nell'espressione di un lignaggio specifica proteina3,4,5 negli adipociti maturi, al contrario di altri comunemente utilizzati coloranti quale etichetta macromolecolare cambia13,14 come Oil Red O15, Nilo rosso16 e Sudan nero17. FABP4 immunolabelling consente di visualizzazione e l'analisi dei cambiamenti nella morfologia cellulare. Questo è un vantaggio distintivo rispetto ai metodi precedentemente descritti utilizzando quantitativa trascrizione d'inversione PCR (RT-qPCR) che analizza le modifiche a livello di trascrizione senza qualsiasi visualizzazione5,18,19 ,20, o citometria a flusso che richiede le cellule in sospensione20o Western blotting che richiede le cellule per essere lisati per isolare proteine19,20. Immunolabelling FABP4 è stabile in celle fisse, non fuoriuscire in soluzione ed essendo una proteina citosolica quando etichettati in un aderente monostrato di cellule, si sovrappongono con il nucleo consentendo facile visualizzazione e aggiunto precisione nell'analisi automatizzata.
Lo screening ad alto contenuto è vantaggioso perché è veloce, preciso, riproducibile ed oggettivo. Fornisce una piattaforma per uso redditizio di reagenti e tempo ricercatore, poiché analisi e acquisizione di immagini richiedono minima manipolazione manuale e si basano sull'elaborazione automatica dello strumento. Diversi fattori sono stati identificati come critico per la precisione e la riproducibilità dello screening ad alto contenuto saggi31. La quantificazione dell'espressione dell'antigene si basa sulla qualità dell'immagine. Per l'analisi di immagine di successo, immagini da ogni canale per pozzetto devono essere a fuoco e cadere all'interno di una gamma dinamica ottimale per i valori di grigio (impostazioni Auto esporre sono ideali). Fuori della messa a fuoco o immagini sature di portare a risultati errati.
Alcune potenziali limitazioni dei metodi descritti in questo articolo sono i seguenti. Il requisito per specializzata attrezzature e analisi software di imaging. Mentre all'esterno dell'ambito di questo articolo, le opzioni di software open source alternativi (ad esempio, ImageJ32,33, Fiji34, CellProfiler32,35) possono essere utilizzate per eseguire la segmentazione di immagini simili attività; Tuttavia essi richiedono la capacità di scaricare e personalizzare le macro disponibili online oppure scrivere macro/comandi per loro condotte analisi specifica. Inerente a tutto automatizzato imaging analisi condotte è un livello di rumore di fondo. Questo può essere attribuito in gran parte ai detriti, immagine scarsa qualità o analisi errore, sottolineando la necessità di preparazione del campione attento e accurato set-up della piattaforma di imaging e l'analisi. L'etichetta di FABP4 nei topi è stato trovato per rilevare progenitori indifferenziati30; mentre i controlli in questo studio (che consistono di cellule indifferenziate) sono privi di colorazione specifica FABP4. Questo sotto-punteggi la necessità di controllare FABP4 espressione indifferenziato dei progenitori in ogni contesto biologico dove è impiegato il dosaggio.
Al fine di fare un confronto valido tra l'etichettatura FABP4 e Oil Red O colorazione, le misurazioni di uscita dalle analisi di immagine dovuto essere biologicamente rilevanti. Di conseguenza, la misurazione, '% cellule positive' è stata usata per FABP4 e 'zona di macchiatura per cella' è stata usata per olio rosso O. È interessante nota che la misura '% cellule positive' non è stata utilizzata per Oil Red O etichettati cellule nel nostro studio perché non era possibile attribuire le goccioline grasse etichettate con precisione ad un determinato nucleo; le goccioline grasse ha variato considerevolmente in dimensioni, numero e distribuzione in tutto il corpo cellulare e raramente coincidevano con il nucleo. Oil Red O macchiatura variabilità esistente tra cellule derivate da fonti differenti del tessuto; mentre il % positivo cellule misura non era appropriato per lo studio corrente, un altro gruppo ha utilizzato con successo per quantificare adipociti derivate da cellule staminali di ghiandola umana22 dove la macchiatura Oil Red O appariva come una grande goccia di grasso che ha misurato la citoplasma e sovrapposte con nuclei e abilitanti i dati verranno presentati come % di cellule positive.
Al contrario, la morfologia del immunolabelling FABP4 è coerenza nei adipocytes derivato da una fascia di tessuto differenti fonti23,24,25. La capacità di quantificare la proporzione di cellule all'interno di una cultura capace di differenziazione ha un numero di applicazioni. Cellule stromali mesenchimali adulte tengono la promessa significativa per una vasta gamma di usi terapeutici. Un problema significativo che è sorto con traduzione clinica è la variabilità inerente nella capacità di queste cellule tra pazienti26, tra siti di isolamento27,28e tra i metodi per l'isolamento12 e l'espansione della cella numero12 per uso terapeutico. Ha dimostrato in precedenza che culture di cellule stromale aderenti sono spesso eterogenee, con alcune cellule capaci di differenziazione e alcuni non 12,17 come nostro FABP4 saggio dimostra per le culture ASC. Saggi come questo, combinato con tecniche di arricchimento, consentirà di identificare sub-popolazioni all'interno di culture eterogenee in grado di differenziazione di lineage-specifici. Avendo un test standardizzato, quantificabile ad esempio, questo saggio di FABP4 fornisce un semplice metodo per il confronto tra tutte queste variabili e il potenziale per valutare i risultati terapeutici all'interno e tra studi clinici.
La quantificazione di FABP4 in modo semi-automatico consente di obiettività e riproducibilità in analisi attraverso molti esempi e casi di donatore. Inoltre come l'etichetta è citoplasmatica, che potenzialmente può essere utilizzato per analizzare l'ipertrofia (ingrossamento della dimensione degli adipociti) oltre a iperplasia (aumento di numero degli adipociti), una distinzione che riveste una notevole importanza nella ricerca di obesità, dove l'ipertrofia è fortemente associato con disfunzione adiposa in individui obesi21. L'epidemia dell'obesità ha stimolato una notevole quantità di interesse nell'identificazione di farmaci in grado di controllare l'immagazzinaggio del lipido. Questo test di FABP4 fornisce anche una lettura semplice per lo screening di migliaia di composti per la loro capacità di inibire l'accumulo di lipidi.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Siamo grati ai donatori di tessuti adiposi e i professionisti di ricerca che raccolgono e forniscono questa risorsa a noi per uso di ricerca. Vorremmo riconoscere finanziamento da Allergan. Saremo grati anche per l'Università di Auckland, facoltà di medicina e salute Scienze Performance Based Research Fund per finanziare i costi di ripresa e di editing per la presentazione di questo articolo.
Materiali
| Name | Company | Catalog Number | Comments |
| Tris Base | Invitrogen | 15504-020 | Tris buffered saline |
| Sodium Chloride | Merck | 1064041000 | Tris buffered saline |
| Potassium Chloride | Merck | 1049360500 | Tris buffered saline |
| Sodium Azide | Scharlau | SO0091 | Casein blocker solution |
| Casein | Sigma | C7078-500G | Casein blocker solution |
| PBS tablet | Sigma | P4417-100TAB | Phosphate buffered saline |
| DMEM/F12 | Gibco | 11330-032 | Cell culture |
| Penicillin/streptomycin | Invitrogen | 15140-122 | Cell culture |
| Glutamax | Gibco | 35050-061 | Cell culture |
| Fetal bovine serum | Gibco | 10091-148 | Cell culture |
| TrypLE Select Enzyme (1X), no phenol red | Gibco | 12563-029 | Cell dissociation enzyme |
| 96 well plate (flat bottom) | Falcon | FAL353072 | Cell culture equipment |
| T75 culture flask, with filter cap | Greiner | 658175 | Cell culture equipment |
| Insulin | Sigma | 19278-5ML | Adipogenic differentiation media |
| dexamethasone | Sigma | D2915-100MG | Adipogenic differentiation media |
| indomethacin | sigma | I7378-5G | Adipogenic differentiation media |
| Oil-Red O | Sigma | O-0625 | Classic stain for adipogenesis |
| Isopropanol | Merck | 1.09634 | Classic stain for adipogenesis |
| 16% formaldehyde | Pierce | 28908 | Cell fixation |
| Acetone | Merck | 100983 | Cell fixation |
| DAPI | Sigma | D9542 | Immunocytochemistry |
| Anti rabbit IgG alexa 488 | Molecular Probes | A11008 | Immunocytochemistry |
| Thimerosal | Sigma | T5125-10G | Immunocytochemistry |
| Rabbit anti-human fatty acid binding protein 4 (FABP4) antibody | Cayman Chemicals | 10004944 | Marker of adipogenesis |
| Centrifuge tubes (15mL) | Greiner | GR188271 | General |
| Centrifuge tubes (50mL) | Greiner | GR227261-P | General |
| ImageXpress Micro XLS | Molecular Devices | high content screening machine | |
| MetaXpress | Molecular Devices | high content screening software, version 5.4.01 |
Riferimenti
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Proescher, F. Oil Red O Pyridin, A Rapid Fat Stain. Biotech Histochem. 2 (2), 60-61 (1927).
- Matarese, V., Bernlohr, D. a. Purification of murine adipocyte lipid-binding protein. Characterization as a fatty acid- and retinoic acid-binding protein. J Biol Chem. 263 (28), 14544-14551 (1988).
- Lafontan, M., Langin, D. Lipolysis and lipid mobilization in human adipose tissue. Prog Lipid Res. 48 (5), 275-297 (2009).
- Sekiya, I., Larson, B. L., Vuoristo, J. T., Cui, J. C., Prockop, D. J. Adipogenic Differentiation of Human Adult Stem Cells From Bone Marrow Stroma (MSCs). J Bone Min Res. 19 (2), 256-264 (2004).
- Baxa, C., et al. Human adipocyte lipid-binding protein: purification of the protein and cloning of its complementary DNA. Biochemistry. 28 (22), 8683-8690 (1989).
- Bourin, P., et al. Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal/stem cells: A joint statement of the International Federation for Adipose Therapeutics and Science (IFATS) and the International So. Cythotherapy. 15 (6), 641-648 (2013).
- Zuk, P., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, (2012).
- Feisst, V., Brooks, A. E. S., Chen, C. J. J., Dunbar, P. R. Characterization of mesenchymal progenitor cell populations directly derived from human dermis. Stem Cells Dev. 23 (6), 631-642 (2014).
- Mitterberger, M. C., Lechner, S., Mattesich, M., Zwerschke, W. Adipogenic differentiation is impaired in replicative senescent human subcutaneous adipose-derived stromal/progenitor cells. Journals Gerontol - Ser A Biol Sci Med Sci. 69 (1), 13-24 (2014).
- Baer, P. C., Geiger, H. Adipose-derived mesenchymal stromal/stem cells: Tissue localization, characterization, and heterogeneity. Stem Cells Int. , (2012).
- Xu, S., et al. Evaluation of foam cell formation in cultured macrophages: An improved method with Oil Red O staining and DiI-oxLDL uptake. Cytotechnology. 62 (5), 473-481 (2010).
- Hopkins, P. M., et al. Oil red O stain of alveolar macrophages is an effective screening test for gastroesophageal reflux disease in lung transplant recipients. J Hear Lung Transplant. 29 (8), 859-864 (2010).
- Dragunow, M., Cameron, R., Narayan, P., O'Carroll, S. Image-based high-throughput quantification of cellular fat accumulation. J Biomol Screen. 12 (7), (2007).
- Greenspan, P., Mayer, E. P., Fowler, S. D. Nile red: a selective fluorescent stain for intracellular lipid droplets. J Cell Biol. 100 (3), 965-973 (1985).
- Muraglia, A., Cancedda, R., Quarto, R. Clonal mesenchymal progenitors from human bone marrow differentiate in vitro according to a hierarchical model. J Cell Sci. 113 (Pt 7), 1161-1166 (2000).
- Neubauer, M., et al. Basic fibroblast growth factor enhances PPARgamma ligand-induced adipogenesis of mesenchymal stem cells. FEBS Lett. 577 (1-2), 277-283 (2004).
- Janderova, L., McNeil, M., Murrell, A. N., Mynatt, R. L., Smith, S. R. Human mesenchymal stem cells as an in vitro model for human adipogenesis. Obes Res. 11 (1), 65-74 (2003).
- Aldridge, A., Kouroupis, D., Churchman, S., English, A., Ingham, E., Jones, E. Assay validation for the assessment of adipogenesis of multipotential stromal cells--a direct comparison of four different methods. Cytotherapy. 15 (1), 89-101 (2013).
- Wang, Q. A., Tao, C., Gupta, R. K., Scherer, P. E. Tracking adipogenesis during white adipose tissue development, expansion and regeneration. Nat Med. 19 (10), 1338-1344 (2013).
- Gorjup, E., Peter, L., Wien, S., von Briesen, H., Schmitt, D. Automated microscopic quantification of adipogenic differentiation of human gland stem cells. Ann Anat. 191 (1), 13-22 (2009).
- Wojciechowicz, K., Gledhill, K., Ambler, C. A., Manning, C. B., Jahoda, C. A. B. Development of the mouse dermal adipose layer occurs independently of subcutaneous adipose tissue and is marked by restricted early expression of FABP4. PLoS One. 8 (3), e59811 (2013).
- Sandhu, M. A., Jurek, S., Trappe, S., Kolisek, M., Sponder, G., Aschenbach, J. R. Influence of Bovine Serum Lipids and Fetal Bovine Serum on the Expression of Cell Surface Markers in Cultured Bovine Preadipocytes. Cells Tissues Organs. 204 (1), 13-24 (2017).
- LaRosa, P. C., et al. Trans-10, cis-12 conjugated linoleic acid activates the integrated stress response pathway in adipocytes. Physiol Genomics. 31 (3), 544-553 (2007).
- Sen, A., et al. Adipogenic potential of human adipose derived stromal cells from multiple donors is heterogeneous. J Cell Biochem. 81 (2), 312-319 (2001).
- Zuk, P. A., et al. Human Adipose Tissue Is a Source of Multipotent Stem Cells. Mol Biol Cell. 13 (12), 4279-4295 (2002).
- Russo, V., Yu, C., Belliveau, P., Hamilton, A., Flynn, L. E. Comparison of Human Adipose-Derived Stem Cells Isolated from Subcutaneous, Omental, and Intrathoracic Adipose Tissue Depots for Regenerative Applications. Stem Cells Transl Med. 3 (2), 206-217 (2014).
- Tilg, H., Moschen, A. R. Adipocytokines: mediators linking adipose tissue, inflammation and immunity. Nat Rev Immunol. 6 (10), 772-783 (2006).
- Shan, T., Liu, W., Kuang, S. Fatty acid binding protein 4 expression marks a population of adipocyte progenitors in white and brown adipose tissues. FASEB J Off Publ Fed Am Soc Exp Biol. 27 (1), 277-287 (2013).
- Narayan, P. J., Dragunow, M. High content analysis of histone acetylation in human cells and tissues. J Neurosci Methods. 193 (1), (2010).
- Buchser, W., et al. Assay Development Guidelines for Image-Based High Content Screening, High Content Analysis and High Content Imaging. Assay Guid Man. , 1-80 (2004).
- Abràmofff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Part II. Biophotonics Int. 11 (7), 36-43 (2005).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon