Method Article
Preparazione, purificazione e l'uso dei liposomi contenenti acidi grassi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Liposomi contenenti anfifili catena singola, particolarmente gli acidi grassi, presentano proprietà distinti rispetto a quelli contenenti diacylphospholipids a causa delle proprietà chimiche uniche di singola catena anfifili. Qui descriviamo le tecniche per la preparazione, la purificazione e uso dei liposomi composto in parte o la totalità di questi anfifili.
Abstract
Liposomi contenenti anfifili catena singola, particolarmente gli acidi grassi, presentano proprietà distinti rispetto a quelli contenenti diacylphospholipids a causa delle proprietà chimiche uniche di questi anfifili. In particolare, dell'acido grasso liposomi che permettono di migliorare carattere dinamico, dovuto alla relativamente alta solubilità di anfifili catena singola. Allo stesso modo, liposomi che contengono gli acidi grassi liberi sono più sensibili ai cationi bivalenti e sale, a causa di forti interazioni tra i gruppi di testa di acido carbossilico e ioni metallici. Qui illustriamo le tecniche per la preparazione, purificazione e uso dei liposomi composto in parte o tutta la singola catena anfifili (ad es., acidi oleico).
Introduzione
Liposomi o vescicole – compartimenti delimitate da membrane doppio strato comprende da lipidi anfifili - hanno trovato impiego in numerose applicazioni biomedicali come veicoli di consegna per i prodotti farmaceutici, modelli delle membrane cellulari e per lo sviluppo di sintetico cellule. Noi ed altri abbiamo impiegato anche liposomi come modelli delle membrane cellulari primitive nella vita in anticipo. 1 , 2 , 3 , 4 in genere, in tali sistemi, ci avvaliamo di singola catena anfifili contenente la coda di idrocarburi del sola lipido (ad es., acido oleico), come queste molecole sono più semplici di sintetizzare senza il beneficio degli enzimi della proteina codificata impiegano cellule moderne.
Liposomi composto da catena singola lipidi sono simili a quelle formate da diacylphospholipids (ad es., 1-Palmitoil-2-oleoil -sn- glicero-3-fosfocolina o POPC) in quanto il confine è costituito da membrane bilayer. Liposomi formati dalle due classi di lipidi può mantenere un payload disciolto e possono essere ridimensionati e purificati mediante diverse tecniche. Diverse importanti differenze dovute le uniche caratteristiche chimiche dei lipidi a catena singola. Le vescicole formate da fosfolipidi sono stabile sopra una vasta gamma di pH, mentre le vescicole dell'acido grasso sono solo stabile a pH neutro a base leggermente (ca. 7-9), che richiede determinati tampone a pH per la preparazione delle vescicole. La maggior parte del tempo, questo buffer può contenere anche specifiche molecole solubili per l'incapsulamento della vescicola, che può essere sia materiali funzionali (ad es., RNA) per compartimenti reazioni biochimiche o semplici coloranti fluorescenti (ad es., calceina ) per la caratterizzazione della vescicola.
La presenza di solo una catena di idrocarburi singolo produce una membrana che è sia più permeabile ai soluti, nonché più dinamico. Inoltre, il capo gruppo carbossilico presente nei risultati di acidi grassi in vescicole che sono più sensibili alla presenza di cationi bivalenti e sale (ad es., Mg2 +). Il magnesio è uno dei più importanti cationi bivalenti per catalizzare le reazioni biochimiche nel protocellule per studi di origine della vita. Nei primi anni di vita, prima l'evoluzione degli enzimi proteina sofisticato, RNA potrebbe essere stato il polimero dominante, grazie alla sua doppia capacità di auto-replicarsi ed eseguire la catalisi. Un esempio rappresentativo di un RNA che richiedono magnesio correlati è reazione non enzimatica RNA copia, in primo luogo dimostrato in 1960. 5 quando chimicamente attivato RNA nucleotidi (cioè 2-methylimidazolide nucleotidi) si associa a un preesistente complesso di primer-modello, il gruppo 3'-idrossile del primer attacca il 5'-fosfato di un monomero attivato adiacente a spostare il gruppo (cioè 2-metilimidazolo) lasciando e forme un fosfodiesterico nuovo legame. Questa chimica copia di RNA richiede un'alta concentrazione di Mg2 +, che ha bisogno di essere chelato per essere compatibile con acido grasso protocellule. 6 un altro Mg2 +-reazione dipendente è catalizzata dal ribozima hammerhead, che è forse il migliore-caratterizzato RNA catalitico. Questo ribozima, che può essere ricostituito da due corti oligonucleotidi, esegue una reazione auto-fenditura che è conveniente per monitorare tramite uno spostamento di gel. Come tale, è spesso impiegato come un ribozima modello negli studi di origine della vita. 7 a causa di un requisito di questo ribozima per magnesio unliganded, liposomi sono in genere costruiti da una miscela di acidi grassi ed esteri di glicerolo di acidi grassi, che sono più stabili al magnesio. 8 , 9 in questo protocollo, presentiamo tecniche abbiamo sviluppato per la preparazione, la manipolazione, la caratterizzazione di queste vescicole e dimostrare l'applicazione di queste vescicole come protocellule a host non enzimatici RNA copia e hammerhead ribozyme catalisi.
Protocollo
1. preparazione vescicola
-
Preparazione di film sottili
- Utilizzare siringhe tight gas per trasferire determinate quantità di lipidi, come descritto nella tabella 1.1 al cloroformio in un flaconcino di vetro.
- Far evaporare la soluzione risultante in un flusso di azoto o argon nella cappa fumi.
- Sottoporre la pellicola sottile risultante a vuoto di casa per almeno 2 h rimuovere eventuali residui di cloroformio. I lipidi possono essere lasciati sotto vuoto durante la notte a questo punto.
-
Reidratazione delle vescicole
- Preparare 10 mL di tampone di 5mm calceina 250 mM tris-HCl pH 8.0 idratazione 31 mg di polvere di calceina in 2,5 mL di 1 M di tampone tris-HCl pH 8.0 di dissoluzione e aggiungendo un altro 7,5 mL di acqua deionizzata (DI).
- Pipettare 250 µ l di sopra buffer di idratazione in una provetta vuota e aggiungere 1,875 µ l di NaOH 10 M per un finale 75 mM base (½ equivalente degli acidi grassi totali). Trasferire la soluzione per il film sottile di lipido asciutto alle vescicole di forma con una concentrazione di lipidi totali di 0,15 M.
- Uso ad alta velocità (> 3000 giri/min) vortex vortice la miscela risultante per 4-5 s.
- Lasciare la miscela di lipidi-buffer su un agitatore rotante a bassa velocità (ca. 30 giri/min) per reidratare, almeno durante la notte.
-
Dimensionamento delle vescicole (opzionale)
- Con pinzette, applicare un filtro supporto ogni superficie interna delle porte siringa dell'estrusore.
- Bagnare ogni supporto filtro con 250 mM tris-HCl, pH 8.
- Con una pinzetta, applicare una traccia-acidato 100 nm in policarbonato delle membrane a uno dell'estrusore O-ring e filtro supporta. Avendo cura di non strappare o forare la membrana, spingere delicatamente la membrana verso l'o-ring in modo da rendere il buon contatto tra le due superfici.
- Montare l'estrusore, facendo attenzione a non per spostare la membrana e filtro supporta.
- Riempire una siringa estrusore con ca. 0,5 mL di 250 mM tris-HCl, pH 8. Inserire la siringa in un lato dell'estrusore.
- Inserire una siringa vuota nel lato opposto dell'estrusore.
- A mano, spingere lo stantuffo della siringa contenente tampone lentamente (≤ 50 µ l/s) e verificare che si avverte resistenza, che indica che la membrana pista-inciso è a posto e intatto. È utile praticare questo passo senza una membrana in atto al fine di valutare il grado di resistenza.
- Rimuovere e svuotare le due siringhe. Non è necessario pulire le due siringhe in questa fase poiché contengono buffer di composizione identica per la preparazione dei liposomi.
- Caricare la preparazione dei liposomi in una delle due siringhe.
- Rimontare l'estrusore con siringa contenente il campione di vescicola sul lato sinistro e siringa vuota sul lato destro.
- A mano, spingere lo stantuffo della siringa contenente vescicola campione molto lentamente (10-25 µ l/s).
- Osservare attentamente la siringa sul lato destro dell'estrusore; Cancella buffer inizialmente entrerà il lato destro dell'estrusore (ca. 50 µ l, questo è dovuto al volume morto interno dell'estrusore), seguita da un piccolo pennacchio di liposomi estrusi. Immediatamente smettere di premere a questo punto, rimuovere la siringa sul lato destro dell'estrusore e scartare questa soluzione.
- Sostituire la siringa sul lato destro dell'estrusore ed estrudere fino a svuotare la siringa di sinistra.
- Invertire l'orientamento dell'estrusore e ripetere il passaggio 13. Proseguire per il numero desiderato di cicli (in genere 7, 9 o 11); un numero dispari viene sempre utilizzato per garantire ONU-estrusi liposomi non sono raccolti presso la siringa contenente inizialmente la preparazione dei liposomi pre-downsizing.
- Delicatamente versare il contenuto della siringa giusta in una provetta Eppendorf e posizionare il tubo su un agitatore rotante a bassa velocità (ca. 30 giri/min) per circa 0,5 h.
- Procedere con purificazione della vescicola, come descritto nella sezione 2. Vescicole estruse devono essere utilizzate entro 24 ore o ri-estrusi prima del successivo utilizzo.
2. purificazione vescicola
-
Preparazione della fase mobile di purificazione della vescicola
- Preparare 5 mL di tampone a 250 mM tris-HCl pH 8 idratazione aggiungendo 1,25 mL di tampone a 1 M tris-HCl pH 8, 3,75 mL di acqua deionizzata per un tubo Falcon da 15 mL. Quindi 37,5 µ l di NaOH 10 M (½ equivalente di base relativo acido grasso non esterificato) nel buffer di idratazione. Pipettare 235 µ l di acido oleico puro direttamente nella provetta Falcon derivando una soluzione di vescicola con lipidi totali 0,15 M.
- Uso ad alta velocità (> 3000 giri/min) vortex vortice la miscela per 4-5 s, quindi asciugare in asciugatrice a bassa velocità di rotazione dell'agitatore per almeno 2 h. La preparazione del lipido può essere lasciata durante la notte sull'agitatore rotante a questo punto. Filtrare la fase mobile attraverso 0.22 μm unità di filtro siringa prima dell'uso per rimuovere qualsiasi aggregazione potenziale.
-
Purificazione delle vescicole su Sepharose
- Rimuovere ca. 5 mL di etanolica Sepharose 4B liquami dal flacone usando una pipetta. Applicare questo a una colonna di cromatografia monouso da 10 mL.
- Consentire il liquame a stabilirsi ed etanolo scorrere-attraverso fino a etanolo si avvicini superiore del letto della resina.
- Applicare 5 mL di acqua deionizzata in cima della resina e lascia scorrere-attraverso per lavare via i residui di etanolo.
- Applicare 250 mM tris-HCl, pH 8 in porzioni di 1-2 mL alla parte superiore della resina, l'applicazione di una nuova porzione ogni volta che il livello del liquido si avvicina la parte superiore del letto di resina. Ripetere per 3 - 5 volte.
- Fissare la colonna allo stand della storta, quindi collegare la punta della colonna con rubinetto connettore e tubi al collettore frazione. Aggiungere un'altra porzione di buffer per svuotare i tubi, chiudere il rubinetto quando il livello del liquido nella colonna si avvicina la parte superiore della resina.
- Applicare le vescicole estruse dalla sezione 1 alla parte superiore della resina utilizzando una pipetta 200 µ l, facendo attenzione a stendere uniformemente come possibile la preparazione delle vescicole alla resina senza toccare la parete letto o colonna di resina.
- Aprire il rubinetto per iniziare il flusso e iniziare a raccogliere le frazioni in una piastra a 96 pozzetti. Applicare la vescicola purificazione fase mobile nella parte superiore del letto di resina in 0,5-1 mL porzioni come buffer esaurisce, avendo cura di non per consentire il letto di resina ad asciugare. Raccogliere in caduta di cinque frazioni, raccogliendo almeno 36 pozzi (tre righe di una piastra a 96 pozzetti).
-
Caratterizzazione di fluorescenza delle frazioni di purificazione
- Prendere la piastra a 96 pozzetti dalla sezione precedente e leggerlo su un lettore di piastra (λex= 485 nm, λem= 515 nm).
- Tracciare i dati di fluorescenza risultante come fluorescenza vs numero di frazione. Vescicole eluire in primo luogo, seguito dalla frazione non incapsulata (Figura 1).
-
Quantità delle vescicole per monitorare la perdita della vescicola
- Ripetere i passaggi di purificazione e caratterizzazione di sezioni 2.2 e 2.3. Vescicole che hanno conservato il loro contenuto non saranno presente alcun picco di unencapsulated soluto (o uno molto piccolo di circa 5-10% dell'intensità del picco della vescicola).
3. uso delle vescicole in presenza di magnesio
-
Uso di magnesio unliganded
- Preparare e purificare le vescicole come descritto nelle sezioni 1, 2.1 e 2.2.
- Preparare 1 mL di 50 mM MgCl2 soluzione nel buffer di 250 mM tris-HCl pH 8.0 aggiungendo 250 µ l di tampone di 1 M tris-HCl pH 8.0 e 50 µ l di 1 M MgCl2 a 700 µ l di acqua. Vortice per mescolare bene.
- Per dare la concentrazione di magnesio desiderata di 5mm, mescolare 0,9 mL di vescicole purificate e 100 µ l di soluzione di magnesio e mescolare velocemente per minimizzare le interruzioni della vescicola di esposizione transitoria delle vescicole ad alta concentrazione locale di magnesio.
Nota: Miscelazione rapida della soluzione di magnesio è critico per la stabilità della vescicola. Se il magnesio e le vescicole non sono mescolate in modo immediato nel Vortex, alcune vescicole saranno esposti a concentrazioni più elevate di magnesio, con conseguente risultati incoerenti da campione a campione. - Lasciare il campione delle vescicole su un tumbler per almeno 30 min prima di quantità come descritto al punto 2.4 per controllare eventuali perdite di contenuto. Aggiungere la stessa concentrazione di magnesio come esempio di vescicola alla fase mobile quantità.
-
Uso di magnesio liganded
- Preparare e purificare le vescicole come descritto nelle sezioni 1, 2.1 e 2.2.
Nota: Utilizzare ½ KOH equivalente invece di NaOH per deprotonate acidi grassi; è stato trovato che questo produce più stabili liposomi in chelati MgCl2 sistemi. - Preparare la soluzione di citrato di potassio 2M e regolare il pH a 8.0 con KOH.
- Premix MgCl2 e potassio citrato al rapporto specificato (ca. 1:4 per stabile acido oleico vescicole) nel tampone di 250 mM tris-HCl pH 8.0.
- Aggiungere soluzione di citrato di magnesio premiscelata al campione della vescicola, brevemente vortice.
Nota: Premix sempre soluzione di magnesio e ligando. Non esporre mai le vescicole alla soluzione di magnesio unchelated solo. - Lasciare il campione delle vescicole su un tumbler per almeno 30 min prima di quantità come descritto al punto 2.4. Aggiungere la stessa concentrazione di magnesio e citrato come nell'esempio della vescicola per la fase mobile di quantità.
- Preparare e purificare le vescicole come descritto nelle sezioni 1, 2.1 e 2.2.
4. non-enzimatica RNA copia in vescicole
-
Preparazione dei monodispersi RNA incapsulato vescicole
- Preparare una pellicola di acido oleico secco come descritto nella sezione 1.1.
- Preparare il tampone di reidratazione della vescicola con primer di RNA con etichetta fluorescente 50 µM, modello di RNA 150 µM e 250 mM tris-HCl a pH 8,0 contenente ½ KOH equivalente relativo acido oleico.
- Aggiungere 250 µ l di tampone di reidratazione per il film lipidico e seguire il passo 1.2.2 e 1.2.3 per rendere vescicole con concentrazione di lipidi totale 0,15 M.
- Al fine di rendere unilamellari piccole vescicole monodispersi, seguire la sezione 1.3 per l'estrusione della vescicola.
-
Purificazione di aggiunta e della vescicola di citrato di magnesio
- Premix scorte di magnesio e citrato e poi mescolare con il campione di vescicola a una concentrazione finale del lipido di 0,1 M.
- Purificare le vescicole su Sepharose 4B colonna dimensione esclusione, con 250 millimetri tris-HCl pH 8.0, lipidi 0,1 M e dato magnesio e citrato come fase mobile.
- Raccogliere le frazioni della vescicola di seguente sezione 2.3.
-
Reazione di estensione di primer
- Preparare soluzione stock di 200 mM 2-MeImpG (5'-monofosfato di guanosina 2-methylimidazolide) con 250 millimetri tris-HCl pH 8.0. (Nota: seguire precedente pubblicato il protocollo10 per la sintesi di 2-MeImpG.)
- Per avviare la reazione di estensione di primer, trasferimento 150 µ l di soluzione di riserva 2-MeImpG in 450 µ l di campione di vescicola per raggiungere una concentrazione finale di 50 mM e 75 mM lipido attivato monomero. Avvia il timer e mantenere la reazione del campione cadendo tutto il tempo.
- (Opzionale) Per l'alimentazione continua monomero fresco, trasferire 300 µ l di soluzione di reazione a uno alloggiamento di un laboratorio costruito piccolo-volume liposoma dializzatore11 e mettere 300 µ l soluzione in altra camera di alimentazione. La soluzione di alimentazione deve contenere tutti gli ingredienti alla stessa concentrazione come la soluzione di reazione, fatta eccezione per la sostituzione di RNA contenenti vescicole con vescicole vuote. Ogni turno di dialisi prende 1-24 h, a seconda dell'analita e la membrana utilizzata.
- Per studi cinetici, prendere un 100 µ l aliquota in ogni momento e repurify l'aliquota attraverso una colonna di esclusione Sepharose 4B dimensioni con 250 millimetri tris-HCl pH 8.0 come fase mobile.
- Raccogliere le frazioni di vescicola in una provetta eppendorf da 1,5 mL.
- Pipettare Triton per le frazioni di vescicola ad un finale di circa 0,1% v/v.
- Aggiungere 0,5 mL di etanolo freddo al tubo e incubare a-20 ° C per almeno 2 h.
- Centrifugare tutti i campioni a 16,1 × 1000 rcf (16,1 × g) per 10 min e delicatamente pipetta fuori i liquidi. Lavare il RNA pellet con etanolo al 70% freddo e centrifugare nuovamente per 5 min, eliminare il liquido e mettere il tubo con pellet di RNA su un blocco di calore 80 ° C per 2 min per far evaporare etanolo residuo. Sciogliere il pellet in 50 µ l di 8 M Urea con tampone di caricamento 1xTBE.
-
Analisi della pagina
- Preparare 20% gel PAGE mescolando 200 mL di UreaGel sistema concentrato, 25 mL di diluente, del sistema di UreaGel 25 mL di buffer di 10xTBE, 80 µ l di TEMED e 250 mg di persolfato di ammonio. Versare il composto di gel tra lastre di gel di bloccaggio (35 centimetri x 45 centimetri) e inserire il pettine rapidamente. Aspettare almeno 30 minuti fino a completa polimerizzazione.
- Montare la piastra di gel sul supporto in gel e riempire le caselle di gel con il gel 1xTBE tampone di corsa. Togliere il pettine e lavare i pozzetti con la siringa. Pre-corsa il gel con 60 W per 30 min.
- Riscaldare i campioni sul blocco di calore di 80 ° C per 2 min e 5 µ l di ogni campione per pozzetto di carico.
- Attivare la casella di potere di gel e impostata gel in esecuzione con Watt costante a 60 W per 2,5 h.
- Smontare la lastra di gel presso lo stand di gel, pulire il vetro e mettere tutta la piastra in gel scanner per avviare la scansione di gel.
- Quantificare il gel con analisi 1D ImageQuant TL. Tracciare il logaritmo naturale del rapporto tra la quantità di primer restanti in un punto dato tempo all'importo iniziale di primer vs tempo, adatta a una linea e calcolare il tasso di reazione pseudo-primo ordine (Figura 2).
5. hammerhead RNA Self clivaggio in vescicole
- Preparazione e purificazione di ribozima incapsulato in vescicole
- Preparare una pellicola sottile del lipido (OA: OGM = 9:1) nella sezione 1.1 con componenti come in tabella 1.2. Nota: caldo OGM ad almeno 60 ° C per la fusione completa prima dell'uso.
- Preparare il tampone di reidratazione della vescicola con 5 µM di ogni filo ribozima hammerhead e 250 millimetri tris-HCl pH 8.0.
- Aggiungere 250 µ l di tampone di reidratazione per il film lipidico e seguire i passaggi 1.2.2 e 1.2.3 per rendere vescicole con 0,15 M totale del lipido concentrazione.
- Al fine di rendere unilamellari piccole vescicole monodispersi, seguire la sezione 1.3 per l'estrusione della vescicola.
- Purificare le vescicole su una colonna esclusione Sepharose 4B dimensioni, con 250 millimetri tris-HCl pH 8.0, 0,15 M miscelati lipidi come fase mobile.
-
Reazione di auto-fenditura del ribozima Hammerhead
- Preparare la soluzione di magnesio e mescolare con le vescicole purificate come descritto nella sezione 3.1 per avviare la reazione di auto-fenditura.
- Per studi cinetici, prendere 100 µ l della miscela in ogni momento e direttamente repurify questa aliquota attraverso una colonna di esclusione Sepharose 4B dimensioni con 250 millimetri tris-HCl pH 8.0 come fase mobile. Raccogliere la frazione di vescicola.
-
Analisi della pagina
- Procedura 4.3.6 a 4.3.8 per preparare il caricamento del campione di RNA.
- Porre in commercio castato gel di TBE-Urea 15% nella scatola di gel e riempire la vaschetta del gel con il gel 1xTBE tampone di corsa.
- Riscaldare i campioni sul blocco di calore di 80 ° C per 1 min e 5 µ l di ogni campione per pozzetto di carico.
- Esegua il gel con costante 200 V per circa 1 h.
- Scansione il gel.
- Quantificare il gel con un software di analisi, come TL ImageQuant 1D, per misurare l'entità della fenditura confrontando l'intensità delle restanti band di RNA substrato e RNA fenduto frammento banda (Figura 3).
6. gigante dell'acido grasso vescicole per microscopia
-
Preparazione delle vescicole giganti dell'acido grasso
- Seguire la sezione 1.1 e 1.3 tabella per preparare un film sottile di acido oleico 0,2 mol % di lipidi fluorescente contrassegnati per una migliore osservazione della membrana.
- Reidratare il film lipidico con 500 µ l 250 mM tris-HCl pH 8.0 per rendere i lipidi di vescicola campione 10 mM in totale. Il buffer può contenere coloranti fluorescenti o molecole di RNA, se lo si desidera. Lasciare la vescicola campione cadendo durante la notte.
- Preparare i lipidi totali 150 mL di tampone di dialisi di acido grasso puro con 10 mM con 470 µ l di acido oleico e 150 mL 250 mM tris-HCl a pH 8,0 contenente ½ NaOH equivalente.
- Estrudere il campione di vescicola attraverso una membrana di policarbonato 10 µm per rimuovere grandi aggregati.
- Trasferire il campione di vescicola nel cassetto di grande poro dialisi 1 µm, come descritto in precedenza. 12
- Inserire la cassetta di dialisi in un becher da 100 mL contenente 30 mL di tampone di dialisi. Agitare il recipiente delicatamente su un agitatore di tavolo a 80-100 rpm.
- Modificare il buffer di dialisi ogni 30 min per 5 volte rimuovere tinture libere o RNA e piccole vescicole.
- Rimuovere delicatamente il campione della vescicola dal cassetto dialisi con una siringa e un trasferimento in una provetta Eppendorf.
-
Osservazione di microscopia
- Pipettare 10 µ l di vescicole su un vetrino pulito standard e mettere un vetro vetrini coprioggetto sopra il campione. Guarnizione vetro di copertura con smalto trasparente.
- Osservare le vescicole con un 60 X olio-dispersione o simile obiettivo mediante microscopia confocale utilizzando la sorgente laser appropriato per la membrana fluorescente etichettati, RNA o tintura incapsulata (Figura 4).
Risultati
In genere eseguiamo purificazioni liposoma su colonne di esclusione dimensionale. Liposoma tipici preparati contengono un fluoroforo di qualche tipo. Quando i liposomi sono generati ed estruso, la specie ad essere incapsulati sono presente sia all'interno che all'esterno i liposomi. Purificando liposomi su una resina di esclusione dimensionale (Sepharose 4B), unencapsulated soluti vengono conservati all'interno dei pori della resina, mentre i più grandi liposomi non sono ed eluire prima (Figura 1A). Raccolta di frazioni e tramando fluorescenza vs numero di frazione (Figura 1B) in genere produce una traccia di due-picco, con le frazioni di primi medicati corrispondente ai liposomi, che vengono poi raccolti e utilizzati in applicazioni successive.
Esaminiamo frequentemente reazioni di estensione di primer non enzimatica, che erano un mezzo probabile replica del RNA prima dell'emersione del ribozima e basati su proteine RNA polimerasi. Queste reazioni di solito impiegano un primer fluorescente identificato (Figura 2A), che si è esteso da monomeri attivati. Queste reazioni possono essere monitorate mediante elettroforesi su gel (Figura 2B) e gli elettroferogrammi risultanti integrata per ottenere costanti di velocità per una condizione di reazione dato (Figura 2).
Per dimostrare che il RNA potrebbe funzionare all'interno di protocellule, impieghiamo il ribozima hammerhead auto-fenditura (Figura 3A) come una reazione catalitica del RNA di modello. Questa reazione richiede gratuito Mg2 + per facilitare la catalisi, e quindi abbiamo usato le vescicole OA/OGM poiché sono stabili in presenza di 5 mM Mg2 +. Simili alle reazioni di estensione del primer, la reazione di auto-fenditura ribozima hammerhead può anche essere monitorato mediante elettroforesi su gel (Figura 3B) e successivamente analizzati per acquisire la costante di velocità in condizioni specifiche (Figura 3).
Abbiamo immagine liposomi che impiegano entrambi fluorescenza e luce trasmessa. I liposomi possono essere etichettati utilizzando lipidi fluorescenti, che danno un'etichetta di membrana (Figura 4A), o utilizzando un soluto fluorescente all'interno loro lumen (Figura 4B). Luce trasmessa è utilizzabile anche per osservare vescicole (anche mostrate in Figura 4B).
| Tabella 1.1 acido oleico puro in cloroformio | |||
| Componente | Stock | Importo | |
| Acido oleico | > 99% | Μ l 11,7 | |
| Cloroformio | 1 mL | ||
| Tabella 1.2 acido oleico e glicerolo monooleato (9:1) in cloroformio | |||
| Componente | Stock | Importo | |
| Acido oleico | > 99% | Μ l 10,5 | |
| Glicerolo monooleato | > 99% | 1,4 Μ l | |
| Cloroformio | 1 mL | ||
| Tabella 1.3 acido oleico con 0.2mol% rodamina-PE in cloroformio | |||
| Componente | Stock | Importo | |
| Acido oleico | > 99% | 1,6 Μ l | |
| Rodamina-PE in cloroformio | 10 mM | 20 Μ l | |
| Cloroformio | 1 mL | ||
Tabella 1. Soluzioni di cloroformio di acido grasso.
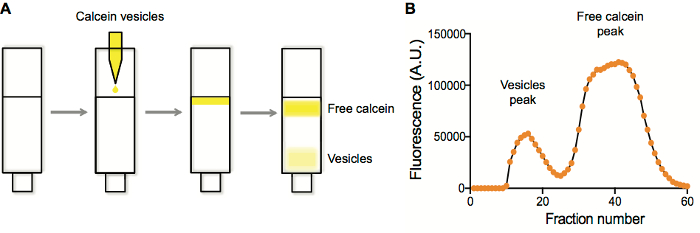
Figura 1. Caratterizzazione della vescicola di purificazione e fluorescenza della frazione di purificazione. R. separazione delle vescicole contenenti calceina da calceina gratis su una colonna di Sepharose 4B. B. della vescicola e rilevamento di picco gratis calceina tracciando la fluorescenza in ciascun pozzetto vs numero ben dopo la raccolta della frazione. Clicca qui per visualizzare una versione più grande di questa figura.
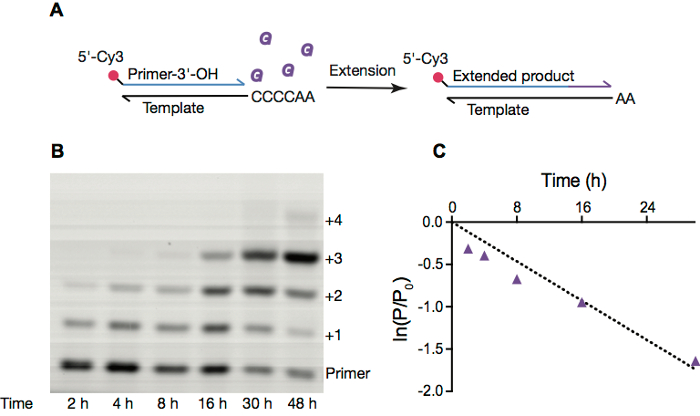
Figura 2. Replica non enzimatica di RNA all'interno di vescicole OA. R. schema di estensione dell'iniettore del RNA non-enzimatici. B. immagine della pagina di una reazione di estensione di primer all'interno di vescicole di acido oleico puro, con condizioni come nella sezione 4. C. lineare adatta del logaritmo naturale del rapporto tra quantità di primer rimanente al dato punto di tempo all'importo iniziale di primer vs tempo oltre 30 h. velocità di reazione, calcolato dal versante del ln (P/P0) contro il tempo, è 0,058 h-1. Clicca qui per visualizzare una versione più grande di questa figura.
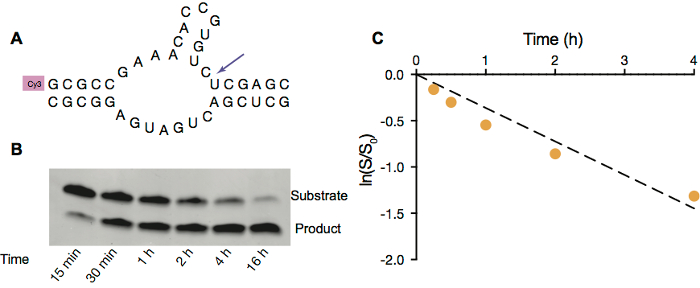
Figura 3. Clivaggio di ribozima Hammerhead in vescicole di OA/OGM. R. schema di fenditura ribozima hammerhead di filo fluorescente contrassegnati substrato (in alto). B. immagine della pagina di fenditura ribozima hammerhead all'interno di vescicole OA/OGM con 5 mM Mg2 +. C. Ribozyme attività all'interno di vescicole. Misura lineare del logaritmo naturale del rapporto tra quantità di substrato rimanente al dato punto nel tempo all'importo iniziale del substrato rispetto al tempo in h. 4 prima reazione tasso, calcolato dal versante del tempo: ln (s/s0) vs, è 0,36 h-1. Clicca qui per visualizzare una versione più grande di questa figura.
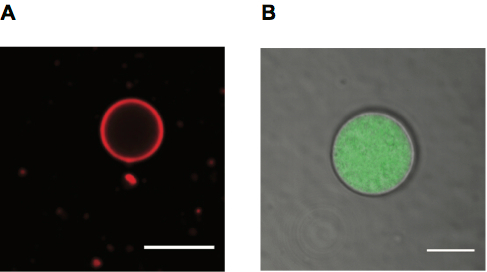
Figura 4. Vescicole giganti dell'acido grasso per microscopia. R. immagine di microscopia Confocal di un PE di rodamina etichettati acido oleico vescicola, scala bar 10 μm. B. immagine di microscopia confocale della vescichetta di acido oleico contenente Alexa488 etichettati RNA con membrana mostrata nel canale di rivelatore trasmessi (TD), scala bar 5 μm.
Discussione
Liposomi formati da acidi grassi sono stati suggeriti da molti come potenziali modelli per cellule primitive grazie alla loro elevata permeabilità e proprietà dinamiche. Il gruppo carbossilico testa di acidi grassi a catena singola consente solo l'auto-assemblaggio nelle membrane in una gamma ristretta di pH e le membrane risultante sono molto sensibili alla presenza di sali. Di conseguenza, dell'acido grasso vescicole richiedono preparazione diversa e gestione metodi confrontato con vescicole di fosfolipidi.
In questo protocollo, anche se usiamo l'acido oleico come esempio per la formazione di liposomi, altri lunga catena acidi grassi insaturi (C14) e loro derivati (ca. acido miristoleico, acido palmitoleico e degli alcoli corrispondenti e gli esteri del glicerolo) anche formare vescicole seguendo il metodo di reidratazione di film sottile, purché la concentrazione totale di lipidi è sopra il cmc e il pH del tampone di idratazione è vicino la pKa dell'acido grasso all'interno della membrana. Diverso da quello di tampone tris-HCl utilizzata nel presente protocollo, altri sistemi di polmonatura (ca. bicina, fosfato, borato) sono stati segnalati per sostenere la formazione della vescicola dell'acido grasso, anche se le vescicole formate in tampone fosfato o borato sono solitamente piuttosto che perde13. Le vescicole di acido grasso risultante dopo la reidratazione sono polidispersi e multilamellari, ma sono facilmente trasformato in vescicole unilamellari piccole monodisperse da estrusione come descritto. Rispetto a sonicazione come metodo alternativo per la generazione di piccole vescicole, estrusione fornisce più opzioni per il controllo della dimensione della vescicola applicando le membrane poro differenti dimensioni. Vescicole dopo estrusione sono di solito leggermente più grande rispetto alla dimensione dei pori della membrana, ma aumentando il numero di cicli di estrusione, vescicole con una più stretta distribuzione di dimensioni e una dimensione media vicino alla dimensione del poro della membrana possono essere ottenute.
Al fine di sintetizzare funzionale protocellule, vescicole di acido grasso necessario specifiche reazioni biochimiche host, derivante dall'incapsulamento di RNA o altri blocchi di edificio. Il metodo di reidratazione film sottile fornisce un modo semplice per vescicole di forma contenente materiali incapsulati desiderate. Tuttavia, l'efficienza di incapsulamento è relativamente bassa e una grande frazione di materiali preziosi come RNA sono in genere persi durante il processo di purificazione. In alcuni casi l'efficienza di incapsulamento può essere migliorato modestamente da cicli ripetuti di congelamento-scongelamento prima dell'estrusione. Metodi microfluidici per la preparazione ad alto rendimento di liposomi fosfolipide permettono quasi 100% incapsulamento efficienza, tuttavia metodi analoghi non sono ancora state sviluppate per le vescicole dell'acido grasso.
Quando Gestione protocellule con Mg o chelata o gratuito2 +, purificazione dopo aggiunta di soluzione di magnesio e quantità prima di ogni punto del tempo assicura la rimozione di trapelata incapsulato materiale che potrebbe influenzare la precisione della velocità di reazione misure all'interno di vescicole. Poiché ogni purificazione richiede almeno 10 minuti per ottenere una buona separazione e raccogliere le frazioni della vescicola, l'analisi delle reazioni veloci è difficile, e la reazione deve essere interrotto prima della quantità di colonna.
Il protocollo che presentiamo qui è adatto per la costruzione dei liposomi di acido grasso che ospitano le reazioni che imitano quelli che potrebbero verificarsi nelle cellule primitive. I nostri protocolli consentono anche potenziali applicazioni nello sviluppo di sistemi di consegna biomedici e bioreattori per altre reazioni biochimiche.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
J.W.S. è un investigatore di Howard Hughes Medical Institute. Questo lavoro è stato sostenuto in parte da una sovvenzione (290363) la Fondazione Simons a J.W.S. A.e.e. sia K.P.A. riconoscere il sostegno dei fondi avvio Università del Minnesota.
Materiali
| Name | Company | Catalog Number | Comments |
| sephorose 4B | SIGMA-ALDRICH INC | 4B200 | |
| calcein | SIGMA-ALDRICH INC | C0875-10G | |
| tris-HCl pH8.0 1M | LIFE TECHNOLOGIES CORP | AM9851 | |
| citric acid | SIGMA-ALDRICH INC | 251275-500G | |
| sodium hydroxide | SIGMA-ALDRICH INC | 71690-250G | |
| potassium hydroxide | Sigma | 30614 | |
| oleic acid | Nu-Chek | U-46-A | |
| glycerol monooleate | Nu-Chek | M-239 | |
| Liss Rhodamine-PE | LIFE TECHNOLOGIES CORP | L1392 | |
| magnesium chloride | Fisher/Thermo Fisher Scientific | AM9530G | |
| sequagel concentrate | National Diagnostics | EC-830 | |
| sequagel DILUENT | National Diagnostics | EC-840 | |
| 15% TBE-UREA GEL | Thermo Fisher Scientific | EC68852BOX | |
| urea | Sigma Aldrich | U6504-500G | |
| titon-100x | SIGMA-ALDRICH INC | T9284-100ML | |
| RNA primer | IDT | 5'Cy3-GCG UAG ACU GAC UGG | |
| RNA template | IDT | 5'-AAC CCC CCA GUC AGU CUA CGC | |
| hammerhead substrate strand | IDT | 5'Cy3-GCG CCG AAA CAC CGU GUC UCG AGC | |
| hammerhead ribozyme strand | IDT | 5'GGC UCG ACU GAU GAG GCG CG | |
| vesicle extruder set | AVANTI POLAR LIPIDS | 610000 | |
| fraction collector | Gilson, Inc. | 171041 | |
| 96-well plates | Fisher | NC9995941/675 | |
| plate reader | Molecular Devices | SpectraMax i3 | |
| confocal microscope | Nikon | Nikon A1R MP Confocal | |
| gel scanner | GE Healthcare Life Sciences | Typhoon 9410 scanner |
Riferimenti
- Hanczyc, M. M., Fujikawa, S. M., Szostak, J. W. Experimental Models of Primitive Cellular Compartments: Encapsulation, Growth, and Division. Science. 302, 618-622 (2003).
- Mansy, S. S., Schrum, J. P., Krishnamurthy, M., Tobé, S., Da Treco,, Szostak, J. W. Template-directed synthesis of a genetic polymer in a model protocell. Nature. 454 (7200), 122-125 (2008).
- Apel, C. L., Deamer, D. W., Mautner, M. N. Self-assembled vesicles of monocarboxylic acids and alcohols: conditions for stability and for the encapsulation of biopolymers. Biochim. Biophys. Acta. 1559 (1), 1-9 (2002).
- Walde, P., Wick, R., Fresta, M., Mangone, A., Luisi, P. L. Autopoietic Self-Reproduction of Fatty Acid Vesicles. J. Am. Chem. Soc. 116 (26), 11649-11654 (1994).
- Sulston, J., Lohrmann, R., Orgel, L. E., Todd Miles, H. Nonenzymatic Synthesis of Oligoadenylates on a Polyuridylic Acid Template. Proc. Natl. Acad. Sci. U. S. A. 59 (3), 726-733 (1967).
- Adamala, K., Szostak, J. W. Nonenzymatic template-directed RNA synthesis inside model protocells. Science. 342 (6162), Science. New York, N.Y. 1098-1100 (2013).
- Uhlenbeck, O. C. A small catalytic oligoribonucleotide. Nature. 328 (6131), 596-600 (1987).
- Chen, I. A., Salehi-Ashtiani, K., Szostak, J. W. RNA catalysis in model protocell vesicles. J. Am. Chem. Soc. 127 (38), 13213-13219 (2005).
- Adamala, K. P., Engelhart, A. E., Szostak, J. W. Collaboration between primitive cell membranes and soluble catalysts. Nat. Commun. 7, 1-7 (2016).
- Joyce, G. F., Inoue, T., Orgel, L. E. RNA Template-directed Synthesis on Random Copolymers. J. Mol. Biol. 176, 279-306 (1984).
- Adamala, K., Engelhart, A. E., Kamat, N. P., Jin, L., Szostak, J. W. Construction of a liposome dialyzer for the preparation of high-value, small-volume liposome formulations. Nat. Protoc. 10 (6), 927-938 (2015).
- Zhu, T. F., Szostak, J. W. Preparation of large monodisperse vesicles. PloS one. 4 (4), e5009(2009).
- Zhu, T. F., Budin, I., Szostak, J. W. Vesicle extrusion through polycarbonate track-etched membranes using a hand-held mini-extruder. Methods Enzym. 533, Elsevier Inc. (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon