Method Article
Una piattaforma di Microfluidic ad altissima velocità di trasmissione per il sequenziamento del genoma di cella singola
In questo articolo
Riepilogo
Cella singola sequenza rivela eterogeneità genotipica nei sistemi biologici, ma le attuali tecnologie mancano la velocità effettiva necessaria per la profonda analisi della funzione e della composizione della Comunità. Qui, descriviamo un workflow di microfluidica per sequenziamento > 50.000 unicellulare genomi da diverse popolazioni cellulari.
Abstract
Tecnologie di sequenziamento hanno subito un cambiamento di paradigma da massa a cella singola risoluzione in risposta a un'evoluzione della comprensione del ruolo della eterogeneità cellulare nei sistemi biologici. Tuttavia, cella singola sequenza di grandi popolazioni è stata ostacolata dalle limitazioni in genomi per la sequenza di elaborazione. In questo articolo, descriviamo un metodo per il sequenziamento del genoma di singola cellula (SiC-seq) che utilizza la gocciolina microfluidica per isolare, amplificare e codici a barre i genomi delle singole cellule. Incapsulamento delle cellule in microgels permette la purificazione compartimenti e tagmentation del DNA, una fusione di microfluidica coppie efficientemente ogni genoma con un codice a barre univoco del oligonucleotide di singola cellula, permettendo > 50.000 celluli da sequenziare per corsa. I dati di sequenziamento sono demultiplexing di codici a barre, generando gruppi di letture che proviene dalle cellule singole. Come un metodo ad alta produttività e basso-polarizzazione di cella singola sequenza, SiC-seq consentirà una più ampia gamma di studi genomici mirati alle popolazioni cellulari diversi.
Introduzione
Il genoma serve come un modello di identità cellulare e funzione, che contiene la totalità di un organismo di codificazione potenziale. Una comprensione della biologia cellulare a livello del genoma può spiegare la diversità fenotipica osservata all'interno delle popolazioni eterogenee delle cellule. Questa eterogeneità è evidente nei sistemi biologici e ha vaste implicazioni per salute umana e la malattia. Ad esempio, variazioni del numero di copia genica tra le cellule del tumore sono collegati per l'evoluzione e la diffusione di cancro1,2. Nelle infezioni batteriche, Isole di patogenicità presente in una piccola frazione del genoma possono essere trasferiti in orizzontale e conducono alla proliferazione di batteri antibiotico-resistenti3,4. Una sfida primaria nello studio di genomi a livello di singola cellula è il basso quantità di DNA disponibile, come pure la necessità di analizzare migliaia di cellule per assaggiare la completa diversità dei genotipi. Per questi motivi, limitazioni nella velocità effettiva sperimentale hanno ostacolato l'efficacia degli studi unicellulare, differenziazione dei risultati verso le cellule più abbondanti. Tecniche di isolamento di singole cellule come flusso ordinamento5,6, pinzette ottiche7, infissione in bulk gel8e microfluidica9 sono capaci di elaborare centinaia di cellule per il sequenziamento; Tuttavia, questo rappresenta solo una piccola frazione della maggior parte dei campioni. Un metodo per il sequenziamento del genoma unicellulare con throughput sostanzialmente più elevato consentirebbe più profonda e più completa analisi di popolazioni di cellule, quindi chiarire il ruolo della diversità genotipica all'interno di queste comunità.
Gocciolina microfluidica consente la manipolazione di alto-rendimento delle cellule e reagenti biologici all'interno milioni di reattori picolitri-scala. Ad oggi, microdroplet tecnologie sono state utilizzate per studiare i modelli di espressione differenziale tra cellule da tessuti eterogenei10,11,12, profondamente sequenza lunghe molecole13,14 ,15e condotta analisi di sequenziamento (ChiP-seq) immunoprecipitazione della cromatina su singole cellule16. Microgocce sono infatti in grado di operazioni ad alta velocità, suddiviso in compartimenti, che li rende suscettibili di applicazioni in cella singola genomica. Lo sviluppo di questa tecnologia presenta le proprie sfide tecnologiche specifiche, tuttavia. Cellule devono essere lisate, purificate e amplificate con polarizzazione minima, di popolazioni di cellule campione uniformemente. Inoltre, a differenza di poliadenilazione trascritti di mRNA in cellule di mammifero, non c'è nessun motivo molecolare comparabile nel genoma per facilitare la cattura dell'acido nucleico bersaglio. Per questi motivi, il sequenziamento del genoma cella singola è stato difficile da attuare nelle piattaforme di microdroplet.
In questo lavoro, forniamo un protocollo dettagliato del nostro approccio precedentemente segnalati unicellulare microfluidici capace di sequenziamento dei genomi di decine di migliaia di cellule in un singolo esperimento17. Con questa tecnologia, denominata SiC-seq, cellule batteriche sono incapsulate in idrogel micron-scala e lisate individualmente, tagmented e si fuse con un microdroplet contenente un codice a barre univoco del oligonucleotide, che è calettati su DNA genomico delle cellule tramite un sovrapposizione singola estensione reazione a catena della polimerasi (PCR). Nel caso degli idrogeli funge da contenitori isolati in cui il DNA genomico ad alto peso molecolare è stericamente racchiusi, permettendo che le molecole più piccole come i detersivi e gli enzimi litici per accedere e purificare il DNA prima del barcoding18. Questo protocollo elabora > 50.000 unicellulari in poche ore, risultante in una libreria di codice a barre pronta per il sequenziamento. Dopo il sequenziamento, le letture sono demoltiplicate secondo la loro sequenza unicellulare barcode, risultante in un set di dati composto da milioni di letture, ciascuno con un indice di cellulare.
Protocollo
1. fabbricazione di dispositivi microfluidici
- Preparare la microfluidica maschera progetti usando il software di progettazione assistita da elaboratore (CAD) (fornito come. DWG; vedere File supplementari). Hanno questi disegni stampati dal venditore con una risoluzione di 10 µm su una pellicola del circuito.
Nota: Per dispositivi microfluidici a più livelli, le maschere corrispondenti contengono indicatori di allineamento. -
Per ogni dispositivo, fabbricare lo stampo master SU-8 (Figura 1A) come segue.
- Preparare un wafer di silicio del diametro di 3 in versando circa 1 mL di SU-8 3025 photoresist sul centro del wafer. Fissare la cialda sulla SPALMATRICE di rotazione mandrino applicando l'aspirazione.
- Vedere la tabella 1 per un elenco degli spessori di strato e spin velocità per ogni dispositivo. Per tutti i dispositivi, è necessario iniziare la spin-coating con 30 s a 500 giri/min, seguita da 30 s alla velocità indicata.
- Rimuovere la lastra di silicio-SU-8 dal velo di spin e morbido cuocere su una piastra riscaldante impostata a 135 ° C per 30 min. consente la cialda raffreddare a temperatura ambiente dopo la cottura.
- Esporre il wafer di silicio-SU-8 con la maschera di microfluidica appropriato sotto una luce collimata 190-mW, 365-nm UV LED per 3 min.
- Dopo l'esposizione, duro cuocere la cialda su una piastra riscaldante impostata a 135 ° C per 1 min. A seguito di questa fase di cottura, consentire la cialda raffreddare a temperatura ambiente.
- Per i dispositivi microfluidici singolo-stratificato, passare al punto 1.2.7. Per i dispositivi microfluidici multistrato, ripetere i passaggi 1.2.1 - 1.2.5 per il secondo strato di photoresist (Figura 1B).
- In seguito il primo duro cuocere per un dispositivo singolo strato (o seconda cuoc duro per un dispositivo multi-strato), è necessario sviluppare la cialda immergendolo in un bagno di propilene glicole monometil etere acetato (PGMEA) per 30 min.
- Dopo lo sviluppo di wafer, utilizzare una spruzzetta contenente PGMEA per sciacquare il wafer. Poi sciacquare la cialda con una spruzzetta contenente isopropanolo prima di posizionarla su una piastra di 135 ° C per 1 min ad asciugare.
- Inserire la cialda (di seguito "il maestro") in una capsula Petri per colata con polidimetilsilossano (PDMS).
-
Con il Maestro preparato al punto 1.2, procedere per eseguire la fabbricazione di dispositivi con un casting di PDMS.
- Preparare il PDMS unendo una base in silicone con un agente indurente in un rapporto di 11:1 in massa. Mescolare la base in silicone e l'agente indurente a mano con un bastone di mescolare.
- Degassare il PDMS ponendolo in una camera di degasaggio e l'applicazione di un vuoto. Consentire il PDMS degassare fino a bolle d'aria non sono più visibili (in genere 30 min).
- Versare con cautela il PDMS degassato sopra il padrone, per uno spessore finale di PDMS-strato di circa 5 mm. Degas il PDMS nuovamente per garantire la rimozione di eventuali bolle d'aria.
- Dopo il degassamento, cuocere il PDMS e il maestro a 80 ° C per 80 min.
- Asportare con attenzione la lastra PDMS curata dal maestro al forno usando una lama di rasoio. Garantire che tutti i tagli sono in cima il wafer di silicio.
Nota: Eventuali tagli fatti fuori il wafer di silicio possono comportare un labbro impedendo un incollaggio uniforme. - Un pugno gli ingressi e le uscite usando un punzone di biopsia di 0,75 mm. Rimuovere polvere e randagi PDMS utilizzando un nastro di imballaggio sul lato di funzionalità del dispositivo.
- Prima del plasma nel trattamento del dispositivo, pulire una lastra di vetro 50 mm x 75 mm sciacquandola con isopropanolo ed asciugarlo.
- Per il trattamento al plasma, porre il vetrino di lastra e vetro PDMS nel bonder del plasma con le caratteristiche rivolto verso l'alto. Eseguire il trattamento al plasma usando 1 mbar O2 plasma per 1 min. Bond il dispositivo al vetro scorrere portando l'esposto, o verso l'alto, lati insieme.
- A seguito del trattamento al plasma, cuocere il dispositivo a 80 ° C per 40 min.
- Infine, iniettare liquido di trattamento di superficie di vetro in una delle insenature per eseguire il rendering i canali microfluidici idrofobo. Garantire tutti i canali sono completamente allagati con la soluzione e ripetere l'iniezione per ogni dropmaker. Cuocere il dispositivo trattato a 80 ° C per 10 min per far evaporare il solvente in eccesso.
2. incapsulamento di cellule in agarosio Microgels
Nota: Vedere Figura 2A.
- Preparare 1 mL di agarosio di temperatura basso punto di fusione 3% p/v in 1 x tampone Tris-EDTA (TE). Tenere la soluzione di agarosio su un blocco di calore 90 ° C fino al momento immediatamente precedente la siringa caricamento.
-
Preparare la sospensione cellulare.
Nota: Questo protocollo e i relativi dispositivi microfluidici associato sono stati convalidati per lavorare con le cellule batteriche, da un'azione congelate o preparazione fresca. Cellule di mammifero, a seconda del tipo di cellula, possono richiedere un aggiustamento delle dimensioni canali microfluidici per ospitare le taglie più grandi delle cellule.- Risospendere le cellule in 1 mL di tampone fosfato salino (PBS).
- Contare le celle in un emocitometro o ordinando di flusso. Per 25 µm microgels con un tasso di incapsulamento delle cellule bersaglio 1/10, preparare 1 mL di sospensione cellulare ad una concentrazione finale di 2.4 x 107 cellule/mL.
- Rallentare le cellule a 3.000 x g per 3 min. aspirare il supernatante e risospendere il pellet cellulare in 1 mL di 17% v/v densità gradiente medio (Vedi Tabella materiali) in PBS. Tenerlo su ghiaccio fino a quando il caricamento della siringa.
- Caricare una siringa da 3 mL con olio fluorurati (HFE) contenente un surfattante di 2% w/w perfluoropolieteri-polietilene glicole (PFPE-PEG), montarla con un ago 27G e metterlo in una pompa a siringa.
Nota: Montare tutte le siringhe con ago 27G per la microfluidica i passaggi in questo protocollo. Per ridurre il rischio di puntura accidentale, è possibile mantenere tappi su tutti gli aghi fino a quando inizia il funzionamento della pompa. - Caricare la sospensione cellulare e agarosio fuso in 1 mL siringhe, entrambi con aghi di calibro 27 in forma e inserire questi nelle pompe a siringa.
- Tenere la siringa di agarosio e pompa caldo con una piccola stufa di spazio per impedire che l'agarosio gelificante nella siringa e nella tubazione di aspirazione. Impostato la scaldiglia alta e posizionarlo in modo che la superficie di riscaldamento è di circa 10 cm di distanza la siringa. Assicurarsi che la temperatura misurata a siringa è circa 80 ° C.
Nota: Gli utenti sono invitati a mantenere il riscaldatore alla distanza consigliata dall'apparato di pompaggio per ridurre il rischio di danni alle apparecchiature, tra cui la fusione del tubo. -
Generare 25 µm microgel gocce utilizzando il dispositivo di co-flusso dropmaking.
Nota: Vedi Figura 3A per un dispositivo schematico che indica la posizione della insenature di reagente e outlet.- Collegare il siringa aghi per gli ingressi dei dispositivi microfluidici usando pezzi di tubi di polietilene (PE). Prima di inserire i tubi nell'apparecchio, adescare le pompe per rimuovere l'aria dalla linea.
- Collegare un pezzo di tubo alla presa e inserire l'estremità libera in una provetta da 15 mL.
- Utilizzare le seguenti portate (scelta consigliata) per dropmaking: 800 µ l/h per il HFE 2% w/w PFPE-PEG; 200 µ l/h per la sospensione cellulare in PBS; e 200 µ l/h per il 3% p/v dell'agarosi.
- Dopo il dropmaking, è possibile posizionare il tubo di raccolta a 4 ° C per 30 min assicurare la completa gelificazione di agarosio.
3. rottura e il Microgels di agarosio di lavaggio
- Rimuovere lo strato più basso dell'olio dal tubo raccolta utilizzando una siringa da 3 mL con ago 20 G, facendo attenzione a non per disturbare lo strato superiore delle goccioline dell'agarosi.
-
Rompere le emulsioni con perfluorooctanol (PFO).
- Aggiungere 1 mL di 10% v/v PFO in HFE per le gocce di agarosio. Dispensare questa soluzione su e giù per 1 min rivestire completamente le emulsioni.
Nota: Per tutti il microgel lavare passaggi, dispensare le soluzioni con una punta di 1.000 µ l. La sospensione di microgel dovrebbe apparire omogeneo e privo di grumi dopo esso il pipettaggio. - Girare il tubo conico a 2.000 x g per 1 min raccogliere il microgels di agarosio. Rimuovere il surnatante PFO/HFE di aspirazione; i microgels sono ora liberi di loro strato di tensioattivo e apparirà chiaro.
- Aggiungere 1 mL di 10% v/v PFO in HFE per le gocce di agarosio. Dispensare questa soluzione su e giù per 1 min rivestire completamente le emulsioni.
-
Lavare il microgels con un tensioattivo in esano.
Attenzione: Esano è un solvente organico volatile, e il lavaggio in fase 3.3 deve essere condotto in una cappa aspirante.- Aggiungere 2 mL di tensioattivo non ionico 1% v/v monooleato di sorbitano (Vedi Tabella materiali) in esano per la microgels di agarosio. Dispensare su e giù per 10 volte per mescolare, garantendo la completa rottura del microgel a pellet.
- Girare il tubo a 1.000 x g per 1 min raccogliere il microgels. Aspirare il supernatante per rimuovere la soluzione di tensioattivo/esano.
- Ripetere il lavaggio dell'agente tensioattivo/esano.
-
Lavare il microgels in un tampone acquoso per rimuovere qualsiasi residuo solvente organico.
- Aggiungere 5 mL di tampone di TET [detergente non ionico etossilato octilfenolo 0.1% v/v (Vedi Tabella materiali) in 1 x TE] al tubo conico. Dispensare su e giù per 10 volte per mescolare.
- Girare il tubo conico a 2.000 x g per 2 minuti raccogliere il microgels. Aspirare il supernatante per rimuovere il buffer di TET.
- Ripetere il TET lavare 2x.
- Aggiungere 5 mL di tampone TE 1x tubo conico. Dispensare su e giù per 10 volte per mescolare.
- Girare il tubo conico a 2.000 x g per 2 minuti raccogliere il microgels. Aspirare il supernatante per rimuovere il buffer di TE.
- Ripetere il lavaggio di TE.
- Verificare l'incapsulamento delle cellule in microgels sotto un microscopio ad un ingrandimento di X 400 macchiando di un'aliquota di 10 µ l di gel con 1 x dell'acido nucleico macchia (Vedi Tabella materiali).
Nota: Microgels apparirà chiaro sotto il canale trasparente mentre cella che DNA darà fluorescenza sotto il canale GFP (497/520 nm eccitazione/emissione lunghezze d'onda). Una sovrapposizione dei canali trasparente e fluorescente mostrerà le cellule nella microgels, come mostrato in Figura 4A.
4. lisi delle cellule nell'agarosi tramite enzimi litici
- Preparare 1 mL di un cocktail utilizzando 800 µ l di buffer di TE (1x), 2 µ l di enzima litico di lievito (5 U / µ l Stock in, finale di 10 U/mL), 30 µ l di ditiotreitolo (stock di 1 M, 30 mM finale), 60 mg di lisozima (polvere liofilizzata), 15 µ l di EDTA (0,5 M stock di enzimi litici finale 7,5 mM), 2 µ l di mutanolysin (100 stock U / µ l, 200 U/mL finale), 2 µ l di lysostaphin (10 stock U / µ l, 20 U/mL finale) e 30 µ l di NaCl (1m stock, 30mm finale).
- Aggiungere ulteriori TE per portare il volume a 1 mL. Mescolare nel Vortex.
- Aggiungere l'intero 1 mL della soluzione degli enzimi litici a non più di 1 mL della microgels lavato. Mescolare di pipettaggio 10x. Incubare la miscela a 37 ° C per > 2 h in uno shaker (il massimo è di incubazione overnight).
5. detergente a base Microgel trattamento
-
Dopo la lisi tramite enzimi litici (passaggio 4), lavare il microgels.
- Rotazione verso il basso il microgels a 2.000 x g per 2 min e aspirare il supernatante. Le goccioline apparirà bianco opaco a causa di detriti cellulari dislocati nel pellet.
- Risospendere il microgels in 5 mL di tampone Tris-HCl 10 mM e dispensare su e giù per 10 volte per mescolare.
- Rallentare la miscela a 2.000 x g per 2 minuti, quindi eliminare il surnatante tramite aspirazione.
-
Eseguire un trattamento detergente sulla microgels.
- Risospendere i gel in un buffer di lisi di litio dodecil solfato (coperchi) (0,5% w/v coperchi in 20 mM Tris-HCl) e 60 µ l di EDTA 0.5 M fino ad un volume finale da 3 mL.
- Aggiungere 5 µ l di un enzima di proteinasi K (800 U/mL di brodo). Quindi, dispensare su e giù per 10 volte per mescolare, incubare la miscela a 42 ° C su un blocco di calore per 1 h di solubilizzare le membrane cellulari e digerire le proteine.
-
A seguito del trattamento detergente, lavare il microgels.
- Selezione il tubo conico con il microgels verso il basso a 2.000 x g per 2 minuti rimuovere il surnatante dall'aspirazione.
- Lavare il microgels con 10 mL di polisorbato di 2% v/v 20 in acqua. Dispensare su e giù per 10 volte per mescolare.
- Rallentare il tubo conico a 2.000 x g per 2 minuti, quindi eliminare il surnatante tramite aspirazione.
- Lavare il microgels con 10 mL di etanolo al 100% per inattivare qualsiasi enzimatica residua. Dispensare su e giù per 10 volte per mescolare.
- Rallentare il tubo conico a 2.000 x g per 2 minuti, quindi eliminare il surnatante tramite aspirazione.
- Lavare il microgels con 10 mL di polisorbato di 0,02% v/v 20 in acqua. Dispensare su e giù per 10 volte per mescolare.
- Rallentare il tubo conico a 2.000 x g per 2 minuti, quindi eliminare il surnatante tramite aspirazione.
- Ripeti il polisorbato 20 lavare x 3. Filtrare la soluzione attraverso un colino di cella da 100 µm prima dell'ultimo lavaggio per rimuovere qualsiasi grandi ciuffi.
- Risospendere il microgels in 5 mL di tampone Tris-HCl 10 mM per evitare la degradazione del DNA. Il microgels possono essere conservati a 4 ° C fino a 1 settimana prima del tagmentation (passaggio 7).
6. generare goccioline di codici a barre mediante PCR digitale
- Preparare un brodo di 500-pM di BAR primer (tabella 2) in un 1x buffer di TE in un tubo di basso-bind. Prima di ogni utilizzo, è necessario diluire il primer per uno stock di lavoro di 13 e riscaldare fino a 70 ° C per 1 minuto su un blocco di calore.
- Preparare una miscela di reazione PCR 150-µ l utilizzando 75 µ l di avviamento a caldo ad alta fedeltà master mix (Vedi Tabella materiali) (2x), 42 µ l di acqua di PCR-grado, 3 µ l di primer DNA_BAR (10 µM stock, 0,2 µM finale), 3 µ l di primer P7_BAR (10 Stock in µM 0,2 µM finali), 6 µ l della diluizione di codici a barre (13 stock, 40 fM finale), 6 µ l di polisorbato 20 (50% v/v stock, 2% finale) e 15 µ l di PEG 6K (50% p/v stock, 5% finale). Mescolare pipettando su e giù per 10 volte.
- Prepara una siringa HFE-backed disegnando 200 µ l di HFE di olio in una siringa e montarla con un ago. Allegare una sezione di tubo PE per l'ago e la linea di prima a mano. Inserire l'estremità del tubo PE la soluzione di destinazione e disegnare accuratamente tutti i 150 µ l di miscela di PCR nella tubazione PE e siringa. Caricare la siringa nella pompa a siringa.
- Caricare una siringa da 1 mL con olio fluorurati (HFE) contenente un surfattante di 2% w/w perfluoropolieteri-polietilene glicole (PFPE-PEG), montarla con un ago e metterlo in una pompa a siringa.
-
Generare 25 µm gocce di codici a barre utilizzando il dispositivo di co-flusso dropmaking.
Nota: Vedi Figura 3A per un dispositivo schematico che indica la posizione della insenature di reagente e outlet.- Collegare l'ingresso di cellule di un dispositivo di co-flusso dropmaker con un piccolo pezzo di piombo della saldatura.
- Collegare le siringhe caricate con HFE e PCR mescolare per gli ingressi dei dispositivi microfluidici usando pezzi di tubi di PE, utilizzando l'Agarosio fuso di ingresso per il codice a barre mix di PCR. Prima di inserire i tubi nell'apparecchio, adescare le pompe per rimuovere l'aria dalla linea.
- Collegare un pezzo di tubo alla presa e inserire l'estremità libera in una provetta PCR da 0,2 mL. Utilizzare le seguenti portate (scelta consigliata) per dropmaking: 600 µ l/h per il HFE 2% w/w PFPE-PEG e 200 µ l/h per il mix PCR. Raccogliere le gocce nelle provette PCR con circa 50 µ l di gocce in ciascun tubo.
- Dopo il dropmaking, rimuovere con attenzione lo strato inferiore di HFE olio da emulsioni utilizzando gel-caricamento dispensare consigli e sostituirlo con FC-40 fluorurati olio contenente un surfattante PFPE-PEG di 5% w/w. Ciclo termico con il seguente protocollo: 98 ° C per 3 min, 40 x di (98 ° C per 10 s, 62 ° C per 20 s, 72 ° C per 20 s), 72 ° C per 5 min e poi tenere a 12 ° C.
Nota: Le goccioline pedalato termica possono essere conservate a 4 ° C per fino a 1 giorno. -
Verificare il tasso di amplificazione e l'incapsulamento del codice a barre.
- Preparare un acido nucleico 1x macchia (Vedi Tabella materiali) in HFE con un tensioattivo di PFPE-PEG 2% w/w; la macchia è marginalmente miscibile in HFE e si legherà al DNA in goccioline.
- Aggiungere 1 µ l di emulsione pedalato termica barcode a 10 µ l di olio di colorazione. Li Incubare per 5 min a temperatura ambiente.
- Goccioline di immagine di microscopia fluorescente (GFP canale, lunghezze d'onda di eccitazione/emissione di 497/520 nm) ad un ingrandimento X 200 e contare il tasso di incapsulamento del codice a barre. Si noti che il segnale sarà discreto: le goccioline contenenti i codici a barre amplificato darà fluorescenza brillantemente, considerando che le gocce vuote appare scure (Figura 4B).
7. Tagmentation del DNA genomico in goccioline
Nota: Vedi Figura 2B.
- Preparare 500 µ l di soluzione di tagmentation utilizzando reagenti da una preparazione di biblioteca di sequenziamento di nuova generazione kit (Vedi Tabella materiali). Utilizzare 7 µ l di enzima tagmentation, 250 µ l di tampone di tagmentation e 243 µ l di acqua di PCR-grado. Mescolare nel vortex e rallentare la miscela per raccogliere. Caricare questa soluzione in una siringa di olio-backed 1ml HFE e montarla con un ago.
-
Preparare il microgels per la reiniezione.
- Rotazione verso il basso il tubo microgel per 2 min a 2.000 x g e aspirare il supernatante. Trasferire 200 µ l di gel nella parte superiore di una siringa di HFE-backed con un puntale gel-caricamento e sigillare l'ugello con un piccolo pezzo di nastro.
- Utilizzando un adattatore 3D-stampato centrifuga (Vedi Supplemental file 1 e 2), girare la siringa microgel per 3 min a 3.000 x g.
- Rimuovere il surnatante liquido dalla siringa utilizzando una punta di pipetta gel-caricamento. Spingere lo strato microgel alla base dell'ugello della siringa. Inserire la siringa con un ago.
- Caricare una siringa da 3 mL con olio fluorurati (HFE) contenente un surfattante di 2% w/w perfluoropolieteri-polietilene glicole (PFPE-PEG), montarla con un ago e metterlo in una pompa a siringa.
- Ri-incapsulare il microgels in goccioline contenenti i reagenti tagmentation.
Nota: Vedere Figura 3B per un dispositivo schematico che indica la posizione della insenature di reagente e outlet.- Collegare le siringhe contenenti HFE, mix di tagmentation e microgels per le insenature di dispositivo microfluidico usando pezzi di tubi di PE. Prima di inserire i tubi nell'apparecchio, adescare le pompe per rimuovere l'aria dalla linea.
- Collegare un pezzo di tubo alla presa e inserire l'estremità libera in una siringa 1 mL vuota con lo stantuffo disegnato per la linea di 1 mL.
- Utilizzare le seguenti portate (scelta consigliata) per dropmaking: 2.000 µ l/h per il HFE 2% w/w PFPE-PEG, 200 µ l/h per la microgels e 500 µ l/h per il mix di tagmentation.
- Verificare il tasso di incapsulamento microgel sotto un microscopio ottico a 400 ingrandimenti. Circa l'80-90% delle gocce dovrebbe contenere un microgel, come mostrato in Figura 4.
- Inserire la siringa contenente le emulsioni di tagmentation con un ago e incubare in posizione verticale in un blocco riscaldante o forno per 1 ora a 55 ° C a frammentare il DNA genomic.
8. single-cell Barcoding di Microfluidic doppia fusione
Nota: Vedere Figura 2.
- Preparare le goccioline di codici a barre per la fusione, sostituendo la frazione dell'olio di FC-40 con HFE 2% w/w PFPE-PEG. Attentamente trasferire queste gocce in una siringa da 1 mL, montarla con un ago e metterlo in una pompa a siringa.
- Caricare la siringa di gocciolina microgel incubata e tagmented in una pompa a siringa.
- Preparare 500 µ l di miscela di PCR. Aggiungere i reagenti nel seguente ordine per impedire la formazione di precipitati: 140 µ l di acqua di PCR-grado, 10 µ l di primer P5_DNA (10 µM stock, 0,2 µM finali), 10 µ l di primer P7_BAR (10 µM stock, 0,2 µM finali), 50 µ l di PEG 6K (stock 50% w/v 5% finale), 50 µ l di polisorbato 20 (50% v/v stock, 5% finale), 250 µ l di Master Taq Mix (2x) (Vedi Tabella materiali), 10 µ l di polimerasi isotermica (Vedi Tabella materiali) e 10 µ l di tampone di neutralizzazione (Vedi Tabella materiali). Mescolare pipettando su e giù per 10 volte e rallentare la miscela per raccoglierlo. Caricare questa soluzione in una siringa 1 mL HFE-backed, montarla con un ago e metterlo in una pompa a siringa.
- Carico tre 3 mL siringhe con olio fluorurati (HFE) contenente un 2% w/w perfluoropolieteri-polietilene glicole (PFPE-PEG) dell'agente tensioattivo, ciascuno con un ago in forma e inserirli in pompe a siringa.
- Caricare tre siringhe da 1 mL con 2 M di NaCl, misura ognuna con un ago e metterle da parte.
-
Unire le gocce di codici a barre, tagmented goccioline di genoma, e PCR mix utilizzando il dispositivo di doppia fusione.
Nota: Vedere la Figura 5 per un dispositivo schematico che indica la posizione dell'elettrodo e reagente insenature e in uscita.- Collegare il 3 siringhe di NaCl 2 ingressi elettrodo e l'unico fossato inletusing pezzi di tubi di PE. Per gli elettrodi, applicare pressione le siringhe manualmente fino a quando gli elettrodi sono completamente riempiti con soluzione salina. Dopo aver compilato gli elettrodi, applicare una pressione manuale sulla siringa fossato fino a riempita il fossato. Collegare l'altra estremità del fossato con un piccolo pezzo di piombo della saldatura.
- Collegare il 3 siringhe HFE montate su pompe per i 2 introduttori d'olio di distanziale e dropmaking olio inletusing pezzi di tubi di PE. Prima di inserire i tubi nell'apparecchio, adescare le pompe per rimuovere l'aria dalla linea.
- Collegare la siringa di mix PCR, microgel gocce siringa e codice a barre gocce siringa alle loro rispettive entrate utilizzando tubi di PE. Sparare tutte le tubazioni di reiniezione di goccia con una pistola antistatica prima di collegarli agli aghi siringa; il trattamento antistatico riduce il rischio di coalescenza di goccia indotta da cariche elettrostatiche del tubo di PE.
- Collegare un pezzo di tubo PE alla presa e posizionare l'estremità libera in una provetta PCR da 0,2 mL.
- Collegare l'ago della siringa elettrodo ad un inverter fluorescente a catodo freddo utilizzando un morsetto a coccodrillo. Impostare alimentazione dell'inverter DC a 2 V.
- Eseguire il dispositivo di doppia fusione con le portate consigliate: 300 µ l/h per le gocce di microgel tagmented, 100 µ l/h per le gocce di codici a barre, 1500 µ l/h per il HFE 2% w/w PFPE-PEG (olio dropmaking), 600 µ l/h per l'amplificazione della miscela, 200 µ l/h per il HFE 2% w/w PFPE-PEG ( olio di distanziale codice a barre) e 700 µ l/h per il HFE 2% w/w PFPE-PEG (microgel olio distanziatore). Raccogliere le gocce nelle provette PCR con circa 50 µ l di emulsione in ogni provetta.
- Prima i cicli termici, rimuovere con attenzione lo strato inferiore di HFE olio da emulsioni utilizzando gel-caricamento dispensare consigli e sostituirli con FC-40 fluorurati olio contenente un surfattante PFPE-PEG di 5% w/w. Ciclo termico con il seguente protocollo: 65 ° C per 5 min, 95 ° C per 2 min, 30 x (95 ° C per 15 s, 60 ° C per 1 min, 72 ° C per 1 min), 72 ° C per 5 min, poi tenere a 12 ° C.
-
Recuperare il codice a barre del DNA dalle goccioline thermal-pedalato.
- Piscina le goccioline in una microcentrifuga e rompere le emulsioni utilizzando 20 µ l di PFO. Vortex per 10 s a mescolare.
- Girare il tubo a 10.000 x g per 1 min frazionare la miscela acquosa (in alto) e fasi di olio (in basso). Rimuovere lo strato acquoso superiore dal tubo utilizzando una pipetta delicatamente e trasferirlo in un nuovo tubo del microcentrifuge. Scartare la fase di olio.
- Purificare il prodotto di PCR con codice a barre in una colonna di rotazione secondo il protocollo del produttore ed eluire esso in 20 µ l di tampone TE 1x.
- Procedere alla eseguita sequenziamento e analisi secondo i passaggi 9 e 10.
9. Biblioteca preparazione e sequenziamento
- Preparare la libreria cella singola per il sequenziamento seguendo protocolli del produttore per la dimensione del frammento-selezione e quantificazione.
- La libreria di fine accoppiato con chimica predefinito di sequenza per lettura 1 e 2 di lettura. Utilizzare il primer 1 indice personalizzato I7_READ (tabella 2) per un indice 15-bp leggere, corrispondente del codice a barre di cella singola.
10. analisi dei dati di cella singola
Nota: Gli script Python Custom per controllo qualità e analisi preliminare dei dati di SiC-seq possono essere scaricati da https://www.github.com/AbateLab/SiC-seq.
- Eseguire lo script "barcodeCleanup.py" per eseguire il controllo di qualità sulla recita con codice a barre ed esportare i dati di cella singola a un database SQLite. Per un esperimento di controllo, utilizzare questo script con il "-allineare" flag impostato per allineare le letture di genomi di riferimento noto.
- Analizzare la purezza dei gruppi di codice a barre (per un esperimento di controllo) utilizzando lo script "purity.py" e confermare i valori di elevata purezza coerenti con Figura 6B.
Risultati
Il flusso di lavoro sperimentale di SiC-seq contiene 3 dispositivi microfluidici PDMS fabbricati utilizzando una procedura di litografia soft (Figura 1). Un co-flusso dropmaker (Figura 3A) genera 25 µm di goccioline digitale codice a barre per l'etichettatura di DNA genomico con un identificatore univoco di cella singola. I oligonucleotides di codici a barre consistono di una sequenza di degenerato bp 15 affiancato da maniglie PCR per l'amplificazione (tabella 2, BAR primer). I codici a barre sono diluiti ad una concentrazione di femtomolar per raggiungere l'incapsulamento di singola molecola, e ricevano tutte le goccioline frammenti di codice a barre sia 0 o 1. Le goccioline contenenti un codice a barre sono amplificate, producendo molte copie degli ampliconi di double-stranded del codice a barre. Una macchia di acido nucleico viene utilizzata per verificare l'amplificazione di successo e quantificare la velocità di incapsulamento dei frammenti di codice a barre (Figura 4B). I microgels vengono generati dal co-che scorre una sospensione di cellule batteriche e un gel di agarosio fuso alle portate uguali (Figura 2A). L'agarosio è preparato a due volte la concentrazione finale desiderata, come il processo di dropmaking di co-flusso diluisce in modo efficace le soluzioni acquose di un fattore 2. Come l'agarosio si raffredda, si solidifica in un 25 µm diametro microgel occupando il volume sferico della goccia.
Una serie di passaggi di lavaggio e Lisi purifica il DNA genomic di alto peso molecolare in microgels (Figura 2B). Dopo la rottura delle emulsioni, lavaggi acquosi sono effettuati in grandi volumi per diluire fuori traccia solventi organici che possono inibire i trattamenti enzimatici a valle. Il microgels lavato sono osservati al microscopio per verificare il tasso di incapsulamento delle cellule (Figura 4A). Un cocktail di enzimi con vasta attività litica è aggiunto alla sospensione microgel per digerire le pareti cellulari dei batteri e microbi eucarioti19. Un secondo trattamento con proteinasi K e detergente degrada le proteine e solubilizza i detriti cellulari.
Tagmentation del DNA purificato viene effettuata nelle goccioline per evitare potenziali contaminazioni derivanti dalla diffusione di frammenti di DNA di piccolo tagmented tra i microgels18. Un dispositivo di incapsulamento di goccia (Figura 3B) compartmentalizes ogni microgel con un enzima buffer e tagmentation, che contemporaneamente frammenti di DNA double-stranded mentre anche "tagging" con un oligonucleotide precaricato20. I microgels vengono caricati nelle gocce di come Chiudi-pranzo particelle, realizzando i tassi di incapsulamento si avvicina 1 microgel per ogni goccia con alcuni doppietti21 (Figura 4).
Nel passaggio finale del flusso di lavoro microfluidica (Figura 2), un dispositivo esegue un'operazione di fusione doppia combinazione 1 goccia di codici a barre, 1 goccia di microgel-contenente e il mix di amplificazione in un processo controllato in due fasi. In primo luogo, una gocciolina contenente reagenti PCR accoppiata e fuse con una goccia di codice a barre nella regione evidenziata in giallo (Figura 5). Acqua salati elettrodi nel canale microfluidico producono un gradiente elevato campo elettrico che innesca la fusione della gocciolina. In modo simile, la prima goccia unita è accoppiata con una gocciolina di microgel e incorporata una seconda volta nella regione indicata in rosso. Le goccioline vengono raccolti e termica pedalato off-chip in un'estensione di singolo-sovrapposizione (SOE) PCR. Le estremità sovrapposte complementari del codice a barre e il DNA di genomic tagmented consentono fusion e amplificazione esponenziale di costrutti di codice a barre solo correttamente.
I dati di sequenziamento sono filtrati prima di una qualità di lettura e quindi analizzati raggruppando le letture secondo la loro sequenza di codici a barre cella singola 15-bp. Per un gruppo di codice a barre può essere considerata valida, deve contenere un numero minimo di letture; Questa soglia limita l'analisi alle cellule con una quantità utile di dati di sequenziamento e rimuove il codice a barre "orfani" PCR-mutato dal dataset. In questo esempio eseguito, il minimo è impostato su 7,5 kbps per ogni gruppo (50 letture di 150 bp ogni). Un istogramma dei conteggi barcode contro la dimensione del gruppo dimostra che una porzione significativa dei gruppi validi codici a barre è appena sopra la dimensione della soglia (Figura 6A).
In un esperimento di controllo cui è nota la composizione della comunità microbica, la purezza e la relativa abbondanza metriche vengono utilizzati per valutare la qualità di un SiC-seq eseguire. Qui, una comunità di 10 celle sintetica composto da 3 batteri gram-negativi, batteri Gram-positivi 5 e 2 lieviti è analizzata. La purezza di un gruppo determinato codice a barre è definita come il numero di letture mapping al genoma più comune nel gruppo diviso per il numero totale di letture nel gruppo. La stragrande maggioranza dei gruppi di codice a barre hanno gradi di purezza superiore a 0,95 (Figura 6B). Relativa abbondanza dei tipi cellulari viene calcolato contando le letture crude e contando i gruppi di codice a barre, dove i gruppi vengono assegnati un tipo di cella corrispondente al consenso delle sue letture di membri (Figura 6). L'abbondanza di letture e di gruppi di codice a barre traccia in proporzioni più o meno uguali, che indica che le popolazioni delle cellule sono campionate tale che alcune specie non sono contenuti nel codice a barre sproporzionatamente piccole o grandi gruppi. Stampa la copertura aggregata di tutti i gruppi di codice a barre da una singola specie indica una copertura elevata attraverso l'intero genoma, con pochi o nessun regioni dropout (Figura 7). L'uniformità di copertura può essere verificato con una distribuzione di frequenza dei valori di copertura normalizzato, con maggior parte dei valori centrata intorno alla media (Figura 7, inserto).
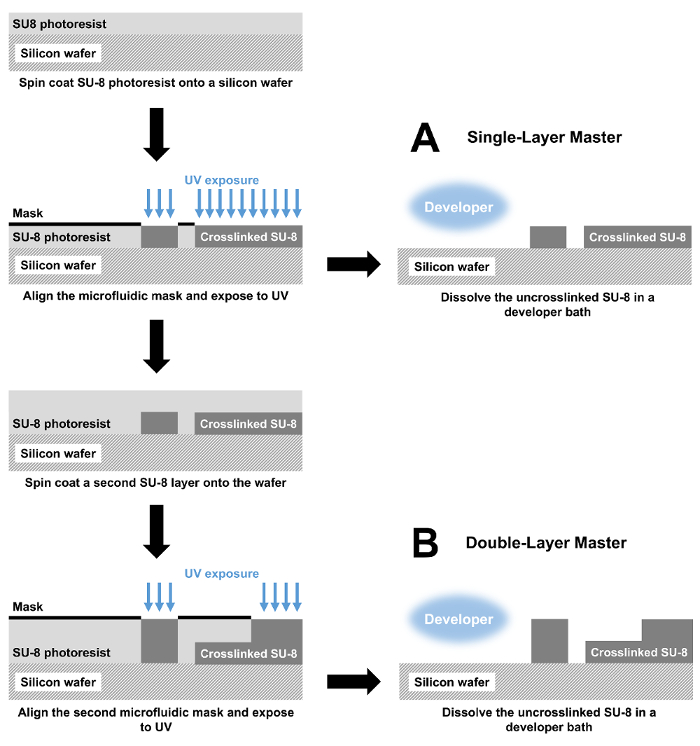
Figura 1 : Fabbricazione di dispositivi microfluidici di fotolitografia. (A) Master stampi con un'altezza di singola caratteristica sono fabbricati da spin coating di uno strato di photoresist SU-8 su un wafer di silicio. Il photoresist è poi modellato con una maschera fotolitografica e ai raggi UV, reticolazione esposta SU-8. Infine, reticolato SU-8 è dissolto in un bagno di sviluppatore. La muffa risultante viene utilizzata per PDMS che è legato a una lastra di vetro per produrre il dispositivo microfluidico completa il cast. (B) per un dispositivo a doppio strato, la fabbricazione inizia allo stesso modo con passaggi di rivestimento e l'esposizione di spin. Questi passaggi vengono ripetuti poi per creare un dispositivo di due-strato. Clicca qui per visualizzare una versione più grande di questa figura.
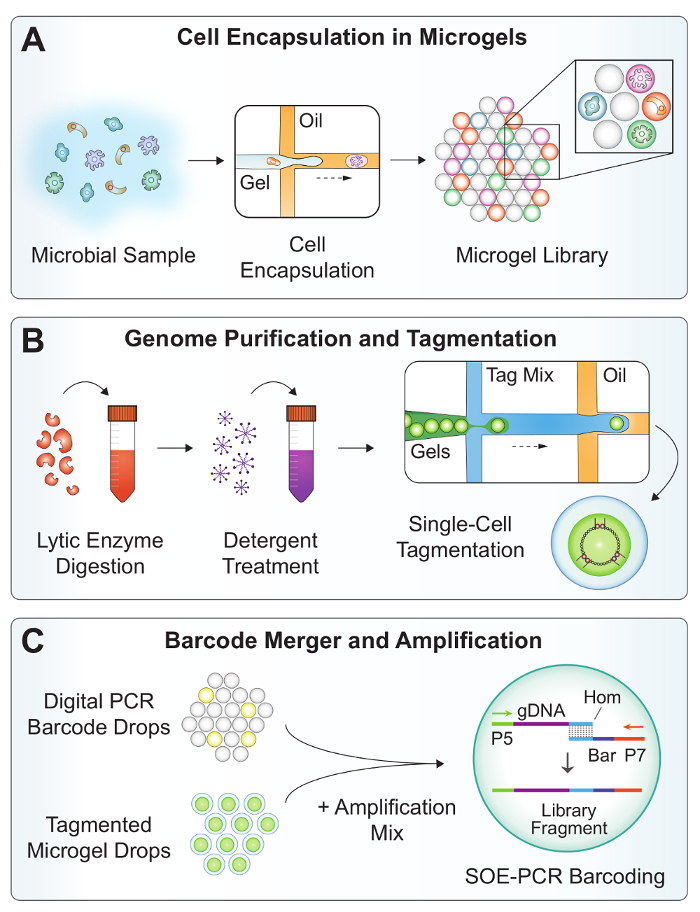
Figura 2: Panoramica del flusso di lavoro SiC-seq. (A), A sospensione microbica è co-propagata con agarosio fuso in un dispositivo di dropmaker per incapsulare singole cellule in microgels. (B) i microgels sono sottoposti a una serie di lavaggi per purificare il DNA genomico batterico. Enzimi litici digeriscono le pareti cellulari dei lieviti e batteri Gram-positivi, e detergente solubilizza i detriti cellulari. I microgels sono ri-incapsulato in goccioline per la tagmentation per ridurre la contaminazione incrociata. (C), la fusione di microfluidica combina un codice a barre digitale di PCR, un genoma di microgel tagmented e un mix di amplificazione ad un tasso > 1 kHz. Off-chip SOE-PCR giunzioni un codice a barre univoco di cella singola sul genoma tagmented e selettivamente amplifica completamente costrutti di codice a barre. Clicca qui per visualizzare una versione più grande di questa figura.
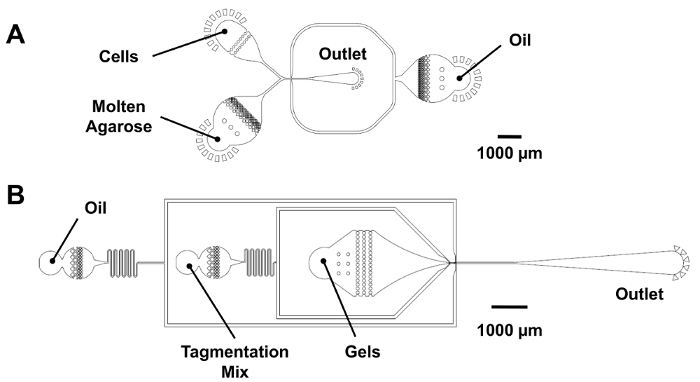
Figura 3: Dispositivi microfluidici per ri-l'incapsulamento di dropmaking e microgel. (A), questo pannello mostra un co-flusso dropmaker (25 µm di altezza caratteristica). Cellule e agarosio fuso vengono introdotti nel dispositivo a velocità di flusso pari a produrre 25 µm goccioline in un incrocio di µm 25 µm x 25. Per la dropmaking digitale codice a barre, è collegato all'ingresso della cella, e un mix PCR è stato introdotto nell'ingresso dell'agarosi. (B), questo pannello mostra un dispositivo di ri-incapsulamento microgel (25 µm di altezza caratteristica). Il microgels di flusso in un'insenatura a forma di imbuto per mantenere il loro pranzo di chiusura dell'ordine e ricevere un volume di mix tagmentation prima il Re-incapsulamento in un incrocio di µm 25 µm x 30. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Micrografie di goccioline e microgels. (A), questo pannello spettacoli lavati 25 µm microgels prima della lisi enzimatica. I batteri sono macchiati fluorescente per la quantificazione del tasso di incapsulamento. Statistiche di caricamento di Poisson dettano che le cellule dovrebbero essere incapsulato ad un tasso di 1 a 10 gocce o meno per ridurre al minimo la frequenza di eventi multipli-incapsulamento. (B) questo pannello mostra un'immagine di microscopia di fluorescenza di 25 µm digitale barcode goccioline trattato con una macchia di acido nucleico. Le goccioline contenenti frammenti di codice a barre amplificato producono un segnale di fluorescenza forte. (C) questo pannello mostra microgels ri-incapsulati in 50 µm gocce. L'impacchettamento del microgels consente velocità di incapsulamento si avvicina 1 gel a goccia con pochi doppietti. Clicca qui per visualizzare una versione più grande di questa figura.
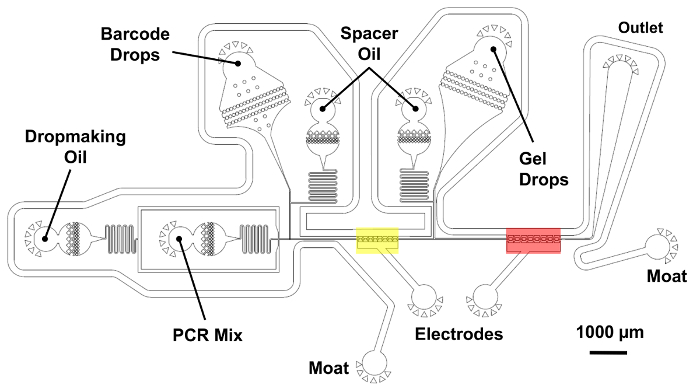
Figura 5 : Dispositivo di doppia fusione microfluidici per cella singola genoma barcoding. Un'operazione di fusione di due fasi coppie barcode goccioline con genomi di tagmented in un high-throughput. Una gocciolina di miscela PCR prima viene generata e si fuse con una gocciolina di codice a barre nella regione evidenziata in giallo usando elettrodi di acqua salati. Successivamente, una gocciolina contenente un microgel è introdotto e incorporata una seconda volta nella regione indicata in rosso. Introduttori d'olio consentono un controllo preciso della spaziatura tra le goccioline reiniettate. Camera di reiniezione di codici a barre e il suo petrolio distanziatore sono collocati sul livello 25 µm più breve, ombreggiato in blu. Tutte le altre caratteristiche del dispositivo appartengono allo strato più spesso con 45 µm di altezza totale. Clicca qui per visualizzare una versione più grande di questa figura.
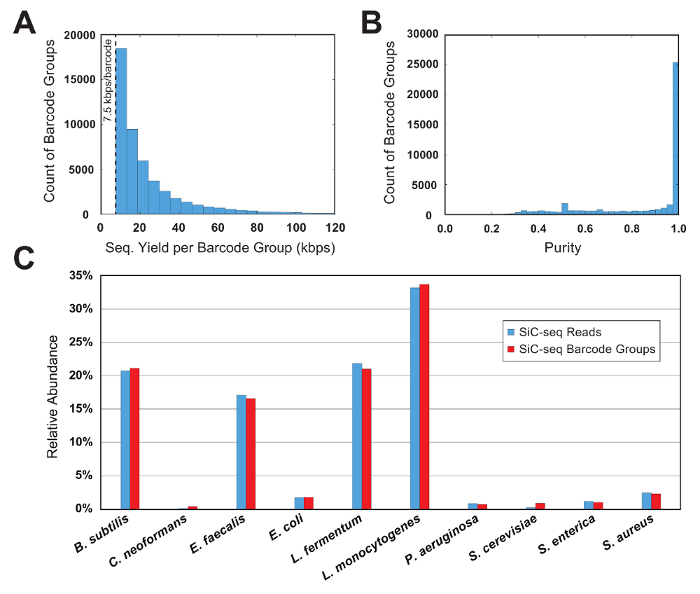
Figura 6 : Metrica del gruppo di codice a barre per una comunità microbica sintetica 10 celle. (A), questo pannello mostra la distribuzione di codice a barre dimensioni del gruppo. Il numero di gruppi di una determinata dimensione diminuisce in modo esponenziale con l'aumentare della dimensione di gruppo. Una soglia minima di 7,5 kbps per ogni gruppo limita l'analisi ai gruppi con una quantità sufficiente di informazioni e rimuove la sequenza di PCR-mutato "orfani". (B), questo pannello mostra la distribuzione dei codici a barre purezze di gruppo. La maggior parte (> 90%) dei gruppi sono di elevata purezza (> 95%). (C) questo pannello mostra l'abbondanza relativa di 10 specie calcolato a livello di gruppo di leggi e codici a barre. 2 metodi di conteggio producono risultati simili, che indica che le dimensioni del gruppo di codice a barre siano coerenti tra le specie. Clicca qui per visualizzare una versione più grande di questa figura.
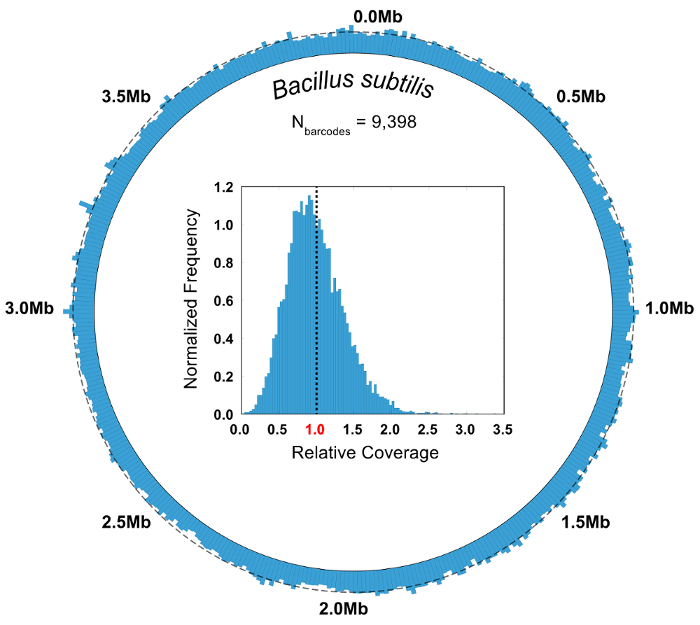
Figura 7 : Aggregare genomico copertura di Bacillus subtilis gruppi di codice a barre. Le letture di tutti i gruppi di codice a barre mappatura al batterio Bacillus subtilis (N = 9.398) sono riuniti e analizzati in forma aggregata. Una mappa di copertura circolare illustra l'uniformità di copertura della legge SiC-seq, con nessuna regione osservabile dropout. Una linea tratteggiata attorno alla circonferenza indica la copertura media (5,55 x). L'istogramma di inserzione delle frequenze relativa copertura mostra che una massa delle basi sono coperti di profondità vicino alla media del genoma, rappresentato dalla linea tratteggiata. Clicca qui per visualizzare una versione più grande di questa figura.
| Dispositivo | 1 ° strato di altezza (µm) | 1 ° strato Spin velocità (rpm) | 2 ° strato di altezza (µm) | 2 ° strato Spin velocità (rpm) |
| Dropmaker co-flusso | 25 | 4000 | N/A | N/A |
| Ri-incapsulatore gel | 25 | 4000 | N/A | N/A |
| Doppia fusione | 25 | 4000 | 20 | 5000 |
Tabella 1: parametri di fabbricazione del dispositivo microfluidico. Questa tabella mostra una lista dei dispositivi microfluidici il SiC-seq di flusso di lavoro con la loro velocità necessaria per photoresist spin coating (basato sulle specifiche del produttore per SU-8 3025).
| Etichetta | Sequenza (5' > 3') | ||||
| BAR | GCAGCTGGCGTAATAGCGAGTACAATCTGCTCTGATGCCGCATAGNNNNNNNNNNNNNNNTAAGCCAGCCCCGACACT | ||||
| DNA_BAR | CTGTCTCTTATACACATCTCCGAGCCCACGAGACGTGTCGGGGCTGGCTTA | ||||
| P7_BAR | CAAGCAGAAGACGGCATACGAGATCAGCTGGCGTAATAGCG | ||||
| P5_DNA | AATGATACGGCGACCACCGAGATCTACACTCGTCGGCAGCGTC | ||||
| I7_READ | GCCCACGAGACGTGTCGGGGCTGGCTTA | ||||
Tabella 2: Sequenze Primer.
File supplementare 1: Per favore clicca qui per scaricare questo file.
File supplementare 2: Per favore clicca qui per scaricare questo file.
Discussione
Il flusso di lavoro di microfluidica SiC-seq produce dati di sequenziamento del genoma di cella singola da migliaia di cellule batteriche. Codici a barre digitale calettati sui genomi di cellule incapsulate microgel consentono la deconvoluzione in silico di dati NGS in gruppi di codice a barre letture provenienti dalla stessa cellula. Un esperimento di controllo con una comunità microbica di composizione nota è necessario per valutare la purezza dei gruppi di codice a barre. Una grande frazione di gruppi di basso-purezza indica che il tasso di incapsulamento delle cellule è troppo alto o che ci sia contaminazione gocciolina significativi che si verificano durante le fasi di lavorazione di microfluidica. Secondo le statistiche di Poisson, i codici a barre e le cellule dovrebbero essere incapsulate in un rapporto di destinazione della 1 particella per ogni 10 gocce limitare la frequenza di più eventi di incapsulamento a meno di 5% di tutte le goccioline non vuoto. Un tasso di incapsulamento più elevato aumenta i tassi di doppietti in modo esponenziale, quindi la verifica del rapporto dell'incapsulamento durante il processo di dropmaking è di importanza critica. Gli utenti dovrebbero essere particolarmente prudenti di incapsulamento di più celle in una singola microgel perché letture da cellule diverse, condividendo la stessa sequenza di codici a barre non possono essere bioinformatically separati. Nel caso che la 1 cella riceve 2 diversi codici a barre, la purezza del gruppo di codice a barre è inalterata anche se le metriche di abbondanza sono distorta quando il conteggio di sequenza di codice a barre.
Contaminazione incrociata gocciolina può insorgere anche a causa delle condizioni non ottimali di fusione. Durante un'operazione di successo, il dispositivo di fusione di microfluidica (Figura 5) può abbinare controllably 1 goccia di codici a barre con 1 microgel ed un volume di reagente PCR. Le portate non-ideale si tradurrà in una gocciolina in abbinamento a rapporti non corretti: 1 codice a barre può essere accoppiato con 2 microgels, per esempio. Tutte le portate elencate nel protocollo sono destinate ad essere stime e potrebbero essere necessario essere regolata a seconda delle lievi variazioni nelle dimensioni di geometria e gocciolina di dispositivo. Gli utenti con accesso alle telecamere con capacità di registrazione ad alta velocità (> 10.000 fotogrammi/s) dovrebbe verificare la fusione goccia corretta all'inizio e nel corso dell'operazione microfluidica. Utenti senza accesso ad una macchina fotografica ad alta velocità è in grado di raccogliere un piccolo volume di output Unito e misurare manualmente le dimensioni delle gocce sotto un microscopio. La dimensione delle gocce deve essere uniforme: un eccesso di codici a barre non unite o gocce microgel indica che i tassi di reiniezione dovrebbero essere ridotto di conseguenza.
Diversi generali bisogna tener conto quando si maneggiano microgels e microgocce di preservare la loro integrità. Microgels, anche se meccanicamente robusta, deve essere sufficientemente raffreddato prima di rompersi e fasi per garantire completa gelificazione di lavaggio. Microgels non-sferiche sono un'indicazione che l'agarosio non era dato tempo sufficiente per solidificare. Quando si lava microgels, rallentare le sospensioni alla velocità necessaria per evitare una perdita di prodotto. Idrogel di agarosio ha un indice di rifrazione strettamente corrispondente a quello dell'acqua e può essere difficile da vedere in un tubo22, così gli utenti dovrebbero identificare attentamente il contorno di gel-liquido prima dell'aspirazione. Goccioline di acqua in olio sono suscettibili di coalescenza da accumuli di forze statiche23 su guanti da laboratorio e tubi. Per questo motivo, si consiglia di caricare le siringhe di reiniezione di goccia con le mani nude e nel trattamento di tutte le linee di reiniezione con una pistola anti-statica prima dell'innesco della pompa. Grandi goccioline si fusero possono essere rimosso lentamente ruotando le emulsioni in una siringa ed aspirare manualmente le gocce più grandi, che si accumulano nella parte superiore a causa della loro più grande forza capace di galleggiare.
SiC-seq è la prima tecnologia per dimostrare il sequenziamento del genoma unicellulare di > 50.000 cellule batteriche. Questa piattaforma offre significativi vantaggi nella velocità effettiva rispetto approcci esistenti e consente un campionamento più profondo delle comunità microbiche eterogenee. Ad oggi, microfluidica tecnologie per il sequenziamento del genoma di singola cellula hanno impiegato microchambers9 e micropozzetti24 per isolamento delle cellule e amplificazione, ma con volumi di produzione nella gamma di solo decine o centinaia di cellule. L'ordinamento di flusso delle singole cellule in wellplates5,6 non richiede nessuna strumentazione specializzata microfluidici ma possiede un throughput altrettanto basso. Dato che i campioni di suolo e acqua dall'ambiente hanno comunemente alfa diversità di > 1.000 alle specie livello25,26, SiC-seq è altamente vantaggiosa in virtù della sua abilità di campionare un numero molto maggiore di organismi. Il flusso di lavoro di SiC-seq è adattabile agli ingressi delle cellule da laboratorio cultura, l'ambiente naturale o un ospite vivente. Un campione di cellule necessario solo in una sospensione acquosa e privo di particelle di grandi dimensioni (> 10 µm) per essere adatto ad incapsulamento microfluidica. Ad esempio, il metodo è stato precedentemente applicato ad un campione di acqua di mare utilizzando una serie di lavaggio e filtraggio passaggi per pre-elaborare le cellule prima dell'incapsulamento17.
Il protocollo di SiC-seq genera una quantità relativamente scarsa di dati di sequenziamento da ogni singola cellula e potrebbe non essere adatto per tutte le applicazioni. Alcuni algoritmi di bioinformatica come de novo genoma assembly o variante di singolo nucleotide (SNV) chiamata richiedono profondità di copertura superiori di lavorare efficacemente. Invece, i gruppi di codice a barre possono essere cluster in silico di tassonomico binning metodi27 affinché gli algoritmi possono essere applicati su grandi insiemi di letture. L'efficienza complessiva relativamente basso di codici a barre del flusso di lavoro SiC-seq può presentare sfide in casi in cui la disponibilità dell'esempio di input è bassa. SiC-seq si basa su un passo di incapsulamento di Poisson-distribuito codice a barre, quindi circa il 10% delle cellule ricevono un codice a barre molecolare e sono amplificati durante il passaggio di preparazione finale biblioteca. Mentre questo è paragonabile ad altri regimi di barcoding basato su microdroplet10, gli utenti che lavorano con i campioni delle cellule preziose possono avere difficoltà a raggiungere il rendimento adeguato biblioteca per il sequenziamento e potrebbero essere necessario aumentare il numero di cicli PCR in finale passo di amplificazione. Un'altra potenziale soluzione per gli utenti con competenze di microfluidica è per ordinare goccioline barcode positivo dopo il passaggio PCR digitale, portando così l'efficienza complessiva di codici a barre > 85%28.
Un orientamento futuro potenziale per SiC-seq tecnologia sta adattando il flusso di lavoro per l'utilizzo con cellule di mammifero, aprendo la strada a nuovi studi clinici di cella singola. Ad esempio, un'analisi della variazione numero di copia tra singolo cancro cellule maggio avanzare la nostra comprensione del ruolo dell'eterogeneità in cancro patologia2. In alternativa, l'integrazione di SiC-seq con metodi esistenti di sondare ed arricchire le sequenze del DNA di interesse29 consentirebbe il sequenziamento di singola cellula mirato delle sottopopolazioni o rari ceppi di cellule. Con i campioni ambientali, geni all'interno di una via metabolica nota potrebbero essere mirati e analizzati contestualmente accanto alla confinate geni per identificare nuove isole genomiche. All'interno di un ambiente ospite umano, campioni di batteri patogeni di basso-titolo potrebbero essere isolati e sequenziato a livello di singola cellula per esaminare più da vicino le loro origini genotipiche di virulenza.
Divulgazioni
Brevetti relativi a questo flusso di lavoro possono essere concessi in licenza a Bio di missione, di cui Adam R. Abate è azionista.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Science Foundation attraverso un premio alla carriera (concessione numero DBI-1253293); il National Institutes of Health (NIH) (grant numeri HG007233-01, R01-EB019453-01, 1R21HG007233, DP2-AR068129-01, R01-HG008978); e la Defense Advanced Research Progetti Agenzia Living fonderie Program (numeri di contratto HR0011-12-C-0065, N66001-12-C-4211, HR0011-12-C-0066).
Materiali
| Name | Company | Catalog Number | Comments |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| SU-8 3025 photoresist | Microchem | 17030192 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Photomasks | CadArt Servcies | (custom) | See Supplemental Files for mask designs |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| Sylgard 184 silicone elastomer kit | Krayden | 4019862 | |
| Degassing chamber | Bel-Art | 42025 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| Glass microscope slides (75 mm x 50 mm) | Corning | 294775X50 | |
| Aquapel (hydrophobic glass treatment) | Pittsburgh Glass Works | 47100 | |
| PE-2 polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| 1 mL syringes | BD | 309628 | |
| 27 gauge needles | BD | 305109 | |
| Syringe pump | New Era Pump Systems | NE-501 | |
| Novec HFE-7500 fluorinated oil (HFE) | 3M | 98-0212-2928-5 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| PEG-PFPE surfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| Space heater | Lasko | CD09250 | |
| Agarose, low gelling temperature | Sigma-Aldrich | a9414 | |
| TE (10X) | Rockland | mb-007 | |
| PBS 1X, pH 7.4 | E&K Scientific Products | EK-65083 | |
| OptiPrep (density gradient medium) | Sigma-Aldrich | d1556 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| Hexane | Sigma-Aldrich | 139386 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Lysozyme Type IV | MP Biomedicals | 195303 | |
| Mutanolysin | Sigma-Aldrich | M9901 | |
| Zymolyase (yeast lytic enzyme) | Zymo Research | e1004 | |
| Lysostaphin | Sigma-Aldrich | L7386 | |
| Sodium chloride | Sigma-Aldrich | S9888 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Tris-HCl, pH 7.5, 1M | Invitrogen | 15567-027 | |
| Dithiothreitol (DTT) | Teknova | d9750 | |
| Lithium dodecyl sulfate | Sigma-Aldrich | L9781 | |
| Proteinase K | New England Biosciences | P8107S | |
| Ethanol, 200 Proof (100%) | Koptec | V1001 | |
| SYBR Green I (nucleic acid stain) | Invitrogen | S7563 | |
| PEG 6k | Sigma-Aldrich | 81260 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Nextera DNA Library Prep Kit | Illumina | FC-121-1030 | |
| Phusion Hot Start Flex Master Mix (High-Fidelity Hot Start Master Mix) | New England Biosciences | m05365 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Warmstart 2.0 Bst Polymerase (isothermal polymerase) | New England Biosciences | m0538m | |
| NT buffer from Nextera XT kit (neutralization buffer) | Illumina | FC-131-1024 | |
| Cold cathode fluorescent inverter | (custom) | (custom) | |
| DC power supply | Mastech | HY1503D | |
| Zerostat 3 anti-static gun | Milty | 5036694022153 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | See Supplemental Files for 3D print file |
| Zymo DNA Clean & Concentrator-5 | Zymo Research | D4003 |
Riferimenti
- Navin, N., et al. Tumour evolution inferred by single-cell sequencing. Nature. 472 (7341), 90-94 (2011).
- Ni, X., et al. Reproducible copy number variation patterns among single circulating tumor cells of lung cancer patients. Proceedings of the National Academy of Sciences of the United States of America. 110 (52), 21083-21088 (2013).
- Schmidt, H., Hensel, M. Pathogenicity islands in bacterial pathogenesis. Clinical Microbiology Reviews. 17, 14-56 (2004).
- Martínez, J. L., Baquero, F. Interactions among strategies associated with bacterial infection: pathogenicity epidemicity, and antibiotic resistance. Clinical Microbiology Reviews. 15 (4), 647-679 (2002).
- Rinke, C., et al. Obtaining genomes from uncultivated environmental microorganisms using FACS-based single-cell genomics. Nature Protocols. 9 (5), 1038-1048 (2014).
- Rinke, C., et al. Insights into the phylogeny and coding potential of microbial dark matter. Nature. 499 (7459), 431-437 (2013).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society Interface. 5 (24), 671-690 (2008).
- Xu, L., Brito, I. L., Alm, E. J., Blainey, P. C. Virtual microfluidics for digital quantification and single-cell sequencing. Nature Methods. 13 (9), 759-762 (2016).
- Gawad, C., Koh, W., Quake, S. R. Dissecting the clonal origins of childhood acute lymphoblastic leukemia by single-cell genomics. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 17947-17952 (2014).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Klein, A. M., et al. Droplet barcoding for single-cell transcriptomics applied to embryonic stem cells. Cell. 161 (5), 1187-1201 (2015).
- Rotem, A., et al. High-throughput single-cell labeling (Hi-SCL) for RNA-Seq using drop-based microfluidics. PLoS One. 10 (5), 1-14 (2015).
- Amini, S., et al. Haplotype-resolved whole-genome sequencing by contiguity-preserving transposition and combinatorial indexing. Nature Reviews Genetics. 46 (12), 1343-1349 (2014).
- Zheng, G. X. Y., et al. Haplotyping germline and cancer genomes with high-throughput linked-read sequencing. Nature Biotechnology. 34 (3), 303-311 (2016).
- Lan, F., Haliburton, J. R., Yuan, A., Abate, A. R. Droplet barcoding for massively parallel single-molecule deep sequencing. Nature Communications. 7, 11784 (2016).
- Rotem, A., et al. Single-cell ChIP-seq reveals cell subpopulations defined by chromatin state. Nature Biotechnology. 33 (11), 1165-1172 (2015).
- Lan, F., Demaree, B., Ahmed, N., Abate, A. R. Single-cell genome sequencing at ultra-high-throughput with microfluidic droplet barcoding. Nature Biotechnology. 35 (7), 640-646 (2017).
- Novak, R., et al. Single-cell multiplex gene detection and sequencing with microfluidically generated agarose emulsions. Angewandte Chemie Internation Edition. 50 (2), 390-395 (2011).
- Gill, C., Van De Wijgert, J. H. H. M., Blow, F., Darby, A. C. Evaluation of lysis methods for the extraction of bacterial DNA for analysis of the vaginal microbiota. PLoS One. 11 (9), 1-16 (2016).
- Picelli, S., et al. Tn5 transposase and tagmentation procedures for massively scaled sequencing projects. Genome Research. 24 (12), 2033-2040 (2014).
- Abate, A. R., Chen, C. H., Agresti, J. J., Weitz, D. A. Beating Poisson encapsulation statistics using close-packed ordering. Lab on a Chip. 9 (18), 2628 (2009).
- Jain, A., Yang, A. H. J., Erickson, D. Gel-based optical waveguides with live cell encapsulation and integrated microfluidics. Optic Letters. 37 (9), 1472 (2012).
- Karbaschi, M., Shahi, P., Abate, A. R. Rapid chemical-free breaking of microfluidic emulsions with a hand-held antistatic gun. Biomicrofluidics. 11 (4), 1-6 (2017).
- Gole, J., et al. Massively parallel polymerase cloning and genome sequencing of single cells using nanoliter microwells. Nature Biotechnology. 31 (12), 1126-1132 (2013).
- Chao, Y., et al. Metagenomic analysis reveals significant changes of microbial compositions and protective functions during drinking water treatment. Scientific Reports. 3 (1), 3550 (2013).
- Fierer, N., et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes. Proceedings of the National Academy of Sciences of the United States of America. 109 (52), 21390-21395 (2012).
- Mande, S. S., Mohammed, M. H., Ghosh, T. S. Classification of metagenomic sequences: methods and challenges. Briefings in Bioinformatics. 13 (6), 669-681 (2012).
- Eastburn, D. J., et al. Microfluidic droplet enrichment for targeted sequencing. Nucleic Acids Research. 43 (13), e86 (2015).
- Clark, I. C., Abate, A. R. Finding a helix in a haystack: nucleic acid cytometry with droplet microfluidics. Lab on a Chip. 17 (12), 2032-2045 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon