Method Article
Antimicrobica caratterizzazione di materiali avanzati per applicazioni di Bioingegneria
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Vi presentiamo un protocollo per la caratterizzazione antimicrobica dei materiali avanzati. Qui, l'attività antimicrobica su superfici di materiale viene misurata dai due metodi che si completano a vicenda: uno si basa su test di diffusione del disco di agar, e l'altra è una procedura standard in base alla norma ISO 22196: 2007.
Abstract
Lo sviluppo di nuovi materiali avanzati con proprietà migliorate sta diventando sempre più importante in una vasta gamma di applicazioni di bioingegneria. Così, molti nuovi biomateriali sono stati progettati per simulare ambienti specifici richiesti per applicazioni biomediche quali ingegneria tissutale e somministrazione controllata. Lo sviluppo di materiali con proprietà migliorate per l'immobilizzazione di cellule o di enzimi è anche un argomento di ricerca corrente in ingegneria dei bioprocessi. Tuttavia, una delle proprietà più desiderabile di un materiale in queste applicazioni è la capacità antimicrobica per evitare eventuali infezioni indesiderate. Per questo, vi presentiamo facile da seguire protocolli per la caratterizzazione antimicrobica dei materiali basata (i) il test di diffusione disco agar (metodo di diffusione) e (ii) la norma ISO 22196: 2007 per misurare l'attività antimicrobica su superfici di materiale (contatto Metodo). Questo protocollo deve essere eseguito usando batteri Gram-positivi e Gram-negativi e lieviti per coprire un'ampia gamma di microrganismi. Ad esempio, 4 materiali con diversa natura chimica sono testati seguendo questo protocollo contro lo Staphylococcus aureus, Escherichia colie Candida albicans. I risultati di questi test mostrano attività non antimicrobico per il primo materiale e aumentando l'attività antibatterica contro i batteri Gram-positivi e Gram-negativi per gli altri 3 materiali. Tuttavia, nessuno dei 4 materiali sono in grado di inibire la crescita di Candida albicans.
Introduzione
Fallimento dell'impianto è spesso una conseguenza di infezioni microbiche che si verificano nonostante la profilassi antimicrobica e condizioni di lavoro asettico. Questo problema è causando costi sanitari molto elevati ed è angosciante tra pazienti1. Importanti batteri come Staphylococcus aureus sono attualmente considerati molto pericolosi agenti patogeni nelle infezioni nosocomial connesse con cateteri e altri impianti medici e sono i principali contaminanti di strumenti medici2. Di conseguenza, lo sviluppo di nuove strategie antimicrobiche è urgente per usi sia giornalieri che medicali.
Agenti antimicrobici includono antibiotici3, composti di ammonio quaternario4, ioni/ossidi metallici5e peptidi antimicrobici (amp)6. Gli antibiotici sono gradualmente sempre meno efficienti a causa della resistenza batterica7, che è in aumento a causa di un uso eccessivo di antibiotici8. Composti di ammonio quaternario sono solo molto efficienti per un uso a breve termine a causa della resistenza microbica9. Gli ioni/ossidi metallici sono stati a lungo utilizzati come agenti antimicrobici molto efficaci e sono utilizzati in molti prodotti commerciali comuni tra cui bende, filtri per l'acqua, vernici, ecc.10,11,12. Tuttavia, è stato dimostrato che questi tipi di composti possono essere tossici per alcuni tipi di cellule di mammifero13.
Amplificatori Visualizza eccellente antimicrobico e immunomodulatori proprietà14,15, e batteri sembrano trovare molto difficile sviluppare una resistenza contro di loro16. Tuttavia, il processo per produrre puro AMPs è costoso; di conseguenza, una produzione su larga scala non è praticabile. Quindi, strategie per contrastare i problemi nella produzione di amplificatori sono stati sviluppati (ad es., piccolo molecolare antibatterico peptoid imita17, peptoids18, α-peptidi19 e β-peptidi20). Polypeptoids e si è conclusa in metacrilato polipeptidi sono stati sintetizzati per rivestimenti antimicrobici e antivegetativa21.
Lo sviluppo di nuovi agenti antimicrobici quali materiali avanzati in puro o la forma ibrida, in grado di prevenire e curare le infezioni multidrug-resistente, è sempre più necessario. Una vasta gamma di nuovi materiali avanzati per molti campi di bioingegneria come tessuto e ingegneria di bioprocess sono stati sviluppati con proprietà chimiche e fisiche migliorate negli ultimi decenni attraverso diversi metodi: polimerizzazione al plasma innesto un substrato idrofobo22,23,24, sartoria di reticolazione densità25,26, polimerizzazione in soluzione27,28,29 , 30, porogen dissoluzione31,32e dall'incorporazione di nanomateriali quali grafene ossido (GO)33,34,35,36 e carbonio nanofibre (CNFs)37.
Lo studio della capacità antimicrobica di questi nuovi materiali potrebbe aumentare in modo esponenziale il loro potenziale applicabilità di Bioingegneria e ha, pertanto, diventano essenziale. Vi presentiamo un protocollo facile da seguire per quantificare l'attività antimicrobica di tali nuovi materiali avanzati. Qui, dopo la preparazione del campione, sono seguiti due metodi complementari: il primo si basa su agar diffusione test disco38 (metodo di diffusione) e la seconda si basa sulla norma ISO 22196: 200739 per misurare l'attività antimicrobica su superfici del materiale (metodo di contatto).
Protocollo
1. preparazione del campione
- Tagliare i campioni di materiale in dischi di diametro di 10 mm con un diametro di 10 mm punzone cilindrico.
Nota: Materiali fragili possono essere ammorbiditi in opportuni solventi sterile per 1 h e poi tagliarle a dischi. Ad esempio, materiali idrofili come alginato di zinco sono stati testati seguendo questo protocollo e sono stati inumiditi in acqua in autoclave prima di tagliare loro al fine di evitare la rottura del campione. Tuttavia, altri materiali idrofobi quali poly(3-hydroxybutyrate-co-3-hydroxyvalerate) non è necessario alcun tipo di gonfiore precedente al fine di essere opportunamente tagliati. - Asciugare i dischi di materiale campione a 60 ° C in un forno sottovuoto (< 10-2 Torr) per 24 h.
Nota: Alcuni materiali potrebbero essere necessario un'ad alta temperatura di essiccazione. Tuttavia, è importante non arrivare ad una temperatura che termicamente potrebbe degradare il materiale. - Misurare lo spessore di pellicola materiale con un calibro a corsoio digitale.
Nota: Questo protocollo consiglia l'utilizzo di materiale film con spessori costanti e simili quando si confrontano l'attività antimicrobica di materiali diversi. - Sterilizzare ogni campione mediante immersione in etanolo al 70% per 10 min e successive radiazioni ultraviolette (UV) per 1 h per ogni lato.
Nota: Radiazioni UV possono essere eseguita ponendo ogni campione in una piastra Petri sterile all'interno di una cappa a flusso laminare con una lampada W 12.0 di radiazioni UV-C.
Attenzione: I ricercatori dovrebbero non esporsi ai raggi UV, perché è mutageno. - Eseguire i passaggi 1.1, 1.2, 1.3 e 1.4. con i dischi di materiale di controllo.
Nota: Polietilene tereftalato (PET) o materiali non antimicrobico alternativi possono essere utilizzati come dischi di controllo nel metodo di diffusione e contatto. Inoltre, quando che caratterizzano nanocompositi o materiali trattati, il materiale di base deve essere utilizzato come materiale di controllo.
2. consigliati microrganismi
Nota: Si consiglia l'utilizzo di 3 diversi microrganismi per studiare la capacità antimicrobica del materiale testato contro una vasta gamma di microrganismi.
- Utilizzare colture pure di 3 microrganismi: i batteri Gram-positivi Staphylococcus aureus, i batteri gram-negativi Escherichia colie il lievito Candida albicans.
Nota: Altre specie di microorganismo può essere testato anche con questo protocollo modificando le condizioni di incubazione, se necessario.
Attenzione: Le misure di biosicurezza necessarie devono essere seguite in base al tipo di microrganismo impiegato in questo protocollo. - Lavorare con materiale pre-sterile o in autoclave e utilizzare un bruciatore di Bunsen durante l'intero processo di manipolazione microbica o un armadio di sicurezza biologica (se necessario) per garantire condizioni asettiche.
Nota: Condizioni di autoclave consigliati sono 121 ° C durante 15 min per coltura e 121 ° C durante 20 min per il materiale di lavoro e residui biologici.
3. Test di diffusione del disco agar (metodo di diffusione)
Nota: Quando una liquida diffusione di composti antimicrobici potrebbe essere il principale meccanismo antimicrobico di materiali avanzati, il metodo di diffusione può fornire informazioni molto utili circa la capacità antimicrobica di questi materiali. Il disco di materiale si trova al centro della piastra di agar possa formano una zona di anello trasparente (halo) dove un'inibizione della crescita dei microrganismi si verifica dopo 24 h di cultura (Vedi Figura 1).
-
Procedura di test di diffusione
- Preparare e autoclave tryptic soy agar (TSA) seguendo le istruzioni del produttore.
- Versare il TSA Petri sterili in condizioni asettiche con un becco Bunsen o cappa a flusso laminare.
Nota: Le piastre TSA devono essere 4 – 6 mm di spessore. - Coltura di microrganismi diversi da sottoporre a aerobicamente per 18 – 24 h nei piatti Petri con TSA in un incubatore a 37 ° C.
- Preparare e il brodo di soia triptico di autoclave (TSB) seguendo le istruzioni del produttore.
- Versarvi il TSB una provetta da centrifuga pre-sterilizzati 50 mL con una pipetta sierologica pre-sterilizzata in condizioni asettiche con un becco Bunsen o cappa a flusso laminare.
- Risospendere alcune colonie dal punto 3.1.3 in 25 mL di TSB contenute in una provetta sterile utilizzando un tampone di cotone sterile e vortex per 1 min ottenere una miscelazione uniforme.
- Regolare l'assorbanza (a 540 nm) della cultura con uno spettrofotometro per il numero adatto di unità formanti / mL Colonia (UFC): circa 1.5 x 108 UFC/mL per i batteri e da 1 x 106 a 5 x 106 CFU/mL per il lievito.
Nota: I volumi di cultura e cuvette per misurare l'assorbanza devono essere selezionati secondo il tipo di spettrofotometro utilizzato. - Vortice il brodo microbico per 5 secondi per migliorare la dispersione del microorganismo e brevemente immergere un tampone di cotone sterile in questa sospensione microbica. Rimuovere l'eccesso di liquido dal tampone premendolo contro la parete del tubo che contiene le impostazioni cultura.
- Striscia in modo uniforme la sospensione microbica brodo con il tampone di cotone sterile sulla superficie delle piastre TSA in 3 piani per coprire tutta la loro superficie con il microorganismo e lasciare asciugare per 5 min dopo l'inoculazione.
Nota: Per rimuovere eventuali tracce di umidità, le piastre TSA devono trovarsi aperte in posizione invertita a 37 ° C per 10 – 15 min prima dell'inoculazione. - Sterilizzare un paio di pinzette immergendole in un becher con etanolo al 96% e poi li fiammeggiante con un becco Bunsen o bruciatore ad alcool.
- Inserire i dischi di campione per essere testato e controllare il disco al centro delle piastre TSA utilizzando la coppia di pinzette sterili.
- Aerobicamente Incubare le piastre TSA in posizione invertita a 37 ° C per 24 h.
Nota: Per evitare qualsiasi rischio di contaminazione, si consiglia di incubare le piastre TSA in posizione invertita. Tuttavia, se il disco di campione si stacca dalle piastre TSA, non eseguire questo passaggio in posizione invertita. In questo caso, si raccomanda di asciugare le piastre nella cappa a flusso laminare. Questa prova antimicrobica deve essere eseguita almeno in quadriplicate in giorni diversi per garantire la riproducibilità.
-
Il controllo della purezza e della concentrazione di sospensione microbica
Nota: I passaggi seguenti sono necessari per verificare che la concentrazione microbica determinata con lo spettrofotometro nel passaggio 3.1.7 sia corretta e garantire che non c'era nessuna contaminazione microbica ambientale. Una contaminazione microbica ambientale possa essere facilmente individuata dalla comparsa di vari tipi di colonie microbiche dopo 24 h di cultura. Inoltre, nessuna contaminazione microbica del mezzo TSB durante la sua manipolazione nelle diluizioni seriali decimali deve essere garantita con una piastra di controllo TSB negativa.- Dispensare il TSB sterile (preparata al punto 3.1.4) in microcentrifuga sterile utilizzando una micropipetta con punte in autoclave adatti in condizioni asettiche. Uno di loro sarà utilizzato come controllo negativo TSB.
- Effettuare diluizioni seriali decimali con la sospensione microbica brodo utilizzata nel passaggio 3.1.9 nelle provette microcentrifuga sterile contenente TSB.
- 100 µ l di ciascuna diluizione su piastre TSA utilizzando una spatola Drigalski pre-sterilizzata o uno strumento alternativo di diffusione. Diffuse anche 100 μL del mezzo TSB senza microorganismo (preparata al punto 3.2.1) su una piastra TSA come una piastra di controllo TSB negativa.
- Aerobicamente Incubare le piastre TSA aerobicamente a 37 ° C per 24 h.
- Contare il numero di colonie per controllare che i CFU/mL sono simili a quella determinata nel passaggio 3.1.7.
- Verifica che non c'è nessuna contaminazione microbica ambientale sulle piastre TSA con un solo tipo di colonie.
- Verifica che non c'è nessuna contaminazione microbica sulla piastra di controllo negativo di TSB non mostrando nessun colonie
4. la valutazione dell'attività antimicrobica su superfici di materiale (metodo di contatto)
Nota: Quando la superficie di contatto potrebbe essere il principale meccanismo antimicrobico di alcuni materiali avanzati, il metodo di contatto può fornire informazioni molto utili circa la capacità antimicrobica di questi materiali. In questo metodo, i microrganismi sono collocati direttamente sulla superficie del materiale e la loro inibizione di crescita può essere determinato dopo un certo periodo di tempo.
-
Procedura iniziale
- Preparare ed autoclave TSB seguendo le istruzioni del produttore.
- Versarvi il TSB una provetta da centrifuga pre-sterilizzati 50 mL con una pipetta sierologica pre-sterilizzata in condizioni asettiche con un becco Bunsen o cappa a flusso laminare.
- Coltura di microrganismi diversi da sottoporre a aerobicamente pernottamento nel tubo con TSB in un agitatore orbitale (140 giri/min) a 37 ° C.
- Diluire la cultura pernottamento in 20 mL di TSB in una provetta da centrifuga pre-sterilizzati 50 mL ad una concentrazione di circa 106 CFU/mL (determinato con uno spettrofotometro a 540 nm).
Nota: I volumi di cultura e cuvette per misurare l'assorbanza devono essere selezionati secondo il tipo di spettrofotometro utilizzato. - Eseguire diluizioni decimali seriali di questa cultura in microcentrifuga sterile contenente TSB. Sviluppa 100 µ l della coltura su piastre di TSA e viene quindi incubato aerobicamente a 37 ° C per 24 h.
- Contare il numero di colonie per garantire una concentrazione di cellula iniziale di circa 1 x 106 CFU/mL
- Posto 4 dischi di controllo per la conta microbica dopo 24 h e 4 dischi di esempio di ogni tipo di materiali testati per la conta microbica dopo 24 h in separa dei pozzetti di una piastra a 48 pozzetti sterile.
- Dispensare 150 µ l della sospensione microbica su ciascuna superficie del disco.
-
Microbica contando sul controllo e materiali testati (dopo 24 h)
- Dopo passo 4.1.6, aerobicamente Incubare i 4 dischi di campione restanti nella piastra 48 pozzetti a 37 ° C per 24 h.
Nota: Questo tempo di incubazione di 24 ore può essere modificato al fine di studiare l'inibizione della crescita in tempi più brevi o più lunghi. - Dopo 24 h di incubazione, 850 µ l di PBS sterile sulla superficie dei 4 dischi campione e mescolarlo con il 150 µ l della sospensione microbica.
- Raccogliere la miscela di sospensione PBS/microbica e ogni disco dalla piastra 48 pozzetti e trasferirli in una provetta pre-sterilizzati da 10 mL.
- Vortice la miscela di sospensione PBS/microbica e ogni disco per 1 min, Sonicare esso a 50 Hz per 5 min e vortice ancora per 1 min assicurare che nessun microrganismi vitali rimangano aderì alla superficie del materiale.
- Eseguire diluizioni decimali seriali di ogni cultura lisati mediante in microcentrifuga sterile contenente TSB e diffondere 100 µ l della coltura su piastre di TSA e viene quindi incubato aerobicamente a 37 ° C per 24 h.
- Contare il numero di colonie, che sono il numero di microrganismi vitali su ogni superficie del disco campione e controllo. Esprimere questo numero di cellule vitali in (CFU/mL).
- Prendere una fotografia della coltura microbica finale per i dischi del campione e controllo.
- Dopo passo 4.1.6, aerobicamente Incubare i 4 dischi di campione restanti nella piastra 48 pozzetti a 37 ° C per 24 h.
5. antimicrobica Risultati analisi
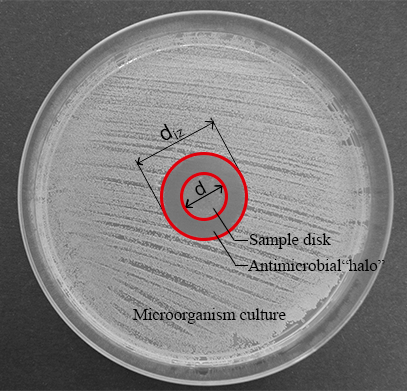
Figura 1: misure per la larghezza normalizzata dell'antimicrobico "halo". Questo pannello mostra il diametro della zona di inibizione (diz) e il diametro del disco (d). Clicca qui per visualizzare una versione più grande di questa figura.
-
Analisi dei risultati metodo di diffusione
- Misurare il diametro della zona di inibizione (diz) e il diametro del disco (d) (Vedi Figura 1) con un calibro a corsoio digitale.
Nota: L'inibizione zona o antimicrobico "alone" è formata come conseguenza l'inibizione della crescita microbica prodotto dal disco materiale antimicrobico (Vedi Figura 1). È possibile osservare che c'è una zona trasparente anello vicino il campione rispetto al resto della piastra dove i microrganismi cresciuti correttamente (zona opaco). - Determinare la larghezza normalizzata dell'antimicrobico "halo" (nwhalo) di ciascun disco applicando l'equazione (1).
(1)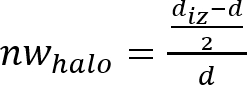
- Determinare la media e la deviazione standard della larghezza normalizzata dei valori nwhalo antimicrobica "alone" con 4 determinato di ciascun campione.
- Prendere una fotografia della coltura microbica finale con il disco di materiale.
Nota: Il diametro della zona di inibizione (diz) e il diametro del disco (d) può anche essere misurate dalla fotografia scattata al punto 5.1.4 utilizzando una software di elaborazione di immagini adatta.
- Misurare il diametro della zona di inibizione (diz) e il diametro del disco (d) (Vedi Figura 1) con un calibro a corsoio digitale.
-
Metodo di contatto Risultati analisi
- Determinare il numero di microrganismi vitali recuperate secondo l'equazione (2).
(2)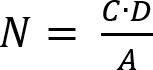
Nota: Qui, N è il numero di microrganismi vitali recuperato per cm2 al provino; C è il conteggio di piatto; D è il fattore di diluizione; A è l'area della superficie del provino in cm2 determinato con il diametro del disco del campione. - Determinare la perdita di attuabilità (LV) per riflettere l'inibizione della crescita delle cellule applicando l'equazione (3).
(3)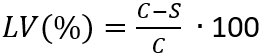
Nota: Qui, C è il numero medio di microrganismi vitali (N) in CFU/mL•cm2, recuperato agli esemplari di controllo dopo 24 h; S è il numero di microrganismi vitali (N) in CFU/mL•cm2, recuperato i campioni del test dopo 24 h. - Determinare la media e la deviazione standard della perdita di attuabilità con 4 valori determinati LV(%) di ciascun campione.
- Determinare il numero di microrganismi vitali recuperate secondo l'equazione (2).
Risultati
Questo protocollo è stato impiegato, ad esempio, per testare la capacità antimicrobica dei 4 materiali con diversa natura chimica contro i 3 consigliato microrganismi: Staphylococcus aureus, Escherichia colie Candida albicans . I risultati dei test di diffusione disco agar (metodo di diffusione) ha esibito l'attività non antimicrobico per il primo materiale (M1) come avvenuto nel disco di controllo (C, immagine non mostrato) e aumentando l'attività antibatterica contro batteri Gram-positivi e Gram-negativi batteri per gli altri materiali di 3 M2, M3 e M4 (Vedi Figura 2).
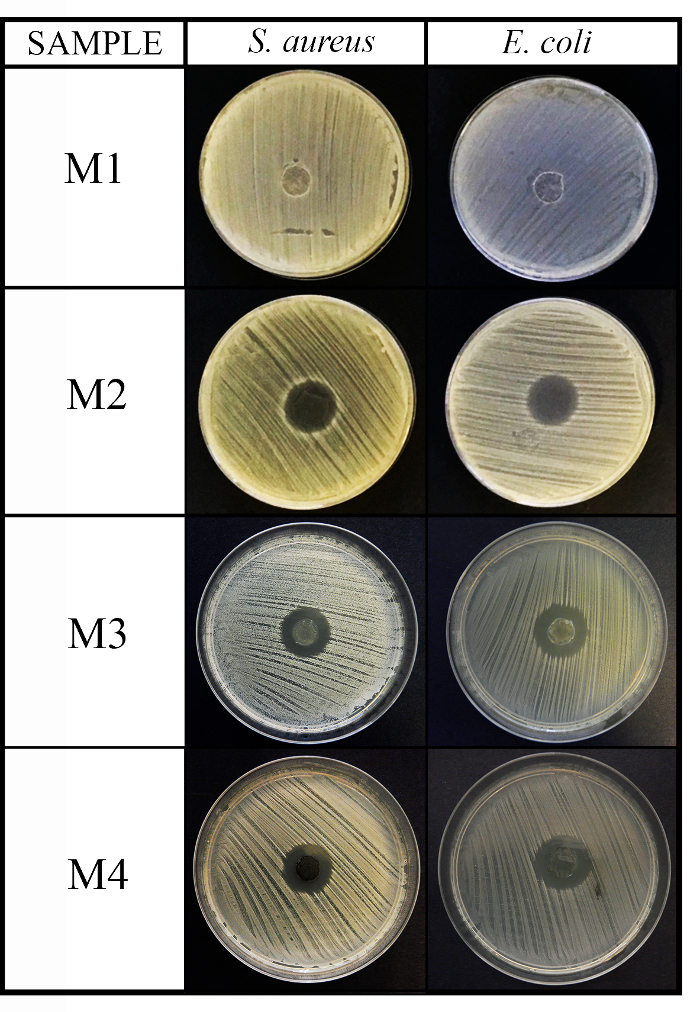
Figura 2: risultati del metodo di diffusione antimicrobica. Questo pannello mostra il metodo di diffusione antimicrobica per i 4 materiale (M1, M2, M3 e M4) dischi (diametro 10 mm x 1 mm di spessore) contro s. aureus ed Escherichia coli dopo 24 h di incubazione. Clicca qui per visualizzare una versione più grande di questa figura.
La figura 3 Mostra le diverse larghezze normalizzate dell'antimicrobico "halo" (nwhalo), per i materiali differenti esempio M1, M2, M3 e M4 contro i batteri Gram-positivi e Gram-negativi, calcolata con l'equazione (1). Tuttavia, nessuno dei 4 materiali erano in grado di inibire la crescita del lievito Candida albicans (immagini non mostrate).
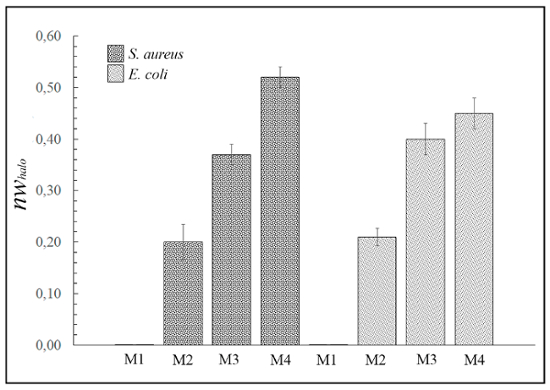
Figura 3: risultati di diffusione antimicrobica "halo". Questo pannello mostra il normalizzato "halo" (nwhalo) per ogni materiale (M1, M2, M3 e M4) disco (diametro 10 mm x 1 mm di spessore) contro s. aureus ed Escherichia coli dopo 24 h di incubazione. Le differenze sono statisticamente significative (p < 0,01). Tuttavia, esempio M1 hanno esibito alcuna attività antimicrobica. Clicca qui per visualizzare una versione più grande di questa figura.
I risultati del metodo di contatto anche esposto non antimicrobico attività per il primo materiale (M1), come avvenuto nel controllo disco (C) e la crescente attività antibatterica contro Gram-positivi e batteri gram-negativi per gli altri 3 materiali (Vedi Figura 4).

Figura 4: antimicrobica contattare risultati metodo. Questo pannello mostra le piastre rispettivi 90 mm 4 materiale (M1, M2, M3 e M4) superficie attività antimicrobica dell'analisi di secondo la ISO 22196: 2007 dopo 24 h di incubazione per S. aureus ed Escherichia coli (fattore di diluizione di 10-4). C è i batteri vitali ha recuperati dal disco di controllo dopo 24 h di incubazione. Clicca qui per visualizzare una versione più grande di questa figura.
La perdita di attuabilità (%) è stata determinata dall'equazione (2) e (3) come indicato nel presente protocollo (Vedi Figura 5).
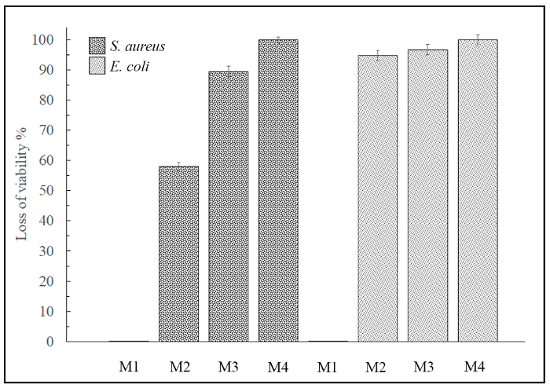
Figura 5: perdita di attuabilità di metodo di contatto. Questo pannello mostra la perdita di attuabilità (%) per M1, M2, M3 e M4 contro lo Staphylococcus aureus ed Escherichia coli sulla superficie del materiale. M1 campione non esposto alcuna attività antimicrobica. Clicca qui per visualizzare una versione più grande di questa figura.
Tuttavia, nessuno dei 4 materiali erano in grado di inibire la crescita del lievito Candida albicans dal metodo di contatto sia (immagini non mostrati). Di conseguenza, 3 di questi 4 materiali avanzati hanno mostrato risultati positivi antimicrobiche contro batteri Gram-positivi e Gram-negativi e quindi potrebbe essere molto utile per molte applicazioni di Bioingegneria con requisiti di alta attività antibatterica. Tuttavia, nessuno dei 4 materiali erano in grado di inibire la crescita del lievito.
Discussione
L'attività antimicrobica dei nuovi materiali avanzati possa essere analizzato dal presente protocollo facile da seguire che consiste di 2 procedure complementari basate su 2 metodi esistenti: la diffusione del disco di agar test38 e l'attività antimicrobica misurata su superfici del materiale secondo la ISO 22196: 2007 norma39.
In questo campo di ricerca, molte delle prove antimicrobiche segnalate nella letteratura sono altamente dipendenti dal dosaggio. Pertanto, è molto importante avere precise e coerenti protocolli in luogo attraverso laboratori. Questo articolo è un passo in quella direzione. Inoltre, esso potrebbe essere molto utile per molti ricercatori che sono meno esperti in questo campo e richiedono approfondite, passo dopo passo le procedure da seguire per ottenere risultati accurati.
Questo protocollo può essere usato con molti tipi di materiali tagliati in forme di disco del diametro di 10 mm. Materiali fragili possono essere gonfiati in un solvente adatto per 1 h rendere più facile il processo di taglio. Così, materiali idrofili quali alginati possono essere idratate in acqua distillata in autoclave. Altri solventi, quali etanolo, chetone, diclorometano e possono essere impiegati a gonfiarsi materiali idrofobi per 1 h prima di tagliarli. Tuttavia, non è necessario che alcuni materiali come poly(3-hydroxybutyrate-co-3-hydroxyvalerate) essere gonfio e possono essere tagliate direttamente. Dopo di che, è molto importante asciugare i dischi di materiale campione in un forno sottovuoto e sterilizzare ogni esemplare con etanolo e raggi UV per 1 h per evitare qualsiasi rischio di contaminazione.
Questo protocollo raccomanda TSA e TSB come terreni di coltura e l'uso di colture pure di 3 microrganismi per raggiungere un'ampia gamma di microrganismi: i batteri Gram-positivi Staphylococcus aureus, i batteri gram-negativi Escherichia coli, e il lievito Candida albicans. Tuttavia, media alternativi di cultura e altri microrganismi che hanno bisogno di condizioni di incubazione diversi potrebbero essere usati anche con questo protocollo. A volte, solo 1 microorganismo è testato per avere un'idea iniziale dell'attività antimicrobica di un nuovo materiale.
I materiali mostrando forte attività antimicrobica contro i consigliati 3 diversi tipi di microrganismi devono essere testati anche contro gli agenti patogeni antibiotico-resistenti come meticillina-resistente Staphylococcus epidermidis (MRSE), che sono stati utilizzati con successo con questo protocollo. Altri importanti microrganismi farmaco-resistenti che sono causa di molta preoccupazione sono i gram-positivi meticillino-resistente Staphylococcus aureus (MRSA) e vancomicina-resistenti enterococchi (VRE) e il gram-negativi Pseudomonas aeruginosa40,41.
Inibizione di biofilm e l'attività antimicrobica dei materiali contro altri tipi di microrganismi come virus e parassiti non possono essere testati con questo protocollo. Tuttavia, questo protocollo fornisce un punto di partenza molto utile per uno studio antimicrobico di un nuovo materiale avanzato.
Nel test di diffusione disco antimicrobico agar, un passaggio critico si verifica quando il disco campione deve essere posto al centro della piastra perché alcuni materiali piegare appena contatto con i media di agar. In questo caso, è consigliabile utilizzare una coppia sterile di pinzette per spiegare accuratamente il campione. D'altra parte, nel metodo di contatto, è fondamentale per il controllo di lavare e dischi di campione molto bene con PBS pipettando li quattro volte seguita da una vigorosa agitazione e sonicazione per non garantire che nessun microrganismi vitali rimangono aderiti al materiale superficie.
Questo video protocollo può essere utilizzato in molte applicazioni di bioingegneria, quali ingegneria dei bioprocessi, ingegneria tissutale, controllata di farmaci, materiali da imballaggio, trattamento delle acque reflue e l'agricoltura, che utilizzare biomateriali con un altamente capacità antimicrobica desiderabile.
I risultati ottenuti con questo protocollo sono qualitativi (le immagini) e quantitativa (la larghezza normalizzata di antibatterico "halo" e la perdita di attuabilità) con una buona analisi della sua riproducibilità (media ± deviazione standard). Quando si confrontano diversi materiali, questi valori medi ottenuti con l'analisi di risultati metodo di diffusione e contatto devono essere analizzati da One-way ANOVA, seguita da analisi post hoc, della Turchia, al fine di studiare se essi sono, statisticamente, significativamente differenti (p < 0,01).
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori si desidera ringraziare la Universidad Católica de Valencia San Vicente Mártir per il supporto finanziario per questo lavoro attraverso la 001UCV-231-2017 e 2018-231-001UCV concede.
Materiali
| Name | Company | Catalog Number | Comments |
| Cylindrical punch | 10 mm diameter | ||
| Petri dishes | soria genlab | P101 | 90 mm diameter, sterile |
| Tryptic soy agar (TSA) | Liofilchem | 610052 | Dehydrated medium 500 g (powder) |
| Tryptic soy broth (TSB) | Liofilchem | 610053 | Dehydrated medium 500 g (powder) |
| Sterile cotton swab | EUTOTUBO | 300200 | |
| Centrifuge tubes | VIDRA FOC, SA | 429900 | 50 mL, sterile |
| Ethanol | VWR | 83813360 | Absolute ethanol |
| Sterile 48-wells plate | COSTAR | 3548 | Flat bottom with lid, tissue culture treated, non-pyrogenic, polystyrene |
| A pair of tweezers | BRAUN | 24612036 | Toothless |
| Sterile phosphate buffered saline (PBS). | VWR | E404-100TAPBS | |
| Vaccum oven with a connected vacuum pump | JP Selecta, SA | 5900620 | |
| Laminar flow hood | TELSTAR Technologies, SL | TELSTAR AH-100 | 12.0 W lamp of UV-C radiation |
| Class II Biological safety cabinet | LABOGENE | MARS 1200 | |
| Incubator | ASTEC CO, LTD | SCA-165DR | |
| Vortex mixer | Biosan | V-1 Plus | |
| Spectrophotometer | Macherey-Nagel, Germany | Nanocolor UV/VIS II | |
| Bunsen burner | JP Selecta, SA | 7001539 | |
| Alcohol burner | VIDRA FOC, SA | 1658/20 | In case sterilisation is necessary to be performed inside class II biological safety cabinet |
| Orbital shaker | sartorius stedim | 8864845 | |
| Sonicator | SELECTA | 3000617 | 50/60 Hz |
| Digital calliper | ACHA | 17-260 | 0-150 mm |
| Serological pipette | Fisherbrand | 13-678-11 | 25 mL, sterile |
| Serological pipette | VWR | 612-4950 | 5 mL, sterile |
| Serological pipette | VWR | 612-5541 | 10 mL, sterile |
| Micropipette | GILSON | FA10005P | Pipetman L P200L, plastic 20-200 µL |
| Micropipette | GILSON | F123602 | Pipetman P1000, 200-1000 µL |
| Micropipette | GILSON | FA10016 | Pipetman L P12X300L, 20-300 µL |
| Micropipette tips | LABBOX | TIBP-200-960 | 2-200 µL |
| Micropipette tips | LABBOX | TIBP-1K0-480 | 100-1000 µL |
| Pre-sterilized tube | INSULAB | 301402 | 10 mL |
| Photo camera | Canon EOS 5D | Any camera with high resolution can also be utilized | |
| Gram-positive bacteria Staphylococcus aureus | strain V329 | Cucarella et al. J Bacteriol 183 (9), 2888–2896 (2001) | |
| Gram-negative bacteria Escherichia coli | Colección Española de Cultivos Tipo CECT | CECT 101 | |
| Yeast Candida albicans | Colección Española de Cultivos Tipo CECT | CECT 1394 | |
| Microcentrifuge tubes | DASLAB | 175508 | 1,5 mL |
| Autoclave | JP Selecta, SA | 4002136 | |
| Spectrophotometer-cuvettes | UVAT Bio CB | F-0902-02 | 4,5 mL |
| Drigalski spatula | LABBOX | SPRP-L05-1K0 | Sterile, disposable |
| glass balls (2 mm diameter) | Hecht Karl | 1401/2 | Autoclavable, alternative device to the Drigalski spatula |
| Autoclave bags | DELTALAB | 200318 | To sterilize microbiological residues or contaminated material |
| Electronic pipette filling device | JetPip | JET BIOFIL | |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-100-010 | 100 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-250-010 | 250 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-500-010 | 500 mL, for autoclaving culture media |
| Laboratory bottle with ISO thread, graduated, borosilicate 3.3 | LABBOX | SBG3-1K0-010 | 1000 mL, for autoclaving culture media |
| Latex gloves | DENIA | 2278000000 | |
| Indicator tape for sterilization | LABBOX | STAP-A55-001 | Self-adhesive tape with impregnated paper turning to colour when exposed to sterilization process. |
| Universal test tube rack | LABBOX | MTSP-001-001 | To hold centrifuge tubes |
| Microcentrifuge tube rack | VWR | 211-0210 | To hold microcentrifuge tubes |
| Sterile loop | ACEFE S.A. | 100140055 | 10 µL of capacity for microbial culture |
| Material M1 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 1 | |
| Material M2 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 2 | |
| Material M3 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type3 | |
| Material M4 | Universidad Católica de Valencia San Vicente Mártir (UCV) | Material type 4 | |
| Material C | Universidad Católica de Valencia San Vicente Mártir (UCV) | Control material |
Riferimenti
- Sydnor, E. R. M., Perl, T. M. Hospital epidemiology and infection control in acute-care settings. Clin Microbiol Rev. 24 (1), 141-173 (2011).
- Chessa, D., et al. Staphylococcus aureus and Staphylococcus epidermidis Virulence Strains as Causative Agents of Persistent Infections in Breast Implants. PLoS One. 11 (1), e0146668 (2016).
- Pandey, H., Parashar, V., Parashar, R., Prakash, R., Ramteke, P. W., Pandey, A. C. Controlled drug release characteristics and enhanced antibacterial effect of graphene nanosheets containing gentamicin sulfate. Nanoscale. 3 (10), 4104 (2011).
- Jia, Z., Shen, D., Xu, W. Synthesis and antibacterial activities of quaternary ammonium salt of chitosan. Carbohydr Res. 333 (1), 1-6 (2001).
- Liu, Y., Wang, X., Yang, F., Yang, X. Excellent antimicrobial properties of mesoporous anatase TiO2 and Ag/TiO2 composite films. Microporous Mesoporous Mater. 114 (1-3), 431-439 (2008).
- Wang, L., Chen, J., Shi, L., Shi, Z., Ren, L., Wang, Y. The promotion of antimicrobial activity on silicon substrates using a "click" immobilized short peptide. Chem Commun (Camb). 50 (8), 975-977 (2014).
- Kümmerer, K. Resistance in the environment. J Antimicrob Chemother. 54 (2), 311-320 (2004).
- Ng, V. W. L., et al. Antimicrobial hydrogels: A new weapon in the arsenal against multidrug-resistant infections. Adv Drug Deliv Rev. 78, 46-62 (2014).
- Hegstad, K., Langsrud, S., Lunestad, B. T., Scheie, A. A., Sunde, M., Yazdankhah, S. P. Does the Wide Use of Quaternary Ammonium Compounds Enhance the Selection and Spread of Antimicrobial Resistance and Thus Threaten Our Health?. Microb Drug Resist. 16 (2), 91-104 (2010).
- Rana, D., Matsuura, T. Surface modifications for antifouling membranes. Chem Rev. 110 (4), 2448-2471 (2010).
- Lok, C. N., et al. Proteomic analysis of the mode of antibacterial action of silver nanoparticles. J Proteome Res. 5 (4), 916-924 (2006).
- Chen, X., Schluesener, H. J. Nanosilver: A nanoproduct in medical application. Toxicol Lett. 176 (1), 1-12 (2008).
- Ahamed, M., AlSalhi, M. S., Siddiqui, M. K. J. Silver nanoparticle applications and human health. Clin Chim Acta. 411 (23-24), 1841-1848 (2010).
- Yeaman, M. R. Mechanisms of Antimicrobial Peptide Action and Resistance. Pharmacol Rev. 55 (1), 27-55 (2003).
- McLean, D. T. F., Lundy, F. T., Timson, D. J. IQ-motif peptides as novel anti-microbial agents. Biochimie. 95 (4), 875-880 (2013).
- Brogden, K. A. Antimicrobial peptides: Pore formers or metabolic inhibitors in bacteria?. Nat Rev Microbiol. 3 (3), 238-250 (2005).
- Ghosh, C., et al. Small molecular antibacterial peptoid mimics: The simpler the better!. J Med Chem. 57 (4), 1428-1436 (2014).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proc Natl Acad Sci. 105 (8), 2794-2799 (2008).
- Chen, Y., Mant, C. T., Farmer, S. W., Hancock, R. E. W., Vasil, M. L., Hodges, R. S. Rational design of alpha-helical antimicrobial peptides with enhanced activities and specificity/therapeutic index. J Biol Chem. 280 (13), 12316-12329 (2005).
- Porter, E. A., Wang, X., Lee, H. S., Weisblum, B., Gellman, S. H. Non-haemolytic beta-aminoacid oligomers. Nature. 404 (6778), 565 (2000).
- Gao, Q., Li, P., Zhao, H., Chen, Y., Jiang, L., Ma, P. X. Methacrylate-ended Polypeptides and Polypeptoids for Antimicrobial and Antifouling Coatings. Polym Chem. 8 (41), 6386-6397 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Gómez-Ribelles, J. L., Monleón-Pradas, M., Vidaurre-Garayo, A., Suay-Antón, J. Characterisation of macroporous poly(methyl methacrylate) coated with plasma-polymerised poly(2-hydroxyethyl acrylate). Eur Polym J. 43 (10), 4552-4564 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Plasma-induced polymerisation of hydrophilic coatings onto macroporous hydrophobic scaffolds. Polymer (Guildf). 48 (7), 2071-2078 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L., Rault, J. Thermal analysis of water in reinforced plasma-polymerised poly(2-hydroxyethyl acrylate) hydrogels. Eur Polym J. 72, 523-534 (2015).
- Monleón-Pradas, M., Gómez-Ribelles, J. L., Serrano-Aroca, &. #. 1. 9. 3. ;., Gallego-Ferrer, G., SuayAntón, J., Pissis, P. Interaction between water and polymer chains in poly(hydroxyethyl acrylate) hydrogels. Colloid Polym Sci. 279 (4), 323-330 (2001).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Effect of crosslinking on porous poly(methyl methacrylate) produced by phase separation. Colloid Polym Sci. 286 (2), 209-216 (2008).
- Monleón-Pradas, M., Gómez-Ribelles, J. L., Serrano-Aroca, &. #. 1. 9. 3. ;., Gallego Ferrer, G., Suay Antón, J., Pissis, P. Porous poly (2-hydroxyethyl acrylate) hydrogels. Polymer (Guildf). 42 (10), 4667-4674 (2001).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Monleón-Pradas, M., Gómez-Ribelles, J. L. Macroporous poly(methyl methacrylate) produced by phase separation during polymerisation in solution. Colloid Polym Sci. 285 (7), 753-760 (2007).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Llorens-Gámez, M. Dynamic mechanical analysis and water vapour sorption of highly porous poly(methyl methacrylate). Polymer (Guildf). 125, 58-65 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Campillo-Fernández, A. J., Gómez-Ribelles, J. L., Monleón-Pradas, M., Gallego-Ferrer, G., Pissis, P. Porous poly(2-hydroxyethyl acrylate) hydrogels prepared by radical polymerisation with methanol as diluent. Polymer (Guildf). 45 (26), 8949-8955 (2004).
- Rodríguez-Hernández, J. C., Serrano-Aroca, &. #. 1. 9. 3. ;., Gómez-Ribelles, J. L., Monleón-Pradas, M. Three-dimensional nanocomposite scaffolds with ordered cylindrical orthogonal pores. J Biomed Mater Res - Part B: Appl Biomater. 84 (2), 541-549 (2008).
- Brígido-Diego, R., et al. Acrylic scaffolds with interconnected spherical pores and controlled hydrophilicity for tissue engineering. J Mater Sci Mater Med. 40 (18), 4881-4887 (2005).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Ruiz-Pividal, J. F., Llorens-Gámez, M. Enhancement of water diffusion and compression performance of crosslinked alginate with a minuscule amount of graphene oxide. Sci Rep. 7, 11684 (2017).
- Serrano-Aroca, &. #. 1. 9. 3. ;., Deb, S. Synthesis of irregular graphene oxide tubes using green chemistry and their potential use as reinforcement materials for biomedical applications. PLoS One. 12 (9), e0185235 (2017).
- Sánchez-Correa, F., Vidaurre-Agut, C., Serrano-Aroca, A., Campillo-Fernández, A. J. Poly(2-hydroxyethyl acrylate) hydrogels reinforced with graphene oxide: Remarkable improvement of water diffusion and mechanical properties. J Appl Polym Sci. , (2018).
- Serrano-Aroc, &. #. 1. 9. 3. ;., Iskandar, L., Deb, S. Green synthetic routes to alginate-graphene oxide composite hydrogels with enhanced physical properties for bioengineering applications. Eur Polym J. 103, 198-206 (2018).
- Llorens-Gámez, M., Serrano-Aroca, &. #. 1. 9. 3. ;. Low-Cost Advanced Hydrogels of Calcium Alginate/Carbon Nanofibers with Enhanced Water Diffusion and Compression Properties. Polymers (Basel). 10 (4), 405 (2018).
- Bauer, A. W., Kirby, W. M. M., Sherris, J. C., Turck, A. M. Antibiotic susceptibility testing by a standardized single disk method. A J Clin Pathol. 45, 493-496 (1966).
- . . ISO Specification 22196: measurement of antibacterial activity on plastics surfaces. , 584 (2007).
- Taubes, G. The bacteria fight back. Science. 321 (5887), 356-361 (2008).
- Boucher, H. W., et al. 10 x '20 progress--development of new drugs active against Gram-negative bacilli: an update from the infectious diseases society of America. Clinical Infectious Diseases. 56 (12), 1685-1694 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon