Method Article
Analisi della funzione Beta-cellulare usando la formazione immagine del calcio cella singola risoluzione in Zebrafish isolotti
In questo articolo
Riepilogo
Funzionalità beta-cellula è importante per l'omeostasi del glucosio nel sangue, che viene valutato a cella singola risoluzione utilizzando un reporter codificato geneticamente per afflusso del calcio.
Abstract
Beta-cellule pancreatiche rispondono all'aumento delle concentrazioni di glucosio nel sangue che secerne l'ormone insulina. La disfunzione delle cellule beta porta a iperglicemia e conseguenze gravi, pericolo di vita. Comprendere come le beta-cellule operano in condizioni fisiologiche e quali fattori genetici ed ambientali potrebbero causare loro disfunzione potrebbe portare a migliori opzioni di trattamento per i pazienti diabetici. La capacità di misurare i livelli del calcio in cellule beta serve come un importante indicatore della funzione beta-cellulare, come l'afflusso di calcio ioni Trigger rilascio di insulina. Qui descriviamo un protocollo per il monitoraggio l'afflusso di calcio glucosio-stimolata in zebrafish beta-cellule utilizzando GCaMP6s, un sensore codificato geneticamente di calcio. Il metodo consente di monitorare le dinamiche del calcio intracellulare con risoluzione di singole cellule in isolotti ex vivo montato. La glucosio-risposta delle cellule beta entro l'isolotto stesso possa essere catturata contemporaneamente sotto le concentrazioni di glucosio differenti, che suggerisce la presenza di eterogeneità funzionale tra zebrafish beta-cellule. Inoltre, la tecnica fornisce alta risoluzione temporale e spaziale, che rivela la natura oscillatoria dell'afflusso del calcio su stimolo del glucosio. Il nostro approccio apre le porte per utilizzare zebrafish come modello per studiare il contributo di fattori genetici ed ambientali alla funzione beta-cellulare e disfunzione.
Introduzione
La nostra glicemia è mantenuta in un intervallo ristretto, in gran parte dovuto la funzione del pancreas endocrino. Il ruolo endocrino del pancreas è eseguito da degli isolotti di Langerhans, che contengono cellule disecrezione. Il beta-cellule secernenti insulina sono responsabili della riduzione dei livelli di glucosio nel sangue dopo un pasto contenente carboidrati. Secrezione di insulina insufficiente da beta-cellula può causare diabete1, che è caratterizzato da glicemia alta sostenuta. Tipo 1 e diabete di tipo 2, che attualmente affligge più di 400 milioni di persone nel mondo, conduce alla morbosità ed alla mortalità2. Indagando i fattori molecolari e ambientali che contribuiscono alla disfunzione beta-cellulare, comprenderemo meglio come diabete di tipo 2 inizia e progredisce. Inoltre, la capacità di differenziare cellule staminali umane in beta-cellule funzionali in vitro può fornire una fonte di nuove cellule beta per le terapie di sostituzione cellulare nel diabete di tipo 1. A tal fine, è importante studiare la funzione beta-cellulare e la maturazione in organismi modello genetico al fine di acquisire le conoscenze necessarie per rendere funzionale beta-cellule in un piatto.
Funzionalità delle cellule beta può essere monitorato a livello di intero-isolotto di quantificare la quantità totale di insulina secernuta in risposta a stimolazione del glucosio. Questo approccio cumulativo studia l'isolotto come un singolo gruppo di cellule senza differenziare le singole proprietà di una cella. Tuttavia, l'analisi delle risposte del glucosio delle cellule beta individuali ha rivelato una diversità nelle proprietà funzionali delle cellule beta e la presenza di eterogeneità3. Per valutare la funzione delle beta-cellule individuali, è possibile monitorare i cambiamenti intracellulari che portano alla secrezione di insulina4. La secrezione dell'insulina è preceduta da un'entrata del glucosio nelle cellule beta. Il glucosio che entra nelle cellule beta viene rapidamente metabolizzato all'ATP. Più alte concentrazioni di ATP intracellulare diminuiscono la probabilità aperta di canali di ioni del potassio ATP-sensibili che portano alla depolarizzazione della cellula beta. Depolarizzazione apre i canali ionici voltaggio-dipendenti del calcio e aumenta il calcio intracellulare. A sua volta, calcio innesca l'esocitosi di insulina, che viene rilasciato nella circolazione e abbassa i livelli di glucosio promuovendo l'utilizzazione del glucosio5,6,7.
Diverse strategie sono state applicate per studiare la funzione delle cellule beta, tra cui monitoraggio del potenziale di membrana8, visualizzazione diretta di insulina-vescicole esocitosi9e la quantificazione di intracellulare di Ca2 + afflusso come proxy per glucosio-reattività10. Fra loro, la formazione immagine del intracellulare di Ca2 + offre il vantaggio di upscaling l'analisi a più celle individuali all'interno stesso dell'isolotto11,12, consentendo per un confronto diretto della glucosio-responsività tra beta-cellule individuali. Concentrazione intracellulare di Ca2 + possa essere monitorata utilizzando coloranti fluorescenti sensibili al calcio13 o geneticamente codificato calcio indicatori (GECIs)14. Considerando che il calcio-indicatore coloranti mancanza cellula-tipo specificità, GECIs può essere espressa in uno specifico tipo cellulare di promotori specifici. Inoltre, la nuova generazione di GECIs, come GCaMP6, fornisce il migliore rapporto segnale-rumore insieme più veloce dinamica temporale15. Qui descriviamo l'utilità della nuovo-generazione di GECIs, in particolare GCaMP6s, visualizzare calcio in cellule beta a cella singola risoluzione. Applichiamo questo metodo fino all'isolotto di zebrafish primario come il nostro modello di scelta. Durante lo sviluppo embrionale, beta-cellule nell'isolotto primaria provengono da dorsale e ventrale del pancreas boccioli16. L'isolotto primario si trova in una posizione anatomica stereotipata all'interno del pancreas di zebrafish, consentendo la facile identificazione e isolamento. Beta-cellule nell'isolotto primaria sono necessari per la regolazione del glucosio, come loro ablazione genetica conduce a iperglicemia17,18. Inoltre, queste cellule beta diventano glucosio-reattiva durante i primi zebrafish sviluppo19. Questo protocollo può essere applicato anche per gli isolotti secondari, che si formano durante le fasi di post-embrionale di imaging. Il protocollo permette di immagine beta-cellule ex vivo, alle successive fasi di sviluppo e sotto le concentrazioni di glucosio definiti.
Protocollo
Tutte le procedure tra cui animali soggetti sono state approvate dall'Animal Welfare Act e con permesso della Landesdirektion Sachsen, Germania (AZ 24 – 9168.11-1/2013-14, T12/2016).
1. preparazione
Nota: Questo protocollo è per l'ex vivo imaging di zebrafish isolotto primario da doppi transgenici Tg (ins:nls-Renilla-mKO2; cryaa:CFP); TG (ins:GCaMP6s; cryaa:mCherry) 19 zebrafish. In questa linea transgenica, il promotore di insulina (ins) unità espressione specifica della cellula beta di due transgeni: nls-Renilla-mKO2, che segna il nucleo delle cellule beta con monomerico Kusabira orange 2 (mKO2) fluorescenza; e GCaMP6s15, che emette fluorescenza verde in risposta all'aumento dei livelli di calcio intracellulare. L'espressione della beta-cellula-specifico di GCaMP6s permette di studiare la reattività del glucosio delle cellule beta senza interferenze dalla variazione del calcio che circondano i tipi delle cellule.
- Preparare il brodo di fibrinogeno fresco (10 mg/mL) sciogliendo 10 mg di fibrinogeno bovino in 1 mL di Ca2 +/Mg2 +-contenente soluzione salina bilanciata Hanks' (HBSS) in una provetta da centrifuga da 1,5 mL. Vortice energicamente fino a quando la polvere di fibrinogeno si dissolve completamente. Mantenere la soluzione a temperatura ambiente per almeno 15 minuti di più.
Nota: Lo stock può essere mantenuto a temperatura ambiente per 2 – 3 h. scartare il brodo se la soluzione inizia a polimerizzare e diventa viscosa. - Preparare la soluzione di lavoro di fibrinogeno (3,3 mg/mL) diluendo il brodo di fibrinogeno triplice in HBSS. Per esempio, mix 300 µ l di brodo di fibrinogeno in 600 µ l di HBSS per preparare 900 µ l di soluzione di lavoro di fibrinogeno.
- Preparare la soluzione di trombina (10 U/mL) sciogliendo 10 unità di trombina in 1 mL di HBSS o fosfato tampone salino (PBS).
Nota: Questa soluzione può essere preparata in anticipo, aliquotata in 50 parti di µ l e congelata a-20 ° C. - Preparare 200 mM D-glucosio soluzione sciogliendo 1,8 g di D-glucosio in 50 mL di acqua. Conservare a 4 ° C per la conservazione a lungo termine.
- Preparare 300 mM KCl soluzione sciogliendo 1,1 g di KCl in 50 mL di acqua. Conservare a 4 ° C per la conservazione a lungo termine.
- Procurare piatti con fondo di vetro di diametro 35 mm per gli isolotti di montaggio.
- Per dissezione e montaggio dell'isolotto, utilizzare un microscopio stereo dotato di Lampada fluorescenza e filtro rosso cubo (TRITC: eccitazione: 532 – 554 nm, emissione: 570 – 613 nm; o Texas-rosso: eccitazione: 540-580 nm, emissione: 592 – 667 nm).
- Per l'imaging l'afflusso di calcio nelle cellule beta, uso un microscopio confocale invertito (Zeiss LSM 780 o simili) con 20 X (0,8 NA) aria obiettivo e dotato di un porta targa per i piatti con fondo di vetro di diametro 35 mm.
- Preparare una soluzione di 200 mg/L di solfonato di tricaina metano (MS222) per eutanasia zebrafish.
- Procurare piastre di Petri di 90 mm per la dissezione di zebrafish.
2. Zebrafish primaria dell'isolotto dissezione e montaggio
- Eutanasia di un pesce tramite incubazione prolungata in MS222. Per questo, delicatamente togliere il pesce dal serbatoio di pesce utilizzando una rete da pesca e viene quindi incubato in una piastra Petri contenente la soluzione di MS222 fino a quando l'animale non mostra nessun movimento opercular (branchie); in genere, questo prende 5 minuti trasferimento il pesce a una piastra Petri contenente la soluzione HBSS con Ca2 +/Mg2 +.
-
Microscopio stereo dotato di una lampada a fluorescenza e cubo di filtro rosso, sezionare la pelle che copre il lato destro dell'addome dell'animale per isolare il pancreas.
- Per questo, tagliare la pelle di zebrafish dalla bocca alla pinna anale utilizzando pinze taglienti. Togliere la pelle tagliata per esporre l'addome; Questa cattura espone gli organi interni. Usando la fluorescenza rossa di mKO2 espressione in cellule beta, accertare la posizione degli isolotti da esame visivo sotto il microscopio. Se necessario, rimuovere i lobi del fegato, come essi potrebbero coprire l'isolotto, che lo rende difficile da trovare.
Nota: L'isolotto primario si trova nei pressi della regione anteriore dell'addome, in genere sul lato destro.
- Per questo, tagliare la pelle di zebrafish dalla bocca alla pinna anale utilizzando pinze taglienti. Togliere la pelle tagliata per esporre l'addome; Questa cattura espone gli organi interni. Usando la fluorescenza rossa di mKO2 espressione in cellule beta, accertare la posizione degli isolotti da esame visivo sotto il microscopio. Se necessario, rimuovere i lobi del fegato, come essi potrebbero coprire l'isolotto, che lo rende difficile da trovare.
- Pulire l'isolotto primario rimuovendo accuratamente il tessuto circostante come fegato e adipociti. Prendere precauzioni per non ferire o poke l'isolotto; dopo l'eliminazione del tessuto circostante, le singole celle sulla superficie dell'isolotto diventano percepibile.
- Dispensare una goccia di 30 µ l di HBSS al centro di un piatto fondo di vetro. Trasferire l'isolotto dissecata questo calo.
- Lavare accuratamente l'isolotto una volta con HBSS e una volta con 30 µ l di soluzione di lavoro di fibrinogeno (3,3 mg/mL). Assicurati di evitare l'essiccazione dell'isolotto durante le fasi di lavaggio, perché in caso contrario si traduce nella morte delle cellule.
- Lentamente e delicatamente aggiungere 10 µ l di soluzione di trombina (10 U/mL). Lasciare intatta per 15 – 20 min. osservare che la goccia di fibrinogeno-trombina diventerà viscoso e leggermente opaco a questo punto l'isolotto e il piatto.
3. Ex Vivo Live-imaging di intensità di fluorescenza di GCaMP in Zebrafish primaria isolotti
- Aggiungere 200 µ l di HBSS sopra lo stampo e mettete il piatto con attenzione sul supporto piastra del microscopio confocale. Utilizzare un obiettivo di aria X, 0,8 NA, 20 per l'imaging confocale. Individuare l'isolotto utilizzando l'opzione di campo chiaro.
- Utilizzo del filtro per fluorescenza rossa per visualizzare la fluorescenza di mKO2 nucleare in cellule beta, concentrarsi sull'isolotto. Diversi nuclei devono essere chiaramente visibili.
- Individuare un chiaro piano di imaging modificando manualmente il piano focale del microscopio confocale in modo da muoversi attraverso lo spessore dell'isolotto lungo l'asse z. Assicurarsi che il piano di formazione immagine contiene un numero sufficiente (50 – 100) delle beta-cellule per l'imaging e la luminosità della fluorescenza mKO2 nucleare è uniforme, soprattutto nel centro dell'isolotto.
- Impostare un'acquisizione sequenza fluorescenza GCaMP6s e mKO2 utilizzando le seguenti impostazioni nel Menu"Smart Setup": GCaMP6s, eccitazione: 488 nm, emissione: 500 – 555 nm, falso-colore: verde (Select "GFP"); mKO2, eccitazione: 561 nm (mCherry), emissione: 570-630 nm, falso-colore: rosso (selezionare "mCherry").
Nota: Con questa impostazione, il canale rosso Registra la posizione dei nuclei delle cellule beta, mentre il canale verde registrerà l'intensità di fluorescenza di GCaMP. - In modalità"acquisizione" impostare la risoluzione dell'immagine a 1.024 x 1.024 pixel, velocità a 10 e con una media di 1. Iniziato un continuo registrazione selezionando l'opzione per "Time-series", e impostando la "durata" per 500 cicli, con circa 2 s tempo di acquisizione per ogni frame.
Nota: I primi 50 fotogrammi della serie tempo corrispondono all'attività delle beta-cellule a concentrazione nel glucosio di 5 mM. Questa è la risposta della linea di base. Una risposta della cellula beta mostrerà inceratura e calante dell'intensità di fluorescenza verde con tempo. Abbiamo osservato che alcuni (1 – 5%) delle beta-cellule oscillano al glucosio di 5 mM. -
Tenere d'occhio il ciclo di formazione immagine. Dopo i primi 50 fotogrammi, aumentare la concentrazione di glucosio della soluzione circostante fino a 10 mM senza arrestare la registrazione.
- Senza perturbare l'acquisizione dell'immagine, delicatamente Pipettare 5 µ l della mM 200 D-glucosio soluzione sulla superficie del gel che tiene l'isolotto. Acquisire 150 fotogrammi al glucosio di 10 mM.
Nota: L'aumento della concentrazione di glucosio aumenterà il numero delle beta-cellule che subiscono le oscillazioni fluorescente GCaMP nel verde del canale. - Garantire che i nuclei delle cellule rimangono stabili durante il processo. Se l'isolotto è agitazione estesamente durante l'acquisizione e i nuclei sono in movimento fuori dal piano focale, scartare il campione (se necessario).
- Attendere un sufficiente periodo di tempo per attivare la polimerizzazione dello stampo del fibrinogeno-trombina al fine di garantire la stabilità dei campioni successivi.
- Senza perturbare l'acquisizione dell'immagine, delicatamente Pipettare 5 µ l della mM 200 D-glucosio soluzione sulla superficie del gel che tiene l'isolotto. Acquisire 150 fotogrammi al glucosio di 10 mM.
- A 200 fotogrammi, aumentare ulteriormente la concentrazione della soluzione a 20 mM pipettando delicatamente 10 µ l di 200mm soluzione di D-glucosio. Acquisire 150 fotogrammi per la concentrazione di 20 mM.
- Dopo 350 telai, depolarizzare l'isolotto con 30 mM di KCl. Per questo, aggiungere 20 µ l di soluzione di KCl riserva di 300 millimetri. In questa fase, osservare che le oscillazioni di fluorescenza GCaMP6s verranno interrompere e difficoltà ad alta intensità; beta-cellule che non hanno risposto al glucosio possono inoltre essere visualizzato un aumento nell'intensità di fluorescenza verde con l'aggiunta di KCL.
4. quantificazione degli GCaMP traccia di fluorescenza per Beta-cellule individuali
Nota: Per tracciare e quantificare le risposte delle beta-cellule individuali ai diversi livelli di glucosio, quantificare l'intensità di fluorescenza di GCaMP per l'intero periodo di formazione immagine. Quantificazione è effettuata al cellulare ad alta risoluzione. Per questo, è necessario utilizzare FIJI20 per estrarre i valori di intensità di fluorescenza GCaMP dalle immagini (punti 4.1-4.6) e software di foglio di calcolo o R21 per eseguire l'analisi (passaggi 4.8-4.9).
- Aprire il file di immagine in Figi utilizzando "LSM casella degli strumenti". Per questo, selezionare "Plugin | LSM Toolbox | Visualizzare la casella degli strumenti LSM". Nellacasella"LSM", fare clic su "Open LSM" e selezionare il file di immagine.
Nota: Per i formati non supportati da "LSM Toolbox", convertirli prima di tiff per analisi. - Estrarre le risposte delle cellule utilizzando lo strumento area di interesse (ROI) in FIJI. Aprire il "ROI Manager" nel menu "Analizza" sotto "Strumenti". Disegnare manualmente il ROI utilizzando lo "strumento di selezione poligono" situato nella barra degli strumenti.
- Disegnare il ROI nel canale del rosso in cui sono visibili i nuclei delle cellule beta. Selezionare il ROI tale che copre un'area che è più grande di nucleo di una cellula al fine di includere alcuni di citoplasma della cellula. Assicurarsi che la posizione di ROI è coerenza tra i fotogrammi e se necessario, regolare la posizione.
- Aggiungere il ROIs selezionato al "manager di ROI" cliccando sul pulsante "Aggiungi [t]". Selezionare e aggiungere più ROIs il ROI per l'ottenimento di dati su più celle.
- Successivamente, dal menu "Analizza", selezionare "Set di misurazioni". Selezionare "Densità integrata" per la specifica estrazione dell'intensità di fluorescenza totale all'interno dell'area.
- Spostare il canale verde contenente la fluorescenza di GCaMP e selezionare "Multi misura" in "Gestione ROI".
Nota: Ciò fornirà le misure di intensità per le cellule in tutto il tempo-serie. - Nel caso in cui la posizione di ROI deve essere regolata a causa del movimento dell'isolotto, compilare manualmente le misure di intensità in fotogrammi diversi. Copiare e incollare i valori in un foglio di calcolo separato.
- Ottenere il timestamp dei frame immagine da "LSM Toolbox". Uso "Applica timbri | Applica timbri t | Nome del file | Dump di file di testo"per ottenere il timestamp. Salvare i timestamp usando l'opzione "Salva come", o li copia nel foglio di lavoro.
- Al momento di compilare i valori di intensità per tutte le celle, è necessario eseguire l'analisi una cella alla volta o automaticamente (ad esempio, utilizzando le formule di Excel o R).
-
Analizzare le singole celle in due passaggi.
- Nel primo passaggio, calcolare l'intensità di fluorescenza sopra la linea di base. A tal fine, è necessario calcolare l'intensità di fluorescenza della linea di base (F0) come la media delle intensità di fluorescenza per i primi 50 fotogrammi (glucosio 5 mM). Quindi sottrarre la linea di base (F0) dall'intera serie temporale (F-F0).
Nota: alcune cellule possono mostrare chiare oscillazioni GCaMP sotto basale del glucosio, che in genere continuano a seguito di una stimolazione con concentrazioni più elevate. Per tali cellule, è solo possibile stimare F0 prendendo l'intensità media dei fotogrammi iniziali in cui le cellule hanno mostrato un calo in fluorescenza. - Nella seconda fase dell'analisi, è possibile ottenere l'intensità di fluorescenza GCaMP finale normalizzando l'intensità di fluorescenza.
Nota: Questo viene eseguito per rimuovere le differenze tra gli isolotti da diversi animali. Individuali degli isolotti visualizzare diversi livelli di emissione di fluorescenza su stimolo del glucosio. - Normalizzare l'intensità di fluorescenza dividendo con il più alto valore di intensità. Per questo, calcolare l'intensità di picco (Fmax – F0) e dividere i valori basali sottratto per intensità di picco per produrre l'intensità di fluorescenza GCaMP finale (F – F0) / (Fmax – F0).
- Nel primo passaggio, calcolare l'intensità di fluorescenza sopra la linea di base. A tal fine, è necessario calcolare l'intensità di fluorescenza della linea di base (F0) come la media delle intensità di fluorescenza per i primi 50 fotogrammi (glucosio 5 mM). Quindi sottrarre la linea di base (F0) dall'intera serie temporale (F-F0).
- Scartare le cellule che non presentano una variazione di intensità dopo stimolazione con KCl, come potrebbero essere integro o danneggiato.
- Per eseguire l'analisi (passaggi 4.9 – 4.10) in R, utilizzare lo script di R (plotcelltrace. R) fornito con questo manoscritto.
Risultati
Utilizzando il protocollo sopra descritto, sono state analizzate le risposte del glucosio delle cellule beta in un isolotto da un 45 giorni post-fertilizzazione (dpf) zebrafish. Per questo, l'isolotto primario è stato sezionato da un animale eutanasizzato e montato nello stampo fibrinogeno-trombina in un piatto fondo di vetro. L'isolotto è stato immerso in HBSS contenente glucosio di 5 mM. La concentrazione di glucosio è stata aumentata in modo graduale per 10 mM e 20 mM. Le risposte delle beta-cellule per l'aumento delle concentrazioni di glucosio sono state registrate. Infine, le cellule beta erano depolarizzate utilizzando 30 mM KCl (Figura 1). La depolarizzazione utilizzando KCl induce voce calcio in beta-cellule sane.
Utilizzando un software di analisi dati e FIJI, l'intensità di fluorescenza GCaMP6s delle beta-cellule individuali viene estratta e normalizzato (Figura 2). Come si vede dalla traccia di intensità di fluorescenza, beta-cellule individuali Visualizza oscillazioni a fluorescenza GCaMP6s su stimolo del glucosio, che si ferma su stimolo di KCl. La tecnica fornisce una risoluzione cellulare della glucosio-reattività di beta-cellula e una finestra nella loro funzionalità.
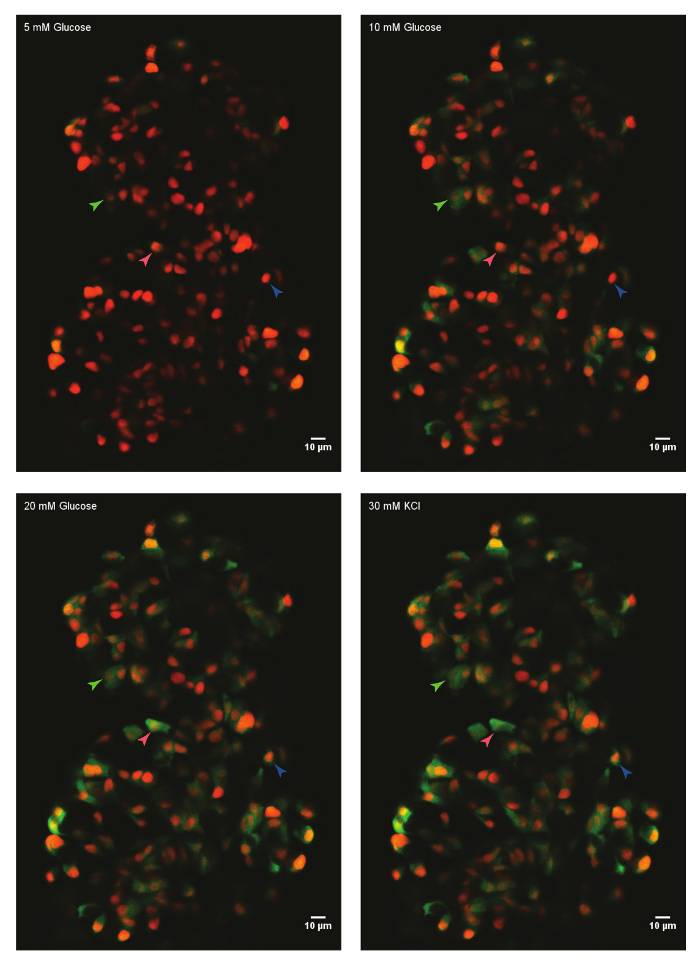
Figura 1: Ex vivo live-imaging di afflusso del calcio utilizzando GCaMP6s in zebrafish beta-cellule. Un isolotto primario da Tg(ins:nls-Renilla-mKO2); TG(ins:GCaMP6s) zebrafish (45 dpf) era montato in stampo di fibrinogeno-trombina e incubate con glucosio 5 mM (basale). Le cellule beta sono state etichettate con un pennarello rosso nucleare, mentre la fluorescenza di GCaMP6s è presente nel canale verde. L'isolotto è stato stimolato con una rampa di glucosio costituito da incubazione sequenza con 10 e 20 mM D-glucosio e depolarizzate tramite l'aggiunta di 30 mM che KCl. sagittarie contrassegno singole beta-cellule cui attività è stata analizzata. Clicca qui per visualizzare una versione più grande di questa figura.
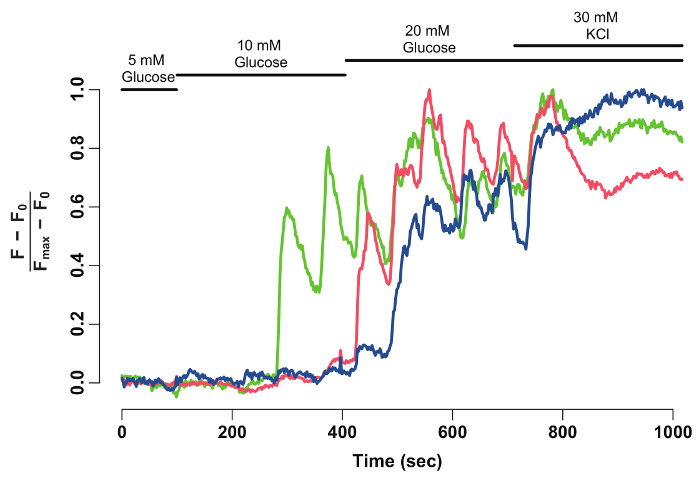
Figura 2: normalizzato GCaMP6s fluorescenza intensità-traccia per singole cellule beta. Normalizzato. GCaMP6s fluorescenza intensità-traccia per la beta-cellule contrassegnato con le frecce nella Figura 1. L'asse x indica il tempo in secondi. Nella parte superiore, bar raffigurano la concentrazione di glucosio e KCl nel medium HBSS. L'asse y indica l'intensità di fluorescenza normalizzata durante la serie temporale. Per questo, intensità della linea di base (F0) è calcolata come intensità media durante l'incubazione in glucosio di 5 mM. Questo viene sottratto da tutti i dati di serie temporali (F - F0). La previsione di intensità-over viene normalizzata dall'intensità massima visualizzato dalla cella (F - F0) / (Fmax- F0). La traccia normalizzata Mostra una risposta oscillatoria delle beta-cellule a glucosio, che si stabilizza quando le cellule sono depolarizzate con 30 mM KCl. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Qui dimostriamo una tecnica per la quantificazione-risposta delle cellule beta glucosio a cella singola risoluzione. Ciò è reso possibile da monitorare la concentrazione di calcio intracellulare utilizzando un indicatore di calcio geneticamente codificati, GCaMP6s. L'attività della beta-cellula è acquisito ex vivo montando l'isolotto in uno stampo di fibrinogeno-trombina. Un passaggio fondamentale del protocollo è la stabilità dello stampo. Tempo sufficiente deve essere dato per il fibrinogeno sciogliere nella soluzione di HBSS. Senza questo, la muffa non polimerizza sufficientemente per fornire la stabilità durante la sessione di imaging. Un isolotto montato in stampo di fibrinogeno-trombina e immersi in terreni di coltura delle cellule possa rimanere vitale per almeno una settimana (dati non mostrati). Alternative allo stampo di fibrinogeno-trombina, come dell'agarosi di basso-fusione, possono essere utilizzate per montare l' isolotto22. Un altro parametro critico è la dissezione dell'isolotto. Durante questo passaggio, il tessuto che circonda l'isolotto deve essere rimosso senza ferire o frugando l'isolotto. Una dissezione abile è dotato di pratica.
Una limitazione del protocollo imaging è la limitazione a un piano confocale dell'isolotto. Questo viene fatto per catturare le dinamiche di afflusso del calcio all'interno di singole cellule beta. Uno Z-stack attraverso l'intero spessore dell'isolotto conduce a bassa velocità e perdita di segnale oscillatorio da singole celle imaging. Questa limitazione potrebbe essere migliorata utilizzando mezzi più veloci di imaging confocale come microscopia di disco rotante, per consentire di catturare le dinamiche del calcio in 3 dimensioni. Un'altra frontiera sarebbe in vivo del calcio imaging12. La natura trasparente di embrione di pesce zebra o l'uso di ceppi di pigmento-meno di zebrafish adulti23 potrebbe aprire la possibilità per in vivo imaging in futuro.
L'imaging di attività della beta-cellula ad alta risoluzione spaziale e temporale consente di indagare l'eterogeneità funzionale tra beta-cellule individuali. Questo approccio può aiutare a far luce sull'esistenza di sub-popolazioni beta-cellula. Recentemente, diversi studi hanno dimostrato l'esistenza delle sottopopolazioni nelle dimensioni nominali omogenee beta-cellule24,25,26. Ex vivo imaging può essere combinato con reporter genetici per la caratterizzazione della risposta della sub-popolazione a glucosio. Inoltre, combinando il programma di installazione di imaging con stimolo farmacologico può consentire per screening di composti che potrebbero migliorare la funzionalità delle cellule beta.
In sintesi, la tecnica presentata qui permette la quantificazione e confronto tra la velocità di risposta del glucosio per beta-cellule individuali. Fornisce una finestra diretta nella funzionalità delle cellule beta, un parametro importante nello sviluppo del diabete.
Divulgazioni
Gli autori non dichiarano concorrenti interessi finanziari.
Riconoscimenti
Ringraziamo i membri del laboratorio Ninov per commenti sul manoscritto, membri del centro per strutture di pesce e microscopia di Dresda di terapie rigenerative (CRTD) per assistenza tecnica. N.N. è sostenuto da finanziamenti da DFG-CRTD, Cluster of Excellence di TU-Dresden, Fondazione di ricerca tedesca (DFG) e il centro tedesco per la ricerca di diabete (DZD).
Materiali
| Name | Company | Catalog Number | Comments |
| Transgenic Zebrafish line: Tg(ins:nls-Renilla-mKO2; cryaa:CFP); Tg(ins:GCaMP6s; cryaa:mCherry) | By request from authors | ||
| Stereo microscope | ZEISS | 495015-0001-000 | SteREO Discovery.V8 |
| Fluorescence lamp | ZEISS | 423013-9010-000 | Illuminator HXP 120 V |
| Red Filter Cube | ZEISS | 000000-1114-462 | Filter set 45 HQ TexasRed |
| Confocal Microscope | ZEISS | LSM 780 | |
| Bovine fibrinogen | Sigma | F8630 | |
| HBSS (Hanks' Balanced Salt solution) | ThermoFisher | 14025092 | |
| Thrombin | Sigma | T4648 | |
| D-Glucose | Sigma | G8270 | |
| KCl | Sigma | P9333 | |
| 35 mm diameter glass-bottom dishes | ThermoFisher | 150680 | |
| tricaine methane sulfonate | Sigma | E10521 | |
| Fine Forceps | Fine Science Tools | 11445-12 | |
| FIJI, using ImageJ Version: 2.0.0-rc-43/1.50e | https://fiji.sc/ | ||
| R, version 3.2.4 | https://www.r-project.org/ | ||
| RStudio | https://www.rstudio.com/ | ||
| plotcelltrace.R | A custom script provided with the manuscript |
Riferimenti
- Kahn, S. E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 46 (1), 3-19 (2003).
- Ogurtsova, K., et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 128, 40-50 (2017).
- Pipeleers, D. G. Heterogeneity in pancreatic beta-cell population. Diabetes. 41 (7), 777-781 (1992).
- MacDonald, P. E., Joseph, J. W., Rorsman, P. Glucose-sensing mechanisms in pancreatic beta-cells. Philos Trans R Soc Lond B Biol Sci. 360 (1464), 2211-2225 (2005).
- Hellman, B., et al. Glucose induces oscillatory Ca2+ signalling and insulin release in human pancreatic beta cells. Diabetologia. 37, S11-S20 (1994).
- Bergsten, P., Grapengiesser, E., Gylfe, E., Tengholm, A., Hellman, B. Synchronous oscillations of cytoplasmic Ca2+ and insulin release in glucose-stimulated pancreatic islets. J Biol Chem. 269 (12), 8749-8753 (1994).
- Wollheim, C. B., Pozzan, T. Correlation between cytosolic free Ca2+ and insulin release in an insulin-secreting cell line. J Biol Chem. 259 (4), 2262-2267 (1984).
- Pace, C. S., Price, S. Electrical responses of pancreatic islet cells to secretory stimuli. Biochem Biophys Res Commun. 46 (4), 1557-1563 (1972).
- Ohara-Imaizumi, M., Nakamichi, Y., Tanaka, T., Ishida, H., Nagamatsu, S. Imaging exocytosis of single insulin secretory granules with evanescent wave microscopy: distinct behavior of granule motion in biphasic insulin release. J Biol Chem. 277 (6), 3805-3808 (2002).
- Soria, B., Martin, F. Cytosolic calcium oscillations and insulin release in pancreatic islets of Langerhans. Diabetes Metab. 24 (1), 37-40 (1998).
- Kenty, J. H. R., Melton, D. A. Testing pancreatic islet function at the single cell level by calcium influx with associated marker expression. PLoS One. 10 (4), e0122044 (2015).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Bootman, M. D., Rietdorf, K., Collins, T., Walker, S., Sanderson, M. Ca2+-sensitive fluorescent dyes and intracellular Ca2+ imaging. Cold Spring Harb Protoc. 2013 (2), 83-99 (2013).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Hesselson, D., Anderson, R. M., Beinat, M., Stainier, D. Y. R. Distinct populations of quiescent and proliferative pancreatic beta-cells identified by HOTcre mediated labeling. Proc Natl Acad Sci U S A. 106 (35), 14896-14901 (2009).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. coli nitroreductase. Mech Dev. 124 (3), 218-229 (2007).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat Protoc. 3 (6), 948-954 (2008).
- Singh, S. P., et al. Different developmental histories of beta-cells generate functional and proliferative heterogeneity during islet growth. Nat Commun. 8 (1), 664 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676 (2012).
- R Core Team. . R: A Language and Environment for Statistical Computing. , (2016).
- Friedman, R. S., et al. An evolving autoimmune microenvironment regulates the quality of effector T cell restimulation and function. Proc Natl Acad Sci. 111 (25), 9223-9228 (2014).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Bader, E., et al. Identification of proliferative and mature β-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Dorrell, C., et al. Human islets contain four distinct subtypes of β cells. Nat Commun. 7, 11756 (2016).
- Johnston, N. R., et al. Beta Cell Hubs Dictate Pancreatic Islet Responses to Glucose. Cell Metab. 24 (3), 389-401 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon