È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fabbricando un rene corteccia extracellulare Matrix-derivato idrogel
In questo articolo
Riepilogo
Qui presentiamo un protocollo per fabbricare un rene corteccia extracellulare derivata matrice idrogel per mantenere la composizione strutturale e biochimica del rene nativo di matrice extracellulare (ECM). Il processo di fabbricazione e le sue applicazioni sono descritte. Infine, una prospettiva sull'utilizzo questo idrogel per supportare la bioingegneria e la rigenerazione cellulare e tessutale del rene-specifici è discussa.
Abstract
Matrice extracellulare (ECM) fornisce importanti segnali biochimici e biofisici per mantenere l'omeostasi del tessuto. Corrente idrogel sintetico offrono robusto supporto meccanico per in vitro colture cellulari ma manca la composizione proteica e ligando necessaria per suscitare fisiologico comportamento dalle cellule. Questo manoscritto descrive un metodo di fabbricazione per un rene corteccia ECM-derivato idrogel con adeguata robustezza meccanica e solidale composizione biochimica. L'idrogel è realizzato meccanicamente omogeneizzazione e solubilizzanti corteccia del rene umano decellularizzati ECM. La matrice mantiene rapporti di proteina di Natale del rene corteccia ECM consentendo anche gelificazione a rigidità meccanica fisiologica. L'idrogel funge da un substrato su cui rene cellule derivate da corteccia possono essere mantenute in condizioni fisiologiche. Inoltre, la composizione di idrogel possa essere manipolata per modellare un ambiente malato che consente lo studio futuro di malattie renali.
Introduzione
Matrice extracellulare (ECM) fornisce importanti segnali biochimici e biofisici per mantenere l'omeostasi del tessuto. La composizione molecolare complessa disciplina proprietà strutturali e funzionali del tessuto. Proteine strutturali forniscono cellule con consapevolezza spaziale e permettono di adesione e migrazione1. Associato ligandi interagiscono con recettori di superficie per controllare il comportamento di cella2. Rene ECM contiene una miriade di molecole la cui composizione e la struttura varia a seconda della posizione anatomica, fase inerente allo sviluppo e malattia stato3,4. Ricapitolando la complessità di ECM è un aspetto fondamentale nello Studio in vitrodi cellule derivate dal rene.
I precedenti tentativi di replicare microambienti ECM si sono concentrati sul tessuto decellularizing tutto per creare impalcature in grado di ricellularizzazione. Decellularizzazione è stata eseguita con detergenti chimici come sodio dodecil solfato (SDS) o detergenti non ionici, e utilizza sia organo intero aspersione o immersione e agitazione metodi5,6,7 ,8,9,10,11,12,13. I ponteggi presentati qui preservare gli spunti strutturali e biochimici trovati in tessuto nativo ECM; Inoltre, ricellularizzazione con cellule del donatore-specific ha rilevanza clinica in chirurgia ricostruttiva14,15,16,17,18, 19. Tuttavia, queste impalcature mancano di flessibilità strutturale e pertanto non sono compatibili con molti dispositivi a corrente utilizzati per gli studi in vitro . Per ovviare a questa limitazione, molti gruppi hanno ulteriormente elaborato decellularizzati ECM in idrogel20,21,22,23,24. Questi idrogeli sono compatibili con bioink e stampaggio ad iniezione ed eludere micrometro scala spaziale i vincoli che decellularized ponteggi posto sulle cellule. Inoltre, composizione molecolare e rapporti trovati in nativo ECM vengono mantenuti3,25. Qui dimostriamo un metodo per fabbricare un idrogel derivato dalla corteccia del rene ECM (kECM).
Lo scopo del presente protocollo è quello di produrre un idrogel che replica il microambiente della regione corticale del rene. Tessuto del rene corteccia è decellularized in una soluzione di SDS 1% sotto costante agitazione per rimuovere la materia cellulare. SDS è comunemente usato per decellularize del tessuto a causa della sua capacità di rimuovere rapidamente immunologici cellulari materiale6,7,9,26. Il kECM è quindi soggetto a omogeneizzazione meccanica e liofilizzazione5,6,9,11,26. Solubilizzazione in un acido forte con pepsina si traduce in un finale idrogel soluzione stock20,27. KECM nativo di proteine che sono importanti per strutturale supportano e segnale di trasduzione sono conservate3,25. L'idrogel può anche essere gelificato all'interno di un ordine di grandezza di Natale del rene umano corteccia28,29,30. Questa matrice fornisce un ambiente fisiologico che è stato utilizzato per mantenere la quiescenza delle cellule del rene-specifici rispetto a idrogeli da altre proteine della matrice. Inoltre, composizione di matrice possa essere manipolati, ad esempio, attraverso l'aggiunta di collagene-I, per ambienti di malattia di modello per lo studio della fibrosi renale ed altri malattie di rene31,32.
Protocollo
Reni umani sono stati isolati da LifeCenter Northwest seguendo linee guida etiche impostate per l'associazione delle organizzazioni di approvvigionamento dell'organo. Questo protocollo segue animale linee guida cultura cura e cella delineate dalla Università di Washington.
1. preparazione del tessuto del rene umano
- Preparazione della soluzione di decellularizzazione
- Sterilizzare un becher da mL 5000 e un ancoretta 70 x 10 mm.
- Mescolare 1: 1000 (peso: volume) sodio dodecil solfato (SDS) in acqua deionizzata in autoclave nel becher. Lasciare la soluzione su un piatto di mescolare a circa 200 rpm per 24 ore o fino a quando la SDS è completamente sciolto.
Nota: In genere, 2500 mL di soluzione 1% SDS è sufficiente per decellularize un singolo rene umano. - Trasferire la soluzione in un filtro vuoto sterile da 500 mL e filtrarlo in contenitori sigillabili sterilizzati.
- Elaborazione del tessuto del rene
- Lavaggio ed autoclave un paio di pinze, pinza emostatica due morsetti, un paio di forbici di grado di servizio generale, due manici per bisturi lama, un becher da 1000 mL coperto con foglio di alluminio e un ancoretta 36 x 9 mm.
- Una cappa di coltura del tessuto con underpad la linea. Posizionare il bicchiere, un piatto di sterili per coltura (150 x 25 mm) e l'organo intero rene nel cofano. Riempire il becher con 500 mL di soluzione 1% SDS.
Nota: I reni umani sono stati ricevuti sul ghiaccio da LifeCenter NorthWest. - Riporre il rene nel piatto sterile coltura tissutale (Figura 1A). Rimuovere tutto il grasso perirenale radendosi leggermente intorno alla capsula renale con un bisturi (Figura 1B).
- Fare un'incisione superficiale 8-10 cm con il bisturi, appena abbastanza in profondità per rompere la capsula renale senza danneggiare il tessuto sottostante di corteccia, attraverso l'estremità superiore del rene. Rimuovere la capsula renale da peeling lontano il tessuto di corteccia con due pinze pinza emostatica (Figura 1).
- Bisecare il rene lungo il piano corona utilizzando il bisturi lungo il lato laterale del rene (Figura 1). Isolare il tessuto di corteccia da entrambe le metà di ritagliarsi la regione midollare con il bisturi (Figura 1E) e tagliare a dadini il tessuto di corteccia in pezzi di cm 0,53 (Figura 1F). Rimuovere qualsiasi grandi vasi visibili.
- Isolamento della matrice extracellulare
- In una cappa di coltura del tessuto, riempire un bicchiere da 1000 mL con 500 mL di soluzione 1% SDS. Posizionare la barra di tessuto e mescolate a dadini corteccia nel becher contenente la soluzione di SDS. Coprire il becher con un foglio di alluminio in autoclave e metterlo su un piatto di mescolare a circa 400 giri esterno della cappa di coltura del tessuto.
- Dopo il tessuto di corteccia è stato sulla piastra stir per 24 h, portare il becher in un cappuccio di coltura del tessuto e aggiungere un filtro sterile cella 40 µm realizzato con maglia di nylon. Riempire un becher da mL 1000 separata con 200 mL di candeggina e collocarlo nella cappa di coltura del tessuto.
- Dispensare la soluzione SDS attraverso il filtro delle cellule nel becher contenente candeggina. Pipettare fuori tutta la soluzione SDS finché non solo tessuti decellularizzati e del filtro cella rimangono nel becher.
Nota: Il filtro cella deve evitare qualsiasi tessuto da essere rimosso durante l'aspirazione di soluzione. - Lasciare il filtro cella nel becher e riempire con 500 mL di soluzione fresca di SDS. Coprire il becher con la stessa carta stagnola e mettere in un piatto mescolare alla stessa velocità come prima.
- Ripetere i passaggi 1.3.1-1.3.3 ogni 24 ore con soluzione fresca di SDS per un totale di cinque giorni.
- Sciacquare il tessuto decellularizzato con autoclave DI acqua ogni 24 ore, per un totale di 3 giorni, seguendo la tecnica descritta nella procedura 1.3.1-1.3.3.
- Sciacquare decellularizzato tessuto con acqua di grado di cultura cellulare ogni 24 h per totale di 2 giorni, seguendo la tecnica descritta nella procedura 1.3.1-1.3.3.
- Ripetere i passaggi 1.3.1-1.3.2. Trasferire il tessuto decellularizzato (denominato kECM da questo punto in su) in un 30 mL self standing e tubo conico e riempirlo con acqua di grado di cultura cellulare fino a quando tutto il tessuto è sommerso.
2. fabbricazione di soluzione Stock di idrogel
- Lavorazione meccanica del tessuto decellularizzato
- In una cappa di coltura del tessuto, omogeneizzare meccanicamente il kECM all'interno del tubo conico con un omogeneizzatore del tessuto per 2 min.
Nota: KECM omogeneizzato dovrebbe assomigliare ad una soluzione opaca senza le parti visibili di ECM. - Immergere il tubo conico contenente il kECM in azoto liquido fino a quando non è più bollente che circonda il tubo persiste. Conservare il kECM a-4 ˚ c durante la notte.
- In una cappa di coltura del tessuto, omogeneizzare meccanicamente il kECM all'interno del tubo conico con un omogeneizzatore del tessuto per 2 min.
- Liofilizzazione del tessuto congelato decellularizzato
- Allentare leggermente il tappo del tubo conico per consentire lo scambio di gas e posizionare il tubo in una macchina di liofilizzazione. Lyophilize la kECM per tre giorni o fino a che assomiglia ad una polvere bianca fine. Archivio a-4 ˚ c.
- Digestione chimica e solubilizzazione di gel
- Autoclave una fiala di scintillazione 20ml e tappo, un ancoretta 15,9 x 7,9 mm e un paio di belle-punta forcipe.
- Pesare il kECM liofilizzato e calcolare il volume di HCl e massa di pepsina necessaria per solubilizzare il kECM per una soluzione di 3% (30 mg/mL) utilizzando le seguenti equazioni, dove mpepsina è la massa di pepsina, tessuto di m è la massa del tessuto liofilizzato e VHCl è il volume di 0.01 N HCl:
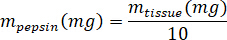
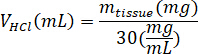
- In una cappa di coltura del tessuto, aggiungere l'ancoretta, 0.01 N HCl e pepsina gastrica suina nella fiala di scintillazione e lasciarlo su una zolla di mescolare a circa 500 giri/min fino a sciolta tutti la pepsina. Trasferire la kECM liofilizzato nel flaconcino di scintillazione e lasciare la soluzione su un piatto di mescolare a circa 500 giri/min per tre giorni.
3. idrogel gelificazione
- Preparazione di idrogel di rene ECM
- Gel l'idrogel mescolando la soluzione madre di idrogel di kECM con 1 N NaOH, 10 x Media supplemento (M199) e terreni di coltura delle cellule. Tenere tutte le soluzioni sul ghiaccio.
Nota: Le concentrazioni di gel finale di 7,5 mg/mL sono state utilizzate per la coltura cellulare. 1 mL di gel di kECM era sufficiente per esperimenti di coltura cellulare presentati. - Determinare il volume di lavorabile kECM gel prodotto e volume di stock kECM idrogel necessari utilizzando l'equazione seguente, dove Vfinale è il volume del gel creato, VkECM stock è il volume di idrogel di stock kECM necessario, Cstock kECM è la concentrazione dell'idrogel di stock kECM e Cfinale è la concentrazione del gel finale:
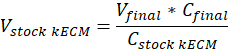
- Determinare il volume dei reagenti necessari utilizzando le seguenti equazioni, dove VNaOH è il volume di 1 N NaOH di neutralizzazione, V10 X è il volume di M199 supplemento 10 X media, e V1 X è la volume di terreno di coltura delle cellule:
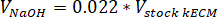
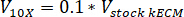
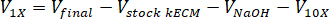
- In una cappa di coltura del tessuto, dispensare i reagenti neutralizzanti (NaOH, M199 e terreni di coltura delle cellule) in una sterile 30ml self standing e tubo conico. Miscelare la soluzione di reagente neutralizzante con un microspatula.
- Utilizzare una siringa sterile da 1 mL per trasferire il volume appropriato di stock kECM idrogel per la soluzione di reagente neutralizzante. Utilizzare un microspatula per miscelare la soluzione fino ad ottenuta un impasto omogeneo in soluzione di idrogel di colore.
Nota: Evitare di introdurre bolle d'aria mescolando lentamente e delicatamente. - Per incorporare le cellule nell'idrogel di kECM, sottrarre 10 µ l di terreno di coltura cellulare (V1 X) i calcoli di volume di soluzione neutralizzante nel passaggio 3.1.1.3.
- Sospendere le cellule in 10 µ l di terreno di coltura delle cellule. Determinare il numero di cellule in sospensione utilizzando l'equazione seguente, dove #cellule implica il numero delle cellule di sospendere efinale V è il volume del gel creato:
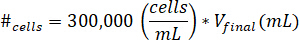
Nota: 300.000 cellule/mL è la concentrazione di celle utilizzate nel gel kECM. - Pipettare i 10 µ l di soluzione di cella sospesa in gel kECM finale dopo la soluzione di riserva di kECM è stata mescolata con soluzione di reagente neutralizzante. Agitare la soluzione con un microspatula fino a quando le cellule sono distribuite uniformemente.
- Sospendere le cellule in 10 µ l di terreno di coltura delle cellule. Determinare il numero di cellule in sospensione utilizzando l'equazione seguente, dove #cellule implica il numero delle cellule di sospendere efinale V è il volume del gel creato:
- Gel l'idrogel mescolando la soluzione madre di idrogel di kECM con 1 N NaOH, 10 x Media supplemento (M199) e terreni di coltura delle cellule. Tenere tutte le soluzioni sul ghiaccio.
- Utilizzare una siringa da 1 mL per riempire un cella desiderata cultura dispositivo con l'idrogel di kECM.
- Lasciare che il gel impostare a 37 ˚ c per 1 h prima di trasferire o cellule di placcatura.
Risultati
L'idrogel di kECM fornisce una matrice per la coltura delle cellule del rene con composizione chimica simile come il microambiente di Natale del rene. Per fabbricare l'idrogel, tessuto del rene corteccia è meccanicamente isolato da un organo rene intero e tagliato a dadini (Figura 1). Decellularizzati con un detersivo chimico (Figura 2A.1-a. 3) seguito da risciacqui con acqua per rimuovere le particelle di deter...
Discussione
Matrici di forniscono importanti indicazioni meccaniche e chimiche che governano il comportamento delle cellule. Idrogeli sintetici sono in grado di supportare complesse patterning 3-dimensionale, ma non riescono a fornire i diversi segnali extracellulari trovati in microambienti matrice fisiologica. Idrogel derivato dal nativo ECM sono materiali ideali per studi sia in vivo che in vitro . Precedenti studi hanno utilizzato decellularizzati ECM idrogeli per rivestire biomateriali sintetici per evitare
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori si desidera ringraziare la Lynn e Mike Garvey Imaging laboratorio presso l'Istituto per le cellule staminali e medicina rigenerativa e LifeCenter NorthWest. Vorrebbero anche riconoscere il sostegno finanziario di sovvenzioni National Institutes of Health, UH2/UH3 TR000504 (di J.H.) e DP2DK102258 (per Y.Z.), NIH T32 formazione grant DK0007467 (per R.J.N.) e un regalo senza restrizione dai centri nord-ovest del rene per la Istituto di ricerca del rene.
Materiali
| Name | Company | Catalog Number | Comments |
| Preparation of Kidney Tissue | |||
| 5000 mL Beaker | Sigma-Aldrich | Z740589 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma-Aldrich | 436143 | |
| Sterile H2O | Autoclaved DI H2O | ||
| Stir Bar (70 x 10 mm) | Fisher Science | 14-512-128 | |
| 500 mL Vacuum Filter | VWR | 97066-202 | |
| Stir Plate | Sigma-Aldrich | CLS6795420D | |
| 1000 mL Beaker | Sigma-Aldrich | CLS10031L | |
| Forceps | Sigma-Aldrich | F4642 | Any similar forceps may be used |
| Scissor-Handle Hemostat Clamp | Sigma-Aldrich | Z168866 | |
| Dissecting Scissors | Sigma-Aldrich | Z265977 | |
| Scalpel Handle, No. 4 | VWR | 25859-000 | Any similar scalpel handle may be used |
| Scalpel Blade, No. 20 | VWR | 25860-020 | Any similar scalpel blade may be used |
| Stir Bar (38.1 x 9.5 mm) | Fisher Science | 14-513-52 | |
| Absorbent Underpad | VWR | 82020-845 | |
| Petri Dish (150 x 25 mm) | Corning | 430597 | |
| Autoclavable Biohazard Bag | VWR | 14220-026 | |
| Sterile Cell Strainer (40 um) | Fisher Science | 22-363-547 | |
| Cell Culture Grade Water | HyClone | SH30529.03 | |
| 30 mL Freestanding Tube | VWR | 89012-778 | |
| Fabrication of ECM Gel | |||
| Tissue Homogenizer Machine | Polytron | PCU-20110 | |
| Freeze Dryer | Labconco | 7670520 | |
| 20 mL Glass Scintillation Vials and Cap | Sigma-Aldrich | V7130 | |
| Stir Bar (15.9 x 8 mm) | Fisher Science | 14-513-62 | |
| Pepsin from Porcine Gastric Mucosa | Sigma-Aldrich | P7012 | |
| 0.01 N HCl | Sigma-Aldrich | 320331 | Dilute to 0.01 N HCl with cell culuture water |
| Kidney ECM Gelation | |||
| 1 N NaOH (Sterile) | Sigma-Aldrich | 415413 | Dilute to 1 N in cell culture grade water |
| Medium 199 | Sigma-Aldrich | M4530 | |
| 15 mL Conical Tube | ThermoFisher | 339651 | |
| Cell Culture Media | ThermoFisher | 11330.032 | Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12) |
| Fetal Bovine Serum (FBS) | Gibco | 10082147 | |
| Antibiotic-Antimycotic 100X | Life Technologies | 15240-062 | |
| Insulin, Transferrin, Selenium, Sodium Pyruvate Solution (ITS-A) 100X | Life Technologies | 51300-044 | |
| 1 mL Syringe | Sigma-Aldrich | Z192325 | |
| Microspatula | Sigma-Aldrich | Z193208 |
Riferimenti
- Lelongt, B., Ronco, P. Role of extracellular matrix in kidney development and repair. Pediatric Nephrology. 18 (8), 731-742 (2003).
- Yue, B. Biology of the Extracellular Matrix: An Overview. Journal of Glaucoma. 23, S20-S23 (2014).
- Miner, J. H. Renal basement membrane components. Kidney International. 56 (6), 2016-2024 (1999).
- Petrosyan, A., et al. Decellularized Renal Matrix and Regenerative Medicine of the Kidney: A Different Point of View. Tissue Engineering Part B. 22 (3), 183-192 (2016).
- Caralt, M., et al. Optimization and Critical Evaluation of Decellularization Strategies to Develop Renal Extracellular Matrix Scaffolds as Biological Templates for Organ Engineering and Transplantation. American Journal of Transplantation. 15 (1), 64-75 (2015).
- Nakayama, K. H., Batchelder, C. A., Lee, C. I., Tarantal, A. F. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering. Tissue Engineering Part A. 16 (7), 2207-2216 (2010).
- Nakayama, K. H., Lee, C. C. I., Batchelder, C. A., Tarantal, A. F. Tissue Specificity of Decellularized Rhesus Monkey Kidney and Lung Scaffolds. Public Library of Science ONE. 8 (5), (2013).
- Orlando, G., et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations. Annals of Surgery. 256 (2), 363-370 (2012).
- Sullivan, D. C., et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials. 33 (31), 7756-7764 (2012).
- Choi, S. H., et al. Development of a porcine renal extracellular matrix scaffold as a platform for kidney regeneration. Journal of Biomedical Materials Research Part A. 103 (4), 1391-1403 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
- Nagao, R. J., et al. Decellularized Human Kidney Cortex Hydrogels Enhance Kidney Microvascular Endothelial Cell Maturation and Quiescence. Tissue Engineering Part A. 22 (19-20), 1140-1150 (2016).
- Gupta, S. K., Mishra, N. C., Dhasmana, A. Decellularization Methods for Scaffold Fabrication. Methods in Molecular Biology. , 1-10 (2017).
- Hudson, T., et al. Optimized Acellular Nerve Graft is Immunologically Tolerated and Supports Regeneration. Tissue Engineering. 10 (11), 1641-1651 (2004).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367 (9518), 1241-1246 (2006).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B., et al. Organ reengineering through development of a transplantable recellularied liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Nagao, R. J., et al. Preservation of Capillary-beds in Rat Lung Tissue Using Optimized Chemical Decellularization. Journal of Materials Chemistry B. 1 (37), 4801-4808 (2013).
- Song, J. J., et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine. 19 (5), 646-651 (2013).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29 (11), 1630-1637 (2008).
- Wolf, M. T., et al. A hydrogel derived from decellularized dermal extracellular matrix. Biomaterials. 33 (29), 7028-7038 (2012).
- Fisher, M. B., et al. Potential of healing a transected anterior cruciate ligament with genetically modified extracellular matrix bioscaffolds in a goat model. Knee Surgery, Sports Traumatology, Arthroscopy. 20 (7), 1357-1365 (2012).
- Ghuman, H., et al. ECM hydrogel for the treatment of stroke: Characterization of the host cell infiltrate. Biomaterials. 91, 166-181 (2016).
- Rijal, G. The decellularized extracellular matrix in regenerative medicine. Regenerative Medicine. 12 (5), 475-477 (2017).
- Lennon, R., et al. Global Analysis Reveals the Complexity of the Human Glomerular Extracellular Matrix. Journal of the American Society of Nephrology. 25 (5), 939-951 (2014).
- Bonandrini, B., et al. Recellularization of Well-Preserved Acellular Kidney Scaffold Using Embryonic Stem Cells. Tissue Engineering Part A. 20 (9-10), 1486-1498 (2014).
- O'Neill, J. D., Freytes, D. O., Anandappa, A. J., Oliver, J. A., Vunjak-Novakovic, G. V. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney. Biomaterials. 34 (38), 9830-9841 (2013).
- Streitberger, K. -. J., et al. High-resolution mechanical imaging of the kidney. Journal of Biomechanics. 47 (3), 639-644 (2014).
- Bensamoun, S. F., et al. Stiffness imaging of the kidney and adjacent abdominal tissues measured simultaneously using magnetic resonance elastography. Clinical Imaging. 35 (4), 284-287 (2011).
- Moon, S. K., et al. Quantification of Kidney Fibrosis Using Ultrasonic Shear Wave Elastography. Journal of Ultrasound in Medicine. 34, 869-877 (2015).
- Genovese, F., Manresa, A. A., Leeming, D. J., Karsdal, M. A., Boor, P. The extracellular matrix in the kidney: a source of novel non-invasive biomarkers of kidney fibrosis?. Fibrogenesis & Tissue Repair. 7 (1), (2014).
- Hewitson, T. D. Fibrosis in the kidney: is a problem shared a problem halved?. Fibrogenes & Tissue Repair. 5 (1), S14 (2012).
- Wolf, M. T., et al. Polypropylene surgical mesh coated with extracellular matrix mitigates the host foreign body response. Journal of Biomedical Materials Research Part A. 102 (1), 234-246 (2014).
- Faulk, D. M., et al. ECM hydrogel coating mitigates the chronic inflammatory response to polypropylene mesh. Biomaterials. 35 (30), 8585-8595 (2014).
- Jeffords, M. E., Wu, J., Shah, M., Hong, Y., Zhang, G. Tailoring Material Properties of Cardiac Matrix Hydrogels To Induce Endothelial Differentiation of Human Mesenchymal Stem Cells. ACS Applied Materials & Interfaces. 7 (20), 11053-11061 (2015).
- Kim, M. -. S., et al. Differential Expression of Extracellular Matrix and Adhesion Molecules in Fetal-Origin Amniotic Epithelial Cells of Preeclamptic Pregnancy. Public Library of Science ONE. 11 (5), e0156038 (2016).
- Paduano, F., Marrelli, M., White, L. J., Shakesheff, K. M., Tatullo, M. Odontogenic Differentiation of Human Dental Pulp Stem Cells on Hydrogel Scaffolds Derived from Decellularized Bone Extracellular Matrix and Collagen Type I. Public Library of Science ONE. 11 (2), e0148225 (2016).
- Viswanath, A., et al. Extracellular matrix-derived hydrogels for dental stem cell delivery. Journal of Biomedical Materials Research Part A. 105 (1), 319-328 (2017).
- Uriel, S., et al. Extraction and Assembly of Tissue-Derived Gels for Cell Culture and Tissue Engineering. Tissue Engineering Part C Methods. 15 (3), 309-321 (2009).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissues: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Faust, A., et al. Urinary bladder extracellular matrix hydrogels and matrix-bound vesicles differentially regulate central nervous system neuron viability and axon growth and branching. Journal of Biomaterials Applications. 31 (9), 1277-1295 (2017).
- Pouliot, R. A., et al. Development and characterization of a naturally derived lung extracellular matrix hydrogel. Journal of Biomedical Materials Research Part A. 104 (8), 1922-1935 (2016).
- Pati, F., et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 5, 3935 (2014).
- Pati, F., et al. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials. 62, 164-175 (2015).
- Wang, R. M., Christman, K. L. Decellularized myocardial matrix hydrogels: In basic research and preclinical studies. Advanced Drug Delivery Reviews. 96, 77-82 (2016).
- Jang, J., et al. 3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair. Biomaterials. 112, 264-274 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (Pt 24), 4195-4200 (2010).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nature Reviews Molecular Cell Biology. 15 (12), 771-785 (2014).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Hinderer, S., Layland, S. L., Schenke-Layland, K. ECM and ECM-like materials - Biomaterials for applications in regenerative medicine and cancer therapy. Advanced Drug Delivery Reviews. 97, 260-269 (2016).
- Uriel, S., et al. The role of adipose protein derived hydrogels in adipogenesis. Biomaterials. 29 (27), 3712-3719 (2008).
- Singelyn, J. M., et al. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30 (29), 5409-5416 (2009).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- Loneker, A. E., Faulk, D. M., Hussey, G. S., D'Amore, A., Badylak, S. F. Solubilized liver extracellular matrix maintains primary rat hepatocyte phenotype in-vitro. Journal of Biomedical Materials Research Part A. 104 (4), 957-965 (2016).
- Hill, R. C., Calle, E. A., Dzieciatkowska, M., Niklason, L. E., Hansen, K. C. Quantification of extracellular matrix proteins from a rat lung scaffold to provide a molecular readout for tissue engineering. Molecular & Cellular Proteomics. 14 (4), 961-973 (2015).
- Li, Q., et al. Proteomic analysis of naturally-sourced biological scaffolds. Biomaterials. 75, 37-46 (2016).
- Tanaka, T., Yada, R. Y. N-terminal portion acts as an initiator of the inactivation of pepsin at neutral pH. Protein Engineering. 14 (9), 669-674 (2001).
- Ligresti, G., et al. A Novel Three-Dimensional Human Peritubular Microvascular System. Journal of the American Society of Nephrology. 27 (8), 2370-2381 (2016).
- Mozes, M. M., Böttinger, E. P., Jacot, T. A., Kopp, J. B. Renal expression of fibrotic matrix proteins and of transforming growth factor-beta (TGF-beta) isoforms in TGF-beta transgenic mice. Journal of the American Society of Nephrology. 10 (2), 271-280 (1999).
- Romanowicz, L., Galewska, Z. Extracellular matrix remodeling of the umbilical cord in pre-eclampsia as a risk factor for fetal hypertension. Journal of Pregnancy. 2011, 542695 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon