Method Article
Uso di chip microfluidici plastica pre-assemblato per divisione in compartimenti neuroni primari murini
In questo articolo
Riepilogo
Questo protocollo descrive l'uso di chip di plastica per cultura e compartimenti stagni di neuroni primari murini. Questi chip sono preassemblati, facile da usare e compatibile con alta risoluzione, dal vivo e l'imaging di fluorescenza. Questo protocollo descrive come piastra di neuroni ippocampali di ratto all'interno di questi chip ed eseguire immunostaining, assotomia e fluidico isolamento.
Abstract
Metodi di microfabbricati a compartimenti stagni di neuroni sono diventati strumenti essenziali per molti neuroscienziati. Questo protocollo descrive l'uso di un chip di plastica pre-assemblato commercialmente disponibile per divisione in compartimenti neuroni hippocampal coltivati del ratto primario. Questi chip di plastica, contenuto all'interno l'impronta di un vetrino da microscopio standard, sono compatibili con alta risoluzione, live e l'imaging di fluorescenza. Questo protocollo viene illustrato come retrogrado neuroni etichetta tramite assoni isolati utilizzando un virus di rabbia modificate che codifica per una proteina fluorescente, creare microambienti isolati all'interno di uno scomparto ed eseguire assotomia e immunocitochimica su chip. I neuroni sono coltivati per > 3 settimane all'interno del chip di plastica, che illustra la compatibilità di questi chip per le culture di un neurone a lungo termine.
Introduzione
Cultura tradizionale neurone si avvicina risultato in conseguenza casuale degli assoni e dendriti, che impediscono lo studio dei neuroni nella loro specifica morfologia polarizzata. Multicomparto dispositivi microfabbricati sono diventati strumenti di ricerca ben definiti e ben utilizzato per i neuroscienziati negli ultimi 10-15 anni (pubblicazioni selezionate di alto profilo sono riferimento1,2,3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17). questi dispositivi compartimenti stagni di neuroni e fornire un metodo per fisicamente e chimicamente manipolare regioni subcellulare dei neuroni, tra cui somata, dendriti e assoni sinapsi18,19. Forniscono anche più paradigmi sperimentali che non sono possibili utilizzando casuale culture, compresi gli studi del trasporto assonale, sintesi proteica assonale, lesioni/rigenerazione dell'assone e segnalazione di assone-a-soma. La configurazione di base 2-vano è costituito da due canali microfluidici parallele separate da una serie di più piccoli Microscanalature perpendicolare. Neuroni primari o derivati da cellule staminali sono placcati in uno dei canali microfluidici, stabilirsi e attaccare alla superficie inferiore del dispositivo ed estendere i neurites nel corso dei giorni. Molti coni di crescita trovano la loro strada in Microscanalature, che sono abbastanza piccoli che impediscono i corpi cellulari di entrare. Poiché i coni di crescita sono fisicamente limitato e in grado di girare intorno all'interno le Microscanalature, crescono direttamente nel vano adiacente (vano assonale) dove essi sono isolati.
Storicamente, questi dispositivi sono stati modellati utilizzando poly(dimethylsiloxane) (PDMS) da uno stampo master photolithographically fantasia e sono fatti in casa, nei laboratori degli investigatori o acquistati in commercio. Uno dei principali svantaggi dell'utilizzo di PDMS è sua idrofobicità20. PDMS può essere fatta idrofila temporaneamente, ma poi rapidamente diventa idrofobo entro ore in un ambiente non acquoso20. Per questo motivo, i dispositivi devono essere collegati a un coprioggetto in vetro o altro substrato adatto al momento dell'uso. Pre-assemblati chip di plastica vari compartimenti sono ora disponibili in commercio (ad esempio, XonaChips) in materiale plastico stampato ad iniezione. Questi chip sono realizzati permanentemente idrofilici, semplificando la bagnatura del dispositivo e che permette il pre-assemblaggio del chip con un sottile film di copolimero ciclico delle olefine (COC) che racchiude i canali microfluidici sul fondo. Questi chip sono fabbricati in una plastica otticamente trasparente adatto per l'imaging di fluorescenza ad alta risoluzione.
Lo scopo del presente protocollo è per illustrare l'utilizzo dei chip microfluidici plastica pre-assemblato per più paradigmi sperimentali eseguite utilizzando murini neuroni hippocampal o corticali. Questo protocollo descrive come retrogrado neuroni etichetta utilizzando un virus di rabbia modificate all'interno del chip. Sono descritte anche assotomia per gli studi di lesione assonale e la rigenerazione. Infine, questo protocollo viene illustrato come eseguire immunocolorazione fluorescenza con il dispositivo.
Protocollo
Nota: Un disegno schematico del chip multicomparto plastica è mostrato in Figura 1A, B. Il chip è la dimensione di un vetrino da microscopio standard (75 mm x 25 mm). Le caratteristiche del chip, tra cui canali principali o compartimenti, pozzi e Microscanalature sono etichettate e sono fornite per riferimento futuro. Figura 1 è una fotografia del chip dimostrando l'isolamento fluidico dei compartimenti.
1. preparazione e verniciatura dei chip multicomparto
- In un armadietto di bio-sicurezza, inserire il chip in una capsula di Petri o altro contenitore sterile adatto.
- Aggiungere 100 µ l di pre-rivestimento soluzione al pozzo del chip di sinistra superiore e permettono di fluire attraverso il canale principale in adiacente bene.
Nota: La soluzione di pre-rivestimento è utilizzata per pre-rivestire i canali microfluidici per eliminare il potenziale per intrappolare bolle d'aria all'interno del chip. - Riempire l'inferiore sinistro bene con 100 µ l di soluzione di preadesivo. Aspettare 5 minuti per consentire la soluzione di fluire attraverso le Microscanalature.
- Aggiungere 100 µ l di pre-rivestimento soluzione alla tomaia bene e permettono di fluire attraverso il canale principale in adiacente bene. Riempire il pozzetto di destro inferiore con 100 µ l di soluzione di preadesivo.
- Aspirare la soluzione da ogni pozzetto. Aspirare dai canali principali per evitare di rimuovere il liquido dai canali principali (Figura 2A). Aggiungere immediatamente ben 150 µ l di tampone fosfato salino (PBS) in alto a sinistra. Attendere 1,5 min.
Attenzione: Non aspirare tutto il liquido dai principali canali chiusi. - Aggiungere 150 µ l PBS in basso a sinistra. Attendere 5 min per liquido di fluire attraverso le Microscanalature. Aggiungere 150 µ l PBS alla tomaia proprio bene. Aggiungere 150 µ l PBS per abbassare il proprio bene. Aspettare 10 min.
- Ripetere i passaggi da 1.5-1.6 per un secondo lavaggio con PBS.
- Controllare il chip sotto un microscopio di coltura del tessuto per bolle nei canali principali. Se le bolle sono presenti, eseguire le procedure seguenti. Se non ci sono bolle sono presenti, passare al punto 1.9.
- Aspirare il PBS dai pozzetti pesca il puntale lontano dal canale di apertura (Figura 2A).
- Pipettare 100 µ l di soluzione preadesivo nel pozzo superiore, pesca la punta della pipetta vicino al canale di apertura (Figura 2B). Le bolle dovrebbero muoversi attraverso il canale nel pozzo più basso. Attendere 1,5 min.
- Ripetere i passaggi da 1.3-1.8.
- Aspirare il PBS dai pozzetti pesca il puntale lontano dal canale di apertura (Figura 2A).
- Aggiungere 100 µ l di 0,5 mg/mL poli d-lisina (PDL) a superiore sinistro pozzo del chip. Attendere minimo 1,5 riempimento inferiore sinistra bene con 100 µ l di PDL.
- Aggiungere 100 µ l del PDL per il pozzo di destro superiore del chip. Attendere 1,5 min. aggiungere 100 µ l per il pozzo di destro inferiore.
- Chiudere la capsula di Petri e mettere il chip in un incubatore a 37 ° C per 1 h.
- Ripetere i passaggi di lavaggio PBS 1.5-1.6 volte per rimuovere l'eccesso PDL.
- Aspirare il PBS dal dispositivo.
- Immediatamente aggiungere 100 µ l di terreno di coltura delle cellule a superiore sinistro pozzo del chip. Aspettare ben 1,5 min media Aggiungi in basso a sinistra. Aggiungi media alla tomaia proprio bene. Attendere 1,5 min. aggiungere 100 µ l medium al pozzo di destra inferiore del chip.
- Posizionare il chip nell'incubatore 37° C fino al momento di cellule di piastra.
2. semina neuroni nei circuiti integrati di vari compartimenti
- Preparare la sospensione cellulare di neuroni ippocampali di ratto dissociata secondo protocolli stabiliti21,22 per produrre una densità di ~ 12 × 106 cellule/mL.
Nota: Uso di densità sospensione delle cellule compreso tra 3 e 12 × 106 cellule/mL è possibile. Se viene utilizzata una densità più bassa, il volume della sospensione cellulare per essere aggiunto al chip può essere aumentato (Vedi sotto). La procedura descritta di seguito è applicabile per murini neuroni corticali o hippocampal dissociati. Densità cellulare ottimale per altri tipi di neuroni possono variare. - Rimuovere la maggior parte dei media in ogni pozzetto del chip, lasciando circa 5 µ l in ogni pozzetto. Aspirare dai canali principali per evitare di rimuovere il liquido dai canali principali (Figura 2A).
Attenzione: Non aspirare completamente il liquido dai principali canali chiusi. Bolle d'aria può diventare intrappolate nel chip se il liquido viene aspirato dai principali canali. - Caricare 5 µ l di sospensione cellulare in alto a destra bene e un altro 5 µ l di sospensione cellulare nel pozzo destro inferiore (in totale ~ 120.000 cellule). Le celle di carico erogando vicino al canale principale (Figura 2B). Controllare al microscopio per garantire che i neuroni sono nel canale principale. Attendere 5 minuti permettere alle cellule di allegare.
Nota: I neuroni possono essere caricati in uno scompartimento. Ai fini della spiegazione, compartimento somatico è il canale principale sul lato destro, ma entrambi vano può essere utilizzato come compartimento somatico. Uso di bassa densità delle cellule fino a 60.000 cellule per il circuito integrato è possibile. Fino a 10 µ l di cella sospensione può essere aggiunti a ogni bene del compartimento somatico in combinazione con una sospensione cellulare con meno cellule rispetto a quelli descritti sopra. - Aggiungere circa 150 µ l di terreni di coltura neuronale a ciascuno di superiore e inferiore destro pozzi e quindi aggiungere 150 µ l di media a ciascuno di superiore e inferiore sinistra pozzi. Posizionare il chip nel vassoio umidificata in un incubatore a 37 ° C 5% CO2 .
- Dopo 24 h, è necessario eseguire una modifica di media rimuovendo media dai pozzi. Assicurarsi che il canale principale rimane riempito. Aggiungere 150 µ l di media in ciascun pozzetto superiore e poi riempire i pozzetti di fondo.
- Posizionare il chip indietro nell'incubatore per il numero di giorni desiderato.
Nota: Monitorare i media ogni paio di giorni per assicurarsi che essa resti rosa chiaro. Se il supporto è giallastro, sostituire il 50% di esso con i media freschi. Se il livello del liquido è basso, assicurarsi che non c'è umidità adeguate e appropriate misure di contenimento secondario dei chip per evitare l'evaporazione. Le modifiche di supporto riducendo al minimo o addirittura eliminare, è possibile utilizzando il contenimento secondario e/o che copre il piatto contenente il chip con politetrafluoroetilene (PTFE)-pellicola di FEP.
3. retrogrado etichettatura dei neuroni all'interno del Chip
Nota: Etichettatura retrograda può essere eseguita utilizzando varie tecniche, compreso l'uso di virus di tossina e la rabbia di colera modificate. Sotto sono le istruzioni per l'etichettatura di neuroni usando virus di rabbia-mCherry o - eGFP G-eliminato. Gestire materiale potenzialmente infetto secondo le linee guida dell'organizzazione locale. Formazione supplementare può essere richiesto.
- Terreni di coltura neuronali fresco caldo a 37 ° C. Stimano ~ 400 µ l di media per il circuito integrato.
- Diluire le 100.000 unità virale del virus di rabbia modificate in un totale di 50 µ l utilizzando media prelevati da entrambi bene del vano assonale.
Nota: Smaltire consigli e tubi a contatto con il virus in base al protocollo approvato di organizzazione. - Delicatamente dispensare i rimanenti media dai pozzi del vano assonale e negozio in una centrifuga tubo a 37 ° C.
- Aggiungere 150 µ l di media calda fresca e il 50 µ l di virus diluito al vano assonale. Incubare per 2 ore a 37 ° C incubatrice.
- Rimuovere i supporti contenenti virus e smaltirlo correttamente.
Nota: Può diventare bolle d'aria nel chip se il liquido viene aspirato dai canali principali. - Delicatamente aggiungere 75 µ l di media fresco un assone bene e permettono di fluire a altro assone bene.
- Togliere flusso-attraverso l'assone secondo bene e smaltire correttamente.
- Ripetere i passaggi da 3.6 e 3.7 una volta.
- Aggiungere supporti archiviati di nuovo al vano assonale. Aggiungere circa 50 µ l e fresca media, se necessario, per mantenere il volume adeguato e restituire le cellule nell'incubatore.
Nota: L'espressione della proteina fluorescente è visibile di 48 h e persiste fino a 8 giorni. I neuroni possono essere imaged per fino a 30 min a temperatura ambiente in terreni di coltura neuronali. Terreni di coltura può essere sostituito con riscaldato CO2-sospensione indipendente E con B27 ed imaged per più. I neuroni possono essere imaged anche all'interno di una camera ambientale ben umidificata a 37 ° C e 5% CO2. In questo caso, umidificazione è fondamentale per minimizzare le perdite per evaporazione all'interno del chip, che è aggravata dal riscaldamento e può compromettere la salute del neurone.
4. fluidico isolamento del vano Axonal all'interno del Chip
- Rimuovere 20 µ l dalla parte bassa a sinistra ben del vano assonale e posto nel pozzo superiore destro del compartimento somatico. Attendere 2 minuti per il flusso all'interno di ogni canale per equilibrare.
- Rimuovere 50 µ l di media dal vano assonale. Aggiungete 0,3 µ l di idrazide maleica 1mm Alexa Fluor 488 a questo supporto tramite pipetta e tornare al vano di axonal. Il chip è pronto per l'imaging.
Nota: Possono essere aggiunti altri composti di interesse. Aggiunta di un colorante fluorescente con un simile peso molecolare come il composto di interesse è consigliato al fine di monitorare fluidico isolamento nel tempo.
5. esecuzione assotomia all'interno del Chip
- Rimuovere il supporto dal vano axonal mantenendo il puntale dall'ingresso del canale principale (Figura 2A) e memorizzarlo in una provetta da centrifuga.
- Aspirare il vano axonal completamente, ponendo la pipetta di aspirazione vicino entrambi ingresso del canale principale del compartimento assonale (Figura 2B). Continuare l'aspirazione per 1-2 min. Assicuratevi che la soluzione viene completamente rimosso dal vano.
Nota: La pressione di vuoto per l'aspirazione deve essere almeno 18 pollici-Hg per la procedura di assotomia funzionare correttamente. - Sostituire il vano axonal con supporti archiviati e confermare che gli assoni sono interrotta guardando il chip sotto un microscopio.
Nota: Se bolle si formano nel vano di axonal quando si sostituiscono i media, ripetere i passaggi da 5.1-5.2. - Restituire il chip nell'incubatore.
6. fluorescenza Immunostaining all'interno del Chip
- Preparare la soluzione di fissaggio formaldeide 4% in PBS (4% formaldeide, 1 µM MgCl2, 0,1 µm CaCl2, saccarosio 120 mM)
- Rimuovere la maggior parte dei media nei pozzetti del chip (non a secco scomparti interni).
- Immediatamente aggiungere 100 µ l di soluzione di fissazione superiori pozzetti dei compartimenti assonali e somatici.
- Dopo 1 min, aggiungere 100 µ l di soluzione di fissazione dei pozzetti di fondo. Difficoltà per 30 min a temperatura ambiente.
- Rimuovere la maggior parte della soluzione dai pozzi del chip (non a secco scomparti interni). Immediatamente aggiungere 150 µ l di PBS a ciascuno dei pozzi top dei compartimenti assonali e somatici. Attendere 2 minuti per il PBS a fluire nei pozzetti fondo.
- Ripetere il passaggio 6.5 due volte.
- Rimuovere la maggior parte di PBS dai pozzi del chip. Immediatamente aggiungere 150 µ l di PBS con 0,25% TritonX-100 a ciascuno dei pozzi top dei compartimenti assonali e somatici. Attendere 15 minuti.
- Rimuovere la maggior parte del liquido dai pozzetti del chip e immediatamente aggiungere 150 µ l di soluzione bloccante (10% di siero di capra normale in PBS) a ciascuno dei pozzi top dei compartimenti assonali e somatici. Attendere 15 minuti.
Nota: Soluzioni efficaci di blocchi dovrebbe essere specifico per l'anticorpo secondario, ad esempio, per un anticorpo secondario anti-pecore di asino, utilizzare siero asino nella soluzione di blocco. - Rimuovere la maggior parte del liquido dai pozzetti del chip e immediatamente aggiungere 100 µ l di anticorpo primario (o anticorpi) in siero di capra normale di 1% in PBS per ciascuno dei pozzetti top dei compartimenti assonali e somatici. Coprire per minimizzare l'evaporazione e aspettare per 1 h a temperatura ambiente o a 4 ° C durante la notte.
- Rimuovere la maggior parte della soluzione dai pozzi del chip (non a secco scomparti interni). Immediatamente aggiungere 150 µ l di PBS a ciascuno dei pozzi top dei compartimenti assonali e somatici. Attendere 5 min per il PBS a fluire nei pozzetti fondo.
- Ripetere il passaggio 6.10 due volte.
- Rimuovere la maggior parte del liquido dai pozzetti del chip e immediatamente aggiungere 100 µ l di anticorpo secondario (o anticorpi) in PBS per ciascuno dei pozzetti top dei compartimenti assonali e somatici. Coprire per minimizzare l'evaporazione e aspettare per 1 h a temperatura ambiente.
Nota: Fare riferimento alle istruzioni del produttore per la diluizione raccomandata di anticorpi secondari. - Ripetere i passaggi da 6.10-6.11.
- Se imaging entro 1 giorno di immunostaining, tenere il chip pieno di PBS. Se chip verrà memorizzato più di 1 giorno prima di formazione immagine, avvolgere il piatto contenente il chip nella pellicola di paraffina per evitare l'evaporazione e conservare a 4 ° C fino al momento dell'immagine.
- Per archiviazione a lungo termine dei campioni, si possono impiegare mezzi di montaggio (ad es., Fluoromount-G).
- Rimuovere la maggior parte del liquido dai pozzetti del chip. Utilizzare una pipetta di plastica monouso da 1 mL per aggiungere 2 gocce di montaggio supporto a ciascuno dei pozzi top dei compartimenti assonali e somatici.
- Inclinare il chip per incoraggiare il flusso di mezzi di montaggio attraverso i canali. Dopo 5 min aggiungere 2 gocce per i pozzetti di fondo. Attendere 1 ora prima di formazione immagine.
Nota: Dopo l'utilizzo di mezzi di montaggio non sarà possibile ri-sonda per altri obiettivi.
Risultati
Dopo circa 5-7 giorni di crescita del neurone all'interno del chip, è evidente la crescita assonale. I chip sono compatibili con formazione immagine di contrasto di fase come dimostrato nella Figura 3, che mostra una crescita neuronale a 24 giorni. I chip sono compatibili anche con fluorescenza imaging (Figura 4, Figura 5, Figura 6e Figura 7). Tre giorni dopo l'infezione del virus di rabbia tramite il vano assonale, neuroni mCherry-positivi con gli assoni che si estende nel vano di axonal erano imaged nel chip (Figura 4). Per dimostrare la capacità di isolare fluidically i compartimenti, una tintura fluorescente a basso peso molecolare (Alexa Fluor 488 idrazide maleica) è stato aggiunto al vano assonale. Questi risultati sono paragonabili a base di PDMS camera17 e dimostrano l'idoneità del chip in plastica per contrasto di fase e l'imaging di fluorescenza.
Per illustrare la crescita neuronale con i chip di plastica e i dispositivi PDMS, abbiamo colture di neuroni in entrambe le piattaforme e monitorati nel tempo una crescita neuronale. La figura 5 Mostra un neurone crescita da 3 a 22 giorni nella cultura; Questi risultati sono rappresentativi di 3 esperimenti indipendenti. Crescita neuronale è analoga all'interno di due piattaforme fino a 15 giorni nella cultura, ma al più cultura di età compresa tra (> 21 giorni) assoni isolati all'interno del chip di plastica appaiono più sani con meno Perline (Figura 5A). Per visualizzare ulteriormente assoni entro i compartimenti assonali, abbiamo immunostained per β-tubulina III che mostra la crescita assonale sana all'interno della plastica chip a 22 giorni in coltura (figura 5B).
Gli studi di lesione e la rigenerazione dell'assone sono comuni con dispositivi microfluidici compartimenti stagni. Per dimostrare l'idoneità di questi studi utilizzando i chip, retrogrado etichettati neuroni erano imaged prima e 24 h dopo assotomia (Figura 6). Una lampadina di ritrazione e rigenerazione dell'assone sono entrambi assotomia seguente evidente. Questi risultati sono equivalenti ai dati pubblicati utilizzando dispositivi basati su PDMS14,17.
Immunocitochimica è una tecnica comune eseguita all'interno di dispositivi multi-scomparto per visualizzare la localizzazione della proteina. Dopo 24 giorni nella cultura, i neuroni all'interno i chip erano fissi e macchiati per marcatori sinaptici eccitatori ed inibitori, vGlut1 e vGat, rispettivamente (Figura 7). Retrogrado con etichetta mCherry neuroni erano imaged (Figura 7). Imaging è stata eseguita utilizzando il disco rotante confocale con un obiettivo a immersione 60 × in silicone olio, dimostrando la capacità di eseguire imaging ad alta risoluzione. D'importanza, le spine dendritiche erano evidenti all'interno di un'area ingrandita, dimostrando che i neuroni coltivati all'interno i chip erano formando sinapsi mature.
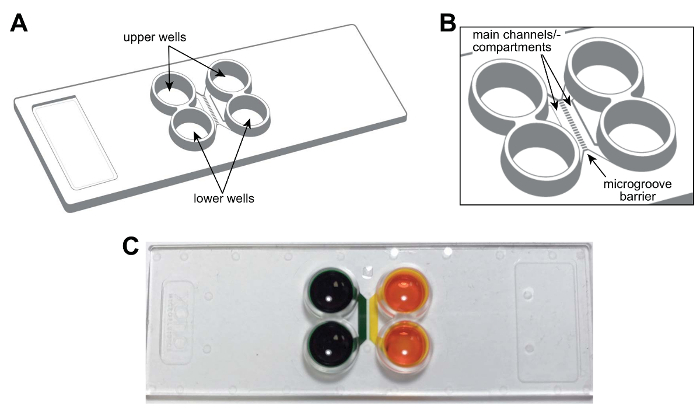
Figura 1 : Un chip microfluidico bicompartimentale pre-assemblati, plastica per divisione in compartimenti neuroni. (A) rappresentazione schematica del chip multicomparto mostrando le posizioni dei pozzetti superiori e inferiori. (B) un disegno schematico allargata del chip mostrando i canali principali (o compartimenti) e microscanalature che collegano i compartimenti. I principali canali sono circa 1,5 mm × 7 × 0,060 mm (L × L × H). La larghezza e l'altezza delle Microscanalature sono circa 0,01 mm × 0,005 mm, rispettivamente. La lunghezza delle Microscanalature varia a seconda della configurazione, 0,15 mm a 0,9 mm. fotografia di A (C) di un rappresentante multicomparto chip contenente colorante alimentare colorante in ogni canale principale o vano dimostrando la capacità di fluidically isolare ogni canale. Clicca qui per visualizzare una versione più grande di questa figura.
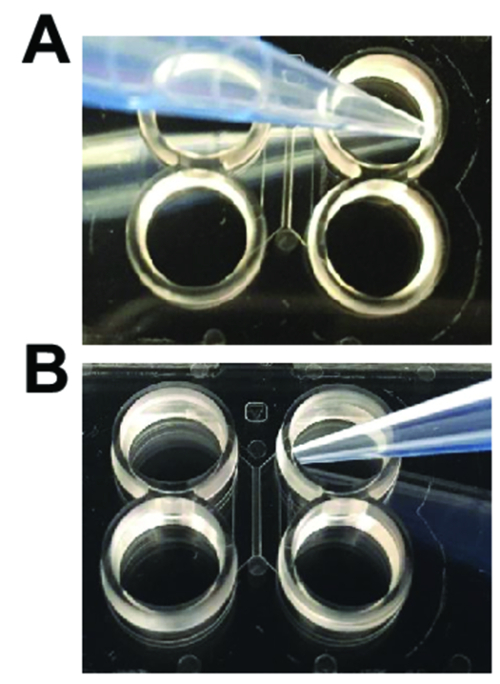
Figura 2 : Tecniche di pipettaggio necessarie quando si utilizza chip di plastica vari compartimenti. (A) quando l'aggiunta e l'aspirazione dei media per lavaggi, il puntale deve essere angolato dall'ingresso del canale principale, come mostrato. (B) quando i neuroni di caricamento o l'esecuzione di assotomia, il puntale deve essere inclinato verso l'ingresso del canale principale. Clicca qui per visualizzare una versione più grande di questa figura.
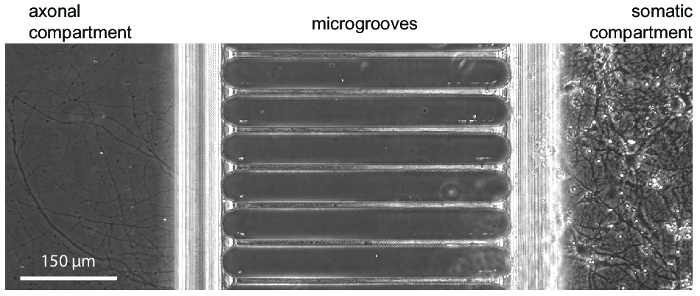
Figura 3 : Una microfotografia di contrasto di fase risultati di crescita neuronale tipica all'interno del chip a 24 giorni nella cultura. Neuroni hippocampal embrionali sono stati seminati nel vano di destra somatico. Crescita dell'assone è visibile all'inizio di axonal vano a 5-7 giorni. Clicca qui per visualizzare una versione più grande di questa figura.
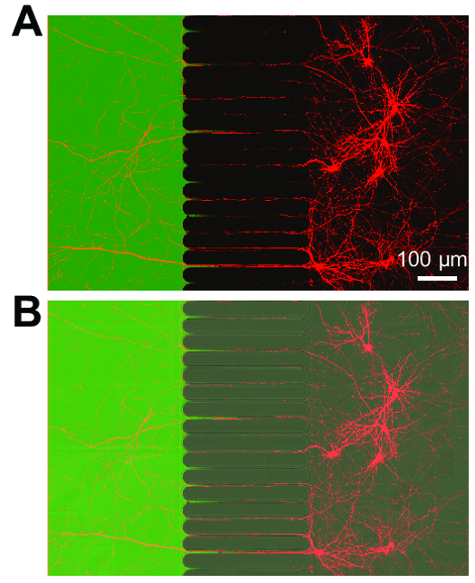
Figura 4 : Retrogradi con etichettati neuroni esprimono proteina fluorescente mCherry ed estendere gli assoni in un vano di axonal fluidically isolato. (A) un micrografo di fluorescenza Unite risultati live retrogradi con etichettati neuroni infettati tramite un virus di rabbia modificate mCherry applicato brevemente al vano assonale. I neuroni erano imaged 3 giorni dopo l'infezione alle 21 giorni nella cultura. Creazione di un microambiente isolato all'interno del compartimento axonal è dimostrato dall'applicazione di una tintura di basso peso molecolare, idrazide maleica Alexa Fluor 488. (B) un'immagine unita di (A), tra cui un'immagine a contrasto (DIC) interferenza differenziale per visualizzare la regione Microscanalature del chip. Immagini sono state acquisite con utilizzando un olio di silicone 30 × / 1,05 N.A. al microscopio confocale a scansione laser (ne = 1,406) dell'obiettivo. Clicca qui per visualizzare una versione più grande di questa figura.
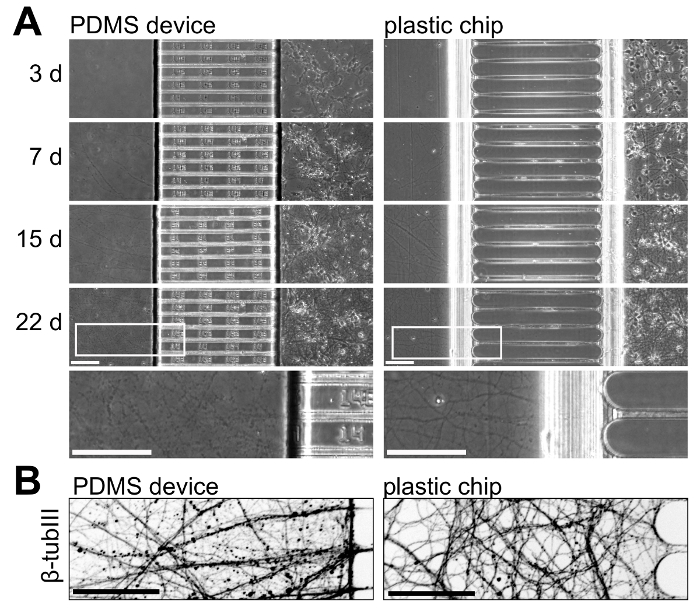
Figura 5 : Confronto side-by-side di crescita neuronale all'interno di vari compartimenti PDMS dispositivi e chip di plastica. (A) micrografi di entrambe le piattaforme prelevate a giorni 3, 7, 15 e 22 nella cultura di contrasto di fase. Nella parte inferiore, una regione di ingrandimento superiore prelevata dalle immagini ai 22 giorni è inclusa per illustrare la crescita assonale a questa età all'interno di entrambe le piattaforme. Assoni all'interno del chip sono più continui e appaiono più sani nel dispositivo PDMS a questa età. (B) un micrografo di immunofluorescenza invertito di β-tubulina III macchiato assoni all'interno del compartimento axonal del dispositivo PDMS e chip di plastica a 22 giorni nella cultura. Immagini sono state acquisite con un sistema rotante disco confocale imaging utilizzando un 20 x / 0.45 N.A. lente dell'obiettivo. Tutte le barre della scala sono 100 µm. Clicca qui per visualizzare una versione più grande di questa figura.
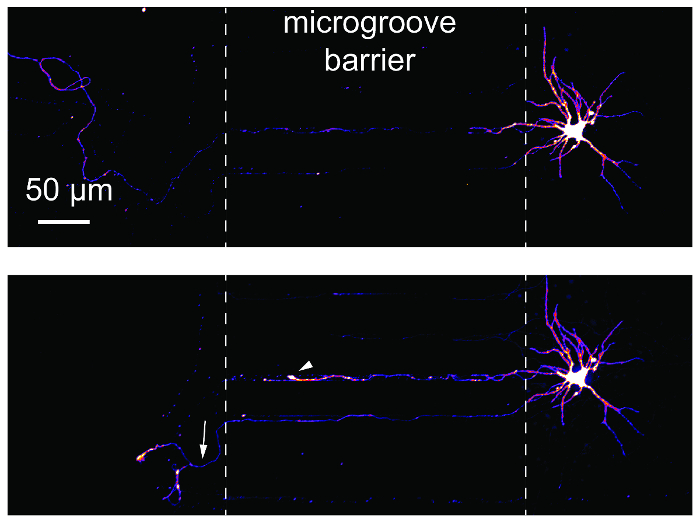
Figura 6 : Lesione assonale e la rigenerazione dei neuroni ippocampali all'interno del chip di plastica vari compartimenti. (In alto) I neuroni sono stati retrogradi etichettati utilizzando un virus di rabbia mCherry modificate e quindi ripreso prima assotomia alle 24 giorni nella cultura. Le immagini erano pseudocolored utilizzando la tabella di look-up colori 'Fuoco'. (In basso) Il neurone stesso imaged nel pannello superiore era imaged 24h post-lesione assonale. Linee bianche tratteggiate mostrano i bordi della barriera microsolco. Axotomy si è verificato la posizione della sinistra linea tratteggiata. La punta della freccia bianca indica una lampadina di ritrazione. La freccia bianca indica un assone rigenerante. Immagini sono state acquisite con un sistema rotante disco confocale imaging utilizzando un 20 × / 0.45 N.A. obiettivo obiettivo. Clicca qui per visualizzare una versione più grande di questa figura.
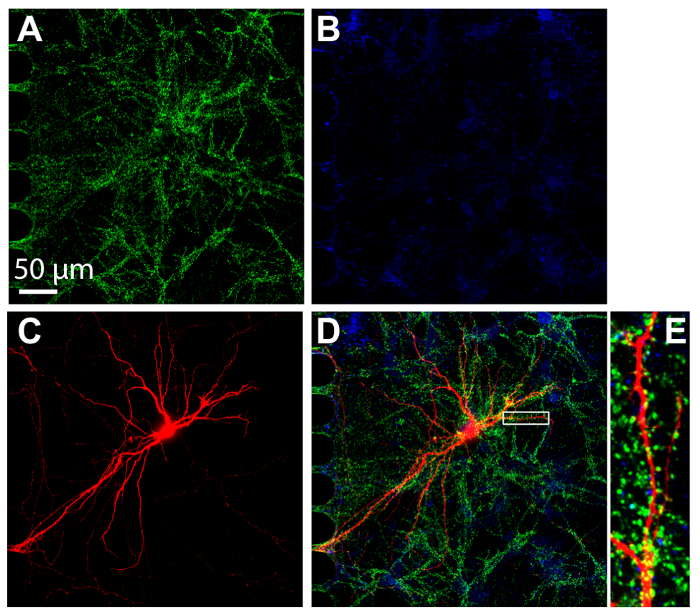
Figura 7 : Sinapsi forma tra neuroni hippocampal coltivati all'interno del chip di plastica multicomparto. Immunostaining era effettuata ai 24 giorni nella cultura e ripreso all'interno del compartimento somatico utilizzando un obiettivo ad immersione in silicone 60 ×. I neuroni esprimono (A) il marcatore di sinapsi eccitatoria, vGlut1 (verde) e (B) il marcatore di sinapsi inibitorie, vGAT (blu). (C) Retrograde etichettato mCherry neuroni (in rosso) sono stati infettati tramite virus della rabbia modificate applicato al comparto assonale. (D) una microfotografia di fluorescenza unita di vGlut1, vGat e mCherry. (E) l'area ingrandita in (D) indicato con una casella bianca Mostra spine dendritiche, i siti che ricevono input sinaptico da altri neuroni. Immagini sono state acquisite con un sistema rotante disco confocale imaging utilizzando un olio di silicone di 60 × / 1.3 N.A. (ne = 1,406) dell'obiettivo. Clicca qui per visualizzare una versione più grande di questa figura.
| Chip di plastica multicomparto | Dispositivi vari compartimenti PDMS |
| isolare gli assoni | isolare gli assoni |
| stabilire microambienti | stabilire microambienti |
| neuroni axotomize | neuroni axotomize |
| otticamente trasparente | otticamente trasparente |
| compatibile con formazione immagine ad alta risoluzione | compatibile con formazione immagine ad alta risoluzione |
| compatibile con microscopia di fluorescenza | compatibile con microscopia di fluorescenza |
| completamente assemblato | Assemblea al substrato necessaria |
| assoni sani > 21 giorni | assoni sani > 14 giorni |
| superficie idrofila di coltura | idrofobo |
| gas impermeabile | gas permeabili |
| Microscanalature arrotondati e canali | Microscanalature dritto |
| meno passaggi di preparazione | Top è rimovibile per la macchiatura entro Microscanalature |
| non compatibile con ablazione laser | assorbimento di piccole molecole & solventi organici |
| non compatibile con oli a base di olio minerale ad immersione (oli a base di silicone vanno bene) |
Tabella 1: Confronto di plastica e PDMS multicomparto piattaforme per la coltura di neuroni.
Discussione
Chip di plastica multicomparto forniscono un'opzione facile da usare per la divisione in compartimenti neuroni, fornendo colture neuronali a lungo termine (> 3 settimane). Questo protocollo dettagli come cultura corticali e ippocampali murini neuroni all'interno di questi chip. La creazione di microambienti solubile e come retrogrado neuroni etichetta, eseguire assotomia ed eseguire immunocytochemistry inoltre sono stati discussi. D'importanza, sono compatibili con questi chip ad alta risoluzione, fluorescenza e creazione di immagini dal vivo.
Chip di plastica multicomparto forniscono molte delle stesse funzioni come i dispositivi basati su PDMS compartimenti stagni, ma hanno alcune caratteristiche distintive, vantaggi e svantaggi. La tabella 1 fornisce un confronto tra le funzionalità di dispositivi basati su PDMS e chip di plastica. Innanzitutto, i chip sono pre-assemblati e reso definitivamente idrofilici, che facilita il bagnante, rendendoli più facili da utilizzare. La plastica non è gas permeabile, a differenza di PDMS, così se le bolle si formano in modo imprevisto all'interno i canali, non sfuggono facilmente e deve essere rimosso. Una soluzione di pre-rivestimento contenente principalmente etanolo e alcuni altri agenti proprietarie Elimina la formazione di bolle.
Immagini di proiezioni seguenti trasduzione di proteine fluorescenti è stato eseguito entro i chip (Figura 4) dal vivo e non c'era nessun autofluorescence rilevabile della plastica. Un avvertimento è che gli oli di immersione utilizzati con il chip per obiettivi di apertura numerica elevata devono essere base di olio di silicone e non olio base minerale. Olio minerale può causare una reazione avversa con il copolimero ciclico delle olefine. Per l'imaging in campo chiaro, è importante notare che le Microscanalature nel chip sono arrotondati alle estremità e c'è un graduale assottigliamento della direzione z dei principali canali verso la barriera di microsolchi causando qualche rifrazione della luce alle due estremità della Microscanalature durante il campo chiaro imaging (Figura 3). Perché il chip è pre-assemblato, la penetrazione dell'anticorpo le Microscanalature micron imprese potrebbe essere irregolare (come con dispositivi basati su PDMS permanentemente legati); così, analisi quantitativa immunostaining di seguito deve essere eseguita nei canali/compartimenti. Immunostaining delle proiezioni neuronali all'interno le Microscanalature può essere migliorata mediante la creazione di una differenza di volume tra i compartimenti per aiutare il flusso degli anticorpi e fluorofori nelle Microscanalature.
Divulgazioni
A.M.T. è un inventore del camera/chip microfluidico (US 7419822 B2) ed è un membro di Xona Microfluidics, LLC. V.P. è un dipendente di Xona Microfluidics, LLC. J.H. è un membro di Xona Microfluidics, LLC. T.N. non dichiara concorrenti interessi finanziari. Pubblicazione di accesso aperto di questo articolo è sponsorizzato da Xona Microfluidics.
Riconoscimenti
Gli autori riconoscono assistenza tecnica o editoriale da Taylor Wilt (xxxxx), Smita Paranjape (UNC-Chapel Hill), Joyce Ciechanowski (xxxxx) e Brad Taylor (xxxxx). Gli autori riconoscono sostegno da Xona Microfluidics, LLC e il National Institute of Mental Health (R42 MH097377). La formazione immagine è stato parzialmente sostenuta dalla confocale e multifotonica Imaging Core Facility di NINDS Center Grant P30 NS045892 e NICHD Center Grant (U54 HD079124). Il contenuto è di esclusiva responsabilità degli autori e non rappresentano necessariamente il punto di vista ufficiale del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| XonaChip | Xona Microfluidics, LLC | XC150 | 150 µm length microgroove barrier |
| Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier | |
| Xona Microfluidics, LLC | XC900 | 900 µm length microgroove barrier | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaPDL | Xona Microfluidics, LLC | XonaPDL | |
| E17/E18 timed pregnant Sprague Dawley rats | Charles River | 24100564 | |
| neuronal culture media: | |||
| - Neurobasal medium | ThermoFisher Scientific | 21103049 | |
| -B-27 Plus Supplement (50x) | ThermoFisher Scientific | A3582801 | |
| -GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| -Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Salk Institute for Biological Studies | G-deleted Rabies-mCherry | Material Transfer Agreement required | |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Pierce 16% formaldehyde | ThermoFisher Scientific | 28906 | |
| PBS (10x) | ThermoFisher Scientific | QVC0508 | |
| normal goat serum | ThermoFisher Scientific | 16210064 | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| Incubator, 5% CO2 37 °C | |||
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| Spinning disk confocal imaging system | Andor Technology | CSU-X1, iXon X3 EMCCD | 60x silicone oil & 20x objectives |
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
Riferimenti
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington's Disease. Cell Reports. 22 (1), 110-122 (2018).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell Reports. 20 (13), 3085-3098 (2017).
- Yang, Y., et al. Presynaptic regulation of astroglial excitatory neurotransmitter transporter GLT1. Neuron. 61 (6), 880-894 (2009).
- Sutton, M. A., Taylor, A. M., Ito, H. T., Pham, A., Schuman, E. M. Postsynaptic decoding of neural activity: eEF2 as a biochemical sensor coupling miniature synaptic transmission to local protein synthesis. Neuron. 55 (4), 648-661 (2007).
- Hengst, U., Deglincerti, A., Kim, H. J., Jeon, N. L., Jaffrey, S. R. Axonal elongation triggered by stimulus-induced local translation of a polarity complex protein. Nature Cell Biology. 11 (8), 1024-1030 (2009).
- Sharma, N., et al. Long-distance control of synapse assembly by target-derived NGF. Neuron. 67 (3), 422-434 (2010).
- Harrington, A. W., et al. Recruitment of actin modifiers to TrkA endosomes governs retrograde NGF signaling and survival. Cell. 146 (3), 421-434 (2011).
- Zhang, Y., et al. Assembly and maintenance of nodes of ranvier rely on distinct sources of proteins and targeting mechanisms. Neuron. 73 (1), 92-107 (2012).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Tran, H. T., et al. Alpha-synuclein immunotherapy blocks uptake and templated propagation of misfolded alpha-synuclein and neurodegeneration. Cell Reports. 7 (6), 2054-2065 (2014).
- Calafate, S., et al. Synaptic Contacts Enhance Cell-to-Cell Tau Pathology Propagation. Cell Reports. 11 (8), 1176-1183 (2015).
- Cosker, K. E., Fenstermacher, S. J., Pazyra-Murphy, M. F., Elliott, H. L., Segal, R. A. The RNA-binding protein SFPQ orchestrates an RNA regulon to promote axon viability. Nature Neuroscience. 19 (5), 690-696 (2016).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Mukhopadhyay, R. When PDMS isn't the best. What are its weaknesses, and which other polymers can researchers add to their toolboxes? Analytical Chemistry. 79 (9), 3248-3253 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain research. 126 (3), 397-425 (1977).
- Banker, G., Goslin, K. Culturing Nerve Cells. , Second edition, MIT Press. (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon