Method Article
Un modello di linfoma della B-cellula Syngeneic del topo per la valutazione pre-clinica delle cellule di T di CD19 auto
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per la produzione e la sperimentazione pre-clinica di cellule CD19 auto T murine di trasduzione retrovirale e l'utilizzazione come terapia contro il linfoma della B-cellula di A20 syngeneic stabilita nei topi BALB/c con o senza lymphodepleting pre-condizionamento.
Abstract
Il sorprendente successo clinico della terapia a cellula T del ricevitore (auto) chimerico antigene CD19 ha portato all'approvazione dei recettori chimerici antigene di due di nuova generazione (automobili) per linfoma di leucemia linfoblastica acuta (tutta) andnon-Hodgkin (NHL). La messa a fuoco del campo è ora emulare questi successi in altre neoplasie ematologiche, dove si osservano meno impressionanti tassi di risposta completa. Ulteriore ingegneria delle cellule di T di auto o la somministrazione concomitante di altre modalità di trattamento può superare con successo gli ostacoli alla riuscita terapia in altre impostazioni di cancro.
Presentiamo quindi un modello in cui gli altri possono condurre la sperimentazione pre-clinica di cellule CD19 auto T. Risultati in questo ben collaudato modello di linfoma della B-cellula sono suscettibili di essere informativa auto T-terapia cellulare in generale.
Questo protocollo permette la produzione riproducibile di topo le cellule di T di auto attraverso la transfezione del fosfato di calcio delle cellule produttore Plat-E con MP71 retrovirali e pCL-Eco imballaggi plasmide seguita da collezione di particelle retrovirali secrete e trasduzione mediante centrifugazione e frammento di fibronectina umana ricombinante. Convalida di trasduzione retrovirale e la conferma della capacità delle cellule di T auto per uccidere destinazione linfoma a cellule ex vivo, attraverso l'uso di citometria a flusso, parametri ed enzima-collegata dell'immunosorbente (ELISA) di dosaggio, è descritto.
Protocolli per il test auto T cells in vivo in lymphoreplete e lymphodepleted topi syngeneic, cuscinetto stabilito linfoma sistemico sono descritti. Attività anticancro è monitorato da in vivo progressione bioluminescenza e malattia. Vi mostriamo i risultati tipici di eradicazione di linfoma della B-cellula stabilito quando si utilizza 1st o 2nd generazione auto in combinazione con lymphodepleting pre-condizionamento e una minoranza di topi ottenere remissioni a lungo termine quando si utilizza auto T cellule che esprimono IL-12 in topi lymphoreplete.
Questi protocolli possono essere utilizzati per valutare le cellule di T di CD19 auto con diverse modifiche aggiuntive, combinazioni di cellule T auto e altri agenti terapeutici o adattati per l'uso delle cellule di T auto contro gli antigeni diversi target.
Introduzione
Terapia a cellula T chimerici antigene recettore (auto) ha mostrato il sorprendente successo clinico nel trattamento di CD19+ malignità di approvazione di tisagenlecleucel per la leucemia linfoblastica acuta ricaduta1 e axicabtagene ciloleucel per progressiva grandi cellule B linfoma non-Hodgkin2 nel 2017.
L'importanza delle interazioni tra il cancro e il sistema immunitario nella progressione della malattia sia meccanismi terapeutici sta diventando sempre più riconosciuta3,4,5. Ad esempio, è ben documentato che il microambiente tumorale (TME) è inondato con i fattori che possono sopprimere le funzioni effettrici delle cellule immuni6,7,8. In alternativa adescamento di cellule immunitarie endogene e diffusione di epitopo può essere chiave nell'estirpazione del tumore e resistenza a lungo termine al tumore sfida9,10. Entrambi questi fenomeni non può essere valutati in xenogeniche modelli che non dispongono di un sistema immunitario. Allo stesso modo, sistemi che utilizzano proteine transgeniche non riflettono accuratamente la sfida di rompere la tolleranza immunitaria che è richiesta per epitopo diffondere11,12. Un modello syngeneic con un sistema immunitario pienamente funzionale è, pertanto, fondamentale per la modellazione di questi aspetti importanti della terapeutica del cancro malattia progressione e immunitario.
Un avvertimento importante della terapia auto T-cellulare è che lymphodepleting pre-condizionamento è necessaria per il successo terapeutico13,14. Questo è tipicamente realizzato in pazienti con la somministrazione di chemioterapia prima dell'infusione di cellule T auto15,16. Come un metodo standard, al fine di imitare lymphodepletion utilizzato nella regolazione del paziente, somministriamo 5 Gy irradiazione dal corpo intero (TBI) per ottenere lymphodepletion prima della somministrazione di cellule di T auto terapeutiche ai topi che sopportano il linfoma della B-cellula di A20 sistematico.
Mentre lymphodepleting pre-condizionamento non è un problema per la maggior parte dei pazienti, tossicità che viene fornito con gli agenti chemioterapeutici significa che pazienti basso performance status non sono eleggibili per la terapia auto T-cellulare. Per creare un sistema di test che rappresenta i pazienti non ammissibili per lymphodepletion, abbiamo stabilito un modello syngeneic del topo di lymphoreplete in cui abbiamo il modello auto T-terapia con cellule di linfoma. In questo modello, abbiamo dimostrato che la secrezione di IL-12 all'interno delle cellule di T auto potrebbe portare all'eradicazione di linfoma stabilito con un tasso di successo di ~ 25%17. Inoltre, abbiamo indicato che le cellule immunitarie endogene sono stati coinvolti nell'eradicazione del cancro.
Qui descriviamo in dettaglio il protocollo per la produzione delle cellule di T auto del topo, che istituisce il linfoma in topi syngeneic ed il trattamento di linfoma con cellule di T di auto con o senza l'uso di lymphodepleting pre-condizionamento. Questo può essere utilizzato per gli studi di combinazione delle cellule di T auto con altri agenti, test cellule di T auto con altri transgeni o per l'utilizzo di altre strategie di terapia o immunoterapia cellulare adottiva contro il linfoma.
Protocollo
Tutti gli esperimenti sugli animali sono stati condotti sotto l'egida dell'atto di animali (procedure scientifiche) 1986 e sotto UK Coordinating Committee per orientamenti di ricerca sul cancro. Tutti gli studi sugli animali sono stati condotti presso l'Istituto CRUK-Manchester e approvati dal locale benessere animale ed etica Esaminiamo corpo (CRUK-MI AWERB).
1. preparati
- Maxiprep pMP71 retroviral costruire plasmide e pCL-Eco retrovirus imballaggio plasmidi18.
Nota: pMP71 codifica mCherry e l'auto separati da una sequenza di FMDV2A. Questo è intercambiabile con altri retrovirali. pCL-Eco codifica gag, pol e le proteine dell'involucro ecotropic. - Preparare mezzo completa T cellulare (TCM) per la coltura di cellule di topo T usando medium RPMI 1640, 10% FCS, 1% 100 x penicillina-streptomicina-glutamina (PSG).
Nota: La soluzione contiene 100 UI/mL di penicillina, 100 µ g/mL di streptomicina e 2 mM di L-Glutammina), 50 μM β-mercaptoetanolo e 25 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acido (HEPES). - Coltura di cellule A20 in RPMI 1640, 10% FCS e 0,05 mM β-mercaptoetanolo a 37 ° C, 5% CO2.
- Coltura le cellule Platinum-E (Plat-E) in completa di Dulbecco modificate eagle medium (DMEM) (DMEM con 10% siero fetale del vitello (FCS), 2 mM L-Glutammina, 1 con puromicina μg/mL e 10 μg/mL Consciousness) a 37 ° C, 5% CO2.
Nota: Plat-E cellule sono derivate dalle cellule 293T ed esprimono proteine retrovirali dell'involucro gag, pol ed ecotropic. - Preparare la transfezione soluzioni multimediali 1 e 2 immediatamente prima della transfezione. Preparare soluzione 1 (pH 7,9) per contenere DMEM + 10% FCS + 25mm HEPES, soluzione 2 (pH 7.1) per contenere DMEM + 25mm HEPES.
- Preparare 10 μg/mL di soluzione di frammento ricombinante fibronectina umana diluendo con soluzione salina sterile tampone fosfato (PBS) e conservare a-20 ° C fino all'utilizzo.
- Sterile filtrare tutti i media 0,2 μm filtri prima dell'uso (escluso frammento di fibronectina umana ricombinante).
2. retrovirali trasduzione delle cellule T
- Giorno 1: Preparazione per la transfezione
- Seme: 7,5 x 106 Platinum-E (Plat-E) cellule in piastre di coltura di tessuto2 di 15 cm in 18 mL di DMEM completo e incubare per una notte a 37 ° C, 5% CO2.
- Giorno 2: Transfezione della linea cellulare di Plat-E imballaggio retrovirali
- Preparare 20,4 μg di pcl-Eco packaging vettoriale DNA, 39,6 μg di DNA del plasmide codifica retrovirali auto costrutto e 150 μL di 1m CaCl2 a volume finale di 3 mL di soluzione di transfezione 2 per ogni piatto2 15 cm per essere transfected. Vortexare per 10 s e riposo per 5 min
- Rimuovere DMEM media dai piatti 15 cm2 e sostituire con 12 mL di soluzione di transfezione 1.
Attenzione Quando si cambia il supporto, possono asciugare i piatti2 15 cm al centro. Ciò può causare notevole morte delle cellule transfettate Plat-E. Lavora velocemente e rimuovere i supporti da solo 1-2 piastre per volta. - Aggiungere 3 mL di soluzione di transfezione 2 contenente DNA e CaCl2 per ogni piatto di2 cm 15 drop-wise, uniformemente attraverso ogni piatto. Piastre di roccia delicatamente con un movimento di lato a lato per 10 s. Incubare a 37 ° C, 5% CO2 durante la notte.
- Giorno 3: Preparazione dei virus contenenti surnatante per trasduzione
- Sostituisci i media delle cellule transfettate piastra-E con 18 mL completare TCM e tornare in incubatrice.
Attenzione Quando cambiare i piatti di media 15 cm2 può asciugare al centro. Ciò può causare notevole morte delle cellule transfettate Plat-E. Lavora velocemente e rimuovere i supporti da solo 1-2 piastre per volta.
- Sostituisci i media delle cellule transfettate piastra-E con 18 mL completare TCM e tornare in incubatrice.
- Giorno 3: Isolamento e in vitro l'attivazione delle cellule T spleniche del topo
- Rimuovere le milze di topi BALB/c 6-8-week-old come precedentemente descritti da Parkinson et al. 19 e immergerli in sterili, ghiacciata, PBS in una provetta conica da 50 mL.
- Utilizzare una pinzetta per trasferire una milza in una microcentrifuga da 1,5 mL e omogeneizzare con un pestello con forza minima.
- Utilizzare una pipetta 1000 μL e ~ 800 μL PBS di trasferire omogeneato per un colino di cella di 100 μm poro apposto su un tubo da 50 mL contenente 5 mL di PBS per raggiungere una sospensione unicellulare. Ripetere il passaggio 2.4.2 per milze aggiuntive. Non superare 3 milze per tubo.
Attenzione Splenocytes passato attraverso filtro può formare grumi se lasciato in piedi. Se l'elaborazione di diversi milze per evitare cella agglutinamento, manualmente di turbinio tubi in modo intermittente. Rimanenti frammenti sul filtro delle cellule può essere ulteriormente purè usando uno stantuffo da una siringa da 5 mL utilizzando una forza minima. - Superiore a 20 mL con PBS. Strato la sospensione cellulare 20ml delicatamente sul 20ml di media gradiente di densità (Tabella materiali) in una provetta da 50 mL. Centrifugare la sospensione risultante sovrapposta a 800 x g per 20 min con nessun freno azionato.
- Raccogliere le cellule a livello di interfaccia, utilizzando una pipetta Pasteur sterile e trasferirlo in una provetta 50 mL. Superiore a 50 mL con PBS e centrifuga a 800 x g per 10 min a lavare. Scartare il surnatante e risospendere le cellule in MTC completa.
- Contare il numero di celle utilizzando un emocitometro.
- Coltura di cellule ad una densità di 5 x 106 cellule/mL in MTC completa con 30 ng/mL di un anticorpo anti-CD3ε (Clone 145-2 C 11), 30 ng/mL di un anticorpo anti-CD28 (Clone 37.51), 100 U/mL ricombinante umano il-2 e ricombinante di 2 ng/mL IL-7 murino. Utilizzare un matraccio di cultura del tessuto dimensioni appropriate per il volume di cellule raccolte.
Nota: Cellule presentanti l'antigene–sono necessari per l'attivazione delle cellule T dagli anticorpi CD3 e CD28, se lavora con le cellule di T purificate è necessario cappotto piastre con anticorpi o utilizzano biglie magnetiche (Tabella materiali) - Incubare splenocytes del topo a 37 ° C, 5% CO2 durante la notte.
- Giorno 3: Preparazione delle piastre per la trasduzione
- Cappotto non-tessuto-cultura 6-pozzetti con 2 mL di 10 μg/mL di fibronectina umana ricombinante del frammento e incubare per una notte a 4 ° C.
- Giorno 4: Trasduzione di cellule di T
- Trasferimento frammento di fibronectina umana ricombinante da piastre di coltura del tessuto freschi 6-pozzetti. Incubare queste piastre durante la notte a 4 ° C per 2 ° turno di trasduzione.
- Aggiungere 2 mL di TCM in ciascun pozzetto di tavole originali di rivestite con frammento di fibronectina umana ricombinante e lasciare per 30 min a temperatura ambiente per bloccare il legame non specifico.
- Raccogliere il supernatante contenente retrovirus da cellule trasfettate Plat-E in piastre di coltura del tessuto di 15cm e Sostituisci con 18 mL di TCM completa.
Attenzione Lavorare rapidamente per evitare la disidratazione delle cellule Plat-E.
Nota: Successo della transfezione può essere controllato in questa fase mediante microscopia a fluorescenza, se utilizzando un gene marcatore fluorescente come mCherry (Figura 1). - Filtrare il surnatante contenente retrovirus attraverso 0,45 μm filtro per rimuovere i detriti cellulari. Rimuovere TCM dalle piastre 6 pozzetti rivestite con frammento di fibronectina umana ricombinante e aggiungere 2,5 mL di surnatante filtrato contenenti retrovirus o ad ogni pozzetto (uso completa TCM per la transfezione finta). Etichettare ogni bene per quanto riguarda l'aggiunta di retrovirus o finto media.
- Centrifugare le piastre a 1200 x g per 30 min a temperatura ambiente.
- Mentre girano piatti, raccogliere le cellule di T attivate e contare utilizzando un emocitometro.
- Trasduzione avviene con 5 x 106 attivato splenocytes in un totale di 5 mL/pozzetto. A pellet il numero richiesto di splenocytes per derisione/trasduzione in provette separate mediante centrifugazione a 500 x g per 5 min.
- Risospendere splenocytes ad una densità di 5 x 106 cellule per 2,5 mL di surnatante filtrato contenenti retrovirus dal passaggio 2.6.4 o TCM come controllo negativo. Aggiungere ricombinante umano il-2 (hIL-2) e mouse ricombinante IL-7 (mIL-7) a una concentrazione finale di 200 IU/mL e 4 ng/mL rispettivamente.
- Raccogliere le piastre da 6 pozzetti dalla centrifuga al completamento del passaggio 2.6.5 e aggiungere 2,5 mL/pozzetto risospeso splenocytes in appositi pozzetti per rendere un volume finale di 5 mL/bene e una concentrazione finale di 100 U/mL hIL-2 e 2 ng/mL mIL-7.
- Centrifugare le piastre a 1200 x g per 90 min a temperatura ambiente. Dopo centrifugazione, incubare le piastre a 37 ° C, 5% CO2 durante la notte.
- Giorno 5: Round 2 della trasduzione
- Raccogliere il frammento di fibronectina umana ricombinante dalle piastre come questo può essere riutilizzato. Ripetere i passaggi 2.6.2 - 2.6.5.
- Mentre girano piatti, raccogliere le cellule dal 1st tondo di trasduzione utilizzando una pipetta Pasteur. Sciacquare ogni pozzetto con 2 mL di PBS, turbinio e raccogliere tutte le cellule rimanenti in ciascun pozzetto.
Nota: Pipettare su e giù per risospendere le cellule sedimentate. Raccogliere ogni gruppo di controllo/trasduzione in provette separate. - Provette per centrifuga a 500 x g per 5 min. Risospendere le cellule in 2,5 mL per pozzetto di trasduzione con 200 IU/mL IL-2 e 4 ng/mL IL-7. Ripetere i passaggi 2.6.7 - 2.6.8.
- Rimuovere le cellule dalla centrifuga e incubare a 37 ° C, 5% CO2 per celle di 4 h. raccogliere trasformata come passi 2.7.2-2.7.3.
- Contare le celle, centrifugare a 500 x g per 5 min e risospendere in TCM completa ad una densità di 1 x 106 cellule/mL con 100 U/mL hIL-2 e 2ng/mL mIL-7. Trasferire in un pallone di cultura opportunamente dimensionati e incubare a 37 ° C, 5% CO2.
- Aggiungere file multimediali TCM fresco contenente 100U/mL hIL-2 e 2ng/mL mIL-7 ogni 2 giorni, mantenere una densità cellulare di 1 x 106 cellule/mL.
Nota: Splenocytes raccolte contengono una varietà di tipi cellulari. In queste condizioni di coltura, le cellule T non muoiono nel corso di 2-3 giorni. Dopo ~ 4 giorni nella coltura cellulare, il numero di cellule T è in genere equivalente al numero totale degli splenocytes raccolte il giorno 0.
3. misurazione della efficienza di trasduzione
- Sulla trasduzione di post del giorno 4, raccogliere un campione di cellule T trasdotte o non trasdotte (circa 3 x 105 cellule). Centrifugare la sospensione cellulare a 500 x g per 5 min, eliminare il supernatante, lavare le cellule pellettate una volta con PBS e centrifugare nuovamente.
- Scartare il surnatante e aggiungere 100 μL di PBS contenente un colorante reattivo di ammina adatto (per esempio, live/dead macchia, diluizione 1 a 100) per pozzetto. Incubare per 15 min a temperatura ambiente al buio.
- Lavare due volte con PBS e centrifugare a 500 g per 5 min, scartare il surnatante e incubare con 50 μL di tampone di FACS contenente anticorpi anti-topo CD16/CD32 recettori Fc blocco (diluizione 1 a 100). Incubare per 10 min a 4 ° C.
- Direttamente aggiungere 50 µ l di anticorpo che macchia mix master contenente anti-topo BV786 CD4 e CD8-BV711 anticorpi (concentrazione finale di 1 μL/pozzetto nel buffer di FACS). Incubare per 30 min a 4 ° C nel buio. Ripetere il passaggio di lavaggio 3.3. Risospendere le cellule in buffer di PFA 1% e mantenere al buio a 4 ° C fino all'analisi di citometria a flusso.
- Analizzare le cellule con citometro adatto equivalente utilizzando BV711, BV785 e mCherry fluorescenza come marcatori di sottoinsieme CD4 e CD8 e di auto espressione rispettivamente gating come in (Figura 2).
4. in vitro convalida di auto T cell attività
- Seme syngeneic destinazione CD19+ le cellule del tumore con o senza espressione di luciferase ad una densità di 1 x 104 cellule in 100 μL TCM/pozzetto in un fondo U 96 pozzetti piastra di coltura del tessuto.
- Aggiungere 1 x 104 CD19 auto T cellule/pozzetto in un volume di 100 μL/pozzetto per raggiungere un realizzatore al rapporto di 1:1 di destinazione (t).
Nota: E:T rapporti dovrebbero essere stabiliti per ogni auto costruire e linea cellulare di destinazione. - Solo uso T cellule e le cellule del tumore da solo come controllo negativo e cellule T stimolate dall'acetato di miristato di phorbol (PMA) (50 ng/mL) e ionomicina (1 μg/mL) come controllo positivo per il rilascio di interferone gamma (IFNγ). Cellule di co-coltura a 37 ° C, 5% CO2 per 16-24 h.
- A seguito di co-coltura, centrifugare le piastre a 500 x g per 5 min e raccogliere il surnatante per ulteriori analisi IFNγ e IL - 12p70 ELISA.
Nota: Questo può essere conservato a-80 ° C. - Risospendere il pellet di cellule in 100 μL di PBS contenente luciferina (concentrazione finale di 1,5 mg/mL). Incubare le piastre per 10 min a 37 ° C. Quindi misurare la luminescenza da ogni pozzetto con un luminometro adatto.
Nota: Tempi di esposizione devono essere ottimizzati per densità e linee cellulari. Risultati rappresentativi sono mostrati in Figura 3a. Ex-vivo di citotossicità delle cellule di T auto modificabile a luciferina espressa dalla co-cultura con linee cellulari che esprimono antigene bersaglio. Come le cellule di T auto uccidono le cellule bersaglio, luciferina viene rilasciato, quindi una riduzione del segnale di parametri è correlata con l'uccisione delle cellule. Cellule trasdotte non possono spesso avere un effetto sulla vitalità cellulare di destinazione, soprattutto per periodi di incubazione lunga. Misurare la concentrazione di murino IFNγ e IL - 12p70 nel surnatante secondo protocolli di ELISA del produttore. Risultati rappresentativi sono mostrati in (Figura 3b e 3C). Ex vivo l'attivazione delle cellule di T auto da co-coltura con linee cellulari che esprimono l'antigene bersaglio può essere analizzato analizzando surnatante contenuto usando ELISA. Il rapporto delle cellule di T auto alle cellule bersaglio e la lunghezza del periodo di co-coltura deve essere ottimizzati per ogni costrutto auto, riga della cella di destinazione e dell'analita. Trattamento di PMA e ionomicina può essere utilizzato come controllo positivo per confermare la qualità delle cellule T e la loro capacità di rispondere.
5. valutare l'attività anti-cancro in topi
-
Protocollo n. 1
- Effettuare 100 mg/kg per via endovenosa (IV) consegna di ciclofosfamide in topi BALB/c 6 a 8 settimane. Questo consente di attecchimento del tumore senza significativi lymphodepletion17 (Figura 4).
Nota: Che istituisce A20 linfoma può prendere più di 2 mesi con un tasso di prendere non ottimali. Questo può essere migliorato tramite l'uso di ciclofosfamide 1 giorno prima della consegna delle cellule di linfoma. Al fine di studiare lymphoreplete topi, abbiamo identificato una dose di ciclofosfamide che potrebbe aumentare l'efficienza di linfoma senza causare lymphodepletion. - Il giorno successivo, iniettare 100 µ l di 5 x 105 syngeneic A20 B-cellula linfoma a cellule modificate per esprimere la proteina fluorescente luciferasi e verde (GFP) in topi per iniezione endovenosa (IV).
- Consentire i topi di sviluppare linfoma sistematico per ~ 17 giorni.
- Confermare la presenza di linfoma sistematico tramite l'iniezione intraperitoneale (IP) di 100 μL di luciferina di 30 mg/mL e imaging utilizzando un bioluminescenza in vivo imaging system.
- Utilizzare i separatori per evitare la ricaduta di segnale in topi adiacenti. Esporre i topi per 1 min sul lato ventrale con una regione di dimensione costante di interesse.
- Visualizzare unità di luce relativa (RLU) come fotoni al secondo (p/s). Le impostazioni devono essere ottimizzate per ogni modello di tumore; utilizzare un'esposizione che può ritirare la diagnosi precoce dei tumori, ma non porta a saturazione come tumori raggiungono gli endpoint.
- RLU record totali per ogni mouse con una costante di dimensioni area di interesse. (Figura 5a e b).
- Iniettare un linfoma di singola dose di 1 x 106 cellule T auto tramite iniezione IV lymphoreplete topi cuscinetto stabilito.
Nota: (importante) Livelli di dosaggio deve essere stabilito per ogni auto costruire utilizzando un programma di escalation della dose per assicurare che qualsiasi possibile tossicità derivanti da cellule T auto sono caratterizzate e possono essere affrontate. Anche se cellule di anti-topo CD19 auto T non vengono visualizzate le tossicità, le cellule di T auto possono dar luogo a tossicità inattesa. Dove più efficienza di trasduzione e costrutti di auto non è identico, il numero totale delle cellule di T amministrato deve rimanere uguale con l'aggiunta di cellule di T non trasdotte in preparazioni di cellule. - Monitorare la progressione della malattia settimanale attraverso iniezione del IP di 100 μL di luciferina di 30 mg/mL e imaging utilizzando un bioluminescenza in vivo imaging system (Figura 5C).
- Attento monitoraggio topi per i segni di tossicità ed eutanasia qualsiasi topi che mostrano segni precoci di paralisi dell'arto (HLP) o carico patologico del tumore prima di qualsiasi sofferenza può sorgere.
Nota: Tossicità da A20 linfoma possono includere paralisi dell'arto posteriore attraverso l'invasione del tumore delle meningi. Controllare regolarmente per i primi segni di andatura alterata. Allo stesso modo, i grandi tumori IP possono sorgere che può portare a disagio mostrato dal comportamento alterato. - Monitorare la sopravvivenza dei topi per 60-100 giorni (Figura 5d). Eseguire l'eutanasia di un metodo di pianificazione-1 al momento della conclusione dell'esperimento.
- Effettuare 100 mg/kg per via endovenosa (IV) consegna di ciclofosfamide in topi BALB/c 6 a 8 settimane. Questo consente di attecchimento del tumore senza significativi lymphodepletion17 (Figura 4).
-
Protocollo n. 2
- Consegnare la ciclofosfamide 200 mg/kg a 6-8 - settimana-vecchi topi BALB/c tramite l'iniezione della vena coda in 100 μL di PBS per topo.
- Il giorno seguente, iniettare 5 x 105 syngeneic A20 B-cellula cellule di linfoma esprimendo la luciferasi e GFP in 100 μL PBS tramite vena iniezione coda.
- Consentire i topi sviluppare i linfomi sistematici per ~ 7-14 giorni
- Confermare linfoma sistematico tramite l'iniezione di 100 μL di luciferina di 30 mg/mL e imaging utilizzando un bioluminescenza in vivo imaging sistema IP.
- Eseguire 5 Gy-irradiazione corporea totale (TBI) a 0.02 Gy/min per lymphodepletion.
Nota: Pazienti sottoposti a trattamenti con le auto T-cellule subiscono una gamma di regimi di raggiungere lymphodepletion prima l'amministrazione delle cellule di T di auto che aumenta significativamente l'attecchimento di passivamente trasferiti le cellule di T di auto. Questo può essere replicato in topi con irradiazione corporea totale (TBI) (Figura 6). - Il giorno successivo, iniettare 1 x 106 cellule T auto in 100 μL di PBS tramite coda vena iniezione nei topi cuscinetto stabilito tumori.
- Raccogliere sangue campioni via coda vena sanguina dopo 7 giorni.
- Aggiungere tampone di lisi delle cellule rosse per ogni campione di sangue, quindi preparare per citometria a flusso come descritto nella sezione 3. Analizzare la persistenza di cella auto T nella circolazione da citometria a flusso (Figura 2).
Nota: Aggiunta di perline conteggio immediatamente prima della citometria a permette di determinare il numero di auto T cellule per millilitro di sangue. - Monitorare il progresso di malattia come descritto ai punti 5.1.5 - 5.1.8 (Figura 7).
Risultati
Per la trasduzione di alta efficienza delle cellule T, è necessario ottenere fresche particelle retrovirali. Transfezione della linea cellulare Plat-E con pCL-Eco produttore plasmide e plasmide retrovirus pMP71 dà luogo alla secrezione di particelle retrovirali nella cella surnatante. Quando un gene marcatore fluorescente, come mCherry, è codificato nel retrovirus, successo transfezione può essere confermata mediante microscopia a fluorescenza (Figura 1). Surnatante contenenti virus da cellule trasfettate Plat-E viene utilizzato per trasdurre cellule T tramite 2 giri di centrifuga-fection su piastre rivestite con frammento di fibronectin. L'efficienza di trasduzione può essere determinato 4 giorni dopo la trasduzione tramite flusso cytometry. Trasdotte con successo cellule esprimono il gene marcatore codificato nel retrovirus (Figura 2). L'efficienza di trasduzione vanno da ~ 50-90% di efficienza con i ricevitori di prima generazione per ~ 10-40% con auto costruisce vicino la capacità di confezionamento retrovirali. Mentre l'espressione del gene marcatore indica successo trasduzione retrovirale, è fondamentale per mostrare la funzionalità delle cellule di T auto al momento coinvolgente con cellule quello antigene bersaglio espressa sulla loro superficie. Linee cellulari bersaglio modificate per esprimere luciferasi utilizzabile nei saggi di luciferasi per testare il grado di uccisione delle cellule dalle cellule di T auto direttamente (Figura 3A). Il rilascio di citochine effettrici dalle cellule di T auto al momento di co-coltura con cellule bersaglio, determinate da ELISA, può anche essere utilizzato come una misura indiretta di citotossicità delle cellule di T auto (Figura 3B e 3C).
Cellule di T auto prodotte nel presente protocollo possono essere valutate in topi lymphoreplete stabilendo linfoma sistematico A20 con una dose di 100 mg/kg di ciclofosfamide (iniettato per via endovenosa), 1 giorno prima dell'iniezione IV delle cellule di 5 x 105 A20 (Figura 4). Iniezione del IP con luciferina e immagine cattura utilizzando un imager di bioluminescenza in vivo può essere utilizzato per monitorare il carico del tumore usando un tempo ROI e l'esposizione costante in tutto (Figura 5A-C). Cellule di T auto modificate per esprimere IL-12 sono in grado di debellare linfoma sistemico con lymphodepleting pre-condizionamento dando la sopravvivenza libera da malattia in circa il 25% dei topi (Figura 5). Lymphodepleting precondizionamento, raggiunto da 5 Gy TBI 1 giorno prima della somministrazione IV di cellule T auto, significativamente migliora l'attecchimento (Figura 6). In questo modello, le cellule di T auto di prima generazione sono in grado di debellare linfoma sistematico A20, inducendo in genere sopravvivenza libera da malattia nel 100% dei topi (Figura 7).
Figura 1. Conferma della riuscita transfezione delle cellule di Plat E. Plat-E cellule trasfettate con il costrutto di auto retrovirale e pMP71 e DNA del plasmide vettore del confezionamento di pcl-Eco. Transfezione di successo è dimostrata dall'espressione del gene marcatore fluorescente mCherry. A) microscopia del campo luminoso, B) microscopia di fluorescenza e C) immagini unite sono mostrati. Ingrandimento = 50 X. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2. Determinare l'efficienza di trasduzione tramite flusso cytometry. Citometria a flusso è utilizzato per determinare l'efficienza di trasduzione delle cellule del mouse T su trasduzione del messaggio di giorno 4, usando UV Zombie live/dead, mCherry, BV711 e BV785 per la rilevazione del live, auto costruire, le cellule CD4 e CD8, rispettivamente. Risultati rappresentativi di A) Non-trasdotte, B) mCherry.αmCD19.mCD3z e C) mCherry.αmCD19.mCD3z.mIL12 sono mostrati con gating di 1) 2 canottiere) 3 cellule vive) CD4 e CD8 4) e 5) valutazione delle cellule positive mCherry esprimendo auto. Clicca qui per visualizzare una versione più grande di questa figura.
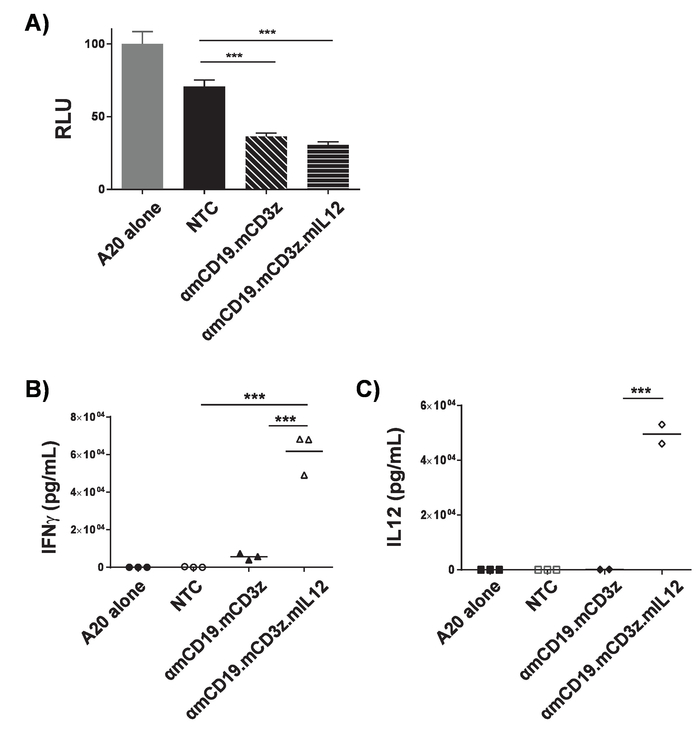
Figura 3. Convalida di attività auto T-cell. Cellule di T di auto αmCD19 erano co-coltivate con le cellule di linfoma A20 modificate per esprimere luciferasi (1 x 104: 1 x 104) per 16 h in un piatto fondo U 96 pozzetti. Dopo co-coltura, le cellule erano pellettate e surnatante è stato raccolto. A) cellule erano risospesi in PBS e parametri è stato utilizzato per valutare la vitalità delle cellule bersaglio. Surnatante da co-coltura è stata valutata la presenza di IFNγ (B) e IL-12 (C). Il rapporto delle cellule di T auto alle cellule bersaglio e la durata del periodo di co-coltura devono essere ottimizzati per ogni auto costruire e linea cellulare di destinazione. Trattamento PMA e ionomicina può essere utilizzato come controllo positivo per confermare la qualità delle cellule T e le loro cellule di capacità di rispondere. Barre di errore indicano SD. Statistical analysis è stata effettuata usando il One-way ANOVA. p < 0,001). Questa figura è stata modificata da17. Clicca qui per visualizzare una versione più grande di questa figura.
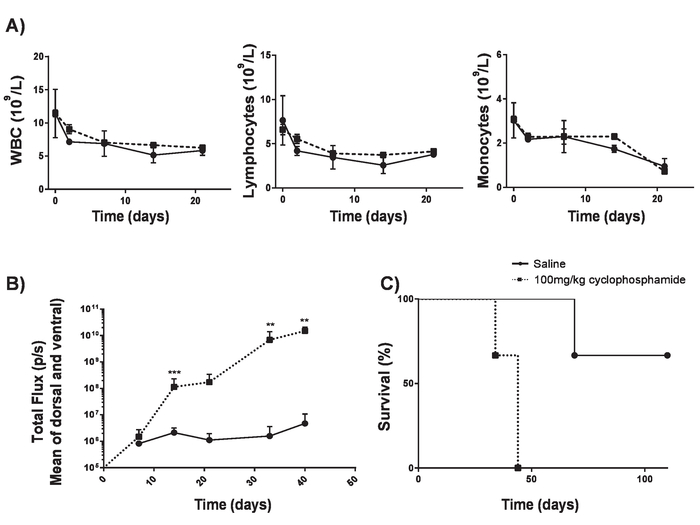
Figura 4. Che istituisce A20 linfoma senza lymphodepletion. Ciclofosfamide può aumentare l'efficienza dell'induzione di linfoma senza causare lymphodepletion. A) i conteggi di anima dei topi BALB/c 6-8-settimana-vecchio dopo la consegna di IV di 100 mg/kg di ciclofosfamide. Barre di errore indicano SD B) onere di linfoma di topi BALB/c 6-8-week-old dopo IV recapito di 100 mg/kg di ciclofosfamide o soluzione fisiologica il giorno -1 e la IV delle cellule di 5 x 105 A20 il giorno 0 misurata usando un luminometro. C) la sopravvivenza dei topi in B). Barre di errore indicano SD. Statistical analysis è stato effettuato usando 2-way ANOVA. * * p < 0.01, * * * p < 0,001). Questa figura è stata modificata da Kueberuwa et al. 17. Clicca qui per visualizzare una versione più grande di questa figura.
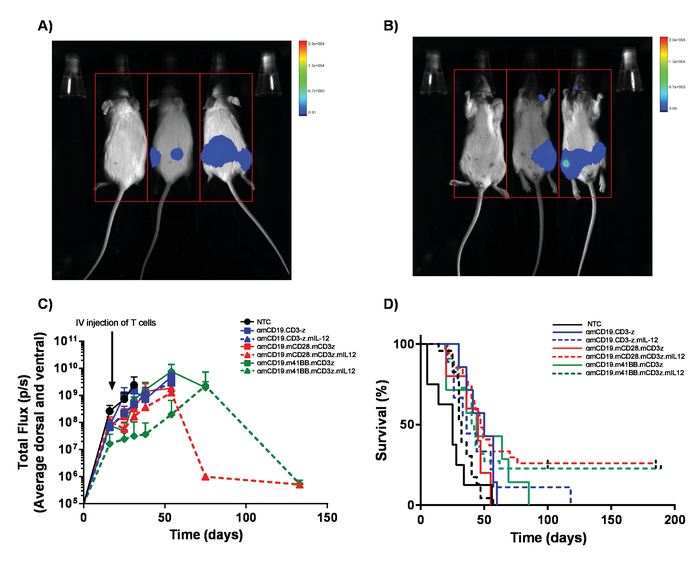
Figura 5. Monitoraggio degli oneri di linfoma e la sopravvivenza. Topi che sopportano A20 linfoma esprimendo la luciferasi ricevano 100 µ l (IP) le iniezioni intraperitoneali di luciferina di 30 mg/mL ed erano imaged utilizzando un bioluminescenza in vivo imaging system. A) topi sono stati esposti per 1 min sul lato ventrale e immediatamente girati su dorsale per raccogliere le masse tumorali su entrambi i lati dei corpi (B)all'immagine. C) risultati rappresentativi dall'onere di linfoma di topi BALB/c ricevendo diverse cellule di T auto αmCD19 senza lymphodepletion. Barre di errore indicano SEM. D) tasso di sopravvivenza dei topi stessi. Questa figura è stata modificata da Kueberuwa et al. 17. Clicca qui per visualizzare una versione più grande di questa figura.
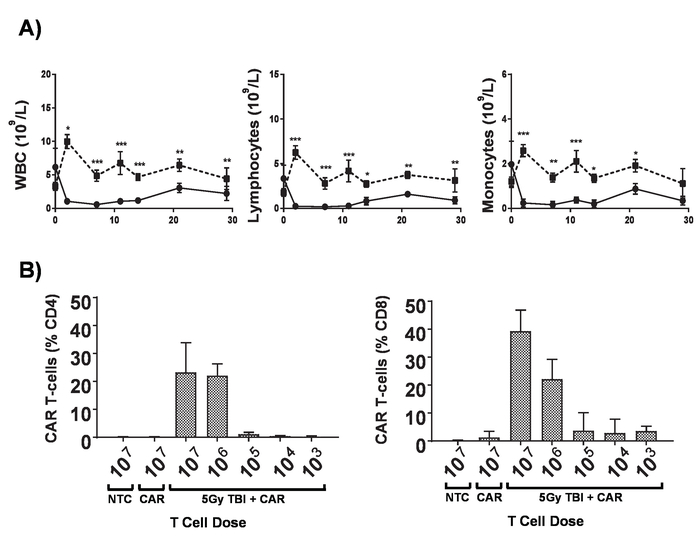
Nella figura 6. Effetti del lymphodepletion. A) i conteggi di anima dei topi BALB/c 6-8-settimana-vecchio dopo la ricezione di 5 Gy TBI a un tasso di dose di 0.02 Gy/min; barre di errore indicano SD. Statistical analysis mediante ANOVA a due vie. p < 0,05, * * p < 0.01, * * * p < 0,001. B) + monitoraggio di CD4 e CD8+ auto T cellule nel sangue periferico di topi da citometria a flusso per l'amministrazione di post mCherry marcatore gene 7 giorni. Barre di errore indicano SD Questa figura è stata modificata da Kueberuwa et al. 17. Clicca qui per visualizzare una versione più grande di questa figura.
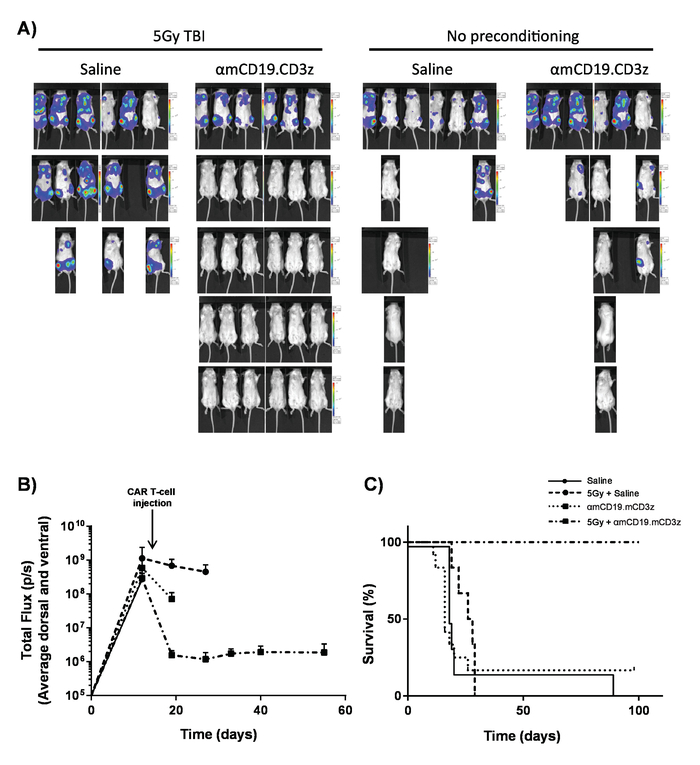
Figura 7. Attività a cellula T auto con pre-condizionata lymphodepleting. Risultati tipici che mostrano l'effetto di 5 Gy TBI il giorno prima della somministrazione di auto T-cellula. A) display grafici Imaging e (B) di formazione immagine dei topi dopo 100 µ l (IP) le iniezioni intraperitoneali di luciferina di 30 mg/mL utilizzando una bioluminescenza in vivo imaging system. Barre di errore indicano SEM. C) sopravvivenza dei topi stessi. Questa figura è stato modificato fromKueberuwa et al. 17. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Syngeneic del topo modelli permettono la sperimentazione di progressione di malattia e terapia pur mantenendo un sistema immunitario intatto. Questo è fondamentale quando si tratta di terapie che interagiscono con il sistema immunitario e in particolare per gli agenti immunoterapeutici.
Il protocollo descritto qui ha due flussi di lavoro critico, quello primo è modifica genetica delle cellule di T del mouse per esprimere le automobili. Ciò richiede 7 giorni da iniziazione alla convalida di trasduzione. Concomitante con la produzione delle cellule di T di auto è l'istituzione di linfoma sistematico nei topi. Dovrebbe produzione delle cellule T auto fallire o essere di qualità insufficiente, in genere non c'è abbastanza tempo per produrre cellule sostitutive prima topi soccombere al linfoma. Pertanto è fondamentale che i ricercatori che usano questi modelli accuratamente eseguano studi di progressione di malattia e di dosaggio del tumore per volta con successo la produzione delle cellule di T auto per somministrazione terapeutica.
Motivi tipici per bassa efficienza di trasduzione di cellule T include efficienza scarsa transfezione delle cellule di produttore, in genere causato da scarsa plasmide purezza o inesatta determinazione del pH dei media di transfezione. Si consiglia di verificare l'efficienza di trasfezione cellulare produttore prima di procedere con il protocollo completo come povera transfezione limiterà l'efficienza di trasduzione del T-cell. Frammenti di fibronectina umana ricombinante possono essere raccolti e conservati a-20 ° C per il riutilizzo, tuttavia, risultato più di gelo-disgelo in efficienza di trasduzione ridotta. Rapida elaborazione delle milze del mouse dopo la raccolta è anche importante per l'ottenimento di elevati rendimenti di cellule vitali di T.
Si deve osservare che il protocollo qui descritto utilizza celle A20 esprimendo la luciferasi. Questo è comodo come fornisce la capacità di misurare il carico sistemico del tumore da formazione immagine di bioluminescenza. Tuttavia, in presenza di un sistema immunitario funzionante, risposte a luciferasi potrebbero falsare i risultati. In precedenza abbiamo testato le reazioni immuni della sopravvivenza di topi a marcatore transgeni17. È la chiave per replicare esperimenti chiavi utilizzando A20 cellule prive di transgeni per convalidare che questi non giocano un ruolo significativo nell'estirpazione del tumore dalle cellule immuni.
Mentre gli agenti clinici possono essere solo usato in vivo in topi immune-carenti, l'uso di cellule di topo auto T contro le cellule tumorali di topo permette di valutare i contributi del sistema immunitario a progressione di malattia o di efficacia terapeutica. Questo protocollo potrebbe essere utilizzato per la valutazione pre-clinica di automobili targeting linfoma della B-cellula o altre vetture con modifiche aggiuntive come la secrezione di IL-12 come descritto qui. Deve essere notato che anche se l'interazione tra cellule immunitarie possa essere valutata in modelli syngeneic del topo, essi possono non accuratamente ricapitolare interazione in esseri umani in vivo. Di particolare nota, umano e mouse auto variano nella struttura, che può avere conseguenze a valle; condizioni di coltura delle cellule e l'attivazione ottimale per la crescita delle cellule di T sono diversi20, distribuzione tissutale di espressione dell'antigene bersaglio può variare tra gli esseri umani e topi e tossicità con esperienza potrebbe essere radicalmente diversa. Pertanto è essenziale utilizzare ex vivo e xenogenici modelli per corroborare i risultati.
In sintesi, il syngeneic lymphodepleted e lymphoreplete modello di linfoma ricapitolare pazienti con e senza previa chemio/radioterapia. Ciò fornisce un sistema modello imitare le impostazioni cliniche per consentire la sperimentazione di una gamma di strategie terapeutiche che sarà importante con la prossima ondata di nuovi agenti di terapia immune.
Con l'uso di pre-condizionamento, si noterà che tutti i topi in genere chiaro il linfoma. Con fino a tassi di risposta completa 90% negli esseri umani, questo è rappresentante. Tuttavia, le sfide per la terapia CD19 auto T-cellulare dipenderà impedendo l'alta frequenza di recidive osservate che sono spesso CD19. Le ricadute non sono state osservate in questo modello fino a e spesso di là di 100 giorni. Modifiche per imitare le ricadute vedute nella clinica potrebbero aiutare con le sfide future della terapia CD19 auto T-cellulare.
Divulgazioni
David Gilham funziona per Celyad che è coinvolto nella produzione delle cellule di T di auto. Il resto degli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare Bloodwise per il finanziamento di questa ricerca (grant 13031) e servizi di nucleo CRUK Manchester risorsa biologica unità, imaging e citometria e biologia molecolare per sostenere questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filter | Appleton Woods | FC121 | |
| 0.45 µm syringe filter | Appleton Woods | FC122 | |
| 1.5ml pestle and microtube | VWR | 431-0098 | |
| 100X penicillin-streptomycin-glutamine (PSG) | Gibco | 10378016 | |
| 2-Mercaptoethanol (50 mM) | Gibco | 31350-010 | |
| Blasticidine S hydrochloride | Sigma- Aldrich | 15205 | |
| Bottle Top Filter (0.2 µm) | Scientific Laboratory Supplies | FIL8192 | |
| Brilliant Violet 711 anti-mouse CD8a Antibody | BioLegend | 100759 | 1 in 100 staining dilution. Clone 53-6.7 |
| Brilliant Violet 785 anti-mouse CD4 Antibody | BioLegend | 100552 | 1 in 100 staining dilution. Clone RM4-5 |
| Calcium chloride dihydrate | Sigma- Aldrich | C7902 | |
| Cell counting beads – CountBright absolute counting beads | Molecular Probes | C36950 | |
| Cell Strainer 100μm | VWR | 734-0004 | |
| Cyclophosphamide Monohydrate | Merck | 239785-1GM | |
| Dulbecco’s Modified Eagle medium (DMEM) - High Glucose | Sigma Aldrich | D6546 | |
| Dynabeads | Gibco | 11131D | |
| Ficoll Paque Plus | GE Healthcare | GE17-1440-03 | Sold by Sigma- Aldrich |
| Flow cytometer - LSR Fortessa x20 | BD Biosciences | 658222R1 | |
| Foetal Bovine Serum | Gibco | 10270 | |
| Haemacytometer | Appleton Woods | HC001 | |
| HEPES solution | Sigma- Aldrich | H0887 | |
| IL-12 p70 Mouse Uncoated ELISA Kit | Invitrogen | 88-7121-76 | |
| IL2, Proleukin | Novartis | PL 00101/0936 | |
| in vivo bioluminescence imaging system – in vivo xtreme II imaging system | Bruker | T149094 | |
| Ionomycin Calcium Salt | Sigma- Aldrich | I0634 | |
| Live/dead stain - Zombie Violet Fixable Viability Kit | BioLegend | 423114 | 1 in 100 staining dilution |
| Luminometer - Lumistart Omega | BMG Labtech | 415-301 | |
| Murine IFN-γ ELISA kit | Diaclone | 861.050.010 | |
| Paraformaldehyde | Sigma- Aldrich | 16005 | |
| pCL-Eco | Novus Biologicals | NBP229540 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma- Aldrich | P8139 | |
| Platinum E cell line | Cell Biolabs | RV-101 | (RRID:CVCL_B488) |
| Purified NA/LE Hamster Anti-Mouse CD28 | BD Biosciences | 553294 | Clone 37.51 |
| Purified NA/LE Hamster Anti-Mouse CD3ε | BD Biosciences | 553057 | Clone 145-2C11 |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553142 | 1 in 100 staining dilution. Clone 2.4G2 |
| Puromycin Dihydrochloride | Sigma- Aldrich | P8833 | |
| Recombinant human fibronectin fragment - RetroNectin Reagent | TaKaRa | T100B | |
| Recombinant Mouse IL-7 (carrier-free) | BioLegend | 577806 | |
| Red cell lysis buffer | eBioscience | 004-4333-57 | |
| RPMI 1640 Medium | Lonza | BE12-167F | |
| Trypsin - EDTA solution | Sigma- Aldrich | T3924 | |
| XenoLight D-Luciferin | Perkin Elmer | 122799 |
Riferimenti
- Brian, W. Food and Drugs Administration Biologics Licence Application Approval letter. , Available from: https://www.fda.gov/downloads/BiologicsBloodVaccines/CellularGeneTherapyProducts/ApprovedProducts/UCM574106.pdf (2017).
- Malarkey, M., Brian, W. Food and Drugs Administration Biologics Licence Application Approval letter. , Available from: https://www.fda.gov/downloads/biologicsbloodvaccines/cellulargenetherapyproducts/approvedproducts/ucm581259.pdf (2017).
- Liu, Y., Zeng, G. Cancer and Innate Immune System Interactions: Translational Potentials for Cancer Immunotherapy. Journal of Immunotherapy. 35 (4), Hagerstown, Md. 299-308 (2012).
- Janssen, L. M. E., Ramsay, E. E., Logsdon, C. D., Overwijk, W. W. The immune system in cancer metastasis: friend or foe. Journal for ImmunoTherapy of Cancer. 5 (1), 79(2017).
- Pandya, P. H., Murray, M. E., Pollok, K. E., Renbarger, J. L. The Immune System in Cancer Pathogenesis: Potential Therapeutic Approaches. Journal of Immunology Research. 2016, 13(2016).
- Vinay, D. S., et al. Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Seminars in Cancer Biology. 35, S185-S198 (2015).
- Gajewski, T. F., Meng, Y., Harlin, H. Immune Suppression in the Tumor Microenvironment. Journal of Immunotherapy. 29 (3), 233-240 (2006).
- Munn, D. H., Bronte, V. Immune suppressive mechanisms in the tumor microenvironment. Current opinion in immunology. 39, 1-6 (2016).
- Vanderlugt, C. L., Miller, S. D. Epitope spreading in immune-mediated diseases: implications for immunotherapy. Nature Reviews Immunology. 2, 85(2002).
- Hardwick, N., Chain, B. Epitope spreading contributes to effective immunotherapy in metastatic melanoma patients. Immunotherapy. 3 (6), 731-733 (2011).
- Makkouk, A., Weiner, G. Cancer Immunotherapy and Breaking Immune Tolerance-New Approaches to an Old Challenge. Cancer research. 75 (1), 5-10 (2015).
- Jackson, S. R., Yuan, J., Teague, R. M. Targeting CD8(+) T-cell tolerance for cancer immunotherapy. Immunotherapy. 6 (7), 833-852 (2014).
- Brentjens, R. J., et al. Lymphodepletion and tumor burden govern clinical responses in patients with B-cell malignancies treated with autologous, CD19-targeted T cells. Journal of Clinical Oncology. 29 (15_suppl), 2534(2011).
- Brentjens, R. J., et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood. 118 (18), 4817(2011).
- Hay, K. A., et al. Kinetics and Biomarkers of Severe Cytokine Release Syndrome after CD19 Chimeric Antigen Receptor-modified T Cell Therapy. Blood. 130, 2295-2306 (2017).
- Zhang, T., et al. Efficiency of CD19 chimeric antigen receptor-modified T cells for treatment of B cell malignancies in phase I clinical trials: a meta-analysis. Oncotarget. 6 (32), 33961-33971 (2015).
- Kueberuwa, G., Kalaitsidou, M., Cheadle, E., Hawkins, R. E., Gilham, D. E. CD19 CAR T Cells Expressing IL-12 Eradicate Lymphoma in Fully Lymphoreplete Mice through Induction of Host Immunity. Molecular Therapy - Oncolytics. 8, 41-51 (2018).
- Engels, B., et al. Retroviral vectors for high-level transgene expression in T lymphocytes. Human Gene Therapy. 14 (12), 1155-1168 (2003).
- Parkinson, C. M., et al. Diagnostic Necropsy and Selected Tissue and Sample Collection in Rats and Mice. Journal of Visualized Experiments: JoVE. (54), e2966(2011).
- Kueberuwa, G., et al. CCR7(+) selected gene-modified T cells maintain a central memory phenotype and display enhanced persistence in peripheral blood in vivo. Journal for Immunotherapy of Cancer. 5, 14(2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon