Method Article
Cell-based test per studiare la Clearance di Tau anticorpo-mediato da Microglia
In questo articolo
Riepilogo
Qui descriviamo un'analisi basata sulle celle per valutare quantitativamente l'assorbimento tau da microglia con l'obiettivo di creare uno strumento in fase di sperimentazione per caratterizzare meglio i meccanismi di azione degli anticorpi anti-tau.
Abstract
Morbo di Alzheimer (annuncio) è una condizione neurodegenerativa progressiva in cui aggregati tau e dell'amiloide proteine si accumulano nel cervello che causano la disfunzione neuronale che finalmente conduce al declino conoscitivo. Aggregati di tau iperfosforilata nel neurone sono creduti per causare la maggior parte della patologia associata con l'annuncio. Questi aggregati sono assunto per essere rilasciato nel compartimento extracellulare e ripreso da neuroni sani adiacenti dove inducono ulteriore aggregazione tau. Questa diffusione "del prion-like" può essere interrotto dagli anticorpi in grado di legare e di "neutralizzare" aggregati extracellulare tau come mostrato nei modelli preclinici del topo dell'annuncio. Uno dei meccanismi proposti da cui gli anticorpi terapeutici riducono la patologia è anticorpo-mediato l'assorbimento e la clearance di forme patologiche aggregate di tau di microglia. Qui, descriviamo un dosaggio quantitativo basato a cellula per valutare l'assorbimento tau da microglia. Questo test utilizza la linea cellulare di topo microglial BV-2, permette di alta specificità, bassa variabilità e rendimento medio. I dati generati con questo test possono contribuire a una migliore caratterizzazione delle funzioni effettrici degli anticorpi anti-tau.
Introduzione
Morbo di Alzheimer (annuncio) è una condizione neurodegenerativa caratterizzata dal cambiamento conformazionale e auto-assemblaggio della proteina tau e del peptide amiloide β in aggregati patologici. Il peptide β amiloide solubile normale viene convertito in β amiloide oligomerici e fibrillare, mentre tau anormalmente fosforilata si accumula come oligomeri e grovigli neurofibrillary1,2. Questi aggregati di proteina causano morte neuronale che porta alla perdita di memoria e declino conoscitivo progressivo successivo. Altri fattori, tra cui non produttivi neuroinflammation e una ridotta capacità di eliminare le proteine misfolded, possono aggravare e accelerare la malattia. Attualmente, le strategie di intervento contro AD fornire sollievo sintomatico in gran parte, ma non ci è cura o prevenzione modificante la malattia.
La prova aumentante suggerisce un ruolo chiave degli aggregati di tau iperfosforilata in patologia dell'annuncio. Nel suo stato non patologico, tau è una nativo spiegata della proteina che si lega ai microtubuli e promuove il loro assemblaggio in del citoscheletro neuronale. Quando tau diventa hyperphosphorylated, esso si stacca dal citoscheletro e cluster in aggregati di tau nel neurone, che si credevano per causare la maggior parte della patologia associata AD3. Aggregate tau inizia ad accumulare prima intracellulare, ma come la malattia progredisce, si presume di essere rilasciato dai neuroni interessati nello spazio extracellulare, da cui possono essere presi dai neuroni sani adiacenti o sinapticamente connessi in un " prione-come il modo". Una volta interiorizzato, l'aggregato di tau induce ulteriore aggregazione tau via cambiamento conformazionale basato su modelli4.
Secondo questa ipotesi, terapie in grado di interrompere tau semina potrebbero rallentare o invertire il corso della malattia neurodegenerative tau-mediata. A sostegno di ciò, topi reso suscettibile di tauopathy da mutazione genetica e passivamente iniettato con gli anticorpi anti-tau mostrano ridotta taupatia e miglioramento della funzione cognitiva5,6,7,8 ,9. Tuttavia, i meccanismi da cui gli anticorpi terapeutici riducono patologia rimangono ancora sfuggenti.
Uno dei meccanismi proposti è l'assorbimento dell'anticorpo-mediata e la clearance di forme patologiche aggregate di tau da microglia, residente cellule immunitarie del cervello. Pubblicazioni recenti suggeriscono che il microglia in modo efficiente può interiorizzare e degradare specie patologiche tau e questa capacità è arricchita da anticorpi anti-tau tramite un Fc-dipendente meccanismo che coinvolge Fc recettori espressi sulla superficie di microglia e recettore mediata fagocitosi10,11. Questi dati per identificare microglia come potenzialmente importanti effettori di anticorpi terapeutici.
Descriviamo qui un'analisi basata sulle celle per valutare quantitativamente l'assorbimento tau da microglia. I dati generati con questo test possono aiutare a chiarire i meccanismi di azione degli anticorpi anti-tau, rappresentando così uno strumento utile per avanzare gli anticorpi anti-tau ulteriore procedura del loro sviluppo come trattamento potenziale AD.
Protocollo
1. cultura di cellule BV-2
Nota: Cellule di maniglia BV-2 sotto contenimento di livello 2 di biosicurezza. La linea cellulare BV-2 produce un ecotropic ricombinante avvolta retrovirus (in grado di infettare cellule murine solo)12; questi virus sono noti per il loro in vitro trasformare capacità e in vivo il potenziale cancerogeno.
- Cultura BV-2 celle in alto glucosio Dulbecco modificate, medium di eagle (DMEM) completati con 10% siero bovino fetale (FBS), 100 U/mL di penicillina, 100 µ g/mL streptomicina e 2 mM L-Glutammina (appresso come mezzo di coltura da ora in poi) da semina celle a 4 x 104 cellule/mL.
- Mantenere culture in atmosfera umidificata di 5% CO2 a 37 ° C.
Nota: le cellule crescono vagamente collegato e in sospensione.
2. etichetta ricombinante Tau aggregati con colorante fluorescente pH sensibili
Nota: Aggregati di Tau sono stati preparati come descritto in Apetri et al. 13 con la differenza che nessun Tioflavina T (ThT) è stato aggiunto al buffer di reazione. Campioni aggregati sono stati raccolti in provette per centrifuga da 1,5 mL. Segnale di fluorescenza finale stato controllato mescolando 118 µ l del campione piscina con 12 µ l di una soluzione di ThT 50 µM. Gli aggregati sono stati separati mediante centrifugazione la miscela di reazione di aggregazione a 20.000 x g per 1 h a 4 ° C. Il surnatante è stato analizzato da SEC-MALS per confermare che tutto il tau monomerico è stato convertito in aggregati. Pellet (aggregati di tau) erano snap congelati e conservati in un congelatore a-80 ° C.
- Risospendere aggregati di tau in 0.1 M tampone sodio bicarbonato (NaHCO3) a pH 8,5 ad una concentrazione di 1 mg/mL (~ 20 µM).
Nota: Concentrazione degli aggregati di tau è basato sulla concentrazione iniziale monomeri come valutata dall'assorbimento di monomeri di tau a 280 nm utilizzando un coefficiente di estinzione di 0,31 mLmg-1cm-1. - Sonicare i sedimento aggregati utilizzando un sonicatore sonda mantenendo il ghiaccio per evitare il surriscaldamento.
- Utilizzare un'ampiezza del 65% (con sonicatore di potenza 250 W).
- Eseguire 8 impulsi di 3 s con pause di 15 s tra gli impulsi per evitare il surriscaldamento.
- Preparare una soluzione stock di 8,9 mM di pH sensibili colorante (d'ora in poi il riferimento a come colorante di pH) in dimetilsolfossido (DMSO) seguendo le istruzioni del fabbricante.
Nota: Sempre preparare una soluzione fresca e usarlo solo per il giorno che è preparato. - Aggiungere 10 moli di tintura per talpa della proteina ad una concentrazione finale di tintura di 0,2 mM.
- Mescolare pipettando delicatamente su e giù.
- Incubare la miscela di reazione per 45 – 60 min a temperatura ambiente, al riparo dalla luce.
- Nel frattempo, montare un gel reticolato destrano desalificazione colonna seguendo le istruzioni del produttore.
- Equilibrare la colonna con 25 mL di 0.1 M NaHCO3 buffer pH 8,5 contenenti 3% DMSO. Scartare il flusso attraverso.
- Aggiungere il prodotto dell'aggregazione tau reazione alla colonna in un volume totale di 2,5 mL di contrassegno. Se il campione è inferiore a 2,5 mL, aggiungere tampone fino a raggiunta un volume totale di 2,5 mL.
- Inserire completamente il gel imballato, scartare il flusso continuo, lasciare che il campione.
- Eluire con 3,5 mL di 0.1 M NaHCO3 buffer pH 8,5 contenenti 3% DMSO e raccogliere l'eluato in 4 frazioni equivalenti in provette da 2 mL.
- Determinare le concentrazioni di proteina delle 4 frazioni dall'analisi di (BCA) acido bicinconinico.
- Conservare la proteina marcata in un congelatore a-20 ° C.
3. l'assorbimento Assay con fluorescenza-attivato delle cellule ordinano (FACS) lettura
-
Giorno 1 – seme le cellule
- Lavare BV-2 cellule nel matraccio rimuovendo coltura media e aggiungendo 1 x tampone fosfato salino (PBS).
Nota: Volume di lavaggio variano in base alla dimensione del pallone cellulare utilizzato. Ad esempio, per un pallone T175, lavare con 10 mL di PBS 1X. - Rimuovere PBS dal pallone e staccare le cellule incubando con tripsina-acido etilendiamminotetraacetico (EDTA) l'acido 0,05% a 37 ° C e 5% CO2 fino a quando le cellule si staccano dalla muffola (circa 5 min).
Nota: Volume di tripsina-EDTA 0,05% dipende dalle dimensioni del pallone cellulare utilizzato. Ad esempio, per un pallone T175, utilizzare 2 mL di tripsina-EDTA 0,05%. - Risospendere le cellule in coltura media pipettando su e giù per tre a cinque volte.
Nota: Volume di mezzo di coltura varia sulla base della dimensione del pallone cellulare utilizzato e quindi numero totale delle cellule nel pallone. Ad esempio, per un pallone T175, utilizzare 8 mL di mezzo di coltura. - Contare le celle e creare una sospensione cellulare con una concentrazione finale di 1 x 105 cellule/mL nel terreno di coltura contenente 200 μg/mL eparina.
- Piastra di 250 µ l di sospensione cellulare (2,5 x 104 celle) per pozzetto di una piastra di coltura del tessuto 96 pozzetti fondo piatto.
- Incubare la piastra durante la notte a 37 ° C e 5% CO2.
- Lavare BV-2 cellule nel matraccio rimuovendo coltura media e aggiungendo 1 x tampone fosfato salino (PBS).
-
Giorno 1 – preparare degli immunocomplessi
- Scongelare il pH della tintura-tau sul ghiaccio.
- Preparare 65 μl a condizione di una soluzione di 500 nM di pH aggregati di tintura-tau in medium senza siero (SFM) (alto glucosio DMEM completate con 100 U/mL di penicillina, 100 µ g/mL streptomicina e 200 µ g/mL di eparina).
- Preparare diluizioni di anticorpo in 65 µ l di SFM e ad una concentrazione doppia di quella finale. Mix pH tintura-tau aggregati e anticorpi in una piastra a 96 pozzetti fondo u. Volume finale a condizione è ora 130 µ l e la concentrazione di aggregati di tintura-tau pH è di 250 nM. La piastra di diluizione ed incubare tutta la notte a 37 ° C.
-
Giorno 2 – l'assorbimento degli immunocomplessi
- Rimuovere il mezzo di coltura da cellule BV-2. Lavare le cellule una volta con 100 µ l temperatura 1X PBS.
- Trasferire 125 µ l di immunocomplessi le celle utilizzando una pipetta multicanale. Incubare le cellule con gli immunocomplessi per 2 ore a 37 ° C e 5% CO2.
- Rimuovere il mezzo di incubazione dalle cellule e scartarlo. Lavare le cellule una volta con 100 µ l temperatura 1X PBS.
- Rimuovere 1X PBS e trattare le cellule con 50 µ l tripsina-EDTA 0,25% per 20 min a 37 ° C e 5% CO2.
- Aggiungere 200 µ l di terreno di coltura e risospendere bene pipettando su e giù per staccare le cellule. Trasferire le cellule a un fondo U 96 pozzetti piastra. Piastra di centrifuga a 400 x g per 5 min a 4 ° C.
- Mettere la piastra sul ghiaccio, rimuovere la coltura delle cellule medie e lavare due volte da risospendere il pellet cellulare in 150 µ l ghiaccio freddo 1X PBS. Piastra di centrifuga a 400 x g per 5 min a 4 ° C.
- Mettere le cellule sul ghiaccio, rimuovere aggiunto 1X PBS e lavare loro da risospendere le cellule pellet in 150 µ l di tampone freddo FACS (1x PBS, 0,5% albumina di siero bovino (BSA), 2 mM EDTA). Piastra di centrifuga a 400 x g per 5 min a 4 ° C.
- Mettere le cellule sul ghiaccio, rimuovere buffer aggiunto FACS e risospendere le cellule in 200 µ l di tampone di FACS freddo.
- Analizzare i campioni immediatamente da FACS l'acquisizione di 2 x 104 eventi nel cancello di cellule vive (Vedi punto 4.1).
4. FACS analisi
Nota: Fare riferimento alla Figura 1 per la strategia di gating.
- Utilizzando l'area di forward scatter (FSC-A) contro laterali zona (SSC-A) densità grafico a dispersione, cancello su cellule vive escludendo eventi con livelli inferiori di forward scatter (cioè, detriti e cellule morte).
- All'interno della popolazione di cellule vive, utilizzare FSC-A contro altezza forward scatter (FSC-H) per escludere cella doppietti e aggregati. Questa è la porta di singoletto.
- Utilizzo degli eventi nel cancello singoletto, generare un istogramma di singolo parametro tintura di pH.
- Determinare l'intensità media di fluorescenza. Determinare la percentuale di cellule positive di tintura-tau pH escludendo le cellule negative come determinato mediante controllo unico BV-2.
5. assorbimento immunocomplessi con lettura di microscopia
-
Giorno 1 – seme le cellule
- Preparare cellule BV-2 come descritto ai punti 3.1.1, 3.1.2 e 3.1.3.
- Contare le celle e risospendere li in mezzo a una concentrazione finale di 104 cellule/mL di coltura.
- Piastra 150 µ l di sospensione cellulare (1,5 x 103) per pozzetto in una poli-D-lisina rivestito lamiera nera 96 pozzetti con fondo trasparente piatto.
- Incubare la piastra a 37 ° C e 5% di CO2 per 48 h.
-
Giorno 3 – preparare degli immunocomplessi
Nota: Lieve sonicazione di aggregati di tau etichettati prima dell'incubazione con anticorpo, è stato effettuato per migliorare i risultati di microscopia.- Scongelare il pH della tintura-tau sul ghiaccio e sottoporre ad ultrasuoni utilizzando un sonicatore sonda mantenendo il ghiaccio. Utilizzare un'ampiezza di 15% (sonicatore potenza di 250 W). Eseguire 30 impulsi 2 s e aspettare 20 s tra gli impulsi.
- Preparare 65 μl a condizione di una soluzione di 500 nM di aggregati di tintura-tau di pH in SFM.
- Diluire gli anticorpi in 65 µ l di SFM ad una concentrazione doppia di quella finale. Mix pH tintura-tau aggregati e anticorpi in una piastra a 96 pozzetti fondo u. Volume finale a condizione è ora 130 µ l e la concentrazione di aggregati di tintura-tau pH è di 250 nM. La piastra di diluizione ed incubare tutta la notte a 37 ° C.
- Rimuovere il mezzo dalla piastra di cella e sostituire con 150 µ l di coltura supplementato con eparina di 200 µ g/mL. Incubare la piastra durante la notte a 37 ° C e 5% CO2.
-
Giorno 4 – l'assorbimento degli immunocomplessi
- Rimuovere il mezzo di coltura dalle cellule BV-2. Trasferire 125 µ l di immunocomplessi le celle utilizzando una pipetta multicanale.
- Incubare le cellule con gli immunocomplessi per 1 h e 45 min a 37 ° C con 5% CO2.
Macchia i nuclei delle cellule con colorante specifico del DNA e organelli acidi con una sonda che selettivamente le macchie compartimenti cellulari a basso pH. Incubare le cellule 15 min a 37 ° C con 5% CO2.
Nota: Diluire i coloranti in SFM. - Eseguire cellule vive imaging utilizzando un alto contenuto sistema confocale di screening. Impostare temperatura a 37 ° C e 5% CO2. Per immagini di alta qualità, utilizzare un obiettivo a immersione in acqua X 63 e acquisire 0,5 µm aerei (20 a Z-stack) per ogni campo imaged.
Risultati
Aggregati tau ricombinante covalentemente era etichettato con un colorante verde sensibili al pH. Questa tintura aumenta drammaticamente la sua fluorescenza su sua interiorizzazione in organelli acidi, consentendo in tal modo per quantificazione intracellulare. Aggregati con etichetta tau sono stati incubati con anticorpi monoclonali anti-tau. In particolare, abbiamo utilizzato una versione chimerica (regione di Fc di IgG1 di topo) di CBTAU-28.1. Questo anticorpo umano si lega alla regione N-terminale inserto di tau ed è in grado di legarsi in vitro generato tau fibrille13. In questa analisi, abbiamo anche testato una versione migliorata di affinità di CBTAU-28.1 – dmCBTAU-28.1. Formato di frammenti Fab di CBTAU-28.1, nel mutante parentale e ad alta affinità, e un mouse IgG1 isotipo controllo sono stati utilizzati come controlli.
BV-2 cellule sono state incubate con i pre-formate degli immunocomplessi o aggregati da solo per due ore in presenza di eparina per bloccare l'assorbimento dell'anticorpo-indipendente tau tau. Dopo l'incubazione, le cellule sono state tripsinizzate per rimuovere il tau associato alla membrana extracellulare e sono state analizzate per l'assorbimento di tau tramite flusso cytometry. Come abbiamo recentemente descritto13, abbiamo osservato che l'assorbimento varianti promossi CBTAU-28.1 di tau in cellule BV-2 in un modo dipendente dalla dose. L'assorbimento era Fc mediata poiché frammenti Fab CBTAU-28.1 non hanno aumentato l'assorbimento basale tau (Figura 2). Inoltre, l'anticorpo di dmCBTAU-28.1 alta affinità mediato l'assorbimento tau in cellule BV-2 in misura superiore rispetto l'anticorpo di selvaggio-tipo (Figura 2).
L'assorbimento dell'anticorpo-mediata tau e localizzazione degli aggregati di tau nel compartimento endolisosomiale è stata confermata mediante microscopia confocale (Figura 3) dove il compartimento cellulare acido era macchiato usando una sonda selettiva per gli organelli basso pH. Puncta intracellulare della tintura di verde pH etichettato tau complessi sono stati osservati all'interno delle cellule che sono state incubate con CBTAU-28.1. Inoltre, gli aggregati intracellulari tau spesso colocalized con il colorante basso pH vano selettiva rosso suggerendo la presenza di aggregati di tau in organelli acidi. CBTAU-28.1 Fab frammenti non hanno aumentato l'assorbimento di tau che indica un meccanismo di internalizzazione di Fc-recettore mediato (Figura 3).
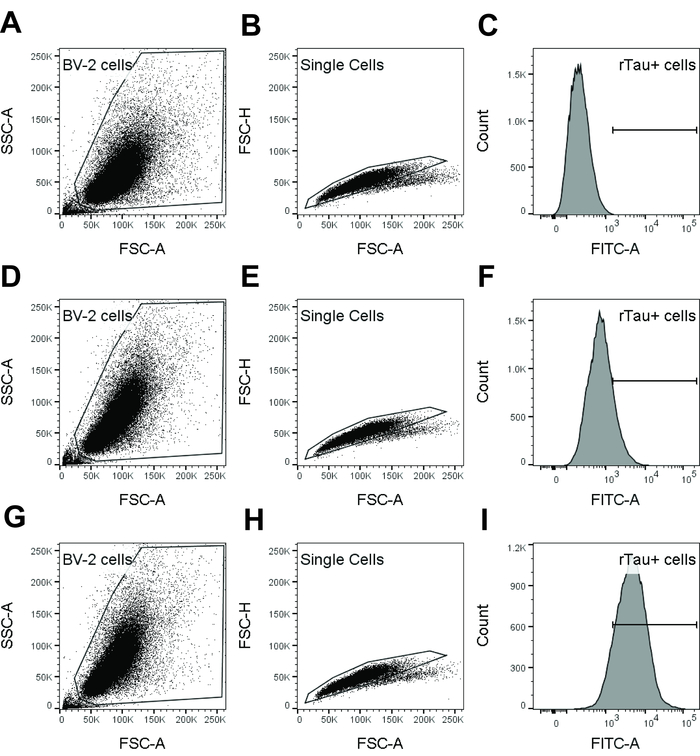
Figura 1: Gating strategia usata in analisi di citometria a flusso per rilevare interiorizzazione tau dalle cellule BV-2. Campioni di dati dal controllo unico BV-2 (A-C), controllo di isotipo (D-F) e dmCBTAU-28.1 (G-io) vengono visualizzati. Popolazione delle cellule BV-2 era stata eliminata su un terreno di SSC-A densità di FSC-A vs esclusi i detriti e le cellule morte (A, D, G). BV-2 cellule poi sono state ulteriormente gated su un terreno di densità FSC-A vs FSC-H per escludere cella doppietti e aggregati (B, E, H). Cancello di singola cellula è stato utilizzato per generare un istogramma di singolo parametro di tintura (FITC in questi risultati rappresentativi) pH (C, F, I) e determinare l'intensità di fluorescenza media geometrica. In alternativa, percentuale di cellule positive di pH tintura-tau è stata calcolata escludendo cellule negative come determinato utilizzando controllo unico BV-2. Clicca qui per visualizzare una versione più grande di questa figura.
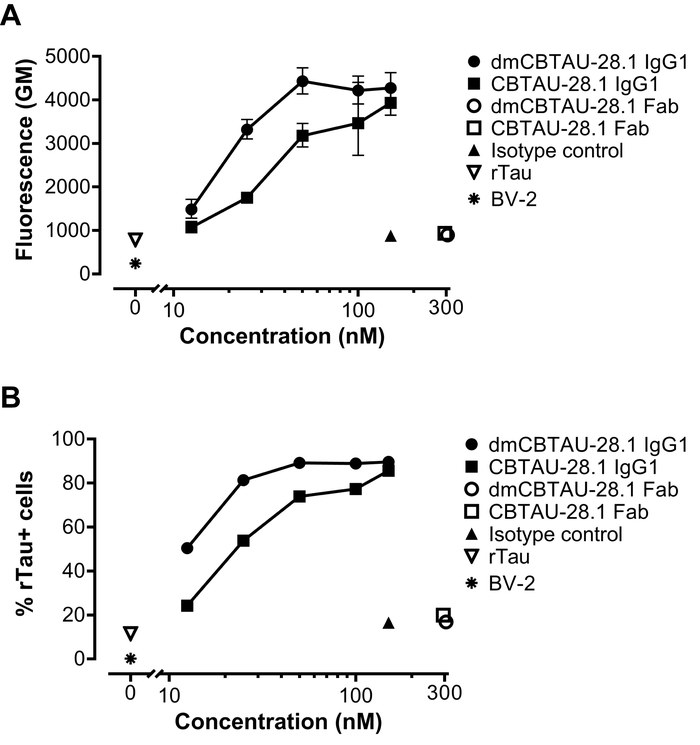
Figura 2: CBTAU-28.1 media l'assorbimento degli aggregati di tau in cellule microglial BV-2. Aggregati tau ricombinante covalentemente era etichettato con tintura di pH sensibili di fluorescenza verde e incubati con una mouse chimerici versione dell'anticorpo umano anti-tau CBTAU-28.1, suo formato migliorato affinità, dmCBTAU-28.1, frammenti Fab corrispondente, un anticorpo di controllo di isotipo IgG1 di topo o nessun anticorpo (aggregati di tau da solo). Immunocomplessi successivamente sono stati incubati con cellule BV-2 per due ore in presenza di eparina per bloccare l'assorbimento dell'anticorpo-indipendente tau. L'assorbimento di immunocomplessi è stata valutata da citometria a flusso ed espresso come la media geometrica (GM) di intensità di fluorescenza (A) o percentuale di tau positivo (tau +) cellule (B). Barre di errore in (A) indicano la deviazione standard dei due esperimenti indipendenti, mentre (B) dimostra un singolo esperimento. Clicca qui per visualizzare una versione più grande di questa figura.
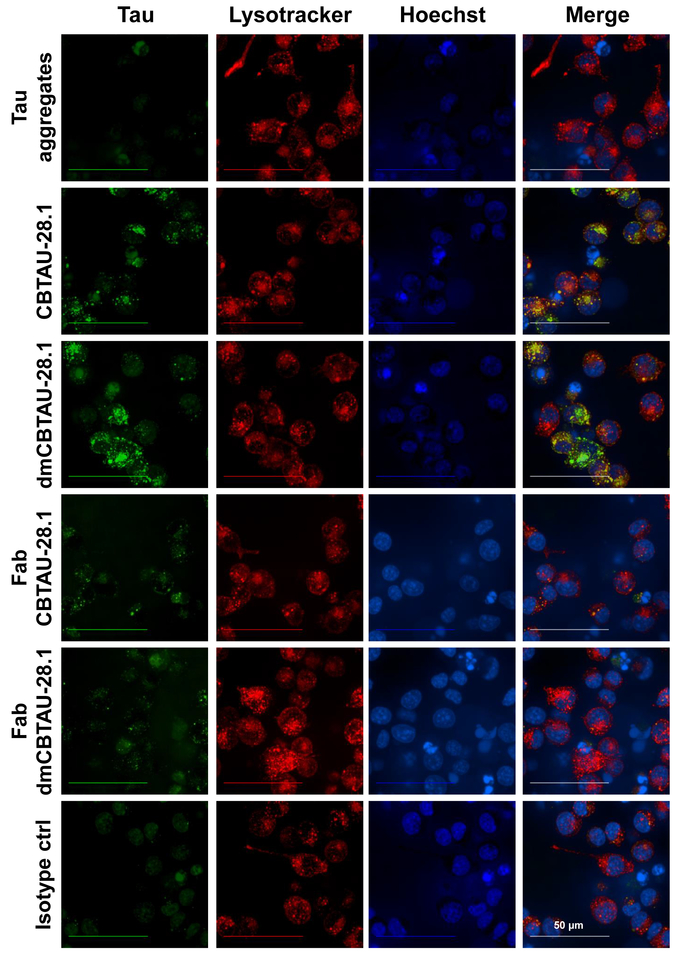
Figura 3: Tau aggregati sono interiorizzati dalle cellule BV-2 e localizzare in organelli cellulari acidi. Tau-anticorpo preformato immunocomplessi sono stati incubati con cellule BV-2 per due ore in presenza di eparina per bloccare l'assorbimento dell'anticorpo-indipendente. Dopo l'incubazione, i nuclei sono stati macchiati con un colorante blu specifico di DNA e il compartimento cellulare siliceo con un colorante di rosso selettivo di vano basso pH. Cellule vive formazione immagine ha rivelato puncta intracellulare degli aggregati di tau con etichetta (verdi) all'interno delle cellule che sono state incubate con CBTAU-28.1 e dmCBTAU-28.1, ma non con il controllo di isotipo. Inoltre, gli aggregati intracellulari tau spesso colocalized con il rosso colorante (gialli), suggerendo la presenza di aggregati di tau nel compartimento cellulare acido. CBTAU-28.1 Fab frammenti non hanno aumentato l'assorbimento di tau che indica un meccanismo di internalizzazione di Fc-recettore mediato. Le immagini rappresentano proiezioni di massima intensità di un 20 aerei Z-stack (piani di 0,5 µm) acquistate con un obiettivo a immersione in acqua X 63. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Microglia, le cellule immunitarie del cervello residente, sono state recentemente identificate come giocatori importanti in anticorpo-mediato di approcci terapeutici per Taupatie10,11. Liquidazione di tau anticorpo-mediato da microglia, insieme al blocco di un neurone assorbimento9, inibizione o destabilizzazione della fibrilla formazione13,14 e clearance di fibrille intraneuronale via la lysosomal percorso15, potrebbe tutti contribuiscono all'efficacia dell'anticorpo anti-tau osservato nel modello del topo di tauopathy5,6,7,8,9.
Abbiamo descritto qui un'analisi basata sulle celle per valutare quantitativamente l'assorbimento tau da microglia con l'obiettivo di creare uno strumento in fase di sperimentazione per caratterizzare meglio i meccanismi di azione degli anticorpi anti-tau.
Questa analisi, adattata da Funk et al. 11, utilizza BV-2 cellule, che sono cellule microgliali murine immortalizzate. Mentre non possono completamente essere confrontati alle cellule microglial primarie, presentano molte delle caratteristiche della microglia primaria, inclusa la possibilità di robustamente fagocitare tau e Aβ fibrille11,16,17 ,18,19. Inoltre, hanno mostrato un comportamento riproducibile in vitro che li ha resi altamente adatto a sviluppo di analisi e studi quantitativi, che richiedono minima variabilità sperimentale. Accanto a questo, linee cellulari immortalizzate permettono un throughput più elevato dosaggio ed eliminano la necessità del sacrificio animale rispetto all'uso di microglia primaria.
Gli aggregati di tau che abbiamo usati per questo test sono stati ottenuti utilizzando la procedura altamente riproducibile in vitro aggregazione che abbiamo recentemente descritto13e visualizza accoppiato morfologia simile ai filamenti elicoidali (app) isolati dal cervello dell'annuncio pazienti. Mentre non abbiamo osservato alcun risultato imprevisto che potrebbe essere stato causato da tau aggregati aderenza alle superfici di plastica o di vetro, l'uso di aggregati stabili e ben caratterizzati tau ha svolto un ruolo cruciale nella riproducibilità di questo test.
Un altro aspetto che ha contribuito significativamente al riproducibilità del test è stata la densità delle cellule. I numeri delle cellule per pozzetto descritto nel protocollo rappresentano la densità cellulare ottimale nelle condizioni descritte.
In modo diverso rispetto a quello che Funk et al. 11 descritto, abbiamo etichettato aggregati di tau con un colorante sensibile di pH che aumenta notevolmente la sua fluorescenza all'interiorizzazione in organelli acidi, consentendo in tal modo quantificazione intracellulare. Questo, insieme a digestione della tripsina di superficie associato degli immunocomplessi e/o tau, garantisce quel segnale di fluorescenza misurata da citometria a flusso è il risultato di assorbimento di tau piuttosto che si legano alla superficie cellulare. Inoltre, l'uso di una facilita di colorante sensibile pH rilevamento degli aggregati di tau interiorizzata in esperimenti di microscopia senza il bisogno di digerire superficie associato aggregati di immunocomplessi/tau che avrebbero poi richiede cellula ri-placcatura e recupero.
Abbiamo ottimizzato ulteriormente la lettura di microscopia della nostra analisi, rispetto a che cosa precedentemente è stato descritto11, utilizzando un colorante altamente selettivo per acidi organelli nei nostri esperimenti di microscopia che ci ha permesso non solo di confermare anticorpo-mediata l'assorbimento di Tau, ma anche la localizzazione degli aggregati di tau nel compartimento endolisosomiale.
Il saggio che abbiamo sviluppato, ha specificità ottimale che si traduce in una buona finestra sperimentale che permette una netta separazione tra i campioni positivi e negativi. Interessante, l'analisi rileva indirettamente differenze nell'affinità dell'anticorpo, rappresentando così un potente strumento per studiare le funzioni effettrici degli anticorpi anti-tau.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare Alberto Carpinteiro Soares per la sua preziosa assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| BV-2 cells | ICLC Interlab Cell Line Collection | ATL03001 | |
| Phosphate Buffered Saline (PBS) (1x) | Gibco | 10010-015 | |
| Trypsin-EDTA 0.05% | Gibco | 25300-054 | |
| DMEM 4.5 g/dL glucose | Gibco | 41966-029 | |
| Fetal Bovine Serum | Gibco | 10091-148 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| L-Glutamine 200 mM | Lonza | 17-605E | |
| EasYFlask | Nunc | 156499 / 159910 | |
| pHrodo Green STP ester | Life Technologies | P35369 | |
| Sodium Bicarbonate pH 8.5 100 mM | |||
| DMSO | Sigma | D2650-100ml | |
| PD10 columns | GE Healthcare | 17-0851-01 | |
| BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Greiner CELLSTAR multiwell culture plates | Greiner | 665180 | |
| Falcon 96-Well Assay Plates | Falcon | 353910 | |
| Heparin | Sigma | H3393-50KU | |
| Trypsin-EDTA 0.25% | Sigma | T4049-100ml | |
| BSA | Sigma | A7030-100G | |
| EDTA 0.5 M, pH8 | |||
| FACS Canto II | BD | ||
| Hoechst 33342 Solution (20 mM) | Thermo Fisher Scientific | 62249 | |
| LysoTracker Deep Red | Thermo Fisher Scientific | L12492 | |
| Opera Phenix | Perkin Helmer | HH14000000 |
Riferimenti
- Hefti, F., Goure, W. F., Jerecic, J., Iverson, K. S., Walicke, P. A., Krafft, G. A. The case for soluble Aβ oligomers as a drug target in Alzheimer's disease. Trends in Pharmacological Sciences. 34 (5), 261-266 (2013).
- Castillo-Carranza, D. L., Lasagna-Reeves, C. A., Kayed, R. Tau aggregates as immunotherapeutic targets. Frontiers in bioscience (Scholar edition). 5, 426-438 (2013).
- Martin, L., Latypova, X., Terro, F. Post-translational modifications of tau protein: Implications for Alzheimer's disease. Neurochemistry International. 58 (4), 458-471 (2011).
- Holmes, B. B., Diamond, M. I. Prion-like properties of Tau protein: The importance of extracellular Tau as a therapeutic target. Journal of Biological Chemistry. 289 (29), 19855-19861 (2014).
- Giacobini, E., Gold, G. Alzheimer disease therapy--moving from amyloid-beta to tau. Nature Reviews Neurology. 9 (12), 677-686 (2013).
- Asuni, A. A., Boutajangout, A., Quartermain, D., Sigurdsson, E. M. Immunotherapy targeting pathological tau conformers in a tangle mouse model reduces brain pathology with associated functional improvements. Journal of Neuroscience. 27 (34), 9115-9129 (2007).
- Boutajangout, A., Ingadottir, J., Davies, P., Sigurdsson, E. M. Passive immunization targeting pathological phospho-tau protein in a mouse model reduces functional decline and clears tau aggregates from the brain. Journal of Neurochemistry. 118 (4), 658-667 (2011).
- Chai, X., et al. Passive immunization with anti-Tau antibodies in two transgenic models: reduction of Tau pathology and delay of disease progression. Journal of Biological Chemistry. 286 (39), 34457-34467 (2011).
- Yanamandra, K., et al. Anti-tau antibodies that block tau aggregate seeding in vitro markedly decrease pathology and improve cognition in vivo. Neuron. 80 (2), 402-414 (2013).
- Luo, W., Liu, W., Hu, X., Hanna, M., Caravaca, A., Paul, S. M. Microglial internalization and degradation of pathological tau is enhanced by an anti-tau monoclonal antibody. Scientific Reports. 5, 11161 (2015).
- Funk, K. E., Mirbaha, H., Jiang, H., Holtzman, D. M., Diamond, M. I. Distinct Therapeutic Mechanisms of Tau Antibodies: Promoting Microglial Clearance Versus Blocking Neuronal Uptake. Journal of Biological Chemistry. 290 (35), 21652-21662 (2015).
- Blasi, E., Barluzzi, R., Bocchini, V., Mazzolla, R., Bistoni, F. Immortalization of murine microglial cells by a v-raf/v-myc carrying retrovirus. Journal of neuroimmunology. 27 (2-3), 229-237 (1990).
- Apetri, A., et al. A common antigenic motif recognized by naturally occurring human VH5-51/VL4-1 anti-tau antibodies with distinct functionalities. Acta neuropathologica communications. 6 (1), 43 (2018).
- Schneider, A., Mandelkow, E. Tau-based treatment strategies in neurodegenerative diseases. Neurotherapeutics. 5 (3), 443-457 (2008).
- Congdon, E. E., Gu, J., Sait, H. B., Sigurdsson, E. M. Antibody uptake into neurons occurs primarily via clathrin-dependent Fcgamma receptor endocytosis and is a prerequisite for acute tau protein clearance. Journal of Biological Chemistry. 288 (49), 35452-35465 (2013).
- Bocchini, V., Mazzolla, R., Barluzzi, R., Blasi, E., Sick, P., Kettenmann, H. An immortalized cell line expresses properties of activated microglial cells. Journal of Neuroscience Research. 31 (4), 616-621 (1992).
- Koenigsknecht, J. Microglial Phagocytosis of Fibrillar β-Amyloid through a β1 Integrin-Dependent Mechanism. Journal of Neuroscience. 24 (44), 9838-9846 (2004).
- Kopec, K. K., Carroll, R. T. Alzheimer's β-Amyloid Peptide 1-42 Induces a Phagocytic Response in Murine Microglia. Journal of Neurochemistry. 71 (5), 2123-2131 (2002).
- Marsh, S. E., et al. The adaptive immune system restrains Alzheimer's disease pathogenesis by modulating microglial function. Proceedings of the National Academy of Sciences of the United States of America. 113 (9), E1316-E1325 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon