È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione semi-quantitativa utilizzando [18F] FDG Tracer in pazienti con trauma cranico severo
In questo articolo
Riepilogo
[18F]-tomografia computata di tomografia a emissione di positroni del fluorodeoxyglucose (FDG) è utile per studiare il metabolismo del glucosio legato alla funzione del cervello. Qui, presentiamo un protocollo per un tracciante FDG [18F] set-up e valutazione semiquantitativa dell'analisi dell'area di interesse per aree cerebrali mirata associata con le manifestazioni cliniche in pazienti con la ferita di cervello traumatica severa.
Abstract
Pazienti con la ferita di cervello traumatica severa (sTBI) hanno difficoltà sapendo se accuratamente essi esprimono i loro pensieri e le emozioni a causa di disturbi della coscienza, interrotto superiore funzione del cervello e disturbi verbali. In conseguenza di un'insufficiente capacità di comunicare, valutazioni obiettive sono necessari da membri della famiglia, personale medico e gli operatori sanitari. Una tale valutazione è la valutazione delle zone del cervello funzionante. Recentemente, l'imaging multimodale cerebrale è stato utilizzato per esplorare la funzione delle zone del cervello danneggiato. [18F]-tomografia computata di tomografia a emissione di positroni del fluorodeoxyglucose ([18F] FDG-PET/CT) è uno strumento di successo per l'esame di funzione del cervello. Tuttavia, la valutazione del metabolismo del glucosio del cervello basata su [18F] FDG-PET/CT non è standardizzato e dipende da diversi parametri variabili, come pure le condizioni del paziente. Qui, descriviamo una serie di protocolli per la valutazione semiquantitativa per un'analisi di immagine di regione di interesse (ROI) utilizzando autoprodotto [18F] FDG traccianti in pazienti con sTBI. Il protocollo si concentra sui partecipanti di screening, preparando il tracciante FDG [18F] in laboratorio caldo, pianificazione l'acquisizione di immagini del cervello [18F] FDG-PET/CT e metabolismo del glucosio, utilizzando l'analisi ROI da un'area del cervello mirato di misura.
Introduzione
Pazienti con sTBI sono presentati con imprevedibili Difficoltà neurologiche nel corso di riabilitazione che includono deficit motori, deficit sensitivi e instabilità psichiatrici1. Anche se la valutazione clinica è generalmente eseguita verbalmente, i pazienti con sTBI come la sindrome di veglia non risponde o stato di minima coscienza hanno particolari difficoltà nel sapere se essi sono accuratamente esprimendo i loro pensieri e le emozioni a causa di disturbi della coscienza, interrotto più alta funzione del cervello e dispersioni verbale2,3. Membri della famiglia, personale medico e gli operatori sanitari sono a volte confusi da imprevedibili cambiamenti neurologici o la mancanza di risposta che può derivare dall'insufficiente capacità communicatory4,5.
Recentemente, l'imaging multimodale cerebrale è stato utilizzato per esplorare regionale del cervello funzione6,7,8,9. Il cervello è il principale consumatore di energia glucosio-derivati, con il metabolismo di glucosio fornisce circa il 95% di adenosina trifosfato (ATP) necessario per il cervello a funzionare10. L'assorbimento di [18F]-fluorodeoxyglucose (FDG) è un indicatore per l'assorbimento di glucosio dal tessuto cerebrale. [18F] FDG-PET/CT in grado di rilevare la captazione di FDG [18F] ed è, pertanto, uno strumento utile per l'esame del cervello funzione11. In generale, analisi dell'immagine [18F] FDG sono diviso in due categorie: ROI analysis e analisi voxel-based (VBA)12. I rapporti precedenti mostrano che analisi del ROI sono comodo per lo studio di specifiche regioni della ferita traumatica. Questo è perché VBA (ad esempio di mappatura statistica parametrica [SPM]) richiede coregistrazione e normalizzazione di un cervello standard, che non funziona bene in casi di trauma cranico dovuto alla deformazione del tessuto del cervello come l'atrofia del cervello, gonfiore, allargamento e restringimento delle spazio ventricolare7,12. Sebbene vari algoritmi e software sono stati sviluppati per l'analisi dei dati di risonanza magnetica (MRI), metalli usati in chirurgia ortopedica e neurochirurgica generano rumore manufatti7,12,13 . Recentemente, l'uso di fotomoltiplicatori con dispositivi di PET/CT ha migliorato la risoluzione spaziale di PET/CT-derivato cervello immagini14. Il protocollo attuale si concentra su semiquantitativo di misurazione del glucosio assorbimento via ROI analisi [18F] FDG-PET/CT utilizzando autoprodotto [18F] elementi traccianti FDG in pazienti con sTBI.
Protocollo
Questo studio è stato svolto in conformità con il Comitato di revisione istituzionale (approvazione n ° 07-01) e ha aderito ai principi della dichiarazione di Helsinki. Consenso informato per uso immagine medico record e cervello è stato ottenuto da rappresentanti legali dei pazienti. Lo studio è stato condotto dopo l'approvazione del Comitato di etica istituzionale (2017-14). Questo protocollo è stato effettuato seguendo le linee guida della società giapponese di medicina nucleare e associazione europea di medicina nucleare come riferimento15,16.
1. la selezione dei partecipanti
- Ottenere il consenso informato per utilizzare le cartelle sanitarie ed immagini del cervello dei pazienti dai rappresentanti legali dei pazienti. Un punteggio di Glasgow Coma Scale ≤ 8 al momento dell'incidente deve sono state registrate in medico record17,18,19 ciascun paziente.
- Tenere conferenze multi-disciplinare personale, psicologia e neurologia ogni sei mesi per valutare le manifestazioni cliniche.
Nota: Membri della conferenza dovrebbero includere il personale medico ad esempio medici, infermieri, fisioterapisti, terapisti occupazionali, logopedisti, nutrizionisti e medici assistenti sociali. Assicuratevi di controllare costantemente se i pazienti possono comunicare (verbalmente o nonverbally) e prendere decisioni per se stessi, perché lo stato di eccitazione e condizione neurologica sono tipicamente instabile. - Condurre le valutazioni cliniche della funzione uditiva, funzione visiva, funzione motoria, di oromotor/verbal funzione, funzione di comunicazione, stato di eccitazione, espressione facciale e altre funzioni pertinenti, utilizzando batterie di valutazione standard come il Coma Recupero Scale-Revised (CRS-R), la scala del Coma di nocicezione e la matrice di Wessex testa ferita20,21,22.
- Programma [18F] FDG-PET/CT esegue la scansione per i pazienti che sono clinicamente stabili e possono tranquillamente partecipare a esami. Pianificare solo coloro che hanno fornito il consenso informato o cui rappresentanti legali hanno fornito il consenso informato, come indicato nel modulo di consenso informato. Acquisizione di immagini di pianificazione [18F] FDG-PET/CT vicino il giorno di valutazione clinica.
2. preparazione del tracciante [18F] FDG nel laboratorio di caldo
- Nel laboratorio di caldo, cominciano a produrre Kit di reagenti per la produzione automatizzata di FDG su misura per il sintetizzatore FDG (Vedi Tabella materiali). Assicurarsi di utilizzare il programma automatico per controllare la mobilità del sistema di pompaggio nel sintetizzatore FDG e garantire che non perda aria dal kit di reagenti. Sterilizzare l'area di contatto della macchina (questa è l'ora di inizio).
Nota: Assicurarsi di controllare il monitor di radiazione in laboratorio caldo e utilizzare i dosimetri di radiazioni portatile per controllare i livelli di radiazione di ogni persona, prima di entrare il laboratorio caldo. - Controllare il volume di [16O] - acqua e [18O] - acqua e il volume di elio, idrogeno e azoto nel serbatoio del gas. Verificare se la temperatura dell'acqua di rubinetto per raffreddamento primario è sotto i 25 ° C e che per il raffreddamento secondario è sotto i 22 ° C. Utilizzare tutta l'acqua nel sistema chiuso (30 min dopo l'inizio) per la produzione.
- Iniziare l'irradiazione preliminare di [16O]-acqua nel ciclotrone (1 h dopo l'inizio). Controllare il monitor per essere sicuri che 2-3 mL di [16O]-acqua è irradiato in condizioni ottimali (ad es., 20 µA, 5 min) nella zona dell'obiettivo del ciclotrone. Dopo irradiazione, installare il flacone di [16O]-acqua in un calibratore di dose del radioisotopo e misurare il livello di radioattività (Vedi Tabella materiali).
Nota: Il decadimento radioattivo deve essere calcolato utilizzando la seguente formula.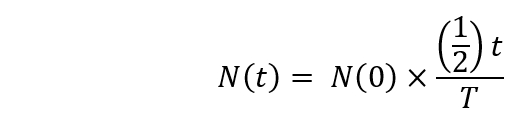
Qui,
Dove è i numeri nuclei radioattivi a t = t secondi;
N(0) è i numeri nuclei radioattivi a t = 0 secondi;
T = il tempo di dimezzamento. - Iniziare l'irradiazione di [18O]-acqua nel ciclotrone (1 h 30 min dopo l'inizio). Impostare il tempo di bombardamento per fino a 20 min e l'energia dei protoni incidente a 16,5 MeV.
- Avviare il sintetizzatore FDG secondo il manuale operatore22 (2 h dopo l'inizio). Una procedura modificata è riportata qui sotto.
- Dopo l'irradiazione, utilizzare gas elio per trasferire 2-3 mL di [18O]-acqua dal ciclotrone al ricevitore in polipropilene del sintetizzatore FDG.
- Gancio di siringhe sul corrispondente driver siringa, pressurizzare i flaconi dei reagenti, sciogliere il 1,3,4,6-Tetra-O-acetyl-2-O-trifluoromethanesulfonyl-β-D-mannopyranose in un flaconcino (7 ± 0,2 mL) di acetonitrile (purezza ≥ 99.5%) e sciacquare la cassetta con acetonitrile.
- Dopo il bombardamento, trasferire l'irradiati [16O] - acqua e [18O] - acqua al sintetizzatore di FDG.
Nota: Una volta iniziata la sintesi, l'irradiati [18O]-l'acqua si muove attraverso una cartuccia di scambio anionico (Vedi Tabella materiali). Essere sicuri di condizione e convertire la cartuccia al carbonato di prima la sintesi. - Dopo aver trasferito l'eluente contenente l'attività [18F] senza liquido ai recipienti di reazione, consentire i solventi ad evaporare fino a secco. Durante il processo di essiccazione, aggiungere piccole quantità di acetonitrile per il recipiente di reazione 3 x (ogni volta, aggiungere 80 µ l). Eseguire l'evaporazione a 95 ° C sotto vuoto e flusso di azoto.
- Aggiungere il precursore triflato di mannosio (25 mg) del residuo secco dopo scioglierlo in circa 3,5 mL di acetonitrile (con una purezza del 99,5%, ≥). Si verifica una reazione di sostituzione nucleofila a 85 ° C nel sintetizzatore FDG.
- Come un preliminare di purificazione, miscelare la soluzione con etichetta con 26 mL di acqua distillata. Inviare circa 4 mL della soluzione diluita d'etichettatura il recipiente di reazione per recuperare le attività rimanenti. Filtrare la soluzione attraverso la cartuccia di inverso-fase (Vedi Tabella materiali). Risciacquare la cartuccia contenente la trappola etichettato precursore 4 x utilizzando 10 mL, 10 mL, 13 mL e 13 mL di acqua distillata sui lavaggi successivi.
- Convertire il composto acetilato (con etichetta precursore) in FDG all'interno della cartuccia tramite idrolisi alcalina, utilizzando 750 µ l di NaOH N 2 per 2 min a temperatura ambiente.
- Dopo idrolisi, raccogliere la soluzione alcalina di FDG in 7 mL di acqua e mescolare con la soluzione di neutralizzazione (5 mL di tampone citrato e 1 mL di HCl N 2).
- Purificare la soluzione risultante di FDG neutralizzata.
- Filtrare la soluzione FDG neutralizzata attraverso una seconda cartuccia di inverso-fase (Vedi Tabella materiali), mantenendo i composti parzialmente idrolizzati e i sottoprodotti non polari.
- Passare attraverso una cartuccia di allumina N (Vedi Tabella materiali), mantenendo le ultime tracce di ioni fluoruro non reagiti [18F]. Quindi, passare attraverso un filtro da 0,22 µm.
- Sciacquare la cassetta e cartucce, filtrare con 3 mL di acqua per recuperare la FDG residua che è rimasto nelle linee e, quindi, drenare il FDG nel flaconcino finale, che contiene 15-17 mL di liquido.
- Eseguire un'analisi qualitativa del tracciante FDG [18F] (2 h 30 min dopo l'inizio).
- Osservare visivamente il flaconcino. Confermare che sia trasparente e che non include eventuali particelle.
- Misurare la quantità di liquido utilizzando l'equilibrio di un Roberval (dovrebbe essere 15-17 mL).
- Misurare la radioattività e Half-Life utilizzando un calibratore di dose del radioisotopo (lo stesso come descritto al punto 2.3, Vedi Tabella materiali) (criterio: 105-115 min).
- Pipettare 0,5 mL dal flaconcino. Eseguire analisi test via del carboidrato una purezza radiochimica. Utilizzare colonne di 3,9 x 300 mm per cromatografia liquida ad alte prestazioni (Vedi Tabella materiali) per rilevare la radioattività di picco (oltre 95).
Nota: Un singolo picco significa elevata purezza. - Misurare il pH (pH 5.0-8.0) utilizzando carta test pH (Vedi Tabella materiali). Misurare la hexacosane residuo 4,7,13,16,21,24-Hexaoxa-1,10-diazabiciclo [8.8.8] (Vedi Tabella materiali) (< 40 ppm) utilizzando carta di prova (Vedi Tabella materiali). Misurare le endotossine con il dispositivo di misurazione dell'endotossina appropriato tramite assorbanza di misurazione (vedere Tabella materiali) (0,25 EU/mL). Fare un test per sterilità (non trovando nessun batteri dopo 8D a 37 ° C).
- Riempire la fiala coperta da piombo e tungsteno con il tracciante FDG [18F] ad un dosaggio di 5 MBq/kg di peso corporeo.
- Trasferire il tracciante FDG [18F] dal laboratorio caldo nella stanza di lavoro (3 h 25 min dopo l'inizio).
3. tempo corso per l'acquisizione delle immagini [18F] FDG-PET/CT cervello
- Pianificare i pazienti. Assicuratevi di informare il personale per interrompere la nutrizione e alimentazione tramite gastrostomia. Non interrompere la fornitura di acqua. I pazienti devono digiunare partenza 7h prima l'acquisizione dell'immagine.
- Preparare la via endovenosa per l'amministrazione di tracciante FDG [18F]. Fissare un ago 22 - 24 G con 5 mL di eparina sodica (10 unità/mL) su uno degli arti inferiori prima di entrare nell'area di radiazione-controllato.
- Hanno i pazienti sdraiati su una barella leggera prima di entrare nell'area di radiazione-controllato. Portare i pazienti alla zona controllata di radiazione e attendere 30 min, in silenzio, mentre il personale medico sono in stand by.
- Ricontrollare la pervietà della via endovenosa di disegno di sangue con una siringa da 10 mL. Misurare i livelli di glucosio nel sangue con un misuratore di glucosio.
- Dopo aver trasferito il tracciante FDG [18F] dal laboratorio caldo stanza di lavoro, configurarlo nel sistema di auto-dosaggio e iniezione (Vedi Tabella materiali).
- Ricontrollare le seguenti informazioni (tramite il personale medico): paziente numero ID, nome, compleanno, altezza e peso corporeo; il nome dell'elemento tracciante, la quantità di tracciante (acqua con 3,5 mL di tracciante FDG [18F] + 12 mL di soluzione fisiologica), la radioattività programmata (5 MBq/kg), il tempo di iniezione, il numero di tracciante-sacco [18F] FDG, la velocità di iniezione (normalmente, 0,3 mL/s) e la livello di radioattività è stata misurata in laboratorio caldo.
- Registrare la misurazione automatica di radioattività preinjected che appare sul display del sistema di auto-dosaggio e iniezione.
- Iniettare la [18F] FDG tracciante via endovenosa preparata al punto 3.2 (3 h 30 min dopo l'inizio).
- Registrare il volume residuo dell'elemento tracciante FDG [18F], che appare automaticamente sul display del sistema di auto-dosaggio e iniezione.
- Avere i pazienti attendere nella sala d'attesa della zona controllata da radiazioni per 50 min.
- Trasferire i pazienti da sala d'attesa alla macchina PET/CT (Vedi Tabella materiali). Registrare le immagini del cervello per 10 min (4 h 30 min dopo l'inizio).
Nota: I parametri di imaging per le immagini [18F] FDG-PET/CT sono modalità elenco 10 min. Ricostruire i dati dai cassonetti di 10 min. I dati meno di 3 min non vengono utilizzati perché i segnali di bassa intensità non sono adeguati. Impostare l'immagine parametri di ricostruzione: un algoritmo di ricostruzione blocco massimazione di aspettativa regolarizzata sequenziale (Vedi Tabella materiali); la dimensione della matrice = 192; il campo di vista = 25 cm; Β-valore: 100-200; filtro di asse z: nessuno. - Dopo aver preso le immagini, controllare l'area di iniezione per stravaso. Scarta tutte le urine se il paziente ha un catetere orinatoio con sacca dell'urina.
- Rimuovere il paziente dall'area di radiazione-controllato (4 h 50 min dopo l'inizio).
Nota: Vedere la Figura 1 per una schematica del calendario degli eventi (paziente procedure e sintesi dell'elemento tracciante FDG [18F]).
4. analisi delle immagini [18F] FDG-PET/CT
- Valutare tutti i dati di immagine per una misura di valore (SUV) standardizzato di assorbimento utilizzando il software di imaging (Vedi Tabella materiali).
- Selezionare i pazienti.
- Assegnare i dati al flusso di lavoro di oncologia MM .
- Fare clic sul pulsante per Functional browser.
- Fare clic sul VOI (volume di interesse) soglia pulsante.
- Impostare la sfera VOI al browser tridimensionale.
Nota: La massima SUV (SUVmax) e SUV medio (SUVmean) sono misurati automaticamente per VOI in base alla soglia di SUVmax selezionata. Assicurarsi di disegnare un bordo intorno il VOI mirate nel browser utilizzando la sfera tridimensionale, escluse altre destinazioni, i muscoli extraocular e il cuoio capelluto, perché essi tendono a disturbare la soglia impostata di SUV. Controllare l'area di destinazione su fette assiale, coronale e sagittale. - Dopo aver selezionato tutte le impostazioni di destra, fare clic sul pulsante modifica la misura .
- Modificare il valore di soglia (per esempio, 50%) dei VOI e fare clic su OK.
- Registrare il SUVmax, SUVmean, volume di destinazione e soglia dell'area target, che automaticamente vengono misurati.
- Per visualizzare stericamente il metabolismo del glucosio della superficie del intero-cervello, utilizzare il software (Vedi Tabella materiali) per impostare una mappa di colori per le immagini di FDG-PET/CT [18F] Basato sulla glicemia.
- Infine, confrontare la valutazione clinica con le immagini di [18F] FDG-PET/CT.
Risultati
Un uomo di 63 anni che era stato investito da un'auto mentre in bicicletta è stato portato al pronto soccorso tramite ambulanza. L'esame ha rivelato un punteggio della Glasgow Coma Scale di 7 (apertura degli occhi = 1, migliore risposta verbale = 2, miglior risposta motoria = 4), anisocoria (destra: 2 mm e la sinistra: 3 mm) e una risposta negativa corneale17. A CT della testa ha mostrato l'emorragia subaracnoidea ed intracranica e una frattura del cranio...
Discussione
Questo protocollo fornisce i mezzi per condurre una serie di cervello-glucosio valutazione metaboliche con [18F] FDG-PET/CT usando autoprodotto tracciante FDG [18F] ad una singola istituzione.
La produzione del tracciante FDG [18F] segue la procedura descritta nel manuale dell'operatore FDG sintetizzatore; Tuttavia, la cautela è necessaria per quanto riguarda i tre punti. In primo luogo, il bombardamento di tempo e di energia (punto 2.5) dovrebbe essere regola...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. Uchino in ospedale Sousen per tutte le procedure. Gli autori ringraziano anche Adam Phillips dal gruppo Esposito (www.edanzediting.com/ac) per la modifica di un progetto di questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 20ml syringe | Terumo | SS-20ESZ | |
| 10ml syringe | Terumo | SS-10ESZ | |
| 1ml syringe | Terumo | SS-01T | |
| Protective plug | Top | ML-KS | |
| Three-way cock L type 180° | Terumo | TS-TL2K | |
| Extension tube | Top | X1-50 | |
| Indwelling needle 22G or 24G | Terumo | SR-OT2225C | |
| Tegaderm transparent dressing | 3M | 1624W | |
| Hepaflash 10U/ml 10ml | Terumo | PF-10HF10UA | |
| Auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01 | |
| Fluid for auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01-001 | |
| Millex-GS Syringe Filter Unit | Millipore | SLGSV255F | |
| Air needle | Terumo | XX-MFA2038 | |
| Check valve | Hakko | 23310100 | |
| Saline 500ml | HIKARI pharmaceutical Co., Ltd. | 18610155-3 | |
| Yukiban 25x7mm | Nitto | 3252 | |
| Elascot No.3 | Alcare | 44903221 | |
| Presnet No.3 27x20mm | Alcare | 11674 | |
| Steri Cotto a 4x4cm | Kawamoto | 023-720220-00 | |
| StatstripXp3 | Nova Biomedical | 11-110 | |
| Statstrip Glucose strips | Nova Biomedical | 11-106 | |
| JMSsheet | JMS | JN-SW3X | |
| Injection pad | Nichiban | No.30-N | |
| Stepty | Nichiban | No.80 | |
| Advantage Workstation | GE Healthcare | Volume Share 7. version 4.7 | |
| Discovery MI PET/CT | GE Healthcare | ||
| EV Insite | PSP | ||
| GE TRACERlab MXFDG synthesizer reagent kit | ABX | K-105TM | |
| TRACERlab MXFDG cassette | GE Healthcare | P5150ME | |
| Extension tube | Universal Giken Co., Ltd | AT511-ST-001 | |
| TSK sterilized injection needle 18x100 | Tochigiseiko | AT511-ST-004 | |
| TSK sterilized injection needle 18x60 | Tochigiseiko | AT511-ST-002 | |
| TSK sterilized injection needle 21x65 | Tochigiseiko | AT511-ST-003 | |
| Seal sterile vial -N 5ml | Mita Rika Kogyo Co., Ltd. | SSVN5CBFA | |
| k222 TLC plate | Universal Giken Co., Ltd. | AT511-01-005 | |
| Anion-cation test paper | Toyo Roshi Kaisha | 7030010 | |
| Endospecy ES-24S set | Seikagaku corporation | 20170 | |
| Sterile evacuated vial | Gi phama | 10214 | |
| 5ml syringe | Terumo | SS-05SZ | |
| Extension tube | Top | X-120 | |
| Finefilter F | Forte grow medical Co.Ltd. | F162 | |
| Millex FG | Merck | SLFG I25 LS | |
| Vented Millex GS | Merck | SLGS V25 5F | |
| Injection needle 18x38 | Terumo | NN-1838R | |
| Injection needle 21x38 | Terumo | NN-2138R | |
| Water-18O | Taiyo Nippon Sanso | F03-0027 | |
| Distilled water | Otsuka phrmaceutical | ||
| Hydrogen gas G1 | Hosi Iryou Sanki | ||
| Helium gas G1 | Hosi Iryou Sanki | ||
| Nitrogen G1 | Hosi Iryou Sanki | ||
| TRACERlabMXFDG | GE Healthcare | ||
| Sep-Pak Light Accell Plus QMA | WATERS | ||
| Sep-Pak Plus tC18 | WATERS | ||
| Sep-Pak Plus Alumina N | WATERS | ||
| HPLC with 3.9 X 300 mm columns | WATERS | ||
| US-2000 | Universal Giken CO. Ltd. | ||
| Kryptofix222 | Merck | ||
| EG Reader SV-12 | Seikagaku Corporation | ||
| UG-01 | Universal Giken Co., Ltd. | ||
| syngo.via | Siemens Healthineers | ||
| Advantage Workstation Volume Share 7, version 4.7 | GE Healthcare | ||
| Q clear | GE Healthcare | ||
| CRC-15PET dose calibrator | CAPINTEC, INC. |
Riferimenti
- Godbolt, A. K., et al. Disorders of consciousness after severe traumatic brain injury: a Swedish-Icelandic study of incidence, outcomes and implications for optimizing care pathways. Journal of Rehabilitation Medicine. 45 (8), 741-748 (2013).
- Klingshirn, H., et al. Quality of evidence of rehabilitation interventions in long-term care for people with severe disorders of consciousness after brain injury: A systematic review. Journal of Rehabilitation Medicine. 47 (7), 577-585 (2015).
- Fischer, D. B., Truog, R. D. What is a reflex? A guide for understanding disorders of consciousness. Neurology. 85 (6), 543-548 (2015).
- Klingshirn, H., et al. RECAPDOC - a questionnaire for the documentation of rehabilitation care utilization in individuals with disorders of consciousness in long-term care in Germany: development and pretesting. BMC Health Services Research. 18 (1), 329 (2018).
- Stéfan, A., Mathé, J. F. SOFMER group. What are the disruptive symptoms of behavioral disorders after traumatic brain injury? A systematic review leading to recommendations for good practices. Annals of Physical and Rehabilitation. 59, 5-17 (2016).
- Liu, S., et al. Multimodal neuroimaging computing: a review of the applications in neuropsychiatric disorders. Brain Informatics. 2 (3), 167-180 (2015).
- Wong, K. P., et al. A semi-automated workflow solution for multimodal neuroimaging: application to patients with traumatic brain injury. Brain Informatics. 3 (1), 1-15 (2016).
- Chennu, S., et al. Brain networks predict metabolism, diagnosis and prognosis at the bedside in disorders of consciousness. Brain. 140 (8), 2120-2132 (2017).
- Di Perri, C., et al. Neural correlates of consciousnes s in patients who have emerged from a minimally conscious state: a cross-sectional multimodal imaging study. The Lancet Neurology. 15 (8), 830-842 (2016).
- Erecińska, M., Silver, I. A. ATP and brain function. Journal of Cerebral Blood Flow & Metabolism. 9 (1), 2-19 (1989).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807 (2015).
- Byrnes, K. R., et al. FDG-PET imaging in mild traumatic brain injury: a critical review. Frontiers in Neuroenergetics. 5, 13 (2014).
- Mortensen, K. N., et al. Impact of Global Mean Normalization on Regional. Glucose Metabolism in the Human Brain. Neural Plasticity. , 6120925 (2018).
- Wagatsuma, K., et al. Comparison between new-generation SiPM-based and conventional PMT-based TOF-PET/CT. Physica Medica. 42, 203-210 (2017).
- Fukukita, H., et al. Japanese guideline for the oncology FDG-PET/CT data acquisition protocol: synopsis of Version 2.0. Annals of Nuclear Medicine. 28 (7), 693-705 (2014).
- Varrone, A., et al. EANM procedure guidelines for PET brain imaging using [18F]FDG, version 2. European Journal of Nuclear Medicine and Molecular Imaging. 36 (12), 2103-2110 (2009).
- Teasdale, G., Jennett, B. Assessment of coma and impaired consciousness. A practical scale. The Lancet. 2 (7872), 81-84 (1974).
- Valadka, A. B., Moore, E. J., Feliciano, D. V., Moore, E. E. Injury to the cranium. Trauma. , 377-399 (2000).
- Carney, N., et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 80 (1), 6-15 (2017).
- Giacino, J. T., Kalmar, K., Whyte, J. The JFK Coma Recovery Scale-Revised: measurement characteristics and diagnostic utility. Archives of Physical Medicine and Rehabilitation. 85 (12), 2020-2029 (2004).
- Schnakers, C., et al. The Nociception Coma Scale: a new tool to assess nociception in disorders of consciousness. Pain. 148 (2), 215-219 (2010).
- Shiel, A., et al. The Wessex Head Injury Matrix (WHIM) main scale: a preliminary report on a scale to assess and monitor patient recovery after severe head injury. Clinical Rehabilitation. 14 (4), 408-416 (2000).
- GE Healthcare. . TRACERlabMXFDG operator manual, Version 1. , (2003).
- Yamaki, T., et al. Association between uncooperativeness and the glucose metabolism of patients with chronic behavioral disorders after severe traumatic brain injury: a cross-sectional retrospective study. BioPsychoSocial Medicine. 12, 6 (2018).
- Schwaiger, M., Wester, H. J. How many PET tracers do we need?. Journal of Nuclear Medicine. 52, (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon