È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Multiplexing focalizzato ad ultrasuoni stimolazione con microscopia di fluorescenza
In questo articolo
Riepilogo
Bassa intensità ha pulsato ultrasuono stimolazione (LIPUS) è una modalità per stimolazione meccanica non invasiva delle cellule endogene o ingegnerizzate con elevata risoluzione spaziale e temporale. Questo articolo viene descritto come implementare LIPUS ad un microscopio a epifluorescenza e come ridurre al minimo disadattamento di impedenza acustica lungo il percorso di ultrasuono per evitare indesiderati artefatti meccanici.
Abstract
Mettendo a fuoco gli impulsi di ultrasuoni a bassa intensità che penetrano i tessuti molli, LIPUS rappresenta una promettente tecnologia biomedica in remoto e in modo sicuro manipolare infornamento neurale, secrezione ormonale e cellule geneticamente riprogrammate. Tuttavia, la traduzione di questa tecnologia per applicazioni mediche attualmente è ostacolata da una mancanza di meccanismi biofisici che mirate senso tessuti e rispondere a LIPUS. Un approccio adatto per identificare questi meccanismi sarebbe utilizzare biosensori ottici in combinazione con LIPUS per determinare sottostanti vie di segnalazione. Tuttavia, l'implementazione LIPUS al microscopio a fluorescenza possono introdurre artefatti indesiderati meccaniche dovuta alla presenza di interfacce fisiche che riflettono, assorbono e rifrangere le onde acustiche. Questo articolo presenta una procedura dettagliata per incorporare LIPUS reperibile in posizione verticale epi-fluorescenza microscopi, riducendo al minimo l'influenza delle interfacce fisiche lungo il percorso acustico. Una procedura semplice è descritta per operare un trasduttore ad ultrasuoni elemento singolo e per portare la zona focale del trasduttore nel punto focale obiettivo. L'utilizzo di LIPUS è illustrato con un esempio dei transienti di calcio LIPUS-indotta in cellule di glioblastoma umano colto misurate usando la formazione immagine del calcio.
Introduzione
Molte malattie richiedono una qualche forma di intervento medico invasivo. Queste procedure sono spesso costosi, rischioso, richiedono periodi di recupero e quindi aggiungere un peso ai sistemi sanitari. Modalità terapeutiche non invasivi hanno il potenziale per fornire alternative più sicure ed economiche per procedure chirurgiche convenzionali. Tuttavia, approcci attuali non invasiva come farmacoterapia o transcranial stimolazione magnetica sono spesso limitati di trade-off tra penetrazione tissutale, risoluzione spazio-temporale ed effetti indesiderati fuori bersaglio. In questo contesto, un ultrasuono messo a fuoco costituisce una promettente tecnologia non invasiva con il potenziale per manipolare le funzioni biologiche profonde all'interno dei tessuti con alta esattezza spatiotemporal ed effetti limitati fuori bersaglio.
Ultrasuono messo a fuoco la stimolazione consiste di erogare energia acustica in posizioni precise profondo all'interno di organismi viventi. A seconda dei parametri di impulso acustico, questa energia può avere una varietà di usi medici. Per esempio, la Food and Drug Administration ha approvato l'uso di ultrasuoni focalizzati ad alta intensità (HiFU) per termoablazione di tumori della prostata, regioni del cervello che causano tremore, fibromi uterini e terminazioni nervose causando dolore metastasi ossee1 . HiFu-mediata microbolle cavitazione è utilizzato anche per aprire transitoriamente la barriera emato - encefalica per la somministrazione mirata di somministrazione sistemica terapeutica2. L'intensità di impulso-media spaziale-picco (misppa) e spaziali-picco temporale-media intensità (mispta) utilizzato per HiFU applicazioni sono in genere sopra parecchi kW cm-2 e producono pressione di impulso di diverse decine di MPa. Questi valori di intensità sono molto di sopra della FDA ha approvatosppa e mispta limiti per diagnostico ad ultrasuoni, 190 W cm-2 e 720 mW cm-2, rispettivamente3. Al contrario, recenti studi hanno dimostrato che la stimolazione non distruttivi ad ultrasuoni pulsata che sono all'interno o nei pressi dei limiti di intensità di diagnostica ad ultrasuoni (LIPUS) può essere efficace in remoto e in modo sicuro manipolare neurale di cottura4, 5,6,7,8, secrezione ormonale9,10 e Bioingegneria cellule11. Ancora, i meccanismi cellulari e molecolari mediante il quale le cellule percepiscono e rispondere ai ultrasuono rimangono poco chiari, precludendo traslazione clinica LIPUS. Quindi, negli ultimi anni, studi di membrane artificiali, cellule coltivate e animali stimolati con ultrasuoni hanno acquisito slancio per rivelare biofisiche e processi fisiologici modulata da LIPUS12,13, 14,15.
Suono è costituito da una vibrazione di moltiplicazione attraverso un supporto fisico. L'ecografia è un suono con una frequenza di sopra della gamma udibile umana (cioè, sopra i 20 kHz). In un ambiente di laboratorio, gli ultrasuoni sono generalmente prodotti da trasduttori piezoelettrici che contengono un materiale che vibra in risposta a un campo elettrico oscillante in una specifica larghezza di banda ad alta frequenza. Esistono due tipi di trasduttori: singolo elemento trasduttori e matrici di trasduttore. Trasduttori a singolo elemento piezoelettrico possiedono una superficie curva che agisce come una lente di focalizzazione e quindi si concentra energia acustica in una regione definita chiamata la zona focale. Trasduttori a singolo elemento sono molto più economico e più facile da gestire rispetto alle matrici di trasduttore. Questo articolo si concentrerà sui trasduttori a singolo elemento.
La dimensione della zona focale di un trasduttore a singolo elemento dipende dalla proprietà geometriche della lente acustica e la sua frequenza acustica. Per raggiungere una zona focale di millimetro-dimensione con un trasduttore a singolo elemento, ultrasuoni frequenze nella gamma MHz sono generalmente richieste. Purtroppo, onde acustiche a tale frequenza vengono attenuate molto rapidamente quando si propaga in un mezzo tenue come l'aria. Pertanto, onde ad ultrasuoni MHz necessario essere generato e propagato al campione in un materiale più denso come l'acqua. Ciò costituisce la prima sfida di integrare modalità LIPUS ad un microscopio.
Una seconda sfida è di minimizzare le interfacce fisiche tra materiali con diverse impedenze acustiche (che è un prodotto della densità del materiale e la velocità acustica) lungo il sentiero acustico. Queste interfacce possono riflettere, rifrangere, dispersione e assorbire le onde acustiche, che lo rende difficile quantificare la quantità di energia acustica efficacemente consegnato ad un campione. Possono inoltre creare manufatti meccanici indesiderati. Per esempio, riflessioni mancata corrispondenza perpendicolare all'acustica prodotta impedenza interfacce creano onde backpropagating che interferiscono con quelli di propagazione in avanti. Lungo il percorso di interferenza, le onde annullano a vicenda alle regioni fisse degli spazi chiamati nodi e riassumere a alternata regioni chiamate anti-nodi, creando le cosiddette onde stazionarie (Figura 1). È importante per lo sperimentalista essere in grado di controllare o eliminare queste interfacce sperimentali in vitro , come non possono esistere in vivo.
Misura di fluorescenza del reporter ottico è un noto metodo per interrogare i campioni biologici trasparenti in tempo reale e con nessun disturbo fisico. Questo approccio è quindi ideale per gli studi LIPUS come eventuali sonde fisici presente nella zona lisati mediante introdurrà manufatti meccanici. Questo protocollo descrive l'attuazione e il funzionamento del LIPUS ad un microscopio a epifluorescenza commerciale.
Protocollo
1. crescita delle cellule su acusticamente trasparente pellicola di poliestere
- Praticare una dimensione del foro di 12 mm nella parte inferiore di una piastra di coltura standard da 35 mm con un trapano verticale a stampa. Spostare lentamente il trapano e indossare occhiali di protezione. Rimuovere i pezzi di plastica attaccato al fondo del piatto con una lama per creare una superficie liscia sul lato esterno (Figura 2).
- Applicare un sottile strato di resina epossidica marino-grado o colla sulla superficie di fondo esterno del piatto.
- Posizionare una pellicola di poliestere (spessore 2,5 µm) contro la superficie di fondo esterno del piatto e premere con decisione per assicurarsi che la colla a resina epossidica/si diffonde in modo uniforme tra la pellicola e la superficie di plastica spessa. Tirare delicatamente il film in modo centrifugo con le dita per creare una superficie piana (Figura 2).
- Quando la resina epossidica/colla si è asciugata, brevemente risciacquo-secco poliestere-fondo piatto con etanolo al 95% e sterilizzare mettendo il piatto e la parte interna superficie del suo coperchio sotto una forte sorgente di eccitazione 254 nm UV. Regolare la durata e l'intensità di trasportare una dose di UV di circa 330 mJ cm-2 per la completa distruzione della maggior parte dei tipi di microrganismi. Questa energia corrisponde approssimativamente a una durata di 5 minuti utilizzando un 1.000 illuminazione UV di µW cm-2 .
- Miscele di proteine di matrice extracellulare commercialmente disponibili aliquota (EMPM) in piccoli tubi (50-100 µ l) e conservare a-20 ° C o meno in condizioni sterili.
- In un ambiente sterile (ad esempio, all'interno di una cappa di biosicurezza), diluire un'azione congelate di EMPM con un terreno di coltura desiderato a 1: 100. Lavorare sul ghiaccio per evitare la polimerizzazione di EMPM a temperatura ambiente. Applicare rapidamente 100 µ l della miscela media sulla pellicola di poliestere. Riposizionare il coperchio sul piatto per mantenere la sterilità.
- Incubare piatti fondo poliestere rivestite con EMPM in un'incubatrice di2 cultura CO cellulare a 37 ° C per 6-12 h.
- Dopo l'incubazione, aspirare l'eccesso del prodotto e seme direttamente la superficie con le cellule alla densità desiderata. Lavorare in condizioni sterili per mantenere la sterilità.
2. LIPUS attuazione
- Posto un serbatoio d'acqua sotto l'obiettivo di un microscopio dritto con grande volume di lavoro e senza hardware di illuminazione nel percorso di trasmissione.
- Utilizzando componenti optomechanical disponibili in commercio, inserire un supporto del campione sotto l'obiettivo e titolare di un trasduttore sotto il portacampioni. Per l'allineamento di ricerca e ultrasuoni campione successivo, montare questi titolari di due fasi di traduzione.
- Posizionare le parti in movimento e attuatori di fasi di traduzione o all'esterno della vasca o sopra la linea di galleggiamento per evitare danni d'acqua. Utilizzare solo materiali corrosivi come in alluminio anodizzato o in acciaio inox per componenti optomechanical immersi.
- Riempire il serbatoio con acqua deionizzata e degassato prima di utilizzare il trasduttore di immersione. La linea di galleggiamento dovrebbe coincidere con il piano orizzontale del supporto del campione (Figura 3).
Nota: Acqua deionizzata impedisce l'accoppiamento elettrico in presenza di elevati campi elettrici. Degasaggio eviterà anche scattering e alterazioni delle onde acustiche. Scolare l'acqua dopo ogni esperimento utilizzando una pompa o una valvola in modo che la linea di acqua cade sotto la posizione del trasduttore. Inoltre, sostituire o filtrare l'acqua frequentemente e clean-up il serbatoio dell'acqua come necessario per evitare la crescita di microrganismi.
3. obliquo eccitazione acustica
- Utilizzando componenti optomechanical commercialmente disponibili, orientare il trasduttore in posizione obliqua rispetto al percorso ottico. Questo farà sì che qualsiasi riflesso onde saranno diretto dal campione (Figura 3 e Figura 4).
4. Guida il trasduttore
Nota: Trasduttori ad ultrasuoni convertono energia elettrica oscillante in espansione/contrazione meccaniche di un materiale piezoelettrico. Questa conversione produce una perdita di energia sotto forma di energia termica. Quindi, mentre trasduttori possiedono un limite di tensione di ingresso di picco, possiedono anche un limite di corrente elettrica per evitare danni termici all'elemento piezoelettrico: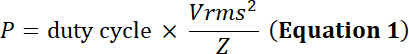
con il dovere ciclo la relativa frazione di tempo di simulazione elettrica, P la potenza elettrica (in watt), Vrms root-mean-square tensione (in volt) della sorgente di tensione alternativa e Z l'elettrico impedenza (in Ohms).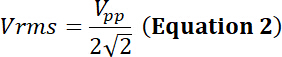
con Vpp la tensione di ingresso di picco-picco applicata al trasduttore.
- Creare una forma di onda sinusoidale contenente la frequenza desiderata, il numero di cicli per impulso, e utilizzando un generatore di funzione commerciale di frequenza di ripetizione di impulso. Tuttavia, il Vpp relativamente elevato necessario per efficacemente guidare trasduttori ad ultrasuoni standard spesso richiede l'aggiunta di un amplificatore di potenza per amplificare l'uscita (cioè, aumentare l'ampiezza di Vpp) del generatore di funzione.
Nota: ad esempio, produttore di un trasduttore indica il limite di potenza per un determinato trasduttore è 35 W. Sarà un sinusoidale picco-picco tensione in ingresso (inV) di 500 mV a un duty cycle del 50% e amplificato attraverso un 50 dB/100 W amplificatore essere entro il limite di potenza di questo trasduttore?- Per rispondere a questa domanda, è possibile calcolare la tensione dopo l'amplificazione. Per un amplificatore di potenza a radiofrequenza (RF), il fattore di amplificazione (dB) è definito da:
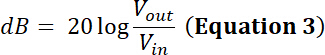
Così, la tensione amplificata ha un'ampiezza uscita Vpp (Vpp = Vfuori) di: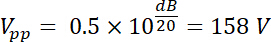
Utilizzando le equazioni 1 e 2 e 50 Ω come impedenza elettrica, la corrispondente potenza generata da questa tensione è: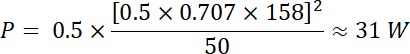
Questa stimolazione è quindi entro il limite di potenza del trasduttore. - Utilizzando l'esempio precedente, calcolare i parametri di forma d'onda (Vpp, frequenza, durata dell'impulso e frequenza di ripetizione di impulso) che corrispondono ai limiti di potenza e tensione forniti dal produttore del trasduttore. Assicurarsi di rispettare questi limiti per evitare di danneggiare il trasduttore e altri apparecchi collegati a valle.
- Per rispondere a questa domanda, è possibile calcolare la tensione dopo l'amplificazione. Per un amplificatore di potenza a radiofrequenza (RF), il fattore di amplificazione (dB) è definito da:
- Scegliere un generatore di funzione che opera all'interno di una gamma di frequenza compatibile con il trasduttore di ultrasuono. Regolare la frequenza del generatore di funzione per la frequenza di picco nominale del trasduttore.
- Creare un impulso di tensione sinusoidale della durata desiderata e frequenza di ripetizione utilizzando la modalità burst del generatore di funzione. Regolare la tensione di picco-picco un valore desiderato. Assicurarsi che la durata dell'impulso è più breve del tempo trascorso tra due impulsi consecutivi.
- Verificare che la forma d'onda corrisponde al segnale desiderato collegando l'uscita del generatore di funzione all'ingresso di un oscilloscopio.
- Collegare l'uscita del generatore di funzione all'ingresso di un amplificatore di RF di potenza (Figura 4). Assicurarsi che i parametri di stimolazione sono entro i limiti del produttore del trasduttore.
5. l'allineamento del raggio
- Scegliere un idrofono che opera con una frequenza gamma e acustica intensità compatibile con la frequenza e l'intensità del trasduttore ad ultrasuoni.
- Mettere con cura la punta di una sonda di idrofono a fuoco entro il campo di vista oggettivo nella posizione corrispondente alla posizione del campione (Figura 4).
- Assicurarsi che la sonda sia trasduttore sono immersi in acqua deionizzata e degassato. Non urtare la punta dell'idrofono con qualsiasi oggetto fisico diverso dall'acqua poiché potrebbe alterare il suo rivestimento e influenzare la misurazione.
- Eseguire un lordo pre-allineamento del trasduttore posizionando visivamente la sua asse acustico verso la sonda idrofono. Fa in modo che la distanza tra la superficie del trasduttore e la punta di idrofono corrisponde approssimativamente alla lunghezza focale del trasduttore.
- Collegare l'idrofono output a uno degli input di segnale dell'oscilloscopio. Collegare il trigger di sincronizzazione del generatore di funzione ad un altro ingresso dell'oscilloscopio. Visualizzare entrambi i segnali simultaneamente sull'oscilloscopio.
- Guidare il trasduttore con pochi cicli di ultrasuono a un duty cycle basso e ampiezza bassa per evitare di danneggiare la sonda. Verifica con condizioni di funzionamento sicuro del produttore di idrofono per evitare di danneggiare la punta idrofono.
- Regolare la manopola s/divisione secondo il tempo di viaggio degli ultrasuoni dalla superficie del trasduttore per l'idrofono. Cercare un idrofono segnale sull'oscilloscopio dopo il trigger di sincronizzazione.
- Azionare lentamente il trasduttore mediante una fase XYZ motorizzata o manuale. Lasciare il trasduttore nella posizione che correla con il segnale di massima idrofono (Figura 4).
Nota: Se non viene rilevato alcun segnale, è possibile che l'intensità degli impulsi acustici è troppo bassa o che il fascio è mis-allineato o sparsi da un oggetto. Controllare regolarmente che l'idrofono e trasduttore sono visivamente preallineati e che nessun bolle o oggetto fisico sono presenti nel percorso tranne la pellicola di poliestere. Se viene ancora rilevato alcun segnale, è possibile aumentare la tensione di ingresso da una piccola quantità per aumentare l'ampiezza del segnale idrofono.
6. la determinazione della pressione di impulso ad ultrasuoni e intensità
- Con il fascio allineato, misurare l'ampiezza picco-picco di idrofono uscita presso l'oscilloscopio per varie tensioni guida il trasduttore. Assicurarsi di non superare il limite di pressione raccomandato dal produttore di idrofono.
- Convertire queste misurazioni in pressione e/o valori di intensità acustica mediante il metodo di calibrazione fornito dal produttore di idrofono.
Nota: L'intensità acustica può essere determinato dalla pressione e viceversa utilizzando la formula:
con io la pressione acustica (in W m-2), P la pressione acustica (in Pa), ρ la densità dei materiali di moltiplicazione (1.000 kg m-3 per l'acqua) e c la velocità del suono nel mezzo di moltiplicazione (per acqua, c = 1.500 m s-1). - Creare curve di calibrazione utilizzando queste misurazioni.
Nota: La pressione vs tensione e intensità vs tensione curve hanno una forma lineare e parabolica, rispettivamente. - Determinare il valore di pressione e/o intensità di una tensione di guida desiderata utilizzando la curva di taratura corrispondente.
7. calcio-sensibili/LIPUS fluorescenza di cellule vive
- Sostituire il terreno di coltura della cella con un buffer di imaging desiderato contenente 5 µM di un colorante sensibile calcio cella-permeante (ad es., Fluo-4 AM). Incubare la piastra di coltura in incubatore a CO2 a 37 ° C per 1 h.
- Lavare accuratamente le cellule con lo stesso buffer esente dalla tintura.
- Mettere il piatto in supporto del campione. Eccitare le celle utilizzando illuminazione a luce blu (490 nm) e regolare l'esposizione di intensità e fotocamera di eccitazione per evitare eccessiva saturazione di imbianchimento o pixel.
- Eseguire time-lapse imaging utilizzando le impostazioni di acquisizione di immagine desiderata. Utilizzare un obiettivo a immersione per una migliore qualità di immagine e con lunga distanza di lavoro per ridurre i riflessi indesiderati (vedere Figura 4).
Risultati
Figura 5 è un esempio di esperimento LIPUS multiplexata con formazione immagine del calcio. Le cellule di glioblastoma (A-172) sono state coltivate su pellicola di poliestere EMPM rivestito in terreno di coltura standard (supplementato con 10% siero e 1% antibiotici) e incubate con il reporter fluorescente sensibili del calcio Fluo-4 AM. Le cellule erano imaged utilizzando un obiettivo 10x immersione e illuminata con una sorgente di luce bianca LED e luce di...
Discussione
Un vantaggio principale di ultrasuoni focalizzati è la sua capacità di non invadente erogare energia meccanica e/o termica a campioni biologici con alta precisione spazio-temporale. Altre tecniche destinate a stimolare meccanicamente cellule solitamente impiegano sonde fisico invasivo (ad es., cella-frugando) o richiede l'interazione di raggi laser ad alta energia con corpi estranei (ad es., pinzette ottiche). Riscaldamento magnetico può riscaldare specifiche posizioni spaziali all'interno di campion...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo la d. ssa Mikhail Shapiro e Nikita Reznik per discussioni fruttuose. Questo lavoro è stato sostenuto dai fondi di Start-up da Western University of Health Sciences e NIH concedere R21NS101384.
Materiali
| Name | Company | Catalog Number | Comments |
| upright microscope with large working volume | Thorlabs | CERNA | |
| upright microscope with large working volume | Scientifica | SliceScope | |
| optomechanical components | Thorlabs | n/a | |
| needle hydrophone | ONDA Corporation | HNP/C/R/A/T series + AH/G pre-amplifier | |
| needle hydrophone | Precision Acoustics | n/a | |
| fiber optic hydrophone | ONDA Corporation | HFO series | |
| fiber optic hydrophone | Precision Acoustics | n/a | |
| oscilloscope | Keysight Technology | DSOX2004A (4-channels 70MHz) | |
| function generator | Keysight Technology | 33500B (20MHz single-channel) | |
| RF power amplifier | Electronic Navigation Industries (ENI) | 325LA, 525LA, 240L, 350L, A075, 2100L, 3100LA | |
| RF power amplifier | Electronics & Innovation (E&I) | ||
| immersion ultrasound transducer | Olympus | focused immersion transdcuers | |
| immersion ultrasound transducer | Benthowave Instrument | HiFu transducer BII-76 series | |
| immersion ultrasound transducer | Precision Acoustics | Piezo-ceramic or HiFu transducers | |
| immersion ultrasound transducer | Ultrasonic-S-lab | HiFu transducers made to order | |
| high-density Matrigel | Corning | VWR 80094-330 | |
| Mylar film 2.5 microns | Chemplex | CAT.NO:107 |
Riferimenti
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
- Toccaceli, G., Delfini, R., Colonnese, C., Raco, A., Peschillo, S. . Emerging strategies and future perspective in neuro-oncology using Transcranial Focused Ultrasound Technology. , (2018).
- Duck, F. A. Medical and non-medical protection standards for ultrasound and infrasound. Progress in Biophysics and Molecular Biology. 93 (1-3), 176-191 (2007).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nature Neuroscience. 17 (2), 322-329 (2014).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews: Neuroscience. 13 (12), 867-878 (2012).
- Tyler, W. J. Noninvasive neuromodulation with ultrasound? A continuum mechanics hypothesis. Neuroscientist. 17 (1), 25-36 (2011).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Tyler, W. J., et al. Remote excitation of neuronal circuits using low-intensity, low-frequency ultrasound. PloS One. 3 (10), e3511 (2008).
- Suarez Castellanos, I., et al. Calcium-dependent ultrasound stimulation of secretory events from pancreatic beta cells. Journal of Therapeutic Ultrasound. 5, 30 (2017).
- Suarez Castellanos, I., Jeremic, A., Cohen, J., Zderic, V. Ultrasound Stimulation of Insulin Release from Pancreatic Beta Cells as a Potential Novel Treatment for Type 2 Diabetes. Ultrasound in Medicine and Biology. 43 (6), 1210-1222 (2017).
- Ibsen, S., Tong, A., Schutt, C., Esener, S., Chalasani, S. H. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nature Communications. 6, 8264 (2015).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but Not NaV1.2 Channels by Ultrasound at 43 MHz. Ultrasound in Medicine and Biology. 44 (6), 1217-1232 (2018).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Scientific Reports. 6, 24170 (2016).
- Prieto, M. L., Omer, O., Khuri-Yakub, B. T., Maduke, M. C. Dynamic response of model lipid membranes to ultrasonic radiation force. PloS One. 8 (10), e77115 (2013).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic Neuromodulation Causes Widespread Cortical Activation via an Indirect Auditory Mechanism. Neuron. 98 (5), 1031-1041 (2018).
- O'Brien, W. D. Ultrasound-biophysics mechanisms. Progress in Biophysics and Molecular Biology. 93 (1-3), 212-255 (2007).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Corrigendum: Infrared light excites cells by changing their electrical capacitance. Nature Communications. 8, 16148 (2017).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nature Communications. 3, 736 (2012).
- Shapiro, M. G., Priest, M. F., Siegel, P. H., Bezanilla, F. Thermal mechanisms of millimeter wave stimulation of excitable cells. Biophysical Journal. 104 (12), 2622-2628 (2013).
- Hwang, J. Y., et al. Investigating contactless high frequency ultrasound microbeam stimulation for determination of invasion potential of breast cancer cells. Biotechnology and Bioengineering. 110 (10), 2697-2705 (2013).
- Nakano, M., et al. Genetically encoded ratiometric fluorescent thermometer with wide range and rapid response. PloS One. 12 (2), e0172344 (2017).
- Donner, J. S., Thompson, S. A., Kreuzer, M. P., Baffou, G., Quidant, R. Mapping intracellular temperature using green fluorescent protein. Nano Letters. 12 (4), 2107-2111 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon