Method Article
Un High-throughput Shigella-specifica analisi battericida
In questo articolo
Riepilogo
Qui presentiamo un protocollo per misurare l'attività del Shigellacidal degli anticorpi nel siero. Siero è mescolato con batteri e complemento esogeno, incubate, e la miscela di reazione è placcata su piastre di agar. Batteri vitali formano colonie che sono contati, utilizzando un enumeratore di Colonia automatizzato e utilizzata per determinarne il titolo battericida.
Abstract
Analisi battericide del siero (SBAs) misurano l'attività funzionale degli anticorpi e sono state utilizzate per molti decenni. SBAs misurare direttamente attività di uccisione dell'anticorpo di valutazione della capacità degli anticorpi nel siero di legare ai batteri ed attivare il complemento. Questa attivazione del complemento provoca la lisi e l'uccisione dei batteri bersaglio. Queste analisi sono utili perché vanno di là di quantificare la produzione di anticorpi per delucidare le funzioni biologiche che dispongono di questi anticorpi, consentendo ai ricercatori di studiare il ruolo che gli anticorpi possono svolgere nella prevenzione dell'infezione. SBAs sono stati usati per studiare le risposte immunitarie per molti agenti patogeni umani, ma al momento non esiste alcuna metodologia ampiamente accettata per Shigella . Storicamente, SBAs sono stati molto laborioso, che richiede molti passaggi che richiede tempo per quantificare con precisione i batteri sopravvissuti. Questo protocollo descrive un semplice, robusto, e ad alta velocità di analisi che misure funzionali degli anticorpi specifici per Shigella in siero in vitro. Il metodo qui descritto offre molti vantaggi rispetto ai tradizionali SBAs, compreso l'uso delle scorte batteriche congelate, 96 ben Kit piastre, un sistema di micro-cultura e Colonia-conteggio automatizzato. Tutte queste modifiche rendono questo dosaggio più alto-rendimento e meno laborioso. Questo protocollo è più semplice e veloce da eseguire rispetto tradizionale SBAs pur utilizzando tecnologie semplici e facilmente disponibili reagenti. Il protocollo è stato applicato con successo in molteplici laboratori indipendenti e il dosaggio è robusto e riproducibile. L'analisi può essere usata per valutare le risposte immunitarie in studi pre-clinici come pure clinici. Quantificare i titoli dell'anticorpo di shigellacidal entrambi prima e dopo l'esposizione dell'antigene (sia da immunizzazione o infezione) consente una più ampia comprensione dell'anticorpo come funzionale, le risposte sono generate e il loro contributo all'immunità protettiva. Lo sviluppo di questo standard, ben caratterizzato dosaggio può facilitare notevolmente design vaccino Shigella .
Introduzione
Sierotipi di Shigella , Shigella flexneri 2a, 3a S. flexneri e S. sonnei, dimostrare prevalenza epidemiologica a livello globale. La malattia diarroica causata da queste specie Shigella viaggiatori impatti militare,1ed è delle cause principali di morte diarroica tra i bambini sotto l'età di 5 in paesi in via di sviluppo2. Attualmente non esistono vaccini con licenza per proteggere contro la Shigella, tuttavia, ci sono più candidati vaccinali nelle varie fasi dello sviluppo. Molti di questi vaccini e altre misure profilattiche attualmente in sviluppo, si concentrano su anticorpi prodotti contro Shigella lipopolisaccaride (LPS). LPS è un candidato vaccino attraente perché è un antigene di superficie principale ed infezione naturale con Shigella induce anticorpi LPS-specifici che possono essere protettivi contro re-infezione in un modo specifico del sierotipo. Di conseguenza, un vaccino di Shigella successo probabilmente dovranno essere multi-Valente e destinazione 3-4 che sierotipi di Shigella per indurre l'immunità contro 70-80% del circolante globalmente ceppi3,4, 5 , 6. questo richiede che i saggi per valutare candidati vaccinali Shigella sia specifici per diversi sierotipi di più.
Corrente saggi immunologici per la valutazione dei candidati vaccinali concentrano su quantificare i livelli dei titoli dell'anticorpo, ma ci sono pochi saggi ben caratterizzati per valutare gli anticorpi funzionali. L'esame delle capacità funzionali dell'anticorpo è importante perché gli anticorpi specifici agenti patogeni sono responsabili della lotta contro l'infezione attraverso una serie di meccanismi funzionali tra cui vincolanti gli antigeni di superficie di batteri e impedendo l'adesione alla e infezione delle cellule epiteliali, cellule batteriche o opsonizzazione e fagocitosi di targeting e direttamente uccidere gli agenti patogeni vincolanti ed iniziando la cascata del complemento. L'uccisione diretta di batteri dagli anticorpi si verifica quando gli anticorpi legano ai componenti di superficie dei batteri bersaglio e iniziano la cascata del complemento che portano all'attivazione di molti zimogeni che in definitiva il risultato nella formazione dei pori nel batterico cella che causa la morte di lisi e batterico. Questa uccisione diretta di batteri facendo circolare gli anticorpi e complemento può essere una linea di prima cruciale della difesa durante l'infezione.
Gli individui che sono infettati naturalmente hanno anticorpi con attività shigellacidal in loro sieri. Questi anticorpi specifici di Shigella-sono stati rilevati utilizzando il tradizionale complemento-mediata uccisione dosaggi 7,8. Ciò indica che potrebbe esserci un ruolo per anticorpi battericidi in protezione contro Shigella. Sono semplici nella loro esecuzione tradizionale test battericida: siero è inattivati al calore (per distruggere l'attività endogena del complemento) e mescolato con i batteri di interesse. Complemento esogeno viene aggiunto a questa miscela ad una concentrazione specifica. La miscela di reazione è incubata per consentire l'uccisione batterica e poi placcata per confermare unità formanti colonie (CFU). Una volta CFUs sono contati, può essere calcolato un indice di abbattimento del 50% (KI) e determina un titolo SBA. Mentre questa procedura è relativamente semplice, queste analisi possono essere laborioso e richiede molto tempo per eseguire e i risultati possono essere molto variabili. Oltre a queste limitazioni, non ben caratterizzati saggi funzionali attualmente esistano per Shigella. Pertanto, abbiamo sviluppato con successo e qualificati un'analisi semplice, ad alta produttività per misurare l'attività battericida di Shigella per tre dei ceppi più clinicamente rilevanti9. Questo protocollo descrive un SBA con modifiche che migliorano l'efficienza del test e la riproducibilità. La prima di queste modificazioni è l'uso delle scorte batteriche congelate. La produzione delle scorte di uso singola elimina la necessità di batteri freschi di cultura per ogni dosaggio, anche riducendo la variabilità di dosaggio a dosaggio. Un altro tempo e manodopera risparmio a vantaggio del presente protocollo è l'utilizzo di un formato di test di piastra a 96 pozzetti. Questo consente per diluizione seriale di campioni così che un intervallo di concentrazioni possa essere testato. Permette anche l'uso di pipette multicanale per placcatura campioni sul quadrato di Petri. Quando questi quadrati di Petri sono utilizzati in combinazione con un sistema di coltura che produce micro-colonie, il numero di piastre di agar richiesto per il dosaggio è ridotto. Questo, in combinazione con il software liberamente disponibile Colonia-conteggio, originariamente sviluppato per il pneumococco anticorpli multiplex uccidendo assay (MOPA)10, consente l'enumerazione di Colonia rapido, automatico e affidabile. Tutti questi miglioramenti significativamente ridurre dosaggio hands-on tempo e creazione di un sistema ad alta produttività consentendo per piastre multiple per essere eseguito in una sola volta.
Mentre questo protocollo è stato ottimizzato per tre dei sierotipi più clinicamente rilevanti di Shigella, la SBA descritto qui può essere facilmente applicato a molti altri batteri patogeni. Oltre a uso potenziale di questo protocollo con altri batteri, questo protocollo ha il potenziale per espandersi oltre usando solo il siero come materiale di partenza, che potrebbe includere l'analisi degli anticorpi in altri tipi di campione pertinenti quali campioni di mucosa, tra cui saliva e campioni di feci. L'uso di questo test per studiare le risposte immunologiche dopo la vaccinazione può dare più ampio spaccato le risposte immunitarie generato dalla vaccinazione che porta il design razionale di vaccini, e aiuto nella comprensione di come naturale immunità si sviluppa.
Protocollo
Questo protocollo segue le linee guida del bordo di protezione del soggetto umano WRAIR. Campioni utilizzati in questo studio sono campioni di siero umano raccolti come parte di WRAIR protocollo numero 1328, rispettando tutte le normative istituzionali e federale in materia di protezione dei soggetti umani. I campioni sono stati de-identificati, e l'uso di questi campioni anonimi è stata classificata come ricerca di soggetto non-umani dalla UAB IRB (numero di protocollo N150115001).
1. preparare i reagenti del saggio
- Preparare 1% gelatina aggiungendo 1 g di gelatina in 100 mL di acqua. Autoclave e conservare a temperatura ambiente.
- Preparare 100 mg/mL soluzione di riserva di TTC (cloruro di 2, 3,5-Triphenyltetrazolium) (1, 000 x) con l'aggiunta di 5 g di TTC a 40 mL di acqua. Quando il TTC sia completamente dissolto, regolare il volume di 50 mL con acqua e filtro sterile usando filtro di 0,2 µm. Conservare la soluzione a 4 ° C e proteggere dalla luce.
Nota: TTC colora le colonie batteriche e li rende molto più facile contare. Soluzione TTC ha un leggero colore giallo. Se la soluzione TTC si sviluppa un colore rosso, scartare e preparare fresco. - Preparare soluzione stock di 10% sodio azide (NaN3) (100 x) con l'aggiunta di 5 g NaN3 a 40 mL di acqua. Dopo dissoluzione completa, è necessario aggiungere acqua a 50 mL. Conservare a temperatura ambiente.
Attenzione: Sodio azide è un veleno e può essere tossica se ingerito o assorbito attraverso la pelle o gli occhi. Può reagire con piombo e rame formando azidi metalliche altamente esplosive. Sullo smaltimento dei reagenti contenenti sodio azide, sciacquare con un grande volume di acqua di azidi o annullare in un sacchetto di biohazard. - Preparare la piastra di LBA (piastra di agar LB) con l'aggiunta di 35 g di agar LB a 1 L di acqua e autoclave. Aggiungere 25 mL per ogni quadrato di Petri (120 x 120 mm2). Incubare le piastre a temperatura ambiente per 10-20 min per consentire agar solidificare. Collocare i piatti indietro in sacchetti di plastica e conservare a 4 ° C fino a 1 mese.
- Preparare Overlay Agar con l'aggiunta di 7,5 g di agar a 1.000 mL di acqua e autoclave. Incubare a bagnomaria di 56 ° C fino a quando necessario. Proprio prima dell'uso, aggiungere 1 mL di 100 mg/mL TTC e 10 mL di 10% NaN3 e mescolare bene.
Nota: Ogni piatto LBA ha bisogno di 25 mL di Agar di Overlay. Agar di copertura può essere preparato fino ad un mese in anticipo e fuso in un forno a microonde o su una piastra calda come necessario per il dosaggio. Assicurarsi che la temperatura di agar è ~ 55 ° C prima dell'applicazione di piastre di LBA. - Preparare Assay Buffer aggiungendo 5 mL di 10 x matasse equilibrato sale soluzione (HBSS) con Ca2 +/Mg2 + e 5 mL di 1% gelatina a 40 mL di acqua. Conservare a temperatura ambiente.
2. preparare il complemento e batteri di destinazione
-
Preparare il coniglio del bambino complemento (BRC)
Nota: Criteri dettagliati per complemento sacco selezione può essere trovato qui: https://www.vaccine.uab.edu/uploads/mdocs/UAB-MOPA.pdf- Ottenere congelato BRC e scongelare con acqua fredda corrente. Fisicamente mescolare il BRC ogni ~ 10-20 min fino a quando completamente sciolto. Non sottoporre BRC a congelare ripetuti cicli di scongelamento.
- Mentre BRC è lo scongelamento, etichettare provette per centrifuga da 1,5 mL, 5mL o 15 mL. Posto provette sul ghiaccio per pre-raffreddare. Aliquotare il corretto volume BRC per le provette da centrifuga pre-raffreddata (dopo il riempimento, restituire immediatamente ogni tubo al ghiaccio). Conservare le aliquote a ≤-70 ° C nel congelatore.
Nota: Circa 1 m di complemento è necessaria per ogni piatto di dosaggio. Aliquote di complemento sono monouso e devono essere titolate in volumi appropriati test layout. - Per preparare il BRC inattivati, scongelare un'aliquota di BRC attivo. Preparare un bagno di acqua di 56 ° C. Dopo BRC è completamente sciolto, trasferirlo a bagno d'acqua ed incubare per 30 min.
- Dopo l'incubazione, rimuovere BRC inattivati dal bagnomaria e lasciare per raffreddare a temperatura ambiente per 10-15 min Mix vigorosamente e aliquota ~ 150 µ l per provette per microcentrifuga da 1,5 mL. Conservare le aliquote a ≤-10 ° C.
-
Preparare destinazione brodo di batteri
Nota: La procedura riportata di seguito viene utilizzata per preparare 48 aliquote di stock di batteri di destinazione; Se sono necessarie ulteriori aliquote il protocollo può essere scalato.- Rimuovere i batteri master stock fiala dal freezer e raschiare la superficie batterica congelata per rimuovere una piccola quantità di ghiaccio dal flaconcino su una piastra di agar sangue. Restituire immediatamente il flaconcino stock master nel congelatore.
- Striscia questa piccola aliquota delle azione batterica sulla piastra di agar sangue e coprire con il coperchio della piastra. Incubare la piastra capovolta durante la notte in incubatore a 37 °C/5% CO2 .
- Trasferimento ~ 10 colonie lisce isolate per un tubo da 50 mL contenente 30 mL di brodo LB. Incubare per 3-5 h a 37 ° C con agitazione delicata fino a quando il brodo di cultura ha un OD600 di ~0.6-0,7.
- Vendemmia alto 12,5 mL della cultura e trasferirlo in una provetta di fresca 50 mL. Centrifugare la coltura a 15.000 x g per 2 minuti utilizzando una piano tavolo micro-centrifuga. Eliminare il supernatante e risospendere il pellet in 25 mL di glicerolo sterile di 15%-LB.
- Mescolare bene e versare aliquote da 0,5 mL in provette sterili da 1,5 mL micro (~ 48 tubi). Conservare le aliquote a ≤-70 ° C nel congelatore.
- Confermare l'identità batterica utilizzando il test di agglutinazione prima dell'uso.
-
Determinazione del fattore di diluizione ottimale per stock di batteri di destinazione
Nota: Ogni lotto di Stock in batteri di destinazione deve essere titolato in condizioni di test per determinare la diluizione necessaria per produrre ~ 120 CFU/spot sulle piastre di LB.- Ottenere una micropiastra (diluizione piastra) e 135 µ l di tampone di dosaggio a bene 1A. Aggiungere 120 µ l di burro Assay per pozzi 1B - 1h.
- Rimuovere una fiala di batteri bersaglio congelate dal freezer e scongelare a temperatura ambiente. Aggiungere 15 UL di stock scongelati batterica a bene 1A per rendere una diluizione di 10 volte dell'azione batterica.
- Trasferire 30 µ l di soluzione batterica da pozzetto 1A 1B bene eseguire una diluizione seriale 5 volte. Continuare 5 volte diluizioni seriali a ben 1H per un totale di 8 diluizioni (01:10; 01:50; 1: 250; 1:1 250; 1:6 250; 1:31 250; 1:156 250; 1:781 250).
- Ottenere un'altra piastra per microtitolazione (saggio piastra) e aggiungere 20 µ l di tampone di dosaggio per tutti ben nelle colonne 1 e 2 nella piastra di dosaggio.
- Trasferire 10 µ l di batteri diluiti da ogni pozzetto nella colonna 1 della piastra diluizione nei pozzetti corrispondenti nelle colonne 1 e 2 della piastra Assay. 10 µ l di batteri viene trasferito dal pozzetto 1A della piastra diluizione pozzetto 1A e 2A nel saggio piastra, ecc.
- Continuare con il test come descritto in siero battericida Assay (SBA) sotto per controllo A e B di controllo, passi 3.6-3.12.
- Dopo le piastre sono state incubate in ghiaccio, è possibile utilizzare una pipetta multicanale con 8 puntali per depositare 10 µ l dei pozzi in colonna 1 su un piatto LBA. Inoltre, individuare i pozzetti della colonna 2 sulla piastra di LBA.
- Continuare con il test come descritto di seguito nei passaggi 3.14-4.6.
- Determinare la diluizione di batteri che produce ~ 120 che CFU/posto nel controllo B, questa diluizione verrà utilizzato nell'analisi.
3. siero battericida Assay (SBA)
Nota: La procedura descritta di seguito è per una piastra di saggio, ma il numero di piastre di dosaggio può essere aumentato.
- Inattivare con il calore testare campioni di campioni di incubazione in bagnomaria a 56 ° C per 30 min.
Nota: Campioni di prova devono essere inattivati prima della prova di abrogare qualsiasi attività endogena del complemento. Questo può essere fatto prima il test e campioni inattivati possono essere ricongelati o conservati a 4 ° C fino a quando non testato. - Prendi un piatto di dosaggio e aggiungere 20 µ l di tampone di dosaggio per colonne da 1 a 12 di riga A attraverso G. aggiungere 20 µ l di tampone alle colonne 1 e 2 di fila H, Vedi tabella 1.
- Caricare 30 µ l di ogni campione, in duplice copia, alla riga H della piastra Assay. Per esempio, pipettare 30 µ l di campione 1 in pozzetti 3 H e 4 H e pipettare 30 µ l di campione 2 nei pozzetti 5 H e 6 H, ecc.
-
Eseguire 3 volte diluizioni dei campioni di prova usando una pipetta multicanale.
- Rimuovere 10 µ del campione da pozzi 3H - 12H e trasferimento a wells corrispondente nella riga G e mescolare il campione ben pipettando su e giù 8 - 10 volte.
- Quindi rimuovere 10 µ da pozzi 3G - 12G e trasferimento a wells corrispondente nella riga F e mescolare bene.
- Continuare queste diluizioni seriali attraverso riga A. Dopo aver miscelato i pozzi nella riga A, rimuovere e scartare 10 µ l da pozzi 3A-12A affinché tutti i pozzetti contengono 20 µ l.
Nota: Perché 20 µ l di siero viene utilizzato in un volume di dosaggio totale di 80 µ l, c'è una diluizione di ulteriore 4 volte nel dosaggio. Questa diluizione deve essere tenuta conto durante il calcolo di un titolo di SBA moltiplicando la diluizione del siero per 4. Ad esempio, se viene utilizzata una diluizione iniziale di 1:2, la diluizione effettiva in fase di test è 1:8.
- Rimuovere un flaconcino di azione di batteri Target congelate e scongelare a temperatura ambiente. Diluire i batteri in 20 mL di tampone del saggio secondo il fattore di diluizione ottimale pre-determinato (questo fattore di diluizione è stato determinato nella sezione 2.3). Aggiungere 10 µ l di batteri diluiti in ciascun pozzetto della piastra dosaggio usando una pipetta multicanale.
- Rimuovere un flaconcino di BRC congelati e un flaconcino di congelati inattivati BRC, scongelare a temperatura ambiente con acqua fredda corrente o collocare sulla griglia di una sicurezza biologica armadio con soffiando aria per scongelare rapidamente.
- Preparare una soluzione di 20% di BRC inattivati al calore. Mix 100 µ l del BRC inattivati con 400 µ l di tampone di dosaggio. Aggiungere 50 µ l di questa soluzione BRC inattivati 20% in tutti i pozzetti nella colonna 1 (controllo un pozzi).
Nota: Inattivati BRC è utilizzato come controllo per monitorare l'uccisione non specifici (NSK) nel dosaggio. - Preparare una soluzione di 20% di nativi BRC. Mescolare 1 mL di BRC nativo con 4 mL di tampone del saggio. Aggiungere 50 µ l di questa miscela in tutti i pozzetti nelle colonne 2 e 12 (pozzetti dei campioni prova e controllo B).
Nota: La concentrazione finale di BRC nella miscela di reazione è del 12,5%. - Brevemente mescolare Assay piastra agitando delicatamente per 10-15 s su un agitatore per piastre o pipettando su e giù per 8 volte usando una pipetta multicanale.
- Mettere la piastra di dosaggio in incubatore microbiologico di 37 ° C per 2 h (senza agitare).
- Secco 2 piastre di LBA rimozione di coperchi e inserendo piastre affrontano in sicurezza microbiologica per 40-60 min.
- Quando l'incubazione di 2h è completo, spostare il piatto di dosaggio bagnato ghiaccio e incubare per 10-20 min arrestare la reazione.
- Utilizzando una pipetta di 12 canali, mescolare i pozzi nella riga H e spot piastra 10 µ l della miscela di reazione sul fondo di un piatto LBA. Immediatamente la piastra di inclinazione e consentire le macchie eseguire per ~1.5-2 cm. Ripetere questa procedura per riga G, F ed E, spotting loro sopra la riga precedente sulla piastra LBA. Riga E, F, G e H sono macchiati su una piastra di LBA e riga A, B, C e D sono macchiati su una seconda piastra LBA nello stesso modo, Vedi Figura 1.
- Incubare le piastre LBA a temperatura ambiente fino a quando la soluzione è adsorbita nelle piastre LBA (10-15 min). Mettere i coperchi sulle piastre LBA e posizionare le piastre di LBA nell'incubatore microbiologico capovolto per incubare per una notte (~ 16-18 h). Incubare S. flexneri 2a e 3a a 29 ° C ed incubare Shigella sonnei è a 26 ° C.
Nota: Queste temperature resa più piccole "micro-colonie" con dimensioni adatte ad un conteggio preciso di un contatore di Colonia9. - Dopo l'incubazione overnight, aggiungere 25 mL di Agar Overlay (a ~ 55 ° C) contenente 100 µ g/mL TTC e 0,1% di NaN3 per ogni piatto LBA.
- Incubare le piastre LBA a 37 ° C per 2 h per consentire i batteri sopravvissuti sviluppare il colore rosso, Vedi Figura 1 qui sotto.
- Fotografare le piastre utilizzando una fotocamera digitale e trasferire immagini su un computer in cui è stato installato Software di enumerazione Colonia integrata del NIST (Nizza), Vedi Figura 2.
Nota: Software di conteggio di Colonia bello è disponibile senza alcun costo. Per dettagli e istruzioni di installazione, vedere Elenco dei materiali .
4. conteggio batterico colonie
- Software Open di Nizza e di input Nome operatore, esperimento informazioni e qualsiasi analisi di Note nei campi vuoti. Dopo aver inseriti questi dati, fare clic sul pulsante fatto .
- Importare piastre fotografati facendo clic sul pulsante Apri e selezionando i file corretti dal computer.
- Regolare i parametri di dosaggio impostando il numero di righe su 4 e il numero di colonne a 12. Regolare l'impostazione di sfondo a sigma-3 e la risoluzione a basso. Vedere la Figura 2.
- Spostare le regioni di interesse (ROI) facendo clic e trascinando affinché ogni ROI si trova direttamente sul posto di un campione. Garantire che tutte le colonie batteriche sono dentro il ROI con alcuna sovrapposizione tra campioni. Una volta completata una piastra, fare doppio clic la piastra successiva nell'elenco immagini memorizzati dati e regolare le ROIs. Vedere la Figura 2.
- Quando tutte le piastre sono state regolate, fare clic sul pulsante verde di conteggio , Vedi Figura 2 e figura 3. Quando il conteggio è finito fare clic sul pulsante Esporta per esportare i dati in formato.xls/.xlsx. Un nome e salvare il file di.xls/.xlsx per l'analisi dei dati.
- Organizzare dati esportati in un formato di tabella affinché i conteggi sono organizzati in una tabella che rappresenta la piastra 96 pozzetti di saggio, vedere tabella 2.
5. calcolare il titolo SBA (KI) e l'uccisione Non specifici (NSK)
Nota: Titolo di SBA, o indice di uccisione (KI) è definita come il reciproco della diluizione del siero che uccide il 50% dei batteri bersaglio.
- Calcolare il 50% uccidendo il valore di cutoff di indice (KI) in media il CFU dei pozzetti di controllo del complemento attivo (controllo B) e dividendo per 2. Calcolare la media CFU per ciascuna diluizione di ciascun campione che è stato eseguito in duplice copia, vedere la tabella 3.
- Perché una diluizione del siero raramente produrrà esattamente questo valore KI del 50%, esso può essere interpolato da due diluizioni di siero sequenziale, uno che uccide meno del 50% e uno che uccide più del 50%, Vedi Figura 4. La formula per calcolare il KI di SBA interpolata è illustrata di seguito:
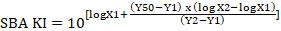
Nota: Il titolo battericida o KI, può anche essere calcolato automaticamente utilizzando Opsotiter software sviluppato da UAB. A richiesta Opsotiter, contattare Dr. Moon Nahm o Mr. Rob Burton. Vedere https://www.vaccine.uab.edu per informazioni di contatto. - Calcolare il valore NSK prendendo 1 meno della media di controllo B divisa per la media di controllo A.
Risultati
Una piastra a 96 pozzetti layout utilizzato in un dosaggio tipico è mostrato tabella 1. Questo layout ha i pozzetti di controllo del complemento attivo (controllo B), i pozzetti di controllo del complemento inattivati (controllo) e cinque campioni in duplicato. I campioni vengono diluiti in serie 3 volte fino la piastra da H riga per riga un permettendo per 8 diluizioni di ciascun campione da testare in una sola volta. La figura 1 Mostra due piastre di LBA dopo l'aggiunta di incubazione e sovrapposizione durante la notte. Lo sviluppo del colore ha avuto luogo e tutte le colonie sopravvissute sono visibili in rosso. Killing batterico è chiaramente visibile per tutti i campioni testati nelle prime tre diluizioni (righe F-H) e come campioni vengono diluiti ulteriormente il piatto, una diminuzione nell'uccisione batterica è visto dove il siero è meno concentrato. Interfaccia software bello può essere visto nella Figura 2. Conteggi di micro-Colonia dal software bello possono essere visto nella Figura 3, e questi conteggi sono stati organizzati in tabella 2. Il conteggio medio di CFU per ciascuna diluizione di ciascun campione viene calcolato e viene calcolato un valore KI di 50% nella tabella 3. Questo valore KI 50% può essere applicato per la media CFUs per ogni diluizione del siero per determinare i valori necessari per calcolare il KI di SBA secondo la formula descritta nella Figura 4. Il risultato finale del test è illustrato nella tabella 4.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| A | Controllo A | Controllo B | Diluizione 8 | Diluizione 8 | Diluizione 8 | Diluizione 8 | Diluizione 8 | Diluizione 8 | Diluizione 8 | Diluizione 8 | Diluizione 8 | Diluizione 8 |
| B | Controllo A | Controllo B | Diluizione 7 | Diluizione 7 | Diluizione 7 | Diluizione 7 | Diluizione 7 | Diluizione 7 | Diluizione 7 | Diluizione 7 | Diluizione 7 | Diluizione 7 |
| C | Controllo A | Controllo B | Diluizione 6 | Diluizione 6 | Diluizione 6 | Diluizione 6 | Diluizione 6 | Diluizione 6 | Diluizione 6 | Diluizione 6 | Diluizione 6 | Diluizione 6 |
| D | Controllo A | Controllo B | Diluizione 5 | Diluizione 5 | Diluizione 5 | Diluizione 5 | Diluizione 5 | Diluizione 5 | Diluizione 5 | Diluizione 5 | Diluizione 5 | Diluizione 5 |
| E | Controllo A | Controllo B | Diluizione 4 | Diluizione 4 | Diluizione 4 | Diluizione 4 | Diluizione 4 | Diluizione 4 | Diluizione 4 | Diluizione 4 | Diluizione 4 | Diluizione 4 |
| F | Controllo A | Controllo B | Diluizione 3 | Diluizione 3 | Diluizione 3 | Diluizione 3 | Diluizione 3 | Diluizione 3 | Diluizione 3 | Diluizione 3 | Diluizione 3 | Diluizione 3 |
| G | Controllo A | Controllo B | Diluizione 2 | Diluizione 2 | Diluizione 2 | Diluizione 2 | Diluizione 2 | Diluizione 2 | Diluizione 2 | Diluizione 2 | Diluizione 2 | Diluizione 2 |
| H | Controllo A | Controllo B | Diluizione 1 | Diluizione 1 | Diluizione 1 | Diluizione 1 | Diluizione 1 | Diluizione 1 | Diluizione 1 | Diluizione 1 | Diluizione 1 | Diluizione 1 |
| Campione 1 | Campione 2 | Campione 3 | Campione 4 | Campione 5 | ||||||||
Tabella 1: layout di piastra di analisi. Le colonne 1 e 2 contengono i pozzetti di controllo del complemento. Controllo un si trova nella colonna 1 ed è il calore-inattivati integrare controllo, contenente tampone SBA, batteri e complemento inattivati al calore. Controllo B si trova nella colonna 2 ed è attivo integrare controllo, contenente tampone SBA, batteri e complemento. 3-12 le colonne contengono campioni di siero. Ogni campione viene eseguito in duplicato e 3 volte in serie diluito dalla fila H alla riga A

Figura 1: piastre LBA dopo lo sviluppo del colore. Rappresentante S. flexneri 3a micro-colonie batteriche sono cresciuti durante la notte la dimensione desiderata. Agar di copertura è stato aggiunto e colonie hanno sviluppato un colore rosso da riduzione del composto TTC in agar di copertura. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: interfaccia del software del NIST enumeratore di Colonia integrata (NICE). Rappresentazione grafica dell'interfaccia software bello. Regioni di interesse (ROI) sono centrate sulle colonie per ogni spot prima del conteggio. I dati possono essere esportati direttamente dalla finestra del bella. Clicca qui per visualizzare una versione più grande di questa figura.
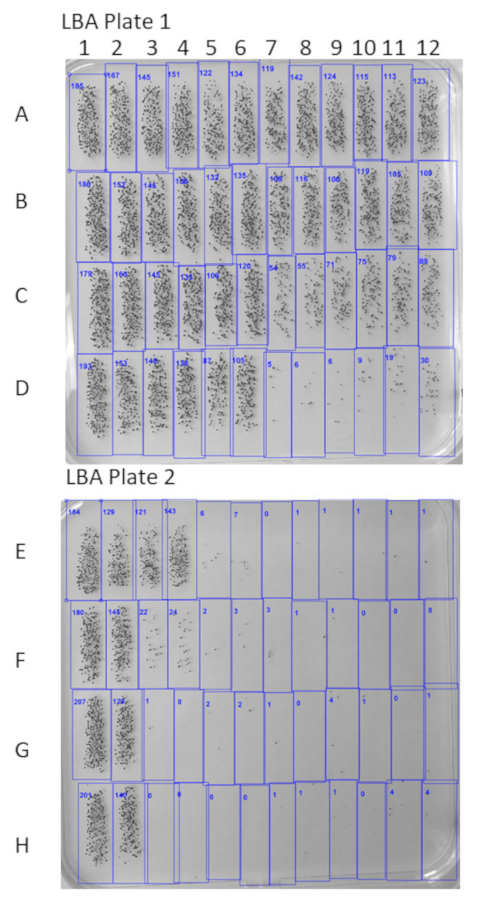
Figura 3: LBA piastre contate in Software bello. Le immagini di fotografia di colore sono caricate nel software bello e unità formanti colonie (CFU) sono contati automaticamente. Questa immagine mostra due piatti rappresentativi di LBA con loro informazioni sul conteggio di Colonia. Clicca qui per visualizzare una versione più grande di questa figura.
| 185 | 167 | 145 | 151 | 122 | 134 | 119 | 142 | 124 | 115 | 113 | 123 | 1:17496 | Diluizione 8 |
| 186 | 152 | 145 | 138 | 132 | 135 | 108 | 116 | 100 | 119 | 105 | 109 | 1:5832 | Diluizione 7 |
| 179 | 160 | 145 | 135 | 109 | 120 | 54 | 55 | 71 | 75 | 79 | 89 | 1:1944 | Diluizione 6 |
| 193 | 153 | 146 | 138 | 87 | 105 | 5 | 6 | 6 | 9 | 19 | 30 | 1:648 | Diluizione 5 |
| 184 | 129 | 121 | 143 | 6 | 7 | 0 | 1 | 1 | 1 | 1 | 1 | 1:216 | Diluizione 4 |
| 180 | 145 | 22 | 24 | 2 | 3 | 3 | 1 | 1 | 0 | 0 | 0 | 1: 72 | Diluizione 3 |
| 207 | 129 | 1 | 0 | 2 | 2 | 1 | 0 | 4 | 1 | 0 | 1 | 01:24 | Diluizione 2 |
| 201 | 140 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 4 | 4 | 1:8 | Diluizione 1 |
| Controllo A | Controllo B | Campione 1 | Campione 2 | Campione 3 | Campione 4 | Campione 5 | |||||||
Tabella 2: conta delle colonie batteriche. Conteggi CFU vengono esportati dal bel software in formato excel. Questi conteggi possono essere disposti in una tabella indicante che i contenuti batterici per tutti campioni duplicati e pozzetti di controllo.
| Controllo A | Controllo B | 148 | 128 | 131 | 120 | 118 | 1:17496 | Diluizione 8 |
| 189 | 147 | 142 | 134 | 112 | 110 | 107 | 1:5832 | Diluizione 7 |
| NSK (1-tfrk/CtrA): 22% | 140 | 115 | 55 | 73 | 84 | 1:1944 | Diluizione 6 | |
| 50% KI (TFRK/2): 73 | 142 | 96 | 6 | 8 | 25 | 1:648 | Diluizione 5 | |
| 132 | 7 | 1 | 1 | 1 | 1:216 | Diluizione 4 | ||
| 23 | 3 | 2 | 1 | 0 | 1: 72 | Diluizione 3 | ||
| 1 | 2 | 1 | 3 | 1 | 01:24 | Diluizione 2 | ||
| 0 | 0 | 1 | 1 | 4 | 1:8 | Diluizione 1 | ||
| Campione 1 | Campione 2 | Campione 3 | Campione 4 | Campione 5 | ||||
Tabella 3: calcolo del valore di cutoff di 50% KI e duplicati esempio medie. Il valore di cutoff KI 50% è stato calcolato considerando la media di tutti i pozzetti di controllo B e dividendo per 2. Medie dei duplicati sono state calcolate per ogni diluizione di ciascun campione che è stato eseguito in duplice copia. Inoltre viene calcolato il valore NSK.

Figura 4: schema di interpolazione lineare. Il numero di batteri sopravvissuti (asse y) ad ogni diluizione del siero è testata (asse x) tracciati (diamanti neri), e singoli punti sono collegati dalla sottile linea nera tratteggiata. Le linee orizzontali continue e tratteggiate indicano 0% e 50% uccidere, rispettivamente. Le diluizioni di siero sopra (diluizione 5) e sotto (diluizione 4) il 50% uccidendo linea sono collegato da una linea rossa, e titolo battericida (KI) è indicato. Clicca qui per visualizzare una versione più grande di questa figura.
| SBA KI | |
| Campione 1 | 72 |
| Campione 2 | 216 |
| Campione 3 | 1994 |
| Campione 4 | 1994 |
| Campione 5 | 648 |
Tabella 4: risultati SBA visualizzando titolo battericida (KI). Valori di KI SBA finali sono stati determinati per ciascun campione e sono mostrati. Questi valori sono calcolati utilizzando il CFUs medio, il valore massimo di 50% KI e la formula di interpolazione lineare.
Discussione
Il protocollo descritto qui di seguito viene illustrato un'analisi funzionale immune per valutare l'attività di shigellacidal di anticorpi nel siero. Nel dosaggio ha dimostrato per questo protocollo gli anticorpi monoclonali specifici per S. flexneri 3a erano usate9 insieme a sieri di controllo umano da un precedente vaccino di Shigella Studio11. L'origine del siero testato in questo test può variare ampiamente da campioni di animali pre-clinici per campioni clinici umani, e l'attività di shigellacidal nel campione di siero sarà colpito da vaccinazioni e le esposizioni che l'individuo ha sperimentato. Alcune cross-reattività può essere previsto tra sierotipi strettamente correlati, in particolare S. flexneri 2a e 3a S. flexneri ma poca reattività crociata è stato visto in questi ceppi in confronto di sonnei dello s.9. La base dello SBA si concentra sull'attivazione della cascata del complemento legandosi dell'anticorpo-antigene. Di conseguenza, la gestione del reagente BRC è uno dei molti passaggi critici coinvolti nell'esecuzione del presente protocollo. BRC è stato selezionato per l'uso con questo test a causa delle sue prestazioni costanti e bassi livelli di NSK in altri saggi battericida12,13,14. L'attività di BRC è sensibile alla temperatura e misure adeguate per garantire che congelare disgelo cicli sono ridotti al minimo, che il BRC è aliquotato in volumi di uso singolo, e che le aliquote BRC sono scongelate rapidamente, immediatamente prima dell'uso nell'analisi. La coerenza delle attività di complemento avrà un impatto la riproducibilità di questo test. Un altro passaggio fondamentale che impatto riproducibilità del è la produzione e la diluizione delle scorte batteriche. È importante che prima di iniziare il dosaggio la diluizione appropriata delle scorte batteriche è determinata, come successo di dosaggio è a seconda della produzione coerenza dei controlli A e B avendo CFU conta media ~ 120 CFU per spot. Al fine di ottenere i punti che sono numerabili dal software, è anche indispensabile che la tecnica utilizzata per batteri piastra viene eseguita correttamente. La deposizione di soluzione batterica e inclinazione della piastra in modo che macchie eseguire ~ 2-3 cm è fondamentale per la produzione di colonie della distribuzione in dimensioni e corretta per un conteggio accurato dal software bello. Mastering di tutti questi passaggi farà in modo che risultati accurati e coerenti sono prodotte da questo protocollo
Anche quando vengono eseguite tutte le fasi critiche ben possono esserci casi in cui è necessario modificare o risolvere il presente protocollo. Le modifiche di questo protocollo per valutare altri batteri possono richiedere ottimizzazione della temperatura di incubazione di piastra con i LBA durante la notte, per garantire la formazione di micro-colonie. Altri ceppi di batteri o anticorpo fonti, diversi dal siero, possono richiedere ottimizzazione della concentrazione di complemento. Valori NSK e KIs di sieri di controllo devono essere monitorati anche per garantire che il test funziona in modo appropriato. NSK non dovrebbe salire oltre il 70%. Il KI del controllo sieri non dovrebbero variare più di dire ± 2SD. Per ottenere risultati coerenti e di successo quando si utilizza questo protocollo, sarà necessario eseguire tutti i passaggi come descritto qui con particolare attenzione ai passaggi critici evidenziati sopra.
Mentre questo protocollo si riempie un bisogno importante nella comunità di ricerca Shigella , non è priva di limiti. Questo protocollo si basa sul materiale biologico e, pertanto, sarà sempre certa variabilità che è difficile da controllare. Variazioni nell'attività di complemento da lotti differenti e fonti possono contribuire alla variabilità nelle analisi. Per ovviare a questo inconveniente, è importante gestire in modo appropriato complemento e testare nuovi lotti di complemento per l'attività prima dell'acquisto. Può anche essere utile creare pool di lotti di complemento con attività conosciuta per avere un approvvigionamento omogeneo. Questo protocollo è semplice da design e non richiede attrezzature specializzate e la Colonia automatizzata l'enumerazione di software è liberamente disponibile. Mentre questa semplicità è un vantaggio, consentendo questo protocollo essere utilizzato in qualsiasi laboratorio, ancora richiede un'incubazione overnight. Saggi di recente sono state descritte che sono molto più breve requisito di incubazione, ma richiedono reagenti specializzati, preparatori15. Un'altra limitazione di questo test è che nella sua forma attuale è solo in grado di indagare su una singola specie batterica in una sola volta. Nel campo di Shigella c'è un desiderio di creare un vaccino multivalente e avere saggi immunologici che possono valutare gli agenti patogeni in modo multiplex è di grande valore. Questo test potrebbe essere modificato in futuro per soddisfare questa esigenza, ma nella sua forma attuale, è un'analisi di singolo-plex.
Mentre questo saggio presenta alcune limitazioni, ha ancora molti vantaggi rispetto ai metodi alternativi o esistenti. Tali vantaggi includono molti miglioramenti che si combinano per rendere l'esecuzione di questo metodo, molto meno laborioso e più high-throughput rispetto tradizionale SBAs. L'uso delle scorte batteriche congelate, un formato di test di piastra a 96 pozzetti, la placcatura sulla più grande piazza di Petri, la colorazione delle colonie che permette di fotografare e Colonia-conteggio automatico, tutti contribuiscono a ridurre i materiali e il tempo necessario per completare questo test. Questa analisi ha anche vantaggi rispetto ad altri metodi di alto-rendimento perché non richiede eventuali reagenti specializzati o attrezzature. Il protocollo descritto può essere eseguito con i reagenti di base e software liberamente disponibile, che consente per la sua applicazione in qualsiasi ambiente di laboratorio.
Tutti i vantaggi di questo protocollo fornisce supporta il suo utilizzo in molti le indagini future. Il dosaggio è ideale per l'esame della risposta immunitaria dopo la vaccinazione o infezione naturale. Questa applicazione consente la SBA essere uno strumento prezioso nella ricerca sui vaccini Shigella ed è già stata utilizzata per valutare l'immunogenicità del vaccino in Shigella bio-coniugato vaccini dove ha dimostrato la capacità di questi vaccini per indurre la produzione di anticorpi funzionali16. Questo protocollo è stato ampiamente testato da laboratori multipli e ha dimostrato di produrre risultati affidabili e riproducibili9. Questo protocollo produce anche risultati comparabili quando gli stessi campioni vengono testati utilizzando altri saggi battericida17. La consistenza dei dati generati da questo test, e la compatibilità con altri più vecchi metodi rende uno strumento robusto per valutare con precisione l'attività battericida in campioni di siero. Il dosaggio può essere anche facilmente adattato per valutare ulteriori campioni diversi. Mentre nel siero è prontamente disponibile in test clinici adulto, può essere difficile da ottenere sufficiente del siero in sperimentazioni su neonati e bambini piccoli; uno dei destinatari eventuali per i vaccini di Shigella . In questi studi, sangue intero è ordinariamente raccolti su carta da filtro e secchi. C'è stato qualche successo preliminare con questo tipo di formato di esempio utilizzando la SBA. Oltre al sangue intero, campioni di mucosa (come saliva, estratti fecali e urina) sono anche una destinazione che è rilevante nella ricerca sui vaccini Shigella . Attualmente, questo protocollo è stato valutato per tre dei sierotipi più clinicamente rilevanti di Shigella , ma può anche essere adattato per ulteriori Shigella spp., così come altri batteri patogeni. Lavoro futuro si concentrerà sulla produzione di un'analisi multiplex con molte delle stesse caratteristiche come il dosaggio descritto dal presente protocollo. Un'analisi multiplex vi permetterà per la valutazione dei sierotipi di Shigella multipli simultaneamente, conservando ulteriori volumi di campione e mani su tempo di dosaggio. C'è anche lavori in corso per trasferire questo test di laboratori in tutto il mondo. Queste valutazioni globali genererà ulteriori dati verso la qualificazione il dosaggio su scala più ampia di ricerca, mentre allo stesso tempo aumentando il numero di laboratori di microbiologia e immunologia che hanno accesso a questo SBA per valutare i batteri e siero campioni raccolti da diverse località endemica. Il metodo descritto qui è semplice e ad alta velocità ed ha la capacità di migliorare la valutazione immunologica in campo di Shigella , così come le applicazioni più ampie alla valutazione di altri batteri patogeni.
Divulgazioni
R.W.K è un dipendente del governo americano e come tale le opinioni espresse in questa pubblicazione sono quelle degli autori e non riflettono necessariamente la politica ufficiale o posizione del dipartimento dell'esercito, reparto di difesa, né il governo degli Stati Uniti.
Riconoscimenti
Quest'opera è stata finanziata da una sovvenzione dal percorso per M.H.N. Questo studio è stato condotto come una cooperativa di ricerca e sviluppo accordo tra il Walter Reed Army Institute of Research e l'Università di Alabama a Birmingham.
Materiali
| Name | Company | Catalog Number | Comments |
| Gelatin | Sigma | G9391 | Type B, powder, BioReagent, suitable for cell culture |
| TTC (2,3,5-Triphenyltetrazolium chloride) | Sigma | T8877 | ≥98.0% (HPLC) |
| Sodium azide (NaN3) | Sigma | S2002 | ≥99.5% |
| Baby Rabbit Complement | PelFreez | 31061-3 | 3-4 week old |
| HBSS with Ca2+/Mg2+ | Invitrogen | 14065-56 | Without Phenol Red |
| LB Agar (Lennox) | Sigma | L2897 | Powder microbial growth medium |
| Bacto Agar | BD | 214010 | Powdered, (C12H18O9)n |
| Glycerol | Sigma | G5516 | For molecular biology, ≥99% |
| LB Broth (Lennox) | Sigma | L3022 | Powder microbial growth medium |
| Square Petri Dish | Sigma | Z617679-240EA | 120 mm x 120 mm |
| Assay Plate | Costar | 3799 | 96 well u-bottom plate with lid |
| NICE Software | University of Alabama at Birmingham | ftp://ftp.nist.gov/pub/physics/mlclarke/NICE/ |
Riferimenti
- Riddle, M. S., Sanders, J. W., Putnam, S. D., Tribble, D. R. Incidence, etiology, and impact of diarrhea among long-term travelers (US military and similar populations): a systematic review. The American Journal of Tropical Medicine and Hygiene. 74 (5), 891-900 (2006).
- Tickell, K. D., et al. Identification and management of Shigella infection in children with diarrhoea: a systematic review and meta-analysis. The Lancet Global Health. 5 (12), e1235-e1248 (2017).
- Livio, S., et al. Shigella isolates from the global enteric multicenter study inform vaccine development. Clinical Infectious Diseases. 59 (7), 933-941 (2014).
- Barry, E. M., et al. Progress and pitfalls in Shigella vaccine research. Nature Reviews Gastroenterology & Hepatology. 10 (4), 245-255 (2013).
- Noriega, F. R., et al. Strategy for cross-protection among Shigella flexneri serotypes. Infection and Immunity. 67 (2), 782-788 (1999).
- Levine, M. M., Kotloff, K. L., Barry, E. M., Pasetti, M. F., Sztein, M. B. Clinical trials of Shigella vaccines: two steps forward and one step back on a long, hard road. Nature Reviews Microbiology. 5 (7), 540-553 (2007).
- Sayem, M. A., et al. Differential host immune responses to epidemic and endemic strains of Shigella dysenteriae type I. Journal of Health Population and Nutrition. 29 (5), 429-437 (2011).
- Rahman, M. J., et al. Effects of zinc supplementation as adjunct therapy on the systemic immune responses in shigellosis. The American Journal of Clinical Nutrition. 81 (2), 495-502 (2005).
- Nahm, M. H., et al. interlaboratory evaluations, and application of a simple, high-throughput Shigella serum bactericidal assay. mSphere. 3 (3), (2018).
- Burton, R. L., Nahm, M. H. Development and validation of a fourfold multiplexed opsonization assay (MOPA4) for pneumococcal antibodies. Clinical and Vaccine Immunology. 13 (9), 1004-1009 (2006).
- Tribble, D., et al. Safety and immunogenicity of a Shigella flexneri 2a Invaplex 50 intranasal vaccine in adult volunteers. Vaccine. 28 (37), 6076-6085 (2010).
- Kim, H. W., Kim, K. H., Kim, J., Nahm, M. H. A high throughput serum bactericidal assay for antibodies to Haemophilus influenzae type b. BMC Infectious Diseases. 16, 473(2016).
- Maslanka, S. E., et al. Standardization and a multilaboratory comparison of Neisseria meningitidis serogroup A and C serum bactericidal assays. The Multilaboratory Study Group. Clinical Diagnostic Laboratory Immunology. 4 (2), 156-167 (1997).
- Jang, M. S., Sahastrabuddhe, S., Yun, C. H., Han, S. H., Yang, J. S. Serum bactericidal assay for the evaluation of typhoid vaccine using a semi-automated colony-counting method. Microbial Pathogeneis. 97, 19-26 (2016).
- Necchi, F., Saul, A., Rondini, S. Development of a high-throughput method to evaluate serum bactericidal activity using bacterial ATP measurement as survival readout. PLoS One. 12 (2), e0172163(2017).
- Riddle, M. S., et al. Safety and immunogenicity of a candidate bioconjugate vaccine against Shigella flexneri 2a administered to healthy adults: a single blind, randomized phase I study. Clinical and Vaccine Immunology. , (2016).
- Shimanovich, A. A., et al. Functional and Antigen-Specific Serum Antibody Levels as Correlates of Protection against Shigellosis in a Controlled Human Challenge Study. Clinical and Vaccine Immunology. 24 (2), (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon