Method Article
Fornitura di payload predicting In Vivo utilizzando una tumore-barriera emato-encefalica in un piatto
In questo articolo
Riepilogo
Drug targeting per tumori del sistema nervoso centrale è una sfida importante. Qui descriviamo un protocollo per produrre un mimo in vitro del tumore-barriera emato-encefalica utilizzando cellule murine e/o umane e discutere la loro rilevanza per la prevedibilità del sistema nervoso centrale targeting tumorale in vivo.
Abstract
Altamente selettivo per natura, emato - encefalica (BBB) è essenziale per l'omeostasi del cervello in condizioni fisiologiche. Tuttavia, nell'ambito dei tumori cerebrali, la selettività molecolare di BBB protegge anche le cellule neoplastici bloccando la consegna di chemioterapie marginalmente amministrate. Lo sviluppo di nuovi farmaci (tra cui nanoparticelle) targeting per i tumori cerebrali maligni idealmente richiede l'utilizzo di modelli animali preclinici per studiare transcitosi efficacia antitumorale e della droga. Al fine di rispettare il principio di 3R (perfezionare, ridurre e sostituire) per ridurre il numero degli animali da laboratorio nella messa a punto sperimentale ed eseguire lo screening ad alta resa di una vasta libreria di agenti antitumorali, abbiamo sviluppato un essere umano in vitro riproducibile e mimic murino di tumore-barriera emato-encefalica (YHBHU) utilizzando colture a tre strati di cellule endoteliali, astrociti e sfere di glioblastoma paziente-derivato. Per una maggiore scalabilità e riproducibilità, linee cellulari commerciali o cellule immortalizzate sono state utilizzate in condizioni su misura per permettere la formazione di una barriera simile a BBB effettivo. Qui descriviamo un protocollo per ottenere un mimo di YHBHU coltivando le cellule endoteliali a contatto con gli astrociti a densità di cella specifica sugli inserti. La mimica di YHBHU può essere utilizzato, ad esempio, per la quantificazione e la formazione immagine confocal di passaggio delle nanoparticelle attraverso le barriere endoteliali e astrocytic, oltre alla valutazione di targeting delle cellule del tumore all'interno della stessa analisi. Inoltre, mostriamo i dati ottenuti possono essere utilizzati per prevedere il comportamento delle nanoparticelle nei modelli animali preclinici. In una prospettiva più ampia, questo modello in vitro potrebbe essere adattato ad altre malattie neurodegenerative per la determinazione del passaggio di nuove molecole terapeutiche attraverso la BBB e/o essere integrato con cervello organoids per valutare direttamente l'efficacia di farmaci.
Introduzione
L'unità neurovascolare è composto da neuroni, astrociti e la BBB, formata da complesse connessioni tra periciti, astrociti, cellule endoteliali e la membrana basale associata formando il cervello microvasculature1. Questa stretta parete cellulare formata da continui, fenestrati vasi finemente regola il movimento di ioni e molecole (compresi gli ormoni, le sostanze nutrienti o farmaci), ma anche di fare circolare le cellule1. La transcitosi considerevolmente bassa attraverso la BBB di molecole ad alto peso molecolare, quali gli anticorpi terapeutici, i coniugati di droga o nanocompounds, limitano drasticamente i progressi nella scoperta di farmaci per le malattie neurologiche, tra cui maligno gliomi2. Infatti, per via orale o per via endovenosa consegnate chemioterapie raggiungono il parenchima cerebrale spesso alle concentrazioni sufficientemente basse per indurre un effetto antitumorale o sono semplicemente in grado di attraversare la YHBHU per raggiungere le cellule neoplastiche3. Parecchi studi preclinici e clinici non hanno affrontato il problema della penetrazione di YHBHU ma hanno tentato di perturbare la YHBHU transitoriamente, ad esempio utilizzando gli ultrasuoni focalizzati4,5, o per aggirarlo direttamente in situ consegna di farmaci6. Tuttavia, nessuna di queste tecniche sono state in grado di contrastare l'espansione di inevitabile del tumore o di ricaduta. Pertanto, durante lo sviluppo di nuove terapie antiglioma, la diffusione attraverso il YHBHU dovrebbe essere considerata come uno degli aspetti critici per il successo della fornitura di agenti terapeutici7.
A causa della natura complessa delle interazioni delle cellule all'interno del YHBHU, studi in vivo su animali da laboratorio sembrano essere la scelta più ovvia quando si studia il passaggio delle molecole dal sangue al cervello. Tuttavia, metodi in vivo su larga scala sono relativamente complesse da stabilire e, pertanto, non consentono la proiezione di alto-rendimento delle molecole in un tempo ragionevole ad un costo ragionevole. Ancora più importante, la sperimentazione animale deve seguire le linee guida etiche di 3R definita come rifinire i), ii) ridurre e, di rilevanza per il contesto corrente, iii) sostituire con protocolli alternativi (ad es., in vitro/in silico metodi). Di conseguenza, ricreando il YHBHU in vitro appare come una possibilità interessante e attraente, ma costituisce anche un compito complesso sfidato da varie limitazioni. Molti tentativi di ricreare questo complesso comparto con cellule in coltura primaria o linee cellulari da canino, porcina, origine murina e anche umano sono stati pubblicati (come Recensito da Rodriguez et al.8 e Helms et al.9). Questi modelli includono tridimensionale microfluidici sistemi10, BBB-on-a-chip11,12, e una moltitudine di varianti basate sulle co-colture del classiche in inserti sistemi. Tuttavia, sistemi microfluidici e chip attuali o non sono adatti per rapid, high throughput droga-convalida studi13,14 o sono attualmente incompatibile con gli studi di drug delivery ai tumori cerebrali. Inoltre, la revisione di 155 modelli pubblicati utilizzando cellule primarie, inducibile staminali pluripotenti (iPSC) o linee cellulari commerciali co-coltivate su tutti gli inserti ha mostrato una tendenza per interstudy discrepanza nelle loro misure e/o conclusioni8. Questa mancanza di riproducibilità interlaboratorio potrebbe essere correlata con le condizioni di coltura i) nonnormalized, per esempio con il rivestimento opzionale con proteine della matrice della membrana dello scantinato nel recipiente della cella cultura, ii) un numero aumentato di sottocultura e utilizzo di siero contenente media, entrambi i piloti principali delle modificazioni genetiche e fenotipiche delle cellule linee15, o iii) la difficoltà di riproducibile ricreare il giusto equilibrio fra il astroglial e componenti endoteliali in un piatto. Sebbene l'uso di cellule immortalizzate o cella commerciale linee per stabilire un modello in vitro di BBB manca di alcune delle proprietà rispetto a modelli simili che utilizzano solo le cellule primarie, nel metodo descritto ci mostra che la giusta combinazione di cellule mostre un molto prestazioni paragonabili a studi pubblicati in altri modelli di riferimento16,17. Alla fine, la mancanza di un modello affidabile e riproducibile per studiare il passaggio dei composti terapeutici targeting per tumori cerebrali attraverso la YHBHU ci ha motivato a sviluppare i metodi descritti qui.
Poiché l'obiettivo era quello di utilizzare il modello per prevedere la somministrazione in vivo di nanoparticelle in modelli animali preclinici, abbiamo prima validato il modello di YHBHU utilizzando inserti contenenti cellule murine endoteliale a contatto con gli astrociti murini. Oltre a questo, abbiamo ottimizzato anche il modello per l'utilizzo di alcune linee cellulari umane. Una volta stabilizzato, le barriere di cella vengono trasferite alle culture con sfere di glioblastoma paziente-derivati o linee cellulari di glioma commerciale. Da allora in poi, la transcitosi di nanoparticelle e targeting di cellula tumorale possono essere visualizzate da microscopia confocal e quantificato attraverso la raccolta di campioni nel corso del tempo. D'importanza, risultati ottenuti utilizzando i mimic di YHBHU potrebbero prevedere in modo affidabile il comportamento delle nanoparticelle in vivo, sostiene l'uso del Priore mimico YHBHU la validazione preclinica.
Protocollo
Esperimenti sugli animali sono stati approvati dal Comitato per gli esperimenti animali del distretto della Finlandia meridionale (ESAVI/6285/04.10.07/2014).
1. istituzione dei Mimic di YHBHU
Nota: Supplementi e terreno di coltura cellulare sono dettagliati nella tabella dei materiali.
- Preparazione degli astrociti
Nota: I seguenti volumi sono adatti per una capsula di Petri 10cm o un matraccio di cultura cellulare T75.- Sotto una cappa di cultura di cellule sterili, lavare accuratamente gli astrociti coltivati con 5 mL di soluzione fisiologica sterile di tampone fosfato (PBS). Delicatamente scartare il PBS utilizzando una pompa a vuoto e aggiungere 2 mL di reagente di dissociazione la cella per 5 min (a 37 °C, vedere la Tabella materiali) per staccare le cellule. Controllare il distacco delle cellule sotto il microscopio. Non superare i 5 minuti di incubazione per limitare lo sforzo sulle cellule.
- Aggiungere 10 mL di terreno di coltura sterile completo Astrocita cellulare (ABM +) alla nave per inibire l'attività del reagente di dissociazione delle cellule. Utilizzare una pipetta sterile sierologica per trasferire le cellule indipendente dalla nave in una provetta sterile 15 mL. Centrifugare la sospensione cellulare per 3 min a 250 rcf (accelerazione: 9 rcf/s, decelerazione: 5 rcf/s) a temperatura ambiente (TA).
- Nel frattempo, preparare gli inserti (Vedi la Tabella materiali): utilizzando pinze sterili, collocare gli inserti dal lato del cervello (Figura 1A) sul coperchio di una piastra a 6 pozzetti sterile (Figura 1B). Verificare in anticipo che la piastra può essere posizionata capovolto sugli inserti senza toccare o muovere gli inserti durante il processo.
Nota: Il corretto posizionamento degli inserti permette l'allettamento della sospensione Astrocita-tra la membrana e il fondo del pozzo. - Una volta centrifugato, attentamente scartare il surnatante da sospensione delle cellule; Risospendere il pellet di astrociti in 1 mL di ABM + da delicatamente risospendere il pellet sul tubo's parete fino a 5x. Evitare di pipettaggio eccessiva delle cellule per limitare lo sforzo sulle cellule. Contare le celle e regolare la densità della sospensione di cellule a 1,5 x 105 celle in 400 µ l di ABM + inserire.
- Posizionare la sospensione di eritrociti al centro del cervello-lato dell'inserto'membrana s (Figura 1B) e, con molta attenzione, si è diffuso tramite forza capillare con una punta di pipetta sterilizzata. Evitare il contatto diretto come la membrana è particolarmente fragile.
- Con il lato del cervello degli inserti è ancora up, posizionare la piastra a 6 pozzetti indietro sugli inserti. Questo assicura che la sospensione cellulare è intrappolata tra la membrana e il fondo effettivo del pozzo (Figura 1). Evitare le bolle d'aria in sospensione delle cellule, come impedirà la diffusione omogenea dei astrocytes sulla membrana.
- Posizionare la piastra e inserti, con il lato di cervello fino, nell'incubatore (a 37 °C con 5% CO2) per consentire l'adesione delle cellule per un minimo di 2 h (murini immortalizzati astrociti) e fino a 6 h (astrociti primari umani).
Nota: Come gli inserti sono mantenuti upside-down, visualizzazione dell'adesione delle cellule non è possibile sotto un microscopio. Si raccomanda, pertanto, di un vaso di cultura separata delle cellule regolari del seme e controllare l'adesione delle cellule nel vaso nel corso del tempo. La manipolazione attenta della membrana è un must, come i risultati saranno inaffidabili quando le membrane sono danneggiate. - Alla fine del tempo di incubazione, verificare l'assenza di perdite di sospensione cellulare fuori della zona di semina e scartare gli inserti se essi sono incapaci di ritenere. Ripristinare la piastra 6 pozzetti per sua posizione regolare, con inserti che ora avrà il lato di sangue alto (Figura 1A). Aggiungere mL 2,6 di ABM + ad ogni pozzetto. Versare 2,5 mL di terreno completo Astrocita in ogni inserto e posizionare la piastra nell'incubatore (a 37 °C con 5% CO2).
- Preparazione delle cellule endoteliali
Nota: Per il cervello murino cellule endoteliali microvascolari (bEND3), le cellule devono raggiungere la confluenza di 100% per garantire massima cellula-cellula contatti innescando l'espressione della proteina di giunzione stretta ottimale il giorno dell'esperimento. Questo non si applica per le cellule endoteliali di vena ombelicale umana (HuAR2T) come la presenza degli astrociti è richiesta per un'espressione di proteina di giunzione stretta per queste cellule.- Procedere come descritto in precedenza per gli astrociti (punti 1.1.1 e 1.1.2.). Una volta centrifugato, attentamente scartare il surnatante; Risospendere il pellet di cellule endoteliali in 1 mL di terreno di coltura delle cellule endoteliali completa (EBM +) pipettando lentamente la sospensione cellulare sul tubo's parete fino a 5x. Evitare di pipettaggio eccessiva delle cellule per limitare lo sforzo sulle cellule. Contare le celle e regolare la densità della sospensione di cella a 2 x 105 celle in 2,5 mL/inserire delle cellule endoteliali del terreno di coltura privo di siero (EBM-) e fattore di crescita endoteliale vascolare-A (VEGF-A).
- Estrarre la piastra che contiene gli inserti, attentamente eliminare il terreno dal lato sangue e sostituirlo con 2,5 mL di sospensione delle cellule endoteliali. Riporre la piastra nell'incubatore (a 37 °C con 5% CO2) e lasciarlo tutta la notte per le cellule endoteliali di aderire alla membrana.
- Il giorno successivo, preparare una piastra a 6 pozzetti sterile trasferendo 3 mL di terreno preriscaldati Astrocita privo di siero (ABM-) in ciascun pozzetto. Gestendo gli inserti con pinze sterili, attentamente scartare la sostanza completa endoteliale dal lato sangue, collocare l'inserto nella nuova piastra contenente ABM- e aggiungere 2,5 mL di EBM-.
Nota: L'uso di EBM - è fondamentale per l'istituzione della barriera endoteliale (fare riferimento alla sezione di discussione). - Lasciare gli inserti nell'incubatrice (a 37 °C con 5% CO2) con minimo disturbo fisico e variazioni di temperatura per 5 giorni, consentendo la produzione della membrana dello scantinato endoteliale, Astrocita contatti con le cellule endoteliali e alla fine, la formazione di mimica di YHBHU. Sostituire il mezzo il giorno del transfer su colture di cellule di glioma (fare riferimento alla sezione 1.4).
- Misura della permeabilità mimica YHBHU (opzionale)
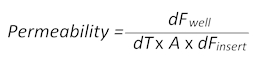
- Diffusione passiva del sodio la tintura fluorescente di piccolo peso molecolare-fluoresceina (Na-Fl) nel corso del tempo dal sangue al lato del cervello degli inserti permette il calcolo dei valori di permeabilità secondo la seguente formula:
Qui, dFbeneè il valore di fluorescenza misurato nel pozzo ad un certo punto di tempo meno il valore di autofluorescenza del terreno di coltura cellulare, dT è il tempo in secondi, A è la superficie della barriera in centimetri quadrati e dFinserire è il valore di fluorescenza misurato nell'inserto allo stesso tempo punto meno il valore medio di autofluorescenza). - Raccogliere 100 µ l del mezzo da entrambi i lati del cervello del mimic di YHBHU e il sangue e ognuno di loro trasferimento in una piastra a 96 pozzetti a fondo piatto, nera separata per misure di fluorescenza successive. Utilizzare i media piano come il vuoto per correggere l'autofluorescenza.
- Preparare 2,5 mL per pozzetto della Na-Fl (50 µM) in EBM-. Preriscaldare la soluzione di Na-Fl a 37 ° C. Sostituire il supporto dal lato sangue degli inserti con i supporti contenenti Na-FL. avviare un timer, non appena il mezzo viene sostituito.
- Raccogliere con cura i 100 µ l di media da sia il sangue e il lato del cervello degli inserti a 5, 30, 60 e 120 min. trasferire ciascun campione per separare i pozzetti della piastra 96 pozzetti nero.
- Di conseguenza, sostituire i mezzi raccolti dagli inserti per mantenere il bilanciamento del volume tra entrambi i lati. Posizionare gli inserti indietro nell'incubatore tra ogni raccolta del campione per ridurre al minimo le variazioni di temperatura.
- Quantificare la fluorescenza da campioni raccolti, utilizzando un lettore di piastra con il filtro impostato su 480/560 nm (eccitazione e emissione, rispettivamente).
Nota: Fluorescenza dal lato del cervello è quasi inosservabile al punto di tempo di 5 min. Valori elevati rispetto al vuoto indica una perdita di / danni all'inserto's membrana o la barriera; di conseguenza, di escluderle da ulteriori analisi. Valori di permeabilità Na-Fl previsti per il YHBHU dovrebbero essere al 10-5 alla gamma di 10-6 cm/s (tabella 1).
- Diffusione passiva del sodio la tintura fluorescente di piccolo peso molecolare-fluoresceina (Na-Fl) nel corso del tempo dal sangue al lato del cervello degli inserti permette il calcolo dei valori di permeabilità secondo la seguente formula:
- Preparazione delle cellule del glioma
Nota: Anche se qui sono usate delle sfere di glioblastoma paziente-derivato, il seguente protocollo può essere facilmente adattato per le cellule di glioblastoma aderente, commercialmente disponibili come U - 87 MG.- Facoltativamente, per l'imaging di immunofluorescenza, posizionare fino a quattro lamelle di borosilicato sterile tondo (ø 0,9 cm) per pozzetto di una piastra a 6 pozzetti contenenti 2 mL di poli-D-lisina (0,01%). Incubare a temperatura ambiente per 30 min.
- Nel frattempo, trasferire con cautela le sfere del tumore dalla nave di cultura delle cellule in una provetta sterile 15 mL utilizzando una pipetta sterile da sierologica. Centrifugare le sfere di tumore per 3 min a 250 rcf.
- Scartare il surnatante, risospendere le sfere in 1 mL di privo di bFGF e EGF (GBM) glioma delle cellule medio-delicatamente e contare le celle. Regolare la densità delle cellule a circa 104 sfere/mL (105 cellule/mL) in GBM-.
- Scartare il poli-D-lisina dai pozzetti e sciacquarli 3 volte con PBS sterile. La piastra con 3 mL/bene della sospensione sferoide tumore di semi e trasferire gli inserti con il mimic BBB sulla sospensione delle cellule del tumore.
- Incubare per una notte (a 37 °C con 5% CO2) per consentire di equilibrio tra il sangue e il cervello i lati del tumore del dosaggio. Il giorno successivo, è necessario sostituire il supporto sul lato di sangue con EBM-completati con le molecole/droghe/nanoparticelle di interesse. I campioni sono raccolti nel corso del tempo per quantificazione diretta come descritto nella sezione precedente. Le celle sono fisse in un punto di tempo preciso per l'imaging di fluorescenza (fare riferimento alle sezioni 2.1 e 2.2).
2. alta risoluzione Imaging confocale della YHBHU
Nota: 4% paraformaldeide (PFA, pH 7.4, 6 mL per replica di YHBHU) è sempre preparati freschi in PBS. Tenerlo su ghiaccio.
Attenzione: PFA è cancerogeno. Utilizzare guanti in nitrile per maneggiare PFA e preparare la soluzione sotto una cappa chimica.
-
Espressione endoteliale di YHBHU delle proteine di giunzione stretta
- Risciacquare entrambi i lati della membrana con PBS ghiacciata (3x per 5 min, 2,5 mL/inserire, 3ml/bene). Scartare il PBS e aggiungere 3 mL e 2,5 mL di ghiacciata 4% PFA nel pozzo e nell'inserto, rispettivamente. Incubare in ghiaccio per 10 min. scartare il PFA (secondo l'istituzione'smaltimento chimici pericolosi s) e lavare 3 volte con PBS a TA (2,5 mL/insert, 3 mL/pozzetto).
Nota: Una volta fissata, campioni possono essere conservati in PBS (2,5 mL/insert, 3 mL/pozzetto) a 4 °C per una settimana. - Utilizzare un cotton fioc per pulire il lato del cervello dell'inserto e rimuovere gli astrociti. Utilizzando un bisturi affilato, tagliare con cura la membrana in quattro parti uguali facendo due tagli perpendicolari, formando una croce. Successivamente, inserire il bisturi nel punto dove la membrana è attribuita al muro di inserire e ruotare l'inserto con l'altra mano per liberare i quattro campioni. Usando la pinzetta bene, trasferire con cautela ogni campione di una piastra a 24 pozzetti contenenti 200 µ l di PBS/pozzetto, dal lato del sangue in ciascun pozzetto.
- Bloccare le membrane con 10% siero bovino fetale in PBS (per 30 min a RT, 200 µ l/pozzetto). Preparare la soluzione di anticorpo 1° per immunostaining della giunzione stretta proteine (Figura 1) (zonula occludens-1, claudin-5; si prega fare riferimento alla Tabella materiali) in 200 µ l di soluzione/pozzetto di blocco. Facoltativamente, delle cellule endoteliali identità viene verificata con l'aggiunta di un anticorpo alzato contro la molecola di adesione delle cellule endoteliali della piastrina (PECAM1 o CD31; si prega fare riferimento alla Tabella materiali) per ogni soluzione di anticorpo di stretta della giunzione. Scartare la soluzione bloccante e incubare con gli anticorpi primari' O/N a 4 °C.
- Il giorno successivo, scartare gli anticorpi primari e risciacquarli con 200 µ l di PBS (3x per 5 min a RT). Incubare a loro con anticorpi secondari coniugati a fluorophore specie-appropriati (diluizione 1: 500, 200 µ l/pozzetto, diluito in soluzione bloccante; si prega fare riferimento alla Tabella materiali) per 2 h a TA.
- Scartare gli anticorpi secondari, sciacquare con 200 µ l di PBS (3x per 5 min a RT). Rimuovere il PBS e colorante di contrasto i nuclei cellulari utilizzando un 4', 6-diamidino-2-phenylindole soluzione di (DAPI) ad una concentrazione finale di 1 µg/mL in acqua distillata pura H2O (dH2O; 200 µ l/pozzetto; consultare il tabella materiali ). Incubare per 7 min a RT. Remove il DAPI e lavare le membrane 3 x con dH2O (200 µ l/pozzetto).
- Mettere una goccia di mezzo di montaggio (Vedi la Tabella materiali) su un vetrino per microscopio. Usando la pinzetta bene, attentamente prendere la membrana dal pozzo e mantenendo l'orientamento, togliere l'eccesso di dH2O e posto sulla goccia di mezzo di montaggio. Aggiungere un'altra goccia di mezzo di montaggio sulla parte superiore della membrana e attentamente coprire con un coperchio in vetro borosilicato. Assicurarsi che non siano senza bolle d'aria intrappolate. Conservare i campioni a 4 °C e lontano dalla luce fino alle osservazioni di microscopia confocale.
Nota: Astrocita macchiatura può essere eseguita inserendo i pezzi delle membrane nella piastra 24 pozzetti dal lato del cervello e con l'uso di anticorpi specifici del astrocyte selezionati (ad es., diretto contro la proteina acida fibrillare glial [GFAP]) (Figura 1E ).
- Risciacquare entrambi i lati della membrana con PBS ghiacciata (3x per 5 min, 2,5 mL/inserire, 3ml/bene). Scartare il PBS e aggiungere 3 mL e 2,5 mL di ghiacciata 4% PFA nel pozzo e nell'inserto, rispettivamente. Incubare in ghiaccio per 10 min. scartare il PFA (secondo l'istituzione'smaltimento chimici pericolosi s) e lavare 3 volte con PBS a TA (2,5 mL/insert, 3 mL/pozzetto).
-
Fluorescenza di YHBHU macchiatura per rilevare delle nanoparticelle transcitosi
- Eseguire cellule vive lisosoma etichettatura (ad es., usando fluorescente sonde [vedi Tabella materiali]). Diluire il colorante fluorescente lisosoma ad una concentrazione di lavoro di 50 nM in preriscaldati EBM - (2.5 mL/inserto) o di 75 mM in preriscaldati ABM - (3 mL/pozzetto) per il lisosoma etichettatura delle cellule endoteliali e astrociti, rispettivamente. Incubare le cellule per 45 min (a 37 °C con 5% CO2); quindi, lavare 3 volte con PBS ghiacciata (2,5 mL/insert, 3 mL/pozzetto).
- Scartare il PBS e aggiungere 3 mL e 2,5 mL di ghiacciata 4% PFA per il pozzo e l'inserto, rispettivamente. Li Incubare in ghiaccio per 10 min. scartare il PFA e sciacquare le celle 3 x con PBS (a RT, 2,5 mL/insert, 3 mL/pozzetto).
Nota: Una volta fissato, i campioni possono essere conservati in PBS (2,5 mL/insert, 3 mL/pozzetto) a 4 ° C per una settimana. - Rimuovere il PBS e colorante di contrasto i nuclei cellulari utilizzando una soluzione DAPI ad una concentrazione finale di 1 µ g/mL in dH2O (1 mL/inserto, 1 mL/pozzetto). Incubare a loro per 7 min a RT. Remove il DAPI e lavare le membrane 3 x con dH2O (2,5 mL/insert, 3 mL/pozzetto).
- Tagliate la membrana con attenzione, rimuovere l'eccesso di dH2O e posto su una goccia di mezzo di montaggio (Vedi la Tabella materiali) su un vetrino per microscopio. Aggiungere un'altra goccia di mezzo di montaggio su altro lato della membrana e attentamente coprire con un coperchio in vetro borosilicato. Evitare le bolle d'aria intrappolate. Conservare i campioni a 4 °C e tenerli al riparo dalla luce fino a formazione immagine di microscopia confocale.
-
Macchiatura di fluorescenza delle cellule del tumore
- Usando la pinzetta bene, trasferire con cautela il coprioggetto rotondo contenente le sfere del tumore per una piastra a 24 pozzetti riempito con PBS ghiacciata. Procedere con cellule vive lisosoma etichettatura usando le sonde fluorescenti lisosoma a 75 nM a preriscaldati GBM - (200 µ l/pozzetto). Incubare i campioni per 45 min; quindi, sciacquarli 3 volte con PBS ghiacciata (200 µ l/pozzetto).
- Scartare il PBS e aggiungere 200 µ l di PFA ghiacciata per pozzetto. Incubare in ghiaccio per 10 min. scartare il PFA e sciacquare i campioni 3 x con PBS (a RT).
Nota: Una volta fissato, i campioni possono essere conservati in PBS (200 µ l) a 4 ° C per una settimana. - Rimuovere il PBS e colorante di contrasto i nuclei cellulari utilizzando una soluzione DAPI ad una concentrazione finale di 1 µ g/mL in dH2O (200 µ l/pozzetto). Incubare li 7 min a RT. Remove il DAPI e lavare i vetrini coprioggetti 3 x con dH2O (200 µ l/pozzetto).
- Usando la pinzetta bene, togliere il vetrino coprioggetto, rimuovere l'eccesso di dH2O e posizionarlo su una goccia di mezzo di montaggio (Vedi la Tabella materiali) su un vetrino per microscopio. Evitare di intrappolare bolle d'aria. Conservare i campioni a 4 °C e tenerli al riparo dalla luce fino alle osservazioni di microscopia confocale.
3. in Vivo studio comparativo
- Registrazione in situ di diffusione di sodio-fluoresceina attraverso la BBB
- Preparare 150 µ l di una soluzione di Na-Fl 50 nM in una soluzione fisiologica. Mantenere la soluzione a 37 °C al momento della consegna per via endovenosa.
- Anestetizzare un mouse con un'iniezione intraperitoneale di un chetamina/xilazina cocktail (300 µ l di 100 mg/kg ketamina e 10 mg/kg xylazina in PBS). Una volta stabilita l'anestesia profonda, metti l'animale su un rilievo di riscaldamento per mantenere la sua temperatura corporea.
Nota: Dieci week-old Naval Medical Research Institute (NMRI) topi nudi femminili immunocompromessi sono stati utilizzati per ottenere i dati presentati nella Figura 2. Tuttavia, questo protocollo è adattato ai topi sia immunocompetenti e immunocompromessi. Il metodo di anestesia/analgesia è presso lo scienziato'discrezione s. Tuttavia, l'anestesia per inalazione come isoflurano non è raccomandato come significativamente aumenta la permeabilità BBB18. - Posizionare il mouse su una cornice stereotassica (Vedi la Tabella materiali) ed eseguire un'incisione longitudinale del cuoio capelluto con forbice, seguita da fusioni delicata del tessuto connettivo, usando bene pinzette, per rivelare il cranio. Con movimenti circolari con un microdrill bene, rimuovere un pezzo circolare di 0,3 mm di ø del cranio dall'osso parietale sinistro o destro. Procedere con estrema cautela durante la perforazione e mentre si rimuove il pezzo di cranio per evitare di ferire il tessuto sottostante meningeo e vasi sanguigni.
- Mettere una goccia di soluzione fisiologica il tessuto esposto. Utilizzando due coppie di una pinzetta, rimuovere con cautela il tessuto meningeo per accedere la corteccia del cervello. Il tessuto cerebrale non dovrebbe mai essere in diretto contatto con l'aria.
Nota: Le emorragie minori da lesioni meningee possono essere interrotto utilizzando spugne ematologiche (si prega di fare riferimento alla Tabella materiali). - Una volta che il tessuto meningeo è rimosso e la corteccia è completamente esposta, intrappolare una goccia di soluzione fisiologica tra la corteccia e un coprioggetto in borosilicato ø 0,5 mm. Rendere sicura l'area di osservazione con una goccia di colla cianoacrilica (si prega di fare riferimento alla Tabella materiali) diffuso in tutto il coprioggetto con un ago. Lasciate che la colla secca per 1 min.
- Preparare il catetere impiantabile per l'iniezione della vena della coda (Figura 2A). Rompere la punta di un ago 25 G usando il forcipe di Rochester-Ochsner e inserire la punta in un tubo di poliuretano PE20 lungo cm 10 (si prega di fare riferimento alla Tabella materiali) (Figura 2A).
- Inserire il catetere nella vena caudale laterale del mouse, utilizzando morsetti bulldog per la manipolazione del catetere e l'inserimento (si prega di fare riferimento alla Tabella materiali) (Figura 2B). Fissare l'ago inserito con una goccia di colla cianoacrilica. Lasciate che la colla secca per 20 s prima di rimuovere il morsetto del bulldog. Attentamente e collegare l'altra estremità del catetere per un ago 25 G collegato ad una siringa contenente la soluzione di Na-Fl (Figura 2B).
- Nota: Non stringere la coda con il bulldog morsetto; è utilizzato solo per la gestione precisa del catetere. Inserzione del catetere corretto può essere confermata da riflusso di sangue nel tubo trasparente.
- Metti l'animale sotto lo stereomicroscopio (Vedi la Tabella materiali). Utilizzando l'autofluorescenza basso livello nel verde del canale (480 nm), concentrarsi su un'area che contiene relativamente grandi vasi sanguigni (appaiono più scuri a causa dell'assorbimento dell'emoglobina di luce a questa lunghezza d'onda) e più piccoli capillari (Figura 2). Avviare l'acquisizione di time-lapse brevemente prima di iniettare la tintura fluorescente, per ottenere una misura della fluorescenza di fondo.
Nota: In alternativa, la registrazione time-lapse possa essere sostituita da immagini di snapshot da T0 e da qualsiasi altro predeterminati intervalli di tempo. - Iniettare la soluzione ad un ritmo lento e continuo, o in alternativa, utilizzare un sistema di infusione automatizzata. La fluorescenza di Na-Fl rilevata nel sangue dovrebbe rimanere stabile (emivita nel sangue: 286 min), che permette una registrazione della diffusione BBB attraverso la finestra cranica per alcuni minuti. Una volta completata l'acquisizione, con attenzione rimuovere il catetere ed eutanasia animale di dislocazione cervicale.
- Determinazione in vivo della permeabilità BBB
Nota: I valori sono ottenuti da qualsiasi software di elaborazione delle immagini, ad esempio ImageJ, permettendo la misura dell'intensità del segnale di fluorescenza all'interno di un'area personalizzata di interesse (ROI).- Utilizzando lo strumento di annotazione, disegnare un ROI a forma di rettangolo all'esterno di un vaso sanguigno, nel tessuto cerebrale, a circa 5 µm distanza da qualsiasi visibile vasi sanguigni riempito con Na-FL. Nota le dimensioni il ROI e l'intensità di fluorescenza misurata a T0 in quel ROI, che è usato come vuoto per il tessuto's autofluorescenza. Senza spostare il ROI, fast-forward per un tempo postinjection punto (ad esempio, per l'ultimo fotogramma registrato quando l'intera soluzione è stata iniettata all'animale) e prendere nota dei valori precisi di tempo e fluorescenza misurati entro il ROI (Figura 2).
- Spostare il ROI su un vaso sanguigno visibile (Figura 2) e prendere nota del valore di autofluorescenza T0 dal sangue. Senza spostare il ROI, fast-forward allo stesso punto di tempo come definito al punto 3.2.1. e nota che il valore di fluorescenza misurata entro il ROI (Figura 2).
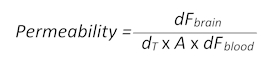
- Utilizzare la formula seguente (adattata da sezione 1.3) per determinare la permeabilità BBB:
- Qui, dFcervello è il valore di intensità di fluorescenza meno il T0 vuoto nel cervello, dT è il punto di tempo di acquisizione in pochi secondi, A è l'area della superficie approssimativa nave, preso come la zona ROI in centimetri quadrati e dF sangue è il valore di intensità di fluorescenza meno il T0 vuoto nell'anima.
Nota: I valori di permeabilità previsto per BBB devono essere nell'intervallo 10-6 cm/s (tabella 1).
- Lavorazione per la rilevazione delle nanoparticelle fluorescenti nel cervello murino del tessuto
- Implantare glioblastoma paziente-derivato sfere (5 x 104 celle a 5 µ l di PBS sterile) in anestetizzati 6-settimana-vecchio NMRI topi nudi femminili nel callosum del corpus. Individuare questa regione del cervello alle seguenti coordinate stereotassiche, a partire dal Bregma: antero-posteriore + 0,5 mm, sinistra a destra + 2,5 mm, dorsoventral + 3 mm. consentire il tumore di cervello a crescere per 2 settimane.
- Iniettare per via endovenosa le nanoparticelle (100 µ g in 100 µ l di soluzione fisiologica sterile) e consentire loro di circolare per 8 h. iniettare per via endovenosa i topi di controllo con 100 µ l di soluzione fisiologica sterile.
- Eutanasia i topi di dislocazione cervicale e raccogliere i cervelli rapidamente per snap-congelamento in isopentano mantenuto il ghiaccio secco (1 min a-50 °C). Memorizzare i cervelli a-80 °C fino alla lavorazione del tessuto.
- Tagliare sezioni coronali del cervello con un cryomicrotome. Individuare l'impianto intracranico la cicatrice formano sulla corteccia e tagliare 9 µm di spessore sezioni da quell'area sui vetrini da microscopio appropriato (Vedi la Tabella materiali).
- Immergere le sezioni del cervello che sono immobilizzate sulle diapositive in PBS ghiacciata (2 volte per 5 min) e, quindi, fissare nella gelido 4% PFA (per 5 min). Lavare i vetrini in PBS (3x per 5 min a RT). Porre i vetrini in posizione orizzontale e dispensare il blocco soluzione contenente 10% siero bovino fetale in PBS sul tessuto sezioni che coprono l'intera superficie (per 1 h a RT, 500 µ l/diapositiva). Preparare l'anticorpo CD31 (si prega di fare riferimento alla Tabella materiali) in 250 µ l di soluzione/diapositiva di blocco. Sostituire la soluzione bloccante con l'anticorpo e incubare per una notte a 4 °C in una camera umidificata.
- Il giorno successivo, immergere i vetrini in PBS (3x per 5 min a RT) e incubare a loro con il corrispondente fluorophore-coniugato anticorpo secondario (1: 500 a 250 µ l di PBS per 2 h a temperatura ambiente). Sciacquare 3x in PBS (a RT) e colorante di contrasto i nuclei cellulari utilizzando una soluzione DAPI ad una concentrazione finale di 1 µ g/mL in dH2O (250 µ l/diapositiva). Incubare i campioni per 7 min a RT. Remove la soluzione DAPI e lavare i vetrini 3 x con dH2O.
- Su ogni sezione di tessuto, aggiungere una goccia di mezzo di montaggio (si prega di fare riferimento alla Tabella materiali) e fissare i campioni con un vetrino coprioggetti. Evitare di intrappolare bolle d'aria. Conservare i campioni a 4 °C e tenerli al riparo dalla luce fino alle osservazioni di microscopia confocale.
Risultati
Formazione immagine confocal del mimic YHBHU murino Mostra l'espressione e la localizzazione cellulare della giunzione stretta proteine zonula occludens-1 (ZO-1) e claudin-5 in bEND3. Contatti tra le cellule endoteliali e astrociti indotto chiaramente la rilocazione della ZO-1 e claudin-5 per i contatti cellula-cellula endoteliale rispetto per le monocolture di bEND3 (Figura 1). Utilizzando l'immunofluorescenza che macchia per visualizzare gli astrociti GFAP-esprimendo il cervello-lato della membrana, è possibile osservare e studiare i processi astrocitari e puntali contattando le cellule endoteliali attraverso la membrana (Figura 1E ). I contatti di Astrocita-endothelial delle cellule sono conosciuti per promuovere e stabilizzare il serraggio della barriera cellulare e sono associati con i valori più bassi di permeabilità del BBB19. In conformità con quello, abbiamo osservato una sostanziale diminuzione della permeabilità del mimic di YHBHU del mouse per la Na-Fl da 27,63 (± 3.45) x 10-6 cm/s in caso di monocolture a 6,74 (± 3.01) x 10-6 cm/s quando co-coltivate con ipossia-viscoelastico fattore knock out astrociti (HIFko) (tabella 1). Il HuAR2T immortalata formano barriere cellulari altamente permeabili (104.92 ± 27,1 x 10-6 cm/s, tabella 1). Simile al modello murino, abbiamo misurato la permeabilità significativamente più basso di YHBHU a Na-Fl, vale a dire (± 14,32) di 47,4 x 10-6 cm/s, quando le cellule di HuAR2T erano co-coltivate con gli astrociti umani primari (tabella 1).
In imita YHBHU sia murine ed umane, la presenza delle sfere glioblastoma paziente-derivato ha indotto un leggero aumento dei valori di permeabilità rispetto alle co-culture endoteliale delle cellule-Astrocita da solo (tabella 1). Questo fenomeno si osserva con molti ma non tutti il glioma paziente sfera modelli. Questo può essere dovuto il VEGF-A che viene secreto da alcune di queste cellule derivanti dal paziente.
Per confrontare i valori di permeabilità dei Mimic di YHBHU in vitro con il BBB in vivo, abbiamo ripreso la diffusione in tempo reale della Na-Fl attraverso una finestra cranica impiantata in topi nudi. Utilizzando un microscopio stereoscopico di fluorescenza, diffusione di Na-Fl dai vasi sanguigni capillari derivante dai vasi sanguigni pial principali è stata registrata prima, durante e dopo l'iniezione sistemica della sonda (Figura 2). Misurazioni dei valori di fluorescenza differenziale dal parenchima corticale con cervello e del sangue circolante nel corso del tempo ci ha permesso di calcolare i valori di permeabilità approssimativo del mouse nudo's BBB per Na-Fl (5,57 ± 2.19 x 10-6 cm/s, Tabella 1).
Per illustrare come la mimica di YHBHU può essere utilizzato per la visualizzazione del passaggio di composti al lato di sangue al lato del cervello, abbiamo confrontato la transcitosi di ø 110 nm (NP110) e ø 350 nm (NP350) nanoparticelle targeting glioblastoma paziente-derivato sfere. Risultati ottengono in vitro sono stati poi confrontati con la transcitosi in vivo. Nell'esempio presentato, le nanoparticelle sono state rivestite di superficie con il peptide di targeting tumorale CooP20 e caricato con il colorante fluorescente (FITC) per facilitare la visualizzazione. Abbiamo identificato le cellule usando il colorante lisosomiale e controcolorati con DAPI 24 h dopo l'aggiunta delle nanoparticelle FITC sul lato sangue della YHBHU imitare e acquisito confocale micrografie a diversi livelli (ad esempio, il lato di sangue, la membrana, il lato del cervello, e le sfere di glioblastoma paziente) (Figura 3A). Il segnale fluorescente NP110-collegato colocalized con i lisosomi nelle cellule endoteliali, astrociti e cellule tumorali. Inoltre, NP110s sono stato rilevato tra le cellule endoteliali e astrociti, passando attraverso i pori di membrana dell'inserto (Figura 3A).
Il passaggio di NP110s è stato quantificato misurando la fluorescenza da campioni raccolti da parte di sangue e nel cervello. Questi valori di permeabilità sono stati confrontati a quelli determinati per le nanoparticelle di ø 350 nm (NP350). I risultati mostrano che solo NP110 era in grado di attraversare i mimic di YHBHU (Figura 3B). NP350 è rimasto sul lato sangue del mimic di YHBHU, che ha provocato più bassi valori di permeabilità per queste nanoparticelle.
Per evidenziare la rilevanza dei Mimic di YHBHU rispetto ai modelli in vivo, topi nudi sono stati iniettati per via endovenosa con nanoparticelle NP110 o NP350 rivestito con il peptide di targeting tumorale CooP e coniugato con colorante fluorescente rosso (TRITC) per la rilevazione. Tessuti raccolti in diversi momenti ha rivelato che dopo 8 h, BBB-permeabile nanoparticelle hanno extravasated nel parenchima cerebrale, mentre il similgranito quelli che siamo stati nella circolazione erano principalmente hanno eliminati dalla circolazione sistemica in vivo. Di conseguenza, abbiamo raccolto i cervelli e quantificato il numero di nanoparticelle per millimetro quadrato di postinjection h 8. In conformità con i risultati in vitro, NP110, ma non NP350, con successo extravasated nel parenchima cerebrale (Figura 3). Formazione immagine ad alto ingrandimento della posizione delle nanoparticelle nel cervello ha mostrato che NP110 era distribuita omogeneamente nel parenchima del cervello fuori i capillari sanguigni e ospitati con successo per le cellule di glioblastoma impiantati (Figura 3D). Nonostante che esibiscono il tumore stesso targeting frazione (CooP), NP350 è riuscito a MPEG nel parenchima cerebrale e solo è stato rilevato all'interno lato luminale dei vasi sanguigni del cervello (Figura 3E), simile ai risultati ottenuti in vitro.
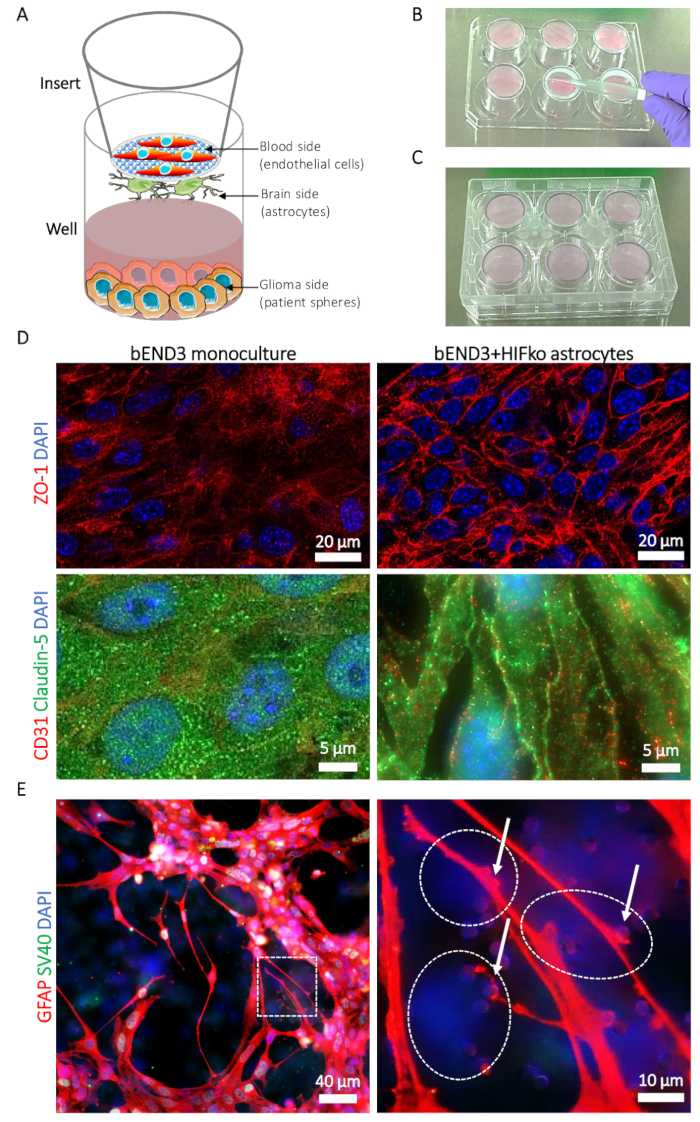
Figura 1: Descrizione del modello (YHBHU) tumore-barriera emato-encefalica. (A) rappresentazione schematica delle posizioni di diversi tipi di cellule. (B) illustrazione del posizionamento inserto sul coperchio piastra a 6 pozzetti e la tecnica di semina per i astrocytes sul lato del cervello dell'inserto'membrana s. (C) illustrazione del posizionamento piastra a 6 pozzetti permettendo l'adesione di astrociti. (D) micrografie di immunofluorescenza della giunzione stretta proteine zonula occludens-1 (riga ZO-1, superiore, rosso) e claudin-5 (riga inferiore, verde). L'espressione della proteina viene confrontato con le cellule endoteliali microvascolari di cervello murino (bEND3) coltivate sul lato di sangue della YHBHU da solo come una monocoltura (colonna sinistra) o con murini immortalizzati HIFko astrociti (colonna destra). Nuclei delle cellule sono controcolorati con DAPI (blu). (E) micrografo di immunofluorescenza mostrando la proteina silicea fibrillare glial (GFAP, rosso) negli astrociti HIFko coltivati a lato del cervello del YHBHU. L'immagine di alto ingrandimento Mostra processi astrociti e puntali (frecce) contatto con le cellule endoteliali attraverso la membrana pori (pannello di destra). L'identità di astrociti HIFko è stata verificata mediante immunofluorescenza colorazione del simian virus 40 grande T antigene (grande T di SV40, verde) utilizzato per l'immortalizzazione delle cellule. Cellule endoteliali express la GFAP, né il grande T di SV40 e, pertanto, possono essere parzialmente osservate attraverso il trasparente, sul lato opposto della membrana come sola DAPI cellule marcate (linee tratteggiate). Nuclei delle cellule sono controcolorati con DAPI (blu). Clicca qui per visualizzare una versione più grande di questa figura.
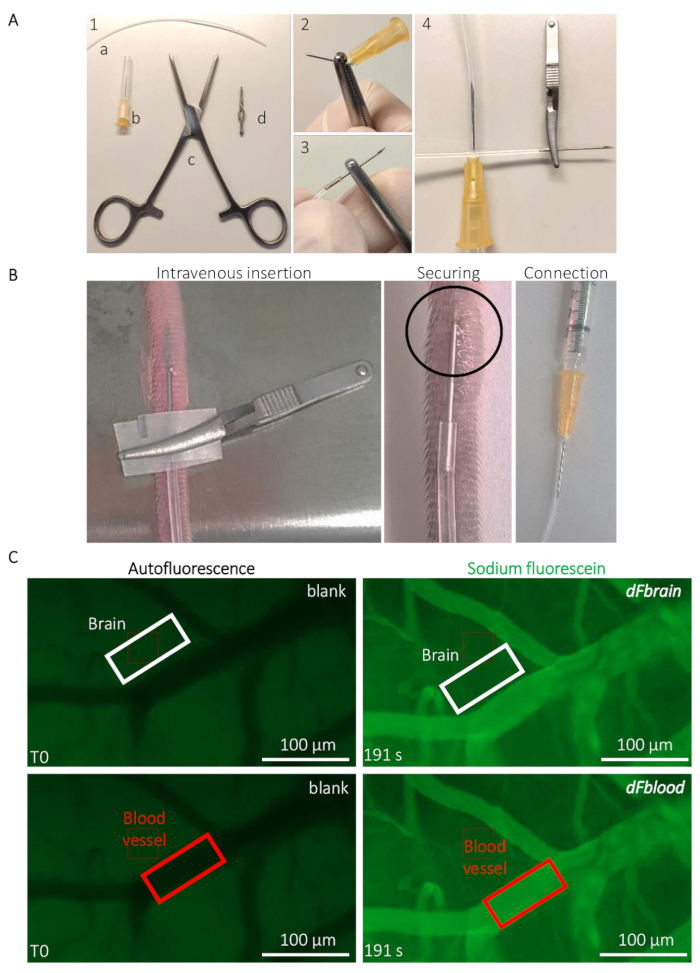
Figura 2: Intravital determinazione diretta del mouse permeabilità BBB. (A) preparazione del catetere impiantabile vena caudale. (1) attrezzi e attrezzature sono i seguenti: (a) un PE20 tubo in polietilene (b) due 25 G aghi (c) Rochester-Ochsner forcipe e (d), un piccolo bulldog morsetto. (2), A 25 G ago viene rimosso da torsioni diversi utilizzando il forcipe e (3) attentamente inserito nel tubo. (4), da altra parte del tubo è collegato a un altro ago 25 G. (B) indicazioni per l'impianto di catetere e posizionamento per iniettare la soluzione di sodio-fluoresceina attraverso la vena caudale di un mouse. L'area cerchiata indica l'area in cui si trova una goccia di colla cianoacrilica per fissare il catetere. Il bulldog morsetto è utilizzato per gestire il catetere e rimosso una volta che il catetere è garantito. (C) rappresentante imaging e quantificazione metodo per determinare i valori di permeabilità di sodio-fluoresceina. Prima dell'infusione di sodio-fluoresceina (colonna sinistra), l'autofluorescenza/blank viene misurata all'interno di una regione di interesse (ROI) collocata sul cervello (rettangolo del pannello superiore, bianco) e zone di vaso sanguigno (rettangolo inferiore pannello, rosso). Durante l'infusione di sodio-fluoresceina (colonna destra), l'intensità di fluorescenza è misurata in entrambi ROIs, che permette il calcolo della permeabilità BBB. Clicca qui per visualizzare una versione più grande di questa figura.
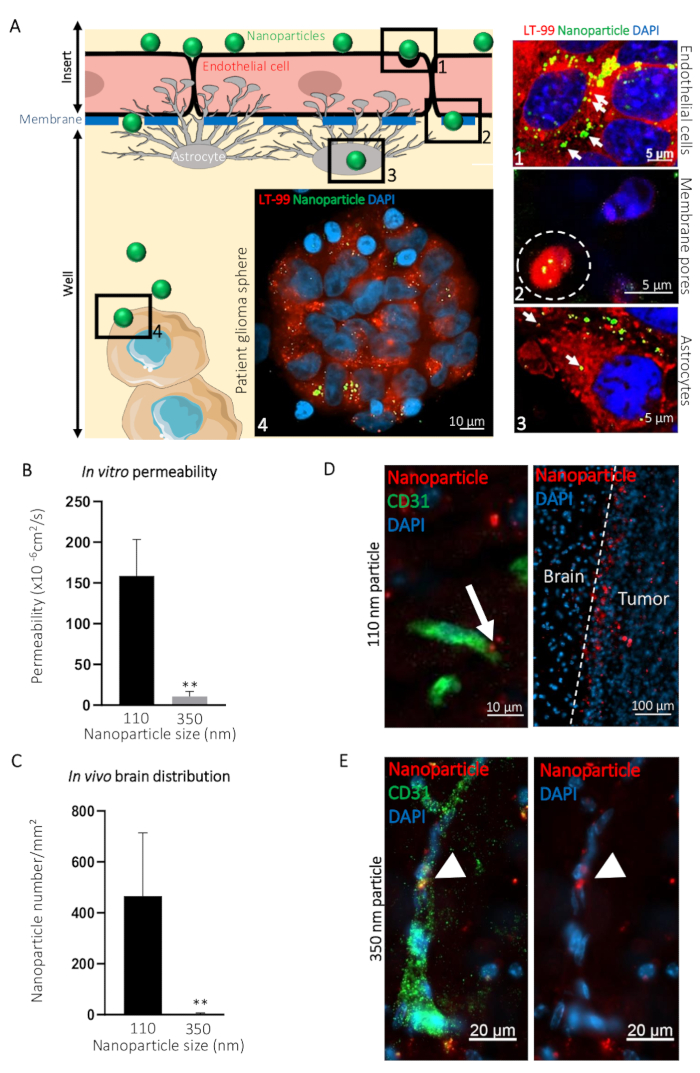
Figura 3: previsione della transcitosi intracerebrale delle nanoparticelle attraverso BBB in vivo usando il modello in vitro di YHBHU. (A) rappresentazione grafica del dosaggio YHBHU con immagini confocale rappresentative ottenuti ai diversi livelli del modello murino YHBHU indicati. Nanoparticelle di 110 nm di diametro (NP110) e coniugato a FITC (verde) sono stati aggiunti al sangue laterale delle cellule YHBHU sono stati etichettati con la sonda lisosomiale (LT-99, rosso). (1), Endothelial cells, (2), Endothelial transcitosi delle nanoparticelle attraverso i pori della membrana (linea tratteggiata bianca), gli astrociti (3), e (4) pazienti di glioblastoma sfere sono identificati sul grafico e corrispondenti micrografie confocale (a destra). Lysosomal incapsulamento delle nanoparticelle (frecce) suggerisce transcitosi attivo attraverso i livelli endoteliali e astrociti della YHBHU. (B) quantificazione della permeabilità delle nanoparticelle indicato attraverso il YHBHU in vitro (n = 6). (C) quantificazione della densità delle nanoparticelle indicato nel tessuto cerebrale di sezioni, 8 h dopo l'infusione di vena caudale di topi nudi (n = 3). (D) confocale micrografie mostrano la distribuzione del ø 110 nm nanoparticelle (NP110, rosso) nelle sezioni del tessuto del cervello murino etichettati con un anticorpo anti-CD31 (verde). La freccia evidenzia la transcitosi di nanoparticelle (pannello di sinistra). Le nanoparticelle accumulato intorno alle cellule del tumore di cervello (tumore, pannello di destra) a causa del peptide CooP-targeting presentato sulla loro superficie. Nessun significativo homing è osservata nel tessuto cerebrale (cervello). (E) confocale micrografie mostrano la distribuzione del ø 350 nm nanoparticelle (NP350, rosso) in sezioni di tessuto del cervello murino etichettate con un anticorpo anti-CD31 (verde). Punte di freccia, scegliere il NP350s che sono stati mantenuti nel lume del vaso sanguigno e sono stati in grado di attraversare la BBB, probabilmente a causa del loro diametro maggiore rispetto ai nuclei cellulari NP110s. sono counterstained con DAPI (blu). P < 0.01. P-valori sono stati calcolati utilizzando un test di Mann-Whitney U a due code, non parametrico. Le barre di errore rappresentano la deviazione standard. Clicca qui per visualizzare una versione più grande di questa figura.
| murino mimica di YHBHU | bEND3 | bEND3 + HIFko come | bEND3 + GB | bEND3 + HIFko come + GB | In vivo |
| Permeabilità (10-6 cm/s) | 27,63 | 6,74 | 26,8 | 10.83 | 5,57 |
| SD (10-6 cm/s) | 3,45 | 3.01 | 7.99 | 2.65 | 2.19 |
| mimica di YHBHU umana | HuAR2T | HuAR2T + hIAs | HuAR2T + GB | HuAR2T + hIAs + GB | |
| Permeabilità (10-6 cm/s) | 104,92 | 47,4 | 89.08 | 48,24 | |
| SD (10-6 cm/s) | 27.1 | 14,32 | 10.21 | 13.07 |
Tabella 1: valori di permeabilità sodio-fluoresceina (Na-Fl) (in centimetri al secondo) determinata in vitro nei sistemi di co-coltura indicato ed in vivo in topi nudi NMRI. I dati da un esperimento rappresentanza (n = 3 topi).
Discussione
L'ascesa del concetto di variabilità interpaziente tumore ringiovanito la ricerca sul cancro personalizzata medicina21. Questa variabilità è anche un segno distintivo di neoplasie del sistema nervoso centrale. Dovuto l'imprevedibilità del tumore, la risposta alla chemioterapia aggiunge all'effetto che ripara della BBB per il drug delivery e costituisce complessivamente grandi sfide nella cura del paziente22. Al fine di sviluppare terapie più efficaci, è spesso necessario librerie di grandi dimensioni di schermo di nuove molecole. Per valutare l'efficacia antitumorale e la capacità dei nuovi cavi terapeutici per raggiungere il sito del tumore, l'opzione migliore è lo studio preclinico su cellule derivate paziente impiantato in vivo nel paziente murino avatar. A causa di pratiche (risorse finanziarie, di tempo, umani e struttura) e motivi etici (principio 3R quando si utilizza animali da laboratorio), lo sviluppo di una piattaforma di screening in vivo su larga scala spesso non è possibile e conseguenza, l'analisi cell-based rimangono un modello di scelta23. Il motivo principale per la selezione di linee cellulari stabilizzate ed evitare le cellule primarie è per facilitare la riproducibilità e ridurre l'uso di animali da laboratorio, che sono la fonte principale per l'isolamento e l'istituzione di colture primarie di murini. I metodi che presentano qui, saldamente conforme le 3R, potrebbero scartare in modo efficiente nanoparticelle da un'ulteriore indagine preclinica sul criterium della loro incapacità di attraversare il modello YHBHU. Come un prova-de-principio, descriviamo qui i risultati ottenuti durante lo sviluppo e la convalida della YHBHU. Siamo stati in grado di confermare i risultati in vitro e in vivo, per esempio quando si misura la diffusione passiva di una 376 Da sodio-fluorescina.
Il protocollo descritto in questo articolo descrive la preparazione delle cellule endoteliali cocultured con gli astrociti per formare un'interfaccia simil-tumorale-barriera emato-encefalica in un'installazione in vitro. Una volta stabilito un contatto fisico tra questi due tipi di cellule, lo strato delle cellule endoteliali esibisce le somiglianze con il BBB (ad esempio, una cella espressione di superficie delle proteine di giunzione stretta e relativamente bassa permeabilità). È interessante notare che, il mimic YHBHU murino sembrava fornire valori di permeabilità Na-Fl particolarmente simili a quelli ottenuti con il topo in vivo BBB permeabilità misure24. Di conseguenza, le prestazioni dei Mimic di YHBHU saranno direttamente collegata alla scelta delle celle utilizzate per formare la barriera. Le cellule endoteliali bEND3 provengono dal cervello e sono noti per essere riuscito a formare barriere quando cocultured con gli astrociti25. Tuttavia, utilizziamo l'immortalizzate HIFko astrociti26 per generare il mimic di YHBHU. A causa della loro mancanza del fattore ipossia-inducibile, questi astrociti non producono VEGF-A, che è per eccellenza in termini di stabilizzazione del mimic YHBHU descritto qui. Gli astrociti sono stati identificati come modulatori della permeabilità BBB, per esempio attraverso il rilascio di VEGF-A in risposta a neuroinflammation27. L'attivazione dei recettori del fattore di crescita endoteliale vascolare (VEGFRs) è un regolatore chiave della permeabilità endoteliale/vascolare sia in vitro28 e in vivo29. Pertanto, integratori di VEGF-A nel mezzo di attivano il VEGFR2 sulle cellule endoteliali, che induce la fosforilazione delle proteine di giunzione dei adherens come VE-caderina30. La perdita di contatti cellula-cellula endoteliale genera ad alta permeabilità dei vasi sanguigni. Allo stesso modo, sia la forte proprietà mitogenica e composizione sconosciuta dei sieri bovini fetali utilizzato nelle analisi di cultura cellulare causare grossi problemi nella riproducibilità di stabilizzazione e dosaggio di barriera.
Le cellule endoteliali di vena ombelicale umana (HUVECs) vengono talvolta utilizzate per formare BBB in vitro31; Tuttavia, differiscono significativamente da cellule endoteliali microvascolari del cervello, come la cella di hCMEC/D3 linea32, in termini di espressione genica e che formano barriera proprietà. Tuttavia, la permeabilità relativamente più elevata i valori ottenuti con le cellule di HuAR2T sviluppate da solo rispetto alla bEND3 notevolmente sono stati ridotti da li coculturing con astrociti di umani. Sebbene le cellule endoteliali sono tenute a formare la parete cellulare, è chiaro che gli astrociti hanno un ruolo altrettanto importante per la formazione di YHBHU e stabilizzazione.
Quando le sfere di glioma paziente-derivati sono stati aggiunti a questa equazione, si ricapitola il mimic di YHBHU del mouse alcune delle caratteristiche degli xenotrapianti murini, quali la diffusione di droga attraverso il sistema vascolare del cervello e il targeting di cellula tumorale. I mimic di YHBHU discussi qui erano, per esempio, successo in mirroring il comportamento in vivo quando abbiamo proiettato nanoparticelle diverse con differenti diametri. Per illustrare il parallelismo tra i modelli in vitro e in vivo, abbiamo usato il precedentemente descritti mesoporosi silicato nanoparticelle33 con cellula-penetrante proprietà34 coniugato al peptide targeting tumorale CooP il loro surface20. Le case di peptide CooP-targeting alle cellule del tumore invasivo attraverso il legame specifico con l'inibitore di crescita mammaria-derivato (MDGI). Parecchi cancri, compreso i gliomi, sono che overexpressing MDGI rispetto al tessuto normale35, che rende la CooP una frazione di targeting tumorale molto efficiente in grado di aumentare la consegna di un carico utile di20. Le nanoparticelle utilizzate qui sono state indicate precedentemente per diffondere nel parenchima cerebrale (27547955), e quando funzionalizzati con Taxol, questi nano-carichi hanno avuto successo nella riduzione della crescita del glioma in modelli preclinici36. L'aggiunta di glicole polietilenico (PEG) residui sulla superficie delle nanoparticelle anche mantenuto la loro carica statica ai valori positivi (intorno + 4 mV), consentendo la migliore interazione con l' unità neurovascolare37 e anche aumentando la loro stabilità in circolazione. Nei dati presentati, 3 kDa di PEG è stato coniugato al NP110s, mentre NP350s sono stati rivestiti con 10 kDa di PEG. Tuttavia, aumentato peso molecolare PEG inoltre ha provocato un significativo aumento del diametro delle nanoparticelle, quindi le loro capacità fisiche di attraversare la BBB. Di conseguenza, abbiamo controllato se le dimensioni fisiche delle particelle impedito loro passaggio attraverso il YHBHU e se queste osservazioni potrebbero riflettersi in vivo.
Secondo le osservazioni precedentemente pubblicate, abbiamo osservato che NP110s extravasated attraverso sia il YHBHU in vitro e la BBB di topi che sopportano i tumori intracranici, mentre NP350s mantenuto dal lato luminal del mimic di YHBHU e nei vasi sanguigni della topi. Questi risultati simili suggeriscono fortemente che il modello di YHBHU previsto la possibilità in vivo di nanoparticelle di attraversare la BBB e raggiungere il cervello.
La rilevanza di modelli cellulari della BBB è spesso discussa, anche per l'andanatura centrale di nanoparticelle38. Indichiamo qui che astrociti e cellule endoteliali, entrambi considerati come i più rilevanti strumenti in vitro, possono essere sostituite dalle cellule immortalizzate e/o disponibili in commercio, garantendo riproducibilità e una maggiore scalabilità. La prossima generazione dei Mimic BBB in vitro potrebbe essere sviluppata incorporando i dispositivi microfluidici, consentendo unità neurovascolare splendidamente formata che assomigliano strutturalmente le effettive BBB12,14. Tuttavia, tali modelli sono attualmente inadatti per lo screening di alto-rendimento delle molecole consegnato ai gliomas, a causa di limitazioni tecniche presenti nel follow-up della consegna14. È infatti difficile catturare la complessità fisiologica della BBB in un piatto, e la possibile mancanza di alcuni recettori e proteine, conosciuto per essere espresso da BBB, potrebbe compromettere l'interpretazione dei risultati. Un altro argomento riguarda la grande variabilità nell'espressione genica tra condizioni in vivo e in vitro, così come da una cellula a altra, soprattutto considerando le cellule endoteliali. Tuttavia, si potrebbe anche sostenere che l'unità neurovascolare non è un'entità uniforme all'interno del cervello39. Ricerca scientifica in biologia ha raggiunto una era umana dove il benessere degli animali, responsabilità etica e il costo di utilizzo vite animali sono sempre considerati prima di progettare un esperimento. Pertanto, per supportare la sostituzione degli animali, un numero crescente di studi recenti Mostra che la consapevolezza dei limiti dei modelli e un'attenta selezione di modelli cellulari per stabilire la barriera — con un'enfasi su astrociti — garantisce un corrispondenza tra i risultati ottenuti in un piatto e nell'animale modelli40. Con la metodologia descritta qui, otteniamo un passo avanti verso la riduzione del numero degli animali sperimentali utilizzati per scopi di transcitosi BBB per terapeutica potenziale di screening.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questa ricerca è stata sostenuta da sovvenzioni da organizzazioni cancro finlandese, Jane & Aatos Erkko Foundation e Sigrid Juselius Foundation (P.L. e V.L.J.), la Swiss National Science Foundation (Advanced Postdoc.Mobility concedere no: P300PB_164732, a S. K.), la Fondazione di ricerca Orion (a S.K.), Maud Kuistila Memorial Foundation (a S.K.) e l'Accademia di Finlandia (TERVA 2017, concedere no: 314 498). L'unità di Imaging Biomedicum (Helsinki) è riconosciuto per fornire la formazione immagine di funzione di memoria di microscopia.
Materiali
| Name | Company | Catalog Number | Comments |
| Cells | |||
| bEND3 | ATCC | CRL-2299 | Cultured in: DMEM (1g/L glucose) supplemented with 10% FBS, 5 mL L-glutamine and 5 mL penicillin/streptomycin |
| HIFko immortalized mouse astrocytes | Isolated in Dr. Gabriele Bergers Lab | https://doi.org/10.1016/S1535-6108(03)00194-6 | Cultured in: BME-1 supplemented with 5% FBS, 5 mL 1 M HEPES, 5 mL 100 mM sodium pyruvate, 3 g D-glucose and 5 mL penicillin/streptomycin |
| HuAR2T | Isolated in Dr. Dagmar Wirth Lab | https://doi.org/10.1089/ten.tea.2009.0184 | Cultured in: EBM-2 with SupplementMix |
| normal human primary astrocytes | Lonza | CC-2565 | Cultured in: ABM with SingleQuots |
| Material and reagents | |||
| 100 mm x17 mm Dish, Nunclon Delta | ThermoFisher Scientific | 150350 | |
| 10 mL serological pipet | ThermoFisher Scientific | 170361 | |
| 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339650 | |
| ABM Basal Medium, 500 mL | Lonza | CC-3187 | For primary human astrocytes. ABM+: contains all the additives from the supplement mix. ABM-:all the additives except for rhEGF and FBS |
| Accutase Cell Detachment Solution | Corning | 25-058-CI | |
| AGM SingleQuots Supplements and Growth Factors | Lonza | CC-4123 | |
| B27 supplement | Gibco | 17504-044 | for both GBM + and - medium |
| Basal Medium Eagle | ThermoFisher Scientific | 21010046 | BME-1 |
| Corning Costar TC-Treated 6-Well Plates | Sigma-Aldrich | CLS3506 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3452 | |
| D-glucose | Sigma-Aldrich | G8270 | dissolve in 50 mL of BME-1 and sterile filter before adding to the medium |
| Dulbecco's Modified Eagle's Medium/Nutrient F-12 Ham | Gibco | 21331-020 | Specific to the culture of the patient-derived spheres isolated in our lab, may vary for other glioma cell lines |
| EBM-2 growth Medium SupplementMix | PromoCell | c-39216 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Endothelial Basal Medium 2 (EBM-2) | PromoCell | c-22211 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Fetal Bovine Serum (FBS), qualified, heat inactivated, E.U.-approved, South America Origin | ThermoFisher Scientific | 10500056 | |
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| Greiner CELLSTAR 96 well plates | Sigma-Aldrich | Greiner 655090 | black polystyrene wells flat bottom (with micro-clear bottom) |
| Menzel-Gläser 0.9 cm round borosilicate Cover Slips | Thermo Scientific | 10313573 | |
| PBS tablets | Medicago | 09-9400-100 | one tablet per liter of dH2O, then sterilize the solution by autoclaving |
| Poly-D-lysine hydrobromide | Sigma-Aldrich | P6407 | |
| Recombinant Human EGF | Peprotech | GMP100-15 | for GBM+ medium |
| Recombinant Human FGF-basic (154 a.a.) | Peprotech | 100-18B | for GBM+ medium |
| Immunofluorescence | |||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| 24 mm x 60 mm microscope slide cover glass | ORSAtec | 0224601-D | |
| AlexaFluor 488 and 594 secondary antibodies | ThermoFisher Scientific | dilution: 1/500 | |
| Anti-Claudin-5 antibody | Abcam | ab15106 | dilution: 1/150 |
| Anti-GFAP antibody clone GF5 | Abcam | ab10062 | dilution: 1/150 |
| Anti-Mouse CD31 antibody Clone MEC 13.3 | BD Biosciences | 550274 | dilution 1/800 |
| Anti-SV40 T-antigen antibody | Abcam | ab16879 | dilution: 1/150 |
| Anti-Zonula Occludens-1 | Abcam | ab96587 | dilution: 1/200 |
| DAPI | TOCRIS | 5748 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680 | |
| LysoTracker Red DND-99 | ThermoFisher Scientific | L7528 | |
| Animal procedures | |||
| 10 cm curved dissecting scissors | World Precision Instruments | 14394 | |
| BD Microlance 25 G needles | Becton Dickinson | 300600 | |
| Fine Forceps (12.5 cm) | World Precision Instruments | 503283 | for tissue dissociation |
| Intramedic Polyethylene tubing PE20 | Becton Dickinson | 427406 | |
| Ketaminol vet 50 mg/mL | Intervet | Vnr511485 | Ketamine |
| Mains Powered microdrill | World Precision Instruments | 503599 | |
| Menzel-Gläser 0.5 cm round borosilicate Cover Slips | Thermo Scientific | 11888372 | |
| Micro Bulldog clamp | World Precision Instruments | 14119 | |
| Physiological saline solution | Mustela | Sterile single dose vials 20 x 5 mL / 40 x 5 mL - Medical device class | |
| Rochester-Oschner forceps | World Precision Instruments | 501709 | |
| Rompun vet 20 mg/mL | Intervet | Vnr148999 | Xylazine |
| Stereotaxic adapter | World Precision Instruments | 502063 | |
| Sugi Sponge Points | Kettenbach | 31603 | |
| Equipment | |||
| Axio Zoom.V16 fluorescence stereo zoom microscope | Carl Zeiss | ||
| FLUOstar Omega microplate reader | BMG Labtech | ||
| ORCA-Flash 4.0 digital sCMOS camera | Hamamatsu Photonics | ||
| Universal 320 tabletop centrifuge | Hettich | Cat. No. 1401 | |
| ZEISS LSM 880 with Airyscan confocal microscope | Carl Zeiss |
Riferimenti
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), a020412(2015).
- Quail, D. F., Joyce, J. A. The Microenvironmental Landscape of Brain Tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Wang, Z., Sun, H., Yakisich, J. S. Overcoming the blood-brain barrier for chemotherapy: limitations, challenges and rising problems. Anticancer Agents in Medicinal Chemistry. 14 (8), 1085-1093 (2014).
- Alkins, R. D., Brodersen, P. M., Sodhi, R. N., Hynynen, K. Enhancing drug delivery for boron neutron capture therapy of brain tumors with focused ultrasound. Neuro Oncology. 15 (9), 1225-1235 (2013).
- Alli, S., et al. Brainstem blood brain barrier disruption using focused ultrasound: A demonstration of feasibility and enhanced doxorubicin delivery. Journal of Controlled Release. 281, 29-41 (2018).
- Ashby, L. S., Smith, K. A., Stea, B. Gliadel wafer implantation combined with standard radiotherapy and concurrent followed by adjuvant temozolomide for treatment of newly diagnosed high-grade glioma: a systematic literature review. World Journal of Surgical Oncology. 14 (1), 225(2016).
- Guishard, A. F., Yakisich, J. S., Azad, N., Iyer, A. K. V. Translational gap in ongoing clinical trials for glioma. Journal of Clinical Neurosciences. 47, 28-42 (2018).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow & Metabolism. 36 (5), 862-890 (2016).
- Wang, J. D., Khafagy, el-S., Khanafer, K., Takayama, S., ElSayed, M. E. Organization of Endothelial Cells, Pericytes, and Astrocytes into a 3D Microfluidic in Vitro Model of the Blood-Brain Barrier. Molecular Pharmaceutics. 13 (3), 895-906 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Experimental Biology and Medicine (Maywood). 242 (17), 1669-1678 (2017).
- Bang, S., et al. A Low Permeability Microfluidic Blood-Brain Barrier Platform with Direct Contact between Perfusable Vascular Network and Astrocytes. Scientific Reports. 7 (1), 8083(2017).
- Wilhelm, I., Krizbai, I. A. In vitro models of the blood-brain barrier for the study of drug delivery to the brain. Molecular Pharmacology. 11 (7), 1949-1963 (2014).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Pirsko, V., et al. An Effect of Culture Media on Epithelial Differentiation Markers in Breast Cancer Cell Lines MCF7, MDA-MB-436 and SkBr3. Medicina (Kaunas). 54 (2), (2018).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Canfield, S. G., et al. An isogenic blood-brain barrier model comprising brain endothelial cells, astrocytes, and neurons derived from human induced pluripotent stem cells. Journal of Neurochemistry. 140 (6), 874-888 (2017).
- Cao, Y., et al. Hypoxia-inducible factor-1alpha is involved in isoflurane-induced blood-brain barrier disruption in aged rats model of POCD. Behavioural Brain Research. 339, 39-46 (2018).
- Abbott, N. J. Astrocyte-endothelial interactions and blood-brain barrier permeability. Journal of Anatomy. 200 (6), 629-638 (2002).
- Kinnari, P. J., et al. Tumour homing peptide-functionalized porous silicon nanovectors for cancer therapy. Biomaterials. 34 (36), 9134-9141 (2013).
- Levin, V. A. Personalized medicine in neuro-oncology. CNS Oncology. 5 (2), 55-58 (2016).
- Weathers, S. S., Gilbert, M. R. Toward Personalized Targeted Therapeutics: An Overview. Neurotherapeutics. 14 (2), 256-264 (2017).
- O'Duibhir, E., Carragher, N. O., Pollard, S. M. Accelerating glioblastoma drug discovery: Convergence of patient-derived models, genome editing and phenotypic screening. Molecular and Cellular Neuroscience. 80, 198-207 (2017).
- Kaya, M., Ahishali, B. Assessment of permeability in barrier type of endothelium in brain using tracers: Evans blue, sodium fluorescein, and horseradish peroxidase. Methods in Molecular Biology. 763, 369-382 (2011).
- Yang, S., et al. Identification of two immortalized cell lines, ECV304 and bEnd3, for in vitro permeability studies of blood-brain barrier. PLoS One. 12 (10), e0187017(2017).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4 (2), 133-146 (2003).
- Argaw, A. T., et al. Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease. Journal of Clinical Investigation. 122 (7), 2454-2468 (2012).
- Miao, Z., et al. VEGF increases paracellular permeability in brain endothelial cells via upregulation of EphA2. The Anatomical Record (Hoboken). 297 (5), 964-972 (2014).
- Heinolainen, K., et al. VEGFR3 Modulates Vascular Permeability by Controlling VEGF/VEGFR2 Signaling. Circulation Research. 120 (9), 1414-1425 (2017).
- Claesson-Welsh, L. Vascular permeability--the essentials. Upsala Journal of Medical Sciences. 120 (3), 135-143 (2015).
- Adriani, G., Ma, D., Pavesi, A., Goh, E. L., Kamm, R. D. Modeling the Blood-Brain Barrier in a 3D triple co-culture microfluidic system. Conference Proceedings - IEEE Engineering in Medicine and Biology Society. 2015, 338-341 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16(2013).
- Paatero, I., et al. Analyses in zebrafish embryos reveal that nanotoxicity profiles are dependent on surface-functionalization controlled penetrance of biological membranes. Scientific Reports. 7 (1), 8423(2017).
- Prabhakar, N., et al. Stimuli-responsive hybrid nanocarriers developed by controllable integration of hyperbranched PEI with mesoporous silica nanoparticles for sustained intracellular siRNA delivery. International Journal of Nanomedicine. 11, 6591-6608 (2016).
- Hyvonen, M., et al. Novel target for peptide-based imaging and treatment of brain tumors. Molecular Cancer Therapeutics. 13 (4), 996-1007 (2014).
- Feng, X., et al. Mammary-Derived Growth Inhibitor Targeting Peptide-Modified PEG-PLA Nanoparticles for Enhanced Targeted Glioblastoma Therapy. Bioconjugate Chemistry. 26 (8), 1850-1861 (2015).
- Nance, E. A., et al. A dense poly(ethylene glycol) coating improves penetration of large polymeric nanoparticles within brain tissue. Science Translational Medicine. 4 (149), 149rA119(2012).
- Berg, C. Quantitative analysis of nanoparticle transport through in vitro blood-brain barrier models. Tissue Barriers. 4 (1), e1143545(2016).
- Noumbissi, M. E., Galasso, B., Stins, M. F. Brain vascular heterogeneity: implications for disease pathogenesis and design of in vitro blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 12(2018).
- Heymans, M., Sevin, E., Gosselet, F., Lundquist, S., Culot, M. Mimicking brain tissue binding in an in vitro model of the blood-brain barrier illustrates differences between in vitro and in vivo methods for assessing the rate of brain penetration. European Journal of Pharmaceutics and Biopharmaceutics. 127, 453-461 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon