Method Article
Interrogando i centri germinali autoreattive individuali di fotoattivazione in un modello misto chimerico dell'autoimmunità
In questo articolo
Riepilogo
Questo protocollo descrive la generazione di chimere di midollo osseo murino misto con i centri germinali autoimmune spontanei, in cui autoreattive linfociti trasportano un reporter di proteina fluorescente verde (GFP-PA) fuse. Questo fornisce la possibilità di collegare posizione cellulare nei tessuti con analisi molecolari e funzionali a valle.
Abstract
Malattie autoimmuni rappresentare un onere significativo per la salute. Questioni fondamentali per lo sviluppo e la progressione della malattia autoimmune rimangono senza risposta. Uno dei requisiti per gli avanzamenti nella nostra comprensione dei meccanismi di malattia e dinamica cellulare è il giunto di precisione della posizione microanatomical di sottoinsiemi di cellule con analisi molecolare o funzionale a valle; un obiettivo che è stato tradizionalmente difficile da raggiungere. Lo sviluppo di fluorofori biologici stabile fuse e loro integrazione nei ceppi reporter ha recentemente permesso preciso microanatomical etichettatura e tracciabilità dei sottoinsiemi cellulare in modelli murini. Qui, descriviamo come la capacità di analizzare i linfociti autoreattivi da singoli centri germinali può contribuire a fornire intuizioni romanzo di autoimmunità, utilizzando la combinazione di un modello di romanzo chimerico dell'autoimmunità con un reporter di fuse come esempio . Dimostriamo che una procedura per la generazione mista chimere con spontanea autoreattive centri germinali popolati da linfociti che trasportano un reporter di proteina fluorescente verde fuse. Utilizzando strategie d'etichettatura in vivo, singoli centri germinali possono essere visualizzati in tessuti linfoidi espiantati e loro fotoattivazione di costituenti cellulari da microscopia del due-fotone. Fotoattivazione linfociti dai singoli centri germinali possono poi essere analizzati o ordinato Flusso cytometrically, come cellule singole o in massa e possono essere sottoposto ad ulteriori analisi molecolari e funzionali a valle. Questo approccio può essere applicato direttamente di fornire uno sguardo rinnovato nel campo dell'autoimmunità, ma la procedura per la generazione delle chimere del midollo osseo e la procedura di fotoattivazione può inoltre trovare ampia applicazione negli studi delle malattie infettive e metastasi del tumore.
Introduzione
L'incidenza della malattia autoimmune è aumentato rapidamente negli ultimi decenni, in particolare nelle società occidentali. Oggi, malattia autoimmune ranghi terzo sulla lista delle più diffuse cause di morbilità e mortalità nel mondo occidentale1. Questioni fondamentali per lo sviluppo e la progressione della malattia autoimmune rimangono senza risposta. Uno dei requisiti per gli avanzamenti nella nostra comprensione dei meccanismi di malattia e dinamica cellulare è il giunto di precisione della posizione microanatomical di sottoinsiemi di cellule con analisi molecolare o funzionale a valle. Nell'ultimo decennio, lo sviluppo di un numero di stabile fotoconvertibile, fuse o fotomodulabili fluorofori biologici e la loro integrazione in ceppi reporter ha permesso l'etichettatura microanatomical precisa e il monitoraggio del cellulare sottoinsiemi in modelli murini.
Kaede, una proteina fluorescente fotoconvertibile proveniente da un corallo pietroso, subisce fotoconversione irreversibile da fluorescenza verde a fluorescenza rossa sopra l'esposizione alla luce ultravioletta o viola2. Inizialmente impiegato per seguire il comportamento dinamico delle singole celle nello sviluppo organotipiche cervello fette3, generazione di un topo knock-in seguito consentito monitoraggio cellulare movimento in vivo di Kaede e il sistema è stato applicato all'analisi di migrazione delle cellule immuni da e verso i linfonodi4. Questo approccio è stato successivamente perfezionato con un reporter di seconda generazione5. Un reporter simile è Dendra6, che è stato recentemente utilizzato per tenere traccia di metastasi linfonodali in vivo7.
La prima proteina fuse sviluppata era una proteina fluorescente verde (GFP) progettata con una singola mutazione puntiforme (T203H), che conduce a una capacità di assorbimento molto bassa della regione di lunghezza d'onda da 450 a 550 nm8. Dopo fotoattivazione da luce viola, questa proteina fluorescente verde fuse (PA-GFP) passa il suo massimo di assorbimento da ~ 400 a ~ 500 nm, producendo un'intensità approssimativa di 100 volte aumentare quando eccitato con una lunghezza d'onda di 488 nm. La generazione di topi transgenici in cui tutte le cellule ematopoietiche express PA-GFP è permesso, per la prima volta, analisi approfondite della selezione delle cellule di B in zone anatomicamente definite chiare e scure del centro germinativo9.
Considerando che la fotoattivazione è una conversione irreversibile da uno stato non fluorescente a uno stato fluorescente e fotoconversione è un passaggio unidirezionale da una lunghezza d'onda a altra, fotomodulabili proteine sono in grado di navetta tra entrambe le condizioni10 . Questa capacità di quest'ultimo è stato recentemente sfruttata per ingegnere controllo ottico della proteina attività11.
Utilizzando il reporter di PA-GFP, abbiamo recentemente caratterizzato i repertori delle cellule di B di singoli centri germinali in un nuovo modello di autoimmunità spontanea di lupus-come12. Questo modello si basa su chimere miste con 1 parte midollare che harboring un autoreattive delle cellule di B del recettore knock-in con specificità per complessi ribonuclear-proteina (564Igi13,14) combinato con midollo osseo 2 parti da qualsiasi desiderato donatore. A circa 6 settimane post la ricostituzione condizioni omeostatiche sono raggiunti in cui autoreattive spontanea centri germinali sono presenti in milza e linfonodi cutanei. In particolare, il centro germinale della popolazione delle cellule di B è quasi esclusivamente (~ 95%) composto di cellule derivate dal vano non-564Igi, e queste cellule di B di selvaggio-tipo-derivati sono diventati autoreattive. Di conseguenza, il modello permette un approccio di 'plug-and-play' per analisi di linfociti autoreattivi centro germinale B utilizzando vari transgeni, knock-out e giornalisti. Qui, descriviamo la procedura per la generazione di chimere miste con i centri germinali popolati da linfociti che trasportano il reporter di PA-GFP autoreattive spontanea. Utilizzando strategie d'etichettatura in vivo, i centri germinali singoli possono essere visualizzati in tessuti linfoidi espiantati e loro fotoattivazione di costituenti cellulari utilizzando un microscopio a due fotoni. Fotoattivazione linfociti dai singoli centri germinali successivamente possono essere analizzati tramite flusso cytometry o ordinati fluorocromo-attivato delle cellule ordinano (FACS) e sottoposte ad ulteriori analisi molecolari e funzionali a valle. La capacità di analizzare i linfociti autoreattivi da singoli centri germinali può essere applicata direttamente per fornire le comprensioni rinnovate nel campo dell'autoimmunità, ma le tecniche e gli approcci descritti possono inoltre trovare applicazioni rilevanti negli studi di malattie infettive e le metastasi del tumore.
Protocollo
Uso di tutti gli animali conformato gli orientamenti della Comunità europea ed è stato approvato dall'ispettorato danese per la ricerca animale (2017-15-0201-01348).
1. allevamento del mouse generale e preparazione di buffer e strumenti
- Topo comune linee sotto condizioni libera (SPF) agente patogeno specifico, con monitoraggio periodico dello stato di salute secondo le linee guida standard.
- Opzionale: verificare l'assenza di centri germinali spontanei in topi ingenuo a causa di infezioni accidentale non monitorato. Questo può essere fatto sia da microscopia di immunofluorescenza (presenza di strutture di centro germinativo) o flusso cytometry (frequenza delle cellule centro germinale B) come descritto in precedenza12.
Nota: Entrambe le femmine o i maschi possono essere utilizzati. In genere, è ideale per sesso partita donatori e beneficiari, come una mancata corrispondenza di sesso teoricamente può condurre a alloreactivity verso l'antigene-Y maschio dalla femmina destinatari/donatori15. - Uso CD45.1 destinatari (B6. SJL -Ptprcun Pepcb/BoyJ) a circa 6-10 settimane di età. Utilizzare 564Igi (B6. Cg-Ightm1 Tik (Igh564)Igktm1 Tik (Igk564)/j) e PA-GFP (donatori di B6.Cg-Tg(UBC-PA-GFP)1Mnz/J) a 6-12 settimane di età.
- Sterilizzare gli strumenti chirurgici (dritto bene forbici e pinze Dumont #5 e #7) in autoclave loro secondo linee guida sulla sterilizzazione di routine.
- Preparare 500 mL di tampone di midollo osseo (BM) contenente tampone fosfato salino (PBS), 2% siero bovino fetale (FBS), 1 millimetro di acido etilendiamminotetraacetico (EDTA) a pH 7,4. Per preparare il tampone di BM, aggiungere 10 mL di inattivati (1 ora in un bagno di acqua di 56 ° C per inattivare il complemento) FBS e 1,25 mL di una soluzione di EDTA 400 mM (regolata a pH 7,4) a 500 mL di PBS, pH 7.4 e mescolare bene. Filtrare il buffer utilizzando una beuta per filtrazione a 0,2 µm.
- Preparare 10 mL di tampone di lisi di globuli rossi (RBC) (155 mM NH4Cl, 12mm NaHCO3, 0.1 mM EDTA) diluendo 1 mL di uno stock di 10 x 10 ml di volume totale con acqua grado reagente. Preparare 50 mL di PBS con 5 mM EDTA, pH 7,4.
2. creazione di chimere misto del midollo osseo
- Irradiazione di destinatari (giorno 0)
- Collocare i destinatari del midollo osseo CD45.1 in un contenitore appropriato di irradiazione e irradiare con 1.100 Rad in un irradiatore di gamma.
Nota: Fonti di irradiazione alternativo possono essere utilizzati. Indipendentemente dall'origine, la dose/tempistica deve essere ottimizzato per ottenere massima myeloablative effetto con danno di tessuto minimo collaterale per gli animali. - Posto sull'acqua antibiotico ad libitum (1 mg di sulfadiazin e 0,2 mg di trimetoprim/mL di acqua potabile).
- Collocare i destinatari del midollo osseo CD45.1 in un contenitore appropriato di irradiazione e irradiare con 1.100 Rad in un irradiatore di gamma.
- Estrazione delle ossa (giorno 1)
- Anestetizzare i donatori di midollo osseo 564Igi di flusso continuo di 4% isoflurane in aria ed eutanasia di dislocazione cervicale. Spray giù i donatori con etanolo e metterli sui rilievi chirurgici sterili nella cappa flusso. Continuare a lavorare mantenendo condizioni di sterilità, utilizzando attrezzature e tamponi sterili.
- Per estrarre il femore e la tibia, prima di fare un'incisione intorno alla caviglia e di estendere verso l'alto fino all'anca utilizzando forbici dritto bene. Utilizzando una pinza per impieghi gravosi o pollice e indice, tirare la pelle e fuori la gamba verso il corpo. Allo stesso modo di tirare la pelle verso il basso e il piede.
- Saltar fuori le articolazioni di ginocchio e caviglia afferrando la gamba all'anca e tirando con forza il piede. Procedere per rompere la caviglia congiunta e tirare il piede verso il corpo mentre si tiene tibia, quindi stripping i tendini e i muscoli fuori della tibia.
- Rompere il ginocchio congiunta per rilasciare la tibia e allo stesso modo questo tirare verso il corpo mentre si tiene femore, quindi stripping tendini e muscoli fuori il femore. Fare un'incisione all'articolazione dell'anca e tagliare i tendini, quindi estrarre il femore dalla presa dell'anca. Ripetere i passaggi 2.2.2 – 2.2.4 per l'arto controlaterale.
- Pulire accuratamente le ossa strofinandoli con un tovagliolo di carta grossolana al fine di rimuovere tutti i restanti muscolo ed il tessuto connettivo. Risciacquateli nel buffer di BM ghiacciata prima di trasferirli infine al buffer di BM freddo fresco sul ghiaccio con un paio di pinze Dumont #7. Ripetere il passaggio 2.2 per i donatori di PA-GFP.
Nota: Il numero di cellule del midollo osseo da un donatore singolo varia secondo il sesso e l'età. Scala il numero dei donatori secondo rapporti di midollo osseo ingresso desiderato e numeri e il numero di destinatari desiderato. Se i donatori sono scarsi, gli arti anteriori possono essere inclusi per l'estrazione del midollo osseo. Questo in genere produce un ulteriore 1/3 a ½ delle cellule ottenute da arti posteriori. In genere, ovunque da 50 milioni di cellule possono essere recuperati per donatore, a seconda di età, sesso, sfondo e se solo posteriori o hind sia gli arti anteriori sono inclusi.
- Estrazione delle cellule del midollo osseo
- Preparare la Malta di risciacquo nel buffer di BM ghiacciata. Svuotare il buffer di risciacquo e utilizzare un pipettatore automatico elettrico con una pipetta sierologica di 10 mL per aggiungere 10 mL di buffer di BM ghiacciata fresca.
- Trasferire le ossa da donatori di 564Igi nel mortaio usando un paio di pinze Dumont #7 e usate il pestello per schiacciare e macinare le ossa per rilasciare il midollo osseo. Aspirare l'Estratto di midollo osseo con una pipetta sierologica 10ml e passarlo attraverso un setaccio di cella di 70 µm in una provetta da 50 mL su ghiaccio.
- Aggiungi un ulteriore 10 mL di tampone di BM ghiacciata fresca nel mortaio e ripetere l'operazione per garantire il completo recupero delle cellule. Rimuovere materiale osseo del mortaio con un tovagliolo di carta, smaltire in modo appropriato e sciacquare il mortaio attentamente con etanolo al 70%, seguita da buffer di BM. Ripetere il passaggio 2.3 per il gruppo di donatori di midollo osseo di PA-GFP.
- Contando le cellule del midollo osseo
- Usando una micropipetta, mettere una goccia contenente 40 µ l di tampone di lisi RBC su un pezzo di pellicola di plastica paraffina. Capovolgere la provetta del midollo osseo di 564Igi un paio di volte e prendere un 10 µ l aliquota utilizzando una micropipetta. Mescolare con il 40 µ l di goccia di RBC lysis buffer.
- Successivamente aggiungere 50 µ l di Trypan blu (0,4% in soluzione acquosa) per la discesa. Immediatamente caricare 10 µ l della miscela risultante in un emocitometro Burker-Türk e conteggio al microscopio. Calcolare il numero di cellule per mL, utilizzando le 10 x fattore di diluizione totale. Confermare la vitalità cellulare adeguata > 90%. Ripetere il passaggio 2.4 per il gruppo di donatori di midollo osseo di PA-GFP.
- Preparazione di sospensioni di donatore
- Basato sui conteggi ottenuti nel passaggio 2.4 e il numero di destinatari desiderato, calcolare il volume del donatore di midollo osseo da ciascuno dei gruppi di due donatori da miscelare in provetta della mix di donatore.
Nota: ad esempio, per impostare un gruppo di 1:2 misto 564Igi:PA-chimere GFP con 6 CD45.1 destinatari: ogni destinatario richiede totale di cellule del donatore di 20 x 106 , 564Igi parte 1 e 2 parti di PA-GFP. Così, questo richiede 6 x 1/3 x 20 x 106 = 40 x 106 564Igi cellule del donatore e 6 x 2/3 x 20 x 106 = 80 x 106 PA-GFP cellule del donatore. - Mescolare la quantità appropriata di PA-GFP e 564lgi del midollo del donatore in una provetta conica da 50 mL. Centrifugare la miscela del midollo osseo a 200 x g e a 4 ° C per 10 minuti utilizzando un rotore oscillante.
- Decantare il supernatante e risospendere le cellule in buffer di BM ghiacciato con una densità di 1 x 108 cellule per mL. Trasferimento in una microcentrifuga da 1,5 mL preraffreddato sul ghiaccio.
- Basato sui conteggi ottenuti nel passaggio 2.4 e il numero di destinatari desiderato, calcolare il volume del donatore di midollo osseo da ciascuno dei gruppi di due donatori da miscelare in provetta della mix di donatore.
- Ricostituzione del midollo osseo destinatari con donatori midollo osseo
- Anestetizzare destinatari mediante induzione con flusso continuo di 4% isoflurane in aria, seguita da manutenzione al 3,75%. Verificare assenza di riflesso di punta-pizzico adeguato piano di anestesia.
- Scorri attentamente le provette con il mix di midollo osseo per garantire un'adeguata risospensione delle cellule del midollo osseo, quindi aspirare 200 µ l di miscela di midollo osseo (~ 20 x 106 cellule), in un 0,3 mL, 30 gauge siringa da insulina.
- Posizionare il destinatario su un lato, stendere delicatamente la pelle sopra e sotto l'occhio per un po' 'pop l'occhio fuori' e inserire delicatamente la punta della siringa circa ad un angolo di 30° nella parte anteriore della cavità oculare, avendo cura di evitare l'occhio e il tessuto circostante. Quando la punta dell'ago è ritenuta per toccare l'osso sottolineando la cavità oculare, retrarre leggermente (~0.5 mm) e iniettare lentamente il midollo osseo di donatori utilizzando una pressione costante.
Nota: non ci dovrebbe essere alcun non sanguinamento, nessuna perdita di liquido e non al rigonfiamento molto minore dell'occhio all'iniezione. - Restituire il mouse alla gabbia con acqua antibiotico ad libitum e verificare il recupero immediato dalla procedura. Ripetere il passaggio 2.6 per ogni destinatario.
Nota: Iniezione in vena caudale può essere utilizzato anziché retroorbital iniezione con risultati simili, tuttavia, nelle nostre mani è notevolmente più lento, che può essere una preoccupazione quando si lavora con grandi gruppi di destinatari. Recupero di animali anestetizzati direttamente sulla biancheria da letto di piccolo diametro dovrebbe essere evitato come esso comporta un rischio di aspirazione e asfissia
- Rimuovere l'acqua antibiotico (giorno 14)
- Rimuovere l'acqua antibiotico dagli strisciamenti e sostituire con acqua potabile normale.
3. controllando la ricostituzione di successo e verificare appropriato grado di chimerismo (6 settimane)
-
Retroorbital sanguinamento delle chimere e controlli
- Preparare i tubi di raccolta sangue etichettatura 1,5 mL microcentrifuga secondo numeri di destinatari orecchio e aggiungendo 50 µ l di PBS contenente 5mm EDTA.
Nota: Includere controlli appropriati per PA-GFP, CD45.1 e CD45.2 e 9 11 (idiotipo). Questo può essere fatto includendo 1 PA-GFP + mouse, 1 CD45.1 mouse, 1 mouse di B6 e 1 564Igi mouse. - Anestetizzare topi e verificare adeguato piano di anestesia come descritto al punto 2.6.1. Appoggiare la chimera su un lato, stendere delicatamente la pelle sopra e sotto l'occhio per un po' 'pop l'occhio fuori'.
- Inserire delicatamente un avvolto BoPET eparinizzato tubo capillare (60 µ l di volume interno) circa ad un angolo di 40° nella parte anteriore della cavità oculare, avendo cura di non danneggiare l'occhio e il tessuto circostante. Torsione/ruotare delicatamente il tubo fino a quando comincia a riempirsi di sangue.
- Permettere al sangue di passivamente riempire la provetta per azione capillare, fino a quando è quasi completamente pieno, quindi ritrarre il tubo e inserirlo nel tubo di raccolta pre-etichettate corrispondente, mentre allo stesso tempo rilassante immediatamente la presa intorno all'occhio per consentire all'occhio di stabilirsi in posizione. Lo spurgo dovrebbe smettere immediatamente.
- Assicurarsi che il tubo capillare è svuotato nella provetta di raccolta e gettarlo in un contenitore di sharps. Tappare la provetta e invertire tre volte a garantire la completa miscelazione con l'EDTA/PBS.
- Restituire il mouse alla gabbia e verificare il recupero immediato dalla procedura. Ripetere il passaggio 3.1 per ogni mouse sperimentali e i controlli appropriati.
Nota: Fare attenzione quando si utilizza la puntura della vena sottomandibolare come questo metodo può rappresentare un rischio maggiore per l'infezione accidentale nei destinatari irradiati prima questi sono completamente ricostituiti. Inoltre, nella nostra esperienza, troviamo che il volume di sangue raccolto e la quantità di sangue perdita a causa di eccessivo sanguinamento è più variabile. Entrambe queste considerazioni sono importanti, come le chimere del midollo osseo sono sensibili nella fase di ricostituzione, prima che il nuovo midollo osseo è completamente innestato ed ematopoiesi ha ripreso i livelli normali.
- Preparare i tubi di raccolta sangue etichettatura 1,5 mL microcentrifuga secondo numeri di destinatari orecchio e aggiungendo 50 µ l di PBS contenente 5mm EDTA.
-
Purificazione di sangue periferico (PBMC) di cellule mononucleate
- Dopo il completamento della raccolta del sangue, brevemente (10 s) Centrifugare le provette a bassa velocità (< 200 x g) per raccogliere il diluito stabilizzato sangue nella parte inferiore dei tubi.
- Riempire una siringa da 10 mL con il mezzo di separazione del linfocita e attaccare un ago da 18 G. Inserire l'ago verso il basso del tubo primo e il campione di sangue con 1 mL di mezzo di separazione del linfocita di ecc. Attentamente, ritirare l'ago e pulirlo con un tovagliolo di carta per evitare contaminazioni del campione successivo.
- Procedere attraverso tutti i campioni, quindi centrifugare per 25 minuti a 800 x g, a temperatura ambiente in una centrifuga basculante, con i freni impostati basso/off.
- Preparare una serie di corrispondentemente etichettati 1,5 mL microcentrifuga contenente 1 mL di tampone di BM ghiacciata ogni.
- In seguito a centrifugazione, per ciascun campione, inserire lo strato superiore (plasma) con una micropipetta 200 µ l e aspirare lo strato di cellule mononucleari (MNC) appena sopra l'interfaccia. Trasferire le cellule nella provetta corrispondentemente etichettata contenente 1 mL di tampone di BM. Chiudere il coperchio e capovolgere per mescolare. Scartare il tubo di mezzo-contenente separazione dei linfociti.
- Procedere attraverso tutti i campioni e poi Centrifugare a 200 x g per 5 min, 4 ° C in un rotore oscillante. Aspirare e scartare il surnatante e risospendere il pellet in 200 µ l di tampone di BM ghiacciata. I campioni sono ora pronti per la macchiatura dell'anticorpo e l'analisi cytometric di flusso.
-
Macchiando per valutazione cytometric di flusso
Nota: Consigliato pannello: CD45.1-FITC, B220-PerCP-Cy 5.5, 9D 11-A568, CD45.2-APC. Non attivato PA-GFP è rilevato nel Pacifico canale arancio (o equivalente). Nessun colorante di attuabilità è necessaria come la separazione dei linfociti si sbarazza di cellule morte.- Usando una micropipetta, aggiungere 100 µ l della sospensione di cellule per pozzetto per ogni campione di chimera e controllo, di una piastra a 96 pozzetti.
- Per i 3 campioni di controllo non-PA-GFP, piscina i restanti 100 µ l di ciascun campione (300 µ l totale). Aggiungere 50 µ l di questo materiale per il controllo non macchia e pozzetti di singolo controllo macchiato. Per il controllo di singolo-macchiate di PA-GFP inoltre aggiungere 50 µ l di campione di PA-GFP non colorato.
- In ciascun pozzetto, aggiungere 100 µ l di tampone (senza macchia), singolo anticorpo (controlli di compensazione singolo-macchiato, eccetto per il controllo di compensazione PA-GFP) o anticorpi mix (campioni). Incubare in ghiaccio per 20 minuti.
- Centrifugare a 200 x g per 5 minuti a 4 ° C. Rovesciare il buffer. Aggiungere 200 µ l di tampone di BM in ciascun pozzetto e centrifugare nuovamente per lavare. Scorri il buffer e risospendere le cellule in ogni pozzetto in 200 µ l di tampone di BM. I campioni sono pronti per l'analisi su un citometro a flusso (Figura 1).
Nota: Le risposte del centro germinale nelle chimere possono essere analizzate in qualsiasi punto da 6 settimane in poi.
4. In vivo di etichettatura del seno subcapsular/zona marginale per aiutare l'identificazione dei singoli centri germinali
Nota: Il presente protocollo è dimostrato per grassatore/hock (popliteal di linfonodo) e le iniezioni endovenose (i.v., milza), ma può essere variato secondo il sito di destinazione.
-
Iniezione di grassatore bilaterali per l'etichettatura di popliteal di linfonodo
- Anestetizzare i topi come descritto al punto 2.6.1.
- In una provetta da microcentrifuga da 1,5 mL, diluire 2 µ l di anticorpo CD169 anti-topo di PE-etichettato ratto in 18 µ l di PBS, pH 7,4. Posizionare due gocce di 10 µ l della miscela su un pezzo di pellicola di plastica paraffina. Aspirare ogni goccia usando una siringa da insulina 0,3 mL con un ago da 30 gauge.
- Iniettare il 10 µ l di etichettatura mix in entrambi il grassatore (entrare con l'ago a un angolo di 5-10° nella parte centrale del grassatore, prossimale fin dall'inizio delle dita del piede e inserire l'ago circa a metà strada verso il tallone) o il garretto (entrare con l'ago a un 5 - 10 ° angolo appena sopra il tallone e inserire circa a metà della sua lunghezza lungo l'asse del tendine di Achille in direzione verso il ginocchio). Restituire i topi nelle loro gabbie e attendere circa 15 minuti prima di procedere con il passaggio 5.
-
Iniezione endovenosa per l'etichettatura di milza
- Anestetizzare i topi come al punto 2.6.1.
- In una provetta da microcentrifuga da 1,5 mL, diluire 10 µ l di anticorpo CD169 anti-topo di PE-etichettato ratto in 90 µ l di PBS. Aspirare la miscela con una siringa da insulina 0,3 mL.
- Eseguire retroorbital i.v. iniezione secondo passo 2.6. Restituire i topi nelle loro gabbie e attendere circa 15 minuti prima di procedere con il passaggio 5.
Nota: come alternativa all'isoflurano, iniezione anestetica come mix di chetamina/xilazina può essere utilizzato; Tuttavia, questo in genere porta a tempi di recupero più lenti. Poiché il drenaggio linfatico è generalmente influenzato dal movimento del muscolo scheletrico, questo dovrebbe portare a tempo di drenaggio più lento.
5. un' milza e linfonodi e preparando per fotoattivazione
-
Preparare una camera di imaging e fotoattivazione bifacciale
- Rimuovere lo stantuffo da una siringa da 20 mL e retro-carico con grasso per vuoto inserendo l'ugello di un tubo di grasso per vuoto. Quindi rimuovere lo stantuffo da una siringa da 5 mL e utilizzare la siringa da 20 mL per retro-carico con grasso per vuoto.
- Utilizzare la siringa 5ml caricato vuoto-grasso per preparare un imaging e la camera di fotoattivazione posizionando un coprioggetto quadrato su una superficie piana e tracciatura lungo i bordi del coprivetrino con grasso per vuoto (circa 1-2 mm dai bordi).
Nota: fare attenzione a evitare la contaminazione di grasso per vuoto di tutte le superfici che successivamente vengono a contatto con la lente del microscopio, come microgocce di vuoto grasso emulsionato in acqua immersione possono contaminare la lente. - Riempire la camera a vuoto grasso coprivetrino con buffer di BM ghiacciata e posto su una superficie piana fredda.
-
Raccolta dei linfonodi e milza
- Eutanasia in vivo etichettato mouse chimerico per essere analizzati secondo il punto 2.2.1. Spray giù la carcassa con etanolo al 70%.
- Per accedere il linfonodo popliteal, usare le forbici dritto bene per fare un'incisione nella pelle appena sotto la fossa di ginocchio e prorogare il taglio verso l'alto lungo la linea del tendine del ginocchio quasi fino al giunto dell'anca. Utilizzando Dumont #5 o 7 # forcipe, tirare ciascuna delle falde esposte verso l'esterno della pelle, per esporre il tessuto nel fossa popliteal (Figura 2A).
- Con attenzione usando un paio di pinze Dumont #5, immettere il fossa popliteal appena mediale alla vena poplitea e sezionare aprire il grasso inserimento e aprendo e chiudendo il forcipe lungo l'asse della gamba, al fine di esporre il linfonodo popliteal sottostante.
- Pop il linfonodo fuori il fossa pizzicando il muscolo quadricipite dal lato anteriore prossimale al ginocchio usando il pollice e il dito indice (Figura 2B). Afferrare il linfonodo da sotto con il forcipe per liberarlo dal tessuto circostante (Figura 2) e poi metterlo nella camera di grasso per vuoto preparata al punto 5.1.
- Ripetere i passaggi 5.2.2 – 5.2.4 per l'arto controlaterale. Linfonodi multipli può essere montati in una sola camera, se lo si desidera.
- Infine chiudere la camera posizionando un secondo vetrino coprioggetto sopra il bordo di grasso per vuoto e premendo delicatamente verso il basso, avendo cura di estrudere tutte le bolle d'aria.
Nota: Alcuni del buffer può essere spinto fuori pure, ma il grasso per vuoto dovrebbe formare una guarnizione a tenuta, impedendo la fuoriuscita di liquido (Figura 2D). I linfonodi sono ora in una camera di imaging bifacciale. - Per accedere alla milza, usando un paio di forbici dritto bene fare un'incisione attraverso la parete addominale sul lato sinistro del mouse, prossimale alla linea mediale anteriore, appena sotto la gabbia toracica e si estendono intorno al corpo di linea ascellare posteriore. La punta della milza deve essere visibile (Figura 3A).
- Tirare fuori la milza con un paio di pinze Dumont #7 e tagliare le adesioni sul lato inferiore per rilasciarlo. Utilizzare il paio di forbici dritto bene taglio ~ 2 mm spessore, sezione trasversale, fette.
- Mettete la fetta nella camera di grasso per vuoto preparata al punto 5.1. Più sezioni di milza possono essere montati in una sola camera, se lo si desidera.
- Infine chiudere la camera posizionando un secondo vetrino coprioggetto sopra il bordo di grasso per vuoto e premendo delicatamente verso il basso, avendo cura di estrudere tutte le bolle d'aria. Tenere tutti gli alloggiamenti imaging sul ghiaccio in ogni momento, fatta eccezione per durante l'imaging e la fotoattivazione.
Nota: Alcuni del buffer può essere spinto fuori pure, ma il grasso per vuoto dovrebbe formare una guarnizione a tenuta, impedendo la fuoriuscita di liquido. Le fette di milza sono ora in una camera di imaging su due lati (Figura 3B).
6. fotoattivazione
-
Identificazione dei singoli centri germinali
Nota: Questo protocollo è descritto per la milza, ma è completamente analogo per i linfonodi.- Posizionare la camera di imaging sul tavolino del microscopio. Utilizzando una pipetta di trasferimento in plastica di 3,5 mL, mettere una goccia di acqua distillata in cima la lamella superiore e più basso l'obiettivo fino al punto di contatto. Concentrarsi sulla parte superiore del tessuto utilizzando la luce trasmessa.
- Passare alla modalità scuro e due-fotone eccitazione e sintonizzare il laser a 940 nm.
Nota: Con il set di filtri appropriati, questa lunghezza d'onda consente eccitazione e rilevamento della seconda generazione di armoniche in strutture contenenti collagene associate con vasi principali e gli elementi strutturali, come pure il CD169-PE iniettato in fase 4.2, che identifica la zona marginale. Tuttavia, l'eccitazione di 940 nm non non photoactivate PA-GFP. - Localizzare singole aree bianco-polpa (delimitate dalla macchiatura CD169-PE) vicino alla superficie del tessuto e la seconda generazione di armoniche connessa con l'arteriola centrale per identificare la guaina linfoide periarteriolar (PALS, zona a cellula T). Nella zona fra il PALS e la zona marginale, cercare la presenza di altamente autofluorescent, attivati macrofagi tingible del corpo (segnale forte autofluorescent in tutti i canali, blob-come l'apparenza con vacuoli scuri) (Figura 4A).
Nota: Se necessario, a causa di orientamento indesiderabile del tessuto, la camera di imaging possa essere capovolte e imaging possono essere eseguite dalla direzione opposta. - Basato su tratti distintivi identificati al punto 6.1.3., disegnare un'area di interesse che identifica un'area singola centro germinale. Impostare una Z-pila di intorno 100-150 µm profondità, a partire dalla superficie del tessuto e utilizzando una dimensione di passaggio di ~ 3 µm.
- Passare alla lunghezza d'onda di eccitazione di 830 nm. Spegnere o dim tutti i canali per impedire il photodamage a rivelatori (come potenza del laser e fluorescenza di uscita in genere è notevolmente superiore a questa lunghezza d'onda) e poi 'immagine' lo stack.
Nota: Le impostazioni specifiche, come laser potenza e pixel tempo di sosta, dipendono la profondità nel tessuto, il tessuto specifico utilizzato e il sistema di imaging. Ogni applicazione deve essere ottimizzato per il sistema di imaging specifico utilizzato. Mentre è essenziale per ottenere la fotoattivazione efficiente in tutto lo stack, cura dovrebbe essere presa di photodamage non le cellule. - Tornare alla lunghezza d'onda di eccitazione di 940 nm e riaprire i canali. Scansione attraverso lo stack per accertare la fotoattivazione efficiente in tutto (Figura 4B) e assenza di photodamage (diffuso, non delimitata da cellulare segnale PA-GFP, macchie scure o alto-grado autofluorescenza nell'area di fotoattivazione).
- Procedere a photoactivate tutti i tessuti interessati nella camera di imaging, quindi restituirlo prontamente al ghiaccio fino al procedimento successivo. Procedere con la fotoattivazione di ulteriori alloggiamenti imaging.
Nota: Tessuto explanting, montaggio e particolarmente fotoattivazione sono processi che richiede tempo, ma il tempo totale dovrebbe essere limitato a 4-6 ore, per evitare una diminuzione drammatica nell'attuabilità delle cellule.
7. il recupero e l'analisi delle cellule di fotoattivazione
-
Estrazione dei linfociti dai linfonodi e milza
- Per ogni campione di fotoattivazione, preparare un tubo del microcentrifuge di conseguenza con etichetta 1,5 mL contenente 500 µ l di tampone di BM sul ghiaccio. Includono i campioni da un controllo non-PA-GFP e un mouse di PA-GFP non attivato. Questo è possibile inserendo un controllo di B6 e un mouse di controllo PA-GFP.
- Rimuovere con cautela il coprioggetto superiore dalla camera di imaging, avendo cura di mantenere la posizione dei campioni (se campioni multipli sono presenti in una sola camera) e ogni campione viene posto nella sua rispettiva provetta.
- Utilizzando un omogeneizzatore pestello, spremere il tessuto e torcere il pestello nel tubo per rilasciare i linfociti. Usando una micropipetta, aspirare il lisato e filtrare attraverso un colino di cella di 70 µm in un tubo del microcentrifuge fresco, pre-raffreddata 1,5 mL. Per i campioni di linfonodo, passare al punto 7.1.5.
- Per i campioni di milza, centrifugare a 200 x g per 5 min a 4 ° C in un rotore oscillante. Eliminare il supernatante e risospendere il pellet in 200 µ l di tampone di lisi RBC. Incubare per 5 min a temperatura ambiente, quindi aggiungere 800 µ l di tampone di BM ghiacciata e procedere al passo 7.1.5.
- Centrifugare a 200 x g per 5 min a 4 ° C in un rotore oscillante. Scartare il surnatante e risospendere in 200 µ l di tampone di BM ghiacciata. I campioni sono ora pronti per la macchiatura per valutazione cytometric di flusso e l'ordinamento, se lo si desidera.
-
Macchiando per valutazione cytometric di flusso
Nota: Consigliato pannello: CD169-PE, B220-PerCP-Cy 5.5, 9D 11-A647, CD38-PE-Cy7, risolvibile attuabilità tintura Efluor-780, GL7-Pacific Blue. Non attivato PA-GFP è rilevato nel Pacifico canale arancio (o equivalente). Photoactivated PA-GFP è rilevato nel canale di GFP. Eventuali co-purificati macrofagi (che possono o non possono essere stato in vivo etichettati con CD169-PE) possono essere esclusi dalla macchiatura con CD169-PE e usando questo come un cancello di dump.- Usando una micropipetta, aggiungere 100 µ l della sospensione di cellule per pozzetto per ogni campione di chimera e controllo, in una piastra a 96 pozzetti.
- Per i campioni di controllo di B6, aggiungere 50 µ l di questo materiale per il controllo non macchia e pozzetti di singolo controllo macchiato. Per il controllo di singolo-macchiato non attivato PA-GFP inoltre aggiungere 50 µ l di campione di PA-GFP non attivati non colorato. Per il controllo di singolo-macchiato attivato del PA-GFP, piscina il restante materiale per tutti i campioni di fotoattivazione.
- In ogni pozzetto, aggiungere 100 µ l di tampone (senza macchia e controlla la compensazione PA-GFP), singolo anticorpo (controlli di compensazione tinto singolo) o anticorpi mix (fotoattivazione campioni). Incubare in ghiaccio per 20 minuti.
- Centrifugare a 200 x g per 5 minuti a 4 ° C. Rovesciare il buffer. Aggiungere 200 µ l di tampone di BM in ciascun pozzetto e centrifugare nuovamente per lavare. Scorri il buffer e risospendere le cellule in ogni pozzetto in 200 µ l di tampone di BM. I campioni sono pronti per l'analisi su un citometro a flusso o selezionatore (risultati rappresentativi nella Figura 5).
Risultati
Generazione delle chimere misto del midollo osseo
Il presente protocollo raggiunge robustamente chimere misto del midollo osseo con un chimerismo vicino-completa nel compartimento delle cellule di B come illustrato nel risultato rappresentativo nella Figura 1 (per il significato statistico consultare 12). I numeri di normalizzata delle cellule di B serotyping rivela a 6 settimane post ricostituzione (Figura 1A), con una bassa frequenza di 9 11 (idiotipo) linfociti B circolanti positivi derivante dal vano 564Igi (Figura 1B). All'interno il cancello del linfocita totale, c'è una bassa frequenza di cellule derivanti dal destinatario residuale, ~ 6% CD45.1 (Q1), che indica un grado complessivo di chimerismo ~ 94% (Figura 1). All'interno il donatore comparto (CD45.1-, Q4 + Q3) il rapporto di 564Igi (Q4) PA-GFP (Q3) è di circa 23%-77%. Questo leggermente inferiori a ingresso 33% al 66% rapporto si spiega con la pesante selezione negativa delle cellule B derivato dal vano 564Igi 12. Come visto in Figura 1, c'è praticamente completo chimerismo nel compartimento delle cellule di B (99,9% CD45.1-) e dominanza PA-GFP derivanti dal midollo osseo delle cellule di B (Q3), che è una conseguenza della pesante selezione negativa delle cellule di B 564Igi-derivate.
Raccolta dei tessuti, elaborazione e valutazione cytometric di flusso
Figura 2 e Figura 3 illustrano le procedure per e risultati di explanting appena isolato fette di milza e linfonodi. Figura 4 presenta un risultato rappresentativo per l'etichettatura in vivo e la fotoattivazione di un'area singola centro germinale in una fetta di milza espiantati. Come si può vedere (Figura 4A), l'etichettatura in vivo con CD169-PE robustamente ha etichettato la zona marginale (rosso, indicato da "MZ"). Il secondo segnale di armoniche è ravvisabile in elementi strutturali che contengono collagene e vasi principali (blu), tra cui l'arteriola centrale della guaina linfoide periarteriolar (PALS). Altamente autofluorescent, macrofagi tingible del corpo attivati sono associati con attività centro germinale (frecce). Presi insieme, l'identificazione della zona marginale, PALS e macrofagi tingible del corpo, permette l'identificazione di una regione di interesse che probabilmente contiene un singolo centro germinale. La regione di interesse è la fotoattivazione come illustrato in Figura 4B. Come dimostrato, fotoattivazione è microanatomically precisa9, producendo un'area definita di attivazione. I risultati presentati inoltre servono come conferma di un'alta densità di PA-GFP + linfociti nella ricostituita chimere e presenza di centri germinali spontanei. A valle del flusso cytometric valutazione ulteriore conferma numeri di vano normalizzata delle cellule di B (Figura 5), una popolazione di centro germinativo spontanea (Figura 5E) e la presenza di un sottoinsieme delle cellule centro germinale B che sono stati fotoattivazione (Figura 5F).
Quindi, il presente protocollo presenta un metodo affidabile per generazione di chimere misto del midollo osseo con spontanea autoreattive centri germinali, che sono composti principalmente di derivate cellule wild-type B, portando un reporter di fuse. Questo consente a sua volta per analisi successive dei singoli centri germinali (panoramica grafica nella Figura 6).
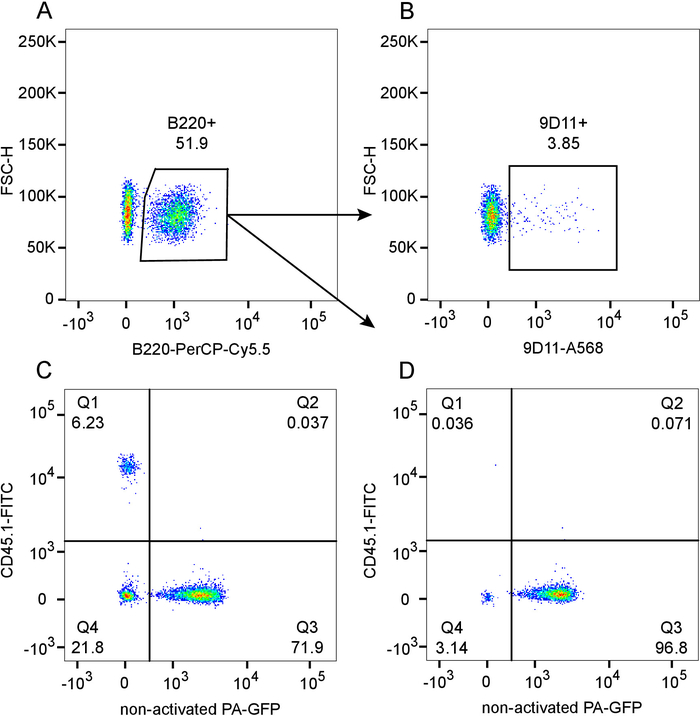
Figura 1: Flow cytometric valutazione del grado di chimerismo nel sangue di 564Igi (CD45.1-, PA - GFP-): PA-GFP (CD45.1-, PA-GFP +) misto chimere in irradiati letalmente CD45.1 destinatari (CD45.1 +, PA - GFP-), 6 settimane dopo la ricostituzione. A) Plot Mostra gating B220 + delle cellule di B, pre-gated sui linfociti di singoletto. B) Subgate da trama A, mostrando 9 11 + (idiotipo) frequenza all'interno della popolazione delle cellule di B. C) trama di PA-GFP contro CD45.1, pre-gated sui linfociti di singoletto. D) trama di PA-GFP versus CD45.1 nella subgate delle cellule di B da trama r. Clicca qui per visualizzare una versione più grande di questa figura.
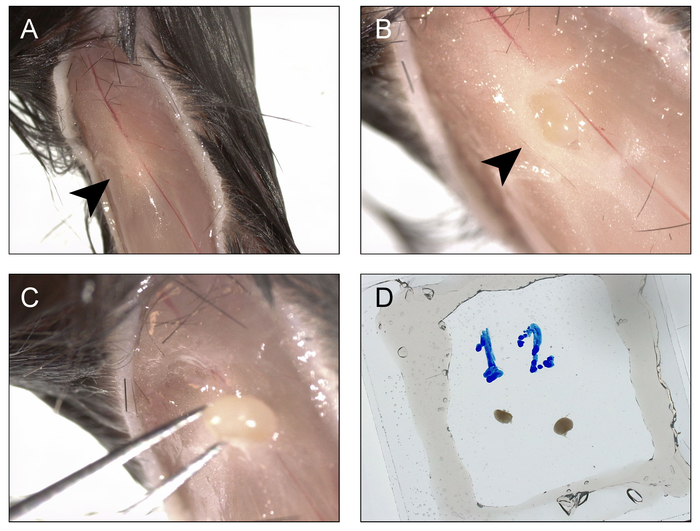
Figura 2: Procedure per la raccolta e montaggio poplitea linfonodi per imaging e fotoattivazione. A) un'incisione è fatta sotto il ginocchio ed esteso fino all'anca, e i bordi sono rientrati ai lati, al fine di esporre la fossa poplitea (punta di freccia). B) la supraclavicle sovrastante è aperto e il linfonodo popliteal è esposta (punta di freccia). C) il linfonodo popliteal è estratto dal fossa. D) la procedura è ripetuta per l'arto controlaterale ed entrambi i nodi sono montati in un alloggiamento di vuoto/vetrino coprioggetti-grasso bifacciale riempito con buffer di BM. Clicca qui per visualizzare una versione più grande di questa figura.
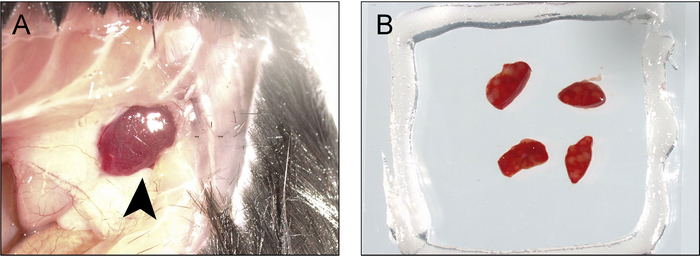
Figura 3: procedura per la raccolta e la milza per l'imaging e la fotoattivazione di montaggio. Un) un'incisione è fatta presso la linea mediale anteriore appena sotto la gabbia toracica ed estesa intorno al corpo di linea ascellare posteriore e i bordi sono retratti per esporre la punta della milza (punta di freccia). B) la milza è retratto e asportata e tagliare a fette sottili (1-2 mm), che sono montati in un alloggiamento di vuoto/vetrino coprioggetti-grasso bifacciale riempito con buffer di BM. Clicca qui per visualizzare una versione più grande di questa figura.
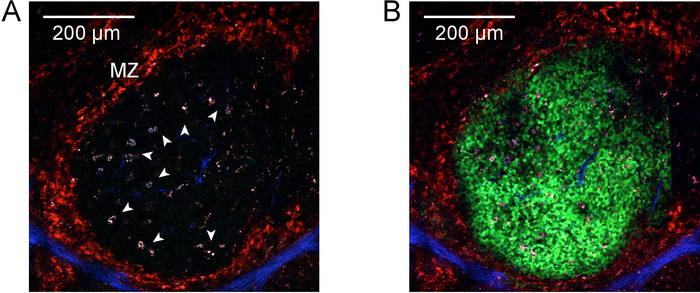
Figura 4: Fotoattivazione. A) due-fotone micrografo di un centro germinale nella milza prima fotoattivazione. Etichettatura in vivo con anti-CD169-PE è stato effettuato prima della raccolta della milza per etichettare la zona marginale (rosso, indicato da "MZ"). Le armoniche seconda segnale è apparente in strutture contenenti collagene associate con il tegumento e vasi principali (blu). Punte di freccia identificare altamente autofluorescent, macrofagi tingible del corpo attivati connessi con attività di centro germinativo. Imaging è stata eseguita a eccitazione di 940 nm. La barra della scala in alto a sinistra indica 200 µm. B) per quanto riguarda A, ma dopo la fotoattivazione a 830 nm. Fotoattivazione cellule sono ora visibili (verde) in un'area definita di interesse delimitata dalla zona marginale e che comprende i macrofagi tingible del corpo precedentemente identificati. Clicca qui per visualizzare una versione più grande di questa figura.
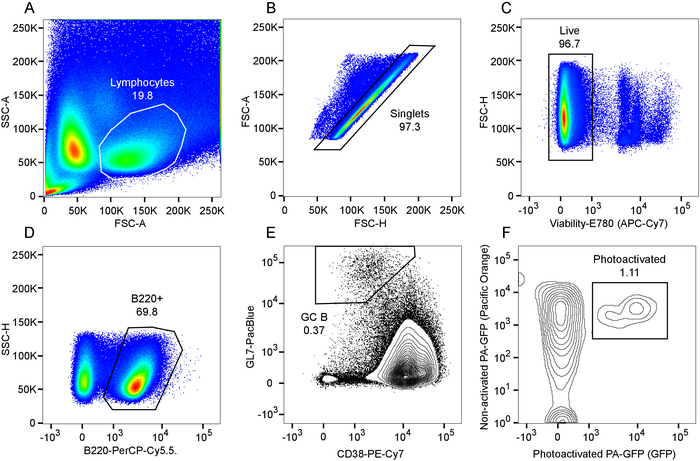
Figura 5: Analisi citofluorimetrica delle cellule di fotoattivazione centro germinale B. A) trama di andata contro il cancello del linfocita e dispersione laterale. B) terreno della superficie di forward scatter in funzione dell'altezza di forward scatter all'interno del cancello del linfocita e cancello di singoletto risultante. C) redditività tintura trama di esclusione all'interno del cancello di singoletto e cancello risultante di cellule vive. D) Gating delle cellule B220 + B. E) Gating delle cellule centro germinale B, identificato come CD38lo GL7hi cellule all'interno del cancello B220 +. F) Gating di fotoattivazione celle all'interno della popolazione delle cellule di GC B, identificato come il sottoinsieme delle cellule cheesprimono non attivati e fotoattivazione PA-GFP. Clicca qui per visualizzare una versione più grande di questa figura.
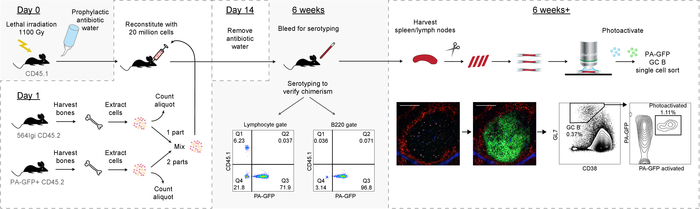
Figura 6: rappresentazione grafica del protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Un gran numero di modelli murini di autoimmunità è disponibile, molti dei quali presenti con centri germinali spontanea16. Tuttavia, molti dei modelli disponibili harbor complessi ambiti di provenienza genetici o mutazioni in centrale regolatori della proliferazione dei linfociti o attivazione, rendendoli poco adatto a intercrossing con linee di reporter e studi del comportamento normale del linfocita nell'autoimmunità, rispettivamente. Il presente modello, al contrario, permette un approccio di 'plug-and-play' per analisi approfondite delle cellule di selvaggio-tipo-derivato centro germinale B autoreattive utilizzando qualsiasi combinazione desiderata di transgeni, knock-out e giornalisti, nella fattispecie rappresentata da fuse GFP. Utilizzando strategie d'etichettatura in vivo, i centri germinali singoli possono essere visualizzati in tessuti linfoidi espiantati e loro fotoattivazione di costituenti cellulari utilizzando un microscopio a due fotoni. Fotoattivazione linfociti dai singoli centri germinali possono quindi essere analizzati o ordinato Flusso cytometrically, come cellule singole o in massa. Queste cellule possono successivamente essere sottoposti a ulteriori analisi molecolari e funzionali a valle di fornire uno sguardo rinnovato nel campo dell'autoimmunità.
Ci sono alcuni passaggi critici per la buona riuscita di questa procedura. Come dimostrato dai risultati rappresentativi, l'irradiazione (1.100 Rad) e la ricostituzione di midollo osseo del donatore sostituire con successo il vano di destinatario del midollo osseo producendo vicino-completa di chimerismo nel compartimento delle cellule di B. Questo è un punto importante, come le cellule B destinatario-derivato residue renderebbe un sottoinsieme della popolazione centro germinale 'dark'. Indipendentemente dalla fonte utilizzata per irradiazione, il dose/tempo di irradiazione deve essere ottimizzato per ottenere massima myeloablative effetto con danno di tessuto minimo collaterale per gli animali. Per la ricostituzione, il protocollo di osso-schiacciamento e ricostituzione con cellule del donatore totale 20 milioni è stato trovato per robustamente resa gradi alta ricostituzione. Sterile e fredda/sul ghiaccio per l'estrazione del midollo osseo di lavoro garantisce alta attuabilità del donatore del midollo. Per raggiungere il desiderato donatore midollo osseo rapporti, è necessario esercitare molta cura quando si contano le aliquote delle cellule, sia per il conteggio stesso e quando tirando fuori il sottocampione del midollo osseo per il conteggio. Miscelazione e co-cubettatura i midolli di donatore, invece di centrifugazione e risospensione separatamente e quindi di miscelazione, serve a prevenire eventuali inclinazioni rapporti del donatore dopo il conteggio delle cellule.
La generazione di chimera misto del midollo osseo del protocollo può stare da sola, e permette la generazione di chimere con centri germinali autoreattive con qualsiasi giornalista desiderata, transgene o knock-out. Tuttavia, una limitazione a questo è la necessità di utilizzare donatori histocompatible. Il ceppo di 564Igi è su uno sfondo di Congenici C57Bl/6J e di conseguenza, l'altro donatore e i destinatari dovrebbero avere un H-2b Congenici sfondo (o in alternativa, il ceppo di 564Igi dovrebbe essere backcrossed per il ceppo desiderato e il fenotipo autoimmune verificato il nuovo sfondo). La procedura di irradiazione tende a favorire un ambiente di tollerogeniche17e mancate corrispondenze in alcuni antigeni di istocompatibilità minore possono essere tollerate. Tuttavia, questo aspetto dovrebbe essere considerato attentamente, specialmente se miscelazione donatori maschili e femminili e/o i destinatari, a causa della potenziale reattività femminile con uomo-restricted Y-antigeni.
Allo stesso modo, l'aspetto di fotoattivazione del protocollo può stare da solo e può essere utilizzato in diversi contesti. Tuttavia, il reporter di PA-GFP è attualmente disponibile solo con il promotore UBC, che è attivo in tutte le cellule ematopoietiche lignaggio, ma non in cellule stromal. Come accennato nell'introduzione, altri fuse, fotomodulabili o ceppi reporter fotoconvertibile sono disponibili e possono essere sostituiti per PA-GFP, con opportuna regolazione delle condizioni sperimentali.
È importante evitare involontarie fotoattivazione di aree indesiderate, mantenendo il laser ben di sopra di 900 nm quando imaging, come questa volontà di lunghezza d'onda non photoactivate PA-GFP. Per la fotoattivazione sé, impostazioni specifiche, come ad esempio laser potenza e pixel tempo di sosta, dipenderà la profondità nel tessuto, il tessuto specifico utilizzato e il sistema di imaging, e ogni applicazione deve essere ottimizzato per il sistema di imaging specifico utilizzato. Prestare attenzione non al photodamage le cellule, ma è allo stesso tempo essenziale per ottenere efficiente fotoattivazione in tutto lo stack, al fine di ottenere una rappresentazione sufficiente di cellule attivate per analisi successive. Centro germinale B cellule costituiscono generalmente ovunque da 0,5% a ~ 2% di cellule spleniche o cutaneo di linfonodo B, e come si può vedere dai risultati rappresentativi (Figura 5), cellule di fotoattivazione singolo centro germinale B possono truccare ~ 1% del totale popolazione presente in una fetta unica della milza. Pertanto, riuscita analisi o l'ordinamento di un numero significativo delle cellule richiede l'elaborazione di un gran numero di eventi.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
SE Degn è un collega di Lundbeckfonden e Fondazione Carlsberg Distinguished Fellow. Questo lavoro è stato in parte inoltre sostenuto da una sovvenzione di biomedica NNF (SE Degn).
Materiali
| Name | Company | Catalog Number | Comments |
| Antibody, 9D11-A568 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Biotium 92255 | |
| Antibody, 9D11-A647 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Nordic Biosite ABD-1031 | |
| Antibody, FITC anti-mouse CD45.1 | Biolegend | 110705 | |
| Antibody, Pacific Blue anti-mouse/human GL7 Antigen (T and B cell Activation Marker) | Biolegend | 144613 | |
| Antibody, PE anti-mouse CD169 (Siglec-1) | Biolegend | 142403 | |
| Antibody, PE/Cy7 anti-mouse CD38 | Biolegend | 102717 | |
| Antibody, PerCP/Cy5.5 anti-mouse/human CD45R/B220 | Biolegend | 103235 | |
| Capillary tube, Mylar-wrapped, heparinized | Fisher Scientific | 211766 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Conical tubes, 50 mL | Falcon | 352235 | |
| Cover slip, square, 22x22 mm, 0.13-0.17 mm | Thermo Fisher Scientific | 22X22-1 | |
| EDTA | Merck | 1,084,180,250 | |
| Ethanol, 70% | VWR | 8301.360 | |
| Fetal bovine serum | Life Technologies | 10270106 | |
| Flow cytometer, FACS Canto II | BD Biosciences | 338962 | |
| Flow cytometer, LSRFortessa SORP | BD Biosciences | - | Special order product with 4 lasers (405 nm, 488 nm, 561 nm and 640 nm) |
| Grease, high vacuum, Dow Corning | VWR | DOWC1597418 | |
| Hemocytometer, Burker-Türk | VWR | 630-1544 | |
| Isoflurane, IsoFlo vet. | Orion Pharma | 9658 | |
| Lymphocyte separation medium (Lympholyte-M Cell Separation Media) | Cedarlane | CL5035 | |
| Microcentrifuge tube, 1.5 mL (Eppendorf) | Sarstedt | 72.690.550 | |
| Microscope, Two-photon | Prairie Technologies (now Bruker) | - | Special order Ultima In Vivo Two Photon Microscope |
| Mortar w. lip, unglazed, 75 ml | VWR | 410-0110 | |
| NaHCO3 | Merck | 1063290500 | |
| Needle, 18 gauge | BD Medical | 304622 | |
| NH4Cl | VWR | 87,769,290 | |
| PBS | Sigma | d8537 | |
| Pestle homogenizer | VWR | 47747-358 | |
| Pestle, unglazed, 175 mm | VWR | 410-0122 | |
| Pipette, Serological, 10 ml | VWR | 612-3700 | |
| Pipette, transfer, plastic | Sarstedt | 861,172,001 | |
| Plastic paraffin film (Parafilm M) | Bemis | PM996 | |
| Plate, 96-well | Falcon | 353910 | |
| Surgical forceps, Student Dumont #5 Forceps | FST - Fine Science Tools | 91150-20 | |
| Surgical forceps, Student Dumont #7 Forceps | FST - Fine Science Tools | 91197-00 | |
| Surgical scissors, Student Fine Scissors, Straight | FST - Fine Science Tools | 91460-11 | |
| Syringe, 10 mL | Terumo | SS-10ES1 | |
| Syringe, 20 mL | Terumo | SS-20ES1 | |
| Syringe, 5 mL | Terumo | SS-05S1 | |
| Syringe, Insulin, 0.3 cc | BD Medical | 324827 | |
| Tribrissen vet. 24% inj., containing 200 mg sulfadiazin and 40 mg trimethoprim/ml | MSD Animal health | 431577 | |
| Trypan blue solution, 0.4% | VWR | K940-100ML | |
| Viability dye, eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific | 65-0865-14 |
Riferimenti
- Lerner, A., Jeremias, P., Matthias, T. The World Incidence and Prevalence of Autoimmune Diseases is Increasing. International Journal of Celiac Disease. 3 (4), 151-155 (2015).
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12651-12656 (2002).
- Mutoh, T., Miyata, T., Kashiwagi, S., Miyawaki, A., Ogawa, M. Dynamic behavior of individual cells in developing organotypic brain slices revealed by the photoconvertable protein Kaede. Experimental neurology. 200 (2), 430-437 (2006).
- Tomura, M., et al. Monitoring cellular movement in vivo with photoconvertible fluorescence protein “Kaede” transgenic mice. Proceedings of the National Academy of Sciences. 105 (31), 10871-10876 (2008).
- Tomura, M., et al. Tracking and quantification of dendritic cell migration and antigen trafficking between the skin and lymph nodes. Scientific Reports. 4, 6030 (2014).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature biotechnology. 24 (4), 461-465 (2006).
- Pereira, E. R., et al. Lymph node metastases can invade local blood vessels, exit the node, and colonize distant organs in mice. Science (New York, NY). 359 (6382), 1403-1407 (2018).
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science (New York, NY). 297 (5588), 1873-1877 (2002).
- Victora, G. D., et al. Germinal center dynamics revealed by multiphoton microscopy with a photoactivatable fluorescent reporter. Cell. 143 (4), 592-605 (2010).
- Habuchi, S., et al. Reversible single-molecule photoswitching in the GFP-like fluorescent protein Dronpa. Proceedings of the National Academy of Sciences of the United States of America. 102 (27), 9511-9516 (2005).
- Zhou, X. X., Chung, H. K., Lam, A. J., Lin, M. Z. Optical control of protein activity by fluorescent protein domains. Science (New York, NY). 338 (6108), 810-814 (2012).
- Degn, S. E., et al. Clonal Evolution of Autoreactive Germinal Centers. Cell. 170 (5), 913-926 (2017).
- Berland, R., et al. Toll-like receptor 7-dependent loss of B cell tolerance in pathogenic autoantibody knockin mice. Immunity. 25 (3), 429-440 (2006).
- Chatterjee, P., et al. Complement C4 maintains peripheral B-cell tolerance in a myeloid cell dependent manner. European journal of immunology. 43 (9), 2441-2450 (2013).
- Toubai, T., et al. Induction of acute GVHD by sex-mismatched H-Y antigens in the absence of functional radiosensitive host hematopoietic-derived antigen-presenting cells. Blood. 119 (16), 3844-3853 (2012).
- Luzina, I. G., et al. Spontaneous formation of germinal centers in autoimmune mice. Journal of leukocyte biology. 70 (4), 578-584 (2001).
- Sachs, D. H., Kawai, T., Sykes, M. Induction of tolerance through mixed chimerism. Cold Spring Harbor perspectives in medicine. 4 (1), a015529 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon