Method Article
Scongelamento, coltura e Cryopreserving linee di cellule di Drosophila
In questo articolo
Riepilogo
Linee di cellule di Drosophila sono importanti reagenti per la ricerca biomedica sia fondamentale. Questo articolo fornisce i protocolli per lo scongelamento, subcoltura e la crioconservazione delle varietà di cellula di Drosophila comunemente usati per aiutare i ricercatori a che prevedano l'impiego di questi reagenti nella loro ricerca.
Abstract
Ci sono attualmente oltre 160 distinte linee cellulari di Drosophila distribuiti da Drosophila Genomics Resource Center (DGRC). Con ingegneria di genoma, il numero di linee cellulari romanzo si pensa che aumenti. La DGRC mira a familiarizzare i ricercatori con l'utilizzo di linee di cellule di Drosophila come uno strumento sperimentale per integrare e guidare la loro agenda di ricerca. Sono disponibili procedure per l'utilizzo di una varietà di linee di cellule di Drosophila con caratteristiche distinte, inclusi i protocolli per lo scongelamento, coltura e cryopreserving linee cellulari. D'importanza, questa pubblicazione illustra le migliori pratiche necessarie per lavorare con linee cellulari di Drosophila per ridurre al minimo il rischio di contaminazioni da microrganismi accidentale o da altre linee cellulari. I ricercatori che acquisire familiari con queste procedure saranno in grado di approfondire le molte applicazioni che utilizzano cellule di Drosophila coltivate tra cui biochimica, biologia cellulare e genomica funzionale.
Introduzione
L'uso di Drosophila coltivato le cellule complementi in vivo l'analisi genetica per volare e serve come strumento di indagine primaria per affrontare molte questioni biologiche di base1,2,3. Linee cellulari di Drosophila offrono unici popolazioni omogenee di cellule derivate da fonti differenti del tessuto con distinti ambiti di provenienza genetici. Le linee cellulari sono adatte per numerose applicazioni tra cui espressione genica transgenici, genomica, trascrittomica, proteomica, metabolomica, schermi di throughput elevato RNA interferenza (RNAi), biologia cellulare e microscopia. D'importanza, l'uso della coltura delle cellule della drosofila facilita la caratterizzazione delle risposte temporale immediate agli stimoli noti. Inoltre, coltura delle cellule della drosofila è favorevole al genoma CRISPR-Cas9 editing, che lo rende relativamente facile creare nuove linee di cellule con genoma specifiche modifiche4,5,6, 7.
La Drosophila Genomics Resource Center (DGRC) funge da centro di repository e distribuzione per linee di cellule di Drosophila . Uno degli obiettivi della DGRC è di assistere i membri della comunità della ricerca nell'utilizzo di risorse di cultura delle cellule della drosofila . Questo articolo presenta protocolli di base per la gestione di linee di cellule di Drosophila . Esso integra le risorse esistenti per aiutare i ricercatori familiarizzano con la manipolazione di colture di cellule di Drosophila e raggiungere un livello di autonomia nelle loro esperimenti1,2,8,9 ,10.
Le linee di cellule di Drosophila più comunemente usate sono: Schneider linee11, Kc16712, Mitsubishi/Miyake immaginale disco e sistema nervoso centrale (SNC) linee13,14, linee di Milner laboratorio immaginale disco 15, le cellule ovariche adulte linee16,17e il Ras linee18 (tabella 1). Le linee di Schneider e Kc167 sono linee cellulari per tutti gli usi generali per l'uso in biochimica, espressione genica transgenici ricombinante e schermi di genetici inverso. Le linee di laboratorio (ML) di Mitsubishi/Miyake sono stata derivate da dischi immaginali larvale o del sistema nervoso centrale (SNC) e sono stati utili per studi relazionati a neurosecretoria, regolazione della trascrizione ed elaborazione del RNA. Le linee di disco Milner (CME) sono state importanti per lo studio della trasduzione del segnale. Le linee cellulari di fGS/OSS derivate dalle ovaie adulte mutante rimangono importanti reagenti per studiare l'impatto di non-codificazione piccolo biologia di RNA in cellule germinali manutenzione e differenziazione17,19. Infine, le linee di Ras sono uniche perché si tratta di linee cellulari derivate da embrioni ectopically che esprime l'oncogene Ras. Essi hanno la firma trascrizionale delle cellule del precursore del muscolo ed esprime attivo piRNA macchinari20. Recenti articoli di revisione e capitoli di libri coprono le applicazioni di queste linee cellulari popolari con più dettagli2,3,9.
Tutte queste linee cellulari possono essere una subcoltura e congelate. Non ci sono requisiti diversi lievi ma importanti come ogni linea cellulare è mantenuta e preparato per la crioconservazione. Ad esempio, le linee distinte delle cellule richiedono diversi media e integratori (tabella 1). Le linee variano anche in proprietà di aderenza superficiale, morfologie (Figura 1 e Figura 2), genotipo e tempo di raddoppiamento (tabella 2). Presentiamo protocolli di base ed evidenziamo le differenze uniche per la gestione delle varie linee di cellulari di Drosophila ampiamente usate.
Protocollo
1. scongelare e rilanciare linee cellulari congelato della drosofila
- Sterilizzare il cofano strofinare la superficie di lavoro con etanolo al 70%. Pipettare 5 mL di terreno appropriato (tabella 1) in un 25 cm2 T-pallone (T-25).
- Rimuovere il cryovial/fiala da liquido N2 o ghiaccio secco. Pulire il cryovial con etanolo al 70%, attentamente allentare e dissigillare la fiala.
- Utilizzando una pipetta Pasteur, prelevare 1 mL di media temperatura (RT) nel matraccio di T-25. Aggiungere lentamente i media nel cryovial e mescolare delicatamente per scongelare le cellule congelate, assicurando che la sospensione cellulare non trabocchi.
- Trasferire l'intero volume della sospensione cellulare scongelati dalla fiala nel pallone T-25. Ripetere l'operazione per garantire che la sospensione cellulare è stato completamente trasferita.
- Collocare la beuta in un incubatore a 25 ° C, permettendo alle cellule di stabilirsi e aderire per almeno 2 h. esaminare le cellule al microscopio per garantire che la maggior parte delle cellule hanno depositato sulla superficie crescente. Delicatamente rimuovere vecchi media e sostituirli con 5 mL di terreno fresco. Restituire il pallone in incubatrice.
- Il giorno seguente, rimuovere i vecchi media delicatamente e sostituire con 5 mL di terreno fresco. Restituire la cultura nell'incubatore.
2. lo scongelamento e rilanciare linee cellulari congelati Drosophila (alternativa)
- In una cappa sterile, scongelare le cellule da risospendere il pellet congelato con 1 mL di media di RT. Trasferire tutti la sospensione cellulare scongelati in una provetta conica da 15 mL.
- Agglomerare le cellule mediante centrifugazione a 1.000 x g per 5 min, scartare il supernatante e risospendere il pellet cellulare in 5 mL di terreno fresco.
- Trasferire l'intero volume della sospensione cellulare in un matraccio da T-25 e incubare la cultura a 25 ° C.
- 1 o 2 h dopo, esaminare le cellule sotto il microscopio per garantire che la maggior parte delle cellule hanno depositato sulla superficie crescente. Il giorno seguente, sostituire i vecchi media con 5 mL di terreno fresco e restituire la cultura nell'incubatore.
3. subcoltura semi-aderente cellule coltivate in piastre di coltura di 100 mm
- Sterilizzare il cofano strofinando con etanolo al 70%. Portare i materiali sterili per subcoltura nel cofano, tra cui bottiglie di media, le pipette, pipetta aiuti e piastre di coltura.
- Esaminare la morfologia e la confluenza della cultura sotto un microscopio. Cerchi chiari segni di microorganismal contaminazioni nella cultura. Determinare se le cellule sono pronte essere attraversate, in base alle caratteristiche della cultura: densità e tempo, tra cui l'ultima volta che sono stati una subcoltura di raddoppiamento delle cellule.
- Se la cultura appare altamente confluenti (Figura 1), determinare la densità delle cellule. Nella cappa sterile, rimuovere le cellule dalla superficie crescente di pipettaggio fino a 10 mL di terreno dalla piastra ed erogazione esso sopra le cellule. Ripetere un paio di volte, garantendo per non creare schiuma, fino a quando la superficie di coltivazione diventa chiara. Determinare la densità delle cellule utilizzando un contatore di particelle automatico (sezione 5, Figura 3) o un emocitometro. Sottocultura le celle se la densità delle cellule è tra 5 x 106 e 1 x 107 cellule/mL.
Nota: Fare non linee cellulari di Drosophila di sottocultura ad una densità di cella inferiore a 1 x 106 cellule/mL. -
Diluire la sospensione cellulare conseguenza utilizzando un terreno adeguato ad una concentrazione finale di semina di almeno 1 x 106 cellule/mL.
- Per passaggio e la manutenzione ordinaria, è possibile aggiungere un appropriato volume della sospensione cellulare in un volume predeterminato di mezzo in una nuova piastra di coltura per ottenere la densità desiderata semina delle cellule.
- Per la scalabilità di una cultura, trasferire la sospensione di eritrociti in un matraccio da grande. Diluire la sospensione cellulare alla densità di cella desiderata con un volume appropriato del mezzo. Distribuire volumi uguali della sospensione diluita di cellule nuove piastre. Questo metodo riduce al minimo le variazioni nella densità di cella tra le piastre.
- Coprire ed etichettare le piastre con le iniziali di operatore, data, rapporto di divisione, densità di semina delle cellule, identificatore di riga cella, media, numero di passaggio ed eventuali aggiunte di media come gli antibiotici.
- Inserire le piastre in un contenitore di plastica e riporre la scatola nell'incubatore.
Nota: tabella 3 elenca i recipienti di coltura comunemente usati per la coltura di linee cellulari di Drosophila e i volumi di lavoro associato.
4. Staccare le cellule aderenti coltivate in piastre di coltura di 100 mm
- Trasferire tutto il mezzo dalla piastra in un nuovo pallone sterile. Salvare il mezzo.
- Sciacquare le cellule lentamente aggiungendo 1 mL di tripsina-EDTA 0,05% alla piastra. Agitare delicatamente per garantire che la soluzione di tripsina copre la superficie di crescita intero. Scartare la soluzione di tripsina.
- Delicatamente aggiungere 1 mL di tripsina-EDTA 0,05% alla piastra. Incubare la piastra a 25 ° C tra 3−10 min mentre monitoraggio per visibili segni di strato di cellule, il distacco e scivolamento fuori la superficie di coltivazione.
- Aggiungere 9 mL di terreno salvato alla piastra per fermare l'attività della tripsina. Mescolare la sospensione cellulare per dissociare ciuffi di cella. Una volta che tutte le cellule hanno state sloggiate, la superficie di coltivazione sarà chiara.
Nota: L'uso di enzimi digestivi come l'aids di tripsina in passaggio linee cellulari fortemente aderente. Tripsina è una miscela delle proteasi spesso derivato dal pancreas suino ed è commercialmente disponibile in diversi gradi di purezza.
5. manuale cella conteggio utilizzando la cella di Neubauer conteggio diapositiva
- Preparare l'emocitometro diapositiva e il vetrino coprioggetti strofinare la superficie con alcool al 70%.
- Mescolare la sospensione cellulare e pipettare 15 µ l di sospensione cellulare nel lato scanalato del emocitometro (Figura 3A) per riempire la camera prima dell'emocitometro. Riempire la seconda camera dell'emocitometro. La sospensione cellulare verrà disegnata nella camera di conteggio per azione capillare.
- Utilizzando un 10x obiettivo del microscopio, contare le celle all'interno dell'area2 di 1 mm al centro della griglia vincolata le linee parallele (Figura 3,D). Per evitare doppi conteggi, contare le cellule che si sovrappongono la parte superiore e sinistra i confini, ma non le cellule che attraversano i confini destro e inferiore delle 200 µm2 piazze. Conta tra le celle 100−200. Ripetere il conteggio con la seconda camera.
- Calcolare la media dei due conteggi e determinare la densità delle cellule secondo la seguente formula: densità (cellule/mL) di cella = conteggio medio delle cellule (n1 + n22) x 104.
Nota: Attuabilità delle cellule è espresso come la percentuale di cellule vitali per cellule totali. Per determinare la vitalità cellulare, mescolare la sospensione cellulare con un volume uguale di trypan blu (0,4%) soluzione prima della conta cellulare manuale o automatico. Cellule vive non occuperà il colorante, mentre le cellule morte saranno colorate blue.
6. Crioconservazione delle varietà di cellula di Drosophila
- Controllare le impostazioni cultura per morfologia sano, la crescita e la mancanza di contaminazione. Raccogliere le colture dalla metà alla fase di crescita del tardo-log (fase 3.3, o sezione 4). Per molte linee cellulari di Drosophila , è approssimativamente fra 4 x 106 cellule/mL a 8 x 106 cellule/mL.
- Trasferire l'intera cella sospensione in una provetta conica da 15 mL o 50 mL. Raccogliere le cellule mediante centrifugazione a 1.000 x g per 5 min e scartare il surnatante.
- Risospendere il pellet cellulare in un volume di congelamento medio (tabella 4) che si tradurrà in una densità di cella finale di almeno 4 x 107 cellule/mL.
- Aggiungere goccia a goccia la quantità appropriata del crioprotettore dimetilsolfossido (DMSO) nella sospensione cellulare tale che la concentrazione di DMSO finale è 10%. Mescolare delicatamente la sospensione cellulare.
- Attentamente Pipettare 0,5 mL di sospensione cellulare in aliquote del cryovials pre-etichettata (~ 2 x 107 cellule/flacone). Collocare le fiale in un contenitore di congelamento riempito con isopropanolo (Figura 4A). Trasferire il contenitore di congelamento in un congelatore-80 ° C durante la notte per consentire alla temperatura di cryovials cadere lentamente (-1 ° C/min) per la temperatura del freezer.
- Estrarre il cryovials congelati e allegarli rapidamente a canne (Figura 4B). Inserire le canne contenente cryovials in una scatola metallica (Figura 4). In alternativa, posizionare cryovials congelato all'interno di una scatola di congelamento pre-raffreddata (Figura 4). Archivio congelati cryovials in fase liquida di congelatori di2 N (Figura 4E,F).
Nota: Quando si utilizza il congelamento media contenente DMSO, un ritardo di fino a 30 min a RT non è dannoso per le cellule.
Risultati
È importante scongelare rapidamente cellule congelate di Drosophila e loro coltura ad una densità di cella che riporta le impostazioni cultura in fase di crescita. Se sono rispettate le procedure di congelamento e scongelamento, la densità delle cellule nel pallone T-25 sarà uguale almeno a 4 x 106 cellule/mL. Una o due ore dopo lo scongelamento, la maggior parte delle linee di cellule di Drosophila inizierà ad attaccare alla superficie crescente. Sotto la circostanza in cui la maggior parte delle cellule non è collegato sulla superficie di coltivazione entro due ore dopo lo scongelamento, si raccomanda di incubare le cellule durante la notte prima di cambiare il supporto.
L'obiettivo della subcoltura è di mantenere le cellule nella sana registro-fase esponenziale della curva di crescita. I criteri per subcoltura dipendono la visibile mancanza di contaminazione microorganismal, densità delle cellule e la necessità di stabilire un programma di manutenzione periodica. È importante innanzitutto valutare l'integrità delle cellule e determinare l'assenza di contaminanti avventizi prima del congelamento. Maggior parte dei contaminanti batterici e fungini sono facili da rilevare semplicemente di ispezioni visive. Colture contaminate possono essere identificati tramite un aumento nella torbidità media. Sotto il microscopio, contaminanti potrebbero apparire come canne batteriche, Cocchi, in erba di cellule di lievito o stringa-come i hyphae fungosi. Altre fonti di contaminazione quali il micoplasma non citopatici non rilevabili visivamente e possono essere regolarmente testati da analisi PCR-based21.
La confluenza di una linea cellulare può essere determinata visivamente (Figura 1). Linee cellulari crescente veloce raggiungono confluenza presto e hanno bisogno di essere attraversate regolarmente. Tali linee sono una subcoltura fino a due volte a settimana. Al contrario, le cellule in crescita lente sono secondarie, almeno una volta ogni due settimane o più. Tuttavia, le cellule hanno bisogno di essere nutriti media freschi ogni settimana. Questo è per prevenire esaurimento media e per diluire i prodotti metabolici di scarto dalle cellule. Linee cellulari derivate da variando tessuto fonti differiscono nella loro morfologia (Figura 2), proprietà di aderenza, requisiti di media (tabella 1) e raddoppiando il tempo (tabella 2). Tabella 5, tabella 6, tabella 7e tabella 8 riportate le ricette per vari terreni di coltura delle cellule della drosofila .
Conta cellulare assicura una densità di semina precisa e una routine prevedibile per subcoltura. Per esperimenti quantitativi, la conta cellulare è essenziale. Le cellule vengono contate tramite un emocitometro (Figura 3A) o un contatore di particelle automatizzati (Figura 3B). Se si utilizza un contatore automatico, seguire le istruzioni del produttore. Conteggio celle manualmente utilizzando un emocitometro è economico e facile. Il numero di celle racchiuso tra le griglie di Neubauer centrale è contato e la densità delle cellule viene calcolata; Per esempio, n = 214 cellule, con conseguente una densità cellulare di 2.14 x 106 cellule/mL (Figura 3D).
Sospensione cellulare da due lastre di 100 mm, ciascuno contenente 10 mL di sospensione cellulare a 4 x 106 cellule/mL sono raccolti e risospeso in 2 mL di congelamento media per ottenere una densità di 4 x 107 cellule/mL. Ogni cryovial congelati con 0,5 mL di sospensione cellulare contiene 2 x 107 cellule. Questo si tradurrà in una cultura con 4 x 106 cellule/mL quando scongelati secondo il protocollo sezione 1.
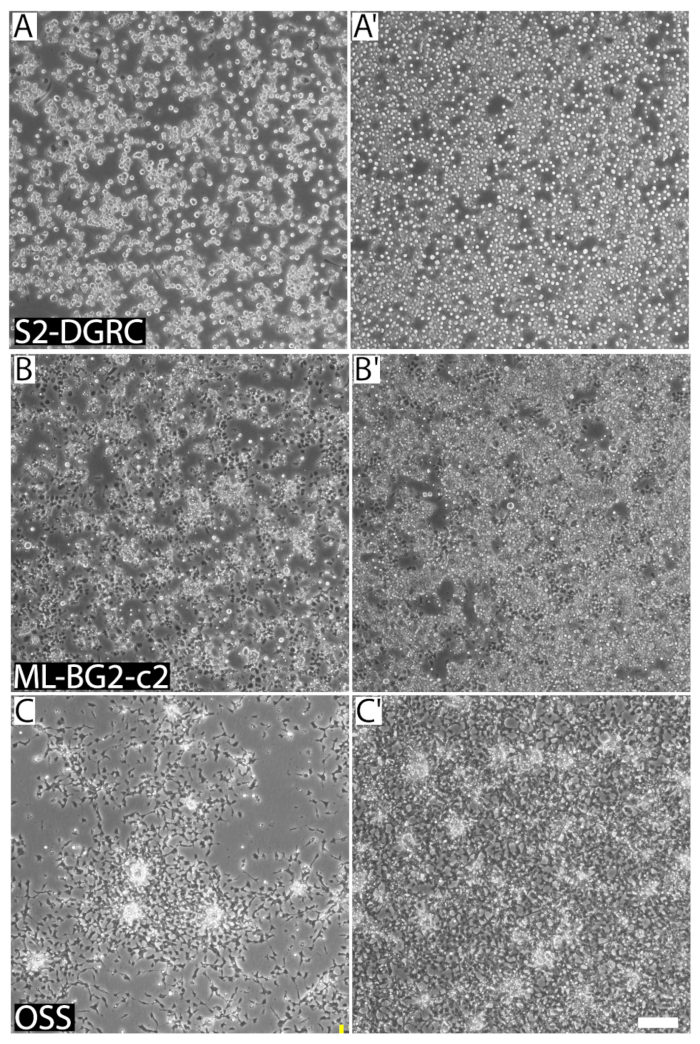
Figura 1 : Immagini rappresentative di tre distinti Drosophila linee a diverse densità di confluenza e cellulare cellulari. (A) S2-DGRC cultura a 1 x 106 cellule/mL. (A') Cultura di S2-DGRC a 4,5 x 106 cellule/mL. (B) ML-BG2-c2 della coltura a 2 x 106 cellule/mL. (B') ML-BG2-c2 cultura a 8 x 106 cellule/mL in cui le cellule sono palificazioni e aggregando come i fuochi. (C), OSS cultura a 1 x 106 cellule/mL. (C') Cultura di OSS a 4 x 106 cellule/mL. Le cellule in sospensione non vengono acquisite sullo stesso piano focale. Barra della scala = 100 µm. Clicca qui per visualizzare una versione più grande di questa figura.
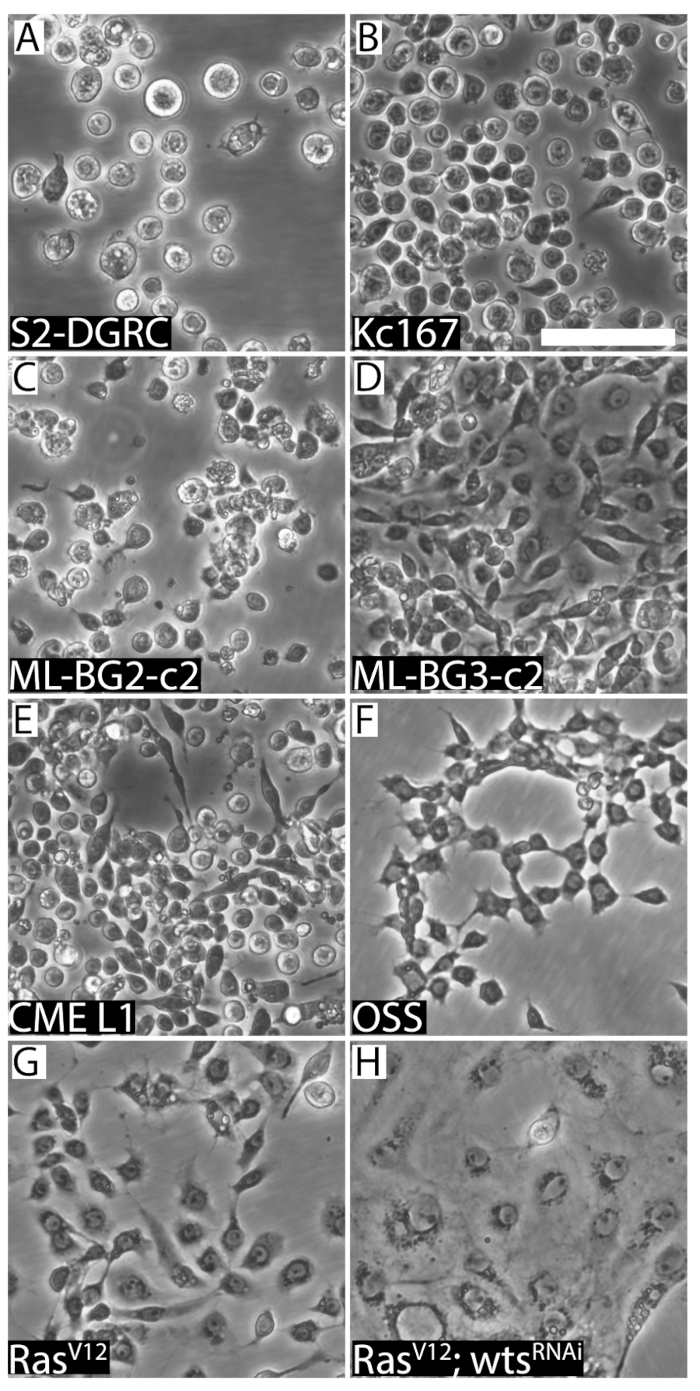
Figura 2 : Immagini rappresentative delle otto distinte linee cellulari Drosophila . (A) Round embrione derivato S2-DGRC. (B) Round embrione derivato Kc167. (C) turno larvale CNS-derivato ML-BG2-c2. (D) Round larvale fusiformi ML-BG3-c2. (E) CME L1, una linea cellulare derivata dai dischi immaginali gamba larvale, è piccolo ed ha morfologia rotonda/fusiforme. OSS (F), una linea cellulare derivata da adulte ovaie, Visualizza morfologia fusiforme. (G), linea di cellule fusiformi RasV12 esprimendo attivato Ras. (H) RasV12; wtsRNAi (WRR1), una linea cellulare che esprime Ras attivato e RNA double-stranded targeting il tumore soppressore verruche (wts), presenta caratteristiche epiteliali. Barra della scala = 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.
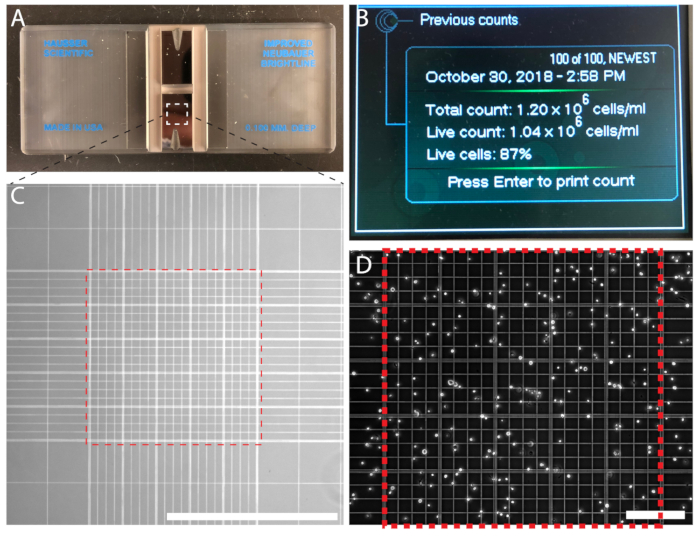
Figura 3 : La densità delle cellule possa essere conteggiata manualmente utilizzando un emocitometro o automaticamente utilizzando un contatore di particelle automatizzati. (A) A emocitometro con due alloggiamenti. (B) un contatore di cellule automatizzato visualizzazione dell'output di un conteggio delle cellule. (C) la migliore delle cellule Neubauer contando griglia hanno visto sotto un obiettivo 10x. Contare le celle vincolate alla griglia centrale di 0,1 mm3 (quadrato rosso tratteggiato). (D) la griglia centrale sull'emocitometro è riempita di cellule per il conteggio. Barra della scala = 1 mm (C); 0,2 mm (D). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Apparecchiature per la crioconservazione. (A) A congelamento contenitore negozi le fiale in posizione verticale per congelamento lento. (B), un metallo canna per lo svolgimento di fiale congelate. (C) A contenitore per lo svolgimento di canne. (D), una scatola di congelamento plastica (criogenico). (E) A scatola metallica che tiene più canne inseriti in un serbatoio di accumulo di liquido N2 . (F), un liquido N2 serbatoio di stoccaggio. Clicca qui per visualizzare una versione più grande di questa figura.
| Sforzo delle cellule | Media | Aderenza | Tripsina |
| Linee di Schneider | M3 + BPYE + 10% di siero fetale di vitello (FCS), pH 6.6 | Semi-aderente | No |
| (S2R +, S2-DRSC, S2-DGRC, Sg4) 11 | |||
| Di Schneider media+ + 10% FCS | |||
| KC linee (Kc167, Kc7E10)21,22 | M3 + BPYE + 5% FCS, pH 6.6 | Semi-aderente | No |
| Hyclone-CCM3, pH 6,2 | |||
| Disco immaginale e CNS (ML-linee)13,14 | M3 + BPYE + 10% FCS, pH 6.6 | Semi-aderente | No |
| insulina di 10 µ g/mL | |||
| Disco immaginale Milner linee (CME-linee)15 | M3 + 2% FCS | Semi-aderente | No |
| insulina di 5 µ g/mL | |||
| 2.5% di Estratto di volare | |||
| fGS/OSS16 | M3 + 10% FCS, pH 6.8 | Aderente | * |
| insulina di 10 µ g/mL | |||
| 1 mg/mL C5H8KNO4 | |||
| 0,5 mg/mL KHCO3 | |||
| glutatione di 0,6 mg/mL | |||
| 10% di Estratto di volare | |||
| RASV12 linee18 | M3 + BPYE + 10% FCS, pH 6.6 | Aderente | Sì |
Tabella 1: I requisiti di proprietà e supporti di vario Drosophila linee cellulari. Diversi isolati di semi-aderente Schneider linee incluse S2R + S2-Drosophila RNAi Screening Center (DRSC), S2-Drosophila Genomics Resource Center (DGRC) e Sg4 sono linee cellulari comunemente usati che proliferano robustamente quando coltivate in media M3 + Bactopetone Estratto di lievito (BPYE) completato con 10% siero fetale di vitello (FCS). In alternativa, media di Schneider (pH 6,7-6,8) è spesso usato al posto di M3 + BPYE. Le linee di Kc proliferano in sia M3 + BPYE (5% FCS) o privo di siero CCM3 media. Il disco immaginale ML e il sistema nervoso centrale (SNC) linee richiedono il completamento di insulina per proliferazione. Le linee di disco immaginale Milner richiedono sia l'insulina che Mosca estratto il completamento. Linee cellulari aderenti fGS/OSS richiedono insulina, una maggiore concentrazione di Estratto di volare, come pure glutatione per la crescita. Aderente RasV12 linee crescono bene in M3 + BPYE (10% FCS). Tripsina viene utilizzata per rimuovere linee cellulari aderenti dalla superficie di crescita.
| Linea cellulare (Stock #) | Genotipo | Raddoppiando il tempo (h) * | Origine del tessuto |
| S2R + (150) | OreR | 39 | Tardi embrioni |
| S2-DGRC (6) | OreR | 23 | Tardi embrioni |
| S2-DRSC (181) | OreR | 46 | Tardi embrioni |
| Kc167 (1) | e/se | 22 | 6−12 h embrioni |
| ML-BG2-c2 (53) | y v f mal | 48 | 3rd instar larvale CNS |
| ML-BG3-c2 (68) | y v f mal | 104 | 3rd instar larvale CNS |
| ML-DmD8 (92) | y v f mal | 66 | 3 disco dird instar larvale ala |
| CME W1 Cl.8+ (151) | OreR | 46 | 3 disco dird instar larvale ala |
| CME L1 (156) | OreR | 47 | 3 disco dird instar larvale gamba |
| OSS (190) | bamD86 | 45 | Ovaie mutante adulto bam |
| RASV12 linee | UAS-GFP; P(UAS-Ras85D.V12) / P (Act5C-GAL4) 17bFO1 | 41−65 | Embrione |
Tabella 2: Genotipo, raddoppiando il tempo e le fonti di tessuto di ampiamente usato Drosophila linee cellulari. Il genotipo del tessuto, la fonte e il tempo di linee cellulari comunemente usato raddoppiamento della popolazione sono presentati. Tempo di raddoppiamento si basa sulla crescita nei mezzi consigliati a 25 ° C.
| Vaso di cultura | Volume dei media (mL) |
| 12,5 cm2 T-boccetta | 2.5 |
| 25 cm2 T-boccetta | 5 |
| 75 cm2 T-boccetta | 15 |
| Piastra 35 mm | 1 |
| piastra mm 60 | 4 |
| piastra mm 100 | 10 |
| piastra 384 pozzetti * | 0,04/pozzetto |
| piastra 96 pozzetti * | 0,1/pozzetto |
| 48-pozzo piastra * | 0,3/pozzetto |
| 24 pozzetti piastra * | 0,5/pozzetto |
| 12-pozzetti | 1.0/pozzetto |
| piastra a 6 pozzetti | 2.0/pozzetto |
Tabella 3: cultura vasi e i volumi di supporti consigliati. Recipienti di coltura di varie dimensioni sono disponibili per la coltura delle cellule della drosofila . I volumi di supporto appropriato (mL) sono raccomandati per ciascuna nave. Sigillare piastre multi-pozzetto contenente meno di 0,5 mL di sospensione cellulare con film di paraffina per ridurre perdita media a causa dell'evaporazione.
| Volume | |
| M3 + BPYE, pH 6.6 | 70 mL |
| FCS inattivato con calore | 20 mL |
| DMSO filtrato sterile * | 10 mL |
Tabella 4: ricetta per preparare 100 mL di terreno di congelamento (M3 + BPYE, FCS 20%, 10% DMSO). Preparare il supporto di congelamento come necessario e non conservare il congelamento supporti contenenti DMSO per periodo prolungato.
| M3 + BPYE medio | Importo |
| Scudi e cantato di M323 | 1 bottiglia |
| KHCO3 | 0,5 g |
| Estratto di lievito selezionato | 1,0 g |
| Bactopeptone | 2,5 g |
| Acqua depurata sterile | 1000 mL |
Tabella 5: Ricetta per la preparazione di 1 L di M3 + BPYE mezzo di coltura tissulare. Regolare il pH a 6.6. Sterilizzare il mezzo di passaggio attraverso un filtro da 0,22 µm.
| Base M3 medio per linea cellulare fGS/OSS | Importo |
| Scudi e cantato M3 | 1 bottiglia |
| KHCO3 | 0,5 g |
| C5H8KNO4 | 1,0 g |
| Acqua depurata sterile | 1.000 mL |
Tabella 6: Ricetta per 1 L di base a media fGS/OSS M3. Regolare il pH a 6,8. Sterilizzare il mezzo di passaggio attraverso un filtro da 0,22 µm.
| Hyclone-CCM3 | Importo |
| CCM3 polvere | 28,6 g |
| NaHCO3 | 0,35 g |
| NaOH N 10 | 2,5 mL |
| CaCl2 | 0,5 g |
| Acqua depurata sterile | 1.000 mL |
Tabella 7: Ricetta per 1 L di terreno di coltura del tessuto Hyclone-CCM3. Regolare il pH a 6.2. Sterilizzare il mezzo di passaggio attraverso un filtro da 0,22 µm.
| M3 + BPYE + 10% FCS | Miyake disco e CNS linee medie | Medio di linee di Milner disco | terreno completo fGS/OSS | |
| M3 + BPYE, pH 6.6 | 90 mL | 90 mL | - | - |
| Inattivato con calore FCS * | 10 mL | 10 mL | 2 mL | 10 mL |
| Insulina (10 mg/mL) | - | 100 Μ l | 50 Μ l | 100 Μ l |
| Estratto di Vola | - | - | 2,5 mL | 10 mL |
| Glutatione (60 mg/mL) | - | - | 1 mL | |
| M3, pH 6.6 | - | - | 97,5 mL | - |
| fGS/OSS M3, pH 6.8 | - | - | 79 mL |
Tabella 8: Ricetta per preparare 100 mL di vari comuni Drosophila terreni di coltura delle cellule. Incubare FCS a 56 ° C per 1 h e agitare ogni cinque minuti per inattivare proteine del complemento a caldo.
Discussione
Colture di cellule di Drosophila sono reagenti primari per gli schermi basati su celle a resa elevata. Loro uso integra anche la ricerca genetica in vivo fornendo una popolazione omogenea delle cellule per biochimica, rapido test di costrutti transgenici prima di iniettare in mosche, biologia cellulare, microscopia e, più recentemente, genetica delle cellule somatiche manipolazioni di genoma editing1,2,3,8,9,10.
La vitalità e il recupero di cellule congelate di Drosophila è sensibile alle fluttuazioni drastiche anche a basse temperature. La DGRC memorizza linee cellulari congelati in fase liquida di N2 (-196 ° C) e li trasporta in ghiaccio secco (-78,50 ° C). Fiale congelati che sono stati trasportati in ghiaccio secco non dovrebbero essere trasferiti nuovamente in liquido N2 o in un congelatore-80 ° C per la conservazione. Invece, le cellule congelate dovrebbero essere scongelate, reseeding una densità alta cella appena possibile all'arrivo (protocollo sezione 1) e coltivate per i loro scopi sono destinati (protocollo sezione 3). Se le linee cellulari non vengono immediatamente utilizzate per esperimenti, la cella linee dovrebbero essere crioconservati (sezione 6 del protocollo) finché non sono pronti per l'uso.
Alcune linee cellulari, quali le linee ML-BG2-c2 e Ras servono alcuni giorni per riprendersi dagli effetti di essere ripresa dallo stato crioconservato. Una notevole quantità di detriti cellulari accompagna queste linee cellulari i primi giorni dopo lo scongelamento. Lasciata indisturbata, le cellule recupererà e proliferare. Molte linee cellulari di Drosophila presso il DGRC sono state adattate a crescere in M3 basata media22. Per linee cellulari che sono lenti a riprendersi dagli effetti del disgelo, l'uso dei media condizionati può essere utile. Media condizionati probabilmente contenga fattori di crescita secernuti dalle cellule nel media che può favorire il recupero e la proliferazione delle cellule dopo lo scongelamento.
Linee cellulari generalmente seguono una curva di crescita stereotypical costituito da una fase di latenza, fase esponenziale, fase del plateau e una fase di deterioramento. Molte linee cellulari di Drosophila proliferano in ritardo-fase di crescita, quando essi sono coltivate ad una densità tra 1 x 106 e 1 x 107 cellule/mL a 25 ° C. È essenziale che le linee cellulari sono attraversate tale che essi sono sempre in fase di crescita esponenziale.
La confluenza di una cultura, espressa in percentuale, descrive l'area della superficie di crescita è coperto dalle cellule. Confluenza di cella per una linea cellulare dipende dalla sua cella di forma e dimensione. Linee cellulari distinti hanno diverse morfologie e proprietà di aderenza. Di conseguenza, diverse linee cellulari approssimativamente simile confluenza possono avere densità nettamente distinte delle cellule (Figura 1). Confluenza di cultura non può essere un indicatore ideale per passaggio di colture di cellule di Drosophila perché Drosophila linee cellulari continuano a proliferare mediante palificazione uno sopra l'altro come i fuochi o in sospensione, anche dopo che la superficie di crescita è stato coperto (Figura 1). Tuttavia, gli utenti esperti con linee cellulari specifiche possono spesso utilizzare confluenza come guida visiva rapida per quando alla subcoltura.
Mentre è possibile far crescere Drosophila linee presso ambiente RT tra 19−25 ° C, non è consigliabile perché le fluttuazioni di temperatura ambiente potrebbero influenzare il tasso di proliferazione. È consigliato l'uso di un incubatore dedicato 25 ° C. L'incubatore per colture di cellule di Drosophila non ha bisogno di facilitare lo scambio di gas di CO2 perché i terreni di coltura delle cellule della drosofila non utilizzano CO2 per il buffer. L'umidità all'interno dell'incubatore per la coltura di linee cellulari è un fattore importante non devono essere trascurati quando la coltura delle cellule in piastre. A seconda del tipo in incubatrice e l'ambiente di lavoro, può essere necessario posizionare un recipiente di acqua sterile all'interno dell'incubatrice. Per minimizzare evaporazione media, utilizzare T-muffola chiusa o conservare piatti di coltura in un contenitore di plastica sigillato ermeticamente mentre all'interno dell'incubatrice.
È importante sviluppare una pianificazione per subcoltura linee di cellule di Drosophila . Per stimare la consistenza di monitor e tasso di crescita, è conveniente alla subcoltura un rapporto anche geometriche (split rapporto 1:2, 1:4, 1:8). Ad esempio, un piatto di 10ml confluenti di cellule Kc167 a 8 x 106 cellule/mL può essere suddiviso in rapporto di 1:8 per ottenere una densità di semina di 1 x 106 cellule/mL (1,25 mL di sospensione cellulare diluito in 8,75 mL di terreno fresco). In 72 h, Kc167 culture dovrebbero proliferano ad una densità di 8 x 106 cellule/mL, dato il suo tempo di raddoppiamento di 24 h. Il rapporto di divisione è quindi determinato per facilitare una routine di sottocultura conveniente di fino a due volte alla settimana, garantendo che le cellule sono coltivate sempre nella loro fase di registro esponenziale di crescita. Questo permette una pianificazione regolare per subcoltura le cellule in modo che il momento di confluenza è troppo lungo né troppo breve. Se il tempo a confluenza è troppo breve, le cellule sono una subcoltura ad una densità di cella inferiore (più alto rapporto di divisione). Allo stesso modo, se il tempo per raggiungere la confluenza è troppo lungo, le cellule sono una subcoltura a una maggiore densità delle cellule (rapporto di divisione inferiore). È importante notare che la maggior parte delle linee di cellule di Drosophila sono molto sensibili a densità bassa delle cellule (< 1 x 105 cellule/mL), in cui le cellule difficilmente proliferano e possono anche morire.
Linee cellulari di Drosophila variano in morfologia e caratteristiche di crescita. Di conseguenza, linee cellulari con proprietà distinte potrebbero essere necessario essere gestiti in modo diverso. La maggior parte delle linee di cellule di Drosophila sono semi-aderente. A bassa densità cellulare, essi aderiscono più forte alla superficie di crescita e come la cultura diventa confluente, le cellule diventano meno aderenti e staccano facilmente. Questo cambiamento graduale nella adesione cellulare facilita la facile subcoltura di più ampiamente usate linee di cellule di Drosophila (Schneider, Kc, disco immaginale e CNS linee) in quanto permette all'operatore di erogare semplicemente media sopra strato monomolecolare della cellula a cacciarli dalla superficie di crescita quando la cultura è densa. Per le linee che sono superficie aderente come la guaina somatica staminali/ovarico di germe-linea femminile (fGS/OSS) e le linee di Ras, è essenziale per incubare le cellule in tripsina per una breve durata per gli aiuti a staccare le cellule dalla superficie di crescita.
Aggiunte di media per la maggior parte delle linee di cellule di Drosophila includono siero fetale di vitello (FCS). Insulina ed Estratto di volare adulto (FEX) sono necessari per alcune linee specifiche. FEX contiene indefiniti componenti essenziali per la crescita delle linee di disco immaginale larvale specifico e le linee cellulari ovariche adulto. La DGRC prepara e rende disponibile FEX adulto derivato da 1 settimana vecchia Oregon-R-modENCODE mosche (RRID: BDSC_25211) in aliquote di 2,5 mL e 10 mL. La DGRC fornisce inoltre le istruzioni per la preparazione di FEX su piccola scala sul suo sito Web < https://dgrc.bio.indiana.edu/include/file/additions_to_medium.pdf>. Preparazione di FEX, tuttavia, richiede tempo e richiede una grande quantità di mosche adulte.
La crioconservazione delle varietà di cellula di Drosophila fa risparmiare tempo e reagenti per la manutenzione delle linee cellulari non in uso immediato. Crioconservazione avviene lentamente congelamento delle cellule (-1 ° C/min) a-80 ° C in un mezzo contenente DMSO, un agente crioprotettivo. La fase del raffreddamento lenta è critica per la crioconservazione di successo. In un congelatore a-80 ° C, la fiala delle cellule viene raffreddata ad un tasso di-1 ° C/min quando inserito in un contenitore di congelamento riempito con isopropanolo. A partire da 25 ° C di temperatura ambiente, ci vorranno fino a 2 h per la temperatura in fiale per raggiungere-80 ° C. Si consiglia di lasciare le fiale di congelare durante la notte.
Fiale congelati quindi devono essere rapidamente trasferiti in fase liquida di azoto per una conservazione prolungata. A temperatura ambiente, il cryovial sarà riscaldare rapidamente a circa 10 ° C/min e la redditività sarà compromessa presso sopra-50 ° C23. Per mantenere il trasferimento rapido, gestire fiale in piccoli lotti per ridurre al minimo l'esposizione a temperatura ambiente. In alternativa, posizionare il cryovials congelati sul ghiaccio secco mentre si prepara per il loro trasferimento in liquido N2. Se azoto liquido non è disponibile, le cellule possono essere conservate in un congelatore a-80 ° C, anche se con un rischio di deterioramento significativo nel corso del tempo.
Densità delle cellule è critica per successo crioconservazione e la successiva rinascita di linee cellulari. In generale, la nuova cella linee devono essere congelati per creare l'iniziale congelare (1−3 fiale) appena un eccesso di cellule diventa disponibile. Una volta che la linea cellulare è stato ulteriormente coltivata stabile, deve essere creato un azione congelate di 10−20 fiale. Questo stock è poi scongelato per verificare per il suo recupero post-congelamento delle cellule e la redditività, dopo di che viene propagato per sperimentazioni o per sostituire il brodo quando il numero di fiale stock congelati scende di sotto di cinque. Infine, è importante convalidare che le cellule scongelate conservano le caratteristiche del suo stock parentale come linee cellulari sono noti per evolvere3,24.
In conclusione, questo articolo presenta un primer per l'utilizzo di colture di cellule di Drosophila , fornendo le informazioni fondamentali sulle varie linee, best practice e protocolli di audiovisivi per la gestione di base delle varietà di cellula di Drosophila . Questa risorsa accessibile si intende senza intoppi agevolano l'introduzione di lavorare con le cellule coltivate di Drosophila e integrare le guide di formazione esistenti presso qualsiasi laboratorio di ricerca.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo il National Institutes of Health (premio NIH P40OD010949) e la comunità di ricerca per utilizzare le varie risorse del DNA/vettore/cella d. melanogaster curate presso la DGRC.
Materiali
| Name | Company | Catalog Number | Comments |
| 100 mm tissue culture plates | Corning | 430167 | Subculturing |
| 25 cm2 T-flask | Corning | 430168 | Subculturing |
| 35HC Liquid Nitrogen Storage Tank | Taylor-Wharton | 35HCB-11M | Cryopreservation |
| Automated Cell counter | BIO-RAD | TC20 | Counting |
| Bactopeptone | BD BioSciences | 211677 | Medium additions |
| Counting Slides | BIO-RAD | 145-0011 | Counting |
| Cryovial 1 mL | Greiner | 123263 | Cryopreservation |
| DMSO | Sigma Aldrich | D5879 | Cryopreservation |
| Freezing Box | Nalgene | 5029-0909 | Cryopreservation |
| Freezing Container | Fisher Scientific | 15-350-50 | Cryopreservation |
| Hematocytometer | Fisher Scientific | #0267110 | Counting |
| Human Insulin | Millipore Sigma | I9278 | Medium additions |
| Hyclone CCM3 media | GE Healthcare Life Sciences | SH30061.03 | Medium |
| Hyclone Fetal Bovine Serum | GE Healthcare Life Sciences | SH30070.03 | Medium additions |
| L-Glutamic acid potassium salt monohydrate | Millipore Sigma | G1149 | Medium additions |
| L-Glutathione reduced | Millipore Sigma | G6013 | Medium additions |
| Potassium Bicarbonate | Millipore Sigma | 237205 | Medium additions |
| Select Yeast Extract | Millipore Sigma | Y1000 | Medium additions |
| Shields and Sang's M3 Insect medium | Millipore Sigma | S8398 | Medium |
| Trpsin-EDTA (0.05 %), phenol red | ThermoFisher Scientific | 25300054 | Subculturing |
| Trypan Blue (0.4%) | BIO-RAD | 145-0013 | Counting |
Riferimenti
- Baum, B., Cherbas, L., Dahmann, C. Drosophila: Methods and Protocols. Methods in Molecular Biology. 420, 391-424 (2008).
- Cherbas, L., Gong, L. Cell lines. Methods. 68 (1), 74-81 (2014).
- Luhur, A., Klueg, K. M., Zelhof, A. C. Generating and working with Drosophila cell cultures: Current challenges and opportunities. Wiley Interdisciplinary Reviews: Developmental Biology. , e339 (2018).
- Franz, A., Brunner, E., Basler, K. Generation of genome-modified Drosophila cell lines using SwAP. Fly (Austin). 11 (4), 303-311 (2017).
- Housden, B. E., et al. Identification of potential drug targets for tuberous sclerosis complex by synthetic screens combining CRISPR-based knockouts with RNAi. Science Signaling. 8 (393), r9 (2015).
- Kunzelmann, S., Bottcher, R., Schmidts, I., Forstemann, K. A Comprehensive Toolbox for Genome Editing in Cultured Drosophila melanogaster Cells. G3 (Bethesda). 6 (6), 1777-1785 (2016).
- Ishizu, H., Sumiyoshi, T., Siomi, M. C. Use of the CRISPR-Cas9 system for genome editing in cultured Drosophila ovarian somatic cells. Methods. 126, 186-192 (2017).
- Echalier, G. . Drosophila Cells in Culture. , (1997).
- Echalier, G., Perrimon, N., Mohr, S. . Drosophila cells in culture. 2nd edition. , (2017).
- Cherbas, L., Cherbas, P., Roberts, D. B. . Drosophila: A practical approach. 10, 319-346 (1998).
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. Journal of Embryollgy and Experimental Morphology. 27 (2), 353-365 (1972).
- Echalier, G., Ohanessian, A. Isolement, en cultures in vitro, de lignees cellulaires diploides de Drosophila melanogaster. Comptes rendus de l'Académie des Sciences. 268, 1771-1773 (1969).
- Ui, K., et al. Newly established cell lines from Drosophila larval CNS express neural specific characteristics. In Vitro Cellular & Developmental Biology − Animal. 30A (4), 209-216 (1994).
- Ui, K., Ueda, R., Miyake, T. Cell lines from imaginal discs of Drosophila melanogaster. In Vitro Cellular & Developmental Biology. 23 (10), 707-711 (1987).
- Currie, D. A., Milner, M. J., Evans, C. W. The growth and differentiation in vitro of leg and wing imaginal disc cells from Drosophila melanogaster. Development. 102, 805-814 (1988).
- Niki, Y., Yamaguchi, T., Mahowald, A. P. Establishment of stable cell lines of Drosophila germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 103 (44), 16325-16330 (2006).
- Saito, K., et al. A regulatory circuit for piwi by the large Maf gene traffic jam in Drosophila. Nature. 461 (7268), 1296-1299 (2009).
- Simcox, A., et al. Efficient genetic method for establishing Drosophila cell lines unlocks the potential to create lines of specific genotypes. PLoS Genetics. 4 (8), e1000142 (2008).
- Sumiyoshi, T., et al. Loss of l(3)mbt leads to acquisition of the ping-pong cycle in Drosophila ovarian somatic cells. Genes & Development. 30 (14), 1617-1622 (2016).
- Dequeant, M. L., et al. Discovery of progenitor cell signatures by time-series synexpression analysis during Drosophila embryonic cell immortalization. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 12974-12979 (2015).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Shields, G., Sang, J. H. Improved medium for culture of Drosophila embryonic cells. Drosophila Information Service. 52, 161 (1977).
- Freshney, R. I., Capes-Davis, A., Gregory, C., Przyborski, S. . Culture of animal cells : a manual of basic technique and specialized applications. Seventh edition. edn. , (2016).
- Lee, H., et al. DNA copy number evolution in Drosophila cell lines. Genome Biology. 15 (8), R70 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon