Method Article
Utilizzo di cellule staminali pluripotenti indotte umane per la generazione di cellule T specifiche dell'antigene tumorale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo articolo viene descritto un metodo per generare un metodo per generare un sistema di cocoltura indotto da cellule staminali indotto specifico dell'antigene del tumore funzionale, cd8- singole cellule T positive utilizzando il sistema di co-coltura OP9/DLL1.
Abstract
La generazione e l'espansione di cellule T funzionali in vitro può portare a un'ampia gamma di applicazioni cliniche. Uno di questi usi è per il trattamento di pazienti con cancro avanzato. Adotta trasferimento di cellule T (ACT) di cellule T altamente arricchite antigene-specifico ha dimostrato di causare regressione durevole del cancro metastatico in alcuni pazienti. Tuttavia, durante l'espansione, queste cellule possono diventare esauste o senescenti, limitando la loro funzione emorservere e la persistenza in vivo. La tecnologia delle cellule staminali pluripotenti indotte (iPSC) può superare questi ostacoli portando alla generazione in vitro di un gran numero di cellule T specifiche dell'antigene tumorale meno differenziate. L'iPSC umano (hiPSC) ha la capacità di differenziarsi in qualsiasi tipo di cellula somatica, compresi i linfociti, che mantengono il riarrangiamento genomico del recettore delle cellule T (TCR) originale quando una cellula T viene utilizzata come cellula iniziale. Pertanto, la riprogrammazione delle cellule T specifiche dell'antigene tumorale umano a hiPSC seguita da ridifferenziazione al lignaggio delle cellule T ha il potenziale di produrre cellule T specifiche dell'antigene tumorale ringiovanite. Descritto di seguito è riportato un metodo per la generazione di CD8 - specifico dell'antigene tumorale:singole cellule T positive (SP) da hiPSC utilizzando il sistema di cocoltura OP9/DLL1. Questo metodo è un potente strumento per la generazione di lignaggio cellulare In vitro e faciliterà lo sviluppo di cellule T derivate in vitro da utilizzare nella medicina rigenerativa e nelle terapie basate sulle cellule.
Introduzione
Oltre ai vantaggi fisiologici, le cellule T hanno molte potenziali applicazioni terapeutiche. La generazione e l'espansione delle cellule T in vitro può essere utilizzata per la modellazione della malattia e la convalida terapeutica, nonché una fonte di trattamento per gli stati di immunodeficienza ereditari e acquisiti (cioè immunodeficienze virali e linfodeption secondario chemioterapia o trapianto) e per l'eradicazione del cancro. Quest'ultima qualità ha portato allo sviluppo del trasferimento adottivo delle cellule T (ACT) per il trattamento di pazienti con cancro avanzato1.
ACT consiste nel resezionare il tumore di un paziente, estrarre linfociti infiltrati di tumore (TIL), espandere TILs ex vivo, quindi reinserire le cellule espanse nel paziente2. È stato dimostrato di essere una modalità di trattamento efficace per alcuni pazienti con cancro metastatico. Purtroppo, non tutti i pazienti rispondono a questa terapia. I rapporti precedenti hanno dimostrato che lo stato di differenziazione delle celle trasferite3,4,5,6,7,8,9, l'utilizzo di grandi numeri di cellule T altamente arricchite di antigene-specifico10, e la persistenza delle cellule T dopo il trasferimento11,12 sono tutti correlati con risposte più durevoli13,14. Pertanto, quando ACT non riesce a suscitare una risposta anti-tumorale, può in parte essere dovuta a una bassa resa di cellule T specifiche dell'antigene del cancro, all'espansione inefficiente dell'ex vivo che porta all'esaurimento e alla perdita di cloni reattivi o alla mancanza di persistenza dopo il trasferimento4 . È stato ipotizzato che questi ostacoli possano essere superati dalla generazione di un gran numero di cellule T specifiche dell'antigene del cancro meno differenziate in vitro15,16.
Le cellule staminali/progenitrici ematopoietiche (HPG) sono una fonte convenzionale per la generazione di cellule T in vitro, anche se questo metodo è limitato dal piccolo numero di cellule in grado di essere recuperate da un singolo donatore1. Le cellule staminali embrionali (ESC) hanno anche dimostrato di produrre cellule T ma con bassa resa17, rendendolo inefficiente per le applicazioni cliniche. Inoltre, poiché le cellule lignaggio T sperimentano una ricombinazione genetica stocastica dei loro recettori delle cellule T (TCR) nelle fasi iniziali dello sviluppo, non è possibile utilizzare HSPC o ESC per generare una popolazione pura di cellule T specifiche dell'antigene senza ulteriori come la trasduzione genica TCR.
Un approccio per superare questi avvertimenti è quello di riprogrammare i TIL alle cellule staminali pluripotenti indotte dall'uomo (hiPSC), che possono fornire una fonte illimitata per la generazione di cellule T in vitro. È stato dimostrato che i TIL specifici dell'antigene del cancro possono essere riprogrammati in hiPSC e ridifferenziati al lignaggio delle cellule T, che mantiene lo stesso riarrangiamento genico del recettore delle cellule T (TCR) della cellula T originale18,19. Questo dettaglio è importante per ACT perché i tumori individuali dei pazienti hanno profili mutazionali unici e pochissimi antigeni tumorali hanno dimostrato di essere condivisi tra i pazienti20. Pertanto, l'utilizzo di TIL specifici dell'antigene del cancro come fonte per la generazione in vitro di cellule T derivate da hiPSC può fornire una nuova strategia per il trattamento personalizzato dei pazienti con cancro metastatico.
Presentato qui in dettaglio è un protocollo per differenziare le cellule di lignaggio T derivate da hiPSC in CD8 - specifico dell'antigene funzionale :singole cellule T positive (SP) utilizzando il sistema di cocoltura OP9/DLL1. Questo metodo è un potente strumento per la differenziazione delle cellule T in vitro di hiPSC, progenitori ematopoietici e cellule staminali embrionali, nonché le loro ulteriori applicazioni nella medicina rigenerativa e nelle terapie basate sulle cellule.
Protocollo
1. Culturing Human iPSCs (hiPSCs) su fibroblasti embrionali di topo (MEF)
NOT: Possono essere utilizzati anche metodi alternativi per coltivare gli pAFFETTI, tra cui, ma non solo: semina su una piastra di 6 pozzetti pre-rivestita con gelatina, una miscela di proteine gelatinose, lamininina ricombinante 511 o qualsiasi altra matrice extracellulare utilizzata nell'espansione hiPSC, e coltivati utilizzando mezzi definiti appositamente formulati per la coltura delle cellule staminali pluripotenti umane.
-
Culturazione MEF
- Rivestire un piatto Petri di coltura cellulare di 10 cm con 4 mL di gelatina dello 0,1% e incubare per 30 min a 37 gradi centigradi.
- Scongelare rapidamente una fiala di 4 x 106 MEF irradiata in 10 mL di un supporto da 37 MEF (DMEM - 10% FBS - 1x penicillina-streptomycin - supplemento di l-glutamina). Centrifuga a 300 x g per 5 min a 4 gradi centigradi. Aspirare il supernatante e risospendere il pellet cellulare in 9 mL di supporti MEF.
- Rimuovere il piatto rivestito di gelatina dall'incubatrice. Gelatina aspirata e aggiungere 7 mL di supporti MEF. Piastra 3 mL di sospensione MEF (dal punto 1.1.2) sul piatto rivestito di gelatina. Rock il piatto da un lato all'altro e front-to-back per garantire una distribuzione uniforme di MEF sul piatto. Incubare a 37 gradi centigradi per 8-36 h.
-
Passaging hiPSC su MEF
NOTA: i dati sono stati generati utilizzando MART-1 iPSC derivato da melanoma coltivato a lungo termine TIL, che riconoscono specificamente il peptide MART-1 nel contesto di HLA-A-02:01, come descritto in precedenza18.- Passaggio hiPSCs quando le colonie sono tra 0,8 - 1,2 mm di diametro. Prima di passare, controllare le colonie hiPSC in uno stereo-microscopio e rimuovere eventuali aree di differenziazione dalla coltura utilizzando il bordo di plastica di una punta di 200 .
- Aspirate ha speso i media e aggiungere 10 mL hiPSC media (media di coltura eS umana [Tabella dei materiali] - 10 ng/mL fattore di crescita del fibrollo di base umano [hbFGF]) integrato con 10 m inibitore rock.
- Tenere il piatto di coltura cellulare in una mano e rotolare uno strumento di passaging cellulare usa e getta su tutto il piatto in una direzione. Applicare una pressione sufficiente in modo che l'intera lama del rullo tocchi il piatto di coltura e mantenga una pressione uniforme durante l'azione di rotolamento.
- Ruotare il piatto di coltura di 90 gradi e ripetere il passaggio 1.2.3. Vedere la piastra nel microscopio per confermare visivamente il corretto taglio delle colonie, che dovrebbe apparire a scacchi. Staccare le colonie tagliate con un delicato lavaggio meccanico utilizzando una pipetta da 200.L.
NOT: Distacco di colonie tagliate da lavaggio meccanico deve essere fatto immediatamente dopo il taglio colonie con il rullo, perché dopo 3 min le colonie tagliate inizieranno a riattaccarsi al piatto, e diventerà difficile staccare colonie di dimensioni omogenee con il lavaggio. - Trasferire 350 - 600 ciuffi di colonie tagliate su un nuovo piatto di 10 cm di MEF (placcato 8 - 36 h prima del passaggio hiPSC) con 10 mL di supporti hiPSC freschi integrati con 10M inibitore rock. Incubare a 37 gradi centigradi.
NOTA: 600 grumi rappresentano circa 1,0 x 106 MART-1 iPSC e produrranno 0,5-1,0 x 106 cellule DP il giorno 35. Tuttavia, i numeri previsti variano a seconda della potenza della linea cellulare iniziale e delle condizioni di coltura. - Il giorno seguente, Aspirate ha speso supporti e aggiungere 10 mL di nuovi supporti hiPSC. Cambia i supporti hiPSC ogni 1-2 giorni a seconda del tasso di crescita hiPSC.
2. Preparazione delle celle OP9/DLL1 per la co-cultura con hiPSC
- Cellule OP9/DLL1 di coltura nei media OP9 [mezzo minimo essenziale di z) - siero bovino fetale del 20% (FBS) - 1x penicillina-streptomycin] a 37 gradi centigradi. Quando le cellule OP9/DLL1 raggiungono la confluenza, aspirano i supporti e si lavano una volta con 5 mL di 1x magnesio, calcio e fenolo galleggiare in nero (PBS) con nefosato rosso.
- Aspirate PBS e aggiungere 2 mL di 0.05% Trypsin-EDTA. Incubare per 5 min a 37 gradi centigradi. Quindi, aggiungere 4 mL di supporti OP9 e dissociare meccanicamente lo strato di cella pipettando per effettuare una sospensione a cella singola.
- Trasferire la sospensione cellulare in un tubo conico da 50 mL attraverso un colino cellulare da 100 m per evitare grumi cellulari. Centrifuga a 300 x g per 5 min a 4 gradi centigradi. Aspirate il supernatante e resuspend in 12 mL di OP9 media.
- Aggiungete 8 mL di supporti OP9 a ciascuno dei sei nuovi piatti Petri per colture cellulari da 10 cm. Piastra 2 mL di sospensione della cella OP9/DLL1 dal passaggio 2.3 su ogni nuovo piatto di 10 cm. Rock il piatto da un lato all'altro poi front-to-back per garantire una distribuzione uniforme di OP9/DLL1 sul piatto.
- Incubare a 37 gradi centigradi. Ripetere il passaggio ogni 2 - 3 giorni quando le cellule raggiungono la confluenza.
NOT: È importante fare abbastanza scorte congelate di cellule OP9/DLL1 e scongelare un nuovo stock ogni 4-6 settimane.
3. Differenziazione in vitro degli hiPSC in CD8- Singola Positiva (SP) Cellule T
- Preparare i piatti OP9/DLL1 gelatinizzati una settimana prima della co-cultura con hiPSC. Per preparare la soluzione di gelatina dello 0,1%, aggiungere 5 mL di temperatura ambiente (RT) soluzione di gelatina di stock di qualità sutale a 500 mL di PBS.
- Cappotto 3 nuova coltura cellulare 10 cm piatti Petri con l'aggiunta di 4 mL per piatto di 0.1% gelatina. Incubare 30 min a 37 .
- Aspirare la gelatina e aggiungere 8 mL di supporti OP9 ad ogni piatto. Passare un piatto confluente di OP9/DLL1 (come fatto nella sezione 2 sopra) a tre piatti pre-rivestiti di gelatina.
- Dopo 4 giorni, aggiungere 10 mL di supporti OP9 a ogni piatto di 10 cm di OP9/DLL1 sulla gelatina, per un totale di 20 mL di supporti per piatto.
- Dopo 7 - 8 giorni, iniziare la co-cultura hiPSC su piatti confluenti OP9/DLL1 (giorno di differenziazione 0).
- Aspirate ha speso i media dal piatto confluente di 10 cm di hiPSCs su MEF. Aggiungere 10 mL di supporti OP9. Tagliare e staccare le colonie hiPSC utilizzando uno strumento di passaging di cellule usa e getta come fatto nei passaggi 1.2.3 e 1.2.4.
- Trasferire 350 - 600 ciuffi di colonie tagliate su un piatto OP9/DLL1 pre-congelatinato di 10 cm (passaggio 3.1) con 10 mL di supporti OP9 freschi utilizzando una pipetta OP9 da 200 cm. Rock il piatto di cultura da un lato all'altro poi front-to-back per garantire la distribuzione anche delle colonie.
NOTA: In alternativa, possono essere utilizzati corpi embrionali hiPSC (EB) preformati o piccole sospensioni lump. Tuttavia, l'uso di uno strumento di passaging cellulare usa e getta o di un sistema di formazione EB è preferibile per produrre grumi hiPSC di dimensioni uniformi.
- Il primo giorno, aspirate ha speso i supporti e sostituito con 20 mL di nuovi supporti OP9. I grumi hiPSC co-coltivati su OP9/DLL1 per 1 giorno appariranno come piccole colonie di monostrato rotonde (Figura 1).
- Il giorno 5, aspirare 10 mL di supporti esauriti e aggiungere 10 mL di supporti OP9 freschi. le colonie hiPSC inizieranno a differenziarsi in mesodermi primitivi, caratterizzato da un centro scuro multistrato.
- Il giorno 9, aspirare 10 mL di supporti esauriti e aggiungere 10 mL di supporti OP9 freschi. A questo punto, le strutture centrali a più livelli si evolveranno in forme simili a una cupola e un'area di tipo rete periferica inizierà a diventare evidente.
- Il giorno 13, raccogliere le cellule progenitrici ematopoietiche (HMC) (Figura 1). Strutture di derivazione hiPSC il giorno 13 sono caratterizzate da un organoide centrale scuro circondato da una rete di aree simili a cupola, rappresentative delle zone ematopoietiche (H) precedentemente riportate per racchiudere i progenitori progenitori ematopoietici derivati da cellule staminali umane 21.
NOTA: La presenza delle strutture a cupola indica un processo di successo anche in assenza di centri oscuri. L'incapacità di produrre HPC può essere dovuta alla scarsa qualità di OP9/DLL1, alla qualità del lotto FBS, alla confluenza dei grumi iPSC seminati su OP9/DLL1 (350-600 grumi è ottimale) e/o variazioni nella potenza delle linee iPSC per produrre precursori ematopoietici.- Aspirate ha speso i supporti e lava 1x con 5 mL di 1x fenolo senza rosse soluzione di sale di Hanks esordiere modificato con calcio e magnesio (HBSS).
- Aspirare HBSS e aggiungere 250 L di 5000 Unità/mL collagenasi IV in 10 mL di HBSS. Incubare a 37 gradi centigradi per 45 min. Aspirate HBSS con collagenane IV e lavare una volta con 5 mL di PBS.
- Aspirate PBS e aggiungere 5 mL di 0.25% Trypsin-EDTA. Incubare a 37 gradi centigradi per 20 min. Quindi, aggiungere 4 mL di supporti OP9 e dissociare lo strato di cella pipettando per effettuare una sospensione a cella singola.
- Trasferire la sospensione cellulare in un tubo conico da 50 mL attraverso un colino cellulare da 100 m. Centrifuga a 300 x g per 5 min a 4 gradi centigradi. Aspirate il supernatante e resuspend in 10 mL di OP9 media.
- Sospensione cellulare piatta su un nuovo piatto Petri gelatinizzato di 10 cm di coltura cellulare (vedere i passaggi 3.1.1 e 3.1.2). Incubare a 37 gradi centigradi per 45 min. Quindi, raccogliere le cellule non aderenti con pipettaggio delicato.
- Trasferimento della sospensione cellulare raccolta in un tubo conico da 50 mL attraverso un colino cellulare di 100 m. Centrifuga a 300 x g per 5 min a 4 gradi centigradi. Aspirati il superatante e resuspend in 10 mL di supporti di differenziazione [OP9 media con 5 ng/mL fattore di cellule staminali umane (hSCF), 5 ng/mL del ligando flt3 umano (hFLT3L) e 5 interleuchina umana ng/mL 7 (hIL-7)].
- Piastrare la sospensione cellulare su un nuovo piatto confluente OP9/DLL1 di 10 cm.
- Il giorno 16, passare le cellule.
- Staccare meccanicamente le cellule non aderenti con una leggera pipettatura e filtrare attraverso un colino cellulare di 100 m. Centrifuga a 300 x g per 5 min a 4 gradi centigradi. Aspirare il supernatante e resuspend in 10 mL di differenziazione media.
- Piastrare la sospensione cellulare su un nuovo piatto confluente OP9/DLL1 di 10 cm.
- Continuare a passare le cellule non aderenti ogni 5-7 giorni successivi ripetendo il passaggio 3.8.
- Il giorno 35, arricchire la popolazione di CD4,CD8, doppia mente positiva (DP) e stimolare a produrre le cellule T di CD8 ,SP (Figura 2).
- Staccare meccanicamente le cellule non aderenti con un pipettaggio delicato e filtrare attraverso un colino cellulare di 100 m per rimuovere i grumi cellulari. Arricchire l'isolamento delle perline magneticheCD4 per via di leali in base al protocollo del produttore.
NOTA: La logica per l'utilizzo di perline magnetiche CD4 è quella di rimuovere le cellule CD4-CD8- DN dalla coltura, in quanto queste hanno dimostrato di causare l'uccisione diretta di CD4-CD8- cellule DP dopo la stimolazione22. - Contare le cellule arricchite CD4 dal vivo utilizzando un emocitometro Neubauer e un colorante blu Trypan. Sospendere nel supporto OP9 alla concentrazione totale 0,5 x 106 celle/mL. Aliquota 1 mL della sospensione cellulare (0,5 x 106 celle) in ogni pozzo di una coltura tissutale piatta inferiore 24 bene piastra di confluente OP9/DLL1.
- Aggiungere 100 iU interleucolo 2 (hIL-2), 5 ng/mL hIL-7, 500 anti-umani anti-umani anticorpi e 2 anti-umani anti-umani anti-uomo.
- Il giorno 4 - 7 dopo la stimolazione, raccogliere le cellule per l'analisi molecolare (Figura 3)o co-coltura con cellule di presentazione dell'antigene a impulsi di peptidi (APC).
- Staccare meccanicamente le cellule non aderenti con un pipettaggio delicato e filtrare attraverso un colino cellulare di 100 m per rimuovere i grumi cellulari. Arricchire l'isolamento delle perline magneticheCD4 per via di leali in base al protocollo del produttore.
4. Misurazione della specificità dell'antigene delle cellule hiPSC Derivate CD8
NOT: Il tipo di APC da utilizzare per questa esposizione dipende dalla restrizione MHC delle cellule T derivate da hiPSC. Qui, viene utilizzata la linea cellulare T2, che è un ibrido di linee cellulari linfoblastoidi T e B. Le celle T2 esprimono HLA-A-02:0123, riconosciuto dalle celle JKF6 da cui è stato derivato MART1-iPSC. Questa linea cellulare T2 può essere espansa in RPMI 1640 - 20% FBS - 1x penicillina-streptomicina ed è passaggiata quando le cellule raggiungono una densità di 5 x 105 cellule / mL.
- Conte in diretta delle cellule T2 di HLA-A-02:01- T-B utilizzando un emocitometro Neubauer e un colorante blu Trypan. Incubare gli APC in 24 placche di coltura dei tessuti con peptide MART-1 di 1 g/mL per 2 h a 37 gradi centigradi.
NOT: La concentrazione ottimale dei peptidi è variabile, a seconda della linea cellulare e della specificità dell'antigene. - Raccogliere APC e lavare 2x con 10 mL di PBS per rimuovere qualsiasi peptide in più.
- Contare gli APC e sospendere a 2 – 5 x 105 celle /mL nei supporti OP9 con 100 IU IL-2 e 5 ng/mL IL-7. Aliquota 100 L di sospensione cellulare (2-5 x 104 celle) in ogni pozzo di un attacco ultra-basso U inferiore 96 bene piastra o direttamente in una piastra ELISpot pre-rivestito.
- Ordinare le cellule CD8- SP T derivate da hiPSC (1 settimana dopo la stimolazione anticorpale anti-uomo CD3/CD28) utilizzando una selezionatrice cellulare e sospendere a 1 x 106 celle/mL nei supporti OP9 con 100 IU IL-2 e 5 ng/mL IL-7. Aliquota 100 L di sospensione cellulare (1 x 105 celle) in ogni pozzo di APC e coltura per 16 - 20 h a 37 gradi centigradi.
- Dopo 16 - 20 h, analizzare il profilo di secrezione di citochine da ELISpot saggio per il protocollo del produttore (Figura 4).
Risultati
Dopo 13 giorni di co-coltura di psPSC con OP9/DLL1, sono apparsi CD34,CD33, cellule progenitrici ematopoietiche (Figura 1). Dopo ulteriori 22 giorni di coltura su OP9/DLL1 non gelatinizzati in presenza di cellule di lignaggio T hSCF, hFLT3L e hIL-7, i progenitori ematopoietici si sono differenziati in CD3,CD7,CD4,CD4,cellule di lignaggio T la maggior parte dei quali esprimeva TCR specifico per l'epitopo MART-1 (tetramero) (Figura 2).
È stato dimostrato in precedenza che le cellule T CD8e SP possono essere indotte da cellule CD4eCD8e DP T tramite segnalazione tramite peptidi agonista o stimolazione TCR guidata da anticorpi24,25. Pertanto, il giorno 35 della coltura, le cellule Cd4,CD8- DP T, derivate dall'hiPSC, sono state stimolate con anticorpi anti-umani CD3 e CD28 anti-umani in presenza di hIL-7 e hIL-2. Quattro giorni dopo la stimolazione, il numero di cellule CD3-CD8- SP è aumentato drasticamente ed è rimasto specifico per l'epitopo MART-1, confermando la conservazione della loro specificità dell'antigene ereditato (Figura 3).
Per determinare le proprietà funzionali delle cellule T derivate dall'hiPSC, è stata analizzata l'attivazione dipendente dall'antigene e la secrezione della gamma di interferone (IFN-z). Dopo la stimolazione con anticorpi anti-umani CD3 e CD28 anti-umani per 1 settimana, le cellule T di HIPSC- -sono state isolate utilizzando una selezionatrice di cellule e co-coltivate con la linea cellulare T2 che esprime HLA-A-02:01 con o senza cognato PEPtide MART1 per 16 - 20 h. Il saggio ELISpot ha rivelato che le cellule di SC8- S. SP non riscevogliono una maggiore quantità di IFN rispetto alle cellule T di CD8, se coltivate in presenza di peptide MART-1. L'espressione IFN-z era nulla solo per le cellule T e gli APC, dimostrando che le cellule T derivate da T-iPSC sono specifiche dell'antigene e funzionali (Figura 4).
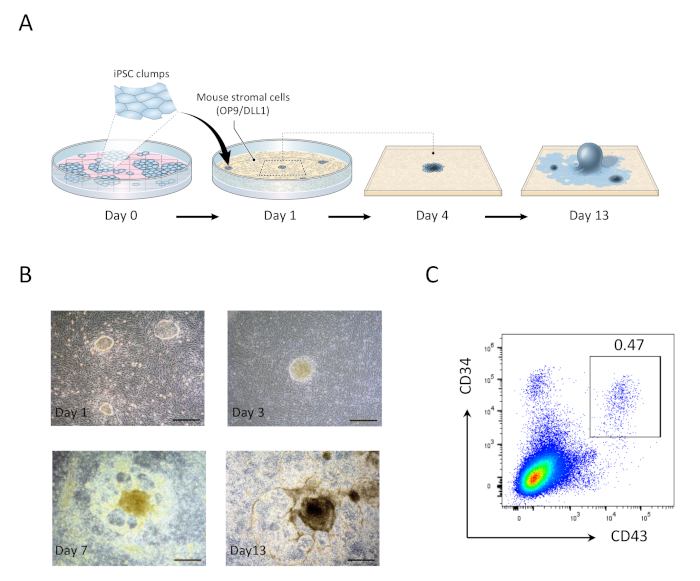
Figura 1: Generazione di cellule progenitrici ematopoietiche derivate da hiPSC. (A) Panoramica schematica della differenziazione degli hiPSC al lignaggio ematopoietico utilizzando la co-cultura OP9/DLL1. (B) Aspetto delle strutture derivate da hiPSC nei giorni 1 (in alto a sinistra), 3 (in alto a destra), 7 (in basso a sinistra) e 13 (in basso a destra). Barre di scala - 100 x m. (C) Analisi citometrica del flusso di cellule CD34- CD344 derivate da hiPSC - CD43- ematopoietiche il giorno 13. I dati sono rappresentativi di sei esperimenti indipendenti (n - 1 a 2). Fare clic qui per visualizzare una versione più grande di questa figura.
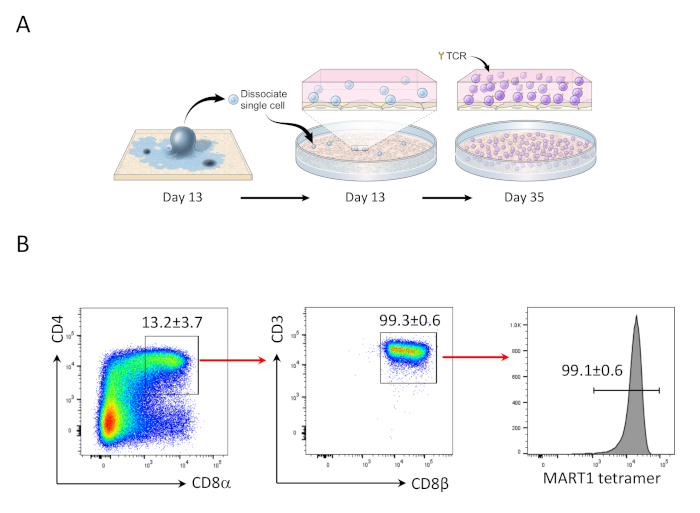
Figura 2: differenziazione hiPSC nelle celle Mart1, CD4,CD8, DP T. (A) Panoramica schematica della differenziazione del lignaggio ematopoietico derivato da hiPSC alle cellule T immature utilizzando la co-coltura OP9/DLL1. (B) Analisi citometrica del flusso delle espressioni T CD4 rispetto a CD8, CD3 e CD8 e MART-1 nelle cellule T derivate da hiPSC il giorno 35. Gated su linfociti, singole cellule, PI negativo. I dati sono rappresentativi di tre esperimenti indipendenti (n - 3 - 8). Fare clic qui per visualizzare una versione più grande di questa figura.
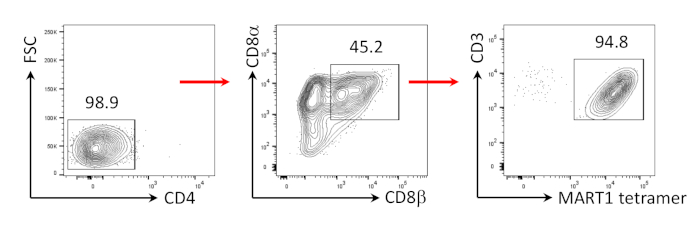
Figura 3: Induzione del fenotipo della cella di CD8- SP. Analisi citometrica del flusso delle cellule T CD4- derivate dall'hiPSC 4 giorni dopo la stimolazione umana anti-CD3 e anti-CD28 anti-CD28. Gated su linfociti, singole cellule, PI negativo (n ) . Fare clic qui per visualizzare una versione più grande di questa figura.
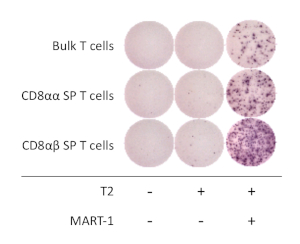
Figura 4: Specificità dell'antigene delle cellule di HIPSC - CLD - SP T . L'IFN-secrezione di ELISpot da parte di ELISpot è stata eseguita su un saggio di CD8, derivato da HIPSC, SP, CD8,SP, e cellule T sfuse dopo la co-coltura di 20 h con o senza cellule T2 pulsate (o meno) con peptide MART-1. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La co-coltura delle cellule stromali murine OP9 è un sistema ben consolidato per la generazione in vitro di linfociti (cioè cellule NK, B e T) da HSPC e cellule staminali pluripotenti. La segnalazione notch è necessaria per indurre l'impegno del lignaggio T e può essere eseguita dall'espressione ectopica di Notch ligand DLL1 o DLL4, che hanno un'efficacia comparabile per la generazione di cellule T1. Pertanto, il sistema di cocoltura OP9/DLL1 è diventato un metodo ampiamente utilizzato per produrre cellule T in vitro. Inoltre, questo metodo è applicabile per l'uso con diversi tipi e fonti di cellule umane, tra cui sangue cordonale, HSPC del midollo osseo e ESC. Tuttavia, la generazione di cellule T da queste fonti è limitata dal recupero insufficiente di cellule di origine o da una differenziazione inefficiente alle celle T1. Inoltre, un prodotto a cellule T con una singola ricombinazione TCR non può essere generato da queste fonti di repertorio aperto. Utilizzando tecniche di medicina rigenerativa, vale a dire la tecnologia delle cellule staminali pluripotenti indotte (iPSC), può essere possibile produrre un numero enorme di cellule T specifiche dell'antigene da utilizzare nelle terapie basate sulle cellule15.
gli psCS sono simili alle ESC pluripotenti nella loro capacità di auto-rinnovamento, espansione illimitata e potenziale di differenziarsi a qualsiasi tipo di cellula somatica nel corpo; tuttavia, mancano delle preoccupazioni etiche relative all'uso di prodotti di origine embrionale per applicazioni cliniche. Inoltre, gli hiPSC possono essere prodotti da qualsiasi cellula somatica, consentendo lo sviluppo di prodotti cellulari per la medicina personalizzata. In precedenti rapporti, hiPSC sono stati prodotti da cellule T umane che utilizzano intere cellule periferiche mononucleari, cellule CD3- o linfociti citotossici isolati (CTL) come fonte18,19,22, 26.Quando gli hiPSC vengono generati da una fonte di cellule T (T-iPSCs), viene ereditato il riarrangiamento del gene TCR originale. Pertanto, le cellule T derivate da T-iPSC possono fornire un modello per il trattamento ACT personalizzato prendendo di mira gli antigeni tumorali distinti di un paziente.
La differenziazione delle cellule staminali pluripotenti umane nelle cellule di lignaggio T è suddivisa in due fasi: la generazione di cellule progenitrici ematopoietiche (HMC)27 e la loro ulteriore differenziazione nelle cellule di lignaggio T21. Entrambi i passaggi possono essere eseguiti utilizzando il sistema di co-culture OP9/DLL1. È importante sottolineare che la qualità delle celle dell'alimentatore OP9/DLL1 è fondamentale per il successo della differenziazione delle celle T. Poiché le celle OP9/DLL1 non sono una linea cellulare omogenea immortalata, la qualità delle condizioni di coltura e FBS è fondamentale per mantenere la loro espansione senza perdere la capacità di supportare la differenziazione hiPSC. Pertanto, si consiglia di pre-valutare il lotto di FBS e il passaggio in modo coerente quando il contatto citoplasmico cellulare-cellula inizia a verificarsi, al fine di prevenire la differenziazione cellulare e la senescenza. Un punto da prendere in considerazione è che il contatto tra cellule può apparire indistinguibile dallo sfondo a seconda del contrasto di fase e dell'ingrandimento del microscopio. Nella nostra esperienza, la maggior parte dei piatti OP9/DLL1 sembrerà essere all'80% confluente quando è pronto al passaggio.
È stato dimostrato che le cellule di lignaggio T redifferenziate generate da T-iPSCs dalla cocoltura OP9/DLL1 possono produrre cellule T CD8- SP su stimolazione18,19. Tuttavia, le cellule DI Tipo di CD8e SP Trigenerate acquisiscono l'innato CD8,28, che è un co-recettore inefficace per la segnalazione TCR29. Inoltre, queste cellule CD8rigenerate hanno dimostrato una forte citotossicità indipendente da TCR, rendendo queste cellule sfavorevoli per uso clinico30. Questo protocollo descrive un metodo recente che prevede la stimolazione di celluleCD4purificate per la generazione di cellule T CD8 -SP con un fenotipo più convenzionale e una migliore citotossicità specifica dell'antigene22. Anche se la perdita di specificità dell'antigene a causa del riarrangiamento allelico secondario di TCR si verifica nella fase DP dopo una cultura prolungata a lungo termine, questo può essere superato dall'editing del genoma in T-iPSCs31. Secondo la nostra esperienza, le cellule DP derivate da hiPSC iniziano ad apparire il giorno 30 -35 di coltura, e queste cellule DP appena generate non sono ancora state sottoposte a un riarrangiamento secondario t. Pertanto, la maggior parte delle cellule DP del giorno 35 conservano la specificità dell'antigene e possono essere utilizzate per generare cellule CD8 -S-G specifiche dell'antigene.
Prima della stimolazione umana anti-CD3 e anti-CD28 il giorno 35, CD4-CD8- Le cellule DN devono essere rimosse dalla coltura, in quanto queste hanno dimostrato di causare l'uccisione diretta di cellule CD4eCD8, DP dopo la stimolazione22. L'utilizzo dell'arricchimento magnetico del tallone CD4 (passaggio 3.10) si arricchirà sia per DP che per CD4-CD8- cellule intermedie a singolo positivo (ISP)1, che abbiamo dimostrato non hanno effetti negativi22. In alternativa, è possibile eseguire lo smistamento delle cellule attivate dalla fluorescenza per citometria di flusso per isolare le cellule DP. Tuttavia, la separazione del perline magnetico è preferibile in quanto evita lo stress meccanico indotto dalla citometria di flusso.
La generazione di cellule T di CD8 -SP da cellule staminali pluripotenti umane senza selezione agonista mediata dall'attivazione è stata successivamente dimostrata dall'uso della coltura di cellule stromali murine 3D3D 32 32 . Tuttavia, la selezione positiva fisiologica dipende dall'interazione del TCR con complessi self-peptide-MHC, che vengono elaborati in modo univoco e presentati da cellule epiteliali corticali timiche33. Inoltre, è stato dimostrato che l'affinità TCR per i peptidi di selezione per i peptidi di selezione è stata dimostrata per determinare le successive capacità funzionali delle cellule matura CD8- SP T34. Attualmente, non ci sono prove che suggeriscano che un sistema di cocoltura basato sulle cellule stromali di Notch possa fornire il peptide di selezione definita e il complesso MHC necessari per la selezione positiva fisiologica.
È stato precedentemente riportato in un modello murino che le cellule di lignaggio T generate da hiPSC derivati da cellule T specifici dell'antigene del tumore che utilizzano OP9/DLL1 da soli non riescono a sperimentare la maturazione convenzionale. Tuttavia, le cellule T immature derivate da iPSC generate dal sistema OP9/DLL1 possono maturare in cellule T ingenue mediante un'ulteriore educazione timica fisiologica in un sistema di coltura 3D 28,35. Pertanto, il protocollo qui presentato per produrre cellule T immature derivate da iPSC generate dal sistema OP9/DLL1 è fondamentale per ulteriori tentativi di generare vere e proprie cellule T post-timiche specifiche dell'antigene del tumore umano in grado di persistere a lungo termine in vivo con l'efficienza per il trattamento di tumori vascolarizzati stabiliti.
Divulgazioni
Gli autori non hanno divulgazioni.
Riconoscimenti
Ringraziamo Alan B. Hoofring ed Erina H. Lui per l'assistenza grafica. Questa ricerca è stata sostenuta dal Programma di Ricerca Intramurale dell'Istituto Nazionale contro il Cancro e dall'Iniziativa NCI Cancer Moonshot per l'immunoterapia del cancro cellulare.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 cm dish | Corning, Inc. | 353003 | |
| Anti-CD3, human | BD Biosciences | Cat# 561812, RRID:AB_1089628 | |
| Anti-CD34, human | BD Biosciences | Cat# 348791, RRID:AB_400381 | |
| Anti-CD4, human | Biolegend | Cat# 344612, RRID:AB_2028479 | |
| Anti-CD43, human | BD Biosciences | Cat# 560198, RRID:AB_1645460 | |
| Anti-CD7, human | BD Biosciences | Cat# 555361, RRID:AB_395764 | |
| Anti-CD8a, human | BD Biosciences | Cat# 555369, RRID:AB_398595 | |
| Anti-CD8b, human | BD Biosciences | Cat# 641057, RRID:AB_1645747 | |
| Anti-TCRb, human | BD Biosciences | Cat# 555548, RRID:AB_395932 | |
| CD28 human monoclonal antibody (15E8), pure functional grade | Miltenyl Biotec | 130-093-375 | |
| CD3 human monoclonal antibody (OKT3), pure functional grade | Miltenyl Biotec | 130-093-387 | |
| CD4 Microbeads, human | Miltenyl Biotec | 130-045-101 | |
| Cell strainer 100 um | Fisher Scientific | 22-363-549 | |
| Fetal Bovine Serum (FBS) | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| Gelatin Solution 2% | SIGMA-Aldritch | G1393-100ML | |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | L-Glutamine supplement |
| HBSS Mg+Ca+ Phenol-Red Free | Gibco | 14025-092 | |
| Interleukin-2 | R&D Systems | 202-IL | |
| Interleukin-7 | R&D Systems | 407-ML | |
| iTAG MHC Tetramer HLA-A*0201 Mart1 Tetramer -ELAGIGILTV | MBL | Cat#TB-0009-2 | |
| Mart1-hiPSC | Vizcardo et al., Cell Stem Cell 2013 | RIKEN-IMS | |
| Melan-A, MART 1 (26-35) | InnoPep | 3146-0100 | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| αMEM powder | Gibco | 61100061 | |
| Mouse Embryonic Fibroblasts (MEF) | Thermo Fisher Scientific | C57BL/6 MEF MITC-TREATED 4M EACH; A34962 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | OP9/DLL1 |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Primate ES Cell Medium | Reprocell | RCHEMD001 | Human ESC Culture Media |
| Rhok inhibitor (Y-27632 dihydrochloride) | Tocris | 1254 | |
| RPMI 1640 | Gibco | 11875093 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| StemPro | EZPassage | 23181-010 | |
| T2-tumor | ATCC | T2 (174 x CEM.T2) (ATCC® CRL-1992™) | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200-072 | |
| U Bottom 96 well plate | Corning, Inc. | 3799 |
Riferimenti
- Brauer, P. M., Singh, J., Xhiku, S., Zuniga-Pflucker, J. C. T Cell Genesis: In Vitro Veritas Est. Trends in Immunology. 37 (12), 889-901 (2016).
- Rosenberg, S. A., Restifo, N. P. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 348 (6230), 62-68 (2015).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. Journal of Clinical Investigation. 115 (6), 1616-1626 (2005).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Crompton, J. G., et al. Lineage relationship of CD8(+) T cell subsets is revealed by progressive changes in the epigenetic landscape. Cellular and Molecular Immunology. 13 (4), 502-513 (2016).
- Henning, A. N., Klebanoff, C. A., Restifo, N. P. Silencing stemness in T cell differentiation. Science. 359 (6372), 163-164 (2018).
- Henning, A. N., Roychoudhuri, R., Restifo, N. P. Epigenetic control of CD8(+) T cell differentiation. Nature Reviews Immunology. 18 (5), 340-356 (2018).
- Vodnala, S. K., et al. T cell stemness and dysfunction in tumors are triggered by a common mechanism. Science. 363 (6434), (2019).
- Restifo, N. P., Gattinoni, L. Lineage relationship of effector and memory T cells. Current Opinion in Immunology. 25 (5), 556-563 (2013).
- Tran, E., et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science. 344 (6184), 641-645 (2014).
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Gautam, S., et al. The transcription factor c-Myb regulates CD8(+) T cell stemness and antitumor immunity. Nature Immunology. 20 (3), 337-349 (2019).
- Klebanoff, C. A., et al. Determinants of successful CD8+ T-cell adoptive immunotherapy for large established tumors in mice. Clinical Cancer Research. 17 (16), 5343-5352 (2011).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting through subsets: which T-cell populations mediate highly effective adoptive immunotherapy. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends in Immunology. 35 (4), 178-185 (2014).
- Crompton, J. G., Rao, M., Restifo, N. P. Memoirs of a reincarnated T cell. Cell Stem Cell. 12 (1), 6-8 (2013).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Reports. 2 (6), 1722-1735 (2012).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Lo, W., et al. Immunologic recognition of a shared p53 mutated neoantigen in a patient with metastatic colorectal cancer. Cancer Immunology Research. , (2019).
- Timmermans, F., et al. Generation of T cells from human embryonic stem cell-derived hematopoietic zones. Journal of Immunology. 182 (11), 6879-6888 (2009).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Salter, R. D., Howell, D. N., Cresswell, P. Genes regulating HLA class I antigen expression in T-B lymphoblast hybrids. Immunogenetics. 21 (3), 235-246 (1985).
- Snauwaert, S., et al. In vitro generation of mature, naive antigen-specific CD8(+) T cells with a single T-cell receptor by agonist selection. Leukemia. 28 (4), 830-841 (2014).
- Takahama, Y., Suzuki, H., Katz, K. S., Grusby, M. J., Singer, A. Positive selection of CD4+ T cells by TCR ligation without aggregation even in the absence of MHC. Nature. 371 (6492), 67-70 (1994).
- Seki, T., et al. Generation of induced pluripotent stem cells from human terminally differentiated circulating T cells. Cell Stem Cell. 7 (1), 11-14 (2010).
- Vodyanik, M. A., Slukvin, I. I. Hematoendothelial differentiation of human embryonic stem cells. Current Protocols in Cell Biology. , (2007).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- McNicol, A. M., et al. CD8alpha/alpha homodimers fail to function as co-receptor for a CD8-dependent TCR. European Journal of Immunology. 37 (6), 1634-1641 (2007).
- Themeli, M., Riviere, I., Sadelain, M. New cell sources for T cell engineering and adoptive immunotherapy. Cell Stem Cell. 16 (4), 357-366 (2015).
- Minagawa, A., et al. Enhancing T Cell Receptor Stability in Rejuvenated iPSC-Derived T Cells Improves Their Use in Cancer Immunotherapy. Cell Stem Cell. 23 (6), 850-858 (2018).
- Montel-Hagen, A., et al. Organoid-Induced Differentiation of Conventional T Cells from Human Pluripotent Stem Cells. Cell Stem Cell. 24 (3), 376-389 (2019).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Takada, K., et al. TCR affinity for thymoproteasome-dependent positively selecting peptides conditions antigen responsiveness in CD8(+) T cells. Nature Immunology. 16 (10), 1069-1076 (2015).
- Vizcardo, R., et al. A Three-dimensional Thymic Culture System to Generate Murine Induced Pluripotent Stem Cell-derived Tumor Antigen-specific Thymic Emigrants. JoVE. , e58672 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon