Method Article
Metodi culturali per determinare il limite di rilevamento e sopravvivenza nei mezzi di trasporto di Campylobacter Jejuni in Human Fecal Specimens
In questo articolo
Riepilogo
Anche se la coltura delle feci per Campylobacter è imprecisa, è ancora considerata il gold standard per l'identificazione. I metodi per determinare il limite di rilevamento e sopravvivenza nei mezzi di trasporto di C. jejuni nelle feci umane sono descritti e confrontati con una nuova immunoanalisi con una migliore precisione.
Abstract
Una coltura da feci umane per la diagnosi della malattia intestinale a base di Campylobacterrichiede diversi giorni, un'attesa che tassa la forza d'animo del medico e del paziente. Una coltura è anche incline a falsi risultati negativi dalla perdita casuale di vitalità durante la manipolazione del campione, dalla crescita eccessiva di altre flora fecali e dalla scarsa crescita di diverse specie patogene di Campylobacter sui media tradizionali. Questi problemi possono confondere le decisioni cliniche sul trattamento del paziente e hanno limitato il campo dal rispondere a domande fondamentali sulla crescita e le infezioni di Campylobacter. Descriviamo una procedura che stima il limite inferiore di numeri batterici che possono essere rilevati da una coltura e un metodo per quantificare la sopravvivenza di C. jejuni nei media utilizzati per il trasporto di questo fragile organismo. Conoscendo queste informazioni, diventa possibile impostare soglie di rilevamento clinicamente rilevanti per i test diagnostici e risolvere problemi non studiati circa la prevalente colonizzazione non sintomatica, se la coinfezione con altri patogeni enterici è comune, o se il carico batterico è correlato a sintomi o gravi sequele. Lo studio ha incluso anche il test di 1.552 campioni fecali di diarrea del paziente raccolti prospetticamente che sono stati inizialmente classificati dalla coltura convenzionale e ulteriormente testati da una nuova immunosposizione enzimatica. I campioni positivi e discrepanti sono stati poi vagliati con quattro metodi molecolari per assegnare lo stato vero positivo o vero negativo. I 5 metodi non-culturali hanno mostrato un accordo completo su tutti i 48 esemplari positivi e discrepanti, mentre la coltura ha identificato erroneamente 14 (28%). I campioni identificati erroneamente dalla coltura includevano 13 campioni falsi negativi e 1 campione falso positivo. Questo protocollo di base può essere utilizzato con più Campylobacter spp. e permetterà di determinare il numero di batteri Campylobacter che producono sintomi di gastroenterite negli esseri umani e di aggiornare i tassi di prevalenza.
Introduzione
Gli Stati Uniti Centers for Disease Control (CDC) hanno recentemente pubblicato che il programma di sorveglianza Foodborne Diseases Active Surveillance Network (FoodNet) ha segnalato 9.723 casi di infezioni da Campylobacter diagnosticate in laboratorio nel 20181. Ciò rappresenta un aumento del 12% dei casi Campylobacter nel corso del 2015-20171. In tutto il mondo, Campylobacter spp. sono tra le infezioni intestinali batteriche più comuni2. Tuttavia, il numero di malattie intestinali basate su Campylobacterche si verificano ogni anno sono sospettate di essere sottosegnalati3. Questa sottovalutazione è prevedibile perché la maggior parte dei pazienti può recuperare solo con disagio moderato e nessun trattamento medico. Tuttavia, per i pazienti con sintomi più gravi o che sono a più alto rischio di malattia grave, e che poi cercano cure mediche, la coltura delle feci è il metodo più comune per valutare se Campylobacter è l'agente patogeno che sta causando il loro disagio4.
Per Campylobacter spp., la cultura delle feci è particolarmente fastidiosa. Gli organismi patogeni più comuni, C. jejuni, C. coli, C. upsaliensis, e C. lari, sono microaerofili5. Ciò significa che i batteri moriranno a tassi casuali e sconosciuti una volta esposti all'aria. Il tempo che intersedispone dalla raccolta degli esemplari e l'impostazione della coltura diventa così una variabile incontrollata nella capacità di rilevare il Campylobacter vitale per cultura.
Per la cultura diretta degli esemplari fecali, anche la lenta crescita di Campylobacter è un problema. Le colonie di Campylobacter sono molto piccole anche dopo 48 h di incubazione e possono essere facilmente coperte da organismi concorrenti nella matrice fecale. Le piastre che contengono antibiotici a cui la maggior parte dei ceppi di C. jejuni e C. coli sono ampiamente utilizzate, in quanto gli antibiotici inibiscono la crescita di molti (ma non tutti) batteri fecali concorrenti, consentendo una migliore visualizzazione delle colonie di Campylobacter 6. Tuttavia, altre specie di Campylobacter come C. lari e C. upsaliensis sono sensibili ad alcuni di questi antibiotici, e o crescono male o non crescono affatto. Ciò contribuisce alla sottosegnalazione delle infezioni da Campylobacter da queste specie sensibili agli antibiotici7.
C'è una terza ragione per cui una cultura per Campylobacter può essere imprecisa. I batteri, quando stressati, possono rimanere vitali ma possono diventare "non-culturabili"8. Questo significa per definizione che la coltura non rileverà i batteri presenti nel campione. La frequenza con cui ciò si verifica non è nota8.
Considerati questi potenziali problemi con la cultura, sono stati utilizzati più metodi di riferimento di confronto in modo che i risultati delle impostazioni cultura difettose non appaiano inesatte9 . I metodi di coltura utilizzati (ad esempio, piastre selettive Campylobacter,mezzi di trasporto, banchine che generano gas) sono stati scelti perché sono ampiamente utilizzati nei laboratori clinici per la coltura dei campioni di feci10.
I protocolli di coltura qui descritti sono stati sviluppati perché il numero più basso di Campylobacter jejuni che potrebbero essere rilevati dalla coltura nelle feci umane non era noto. Anche se le stime sono state pubblicate per il numero di unità formanti colonia (CFU) presenti nelle feci di pollame11, questi risultati non possono essere equiparati alle feci umane, poiché il Campylobacter spp. sono commensioni nei polli e non causano diarrea. Queste informazioni fondamentali sono necessarie per stabilire il numero di batteri Campylobacter che produrranno sintomi di gastroenterite negli esseri umani e per confrontare la virulenza tra ceppi o specie.
Protocollo
1. Enumerazione del Campylobacter in esemplari fecali umani artificiosi
NOTA: Tutte le fasi vengono eseguite utilizzando tecniche sterili e materiali su un foglio protettivo usa e getta all'interno di una cappa di sicurezza del flusso laminare disinfetta.
AVVISO: Il Campylobacter vivo è infettivo e può causare malattie, tra cui la diarrea. Indossare guanti, un camice da laboratorio e occhiali di sicurezza ogni volta che si maneggiano batteri. Non bocca pipet. Smaltire tutto il materiale che ha contattato i batteri in veri e propri contenitori di rischio biologico.
- Crescita della coltura stock di batteri
- Ottenere ceppi di C. jejuni (ATCC-33560) o C. coli (ATCC 33559) (Tabella dei materiali) come colture essiccate o congelate e reidratare o scongelare i batteri secondo le istruzioni del produttore. Streak i batteri reidratati su una piastra di agar specifici Di Campylobacterper iniziare la coltura. Incubare la piastra 48 h a 37 gradi centigradi in un barattolo anaerobico contenente una sacca microaerobica che genera gas.
- Il giorno successivo, preparare 100 mL di infusione cervello-cuore (BHI) brodo di crescita contenente 0.5% tripfite, 0.5% peptone proteasi, 0.0125% pyruvate di sodio, e 0.0125% bisulfite di sodio.
- Preridurre il brodo BHI coprendo liberamente il pallone e posizionandolo in un barattolo anaerobico con una sacca che produrrà un ambiente microaerofilo. Lasciare il brodo per preridurre durante la notte a 37 gradi centigradi. Allo stesso modo, preridurre le piastre specifiche di Campylobacterda utilizzare per i conteggi delle nevi nei punti 1.1.10 e 1.2.2.
- Poiché i Campylobacter sono sensibili all'aria, raccogliere tutti i materiali prima di inoculare il brodo e non indugiare mentre si maneggiano le colture. Quando è pronto per l'inoculare, aggiungere il siero bovino fetale (FBS) al brodo preridotto al 4% del volume totale. Conservare 1 mL di brodo preridotto per fungere da bianco nelle misurazioni della densità ottica a 600 nm (OD600).
- Rimuovere 3 mL di brodo preriduceto contenente FBS e utilizzare il brodo per raschiare la piastra di avviamento contenente la coltura Campylobacter. Raschiare delicatamente la piastra con un anello inoculante, quindi trasferire il liquame batterico in un tubo sterile.
- Inoculare i 100 mL di brodo preridotto con circa 3 mL di liquami batterici e incubare con agitazione moderata a 115 giri a 37 gradi centigradi in un barattolo anaerobico contenente una sacca che genera gas.
- Monitorare la crescita dei batteri spettrofotometricamente da torbidità a OD600. Utilizzare il brodo riservato come uno spazio vuoto. Se il barattolo anaerobico è aperto, sostituire la sacca che genera gas.
- Interrompere l'incubazione del brodo dopo 48/72 h o prima che il valore di OD600 raggiunga 0,4 dollari.
NOTA: Questo OD600 in genere equivale a 107 a 108 CFU/mL. Vedere la tabella 1 per i risultati tipici. - Per stabilire il numero di batteri nella coltura stock pura, eseguire otto serie di diluizione 10 volte di 100 -L di brodo in 900 -L di tampone di diluizione (Tabella dei materiali). Dopo che per la prima diluizione è stato rimosso il 100 L di brodo, restituire il pallone al barattolo anaerobico con una sacca che genera gas fresco per attendere l'uso nella piscina fecale.
- Utilizzare perline sterili per diffondere 100 gradi l delle diluizioni da 10a 10-10 -7 su piastre specifiche di Campylobacterprelevate duplicate dal punto 1.1.3. Etichettare le piastre con la diluizione utilizzata, metterle in un secondo barattolo anaerobico con una sacca che genera gas, e incubare a 37 gradi c per 48-72 h.
NOTA: Vedere la figura 1 e la figura 2 per lo schema di diluizione e le fotografie delle colonie. - Dopo la crescita, scegli la targa con tra le 30 e 300 colonie da contare. Utilizzare i conteggi per determinare la CFU/mL della cultura del brodo azionario utilizzando l'equazione 1:
CFU/mL in magazzino : Numero medio di colonie su piastre analitiche scelte (duplicate) - (mL placcato x diluizione della piastra) [Equazione 1]
- Preparazione ed enumerazione di campioni fecali clinici artificiosi
- Immediatamente dopo che le piastre per i conteggi analitici vengono preparate al punto 1.1.10, effettuare una seconda serie di diluizioni di brodo di magazzino preparando 10 diluizioni seriali di due volte dal brodo grezzo e una piscina fecale negativa (NFP) di Campylobacter. Ad esempio, preparare la prima diluizione mescolando volumi uguali di brodo e NFP (ad esempio, 0,1 mL ciascuno) e fare diluizioni successive trasferendo un volume designato di brodo e miscela NFP in un tubo con un volume uguale denominato NFP. Aggiungere una piastra di controllo con brodo che non contiene Campylobacter aggiunto alla piscina fecale per aiutare a identificare le colonie nonCampylobacter.
- Rendere l'NFP da campioni di sorveglianza dei pazienti diarroici de-identificati o feci di donatore sani che sono stati precedentemente testati e trovati per essere Campylobacter-negativo con metodi come un'immunoastenza enzimatica Campylobacter e da 16S rRNA qPCR.
- L'una di ogni diluizione Campylobacter/sgabello su piastre di agar specifiche di Campylobacter,duplicate. Collocare le piastre nel barattolo anaerobico con una sacca che genera gas e incubare a 37 gradi centigradi per 48 h.
- Esaminate visivamente le tavole striate per le colonie simili a quelle delle culture pure di Campylobacter.
NOTA: Il terzo quadrante è in genere dove questi saranno trovati. Vedere Figura 1 e Figura 2 per lo schema di diluizione e immagini di dimensioni colonia, colore e morfologia. - Seleziona più colonie simili a Campylobactere macchie di Gram. Utilizzando la microscopia con una lente ad immersione ad olio, esaminare un'area striata per ottenere batteri curvi, a spirale o a forma di sigaro grammo.
NOTA: I Campylobacter sono Gram-negativi e richiedono fuchsin di base come contromacchia (invece del tipico safranin) per essere visualizzati con precisione. I batteri classici ad ala di gabbiano possono essere visti, ma non sono un requisito. Vedere la figura 2 per il micrografo rappresentativo. - Se una delle placche duplicate a una diluizione specifica ha 1 o più colonie di Campylobacter presenti, considera quella diluizione fecale-cultura positiva.
- Si consideri l'ultima diluizione che contiene una colonia visibile Gram-negativo Campylobacteril limite del rilevamento della cultura. Utilizzare l'equazione 2 per calcolare la CFU/mL della diluizione positiva nel campione fecale clinico artificioso:
CFU/mL nel campione fecale : CFU/mL analitico - Diluizione con l'ultima colonia positiva [Equazione 2]
NOTA: vedere la tabella 2 per i risultati tipici.
- Immediatamente dopo che le piastre per i conteggi analitici vengono preparate al punto 1.1.10, effettuare una seconda serie di diluizioni di brodo di magazzino preparando 10 diluizioni seriali di due volte dal brodo grezzo e una piscina fecale negativa (NFP) di Campylobacter. Ad esempio, preparare la prima diluizione mescolando volumi uguali di brodo e NFP (ad esempio, 0,1 mL ciascuno) e fare diluizioni successive trasferendo un volume designato di brodo e miscela NFP in un tubo con un volume uguale denominato NFP. Aggiungere una piastra di controllo con brodo che non contiene Campylobacter aggiunto alla piscina fecale per aiutare a identificare le colonie nonCampylobacter.
2. Determinazione della vitalità del Campylobacter conservato nei mezzi di trasporto
- Mescolare 1 mL di coscia di brodo Campylobacter (passaggio 1.1.8) con 1 mL di NFP e preparare 10 diluizioni seriali doppie duplicate in NFP. Diluire ulteriormente ogni diluizione di un ulteriore 1:4 nei media Cary-Blair, proprio come viene trattato un campione clinico preparato nei media di trasporto.
- Conserva i 20 tubi di diluizione e un controllo negativo nel mezzo Cary-Blair in tubi con tappo a 2,8 gradi centigradi per 96 h e conta le colonie da ogni diluizione che si verifica al momento zero e ogni 24 h. Per il conteggio delle coviste, campionare il brodo:tubi fecali e impostare la coltura fecale per il conteggio delle colonia di ogni diluizione, in duplicato.
- Ogni giorno piagni 10- porzioni di diluizioni fecali sull'agar selettivo di Campylobactere incuba a 37 gradi centigradi per 48 h, come descritto sopra nei passi 1.1.9.2.7.
- Eseguire un conteggio analitico simultaneo del brodo batterico originale (dal punto 1.1.8 o un brodo di brodo appena coltivato) come descritto sopra (passaggi 1.1.9.1.11). Calcolare la CFU/mL dello stock batterico originale (Equazione 1) per calcolare la concentrazione di batteri nel campione fecale dei supporti di trasporto e le sue diluizioni (Equazione 2).
3. Saggi non culturali per la verifica dei risultati delle colture
- Utilizzare un'immunoaformazione enzimatica (EIA) che dia risultati falsi positivi minimi12 e che funzioni secondo le istruzioni di inserimento del pacchetto per verificare i risultati della coltura.
- Utilizzare un saggio molecolare in grado di rilevare il gene rRNA 16S o altro gene di una vasta gamma di specie di Campylobacter 13. Confermare che il saggio molecolare reagisce con specie come C. upsaliensis o C. lari che crescono male su agar conforme agli antibiotici standard14. Seguire le istruzioni del produttore per l'estrazione del DNA da campioni fecali ed eseguire il test.
NOTA: il sequenziamento bidirezionale del DNA dell'amplificatore 16S può essere utilizzato per confermare la specie di Campylobacter in un esemplare positivo. La PCR specifica per specie (cfr. tabella 3 per i geni bersaglio) può essere utilizzata anche per identificare le specie presenti negli esemplari discrepanti o positivi15.
Risultati
Identificare le colonie di Campylobacter spp. tra la flora fecale concorrente richiede una vista acuta e un notevole giudizio. Il numero più basso di colonie che possono essere rilevate dalla coltura non è stato studiato, anche se si stima che i campioni di pazienti siano stati stimati al porto di 106-109 CFU/mL16,17. Tuttavia, i campioni di pazienti non possono essere utilizzati quantitativamente in quanto non esiste un metodo indipendente per stabilire numeri batterici accurati. Per superare questa limitazione, vengono effettuate due misurazioni simultanee con un supporto batterico. Un test viene utilizzato per la rilevazione visiva delle colonie di Campylobacter da diluizioni seriali dei batteri stock in una matrice fecale, simulando campioni clinici; l'altro viene utilizzato analiticamente per quantificare la CFU/mL presente nella coltura batterica di stock utilizzata per i picchi (Figura 2A).
Le soglie di rilevamento per Campylobacter non saranno definiti valori. Questo è prevedibile perché ogni matrice fecale è complessa e unica, e la crescita di batteri è variabile. Un parametro chiave per il successo è identificare le colonie di dimensioni indiche tra la flora fecale concorrente. Una piastra rappresentativa della coltura delle feci a spillo è illustrata nella figura 2C e nella Figura 2D. La piastra di controllo negativa senza Campylobacter aggiunto è importante per aiutare a identificare altra flora fecale. Gram che colora molti candidati tende anche l'occhio a distinguere le colonie lucide corrette e il colore rosa intermedio dei batteri gram-negativi macchiati di fucsina e conferma la morfologia dei batteri nelle colonie selezionate (Figura 2B). Sono stati effettuati sette esperimenti indipendenti, utilizzando 5 brodi C. jejuni e 2 C. coli, e hanno dato soglie che si sovrapponevano e si estendevano da 0,3 x 5 x 106 CFU/mL. Vedere la tabella 2 per i dati tipici. I limiti di rilevazione sono stati in media 2 x 106 per C. jejuni e 1,2 x 106 CFU/mL per C. coli. Ciò indica che la coltura è in grado di rilevare i 1x2 x 106C. jejuni o C. coli per grammo di esemplare fecale sull'agar standard di Campylobactercontenente antibiotici utilizzato da molti laboratori clinici. Ci sono più agar specializzati con diversi antibiotici che possono dare diverse soglie per il rilevamento della colonia. I metodi qui descritti dovrebbero incoraggiare studi più quantitativi e comparativi per migliorare l'accuratezza della cultura e ampliare la versatilità dei nuovi media. Ad esempio, 152 colonie sono state contate sulle prime 10-5 piastra e 144 colonie sulla seconda 10-5 piastra. La media tra le due piastre è di 148 colonie. Le piastre sono state inoculate con 0,1 mL (100) di diluizione 10-5, che con l'equazione 1 equivale a 148 x 106 (14,8 x 107) CFU/mL nel brodo di coltura pura. Quando sono state fatte le diluizioni fecali, la coltura è stata aspillta in piscina fecale negativa ad un rapporto 1:1. Pertanto, per equazione 2, il primo punto (piastra "a") sulla curva fecale corrisponde a 14,8 x 107 diviso 2 ed è uguale a 7,4 x 107 CFU/mL. Questo tubo "a" viene utilizzato per effettuare 9 diluizioni aggiuntive. Nella Figura 1, l'ultima diluizione con una colonia visibile grammo-negativa con morfologia simile a Campylobacterè sulla piastra "g". Ciò equivale a 1,1 x 106 CFU/mL per la soglia di coltura fecale di rilevamento in questo esempio.
Anche se la vitalità sostenuta è fondamentale per l'accuratezza della cultura, il mantenimento della vitalità di Campylobacter spp. durante la manipolazione e la spedizione di campioni dai pazienti alle cliniche ai laboratori di riferimento è problematico. Lo stoccaggio tipico è quello di refrigerare i campioni in normali tubi con tappo con esposizione all'aria e senza atmosfera speciale. Si pensa che le spettri nei mezzi di trasporto (noti anche come campioni conservati) abbiano una migliore sopravvivenza, ma ci sono pochi rapporti che forniscono dati quantitativi18.
La combinazione di metodi di campionamento analitici e artificiosi di mostrata sopra è stata riutilizzata per ottenere stime di fattibilità e tempo di sopravvivenza di C. jejuni nei mezzi di trasporto. Un brodo batterico è stato utilizzato per preparare da dieci a 1024 diluizioni di campioni da 2 a 1024 volte nella matrice fecale. Il brodo iniziale è stato trovato dai conteggi analitici per avere una concentrazione di 4,8 x 107 CFU/mL. Sulle piastre fatte il giorno 0, C. jejuni è stato rilevato (2 giorni dopo) sulla piastra striato con la diluizione 32 volte, equivalente a 1,5 x 106 CFU/mL. Tuttavia, sulle piastre fatte dopo aver refrigerato il campione fecale di Cary Blair per 24 ore, solo la diluizione di 2 volte (equivalente a 2,4 x 107 CFU/mL) crebbe colonie visibili. Nessun'ulteriore perdita di vitalità è stata osservata a 96 ore, quando lo studio è stato interrotto. Questa perdita di redditività equivale a una perdita di 16 volte (94%) perdita di organismi culturabili in meno di 24 ore e indica che, anche con la refrigerazione, le feci nel mezzo Cary Blair con meno di 107 CFU/mL C. jejuni possono essere perse dalla cultura.
In contrasto con i risultati della coltura, la VIA ha rilevato la presenza di C. jejuni alla diluizione di 256 volte al momento iniziale e per tutto il periodo di test di 4 giorni. La soglia di rilevamento C. jejuni per questa EIA utilizzando campioni fecali a spillo è 8,4 x 104 CFU/mL. Questa soglia è inferiore a quella della cultura fecale e consente un rilevamento più sensibile e stabile di C. jejuni.
Per testare la capacità della coltura di rilevare la spp. Campylobacter in un ambiente clinico reale, 1.552 campioni di feci clinici sono stati caratterizzati da 6 procedure: coltura fecale, una nuova immunoanalisi per Campylobacter spp., e 4 metodi molecolari. Tutti i campioni sono stati prospetticamente raccolti e inizialmente classificati dalla cultura convenzionale in 3 laboratori negli Stati Uniti, e poi controllati dalla VIA. Qualsiasi esemplare di coltura positiva o DIScrepante/coltura-discrepante sono stati poi esaminati con i metodi molecolari12. Ai campioni è stato assegnato uno stato vero positivo o vero negativo in base ai risultati dei 5 metodi non di coltura. I 5 metodi non-culturali hanno mostrato un accordo completo su tutti i 48 esemplari positivi e discrepanti, mentre la coltura ha identificato erroneamente 14 (28%). I campioni identificati erroneamente dalla coltura includevano 13 campioni falsi negativi e 1 campione falso positivo.

Figura 1: Schema per la preparazione simultanea di campioni fecali analitici e a spillo. Fare clic qui per visualizzare una versione più grande di questa figura.
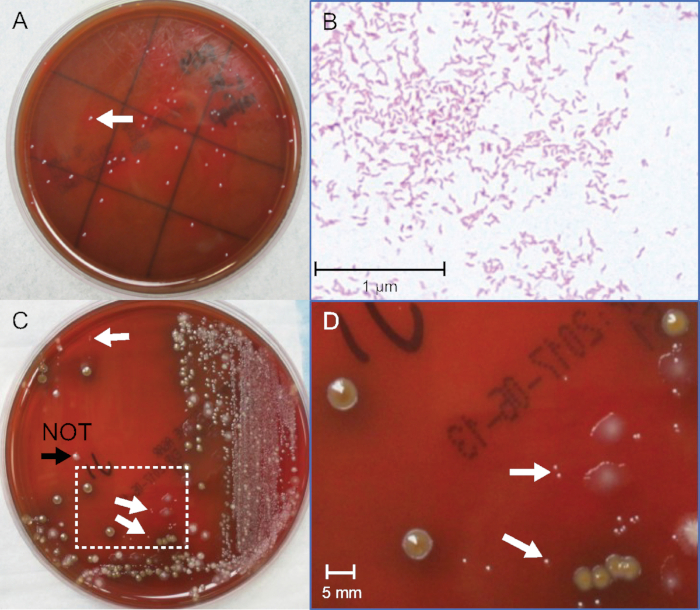
Figura 2: Identificazione delle colonie di C. jejuni da colture pure e fecali. (A) Fotografia di colonie C. jejuni provenienti da coltura batterica pura dopo 72 ore di incubazione. (B) Gram macchia di C. jejuni da coltura batterica pura, ingrandimento olio-immersione 400x. (C) Fotografia di C. jejuni-positivo cultura fecale a spillo dopo 48 h incubazione. (D) Area allargata nella casella in (C), ingrandimento di 10 volte. Le frecce bianche indicano le colonie C. jejuni delle dimensioni del punto di pin. La punta della freccia nera indica una colonia leggermente più grande, gram-positiva e non C. jejuni. Fare clic qui per visualizzare una versione più grande di questa figura.
| Culture | OD600 - T0 | OD600 - T Finale1 | CFU finale/mL |
| C. jejuni | 0.146 | 0.321 | 1,28 x 107 |
| C. coli | 0.245 | 0.508 | 4,50 x 108 |
Tabella 1: Crescita tipica e CFU/mL degli stock C. jejuni e C. coli. 1C. jejuni cultura è stato fermato dopo 48 h di incubazione. La coltura C. coli è stata interrotta dopo 54 h di incubazione.
| Tubo di diluizione per campione fecale a spillo | Numero di colonie simili a Campylobacter | Numero di colonie Gram-negative1 | Cultura positiva? | CFU/mL calcolato del campione a spillo | |
| C. jejuni (1,28 x 108 CFU/mL) | (2 volte) a | Denso | nd 2 (in modoinquestoe | Sì | 6,40 x 107 |
| (4 volte) b | Più di 20 anni | Nd | Sì | 3,20 x 107 | |
| (8 volte) c | 4-10 | Nd | Sì | 1,60 x 107 | |
| (16 volte) d | Nd | Sì | 8,00 x 106 | ||
| (32 volte) e | Nd | Sì | 4,00 x 106 | ||
| (64 volte) f | 1-3 | 1 di 2 | Sì | 2,00 x 106 | |
| (128 volte) g | 2 di 3 | Sì | 1,00 x 106 | ||
| 3(256 volte) h | 1 di 2 | Sì | 5,00 x 105 | ||
| (512 volte) i | 0 di 1 | No | 2,50 x 105 | ||
| (1024 volte) j | 0 | Nd | No | Nfp | |
| C. coli (4,50 x 108 CFU/mL stock) | (2 volte) a | Denso | Nd | Sì | 2,25 x 108 |
| (4 volte) b | Nd | Sì | 1,13 x 108 | ||
| (8 volte) c | Più di 50 anni | Nd | Sì | 5,63 x 107 | |
| (16 volte) d | Più di 30 anni | Nd | Sì | 2,81 x 107 | |
| (32 volte) e | Più di 10 anni | Nd | Sì | 1,41 x 107 | |
| (64 volte) f | 3-8 | Nd | Sì | 7,03 x 106 | |
| (128 volte) g | Nd | Sì | 3,52 x 106 | ||
| 3(256 volte) h | 1-3 | 1 di 3 | Sì | 1,76 x 106 | |
| (512 volte) i | 0 di 1 | No | 8,79 x 105 | ||
| (1024 volte) j | 0 | Nd | No | Nfp |
Tabella 2: Numero tipico di colonie su piastre di campioni fecali a spillo. 1 Gram colonie negative tra colonie simili a Campylobacter, 2nd - non determinato, 3Dati in grassetto indica l'ultima diluizione positiva.
| Specie | Bersaglio genico |
| C. jejuni | Hipo |
| C. coli | cadF |
| C. upsaliensis | cpn60 (informazioni in inglese) |
| C. lari | cpn60 (informazioni in inglese) |
| C. helveticus | cpn60 (informazioni in inglese) |
| C. fetus | cpn60 (informazioni in inglese) |
| C. hyointestinalis | cpn60 (informazioni in inglese) |
| C. concisus | cpn60 (informazioni in inglese) |
Tabella 3: I geni utili per rilevare singole specie di Campylobacter qPCR.
Discussione
I metodi di coltura qui descritti si basano su tecniche e materiali semplici e ampiamente utilizzati disponibili nella maggior parte dei laboratori10. È la combinazione di campioni analitici e artificiosi che forniscono nuove informazioni di una soglia di rilevamento clinicamente rilevante per le colture fecali. Inoltre, il giudizio dei risultati culturali con 5 saggi separati rafforza le conclusioni che Campylobacter fecal coltura identifica erroneamente una porzione significativa di campioni di pazienti. La VIA e i saggi molecolari sono utili come controlli perché si basano ciascuno su un principio diverso (interazione tra antigeni con anticorpi e amplificazione del DNA) e, soprattutto, non si basano sulla vitalità dei batteri. Si noti che il saggio VIA utilizzato per questi studi è ben convalidato e ha dimostrato di essere pienamente d'accordo con 4 test molecolari12.
La cultura di Campylobacter spp. è particolarmente problematica, con la sensibilità riportata di variare dal 60-76%19,20, e come evidente dal suo tasso di incapacità del 30% di rilevare campioni veri positivi qui. Il personale può aspettarsi che il controllo della VIA e i test molecolari producano spesso risultati positivi quando i dati di coltura sono negativi.
Il passo più critico nel protocollo è l'identificazione di colonie pin-point tra la flora fecale concorrente. Non è insolito, in quanto le diluizioni vicino alla soglia di rilevamento, avere stime di conteggio delle coposizioni alternate zero e diverse da zero (ad esempio, 2, 0, 1, 0, 0). È importante riconoscere che le soglie di coltura saranno una gamma di concentrazioni, non una specifica CFU/mL. Tuttavia, la stima delle feci cFU/mL come limite inferiore per il rilevamento della coltura è paragonabile ai rapporti secondo cui gli esseri umani infetti hanno perso da10 6 a 109Campylobacter per grammo feci21. I cambiamenti negli antibiotici o nelle piastre di agar e le variazioni inevitabili nei singoli esemplari fecali cambieranno senza dubbio i valori soglia. Questo protocollo dovrebbe consentire di migliorare i mezzi di crescita.
Questa prima informazione su un limite per il rilevamento della coltura consente di impostare soglie clinicamente rilevanti per i test diagnostici, e pone la base microbiologica necessaria per affrontare problemi non studiati di carrozza non sintomatica22,23 da Campylobacter, o se il carico batterico correla con i sintomi o gravi sequele.
Divulgazioni
Gli autori sono dipendenti di TECHLAB, Inc. che produce il kit QUIK CHEK™ utilizzato come comparatore in questo articolo.
Riconoscimenti
Questi studi sono stati finanziati da TECHLAB, Inc.
Materiali
| Name | Company | Catalog Number | Comments |
| Anaerobic 3.5L Jar | Thermo Fisher | HP0031A | |
| AnaeroGRO Campylobacter Selective Agar | Hardy Diagnostics | AG701 | |
| Bacto Brain Heart Infusion | BD Biosciences | 237500 | |
| Bacto Protease Peptone | Life Technologies Corp | 211684 | |
| Basic Fuchsin | Fisher Scientific | B12544 | |
| BBL Trypticase Peptone | Life Technologies Corp | 211921 | |
| C. coli Type strain | ATCC | 33559 | |
| C. jejuni Type strain | ATCC | 33560 | |
| CampyGen gas generating system sachet | Thermo Fisher | CN0025A | |
| Campylobacter QUIK CHEK | TechLab, Inc. | T5047 / T31025 | |
| Cary-Blair transport medium | Fisher Scientific | 23-005-47 | |
| Coli Roller Sterile plating beads | Millipore Sigma | 71013 | |
| Dilution Buffer | Anaerobe Systems | AS-908 | |
| Fetal bovine serum | Equitech-Bio, Inc | SFBM30 | |
| Sodium bisulfite | Sigma-Aldrich | 243973 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| Spectrophotometer cuvettes | USA Scientific | 9090-0460 |
Riferimenti
- CDC. Annual Summaries of Foodborne Outbreaks. , Available from: https://www.cdc.gov/fdoss/annual-reports/index.html (2018).
- Kaakoush, N. O., Castaño-Rodríguez, N., Mitchell, H. M., Man, S. M. Global Epidemiology of Campylobacter Infection. Clinical Microbiology Reviews. 28 (3), 687-720 (2015).
- Pitkanen, T. a, H, M. L. Global Water Pathogen Project. Rose, J. B., Jimenez-Cisneros, B. , UNESCO (2017).
- Fitzgerald, C., et al. Multicenter Evaluation of Clinical Diagnostic Methods for Detection and Isolation of Campylobacter spp. from Stool. Journal of Clinical Microbiology. 54 (5), 1209-1215 (2016).
- Kirkpatrick, B. D., Tribble, D. R. Update on human Campylobacter jejuni infections. Current Opinion in Gastroenterology. 27 (1), 1-7 (2011).
- CDC. Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 2006-2013. Morbidity and Mortality Weekly Report. 63, 328-332 (2014).
- Jaime, A. L., et al. Campylobacter upsaliensis: Another Pathogen for Consideration in the United States. Clinical Infectious Diseases. 34 (11), 59-60 (2002).
- Bullman, S., O'Leary, J., Corcoran, D., Sleator, R., Lucey, B. Molecular-based detection of non-culturable and emerging campylobacteria in patients preseting with gastroenteritis. Epidemiology and Infection. 140, 684-688 (2012).
- Giltner, C. L., Saeki, S., Bobenchik, A. M., Humphries, R. M. Rapid Detection of Campylobacter Antigen by Enzyme Immunoassay Leads to Increased Positivity Rates. Journal of Clinical Microbiology. 51 (2), 618-620 (2013).
- M'ikanatha, N. M., et al. Culturing stool specimens for Campylobacter spp., Pennsylvania, USA. Emerging Infectious Disease. 18, 484-487 (2012).
- Al Amri, A., Senok, A. C., Ismaeel, A. Y., Al-Mahmeed, A. E., Botta, G. A. Multiplex PCR for direct identification of Campylobacter spp. in human and chicken stools. Journal of Medical Microbiology. 56 (10), 1350-1355 (2007).
- Buss, J. E., et al. Campylobacter culture fails to correctly detect Campylobacter in 30% of positive patient stool specimens compared to non-cultural methods. European Journal of Clinical Microbiology & Infectious Diseases. 38, 1087-1093 (2019).
- Wohlwend, N., Tiermann, S., Risch, L., Risch, M., Bodmer, T. Evaluation of a Multiplex Real-Time PCR Assay for Detecting Major Bacterial Enteric Pathogens in Fecal Specimens: Intestinal Inflammation and Bacterial Load Are Correlated in Campylobacter Infections. Journal of Clinical Microbiology. 54 (9), 2262-2266 (2016).
- Couturier, B. A., Hale, D. C., Couturier, M. R. Association of Campylobacter upsaliensis with Persistent Bloody Diarrhea. Journal of Clinical Microbiology. 50 (11), 3792-3794 (2012).
- Chaban, B., Musil, K. M., Himsworth, C. G., Hill, A. K. Development of cpn60-Based Real-Time Quantitative PCR Assays for the Detection of 14 Campylobacter Species and Application to Screening of Canine Fecal Samples. Applied and Environmental Microbiology. 75, 3055-3061 (2009).
- Allos, B., Blaser, M. J. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases, 7th ed. Mandell, G. L., Bennett, J. E., Dolin, R. , Churchill Livingstone. 2793-2802 (2009).
- Anderson, N. W., Buchan, B. W., Ledeboer, N. A. Comparison of the BD MAX Enteric Bacterial Panel to Routine Culture Methods for Detection of Campylobacter, Enterohemorrhagic Escherichia coli (O157), Salmonella, and Shigella Isolates in Preserved Stool Specimens. Journal of Clinical Microbiology. 52 (4), 1222-1224 (2014).
- Wasfy, M., Oyofo, B., Elgindy, A., Churilla, A. Comparison of preservation media for storage of stool samples. Journal of Clinical Microbiology. 33 (8), 2176-2178 (1995).
- Bessède, E., Delcamp, A., Sifre, E., Buissonniere, A., Mégraud, F. New Methods for Detection of Campylobacters in Stool Samples in Comparison to Culture. Journal of Clinical Microbiology. 49 (3), 941-944 (2011).
- Bessède, E., et al. Evaluation of the Diagnostic Accuracy of Two Immunochromatographic Tests Detecting Campylobacter in Stools and Their Role in Campylobacter Infection Diagnosis. Journal of Clinical Microbiology. 56 (4), (2018).
- Shane, A. L., et al. Infectious Diseases Society of America Clinical Practice Guidelines for the Diagnosis and Management of Infectious Diarrhea. Clinical Infectious Diseases. 65 (12), 1963-1973 (2017).
- Toledo, Z., Simaluiza, R. J., Astudillo, X., Fernández, H. Occurrence and antimicrobial susceptibility of thermophilic Campylobacter species isolated from healthy children attending municipal care centers in Southern Ecuador. Revista do Instituto de Medicina Tropical de Sao Paulo. 59, 77-77 (2017).
- Lee, G., et al. Symptomatic and asymptomatic Campylobacter infections associated with reduced growth in Peruvian children. PLoS Neglected Tropical Diseases. 7 (1), 2036(2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon