È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'incubazione della paura utilizzando un protocollo esteso di condizionamento della paura per i ratti
In questo articolo
Riepilogo
Descriviamo un protocollo esteso di condizionamento della paura che produce sovrallenamento e incubazione della paura nei ratti. Questo protocollo prevede una singola sessione di allenamento con 25 accoppiamenti tono-shock (cioè sovrallenamento) e un confronto delle risposte di congelamento condizionate durante i test di contesto e cue 48 h (a breve termine) e 6 settimane (a lungo termine) dopo l'allenamento.
Abstract
La memoria emotiva è stata studiata principalmente con paradigmi di condizionamento della paura. Il condizionamento della paura è una forma di apprendimento attraverso la quale gli individui imparano le relazioni tra eventi avversi e stimoli altrimenti neutri. Le procedure più utilizzate per studiare i ricordi emotivi comportano il condizionamento della paura nei ratti. In questi compiti, lo stimolo incondizionato (US) è un footshock presentato una o più volte in una o più sessioni, e la risposta condizionata (CR) si sta congelando. In una versione di queste procedure, chiamata condizione della paura cued, un tono (stimolo condizionato, CS) è accoppiato con footshocks (US) durante la fase di allenamento. Durante il primo test, gli animali sono esposti allo stesso contesto in cui si è svolta la formazione e le risposte al congelamento vengono testate in assenza di sferzate e toni (cioè un test di contesto). Durante la seconda prova, il congelamento viene misurato quando il contesto viene modificato (ad esempio, manipolando l'odore e le pareti della camera sperimentale) e il tono viene presentato in assenza di footshocks (cioè una prova di cue). La maggior parte delle procedure di condizionamento della paura cued comportano pochi abbinamenti tono-shock (ad esempio, 1-3 prove in una singola sessione). C'è un crescente interesse per le versioni meno comuni che coinvolgono un ampio numero di abbinamenti (cioè il sovrallenamento) legati all'effetto di lunga durata chiamato incubazione della paura (cioè, le risposte alla paura aumentano nel tempo senza un'ulteriore esposizione a eventi avversivi o stimoli condizionati). I compiti estesi di condizionamento della paura sono stati fondamentali per comprendere gli aspetti comportamentali e neurobiologici dell'incubazione della paura, compresa la sua relazione con altri fenomeni psicologici (ad esempio, disturbo da stress post-traumatico). Qui, descriviamo un protocollo esteso di condizionamento della paura che produce sovrallenamento e incubazione della paura nei ratti. Questo protocollo prevede una singola sessione di allenamento con 25 accoppiamenti tono-shock (cioè sovrallenamento) e un confronto delle risposte di congelamento condizionate durante i test di contesto e cue 48 h (a breve termine) e 6 settimane (a lungo termine) dopo l'allenamento.
Introduzione
La memoria è un processo psicologico che comprende diverse fasi: acquisizione di informazioni, consolidamento (consente la stabilità delle informazioni acquisite) e recupero (prova per il processo di consolidamento)1. Durante la fase di consolidamento, si verificano la creazione di nuove connessioni sinaptiche e la modifica delle connessioni preesistenti. Ciò suggerisce la necessità di un periodo di tempo durante il quale si verificano eventi molecolari e fisiologici responsabili diquesti cambiamenti 1,2. Questi cambiamenti fisiologici o molecolari variano se gli eventi recuperati sono emotivamente caricati o meno (cioè la memoria emotiva). Per esempio, la ricerca ha dimostrato che il nucleo laterale e il complesso di amigdala basolaterale sono particolarmente rilevanti per la memoriaemotiva 3,4,5.
I fenomeni di memoria emotiva sono stati studiati principalmente con paradigmi di condizionamentodella paura 5,6. Il condizionamento della paura è una forma di apprendimento attraverso la quale gli individui imparano le relazioni tra eventi avversi e stimoli altrimenti neutri7. I paradigmi di condizionamento della paura producono cambiamenti molecolari, cellulari e strutturali nell'amigdala. Inoltre, il condizionamento della paura modifica la connettività dell'ippocampo durante i processi di consolidamento e recupero della memoria emotiva.
Una delle procedure più comunemente utilizzate per studiare i ricordi di paura è il condizionamento classico (Pavloviano) nei ratti. Questa procedura utilizza in genere footshock (US) come stimolo avverso, che viene consegnato una o più volte in una o più sessioni. La risposta condizionata (CR) dei ratti esposti a questa procedura è il congelamento (cioè " immobilità generalizzata causata da una risposta tonica generalizzata della muscolatura scheletrica degli animali ad eccezione dei muscoli utilizzati nella respirazione"7 ). Questa risposta potrebbe essere valutata su due tipi di test: test di contesto e cue. Per il test di contesto, il soggetto subisce un determinato numero di footshock durante la sessione di allenamento e quindi viene rimosso dalla camera sperimentale per un periodo di tempo definito. Durante la prova, il soggetto viene riportato nello stesso contesto in cui si è svolta la formazione e vengono raccolte diverse misure di congelamento in assenza di footshock (ad esempio, durata, percentuale o frequenza degli episodi di congelamento) e confrontate con i livelli di base stabiliti durante la fase di allenamento. Per il secondo tipo di test, cue test, uno stimolo (in genere un tono) viene abbinato alle pedonore durante la fase di allenamento (ad esempio, stimolo condizionale, CS). Una volta completata la formazione, l'animale viene rimosso dal contesto di allenamento per un tempo definito e successivamente collocato in un contesto modificato (ad esempio, una camera sperimentale diversa che ha diverse forme di pareti e odore diverso). Il segnale viene quindi presentato un determinato numero di volte e le risposte di congelamento al segnale vengono misurate e confrontate con i livelli di base raccolti durante l'allenamento. La versione più comune di questo paradigma utilizza accoppiamenti tono-shock da 1 a 3 durante una singola sessione di allenamento, seguiti da test di contesto e cue condotti un certo numero di ore o pochi giorni dopo.
Altre procedure di condizionamento della paura attuate meno frequentemente comportano un numero elevato di accoppiamenti shock-cue (cioè prove), che sono state spesso chiamate procedure disovrallenazione 8. Un crescente interesse per questi compiti è legato ai loro effetti di memoria di lunga durata e aumentati chiamati incubazione della paura (cioè, le risposte di paura condizionate aumentano nel tempo in assenza di ulteriore esposizione a eventi avversi o stimoli condizionati)9,10,11. Un esempio di tali procedure di sovrallenazione comporta una fase di formazione di 100 accoppiamenti tono-shock distribuiti in 10 sessioni, seguiti da test di contesto e cue condotti 48 h e 30 giorni dopo11,12. Per evitare un'estesa diffusione di formazione su diversi giorni, Maren (1998) ha riferito che il sovrallenaggio potrebbe essere stabilito e ottimizzato in una singola sessione con 25 accoppiamenti8. L'effetto di incubazione è evidenziato in livelli significativamente più elevati di paura condizionata nei ratti testati 31 giorni dopo l'allenamento, rispetto ai ratti testati 48 h dopo. I compiti estesi di condizionamento della paura sono stati fondamentali per la comprensione degli aspetti comportamentali e neurobiologici alla base dell'incubazione della paura, compresa la sua relazione con altri fenomeni psicologici (ad esempio, disturbo da stress post-traumatico a esordio ritardato)11,12,13.
Qui, descriviamo un protocollo esteso di condizionamento della paura che induce il sovrallenamento e l'incubazione della paura nei ratti. Diverso da altri paradigmi che richiedono diversi giorni di formazione11, il protocollo corrente è focalizzato su una singola sessione di formazione8. Abbiamo usato 25 abbinamenti tono-shock per produrre risposte di congelamento condizionate più elevate durante i test di contesto e cue condotti 6 settimane dopo l'allenamento, rispetto ai test condotti 48 h dopo.
Protocollo
Il seguente protocollo è stato approvato dall'Institutional Animal Care and Use Committee di Fundaciàn Universitaria Konrad Lorenz (IACUC-KL). Sono stati rispettati la dichiarazione universale dei diritti degli animali rilasciata dalla Lega internazionale dei diritti degli animali, Ginevra, Svizzera (1989), e i principi etici di sperimentazione sugli animali emessi dall'ICLAS.
1. Preparazione del soggetto
- Selezionare ratti Wistar adulti maschi (n - 12). Ospitarli in gruppi di quattro per gabbia per tre giorni di acclimatazione, prima dell'inizio del protocollo di formazione e test. Fornire ai ratti libero accesso all'acqua durante l'esperimento. Controllare la temperatura ambiente tra i 20 e i 25 gradi centigradi, in un ciclo di 12 h di luce-scuro (luci accese alle 07:00 h).
NOTA: I ceppi di ratto avevano mostrato prestazioni differenziali durante il condizionamento della paura. Per esempio, Schaap et al. (2013) ha riferito che i ceppi di Wistar e Lewis hanno mostrato durate più lunghe di comportamento di congelamento rispetto ai ratti Fawn Hooded e Brown Norway12. Pertanto, le differenze di dolore e soglia termica dovrebbero essere valutate per regolare l'intensità e la durata degli urti. - Mantenere i ratti all'85% dei loro pesi di alimentazione libera (peso normale tra 350-400 g) dando accesso limitato al cibo alla stessa ora ogni giorno. Pesare i ratti ogni giorno alla stessa ora durante il ciclo della luce. Calcolare il peso dell'annuncio lib (peso del 100%) per tre giorni prima dell'inizio dell'allenamento prolungato di condizionamento della paura.
NOTA: Gli animali utilizzati nel presente esperimento sono stati testati su ulteriori test strumentali che non sono riportati qui. Per questi ulteriori test era necessaria la privazione alimentare. Si presume che questa variazione procedurale esanda la portata della presente procedura, in quanto suggerisce il potenziale per i test combinati strumentale-paura. Tuttavia, gli studi che utilizzano solo test di condizionamento della paura non richiederanno privazione di cibo. - Assegnare casualmente i soggetti a uno dei seguenti gruppi: test emotivi 6 settimane dopo l'allenamento (n - 6); test emozionale 48 h dopo l'allenamento (n .
- Eseguire l'allenamento e i test in ore simili, durante la fase di luce del ciclo di luce scura. Assegnare gli animali alla stessa camera sperimentale e mantenere lo stesso ordine di animali durante l'addestramento e le prove.
NOTA: un controllo aggiuntivo che potrebbe essere implementato è controbilanciare l'ordine degli animali durante le fasi di addestramento e test. È consigliabile utilizzare questa tecnica quando vengono valutati più gruppi o vengono applicate attività diverse tra gli esperimenti, per ridurre un possibile effetto dell'ordine delle attività sul comportamento.
2. Impostazione dell'apparato e calibrazione degli urti
- Pulire tutte le superfici interne della camera sperimentale e del pavimento della griglia in acciaio inossidabile con il 10% di etanolo. Ripetere prima di testare ogni animale.
- Collegare l'apparecchiatura a un computer utilizzando un cavo USB e avviare l'apparecchiatura del sistema di rilevamento del congelamento: la CPU, l'armadio di controllo, la luce infrarossa, lo stimolatore/scrambler avversivo e il calibratore di intensità d'urto.
NOTA: Anche se questo protocollo è stato eseguito utilizzando strumenti disponibili in modo commerciale (Tabella dei Materiali), possono essere utilizzate attrezzature e software di marche diverse. L'apparato è costituito da una camera quadrata acrilica interna (29,53 cm x 23,5 cm x 20,96 cm, chiamata camera sperimentale) incastorata in una scatola di legno ricoperta di plastica formica. Le porte esterne consentono l'isolamento del suono, del rumore o della luce (attenuanti delle porte della scatola). La telecamera si trova lateralmente nella parte interna della porta esterna. La scatola in acrilica interna con griglie metalliche del pavimento (36 aste in acciaio inossidabile, ognuna di 3 mm di diametro e distanziata 8 mm, da centro a centro) consente la consegna footshock. In una delle pareti interne laterali, un altoparlante si trova a 6 cm dal pavimento per presentare uno spunto uditivo. - Collegare le clip rosse e nere del calibratore dell'intensità dell'ammortizzatore (ad esempio, connettori positivi e negativi) a due aste diverse sul pavimento della griglia. Collegare il cavo USB alla porta corrispondente del computer. Assicurarsi di collegare le clip rosse e nere alle barre separate da un'altra barra.
NOTA: in questa sezione viene descritto il processo di calibrazione dell'intensità dell'urti utilizzando una marca specifica di apparecchiature menzionata nella Tabella dei Materiali. Tuttavia, il processo di calibrazione può essere eseguito utilizzando diverse marche di apparecchiature. Si raccomanda di calibrare l'intensità dell'ammortizzatore in tre settori del piano della griglia per verificare che sia coerente. Inoltre, rimuovere sempre i residui fecali e urinari dal pavimento della griglia per evitare interferenze durante la consegna dello shock. - Avviare il software di calibrazione dell'intensità d'urto (Tabella dei materiali). Scegliere un'intensità di 1,0 mA nell'applicazione facendo clic sulla freccia dell'intervallo. Quindi, modificare l'interruttore Esegui/Stop su Esegui.
NOTA: Proponiamo 1,0 mA sulla base dei nostri studi con modelli di roditori nel nostro laboratorio e letteratura che riporta una gamma da 0,75 mA a 1,5 mA come adeguata per gli studi di condizionamento della paura33,34,35. - Accendere lo stimolatore o l'apparecchiatura utilizzata per fornire le pedonole e guardare l'intensità dell'ammortizzatore visualizzata sul pannello dell'applicazione. Se necessario, regolare l'intensità a 1,0 mA utilizzando la manopola sullo stimolatore arivo.
NOTA: Lo stimolatore Aversive deve essere impostato su "OUT" per testare, calibrare ed eseguire l'esperimento in modo appropriato.
3. Calibrazione del sistema di rilevamento del congelamento
- Chiudere la camera sperimentale e le porte della scatola di attenuazione del suono. Non introdurre l'animale a questo punto, in quanto verrà inserito nella camera dopo che la calibrazione del sistema di rilevamento del congelamento è stata completata. Verificare che l'intensità della luce all'interno della scatola sia compresa tra 20 e 30 lux.
- Avviare il software del sistema di rilevamento del congelamento e aprire la finestra di dialogo Configurazione esperimento. Immettere i dettagli di ogni argomento (ad esempio il numero di identificazione del soggetto, la data e il gruppo) e caricare il file intitolato "Training protocol VFC.pro" (disponibile http://doi.org/10.17605/OSF.IO/4NKFQ).
NOTA: i test di contesto e cue utilizzano una configurazione di programma diversa; quindi, assicurarsi di utilizzare il file corretto su ogni test. A questo punto il file corretto corrisponde a "Training protocol VFC.pro". Tenere presente che durante le fasi di test il file corrispondente sarà diverso dalla sessione di allenamento. - Scegliere le videocamere corrispondenti e selezionare l'opzione Salva video (se necessario). Impostate Soglia movimento su 100 e Durata min congelamento su 30 fotogrammi.
NOTA: questo valore di Soglia movimento si basa sulle dimensioni della specie utilizzata (in base al numero di pixel). Il valore Durata minima congelamento è consigliato dal produttore. Questi valori vengono utilizzati per garantire il corretto riconoscimento dell'animale nella camera. - Verificare che il feed live della fotocamera scelta venga visualizzato sullo schermo, insieme al grafico della soglia di movimento e alla sequenza temporale dei diversi stimoli presentati durante l'allenamento (ad esempio, suono e shock).
NOTA: Utilizzando una marca diversa, l'installazione dell'apparecchiatura dovrebbe offrire la possibilità di misurare i movimenti dell'animale per rilevare un "indice" di movimento che dovrebbe consentire confronti sulla quantità di tempo in cui l'animale si muove o si blocca. Un'altra possibilità è l'utilizzo di un software che con solo la sorgente video (durante o dopo l'esperimento) in grado di rilevare la quantità di tempo in cui l'animale è in movimento o congelamento, come il software libero ImageF13, casella degli strumenti open-source in Matlab14, o un classificatore gratuito del comportamento animale come JAABA15. - Fare clic sull'opzione Calibra tre volte, mentre verificare che l'indice di movimento rimanga al di sotto di 100 (soglia). Quindi, impostare l'apparecchiatura per il blocco facendo clic sul pulsante corrispondente sullo schermo.
NOTA: in questa sezione viene descritto un processo di calibrazione del sistema di rilevamento del congelamento utilizzando una marca specifica di apparecchiature elencate nella Tabella dei Materiali. Come è stato detto in precedenza, il processo di calibrazione può essere condotto utilizzando diverse marche di attrezzature (per una revisione delle diverse opzioni in attrezzature e software vedere Anagnostaras et al. 2010)16.
4. Allenamento esteso per condizionamento della paura
- Trasportare i ratti nelle loro gabbie di casa, coperti con un panno, dalla struttura di cura degli animali alla sala di addestramento comportamentale in laboratorio. Evitare l'esposizione a rumori o condizioni di generazione di stress durante il trasporto di animali nella sala di addestramento comportamentale. Se più animali vengono trasportati contemporaneamente, portare solo gli animali da testare e mantenere altri ratti in una sala di attesa per migliorare il controllo sperimentale. Maneggiare delicatamente gli animali per 2 minuti prima di iniziare l'allenamento.
NOTA: Nel protocollo, gli animali sono stati trattati ogni giorno per 2 minuti prima dell'allenamento comportamentale. Dopo la manipolazione, gli animali sono stati introdotti nella camera sperimentale. Abbiamo raccomandato di manipolare gli animali per rendere i ratti abituali al ricercatore. - Introdurre il ratto nella camera sperimentale. Maneggiarlo delicatamente dalla base della sua coda e posizionarlo al centro della camera. Chiudere la camera sperimentale e le porte della scatola di attenuazione del suono.
- Avviare la sessione facendo clic sul pulsante Registra. Lasciate che il ratto si acclimata alla camera per 3 minuti. Questo periodo di 3 minuti è lo standard raccomandato dal produttore dell'apparecchiatura e serve come base e tempo di assuzia per la camera.
- Fornire 25 accoppiamenti tono-shock (prove) con un 60 s Inter-Trial Interval (ITI), a partire dal minuto 3 della sessione. Presentare il tono (stimolo condizionato – CS; 90 dB SPL, 2000 Hz, 50-ms Rise Time) durante gli ultimi 10 s di ogni ITI, e lo shock (stimolo incondizionato – US) durante gli ultimi 2 s di ogni ITI.
NOTA: l'attivazione del pulsante Registra è condizionata dal fatto che le telecamere siano correttamente calibrate e bloccate. - Rimuovere il ratto dalla camera sperimentale quando la sessione di 28 minuti è finita. Riportare gli animali nella rispettiva gabbia di casa. Trasportare i ratti nelle loro gabbie di casa coperte con un panno dalla sala di addestramento comportamentale alla struttura di cura degli animali.
- Ripetere la calibrazione del sistema di rilevamento del congelamento (passaggi 3.1-3.5) e il condizionamento della paura (passaggi 4.1 e 4.3) per addestrare tutti i soggetti.
NOTA: si consiglia vivamente di ricalibrare il sistema di rilevamento per ogni animale per garantire che il software mantenga gli stessi parametri quando elabora le informazioni per il rilevamento del congelamento. - Periodo di riposo: Durante questo periodo, gli animali riposano individualmente nelle loro gabbie di casa. Monitorare il peso degli animali due volte a settimana durante le 6 settimane del periodo di incubazione. Manipolare delicatamente ogni animale per due minuti mentre sono pesati.
5. Test di contesto – singola sessione da 10 min
- Dopo la fase di training, esporre gli animali al primo test di memoria denominato test di contesto. Durante questa fase di 10 minuti, esporre i ratti allo stesso contesto in cui la formazione ha avuto luogo, ma non presentare spunti o shock. Trasportare i ratti nelle loro gabbie di casa coperte (ad esempio, con un panno) dalla struttura di cura degli animali alla sala di addestramento comportamentale. Tenete a mente che gli animali sono stati divisi in gruppi, quindi un gruppo viene testato 48 h dopo la fase di allenamento e l'altro gruppo viene testato 6 settimane dopo l'allenamento (vedi Figura 1).
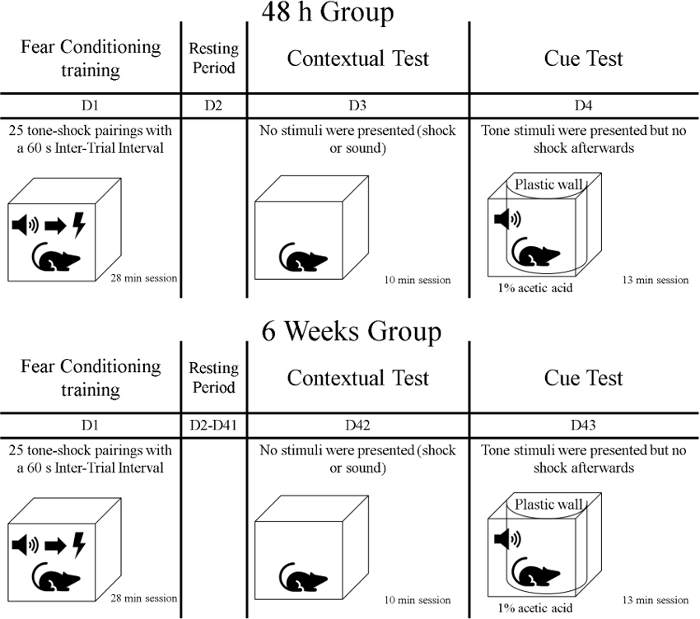
Figura 1: Sequenza temporale dell'esperimento. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
- Pulire tutte le superfici interne della camera sperimentale e del pavimento della griglia in acciaio inossidabile con il 10% di etanolo. Ripetere prima di testare ogni animale.
- Ripetere la calibrazione del sistema di rilevamento del congelamento (passaggi da 3.1 a 3.5). Aprire la finestra di dialogo Configurazione esperimento e caricare il file denominato "Context test protocol.pro", disponibile http://doi.org/10.17605/OSF.IO/4NKFQ.
NOTA: questo file contiene l'impostazione per questa fase sperimentale che consiste di nessun shock o toni. - Introdurre l'animale nella camera sperimentale. Maneggiarlo delicatamente dalla base della sua coda e posizionarlo al centro della camera. Chiudere la camera sperimentale e le porte della scatola di attenuazione del suono.
- Avviare la sessione facendo clic sul pulsante Registra. Durante questa singola sessione di test del contesto di 10 minuti, non vengono presentati stimoli (shock né suono).
- Rimuovere il soggetto dalla camera sperimentale al termine della sessione di 10 minuti. Riportare gli animali nelle rispettive gabbie e trasportare i ratti nelle loro gabbie di casa coperte dalla sala di addestramento comportamentale alla struttura di cura degli animali. Ripetere i passaggi 5.2-5.5 per testare tutti i soggetti.
6. Test cue – singola sessione da 13 min
- Un giorno dopo il test di contesto, gli animali vengono sottoposti al secondo test della memoria chiamato cue test. Durante questa fase, i ratti saranno in un contesto diverso di allenamento durante 13 min.; (toni) sono presentati, ma non vengono forniti ammortizzatori. Trasportare i ratti nelle loro gabbie di casa coperte da una copertura dalla struttura di cura degli animali alla sala di addestramento comportamentale. Testare un gruppo 72 h dopo l'allenamento di condizionamento della paura e testare un altro gruppo 6 settimane e un giorno dopo l'allenamento (Figura 1).
NOTA: un diverso sistema di trasporto (dalla struttura di cura degli animali alla sala sperimentale) potrebbe essere implementato per differenziare più il contesto e i test di segnale. Poiché gli animali sono stati trasportati alla sessione di addestramento e alla sessione di prova di contesto nelle gabbie di casa, durante il trasporto alla sessione di prova potrebbe essere utilizzata una gabbia di trasporto, una biancheria da letto e/o una copertura diverse. - Pulire tutte le superfici interne della camera sperimentale e del pavimento della griglia in acciaio inossidabile con il 10% di etanolo. Ripetere prima di testare ogni animale.
- Per cambiare il contesto visivo, inserire la parete circostante in plastica nella camera sperimentale.
- Per modificare il contesto olfattivo, applicare l'1% di acido acetico a un tampone con punta di cotone e posizionarlo nel vassoio metallico sotto il pavimentodella griglia 17,18,19.
- Ripetere la calibrazione del sistema di rilevamento del congelamento (passaggi 3.1-3.5). Caricare il file denominato "Cue test protocol.pro" file, disponibile da http://doi.org/10.17605/OSF.IO/4NKFQ.
NOTA: Questo file contiene l'impostazione per questa fase sperimentale, che consiste nella consegna degli stessi toni presentati durante la fase di allenamento (CS), ma in assenza di shock (US). - Introdurre l'animale nella camera sperimentale. Maneggiarlo delicatamente dalla base della sua coda e posizionarlo al centro della camera. Chiudere la camera sperimentale e le porte della scatola di attenuazione del suono.
- Avviare la sessione facendo clic sul pulsante Registra. Durante la singola sessione di test cue 13 min, lo stimolo CS (tono) viene presentato 10 volte, a partire dal minuto 3 della sessione.
NOTA: i primi 3 minuti corrispondono alla linea di base di questa sessione, seguiti da 10 prove di prova cue (vale a dire 10 s ciascuna) consegnate con 50 s ITI in assenza di shock. La consegna dei toni è automatica, tramite l'utilizzo del file caricato in precedenza. - Rimuovere l'animale dalla camera sperimentale al termine della sessione di 13 minuti. Riportare gli animali nella rispettiva gabbia e trasportarli coperti all'impianto di cura degli animali. Ripetere i passaggi da 6.2 a 6.5 per testare tutti i soggetti.
7. Analisi dei dati
- Ottenere l'indice di attività generale (ad esempio, indice di movimento) derivato dal flusso video utilizzando il software del sistema di rilevamento del congelamento. Questo software trasforma automaticamente l'indice di movimento per fornire la percentuale di tempo di congelamento per sessione e il numero di episodi di congelamento. Impostate la soglia di congelamento sull'impostazione predefinita Durata minima congelamento del sistema (1 s e 30 fotogrammi).
- Utilizzare il programma personalizzato aggiuntivo (file disponibile da http://doi.org/10.17605/OSF.IO/4NKFQ) per ottenere:
- Utilizzare il programma per determinare la percentuale di congelamento durante i primi tre minuti della sessione di allenamento (ad esempio, congelamento della linea di base, poiché non sono stati presentati urti o toni prima o durante quel periodo di 3 minuti) e durante i primi tre minuti della sessione di test cue.
- Utilizzare il programma per determinare la percentuale di congelamento per ciascuno degli otto contenitori da 3 minuti della sessione di allenamento.
- Utilizzare il programma per determinare la percentuale di congelamento durante le presentazioni cue (cioè, congelamento durante i toni) e periodi no-cue (intervalli intertriali; ITI), sia per le sessioni di formazione che per le sessioni di cue-test.
- Per ottenere questi dati, aprire il software del sistema di rilevamento del congelamento.
- Selezionare File Proprietà Reports . Riepilogo componente batch.
- Selezionare il file con estensione . CMP disponibile da http://doi.org/10.17605/OSF.IO/4NKFQ.
- Denominare il file di output e impostare Soglia movimento su 100. Quindi, fare clic su OK.
- Selezionare i file da analizzare (estensione . RAW). Questi file vengono generati automaticamente dal software di sistema di rilevamento del congelamento quando la sessione è finita e corrispondono ai dati grezzi di ogni sessione. Inizialmente, i file vengono salvati sul desktop del computer, ma possono essere memorizzati in una cartella personalizzata (ad esempio, Documents-Fear condizionamento) per facilitare la loro successiva identificazione e apertura quando hanno bisogno di essere analizzati.
- Aprire i file di output (estensione . CSV). Possono essere modificati in un software foglio di calcolo per ulteriori analisi. Questo file contiene i risultati del congelamento durante la sessione sperimentale.
NOTA: per ottenere la percentuale totale di congelamento, dividere il tempo trascorso dall'oggetto nel tempo totale della sessione. Il numero di episodi di congelamento può essere calcolato contando il numero di eventi di congelamento attraverso la sessione. In entrambi i casi, è necessario definire una soglia di movimento in base a una durata minima di congelamento. Questo è il criterio temporale che definisce se un Episodio di congelamento viene registrato. I sistemi automatizzati di registrazione possono utilizzare una certa quantità di fotogrammi al secondo (fps) come misura della durata minima del congelamento. Ad esempio, con una frequenza di campionamento di 30 fps, una durata minima di congelamento di 15 fotogrammi registra come congelamento un'istanza di immobilità che dura per 30 s.
- Calcola la durata media di ogni episodio di congelamento per ogni sessione (allenamento ed entrambi i test, contesto e cue) dividendo la durata totale di congelamento (in secondi) sul numero totale di episodi di congelamento.
Risultati
Le variazioni nella percentuale di tempo di congelamento durante le diverse fasi della sessione di allenamento sono state analizzate per tutti i soggetti (n e 12) utilizzando un test t dipendente (Tabella 1). Gli animali sono stati attivi ed esplorato la camera sperimentale durante i primi tre minuti della sessione di allenamento (primo giorno del protocollo), tempo durante il quale non sono stati consegnati toni o urti (cioè, baseline-BL). Come illustrato nella
Discussione
L'attuale protocollo esteso di condizionamento della paura è un approccio efficiente e valido per valutare la memoria emotiva in periodi brevi (48 h) e a lungo termine (6 settimane). Così, il protocollo permette di studiare il sovrallenamento e la paura dei fenomeni di incubazione nei ratti. Tra i diversi vantaggi di questo protocollo sono i seguenti. Offre due tipi di test di memoria, vale a dire contesto e cue, che consentono di identificare l'effetto differenziale di due ritardi (48 h e 6 settimane) attraverso le ma...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il sostegno finanziario a questa ricerca è stato fornito da Fundaciàn Universitaria Konrad Lorenz - numero di sovvenzione 9IN15151. Gli autori ringraziano il Dipartimento di Comunicazione dell'Università di Konrad Lorenz per il loro aiuto nella registrazione e nell'editing del video, in particolare Natalia Rivera e Andrés Serrano (Produttori). Inoltre, Nicole Pfaller-Sadovsky e Lucia Medina per i loro commenti sul manoscritto, e Johanna Barrero, Dean presso Corporacion Universitaria Iberoamericana, per la collaborazione istituzionale. Gli autori non hanno conflitti di interesse.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic acid (ethanoic acid) | https://pubchem.ncbi.nlm.nih.gov/compound/acetic_acid | ||
| Aversive Stimulation Current Package | MED Associates Inc | ENV-420 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Contextual test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Cue test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Curved Wall Insert | MED Associates Inc | VFC-008-CWI | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Data processing.zip | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| NIR/White Light Control Box | MED Associates Inc | NIR-100 | |
| Quick Change Floor/Pan Unit for Mouse | MED Associates Inc | ENV-005FPU-M | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Small Tabletop Cabinet and Power Supply | MED Associates Inc | SG-6080D | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standalone Aversive Stimulator/Scrambler (115 V / 60 Hz) | MED Associates Inc | ENV-414S | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standard Fear Conditioning Chamber | MED Associates Inc | VFC-008 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Training protocol VFC.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Video Fear Conditioning Package for Rat | MED Associates Inc | MED-VFC-SCT-R | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
Riferimenti
- Frankland, P. W., Bontempi, B. The organization of recent and remote memories. Nature Reviews Neuroscience. 6 (2), 119-130 (2005).
- Suzuki, A., Mukawa, T., Tsukagoshi, A., Frankland, P. W., Kida, S. Activation of LVGCCs and CB1 receptors required for destabilization of reactivated contextual fear memories. Learning & Memory. 15 (6), 426-433 (2008).
- Hermans, E. J., et al. How the amygdala affects emotional memory by altering brain network properties. Neurobiology of Learning and Memory. 112, 2-16 (2014).
- Moryś, J., Berdel, B., Jagalska-Majewska, H., ŁUczyńSka, A. The basolateral amygdaloid complex -its development, morphology and functions. Folia Morphologica. 58 (3), 29-46 (1998).
- LeDoux, J. E. Emotional memory systems in the brain. Behavioural Brain Research. 58 (1-2), 69-79 (1993).
- Labar, K. S. Beyond fear: Emotional memory mechanisms in the human brain. Current Directions in Psychological Science. 16 (4), 173-177 (2007).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Maren, S. Overtraining Does Not Mitigate Contextual Fear Conditioning Deficits Produced by Neurotoxic Lesions of the Basolateral Amygdala. The Journal of Neuroscience. 18 (8), 3097-3097 (1998).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, (2013).
- Morrow, J. D., Saunders, B. T., Maren, S., Robinson, T. E. Sign-tracking to an appetitive cue predicts incubation of conditioned fear in rats. Behavioural Brain Research. 276, 59-66 (2015).
- Pickens, C. L., Golden, S. A., Adams-Deutsch, T., Nair, S. G., Shaham, Y. Long-lasting incubation of conditioned fear in rats. Biological Psychiatry. 65 (10), 881-886 (2009).
- Schaap, M. W. H., et al. Nociception and Conditioned Fear in Rats: Strains Matter. PLoS ONE. 8 (12), 83339 (2013).
- Shoji, H., Takao, K., Hattori, S., Miyakawa, T. Contextual and Cued Fear Conditioning Test Using a Video Analyzing System in Mice. Journal of Visualized Experiments. (85), e50871 (2014).
- Patel, T. P., et al. An open-source toolbox for automated phenotyping of mice in behavioral tasks. Frontiers in Behavioral Neuroscience. 8, 349 (2014).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: Interactive machine learning for automatic annotation of animal behavior. Nature Methods. 10 (1), 64-67 (2013).
- Anagnostaras, S. G. Automated assessment of Pavlovian conditioned freezing and shock reactivity in mice using the VideoFreeze system. Frontiers in Behavioral Neuroscience. 4 (58), (2010).
- Moyer, J. R., Brown, T. H. Impaired Trace and Contextual Fear Conditioning in Aged Rats. Behavioral Neuroscience. 120 (3), 612-624 (2006).
- Schuette, S. R., Hobson, S. Conditioned contextual fear memory to assess natural forgetting and cognitive enhancement in rats. Journal of Biological Methods. 5 (3), 99 (2018).
- Chang, C. H., et al. Fear extinction in rodents. Current Protocols in Neuroscience. , (2009).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, 1-18 (2013).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Vetere, G., et al. Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice Article Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice. Neuron. 94 (2), 363-374 (2017).
- Koob, G. F., Zimmer, A. Chapter 9 - Animal models of psychiatric disorders. Neurobiology of Psychiatric Disorders. 106, 137-166 (2012).
- Bourin, M. Animal models for screening anxiolytic-like drugs: a perspective. Dialogues in clinical neuroscience. 17 (3), 295-303 (2015).
- Murray, S. B., et al. Fear as a translational mechanism in the psychopathology of anorexia nervosa. Neuroscience & Biobehavioral Reviews. 95, 383-395 (2018).
- Pamplona, F. A., et al. Prolonged fear incubation leads to generalized avoidance behavior in mice. Journal of Psychiatric Research. 45 (3), 354-360 (2011).
- Török, B., Sipos, E., Pivac, N., Zelena, D. Modelling posttraumatic stress disorders in animals. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 90, 117-133 (2019).
- Bhakta, A., Gavini, K., Yang, E., Lyman-Henley, L., Parameshwaran, K. Chronic traumatic stress impairs memory in mice: Potential roles of acetylcholine, neuroinflammation and corticotropin releasing factor expression in the hippocampus. Behavioural Brain Research. 335, 32-40 (2017).
- Uniyal, A., et al. Pharmacological rewriting of fear memories: A beacon for post-traumatic stress disorder. European Journal of Pharmacology. , 172824 (2019).
- Barad, M. Fear extinction in rodents: basic insight to clinical promise. Current Opinion in Neurobiology. 15 (6), 710-715 (2005).
- Haaker, J., et al. Making translation work: Harmonizing cross-species methodology in the behavioural neuroscience of Pavlovian fear conditioning. Neuroscience & Biobehavioral Reviews. 107, 329-345 (2019).
- Heroux, N. A., Horgan, C. J., Pinizzotto, C. C., Rosen, J. B., Stanton, M. E. Medial prefrontal and ventral hippocampal contributions to incidental context learning and memory in adolescent rats. Neurobiology of Learning and Memory. 166, 107091 (2019).
- Rossi, M. A., Yin, H. H. Methods for Studying Habitual Behavior in Mice. Current Protocols in Neuroscience. 60 (1), 8-29 (2012).
- Brady, A. M., Floresco, S. B. Operant Procedures for Assessing Behavioral Flexibility in Rats. Journal of Visualized Experiments. (96), (2015).
- Zoccolan, D., Di Filippo, A. Methodological Approaches to the Behavioural Investigation of Visual Perception in Rodents. Handbook of Behavioral Neuroscience. , (2018).
- Lguensat, A., Bentefour, Y., Bennis, M., Ba-M'hamed, S., Garcia, R. Susceptibility and Resilience to PTSD-Like Symptoms in Mice Are Associated with Opposite Dendritic Changes in the Prelimbic and Infralimbic Cortices Following Trauma. Neuroscience. 418, 166-176 (2019).
- Li, Q., et al. N-Acetyl Serotonin Protects Neural Progenitor Cells Against Oxidative Stress-Induced Apoptosis and Improves Neurogenesis in Adult Mouse Hippocampus Following Traumatic Brain Injury. Journal of Molecular Neuroscience. 67 (4), 574-588 (2019).
- Pantoni, M. M., Carmack, S. A., Hammam, L., Anagnostaras, S. G. Dopamine and norepinephrine transporter inhibition for long-term fear memory enhancement. Behavioural Brain Research. 378 (112266), 112266 (2020).
- Smith, K. L., et al. Microglial cell hyper-ramification and neuronal dendritic spine loss in the hippocampus and medial prefrontal cortex in a mouse model of PTSD. Brain, Behavior, and Immunity. 80, 889-899 (2019).
- Liu, X., Zheng, X., Liu, Y., Du, X., Chen, Z. Effects of adaptation to handling on the circadian rhythmicity of blood solutes in Mongolian gerbils. Animal Models and Experimental. 2 (2), 127-131 (2019).
- Landgraf, D., McCarthy, M. J., Welsh, D. K. The role of the circadian clock in animal models of mood disorders. Behavioral Neuroscience. 128 (3), 344-359 (2014).
- Refinetti, R., Kenagy, G. J. Diurnally active rodents for laboratory research. Laboratory annimals. 52 (6), 577-587 (2018).
- Hurtado-Parrado, C., et al. Assessing Mongolian gerbil emotional behavior: effects of two shock intensities and response-independent shocks during an extended inhibitory-avoidance task. PeerJ. 5, (2017).
- Frey, P., Eng, S., Gavinf, W. Conditioned suppression in the gerbil. Behavior Research Methods & Instrumentation. 4 (5), 245-249 (1972).
- Woolley, M. L., Haman, M., Higgins, G. A., Ballard, T. M. Investigating the effect of bilateral amygdala lesions on fear conditioning and social interaction in the male Mongolian gerbil. Brain Research. 1078 (1), 151-158 (2006).
- Ballard, T. M., Sänger, S., Higgins, G. a Inhibition of shock-induced foot tapping behaviour in the gerbil by a tachykinin NK1 receptor antagonist. European Journal of Pharmacology. 412 (3), 255-264 (2001).
- Luyten, L., Schroyens, N., Hermans, D., Beckers, T. Parameter optimization for automated behavior assessment: plug-and-play or trial-and-error. Frontiers in Behavioral Neuroscience. 8 (28), (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon