È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione del campione nella misurazione del microbilanciamento del cristallo di quarzo dell'adsortazione delle proteine e della meccanica dei polimeri
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il microbilanciamento a cristalli di quarzo può fornire accurate proprietà di massa e viscoelastica per le pellicole nella gamma micron o submicron, che è rilevante per le indagini in biomedica e ambientale rilevamento, rivestimenti e scienza dei polimeri. Lo spessore del campione influenza quali informazioni possono essere ottenute dal materiale a contatto con il sensore.
Abstract
In questo studio, presentiamo vari esempi di come la sottile preparazione della pellicola per gli esperimenti di microbilanciamento del cristallo di quarzo informa la modellazione appropriata dei dati e determina quali proprietà della pellicola possono essere quantificate. Il microbilanciamento a cristalli di quarzo offre una piattaforma particolarmente sensibile per misurare i cambiamenti fini nelle proprietà di massa e/o meccaniche di una pellicola applicata osservando i cambiamenti nella risonanza meccanica di un cristallo di quarzo che oscilla ad alta frequenza. I vantaggi di questo approccio includono la sua versatilità sperimentale, la capacità di studiare i cambiamenti nelle proprietà su una vasta gamma di lunghezze di tempo sperimentali e l'uso di campioni di piccole dimensioni. Dimostriamo che, in base allo spessore e al modulo di taglio dello strato depositato sul sensore, possiamo acquisire informazioni diverse dal materiale. Qui, questo concetto è specificamente sfruttato per visualizzare parametri sperimentali con conseguente calcoli di massa e viscoelastico del collagene adsorbito su complessi oro e poliglitolitico durante il gonfiore in funzione della concentrazione del sale.
Introduzione
Il microequilibrio di cristallo di quarzo (QCM) sfrutta l'effetto piezoelettrico di un cristallo di quarzo per monitorare la sua frequenza risonante, che dipende dalla massa aderita alla superficie. La tecnica confronta la frequenza di risonanza e la larghezza di banda di un sensore di cristallo al quarzo taglio AT (tipicamente nell'intervallo di 5 MHz)1 in aria o un fluido alla frequenza e alla larghezza di banda del sensore dopo la deposizione di una pellicola. Ci sono diversi vantaggi per l'utilizzo del QCM per studiare le proprietà e le interfacce della pellicola sottile, tra cui l'elevata sensibilità alla massa e potenzialmente ai cambiamenti delle proprietà viscoelastice (a seconda dell'uniformità e dello spessore del campione), la capacità di eseguire studi in situ2e la capacità di sondare una scala reologica molto più breve rispetto alla tradizionale reologia di taglio o analisi meccanica dinamica (DMA). Sondare una breve scala temporale reologica permette l'osservazione di come la risposta in questa scala temporale cambia sia su durate estremamente brevi (ms)3 e lunghe (anni)4. Questa capacità è utile per lo studio di una varietà di processi cinetici ed è anche un'utile estensione delle tecniche reometriche tradizionali5,6.
L'elevata sensibilità del QCM ha anche portato al suo uso pesante in applicazioni biologiche studiando le interazioni fondamentali di biomolecole estremamente piccole. Una superficie del sensore non rivestita o funzionalizzata può essere utilizzata per studiare l'adsorbiente delle proteine; ancora più lontano, il biosensing attraverso complessi eventi di legame tra enzimi, anticorpi e aptamers può essere esaminato sulla base di cambiamenti di massa7,8,9. Per esempio, la tecnica è stata utilizzata per comprendere la trasformazione delle vesciche in un bistrato lipidico planare come un processo in due fasi di adsorbizione di vesciboli contenenti liquidi a una struttura rigida osservando i cambiamenti di frequenza e viscoelasticità10. Negli ultimi anni, il QCM ha inoltre offerto una solida piattaforma per monitorare la somministrazione di farmaci tramite vescicoli o nanoparticelle11. All'intersezione tra ingegneria dei materiali e biologia molecolare e cellulare, possiamo usare il QCM per chiarire le interazioni chiave tra materiali e componenti bioattivi come proteine, acidi nucleici, liposomi e cellule. Ad esempio, l'adsortionte delle proteine a un biomateriale media le risposte cellulari a valle come l'infiammazione ed è spesso usato come indicatore positivo di biocompatibilità, mentre in altri casi l'attaccamento extracellulare delle proteine ai rivestimenti che si interfacciano con il sangue potrebbe indurre la coagulazione pericolosa nei vasi12,13. Il QCM può quindi essere utilizzato come strumento per selezionare i candidati ottimali per esigenze diverse.
Due approcci comuni per l'esecuzione di esperimenti QCM raccolgono dati analoghi dall'esperimento: il primo approccio registra lo spostamento di frequenza e la metà della larghezza di banda ()del picco di conduttanza. Il secondo approccio, QCM con dissipazione (QCM-D), registra lo spostamento di frequenza e il fattore di dissipazione, che è direttamente proporzionale alla
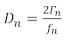 (1)
(1)
dove D è il fattore di dissipazione e è la frequenza. Sia D che - sono legati all'effetto di smorzamento che la pellicola ha sul sensore, che fornisce un'indicazione della rigidità della pellicola. Il pedice n denota la variazione di frequenza o armonica, che sono le frequenze di risonanza dispari del sensore al quarzo (n : 1, 3, 5, 7...). Ulteriori discussioni su modelli che utilizzano molteplici armoniche per ottenere le proprietà di massa e viscoelastica di un film possono essere trovate in una recensione di Johannsmann14 e documenti precedenti del gruppo Shull15,16,17,18.
Una considerazione fondamentale per la preparazione dei campioni QCM è come applicare la pellicola sottile sulla superficie del sensore. Alcuni metodi comuni includono il rivestimento a spin, il rivestimento a tuffo, il rivestimento a goccia o l'adsorption del film sulla superficie del sensore durante l'esperimento19,20. Ci sono quattro regioni per i campioni QCM: il limite di Sauerbrey, il regime viscoelastico, il regime di massa e il regime sovrasmordito. Per i film sufficientemente sottili, si applica il limite di Sauerbrey, dove lo spostamento di frequenzaèquello di una maggiore frequenza. Entro il limite di Sauerbrey, lo spostamento di frequenza si adatta linearmente con l'armonica risonante, n, e le variazioni nel fattore di smorzamento (D o z) sono generalmente piccole. In questo regime non sono disponibili informazioni sufficienti per determinare in modo univoco le proprietà reologiche del layer senza fare ipotesi aggiuntive. I dati di questo regime vengono utilizzati per calcolare la densità di massa della superficie (o spessore se la densità è nota a priori) della pellicola. Nel regime di massa in cui il mezzo a contatto con il cristallo è sufficientemente spesso, l'onda di taglio evanescente si propaga nel mezzo prima di essere completamente smorzata. Qui, nessuna informazione di massa può essere ottenuta utilizzando . Tuttavia, in questa regione, le proprietà viscoelastice sono determinate in modo affidabile utilizzando la combinazione di z -e 15 , 18. Nel regime di massa, se il mezzo è troppo rigido, il film smorza la risonanza del sensore, impedendo la raccolta di dati affidabili dal QCM. Il regime viscoelastico è il regime intermedio in cui la pellicola è abbastanza sottile da avere l'onda di taglio completamente propagata attraverso la pellicola e hanno valori affidabili per il fattore di smorzamento. Il fattore di smorzamento e il fattore di smorzamento e lasbarramento possono quindi essere usati per determinare le proprietà viscoelastiche del film e la sua massa. Qui, le proprietà viscoelastiche sono date dal prodotto della densità e della grandezza del complesso modulo di taglio . G p e l'angolo di fase dato da : arctan(G / G'). Quando i film sono preparati al limite di Sauerbrey, la massa per unità di superficie può essere calcolata direttamente in base all'equazione di Sauerbrey mostrata sotto21,
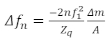 (2)
(2)
dove nè il cambiamento nella frequenza di risonanza, n è il tono di interesse,è la frequenza risonante del sensore, zm / A è la massa per area del film, e q è l'impedimento acustico del quarzo, che per il quarzo tagliato AT è :q , 8,84 x 10 6 kg / m2 s. Il regime viscoelastico è più appropriato per lo studio delle pellicole polimeriche, e il limite di massa è utile per studiare polimeri viscosi22 o soluzioni proteiche16. I diversi regimi dipendono dalle proprietà del materiale di interesse, con lo spessore ottimale per la piena caratterizzazione viscoelastica e di massa generalmente aumentando con la rigidità della pellicola. La figura 1 descrive le quattro regioni per quanto riguarda la densità areale della pellicola, il modulo di taglio complesso e l'angolo di fase, in cui abbiamo assunto una relazione specifica tra l'angolo di fase e la rigidità della pellicola che è stata dimostrata rilevante per i materiali di questo tipo. Molti film di interesse pratico sono troppo spessi per studiare le proprietà viscoelastiche con QCM, come alcuni biofilm, dove gli spessori sono dell'ordine di decine a centinaia di micron23. Tali pellicole spesse non sono generalmente adatte per lo studio utilizzando il QCM, ma possono essere misurate utilizzando risonatori a frequenza molto più bassi (come i risonatori torsionali)23, permettendo all'onda di taglio di propagarsi ulteriormente nella pellicola.
Per determinare quale regime è rilevante per un dato campione QCM, è importante comprendere il parametro d /n, che è il rapporto tra lo spessore della pellicola (d) e la lunghezza d'onda di taglio dell'oscillazione meccanica del sensore di cristallo di quarzo(n)15,16,18. Il regime viscoelastico ideale è d /n - 0,05 - 0,218, dove valori inferiori a 0,05 sono all'interno del limite di Sauerbrey e valori superiori a 0,2 si avvicinano al regime di massa. Una descrizione più rigorosa di d /n è fornita altrove15,18, ma è un parametro quantitativo che delinea il limite di Sauerbrey e il limite viscoelastico. I programmi di analisi utilizzati di seguito forniscono direttamente questo parametro.
Ci sono alcune limitazioni aggiuntive per l'analisi di pellicole sottili con il QCM. I calcoli Sauerbrey e viscoelastico presumono che la pellicola sia omogenea sia per lo spessore della pellicola che lateralmente sulla superficie dell'elettrodo del QCM. Mentre questa ipotesi rende difficile studiare i film che hanno vuoti o riempitivi presenti, ci sono state alcune indagini QCM su film costituiti da nanoparticelle innestate6. Se le eterogeneità sono piccole rispetto allo spessore complessivo della pellicola, è ancora possibile ottenere proprietà viscoelastiche affidabili del sistema composito. Per sistemi più eterogenei, i valori ottenuti da un'analisi viscoelastica devono sempre essere visti con grande cautela. Idealmente, i risultati ottenuti da sistemi con eterogeneità sconosciuta dovrebbero essere convalidati rispetto a sistemi che sono noti per essere omogenei. Questo è l'approccio che abbiamo adottato nel sistema di esempio descritto in questo documento.
Un punto importante che illustriamo in questo documento è l'esatta corrispondenza tra le misurazioni QCM effettuate nel dominio della frequenza (dove viene riportato il dominio di z) e gli esperimenti sul dominio temporale (dove viene riportato D). Vengono descritti i risultati di due diversi esperimenti QCM, un dominio temporale e un dominio di frequenza, ognuno dei quali coinvolge un sistema di modelli diverso ma concettualmente correlato. Il primo sistema è un semplice esempio di attaccamento del collagene al sensore per illustrare la cinetica di legame rappresentativa e l'equilibratura dell'adsorto nel tempo durante una misurazione del dominio temporale (QCM-D). Il collagene è la proteina più abbondante nel corpo, nota per la sua versatilità di comportamenti vincolanti e morfologia. La soluzione di collagene qui utilizzata non richiede un'ulteriore funzionalizzazione della superficie dorata del sensore per indurre l'adsorto9. Il secondo sistema sperimentale è un complesso di polielettroliti (PEC) composto da solfato di polistirolo anionico (PSS) e policazionale cationico (diallyldimethylammonium) (PDADMA) preparato allo stesso modo di Sadman et al.22. Questi materiali si gonfiano e diventano morbidi nelle soluzioni di sale (KBr in questo caso), offrendo una semplice piattaforma per studiare la meccanica dei polimeri utilizzando un approccio di dominio di frequenza (QCM-z). Per ogni protocollo, il processo di preparazione, assunzione e analisi di una misurazione è illustrato nella Figura 2. Lo schema mostra che la differenza principale tra gli approcci QCM- e QCM-D è nella fase di raccolta dei dati e la strumentazione utilizzata nell'esperimento. Tutte le tecniche di preparazione dei campioni menzionate sono compatibili con entrambi gli approcci e ogni approccio può analizzare gli esempi nelle tre aree illustrate nella Figura 1.
I nostri dati dimostrano che la preparazione di campioni, sia mediante rivestimento del sensore prima o durante una misurazione, determina la capacità di estrarre le proprietà viscoelastiche di un sistema. Progettando le prime fasi di un esperimento in modo appropriato, possiamo determinare quali informazioni possiamo raccogliere con precisione durante la fase di analisi.
Protocollo
Annuncio collagene QCM-D
1. Preparazione del campione e pre-pulizia del sensore
- Preparare 20 mL di buffer in acetato da 0,1 M, regolando il pH con HCl e NaOH in base alle esigenze per ottenere il pH 5,6.
- Aggiungere la soluzione di collagene coda di ratto al buffer di 20 mL di acetato in condizioni sterili ad una concentrazione finale di 10 g/mL.
- Pulire il sensore al quarzo rivestito in oro per rimuovere materiale organico e biologico25,26.
- Posizionare il lato attivo del sensore in una camera UV/Ozone e trattare la superficie per circa 10 min.
- Riscaldare una miscela di acqua deionizzata 5:1:1 (dH2O), ammoniaca (25%) e perossido di idrogeno (30%) a 75 gradi centigradi. Posizionare il sensore nella soluzione per 5 min.
- Sciacquare il sensore con dH2O e asciugare con un flusso di gas di azoto.
- Posizionare il lato attivo del sensore in una camera UV/Ozone e trattare la superficie per 10 min.
NOTA: la procedura di pulizia deve essere eseguita immediatamente prima di una misurazione per ridurre al minimo la contaminazione ambientale sulla superficie del sensore.
2. Acquisizione dei dati di misurazione QCM-D
- Accendere tutte le apparecchiature necessarie per prendere una misura tra cui la pompa, l'unità elettronica e il software del computer.
- Rimuovere il modulo di flusso dalla piattaforma della camera e svitare le grandi viti del pollice per aprire il modulo.
- Se il sensore è stato omesso dopo la pulizia iniziale (passaggi 1.3.1-1.3.4), sciacquare il sensore con acqua deionizzata (dH2O) e asciugare con un flusso di gas di azoto per garantire che non vi siano contaminanti sulla superficie.
- Montare il sensore nel modulo di flusso sull'anello O esposto, asciugando prima l'area con un flusso di gas di azoto e controllando che l'anello O sia disteso. Il sensore deve essere posizionato con il lato della superficie attiva verso il basso e l'elettrodo a forma di ancora orientato verso il marcatore nel modulo di flusso.
- Ruotare le viti del pollice per sigillare il modulo di flusso e sostituirlo sulla piattaforma della camera. Collegare tutti i tubi di pompa PTFE necessari al modulo di flusso e alla pompa esterna.
- Utilizzando il software del computer appropriato, impostare la temperatura del modulo di flusso su 37 . Monitorare la temperatura di variazione per 10-15 min per assicurarsi che sia equilibrato al valore desiderato.
- Trovare le frequenze di risonanza iniziali del sensore. Se il software non rileva frequenze di risonanza, verificare che il modulo di flusso sia posizionato correttamente sulla piattaforma della camera o rimontare il sensore nel modulo di flusso per assicurarsi che sia centrato e che sia collegato correttamente.
- Posizionare il tubo della pompa di inseridiazione nella soluzione salina 1x con buffer fosfato (PBS). Avviare il flusso della pompa esterna a 25 l/min e ispezionare visivamente il tubo per essere sicuri che il fluido scorra attraverso il tubo.
NOTA: Il flusso del fluido può essere più facile da vedere aumentando momentaneamente la portata del fluido a 100 l/min o superiore. Se il fluido non sembra muoversi attraverso il tubo, è molto probabile che le due parti del modulo di flusso non stiano creando una guarizione adeguata. Provare a stringere le viti del pollice, stringere i connettori del tubo per l'entrata e la presa, o rimontare il sensore per essere sicuri che l'anello O sia piatto e centrato. - Consentire il flusso fluido dell'1x PBS attraverso il modulo di flusso per almeno 15 min per l'equilibrato corretto.
- Avviare la misurazione nel software del computer per iniziare l'acquisizione dei dati. Monitorare i valori di frequenza e dissipazione per almeno 5 min per garantire una linea di base stabile.
- Fermare la pompa e spostare il tubo di ingresso alla soluzione buffer collagene-acetato, e riprendere il flusso di liquido. Prendere nota dell'ora di questo evento per un'analisi successiva.
- Lasciare che i nuovi valori di frequenza e dissipazione siano equilibrati a un valore stabile. Qui, ci aspettiamo che questa stabilizzazione avvenga dopo 8-12 h.
- Fermare la pompa, spostare il tubo di ingresso di nuovo alla soluzione 1x PBS, e riprendere il flusso di liquido. Prendere nota dell'ora di questo evento per un'analisi successiva.
- Lasciare che i nuovi valori di frequenza e dissipazione siano equilibrati a un valore stabile. Qui, questa stabilizzazione avviene dopo 30 min.
NOTA: i passi 2.13 e 2.14 possono essere ripetuti per ogni nuovo periodo di flusso di fluido in esperimenti più rigorosi con un maggior numero di fasi. - Terminare l'acquisizione dei dati della misurazione e salvare i dati.
- Pulire e smontare l'apparecchiatura QCM.
- Aumentare la portata del fluido della pompa esterna a 500 l/min o superiore e posizionare il tubo di ingresso in una soluzione di 2% Hellmanex soluzione di pulizia per almeno 20 min.
NOTA: per altri esperimenti, se si desidera un'ulteriore analisi del sensore, rimuovere il sensore prima del passaggio 2.16.1 e posizionare un altro sensore di pulizia nel modulo. - Fermare la pompa e spostare il tubo di ingresso a dH2O, e riprendere il flusso di liquido per lavare ulteriormente il sistema per almeno 20 min.
- Interrompere il flusso del fluido e rimuovere il sensore dal modulo di flusso. Asciugare il sensore e all'interno del modulo di flusso con un flusso di gas di azoto. Spegnere il software del computer, l'unità elettronica e la pompa peritaltica.
NOTA: i sensori rivestiti d'oro possono essere puliti correttamente, come descritto nei passaggi da 1.3.1-1.3.4 e riutilizzati per diverse misurazioni. Le indicazioni che un sensore non può più essere riutilizzato per misurazioni affidabili possono includere, ma non si limitano alla grande variabilità delle frequenze di risonanza iniziale e alle derive significative nelle misurazioni di base con flusso di buffer. I dati possono essere aperti e analizzati nel software preferito, compresi quelli forniti da aziende specializzate in apparecchiature QCM-D.
- Aumentare la portata del fluido della pompa esterna a 500 l/min o superiore e posizionare il tubo di ingresso in una soluzione di 2% Hellmanex soluzione di pulizia per almeno 20 min.
Gonfiore complesso di polielettroliti QCM
3. Preparazione dei campioni
NOTA: Questo esperimento è stato eseguito utilizzando un programma MATLAB sviluppato all'interno del gruppo di ricerca Shull per la raccolta e l'analisi dei dati.
- In primo luogo, posizionare un sensore di cristallo di quarzo nudo in un supporto campione collegato all'analizzatore di rete vettoriale e al computer. Accendere l'analizzatore per applicare una tensione oscillante al sensore e raccogliere uno spettro di conduttanza di riferimento per il sensore nell'aria.
- Immergere il supporto del campione in un becher da 100 mL senza labbra riempito con acqua distillata e raccogliere uno spettro di conduttanza di riferimento per il sensore nudo in acqua.
- Preparare una soluzione di 0,5 M di bromuro di potassio (KBr).
- Sciogliere 1,79 g di KBr in 30 mL di acqua distillata. Agitare fino a sciogliere.
- Inserire un piccolo wafer di silicio nella soluzione KBr ad angolo per creare una diapositiva per il sensore di quarzo durante la fase di annessione per evitare che la pellicola eschi dal sensore.
- Preparare il sensore per il rivestimento di spin.
- Impostare i parametri del mantello di rotazione su 10.000 rpm, 8.000 accelerazione e 5 s.
- Inserire il sensore sull'identificatore di spin e accendere il vuoto.
- Coprire la superficie del sensore con etanolo ed eseguire il rivestimento di spin per pulire la superficie del sensore.
- Aggiungere il PEC (PSS:PDADMA preparato nello stesso modo in cui dettagliato in Sadman et al. 22) alla superficie del sensore.
- Se il complesso si trova in due fasi (polimero ricco e polimerico povero), inserire lentamente il tubo nella soluzione. Evacuare il tubo soffiando bolle mentre si sposta il tubo nella fase più densa di polimeri.
- Dopo aver rilasciato un paio di bolle nella fase ricca di polimeri, distrutre 0,5-0,75 mL della soluzione ricca di polimeri nel pipet. Mantenere la pressione sul bulbo del tubo per non consentire alla fase povera di polimeri di entrare nel tubo, estrarre il tubo dalla soluzione.
- Pulire l'esterno del pipet utilizzando un Kimwipe. Aggiungere una soluzione sufficiente dropwise sulla superficie del sensore al quarzo per coprire completamente la superficie. Assicurarsi che non vi siano bolle visibili nella soluzione sulla superficie del sensore.
- Ruotare il campione PEC e immergere immediatamente il sensore nella soluzione KBr da 0,5 M per evitare la cristallizzazione del sale sulla pellicola.
NOTA: questo passaggio è talvolta difficile da coordinare. Rilasciare il sensore appena sopra la soluzione KBr per ottenere i migliori risultati. - Lasciare che il film sia ad anneal per almeno 12 h.
NOTA: Per facilitare l'esecuzione dell'esperimento, preparare il passaggio 4 la sera e lasciare che il film si anneal durante la notte.
4. Misurazione della pellicola in aria e in acqua
- Trasferire il sensore su un becher riempito con acqua distillata per rimuovere il KBr in eccesso dalla pellicola e sul lato posteriore del sensore. Lasciare il sensore nella soluzione per 30-60 min.
- Prendere una misura del film in aria. Riferimento al sensore nudo in aria. Consentire l'eclicazione dei dati della pellicola.
- Inserire il solfato di calcio essiccato in un becher senza labbra da 100 mL e misurare lo spessore della pellicola completamente asciutta. Rimuovere il solfato di calcio dal becher e sciacquare il becher con acqua distillata.
- Riempire il becher senza labbra da 100 mL con 30 mL di acqua distillata. Inserire una barra di agitazione per assicurarsi che l'acqua circoli intorno alla pellicola. Misurare la pellicola in acqua per circa 30-45 min o fino a quando i dati della pellicola sono equilibrati. Riferimento al sensore nudo in acqua.
- Preparare una soluzione da 15 mL di 3 M KBr in acqua distillata. Misurare 5,35 g di KBr in un cilindro graduato e riempire a 15 mL con acqua distillata. Swirl fino a dissoluzione.
- Aggiungere la soluzione KBr al becher con acqua distillata con incrementi di 0,1 M. La tabella 1 descrive gli incrementi di 0,1 M in mL della soluzione KBr da 3 M. Affrontare la pellicola lontano da dove la soluzione KBr viene aggiunto all'acqua in modo che il film non si dissolva. Assicurarsi che il sistema sia equilibrato prima di aggiungere un'altra soluzione KBr.
- Dopo che tutti i dati sono stati acquisiti, rimuovere il film dal supporto e mettere in un bicchiere di acqua distillata. Lasciare il sale per lasciare il film (30-60 min) e asciugare all'aria la pellicola.
- Per pulire la pellicola PEC dal sensore, aggiungere KBr al becher e ruotare delicatamente la soluzione. Lasciare soffermato per 5-10 min. Ripetere questo processo 2-3 volte, quindi risciacquare il sensore con acqua distillata.
NOTA: il sensore può essere pulito e riutilizzato se la risposta dal sensore è ancora valida. Questo può essere controllato dal sensore con piccole letture assolute della larghezza di banda per le armoniche di interesse (<100 Hz).
5. Analisi dei dati
- Aprire la GUI MATLAB di analisi dei dati QCM-D creata da Sadman (https://github.com/sadmankazi/QCM-D-Analysis-GUI)27. Aprire il file di dati della pellicola in un file di dati aria selezionando "Carica QCM".
NOTA: il gruppo Shull ha sviluppato una GUI Python simile per la raccolta e l'analisi dei dati per QCM (https://github.com/shullgroup/rheoQCM). Una parte del codice di analisi viene fornita nelle informazioni supplementari sia per l'analisi dei dati che per la generazione delle cifre contenute in questo documento. - Selezionare il calcolo desiderato (3,5,3 o 3,5,5), gammae pellicola in icone dell'aria. Fare clic su Stampa QCM.
- Determinare lo spessore della pellicola secca utilizzando il punto dati più equilibrato (in genere l'ultimo punto dati) dall'esperimento. Registrare questo valore.
- Aprire la pellicola in un file di dati acqua. Selezionare gli stessi parametri del punto 5.2, ad eccezione della pellicola in acqua anziché della pellicola in aria.
- Dopo ogni fase di equilibratione dell'esperimento di gonfiore, determinare lo spessore della pellicola, il modulo di taglio complesso e l'angolo di fase viscoelastico. Registrare questi valori insieme alla forza ionica (che vanno da 0-1 M in incrementi di 0,1 M).
- Determinare la percentuale di gonfiore come
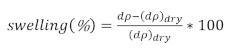 (3)
(3)
dove dp è lo spessore della pellicola dalla soluzione e dpasciutto è lo spessore della pellicola secca.
Risultati
I cambiamenti di frequenza con il tempo durante l'adsorbizione proteica presentano una curva caratteristica e plateau mostrato Figura 3A-B. Il lavaggio iniziale del buffer di 1x PBS sulla superficie del sensore nudo induce solo cambiamenti di frequenza trascurabili, offrendo una linea di base costante che funga da riferimento per i punti dati futuri. L'introduzione della soluzione di collagene provoca l'adsorbimento delle proteine, osservato come una costante diminuzione del...
Discussione
I risultati di adsorbimenti collagene coprono i regimi di Sauerbrey e viscoelastica. Tracciando gli spostamenti di frequenza normalizzati al numero armonico corrispondente, osserviamo che il limite di Sauerbrey è valido per circa le prime 2 h della misurazione. Con l'aderente crescente di massa al sensore, tuttavia, i cambi di frequenza normalizzati per la terza e la quinta armonica iniziano a deviare l'una dall'altra(t > 2 h), indicando una capacità di determinare le proprietà viscoelastiche della pellicola ...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalla NSF (DMR-1710491, OISE-1743748). J.R. ed E.S. riconoscono il supporto della NSF (DMR-1751308).
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma-Aldrich | A6283 | For collagen adsorption |
| Ammonium hydroxide solution | Sigma-Aldrich | 221228 | For collagen adsorption |
| Aqueous QCM probe | AWSensors | CLS 00050 A | For polyelectrolyte swelling |
| Collagen I Rat Protein, Tail | Thermo Fisher Scientific | A1048301 | For collagen adsorption |
| Distilled water | Sigma-Aldrich | EM3234 | For polyelectrolyte swelling; generally easy to acquire in research labs, but there is a catalog number in case it is not accessible |
| Ethanol | Sigma-Aldrich | 793175-1GA-PB | For polyelectrolyte swelling |
| Gibco Phosphate Buffered Saline | Thermo Fisher Scientific | 20012-027 | For collagen adsorption |
| Hellmanex III | Sigma-Aldrich | Z805939 | For collagen adsorption |
| Hydrogen peroxide solution | Sigma-Aldrich | 216763 | For collagen adsorption |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666A | For polyelectrolyte swelling |
| NP2K VNA | Makarov Instruments | For polyelectrolyte swelling | |
| Poly(diallyldimethylammonium chloride), MW 200,000 | Sigma-Aldrich | 409022 | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Poly(styrene-sulfonate) sodium salt 30% weight in water | Sigma-Aldrich | 561967-500G | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Potassium Bromide | Sigma-Aldrich | 793604-1KG | For polyelectrolyte swelling |
| QSense QCM Explorer System | Biolin Scientific | For collagen adsorption | |
| Sodium acetate, anhydrous | Sigma-Aldrich | S2889 | For collagen adsorption |
| Spin coater, Model WS-650MZ-23NPP | Laurell technologies | For polyelectrolyte swelling |
Riferimenti
- Marx, K. A. Quartz crystal microbalance: A useful tool for studying thin polymer films and complex biomolecular systems at the solution - Surface interface. Biomacromolecules. 4 (5), 1099-1120 (2003).
- Kleber, C., Hilfrich, U., Schreiner, M. In situ QCM and TM-AFM investigations of the early stages of degradation of silver and copper surfaces. Applied Surface Science. 253 (7), 3712-3721 (2007).
- Yeh, C. J., Hu, M., Shull, K. R. Oxygen Inhibition of Radical Polymerizations Investigated with the Rheometric Quartz Crystal Microbalance. Macromolecules. 51 (15), 5511-5518 (2018).
- Sturdy, L. F., Yee, A., Casadio, F., Shull, K. R. Quantitative characterization of alkyd cure kinetics with the quartz crystal microbalance. Polymer. 103, 387-396 (2016).
- Delgado, D. E., Sturdy, L. F., Burkhart, C. W., Shull, K. R. Validation of quartz crystal rheometry in the megahertz frequency regime. Journal of Polymer Science, Part B: Polymer Physics. , 1-9 (2019).
- Bilchak, C. R., Huang, Y., Benicewicz, B. C., Durning, C. J., Kumar, S. K. High-Frequency Mechanical Behavior of Pure Polymer-Grafted Nanoparticle Constructs. ACS Macro Letters. 8 (3), 294-298 (2019).
- Hook, F., Rodahl, M., Brzezinski, P., Kasemo, B. Energy dissipation kinetics for protein and antibody-antigen adsorption under shear oscillation on a quartz crystal microbalance. Langmuir. 14, 729-734 (1998).
- Liss, M., Petersen, B., Wolf, H., Prohaska, E. An aptamer-based quartz crystal protein biosensor. Analytical Chemistry. 74 (17), 4488-4495 (2002).
- Felgueiras, H. P., Murthy, N. S., Sommerfeld, S. D., Brás, M. M., Migonney, V., Kohn, J. Competitive Adsorption of Plasma Proteins Using a Quartz Crystal Microbalance. ACS Applied Materials and Interfaces. 8 (21), 13207-13217 (2016).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical Journal. 75, 1397-1402 (1998).
- Olsson, A. L. J., Quevedo, I. R., He, D., Basnet, M., Tufenkji, N. Using the quartz crystal microbalance with dissipation monitoring to evaluate the size of nanoparticles deposited on surfaces. ACS Nano. 7 (9), 7833-7843 (2013).
- Xu, X., Zhang, C., Zhou, Y., Cheng, Q. L. J., Yao, K., Chen, Q. Quartz crystal microbalance study of protein adsorption on chitosan, chitosan/poly(vinyl pyrrolidone) blends and chitosan-graft-poly(vinyl pyrrolidone) surfaces. Journal of Bioactive and Compatible Polymers. 22, 195-206 (2007).
- Weber, N., Pesnell, A., Bolikal, D., Zeltinger, J., Kohn, J. Viscoelastic properties of fibrinogen adsorbed to the surface of biomaterials used in blood-contacting medical devices. Langmuir. 23, 3298-3304 (2007).
- Johannsmann, D. Viscoelastic, mechanical, and dielectric measurements on complex samples with the quartz crystal microbalance. Physical Chemistry Chemical Physics. 10 (31), 4516-4534 (2008).
- Denolf, G. C., Sturdy, L. F., Shull, K. R. High-frequency rheological characterization of homogeneous polymer films with the quartz crystal microbalance. Langmuir. 30 (32), 9731-9740 (2014).
- Martin, E. J., Mathew, M. T., Shull, K. R. Viscoelastic properties of electrochemically deposited protein/metal complexes. Langmuir. 31 (13), 4008-4017 (2015).
- Sturdy, L., Casadio, F., Kokkori, M., Muir, K., Shull, K. R. Quartz crystal rheometry: A quantitative technique for studying curing and aging in artists' paints. Polymer Degradation and Stability. 107, 348-355 (2014).
- Sadman, K., Wiener, C. G., Weiss, R. A., White, C. C., Shull, K. R., Vogt, B. D. Quantitative Rheometry of Thin Soft Materials Using the Quartz Crystal Microbalance with Dissipation. Analytical Chemistry. 90 (6), 4079-4088 (2018).
- Wasilewski, T., Szulczyński, B., Kamysz, W., Gębicki, J., Namieśnik, J. Evaluation of three peptide immobilization techniques on a qcm surface related to acetaldehyde responses in the gas phase. Sensors (Switzerland). 18 (11), 1-15 (2018).
- Lvov, Y., Ariga, K., Kunitake, T., Ichinose, I. Assembly of Multicomponent Protein Films by Means of Electrostatic Layer-by-Layer Adsorption. Journal of the American Chemical Society. 117 (22), 6117-6123 (1995).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik. 155 (2), 206-222 (1959).
- Sadman, K., Wang, Q., Chen, Y., Keshavarz, B., Jiang, Z., Shull, K. R. Influence of Hydrophobicity on Polyelectrolyte Complexation. Macromolecules. 50 (23), 9417-9426 (2017).
- Sievers, P., Moß, C., Schröder, U., Johannsmann, D. Use of torsional resonators to monitor electroactive biofilms. Biosensors and Bioelectronics. 110, 225-232 (2018).
- Ringberg, J. Q-Sense Explorer Operator Manual. Biolin Scientific. , (2017).
- Ringberg, J. Q-Sense User Guide: Instrument care and sensor pre-cleaning. Biolin Scientific. , (2015).
- Kern, W. The Evolution of Silicon Wafer Cleaning Technology. Journal of The Electrochemical Society. 137 (6), 1887 (1990).
- Sadman, K. . sadmankazi/QCM-D-Analysis-GUI: QCMD-Analyze. , (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon