Method Article
Programmi di propagazione captive farfalla a rischio per migliorare la conoscenza della storia della vita e le tecniche efficaci di conservazione ex Situ
In questo articolo
Riepilogo
Qui, presentiamo protocolli per 1) la propagazione in cattività di laboratorio della farfalla blu di Miami in pericolo federale (Cyclargus thomasi bethunebakeri),e 2) valutando le informazioni di base sulla storia della vita come il tempo di sviluppo immaturo e il numero di stadi larvali. Entrambi i metodi possono essere adattati per l'uso con altri programmi di conservazione ex situ.
Abstract
Migliorare la conoscenza delle migliori pratiche ex situ per le farfalle a rischio è importante per generare risultati di successo nel programma di conservazione e recupero. La ricerca su tali popolazioni in cattività può anche fornire dati preziosi per affrontare le lacune di informazioni chiave sul comportamento, la storia della vita e l'ecologia dei taxa bersaglio. Descriviamo un protocollo per la propagazione in cattività del Cyclargus thomasi bethunebakeri a rischio federale che può essere utilizzato come modello per altri programmi di ex situ farfalla a rischio, in particolare quelli della famiglia Lycaenidae. Forniamo inoltre un protocollo semplice e diretto per la registrazione di varie metriche di storia della vita che possono essere utili per informare le metodologie ex situ e adattate per studi di laboratorio di altri lepidoptera.
Introduzione
Un crescente elenco di studi indica cali globali diffusi e gravi nelle popolazioni di farfalle1,2,3,4,5. Questo include la stragrande maggioranza delle specie a rischio. I programmi di conservazione progettati per mitigare tali cali spesso impiegano un mix di strategie tra cui il monitoraggio della popolazione, la gestione e il ripristino dell'habitat, la ricerca scientifica, la propagazione in cattività e la traslocazione degli organismi6. Solo negli Stati Uniti e nei suoi territori, un totale di 30 taxa farfalle sono elencati sotto l'Endangered Species Act (ESA) come minacciati o in pericolo, con 21 di questi che hanno approvato progetti o piani di recupero finali. Per tali taxa, più della metà delle strategie di recupero identificate raccomanda la propagazione in cattività o afferma che la propagazione in cattività deve essere valutata7. L'uso degli sforzi di conservazione ex situ per le farfalle è cresciuto considerevolmente negli ultimi anni8,9, e ha il potenziale per essere uno strumento critico per aiutare gli sforzi di recupero10. Numerose istituzioni, organizzazioni e agenzie sono attualmente coinvolte negli sforzi ex situ per almeno 11 taxa sulle farfalle elencate nell'ESA (ad es. Cyclargus thomasi bethunebakeri, Euphydryas editha quino, Euphydryas editha taylori, Heraclides aristodemus, Hesperia dacotae, Lycaeides melissa samuelis, Oarisma poweshiek, Pyrgus ruralis lagunae, e Speryeria zerene hippolyta) e molti altri taxa a rischio (es., Callophrys irus, Euphydryas phaeton, Speyeria idali, e Speyeriaia, e Eumaeus atala)11. Nonostante il numero di sforzi solidi e di successo, rimane una mancanza di comunicazione regolare tra i programmi e tra i professionisti della conservazione che coinvolgono lo scambio di idee, dati, metodologie efficaci e risultati. Tale condivisione delle conoscenze è essenziale in quanto consente di ridurre al minimo la duplicazione degli sforzi, migliora le migliori pratiche complessive e migliora l'impatto sulla conservazione. Pochi protocolli pubblicati di allevamento, allevamento, allevamento o allevamento sono prontamente disponibili per i taxa delle farfalle a rischio, e quelli che sono spesso privi di sufficienti dettagli narrativi e/o illustrazioni. Questi spesso forniscono per lo più dettagli di riepilogo con istruzioni passo-passo limitate e immagini di accompagnamento, rendendo la replica impegnativa o l'applicazione ad altri taxa difficile da valutare12,13,14,15. Molti dei protocolli disponibili sono limitati in qualche modo: esistono solo nella letteratura grigia, o in diversi livelli di dettaglio, età della pubblicazione, o come componenti in procedure simposio, rapporti di agenzia / finge, o manuali interni16,17,18,19,20,21,22, 23,24.
Per la maggior parte dei programmi di conservazione, la propagazione in cattività viene condotta principalmente per sostenere la traslocazione della conservazione, che comprende la reintroduzione, il rinforzo (cioè l'aumento) e l'introduzione25,26. Tali attività sono destinate ad essere attuate strategicamente come componente della strategia di recupero globale al fine di aiutare a prevenire l'estinzione di una specie, sottospecie o popolazioni elencate. Va notato, tuttavia, che questo è uno dei molti altri ruoli potenziali che tali programmi ex situ possono servire. Questi possono anche includere il mantenimento di un'assicurazione (cioè, refugia) popolazione, il salvataggio temporaneo degli organismi, il sostegno alla ricerca e/o formazione relative al recupero e la promozione di attività di educazione e sensibilizzazione relative alla conservazione27,28. Indipendentemente dal fatto che i programmi ex situ abbiano un unico obiettivo definito o un mix di diversi, i professionisti della conservazione dovrebbero massimizzare le opportunità di raccolta dei dati al fine di colmare le lacune di informazioni chiave quando possibile. Ciò è particolarmente importante perché la stragrande maggioranza dei taxa a rischio sono stati generalmente studiati male prima di un sostanziale declino della popolazione selvatica. Le conoscenze acquisite su vari aspetti comportamentali, ecologici o di storia della vita del taxon focale possono servire a contribuire a far progredire l'efficace conservazione e gestione delle specie29.
Qui, descriviamo in dettaglio il protocollo di propagazione in cattività che è stato sviluppato per la farfalla blu di Miami a rischio federale (Cyclargus thomasi bethunebakeri) (Figura supplementare 1) come parte di un più ampio programma di conservazione e recupero. In questo caso, il programma di propagazione in cattività serve tre ruoli specifici identificati: 1) una popolazione assicurativa in caso di perdita della popolazione selvatica esistente, 2) una popolazione di ricerca progettata per colmare le lacune di conoscenza ecologiche e della storia della vita identificate che possono aiutare a informare il recupero e/o la gestione, e 3) a produrre organismi vitali per la traslocazione di conservazione in siti all'interno della gamma storica del taxon. Il protocollo risultante è stato ben controllato e collaudato, essendo stato utilizzato e migliorato per oltre un decennio. Di conseguenza, riteniamo che le tecniche e le metodologie descritte rappresentino un modello praticabile che può essere applicato o facilmente adattato per altri programmi di farfalle ex situ a rischio, in particolare quelli che coinvolgono Lycaenidae o taxa correlati. Anche se non suggeriamo che il protocollo descritto sia superiore agli altri, riteniamo che ci siano opportunità per applicare alcuni dei metodi in modo più ampio per contribuire a migliorare la produttività, la cura o l'efficienza. Ciò è particolarmente vero in quanto gran parte del nostro allevamento è fatto in condizioni di laboratorio interno con spazio limitato, simile ai programmi di conservazione che coinvolgono Euphydryas editha taylori e Speryeria zerene hippolyta17,23. Numerosi altri protocolli spesso utilizzano materiale in vaso per l'oviposizione o l'allevamento larvale, che a volte può portare a maggiori complessità legate al controllo dei predatori, al controllo ambientale (ad esempio, umidità, temperatura), monitoraggio del bestiame, raccolta dei dati, problemi di parassiti delle piante e spazio per citarne alcuni21,22. Infine, il protocollo presentato delinea i metodi per l'allevamento in cattività. Molti altri programmi di conservazione delle farfalle a rischio comportano l'allevamento di farfalle a testa o in cattività con i protocolli rappresentativi che riflettono tali differenze. Mentre spesso minore, riteniamo che questo aiuta ad ampliare il pool esistente di informazioni disponibili per altri programmi da rivedere. Questo è fondamentale, perché la maggior parte dei programmi ex situ rappresentano sforzi pionieristici per contribuire a facilitare il recupero di taxa rari e spesso poco studiati. I protocolli disponibili possono fungere da ottimo punto di partenza per fornire informazioni preziose, ridurre la duplicazione degli sforzi e promuovere l'innovazione. A causa "dell'ampia diversità interspecifica dei comportamenti delle farfalle, dei tratti della storia della vita e dei requisiti ecologici combinati con differenze spesso marcate nelle strutture del programma, nei budget, nelle competenze dei professionisti" e in altre differenze intrinseche, l'affidamento a una singola metodologia, anche per la taxa strettamente correlata, è spesso limitante e ingiustificata30. La flessibilità di perfezionare o sviluppare nuovi protocolli su misura per le esigenze di specifici taxa o programmi è essenziale per il successo e dovrebbe pertanto essere sottolineata. Descriviamo inoltre tecniche di laboratorio per la raccolta di metriche sullo sviluppo dell'organismo in condizioni di cattività, tra cui il numero di instars larva, la durata delle fasi di sviluppo individuali, il tempo di sviluppo totale e la lunghezza larvale e puupa. Queste tecniche hanno un'ampia applicabilità per gli studi di storia della vita di Lepidoptera che possono essere utilizzati per perfezionare i protocolli ex situ o informare i dati sul campo.
Protocollo
1. Garantire il corteggiamento e l'accoppiamento degli adulti di successo
- Dopo l'eclosione di successo, rilascia le farfalle adulte vitali in una gabbia di volo sicura, walk-in schermata situata in una serra a temperatura controllata (Supplementary Figure 2).
NOTA: Gli adulti possono essere contrassegnati sulla superficie ventrale delle ali con marcatori di inchiostro permanenti se si desidera l'identificazione di individui specifici per la separazione delle linee genetiche, l'origine dello stock o per la raccolta di dati specifici relativi alla longevità, al comportamento dell'organismo, and so on.- Mentre le dimensioni esatte della gabbia possono variare, assicurarsi che ci sia ampio spazio per ospitare un adeguato materiale vegetale di nettare necessario per sostenere la densità di farfalle adulte ospitate e fornire spazio per un essere umano liberamente in piedi e ruotare intorno.
- Al di là della regolazione della temperatura, assicurarsi che la serra sia sicura in modo che possa fornire un secondo strato di contenimento insieme alla protezione dalle intemperie (ad esempio, forti piogge, vento).
- Elevare il materiale vegetale del nettare in vaso in modo che non ci sia più di 30 cm di spazio dalla parte superiore interna della gabbia ai fiori più alti in fiore (Figura supplementare 2). Ciò fornisce un accesso ottimale alle risorse di nettare disponibili, offre ampi posatoi per adulti e riduce al minimo l'attività di volo estranea.
- Collocare una pianta ospite in vaso nella gabbia di volo. Questo assicura che anche se una coppia accoppiata viene persa tutte le uova risultanti deposte possono essere raccolte.
- Fornire un flusso d'aria coerente. Questo migliora l'attività di corteggiamento e il successo dell'accoppiamento. In un ambiente serra, soffiatori e ventilatori a tiratura fissa sono meglio utilizzati per contribuire a migliorare la ventilazione e il movimento dell'aria. È possibile utilizzare anche una ventilazione portatile più piccola, come ventilatori a scatola o da scrivania.
- Mantenere la temperatura interna della serra tra i 27 e i 32 gradi centigradi per promuovere l'attività ottimale degli adulti e il successo dell'accoppiamento. La temperatura all'interno della gabbia viene monitorata utilizzando un termometro di monitoraggio della memoria tracciabile.
- Semplare regolarmente la gabbia di volo schermata (circa una volta ogni 2 h) con acqua utilizzando una pompa a mano, uno spruzzatore di plastica o un tubo da giardino.
- Raccogliere delicatamente singole coppie di accoppiamento dalla gabbia di volo schermata utilizzando una fiala trasparente con tappo di plastica da 50 dram (Tavolo dei materiali), posizionando da una a due coppie per fiala e trasportando una sala di allevamento o laboratorio al coperto ( Figurasupplementare 3).
2. Massimizzare la produzione di uova
- Assemblare camera di oviposizione.
- Prendi una tazza di carta bianca da 12 once e usa un coltello da candida a lama a scatto, fai due tagli orizzontali su ogni lato della tazza di fronte l'uno all'altro. Ogni taglio deve essere di circa 1 cm sotto il bordo.
- Tagliare un singolo tampone di cotone a metà e inserire l'estremità dell'asta di ciascuno nei due tagli orizzontali su ciascun lato della tazza di carta in modo che la porzione di tampone di cotone si estenda di circa 2 cm verso l'interno della tazza.
- Utilizzando un coltello da canottetta snap blade, fare due tagli "X" nella parte inferiore della tazza di carta. Ogni taglio diagonale deve essere lungo circa 1 cm.
- Prendere una tazza di plastica 9 once e riempire il fondo con circa 2 cm di acqua del rubinetto.
- Mettere un taglio fresco, lungo circa 15 cm, della crescita vegetale dell'ospite larvale terminale nella tazza di carta inserendo lo stelo attraverso uno dei tagli "X" nel fondo. Spingere il gambo attraverso il taglio in modo che circa 4-5 cm sporge dal fondo.
- Mettere la tazza di carta con materiale ospite nella tazza di plastica, assicurando che il gambo della pianta sia in acqua.
- Riempire una siringa sub-Q da 1 ml (0,45 mm x 16 mm) con una bevanda sportiva aromatizzata e saturare entrambi i tamponi di cotone nella tazza di carta. Questi agiscono come fiori artificiali.
NOTA: La migliore alternativa per il nettare è la migliore. - Una volta separata ogni coppia di accoppiamento, inserire 2-3 femmine gravid nella configurazione della coppa assemblata (cioè la camera di oviposizione).
- Coprire la tazza con un frammento quadrato tagliato di tulle nero (circa 15 cm x 15 cm) e fissarla con un elastico intorno al coperchio (Supplementary Figure 4). Il tulle nero fornisce la migliore visibilità nella tazza e una facile identificazione di eventuali uova che potrebbero occasionalmente essere deposte sul tulle.
- Stimolare l'attività e l'oviposizione delle farfalle adulte.
- Posizionare ogni camera di oviposizione su una panca di laboratorio o un tavolo di circa 19 cm sotto una luce morsetto di 21,5 pollici (21,59 cm) con un riflettore in alluminio che ospita una lampadina a incandescenza 40 W (Figura supplementare 5).
NOTA: La luce incandescente fornisce il calore radiante necessario per stimolare l'attività e l'oviposizione degli adulti. - Posizionare un termometro di monitoraggio della memoria tracciabile adiacente alle luci ed eseguire il sensore di temperatura in modo che poggia su una camera di oviposizione situata direttamente sotto una luce di morsetto.
N.B.: L'intervallo di temperatura di destinazione è compreso tra 27,5 e 29 gradi centigradi. - Aggiungere le luci di morsetto supplementari in base alle esigenze a seconda del numero totale di camere oviposizionali distribuite.
- Collegare le luci di morsetto in un timer meccanico plug-in interno da 15 Amp 24 h con due prese (programmabili a intervalli di 30 min a intervalli di tempo).
- Impostare il timer per accendere la luce del morsetto per intervalli di 30 min (ad esempio, un ciclo ripetibile di 30 min, 30 min off).
NOTA: Questo ciclo di luce aiuta a massimizzare la produzione di uova fornendo periodi ripetibili di illuminazione per stimolare l'attività e l'oviposizione delle farfalle adulte seguite da brevi periodi di riposo scuro. - Rinfrescare i tamponi di cotone in ogni tazza con una bevanda sportiva aromatizzata tramite la siringa sub-Q e la nebbia regolarmente con acqua utilizzando una bottiglia spray di plastica circa ogni 2-3 h o secondo necessità.
NOTA: Questo fornisce un adeguato nettare artificiale e umidità per consentire alle farfalle di nutrirsi liberamente come desiderato. In questo modo migliora sia la longevità adulta che la produttività dell'oviposizione in condizioni di laboratorio in cui il materiale vegetale vivente e in fiore non può essere facilmente utilizzato. - Monitorare regolarmente le tazze e sostituire l'impianto host con risciocchi freschi, se necessario.
- Quando le uova iniziano a schiudersi o la densità delle uova diventa alta, spostare le femmine in una nuova tazza con ospite fresco e iniziare il protocollo delle larve con i neonati.
- Posizionare ogni camera di oviposizione su una panca di laboratorio o un tavolo di circa 19 cm sotto una luce morsetto di 21,5 pollici (21,59 cm) con un riflettore in alluminio che ospita una lampadina a incandescenza 40 W (Figura supplementare 5).
3. Cura e manutenzione larvale
- Ripetere i passaggi da 2.3-2.6 per assemblare tazze per larve.
- Quando le uova iniziano a schiudersi, spostare il materiale vegetale ospite con uova e larve neonate in una tazza appena assemblata, posizionando lo stelo attraverso la seconda "X" sul fondo assicurando che lo stelo della pianta sia in acqua e lascia toccare il taglio dell'ospite fresco adiacente.
- Quando le larve sono giovani (neonata-2 instar), controllare le tazze larve ogni giorno per la freschezza del materiale vegetale ospite e la presenza di muffa o frass eccessivo.
NOTA: la rimozione giornaliera del materiale ospite non è raccomandata quando le larve sono giovani perché ciò può causare lesioni all'organismo a causa della manipolazione e/o di inutili sprechi di materiale fresco dell'ospite. - Se il materiale dell'ospite è appassito o in cattive condizioni, inserire un altro taglio di materiale fresco dell'ospite nella tazza in modo che tocchi il fogliame esistente e permetta alle larve di spostarsi nel nuovo ospite da sole.
- Una volta che le larve raggiungono il 3rd instar, sostituire la tazza di carta e aggiungere materiale fresco ospite ogni giorno.
- Utilizzare un piccolo pennello ad acquarello cammello per spostare delicatamente le larve dal vecchio materiale ospite o dalla superficie della tazza al materiale fresco dell'ospite nella nuova tazza.
- Collocare il vecchio materiale ospite in un contenitore di stoccaggio di plastica rettangolare vuoto.
- Ripetere i passaggi 3.5-3.7 al giorno e fino a quando tutte le tazze con larve sono state elaborate.
- Al termine, aggiungere una piccola quantità di materiale fresco dell'ospite sopra i rifiuti dell'impianto nel contenitore di stoccaggio del cibo e posizionare liberamente un coperchio sulla parte superiore.
NOTA: Questo serve come una salvaguardia nel caso in cui eventuali larve vengono trascurate durante la lavorazione quotidiana perché strisciano sul nuovo materiale ospite sopra i rifiuti dell'impianto e possono essere rimossi il giorno successivo. - Mantenere le tazze sotto temperatura di laboratorio tra i 25 e i 28 gradi centigradi per un'attività larvale ottimale e lo sviluppo (Figura supplementare 6).
NOTA: Per raggiungere temperature ottimali di allevamento in condizioni interne, è spesso necessario posizionare le tazze sotto i morsetti con riflettori in alluminio che ospitano 40 W lampadine a incandescenza. Le temperature possono quindi essere monitorate attivamente utilizzando un termometro di monitoraggio della memoria tracciabile e l'altezza della luce regolata per raggiungere condizioni di allevamento ottimali.
4. Costruire la camera di pupation
- Tagliare una singola faccia rotolo di carta ondulata in quadrati di dimensioni uguali 3,8 cm x 3,8 cm.
- Mettere un quadrato in una tazza di porzione di plastica trasparente 2 once.
- Posizionare la tazza su un vassoio di sacchetti di plastica trasparente (Figura supplementare 7).
5. Preparazione delle larve per l'upupation
- Identificare le larve mature pronte a pupate durante l'elaborazione quotidiana della colonia.
NOTA: Tali larve trasformeranno un'uniforme opaca verdastro-marrone, perderanno i loro galloni e spesso vagano fuori dall'ospite. - Rimuovere delicatamente ogni larva matura con un piccolo pennello ad acquerello cammello capelli o pinze e posizionarne una in ogni camera di cucciolazione.
- Spezzare saldamente il coperchio di plastica trasparente sulla camera di pupation.
- Ripetere i passaggi da 5,1 a 5,3 fino a quando tutte le larve pronte a pupate non sono state trasferite nelle camere di pupazione aggiungendo nuovi vassoi di plastica in base alle esigenze (Figura supplementare 8).
6. Mantenimento delle pupe
- Per ogni vassoio di camere di pupation, registrare la data della prima pupation e qualsiasi altra informazione pertinente necessaria (ad esempio, linea genetica, sperimentazione sperimentale, ecc.).
- Organizzare i vassoi per data e luogo in un luogo sicuro all'interno del laboratorio (Supplementary Figure 8).
- Monitorare i vassoi ogni giorno per l'eclosione degli adulti.
NOTA: condizioni di laboratorio come la temperatura influenzeranno fortemente i tempi di sviluppo. - Prima dell'eclosione per adulti (tipicamente entro 10 giorni dalla prima pupation), rimuovere i coperchi dalle singole camere di cucciolazione e posizionare il vassoio in una gabbia di allevamento a maglia pieghevole di 34,29 cm x 34,29 cm x 60,96 cm (Supplementary Figure 9).
NOTA: Pupae fissato saldamente all'interno delle scanalature dei quadrati di carta ondulata facilitano l'eclosione adulta di successo (Figura supplementare 10). - Ripetere l'intero protocollo del passaggio 1.1 per la successiva generazione in cattività.
7. Valutazione dei tempi di sviluppo delle fasi immature e del numero di stadi
- Mettere una singola larva sotto un microscopio sezionato. Utilizzare un piccolo pennello ad acquerello capelli cammello per spostare e isolare con attenzione le larve per evitare lesioni all'organismo.
- Immergere un singolo capello del pennello in vernice luminosa non tossica (Tabella dei materiali),e mettere con attenzione una piccola goccia di vernice sul retro (dorsum) della larva. Utilizzare un colore di vernice che si distingue dal colore di sfondo e il colore del modello della larva (Figura supplementare 11). Assicurarsi di evitare di posizionare la vernice sulla testa della larva.
- Una volta che la vernice si asciuga (circa 30 s o giù di lì), posizionare ogni singola larva nella propria tazza di porzione di plastica chiara 2 once contenente circa 1–3 piccole foglie di materiale fresco terminale ospite e scrivere un identificatore univoco sulla tazza e coperchio (Figura supplementare 12).
- Controllare attentamente ogni larva ogni giorno. Rimuovere le foglie e impostare sulla superficie bianca. Ispezionare la tazza, pulire il coperchio ed esaminare le foglie al microscopio dissetante per la presenza di exuviae larvale (pelle di colata) e/o capsule di testa.
- Se viene trovata una exuvia larvale, rimuoverla dalla tazza e metterla in un tubo di microcentrifuga etichettato con il numero di tazza corrispondente e la data (vedere i passaggi 8.1-8.6. di seguito).
- Ridipingi le larve dopo ogni muta e registra le date della muta.
- Misurare la lunghezza totale del corpo (testa all'ultimo segmento addominale) di ogni larva ogni metro al giorno utilizzando pinze digitali. Prendere tre misurazioni e registrare la media dei tre, insieme alla data e all'ora. Per le larve a deradine, è necessario utilizzare una lente di ingrandimento o un mirino di dissezione durante la misurazione per garantire misurazioni accurate.
- Riportare la larva alla tazza porzione di plastica corrispondente.
- Aggiungere il materiale fresco dell'ospite in base alle esigenze e rimuovere tutti i detriti di frag e old host. Se la muffa si trova nella tazza, smaltire e utilizzare una nuova tazza. Scrivere il numero identificativo univoco corretto nella nuova tazza.
- Ripetere i passaggi 7.5-7.9 fino a raggiungere la loro instar finale e iniziare la fase prepupale. Quando le larve cessano l'alimentazione, trasforma un colore uniforme verde-marrone, perdi i galloni e spesso vagano fuori dall'ospite, riduci al minimo l'inquietante.
- Mettere un piccolo pezzo di carta ondulata nella tazza (vedere il passaggio 4.1).
- Una volta che ogni larva ha completamente pupato, misurare la sua lunghezza totale come nel passo 7.8 sopra e registrare la data di pupation. Questa sarà la muta finale di ogni individuo.
- Controllare pupae tutti i giorni e registrare la data di eclosione e il sesso di ogni farfalla adulta risultante.
- Misurare la lunghezza degli accordi ali di ogni farfalla utilizzando pinze digitali. Le farfalle possono essere tenute delicatamente con pinze per la misurazione. Se la farfalla è troppo attiva per misurare facilmente, posizionarla temporaneamente in frigorifero per 30 s o meno e riprovare.
8. Raccolta di exuviae larvale
- Quando si osserva un'esuvia larvale, riempire un tubo di microcentrifuga con 0,2 anni di glicerina. Etichettare la parte superiore del coperchio e il lato con il numero della larva, la data della muta e la capsula della testa (H.C.).
NOTA: Le larve di alcune larve lepidopteran consumano regolarmente la loro exuviae, ma la capsula della testa dovrebbe rimanere. - Mettere l'exuvia larvale e la capsula della testa associata in un coperchio tazza porzione di plastica trasparente e mettere un paio di gocce di etanolo in esso.
- Esaminare l'esuvia larvale al microscopio sezionato mettendolo in un coperchio tazza porzione di plastica trasparente e mettendo qualche goccia di etanolo su di esso. Se la capsula della testa larvale è già separata dall'exuvia, mettere una goccia di glicerina sulla punta di pinze entomologiche appuntite e toccare delicatamente la capsula della testa alla glicerina. Posizionare la capsula della testa nel tubo di microcentrismo associato.
- Se la capsula della testa è ancora attaccata all'esuvia larvale, utilizzare pinze appuntite e un perno di insetto per separare la capsula della testa dall'exuvia larvale.
- Una volta separato, utilizzare la tecnica della glicerina per raccogliere la capsula della testa. Se c'è troppo etanolo, è possibile utilizzare un piccolo tovagliolo di carta per rimuovere alcuni, ma attenzione a non rimuovere accidentalmente la capsula della testa.
- Posizionare la capsula della testa in una fiala piena di glicerina etichettata e chiudere saldamente il coperchio.
Risultati
Nel corso di due iniziative di conservazione separate mirate al recupero di Cyclargus thomasi bethunebakeri dal febbraio 2003 al dicembre 2010 e da novembre 2016 ad oggi, questo protocollo è stato utilizzato per produrre con successo un eccesso di 51.052 organismi vitali. Sulla base dell'istantanea riassuntiva di un anno della produttività complessiva della popolazione in cattività da giugno 2018 a giugno 2019, sono stati prodotti un totale di 10.166 organismi vitali, che rappresentano 782,00, pari a 782,00,93 organismi al mese su 13 generazioni. Allo stesso modo, la produzione totale di uova mediche per donna in condizioni di laboratorio è stata di 114,00 x 26,12 (n - 12)31. La conseguente sostanziale produttività dell'organismo classifica questo programma tra i più grandi sforzi ex situ negli Stati Uniti, insieme a quelli di Euphydryas editha taylori, Speyeria zerene hippolyta e Lycaeides melissa samuelis24. Parte di questa produttività può essere attribuita al fatto che la farfalla viene continuamente covata, producendo una generazione approssimativamente ogni 4-6 settimane in cattività. La maggior parte degli altri programmi di allevamento di conservazione coinvolgono taxa che sono univoltine o bivoltine. Tuttavia, anche per programmi che coinvolgono taxa estremamente fecondi come Speyeria spp., il numero totale di organismi vitali prodotti per la traslocazione di conservazione su base annuale raramente supera poche migliaia32. Di conseguenza, la nostra popolazione in cattività ha permesso di indirizzare la ricerca e la raccolta di dati su numerose lacune di dati importanti per migliorare le migliori pratiche di allevamento e allevamento di laboratorio(Figura 1) nonché contribuire a informare le decisioni di recupero e gestione.
Il tempo medio di sviluppo totale dalla larva neonato all'adulto è stato di 28,63 giorni(tabella 1). La maggior parte delle larve aveva quattro muffe (Figura 2, Figura 3), anche se due avevano cinque muta, e una aveva sei muta. La lunghezza media complessiva di tutte le stelle larve era di 5,97 mm, e le larve erano più grandi nelle fasi della vita quarta e prepupal (Tabella 1). Quando si includono solo variabili con più di 30 osservazioni, il tempo più breve è stato trascorso nelle prime fasi instar e prepupal imbecille e il più lungo è stato speso come pupae (Tabella 1, Figura 2). Le femmine si sviluppavano in genere più rapidamente in tutte le fasi immature rispetto ai maschi, anche se questo non era un effetto significativo (p - 0,625). Le analisi statistiche sono state condotte utilizzando RStudio Versione 1.1.463 (R Core Team 2016)33. La lunghezza media degli accordi dell'ala adulta era di 12,64 mm (tabella 2), e c'era una differenza significativa tra i sessi (p - 0,047). Il test t a due lati è stato eseguito per valutare la differenza di accordi delle ali tra i sessi. Il modello di regressione lineare e la regressione graduale per la durata media di ogni fase della vita hanno mostrato che la lunghezza pupa letale era il miglior predittore per la lunghezza degli accordi dell'ala adulta (Tabella 3, Tabella 4). I modelli di regressione per il tempo di sviluppo hanno mostrato che il numero di giorni trascorsi nel secondo e nel quarto instars e il numero totale di giorni erano i migliori predittori per la lunghezza degli accordi delle alari adulti, ma solo il numero di giorni in quarta stella era significativo (Tabella 5, Tabella 6). Poiché le variabili erano continue, sono stati eseguiti due modelli di regressione lineare per il tempo di sviluppo di ogni fase della vita, così come la lunghezza di ogni fase della vita, con la lunghezza dell'accordo dell'ala adulta come variabile dipendente. Le regressioni passo per passo sono state eseguite su entrambi i modelli di regressione per determinare i migliori predittori della lunghezza degli accordi delle ali adulte.

Figura supplementare 1: Esemplari bloccati di Cyclargus thomasi bethunebackeriadulti . (A) Maschio adulto, dorsale (sinistra), ventrale (destra). (B) Femmina adulta, dorsale (sinistra), ventrale (destra). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare Figura 2: Gabbia di volo schermata ospitata in una serra a temperatura controllata. (A) Gli interni mostrano piante di nettare adulto in vaso e una singola pianta ospite larvale in vaso. (B) Scaffalatura metallica aiuta ad elevare le piante di nettare in vaso in modo che non ci sia più di 30 cm di spazio dalla parte superiore interna della gabbia ai fiori più alti in fiore. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare 3: Procedura per la raccolta di coppie adulte in copula. (A) Accoppiamento coppia di Cyclargus thomasi bethunebakeri adulti all'interno della gabbia di volo schermata (femmina, destra e maschio, sinistra). (B) Coppie di accoppiamento raccolte dalla gabbia di volo in fiale a tappo a scatto e portate in laboratorio. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare Figura 4: Procedura per l'assemblaggio della camera di oviposizione. (A) Sistema a due tazze con materiale terminale host e tamponi di cotone. (B) Una siringa sub-Q da 1 ml (0,45 mm x 16 mm) con bevanda sportiva aromatizzata che satura i bavaglini di cotone nella tazza di carta. (C) Tazze che ospitano femmine gravido fissate con tulle nero. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare 5: Configurazione del laboratorio per massimizzare la produzione di uova. (A) Camere di oviposizione poste su un banco di laboratorio sotto una lampada a morsetto con una lampadina a incandescenza da 40 W. (B) Un termometro di monitoraggio della memoria tracciabile è posto accanto alle luci con il sensore di temperatura appoggiato su una camera di oviposizione situata direttamente sotto una luce di morsetto. (C) Una siringa sub-Q da 1 ml e una piccola bevanda sportiva aromatizzata posta accanto alle camere di oviposizione per facilitare il rinfresco dei tamponi di cotone regolarmente per tutta la giornata. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare 6: Configurazione del laboratorio per la cura e la manutenzione della larva. (A) Sistema a due tazze ciascuno contenente materiale fresco per l'ospite terminale e larve. (B) La temperatura nelle tazze viene mantenuta tra i 25 e i 28 gradi centigradi per un'attività larvale ottimale e lo sviluppo mediante luci a morsetto con 40 W di lampadine a incandescenza. (C) Per monitorare la temperatura viene utilizzato un termometro di monitoraggio della memoria tracciabile con il sensore di temperatura posizionato direttamente in una tazza. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare 7: Camere di pupazione preparate. (A) Tazze singole in plastica alloggiate sui vassoi per bicchieri di plastica trasparente. (B) Un quadrato di carta ondulato è posto in ogni tazza di porzione di plastica. (C) Una singola larva matura sarà collocata in ogni tazza di porzione di plastica preparata da pupate. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare 8: Preparazione delle larve per la pupazione e la manutenzione pupa. (A) Larva matura pronta a pupate su carta ondulata. È un colore opaco verdastro-marrone e ha perso tutti i galloni. (B) Camere di pupazione pronte a ricevere larve mature adiacenti a tazze con larve di alimentazione. Tutte le camere di pupazione con coperchi ospitano larve che si stanno preparando a pupare. (C) Camere di pupazione con pupe. (D) Banche di camere di pupation con pupe organizzate per data e mantenute in condizioni di laboratorio. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare 9: Gabbia di emergenza di laboratorio. (A) Una gabbia pop-up a rete pieghevole che ospita le camere di pupazione occupate. (B) I coperchi di tutte le camere di pupation vengono rimossi per facilitare il successo dell'eclosione degli adulti. (C) Tutte le farfalle adulte che ne derivano saranno rilasciate nella gabbia di volo schermata per garantire una copulazione di successo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare Figura 10: Farfalla maschio adulto eclosing con successo dalla pupa su un quadrato di carta ondulata. (A) Eclosing dall'ezia della pupa. (B) Adulto completamente rimosso dall'involucro pupal. (C) Adulto posizionato per espandere le sue ali. (D) Adulto espandendo le sue ali. Fare clic qui per visualizzare una versione più grande di questa figura.

Supplementare Figura 11: Quinta larva instar contrassegnata con vernice luminosa non tossica. (A) Una piccola goccia di vernice luminosa rossa a contrasto viene posta sul dorsum utilizzando un pennello per contrassegnare con successo la larva. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare Figura 12: Allevaggio per lo studio della storia della vita. (A) Etichettati in modo univoco da 2 once di bicchieri in plastica trasparente. (B) Una singola larva viene sequestrata in ogni tazza. (C) Tutte le larve sono tracciate individualmente attraverso tutte le fasi dello sviluppo, dal neonato all'adulto farfalla. Fare clic qui per visualizzare una versione più grande di questa figura.
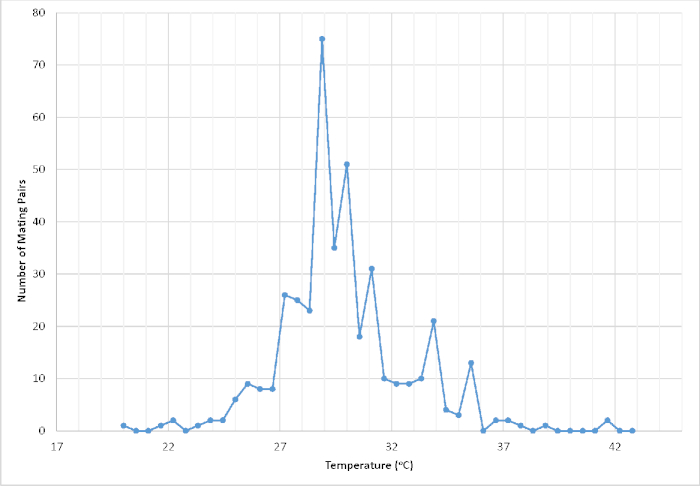
Figura 1: Numero di coppie registrate in copula in base alla temperatura (C) all'interno di una gabbia di volo schermata ospitata in una serra a temperatura controllata. La temperatura è stata registrata entro i primi 2 min di un evento di accoppiamento riuscito (n . 411). I dati risultanti sono stati utilizzati per aiutare a perfezionare le condizioni ambientali controllate al fine di massimizzare il successo dell'accoppiamento e, in ultima analisi, la produttività complessiva della propagazione in cattività. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Tempo medio di sviluppo (numero di giorni) di ogni fase di vita immatura. (A) Le barre mostrano la media di ogni gruppo, e le barre di errore rappresentano i valori di deviazione standard superiore e inferiore per ogni gruppo. (B) Le barre blu scuro rappresentano le femmine, e l'azzurro rappresenta i maschi. Fare clic qui per visualizzare una versione più grande di questa figura.
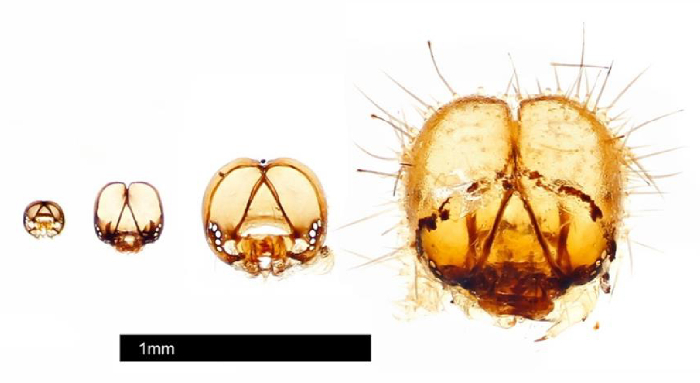
Figura 3: Capsule di testa raccolte da singoli #25 utilizzando il protocollo di storia della vita. Le capsule di testa sono state fotografate da Johnathan Bremer usando un sistema di automontaggio. Fare clic qui per visualizzare una versione più grande di questa figura.
| Fase della vita | Lunghezza media del corpo (mm) | Std. Errore (lunghezza) | Tempo medio di sviluppo (num. giorni) | Errore Std. (ora di sviluppo) |
| Instar I | 1.69478261 (n. 23) | 0.02152643 | 2.90625 (n. 32) | 0.08229783 |
| Instar II | 2.77248958 (n. 32) | 0.04302826 | 3.375 (n. 32) | 0.16649857 |
| Instar III | 5.45751042 (n. 32) | 0.12120829 | 3,5 (n. 32) | 0.20080483 |
| Instar IV | 10.2369688 (n. 32) | 0.23653991 | 3.875 (n. 32) | 0.18917265 |
| Instar V | 8.7625 (n. 2) | 2.6125 | 1,5 (n. 2) | 0.5 |
| Instar VI | 10.2666667 (n. 1) | Na | 3 (n. 1) | Na |
| Pre-pupa | 11.0858333 (n. 24) | 0.23948251 | 2.9375 (n. 32) | 0.21504641 |
| Pupa | 9.0316129 (n. 31) | 0.12106792 | 11.6578947 (n. 38) | 0.3272288 |
Tabella 1: Durata media e tempo di sviluppo di ogni fase della vita. Errore standard incluso per ogni variabile e dimensione del campione tra parentesi.
| Fase della vita | Lunghezza media dell'accordo alare (mm) | Errore Std. |
| Adulto | 12.63895 (n. 38) | 0.1365516 |
| Donna | 12.960 (n. 13) | 0.1465588 |
| Uomo | 12.472 (n. 25) | 0.1863205 |
Tabella 2: Lunghezza media degli accordi delle ali anteriori per farfalle adulte. Include mezzi per le femmine, maschi, e tutti gli adulti (entrambi i sessi combinati).
| Modello LM 1 | Std. Errore di stima | valore t | valore p |
| Intercettare | 1.9179 | 3.128 | 0.0046 ** |
| Lunghezza media secondo instar | 0.6822 | -1.11 | 0.278 |
| Lunghezza media terzo instar | 0.2928 | 0.476 | 0.6381 |
| Lunghezza media quarto instar | 0.1373 | -0.57 | 0.5739 |
| Pupe di lunghezza media | 0.246 | 3.957 | 0.0005 *** |
| p < 0.001; < 0,01; p < 0,05. | |||
Tabella Coefficients per il modello di regressione lineare (LM Model 1) per valutare la relazione tra la lunghezza media di ogni fase della vita (n > 30 inclusa nell'analisi) e la lunghezza degli accordi delle ali adulte. Variabile dipendente: lunghezza dell'accordo dell'ala adulta (mm).
| Coefficienti | Std. Errore di stima | valore t | Pr (> |
| Intercettare | 1.7091 | 3.031 | 0.0053 ** |
| Pupe di lunghezza media | 0.1878 | 4.414 | 0.0002 *** |
Tabella 4: regressione stepwise (Stepwise 1). Variabile dipendente: lunghezza dell'accordo dell'ala adulta (mm).
| Modello LM 2 | Std. Errore di stima | valore t | valore p |
| Intercettare | 1.1888 | 12.643 | 4.21e-12 |
| Num. giorni primi instar | 0.3486 | 0.937 | 0.3583 |
| Num. giorni secondi instar | 0.2603 | -0.686 | 0.4993 |
| Num. giorni terzi instar | 0.2281 | 1.028 | 0.3141 |
| Num. giorni quarta instar | 0.2048 | 2.378 | 0.0257 * |
| Num. giorni pre-pupae | 0.222 | 1.133 | 0.2686 |
| Num. giorni pupe | 0.2495 | 0.616 | 0.5435 |
| Numero totale giorni | 0.1913 | -1.454 | 0.1589 |
| p < 0.001; < 0,01; p < 0,05. | |||
Tabella 5: tabella Coefficients per il modello di regressione lineare (LM Model 2) per valutare la relazione tra il tempo di sviluppo e la lunghezza degli accordi dell'ala adulta. Variabile dipendente: lunghezza dell'accordo dell'ala adulta (mm).
| Coefficienti | Std. Errore di stima | valore t | valore p |
| Intercettare | 0.89304 | 16.314 | 7.86E-16 |
| Num. giorni secondi instar | 0.17974 | -1.809 | 0,0811 . |
| Num. giorni quarta instar | 0.16917 | 2.075 | 0.0473 * |
| Numero totale giorni | 0.04184 | -1.787 | 0,0848 . |
| p < 0.001; < 0,01; p < 0,05; < 0,1 usd | |||
Tabella 6: regressione stepwise (Stepwise 2) per il tempo di sviluppo. Variabile dipendente: lunghezza dell'accordo dell'ala adulta (mm).
Discussione
Qui, illustriamo l'efficacia di questo collaudato protocollo di allevamento della conservazione ex situ per la produzione di massa di farfalle a rischio, e come può essere adattato per la ricerca scientifica per aiutare ad affrontare le principali lacune comportamentali, di vita o di dati ecologici. Una maggiore comprensione del tempo medio di sviluppo totale (da uovo a adulto), la durata media in ogni fase della vita e la temperatura ottimale per l'accoppiamento, ad esempio, sono stati utilizzati per aiutare a perfezionare il protocollo e migliorare il successo complessivo del programma. La stragrande maggioranza dei protocolli esistenti descrive solo i metodi di allevamento degli organismi e non discute la raccolta dei dati, la ricerca scientifica o l'uso di tali risultati per aiutare a informare e potenzialmente adattare i metodi ex situ.
Questo protocollo richiede l'allevamento quotidiano dell'organismo. La salute e la produttività degli organismi sono massimizzate da condizioni di allevamento pulite, dalla mancanza di sovraffollamento dell'organismo e dalla disponibilità di materiale vegetale ospite larvale di alta qualità. Per la maggior parte, utilizziamo forniture e contenitori di allevamento usa e getta (ad esempio, bicchieri di carta e plastica), e in genere li sostituiamo regolarmente, spesso quotidianamente, e non riutilizziamo mai il materiale. Questo è sia conveniente e riduce al minimo la necessità di servizi igienico-sanitari più laboriosi dei materiali. Strumenti di uso comune, tuttavia, come pinze entomologiche, pennelli di vernice ad acquerello e piccole gabbie di volo pop-up, così come tutte le superfici di allevamento come tavoli da tavolo e panchine da laboratorio sono regolarmente sanificati utilizzando una soluzione di candeggina 5%. L'orario esatto dei servizi igienico-sanitari dipende fortemente dalla frequenza di utilizzo, dalla fenologia dell'organismo e da altre variabili e dovrebbe essere adattato alle esigenze specifiche di ogni programma ex situ. Inoltre, troviamo che la carta da macellaio bianca è utile per coprire tutte le superfici di allevamento. Fornisce un substrato pulito economico e facilmente dispiegabile e il colore di sfondo bianco facilita l'avvistamento di organismi randagi. Per l'allevamento quotidiano, tutto il personale di laboratorio deve sempre indossare guanti da esame di laboratorio usa e getta per ridurre al minimo la contaminazione e proteggere il personale da qualsiasi potenziale irritazione cutanea derivante dalla manipolazione di piante o organismi. Ciò è particolarmente importante se il personale di laboratorio ha animali domestici che richiedono trattamenti topici delle pulci. Anche una piccola quantità di residui di principio attivo può essere pericolosa per il bestiame in cattività.
Inoltre, occorre prestare attenzione a ridurre al minimo il sovraffollamento dell'organismo. Il sovraffollamento delle larve può portare rapidamente a una riduzione della salute dell'organismo e persino al cannibalismo in alcuni taxa, in particolare Lycaenidae. Può essere necessario separare regolarmente le larve per ridurre il numero all'interno dell'allevamento di contenitori e/o persino isolare le singole larve come descritto nella parte della storia della vita del protocollo. Il numero ideale per contenitore può variare notevolmente in base al taxon particolare e ai vari vincoli del programma ex situ, come il budget disponibile, le strutture di laboratorio e il numero totale di dipendenti. Allo stesso modo raccomandiamo di lasciare spazio adeguato tra le tazze che ospitano le larve per ridurre al minimo il potenziale di movimento dell'organismo tra i contenitori. Infine, per le popolazioni in cattività più grandi, si raccomanda vivamente di separare lo stock tra una o più strutture di laboratorio. Questa strategia di salvaguardia può contribuire a ridurre al minimo la perdita catastrofica dell'intera popolazione a causa di malattie o altri impatti imprevisti.
La qualità e la disponibilità delle piante ospiti larve guidano la produzione zootecnica e influenzano fortemente sia i tassi di sviluppo larvale che la salute generale della popolazione. Tuttavia, pochi rapporti o studi pubblicati mettono in evidenza questo requisito di backstage o discutono delle migliori pratiche di vivaio. Il successo della pianificazione del programma ex situ deve tenere conto delle quantità, della produzione e della manutenzione dell'impianto. Poiché molte larve richiedono o preferiscono anche alcune parti vegetali (ad esempio, nuova crescita terminale, boccioli di fiori e infiorescenze, frutta, ecc.), è necessaria una messa in scena efficace per garantire un'adeguata fenologia vegetale.
Ulteriori considerazioni includono un'adeguata gestione demografica e genetica e la minimizzazione di eventuali effetti negativi della prigionia. Raccomandiamo lo sviluppo di un piano di gestione genetica. Questo può includere strategie per includere l'infusione di nuovo materiale genetico su base regolare, massimizzare la diversità e prevenire l'inbreeding ravvicinato, valutare periodicamente le variabili chiave di fitness dell'organismo e monitorare la genetica a un certo livello per consentire il confronto con le popolazioni esistenti e controllare la salute degli stock in cattività. Il confronto periodico delle caratteristiche degli individui in cattività agli individui delle popolazioni fondatorie è giustificato anche34,35.
Questi protocolli rappresentano procedure consigliate comprovate. Dovrebbero essere utili per una varietà di ricercatori e professionisti della conservazione che possono applicare o adattare direttamente i nostri metodi ai propri studi e programmi ex situ di conservazione e recupero di insetti a rischio. Lo specifico protocollo di allevamento in cattività delineato è probabilmente più applicabile ai programmi incentrati su altri Lycaenidae, taxa correlati, o taxa di dimensioni minori. Tuttavia, numerosi componenti come quelli che comportano il recupero del corteggiamento e della copulazione di successo, la manutenzione degli adulti con nettare artificiale, la massimizzazione dell'oviposizione e la cura larvale generale potrebbero probabilmente essere applicati o adattati in modo più ampio ad una serie più ampia di taxa. Come accennato in precedenza, mentre la flessibilità del protocollo dovrebbe essere sottolineata, l'accesso ad altre metodologie consolidate può contribuire a fornire informazioni preziose e un punto di partenza vitale per l'adattamento e l'innovazione. I metodi presentati per valutare varie caratteristiche della storia della vita, come il tempo di sviluppo larvale e il numero di stadi larvali, hanno probabilmente un'ampia applicabilità ad altri programmi di allevamento della conservazione e ai taxa a rischio. Incoraggiamo gli altri ad aiutare ad affrontare le principali lacune nei dati ecologici quando possibile e a pubblicare protocolli controllati e risultati del programma.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalle sovvenzioni della Conservation Recovery Initiative (F17AP00467) e del Disney Conservation Fund. Ulteriore supporto è stato fornito dal Florida Museum of Natural History e dal Dipartimento di Entomologia e Nematologia presso l'Università della Florida.
Materiali
| Name | Company | Catalog Number | Comments |
| 12 oz plain white paper cups (Karat) | Lollicup | C-KC16 | |
| 15-Amp 2-Outlet Mechanical Residential Plug-in Countdown Lighting Timer | Lowes | UTTNI2423 | |
| 1ml sub-Q syringes (0.45 mm x 16 mm) | Fisher Scientific | 14-829-10F | |
| 2 oz clear plastic portion cup lids | Party City | #791091 | |
| 2 oz Clear Plastic Portion Cups | Party City | #791088 | |
| 34.29 cm x 34.29 cm x 60.96 cm collapsible mesh popup rearing cage | Bioquip | 1466BV | |
| 8.5" 1-Watt Incandescent Clamped Work Light | Lowes | PTC301L | |
| Adoric Electronic Digital Caliper | Amazon.com | B07QX2SK2F | |
| Big Kid's Choice Arts & Crafts Brush Set-12/Pkg, assorted sizes | Walmart | #10965135 | |
| Clear Plastic Cup Tray | Frontier Scientific Services | AG_9040 | |
| Fisher Scientific traceable memory monitoring thermometer | Fisher Scientific | 15-077-8D | |
| Forceps, Straight Points, Swiss Style #4, Stainless | BioQuip | 4531 | |
| Humco Glycerin 6 oz | Walmart | #303951037966 | |
| Luminous Paint Kit, Blue, Red, Yellow, 4 Dram | Bioquip | 1166A | |
| Melon flavored Gatorade Fierce Thirst Quencher or fruit punch flavored Gatorade Thirst Quencher sports drink | Walmart | #568456137 | |
| Neoteck Digital 2 in 1 Hygrometer-Thermometer | Amazon.com | NTK026 | |
| Olympus 0.6 ml Microtubes, Clear, Polypropylene, Nonsterile | Amazon.com | 24-272C | |
| Plastic Tank Sprayer | Lowes | #5318 | |
| Q-tips Cotton swabs | Walmart | #551398298 | |
| Rectangular plastic tupperware container with lid (Rubbermaid) | Walmart | #554320171 | |
| Showgard 903 Stamp Tongs, 4 5/8 inch Spade Tip | Amazon.com | #787793151378 | |
| Single face corrugated paper roll | Amazon.com | BXSF12 | |
| Snap blade utility knife | OLFA | #5023 | |
| Solo 9 oz plastic cups | Solo | SQ950 | |
| Thorton Plastics 50 dram clear plastic snap cap vial (6.25 oz.) | Thorton Plastics | #50 | |
| Tulle Spool 9 inch x 150 feet - Black | Jo Ann Fabrics | #16029696 | |
| Zep 32 oz Plastic Spray Bottle | Lowes | HDPRO36 |
Riferimenti
- Thomas, J. A. Butterfly communities under threat. Science. 352 (6296), 216-218 (2016).
- Swengel, S. R., Schlicht, D., Olsen, F., Swengel, A. B. Declines of prairie butterflies in the Midwestern USA. Journal of Insect Conservation. 15 (1-2), 327-339 (2011).
- Habel, J. C., et al. Butterfly community shifts over two centuries. Conservation Biology. 30 (4), 754-762 (2016).
- Gilburn, A. S., et al. Are neonicotinoid insecticides driving declines of widespread butterflies? Peer J. 3, e1402(2015).
- Sánchez-Bayo, F., Wyckhuys, K. A. G. Worldwide decline of the entomofauna: A review of its drivers. Biological Conservation. 232, 8-27 (2019).
- Daniels, J. C., Magdich, M., Tolson, P. Butterfly recovery planning: Determining how to contribute. Butterfly Conservation in North America: Efforts to Help Save Our Charismatic Microfauna. Daniels, J. C. , Springer Science+Business Media B.V. New York. 1-21 (2015).
- U.S. Fish and Wildlife Service. Environmental Conservation Online System. Listed Animals. , https://ecos.fws.gov/ecp (2019).
- Schultz, C. B., Russell, C., Wynn, L. Restoration, reintroduction and captive propagation efforts for at-risk butterflies: a review. Israel Journal of Ecology and Evolution. 54, 41-61 (2008).
- Grow, S., Allard, R., Luke, D. The role of AZA-accredited zoos and aquariums in butterfly conservation. Butterfly Conservation in North America: Efforts to Help Save Our Charismatic Microfauna. Daniels, J. C. , Springer Science+Business Media B.V. New York. 23-34 (2015).
- Crone, E. E., Pickering, D., Schultz, C. B. Can captive rearing promote recovery of endangered butterflies? An assessment in the face of uncertainty. Biological Conservation. 139, 103-112 (2007).
- Sanchez, S. J., Daniels, J. C. The butterfly conservation initiative: Developing a new conservation vision through compound eyes. News of the Lepidopterists' Society. 49 (3), 75-77 (2007).
- Wardlaw, J. C., Elmes, G. W., Thomas, J. A. Techniques for studying Maculinea butterflies: I. Rearing Maculinea caterpillars with Myrmica ants in the laboratory. Journal of Insect Conservation. 2 (1), 79-84 (1998).
- Mattooni, R., Longcore, T., Krenova, Z., Lipman, A. Mass rearing the endangered Palos Verdes blue butterfly (Glaucopsyche lygdamus palosverdesensis:Lycaenidae). Journal of Research on the Lepidoptera. 37, 55-67 (1998).
- Pearce-Kelly, P., et al. The captive rearing of threatened Orthoptera: a comparison of the conservation potential and practical considerations of two species' breeding programmes at the Zoological Society of London. Journal of Insect Conservation. 2 (3-4), 201-210 (1998).
- Wells, C. N., Edwards, L., Hawkins, R., Smith, L., Tonkyn, D. A rearing method for Agrynnis (Speyeria) diana (Lepidoptera: Nymphalidae) that avoids diapause. Psyche. , 1-6 (2011).
- Grosboll, D. N. Captive Rearing the Endangered Mardon Skipper (Polites mardon) and Taylor's Checkerspot (Euphydryas editha taylori) Butterflies: Initial Results (Lepidoptera, Nymphalidae). Proceedings of the species at risk, pathways to recovery conference. , Species at Risk Pathways to Recovery Conference Organizing Committee. Victoria. 1-6 (2004).
- Barclay, E., Arnold, M., Andersen, M., Shepherdson, D. Husbandry manual: Taylor's checkerspot (Euphydryas editha taylori). , 1st edition, Oregon Zoo. Portland, Oregon. (2009).
- Johnson, J., et al. Captive Rearing of the Laguna Mountains Skipper (Pyrgus ruralis laguanae): Final Report. , (2010).
- Linders, M. Captive rearing and translocation of Taylor's checkerspot in South Puget Sound: 2011-2012. 2012 Annual Progress Report to the ACUB Technical Review Committee. , (2012).
- Linders, M., Lewis, K. Captive rearing and translocation of Taylor's checkerspot butterfly (Euphydryas editha taylori.): South Puget Sound, Washington, 2012–2013. 2013 Annual Report to the US Fish and Wildlife Service (Cooperative Agreement F12ACI00835), Joint Base Lewis-McChord Fish and Wildlife Program and JBLM-ACUB Technical Review Committee. , (2013).
- Department of Conservation and Research, Toledo Zoo. Propagation Handbook for the Karner Blue Butterfly Lycaeides melissa samuelis. , Fourth edition, (2006).
- Johnson, J. J., et al. Captive Rearing of Lange's Metalmark Butterfly, 2011-2015. United States Fish and Wildlife Service, CVPIA Habitat Restoration Program (F11AP00168). , (2016).
- Andersen, M. J., et al. Oregon Silverspot Butterfly Husbandry Manual. , Oregon Zoo. Portland, Oregon. (2010).
- Washington Department of Fish and Wildlife. Threatened and Endangered Wildlife in Washington: 2012 Annual Report. Listing and Recovery Section, Wildlife Program, Washington Department of Fish and Wildlife. , Olympia. (2013).
- McGowan, P. J. K., Traylor-Holzer, K., Leus, K. IUCN guidelines for determining how ex situ management should be used in species conservation. Conservation Letters. 10 (3), 361-366 (2017).
- Pearce-Kelly, P., et al. The conservation value of insect breeding programmes: Rationale, evaluation tools and example programme case studies. Insect Conservation Biology: Proceedings of the Royal Entomological Society's 23nd Symposium. Stuart, A. J. A., New, T. R., Lewis, O. T., et al. , 57-75 (2007).
- U.S. Fish and Wildlife Service. Policy Regarding Controlled Propagation of Species Listed Under the Endangered Species Act. United States Federal Register. 65 (183), 56916-56922 (2000).
- IUCN/SSC. Guidelines on the use of ex situ management for species conservation. Version 2.0. IUCN Species Survival Commission. , Gland, Switzerland. (2014).
- Sutherland, W. J., Pullin, A. S., Dolman, P. M., Knight, T. M. The need for evidence-based conservation. Trends in Ecology & Evolution. 19 (6), 305-308 (2004).
- Daniels, J. C., Nordmeyer, C., Runquist, E. Improving standards for at-risk butterfly translocations. Diversity. 10, 67(2018).
- Saarinen, E. V. Population genetics of the endangered Miami blue butterfly Cyclargus thomasi bethunebakeri.: implications for conservation. , University of Florida. Gainesville. (2009).
- Becker, T. Propagation and repatriation of the regal fritillary butterfly. , http://titag.org/2016/2016papers/beckerregal.pdf (2019).
- R Core Team. R A Language and Environment for Statistical Computing. R Foundation for Statistical Computing. , Vienna, Austria. (2016).
- Schultz, C. B., Dzurisin, J. D., Russell, C. Captive rearing of Puget blue butterflies (Icaricia icarioides blackmorei) and implications for conservation. Journal of Insect Conservation. 13 (3), 309-313 (2009).
- Frankham, R., Loebel, D. A. Modeling problems in conservation genetics using captive Drosophila populations: Rapid genetic adaptation to captivity. Zoo Biology. 11 (5), 333-342 (1992).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon