Method Article
Valutazione morfologica e funzionale degli assoni e delle loro sinapsi durante la morte di Axon in Drosophila melanogaster
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, forniamo protocolli per eseguire tre semplici saggi di degenerazione degli assoni indotta da lesioni (morte assonale) in Drosophila melanogaster per valutare la conservazione morfologica e funzionale degli assoni recisi e delle loro sinapsi.
Abstract
La degenerazione degli assoni è una caratteristica condivisa nella malattia neurodegenerativa e quando i sistemi nervosi sono sfidati da forze meccaniche o chimiche. Tuttavia, la nostra comprensione dei meccanismi molecolari alla base della degenerazione degli assoni rimane limitata. La degenerazione degli assoni indotta da lesioni funge da semplice modello per studiare come gli assoni recisi eseguono il proprio smontaggio (morte assonale). Negli ultimi anni, è stata identificata una cascata di segnalazione della morte degli assoni conservita evolutivamente dalle mosche ai mammiferi, che è necessaria per la degenerazione dell'assone separato dopo la lesione. Al contrario, la segnalazione attenuata della morte degli assoni si traduce nella conservazione morfologica e funzionale degli assoni recisi e delle loro sinapsi. Qui, presentiamo tre protocolli semplici e recentemente sviluppati che consentono l'osservazione della morfologia assonale, o funzione assonale e sinaptica degli assoni mozzati che sono stati tagliati fuori dal corpo cellulare neuronale, nel filo della frutta Drosophila. La morfologia può essere osservata nell'ala, dove una lesione parziale provoca la morte di assoni fianco a fianco degli assoni di controllo illesi all'interno dello stesso fascio di nervi. In alternativa, la morfologia assonale può essere osservata anche nel cervello, dove l'intero fascio di nervi subisce la morte degli assa innescata dall'ablazione delle antenne. La conservazione funzionale degli assoni recisi e delle loro sinapsi può essere valutata con un semplice approccio optogenetico accoppiato con un comportamento di toelettatura post-sinaptico. Presentiamo esempi utilizzando una mutazione highwire loss-of-function e sovraesprimendo dnmnat,entrambi in grado di ritardare la morte di assoni per settimane o mesi. È importante sottolineare che questi protocolli possono essere utilizzati oltre le lesioni; facilitano la caratterizzazione dei fattori di mantenimento neuronale, del trasporto assonale e dei mitocondri assonali.
Introduzione
L'integrità morfologica dei neuroni è essenziale per la funzione sostenuta del sistema nervoso per tutta la vita. La stragrande maggioranza del volume neuronale è presa da assoni1,2; quindi il mantenimento per tutta la vita di assoni particolarmente lunghi è una grande sfida biologica e bioenergetica per il sistema nervoso. Sono stati identificati più meccanismi di supporto assonale-intrinseco e gliale-estrinseco, garantendo la sopravvivenza assonale per tutta la vita. La loro compromissione provoca la degenerazione degli assoni3, che è una caratteristica comune del sistema nervoso che viene sfidato nella malattia, e dalle forze meccaniche o chimiche4,5. Tuttavia, i meccanismi molecolari alla base della degenerazione degli assoni rimangono poco compresi in qualsiasi contesto, rendendo difficile lo sviluppo di trattamenti efficaci per bloccare la perdita degli assoni. Lo sviluppo di terapie efficaci contro queste condizioni neurologiche è importante, in quanto creano un enorme onere nella nostra società6.
La degenerazione degli assoni indotta da lesioni funge da semplice modello per studiare come gli assoni recisi eseguono il proprio smontaggio. Scoperto e intitolato ad Augustus Waller nel 1850, la degenerazione murale (WD) è un termine generico che comprende due processi distinti e molecolarmente separabili7. In primo luogo, dopo lesioni assonali, gli assoni separati dai loro corpi cellulari eseguono attivamente la propria autodistruzione (morte assonale) attraverso una cascata di segnalazione della morte degli assoni evolutivamente conservata entro un giorno dopo la lesione8. In secondo luogo, glia circostante e fagociti specializzati coinvolgono e ripulire i detriti assonali risultanti entro tre o cinque giorni. L'attenuazione della segnalazione della morte degli assoni si traduce in assoni recisi che rimangono conservati per settimane9,10,11,12, mentre l'attenuazione dell'inghiottimento gliale culmina in detriti assonali che persiste per settimane in vivo13,14,15.
La ricerca su mosche, topi, ratti e pesci zebra ha rivelato diversi mediatori evolutivamente conservati ed essenziali della segnalazione della morte degli assoni8. I mutanti della morte di Assoni contengono assoni recisi e sinapsi che non subiscono la morte degli assoni; rimangono morfologicamente e funzionalmente conservati per settimane, in assenza del supporto del corpo cellulare9,10,12,13,16,17,18,19,20,21,22,23. La scoperta e la caratterizzazione di questi mediatori hanno portato alla definizione di un percorso molecolare che esegue la morte dell'assonale. È importante sottolineare che la segnalazione della morte degli assoni viene attivata non solo quando l'assone viene tagliato, schiacciato o allungato24,25; sembra anche contribuire a modelli animali distinti di condizioni neurologiche (ad esempio, dove gli assoni degenerano in modo indipendente dagli infortuni4, ma con una serie di esiti benefici4,8). Pertanto, capire come la morte degli assoni esegua la degenerazione degli assoni dopo l'infortunio potrebbe offrire intuizioni al di là di un semplice modello di infortunio; potrebbe anche fornire obiettivi per l'intervento terapeutico.
Il filo della frutta Drosophila melanogaster (Drosophila) ha dimostrato di essere un sistema inestimabile per la segnalazione della morte degli assoni. La ricerca nel fly ha rivelato quattro geni essenziali della morte assonale evolutivamente conservati: highwire (hiw)11,14, dnmnat12,26, dsarm10 e axundead (axed)12. La modifica di questi mediatori - mutazioni di perdita di funzione di hiw, dsarm e axed, e over-expression di dnmnat - blocca potentemente la morte di assone per la durata della vita della mosca. Mentre gli assoni semolati subiscono la morte di assoni entro 1 giorno, gli assoni recisi e le loro sinapsi prive di hiw, dsarm o axed rimangono non solo morfologicamente, ma anche funzionalmente conservati per settimane. Resta da determinare se la conservazione funzionale può essere raggiunta anche attraverso elevati livelli di dnmnat.
Qui, presenteremo tre protocolli semplici e recentemente sviluppati per studiare la morte degli assoni (ad esempio, la morfologia e la funzione degli assoni recisi e delle loro sinapsi nel tempo) in assenza di supporto del corpo cellulare. Dimostriamo come la morte degli assoni attenuata si traduca in assoni recisi che sono conservati morfologicamente con una mutazione di perdita di funzione di hiw (hiw- N) e come la morte attenuata degli assoni si traduca in assoni recisi e sinapsi che rimangono funzionalmente conservati per almeno 7 giorni con sovraespressione di dnmnat ( dnatnm dnmnatOE). Questi protocolli consentono l'osservazione di singole morfologia assonale e sinaptica sia nel sistema nervoso centrale o periferico (CNS e PNS, rispettivamente)13,14, mentre la conservazione funzionale degli assoni recisi e delle loro sinapsi nel SNC può essere visualizzata con l'uso di una semplice configurazione optogenetica combinata con la lettura comportamentale12.
Protocollo
1. Osservazione della morfologia axon durante la morte di Axon nel PNS
- Lesione alare: lesione parziale di fasci di assoni
- Utilizzare 5 femmine vergini e 5 maschi del genotipo destro (Figura 4A, generazione P0) per eseguire croci a temperatura ambiente (RT). Passare P0 in nuove fiale ogni 3-4 giorni. Raccogli ogni giorno la progenie per adulti appena eclusa (generazione F1) e invecchiali per 7-14 giorni.
- Anestesizza revola molestie su pastiglie di CO2. Utilizzare micro forbici per tagliare la vena anteriore dell'ala approssimativamente al centro dell'ala (Figura 1A). Usa un'ala per la lesione e l'altra ala come controllo non ferito abbinato all'età. Applicare una ferita per ala, e assicurarsi di ottenere sufficienti ali ferite (circa 15 ali).
NOTA: L'intera ala può essere tagliata attraverso, ma è sufficiente tagliare solo la vena dell'ala anteriore. Questa è la parte più forte dell'ala. - Recuperare le mosche in fiale contenenti cibo.
- Dissezione alare e visualizzazione degli assoni
- Stendere 10 -L di olio di alocarbonio 27 con una pipetta lungo un intero vetrino (Figura 1B).
- Tagliare il ferito, così come, l'ala di controllo illeso nei punti di tempo desiderati (ad esempio, 1 o 7 giorni dopo l'infortunio). Utilizzare micro forbici per tagliare, e pinzette per afferrare l'ala. Montare il massimo di 4 ali nell'olio di alocarbonio 27(Figura 1B)e coprirle con uno scivolo di copertura.
- Immaginare immediatamente l'ala utilizzando un microscopio a disco rotante. Acquisire una serie di sezioni ottiche lungo l'asse z con 0,33 m di dimensioni e comprimere z-stack in un unico file per le analisi successive.
NOTA: Non afferrare la vena anteriore dell'ala dove sono alloggiati i corpi cellulari e gli assoni. Afferra l'ala al centro. Il tessuto nelle ali non è fisso; mantenere il tempo di montare le ali per l'imaging questi sotto 8 min.
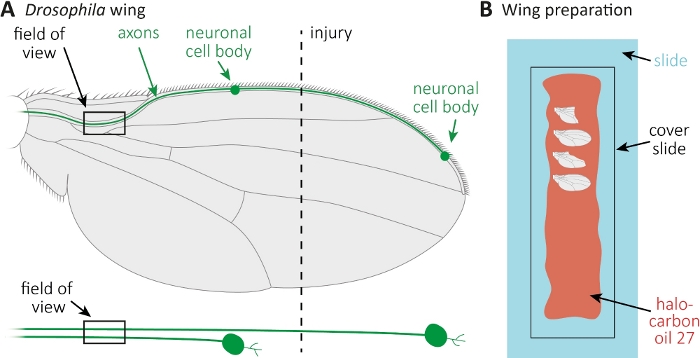
Figura 1: Osservazione della morfologia degli assoni durante la morte degli assoni nell'ala. (A) Ala di mosca schematica con due neuroni sensoriali scarsamente etichettati GFP, che sono anche indicati separatamente di seguito. Sono indicati il luogo della lesione e il campo di osservazione. (B)Impostazione dello schema per l'imaging delle ali. Le ali di controllo lesi e illese (grigio) sono montate in olio di alocarbonio 27 (rosso) su uno scivolo di vetro (azzurro) e coperte da uno scivolo di copertura (nero). Fare clic qui per visualizzare una versione più grande di questa figura.
2. Osservazione della morfologia di Axon e Sinapsi durante la morte di Axon nel SNC
- Ablazione antenne: lesioni di interi fasci di assoni
- Utilizzare 5 femmine vergini e 5 maschi del genotipo destro (Figura 5A, Generazione P0) per eseguire croci a RT. Pass P0 in nuove fiale ogni 3-4 giorni. Raccogliere la progenie degli adulti appena erica (generazione F1) ogni giorno e lasciarli invecchiare per 7 fino a 14 giorni.
- Anestesizza revola molestie su pastiglie di CO2. Utilizzare una pinzetta per ablate il segmento di antenna destra 3rd per l'ablazione unilaterale; o entrambi i segmenti sinistro e destro 3rd antenna per l'ablazione bilaterale (Figura 2A-C). Questo rimuoverà i corpi cellulari neuronali etichettati con GFP, mentre le loro proiezioni assonali rimangono nel SNC.
NOTA: l'ablazione dell'antenna recissce l'intero fascio di assoni. Se viene eseguita l'ablazione unilaterale, il fascio di assone sul lato contralaterale (l'antenna non blated) funge da controllo interno. Assicurarsi di eseguire una quantità sufficiente di antenne (circa 15 animali). - Recuperare le mosche in fiale contenenti cibo.
- Dissezione cerebrale e visualizzazione degli assoni
- Mescolare la base in silicone elastomera (9 mL) e l'agente di polimerità (1 mL) in un rapporto di volume di 10:1. Trasferire ogni miscela da 5 mL in una piastra di coltura dei tessuti da 35 mm e ridurre l'aria introdotta mescolando con agitazione delicata nella cappa di fumi durante la notte. La miscela si solidifica entro 24 h.
NOTA: Le piastre di dissezione devono essere preparate una sola volta e possono essere utilizzate più volte. - Anestesizza vola supastiglie di CO 2 e decapita remi da adulto usando due pinzette nei punti temporali desiderati (ad esempio, 1 o 7 giorni dopo l'ablazione dell'antenna). Utilizzare una pinzetta per afferrare il collo, e l'altra pinzetta per fissare il torace. Tirare delicatamente il collo e la testa fuori il torace.
NOTA: Lasciare le teste decapitate sul pad CO2 fino a ottenere il numero desiderato, ma assicuratevi di procedere al passaggio successivo entro 30 min. - Trasferire tutte le teste in un tubo di microcentrifuga da 1,5 mL contenente 1 mL di soluzione di fissaggio contenente il 4% di paraformaldeide (PFA) e 0,1% Triton X-100 in salina tamponata da fosfato (PBS) utilizzando una pinzetta che sono state immerse nella soluzione di fissaggio.
NOTA: Le teste di volo si attaccano bene sulle pinzette bagnate. Rende possibile trasferire facilmente tutte le teste nel tubo di microcentrifuga. - Fissare le teste per 20 min con agitazione delicata a RT. Mettere il tubo di microcentrifuga sul ghiaccio, teste graviteranno sul fondo del tubo microcentrifuga. Rimuovere il supernatante con una pipetta e ripetere questa procedura con cinque lavaggi da 2 min con 1 mL di buffer di lavaggio contenenti 0,1% Triton X-100 in PBS con agitazione delicata a RT, per rimuovere la soluzione di fissaggio residua.
NOTA: I video su come sezionare i cervelli adulti della Drosophila sono prontamente disponibili27. - Trasferire le teste con una pipetta di vetro in una piastra di dissezione riempita con tampone di lavaggio. Utilizzare una pinzetta per afferrare e tirare la proboscide dalla testa, tenendo la testa con l'altra pinzetta. Questo lascerà un buco se la proboscide è stata attaccata all'esoscheletro.
- Utilizzare due pinzette per rimuovere l'esoscheletro tra il foro e ogni occhio composto. Questo renderà fattibile per aprire la struttura della testa con entrambe le pinzette, e per graffiare delicatamente il cervello all'interno.
- Pulire ogni cervello rimuovendo trachea o grasso attaccato ad esso (Figura 2D, in alto). Una volta che il cervello è pulito, metterlo in un nuovo tubo di microcentrifuga contenente 1 mL di tampone di lavaggio sul ghiaccio.
NOTA: I lobi ottici danneggiati o persi non influenzeranno il lobo olfattivo al centro del cervello (Figura 2D, in alto). - Sostituire il buffer di lavaggio con 1 mL di soluzione di fissaggio una volta che tutti i cervelli sono raccolti e accumulati nella parte inferiore del tubo di microcentrifuga. Fissare il cervello per 10 min con dondolo a RT, seguito da cinque 2 min lavaggi in 1 mL di lavaggio buffer con dondolo a RT.
- Applicare gli anticorpi primari (1:500) nel buffer di lavaggio durante la notte con dondolo a 4 gradi centigradi, seguito da 10 lavaggi su 2 h utilizzando 1 mL di tampone di lavaggio con dondolo a RT.
- Applicare anticorpi secondari (1:500) nel buffer di lavaggio 2 h con dondolo a RT e avvolgere il tubo di microcentrifuga in un foglio di alluminio per bloccare la luce. Mantenere il tubo di microcentrifuga coperto con un foglio di alluminio per il resto della procedura. Applicare dieci lavaggi con 1 mL di tampone di lavaggio su 2 h con dondolo a RT.
- Rimuovere il supernatante e utilizzare una singola goccia di reagente anti-dissolvenza per coprire il cervello nel tubo di microcentrifuga. Incubare cervelli per almeno 30 min a 4 gradi centigradi prima di prepararli per il montaggio e l'imaging.
- Preparare una diapositiva di copertura, attaccare nastro da laboratorio su di esso, e ritagliare una forma "T" -come dal nastro (Figura 2D, fondo). Lo spazio risultante funge da area in cui verrà reindirizzato il reagente antisbicio28 contenente il cervello, preferibilmente in entrambe le camere.
NOTA: Utilizzare una punta di pipetta da 20 a 200, dove 3 mm della punta sono stati tagliati per allargare l'apertura della pipetta. Questo renderà possibile pipettare il reagente antifade contenente cervello. Coprire con cura il cervello con una diapositiva di copertura. - Utilizzare l'argilla per preparare due piccoli rotoli pari. Assicurarsi che i rotoli di argilla non siano superiori all'altezza di uno scivolo di vetro. Attaccare i rotoli di argilla sul vetrino di vetro (Figura 2D, fondo). Posizionare il panino di copertura contenente cervelli sui rotoli di argilla.
NOTA: gli assoni etichettati GFP e le loro sinapsi si trovano nella parte anteriore del cervello. È quindi più facile immagine dalla parte anteriore. Tuttavia, i cervelli saranno sia a faccia in su, o a faccia in giù sul sandwich di copertura scorrevole. I panini di argilla servono come portasandwich e, durante l'imaging, il panino può essere capovolto. Questo renderà possibile acquisire immagini dalla parte anteriore da ogni cervello. - Acquisire una serie di sezioni ottiche lungo l'asse z con 1,0 m di dimensioni passo utilizzando un microscopio confocale, e comprimere z-stacks in un unico file per le analisi successive, per valutare il numero di proiezioni assonali rimanenti intatte.
- Mescolare la base in silicone elastomera (9 mL) e l'agente di polimerità (1 mL) in un rapporto di volume di 10:1. Trasferire ogni miscela da 5 mL in una piastra di coltura dei tessuti da 35 mm e ridurre l'aria introdotta mescolando con agitazione delicata nella cappa di fumi durante la notte. La miscela si solidifica entro 24 h.
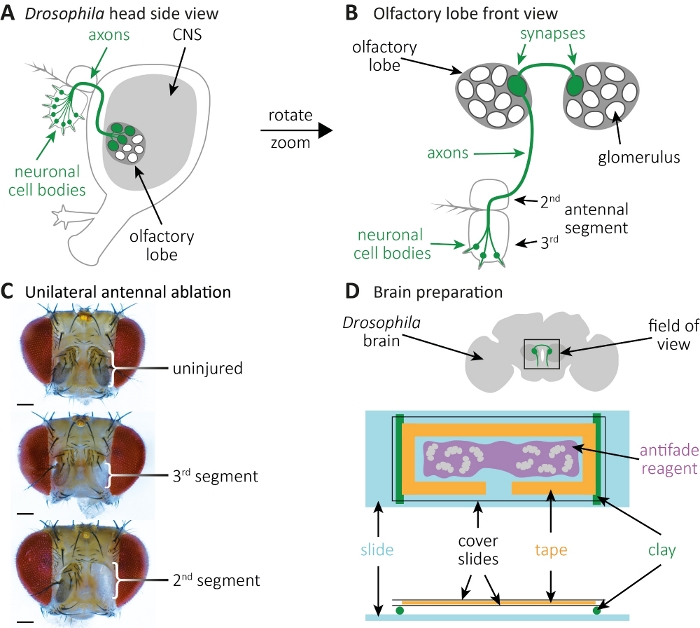
Figura 2: Osservazione della morfologia dell'assone e della sinapsi durante la morte dell'assone nel cervello. (A) Vista laterale di una testa di mosca schematica con corpi cellulari, assoni e sinapsi etichettati con GFP. (B) Vista frontale ad alto ingrandimento dei neuroni recettori olfattivi etichettati con GPF e dei loro assoni e sinapsi. I corpi cellulari sono alloggiati nel segmento delle antenne 3rd, e i loro assoni si proiettano nel CNS. Gli assoni formano le sinapsi in un glomerulus nel lobo olfattivo sinistro, attraversano la linea mediana e formano sinapsi nei glomerulus sul lobo olfattivo contralaterale. (C) Esempi di teste di mosca con ablazione unilaterale dell'antenna. In alto: controllo illeso. Al centro: ablazione del segmento di antenna 3rd. In basso: Ablazione del segmento dell'antenna 2nd (e quindi anche 3rd). (D) Preparazione del cervello. In alto: cervello di mosca sezionato schematico con lobi olfattivi indicati e proiezioni assonali nel campo visivo. In basso: Configurazione schematica per l'imaging cerebrale. Due rotoli di argilla (verde) sono montati su uno scivolo di vetro (azzurro), portano un sandwich di scivolo di copertura, che contiene cervelli di mosca (grigio). I cervelli sono montati in reagente antisbinodo (viola), circondato da un nastro da laboratorio (arancione) e coperti da due diapositive di copertina (nero). Fare clic qui per visualizzare una versione più grande di questa figura.
3. Grooming indotto dall'optogenetica come lettura per la funzione Axon e Synapse
- Configurazione optogenetica
- Eseguire l'esperimento optogenetico in una stanza buia. Assicurarsi che la configurazione sia costituita da un proiettore a LED a infrarossi (IR) da 850 nm per illuminare le mosche al buio(Figura 3A), un faro LED rosso da 660 nm lampeggiante per attivare i neuroni che esprimono CsChrimson e una fotocamera monocromatica con un filtro passa-lungo 700 nm, che impedisce la registrazione di lampeggi di luce rossa.
- Utilizzare una stampante 3D per generare una piccola camera circolare con un diametro di 1 cm, coprirla con uno scivolo di copertura e posizionare un emettitore di 860 nm accoppiato al faretto LED rosso accanto alla camera (Figura 3B).
NOTA: L'emettitore indica quando il proiettore LED rosso è acceso, attivando così i neuroni. - Montare i faretti a LED e la fotocamera sulla parte superiore della camera(Figura 3A, C).
- Attivare i neuroni da 10 Hz lampeggia durante 10 s. La durata dell'attivazione può essere regolata in base al progetto sperimentale.
- Preparare le mosche per l'optogenetica
- Sciogliere il cibo a mosca in un forno a microonde. Dopo che il cibo si è raffreddato, prima della solidificazione, aggiungere 1:100 di 20 mM tutta la transretina in etanolo (EtOH) ad una concentrazione finale di 200 M. Mescolare bene e versare il cibo immediatamente in fiale vuote.
NOTA: Evitare di aggiungere tutto il trans-retina al cibo caldo, questo potrebbe tradursi in optogenetica meno efficiente. - Coprire le fiale contenenti cibo solidificato con tappi o batuffoli di cotone. Avvolgere le fiale con un foglio di alluminio. Quindi, conservare le fiale contenenti cibo in una stanza buia e fredda.
- Utilizzare 5 femmine vergini e 5 maschi (Figura 6A, generazione P0) dal genotipo destro per eseguire croci a RT. Pass P0 in nuove fiale ogni 3-4 giorni. Raccogliere la progenie degli adulti appena erica (generazione F1)su base giornaliera e lasciarli invecchiare per 7 fino a 14 giorni in fiale ricoperte di alluminio contenenti 200 M tutti trans-retinici nel cibo a mosca.
- Raccogli le mosche toccandole dalle fiale contenenti cibo in una fiala vuota senza cibo. Raffreddare la fiala in acqua contenente ghiaccio per circa 30 s. Le mosche si addormenteranno. Mettere le mosche individuali rapidamente in piccole camere coperte da una diapositiva di copertura (Figura 3B).
NOTA: Non appena le mosche si riscaldano, si svegliano. È fondamentale diffondere rapidamente le singole mosche in singole camere ciascuna. Evitare CO2 pastiglie per anabanizzare le mosche, questo avrà un impatto sul loro comportamento. - Eseguire l'optogenetica per suscitare la toelettatura antenna. Qui, il protocollo è costituito dai seguenti intervalli: 30 s dove la luce rossa è assente, seguita da 10 s di esposizione a luce rossa a 10 Hz. Ripeti questa procedura tre volte in totale, seguita da un intervallo aggiuntivo di 30 s in cui la luce rossa è assente12,29,30.
NOTA: Questo protocollo può essere regolato in base alla preferenza sperimentale. - Raccogliere mosche individuali da ogni camera su pad di CO2. Sottopoprima nogli lesioni antenne. Ablate entrambi i segmenti sinistro e destro 2nd antennal (Figura 2C). Questo rimuoverà i corpi cellulari dei neuroni dell'organo di Johnston (JO), mentre le proiezioni assonali rimangono nel SNC. Recuperare le mosche in fiale ricoperte di alluminio contenenti 200 M tutti trans-retinali.
NOTA: Per la toelettatura delle antenne indotta dall'optogenetica, i corpi cellulari sensoriali del neurone sono alloggiati nel segmento 2nd antennal (Figura 2C). - Nei corrispondenti punti temporali (ad esempio, 7 giorni dopo l'ablazione dell'antenna), il soggetto vola a un altro saggio di toelettatura (tornare al passaggio 3.2.4).
- Sciogliere il cibo a mosca in un forno a microonde. Dopo che il cibo si è raffreddato, prima della solidificazione, aggiungere 1:100 di 20 mM tutta la transretina in etanolo (EtOH) ad una concentrazione finale di 200 M. Mescolare bene e versare il cibo immediatamente in fiale vuote.
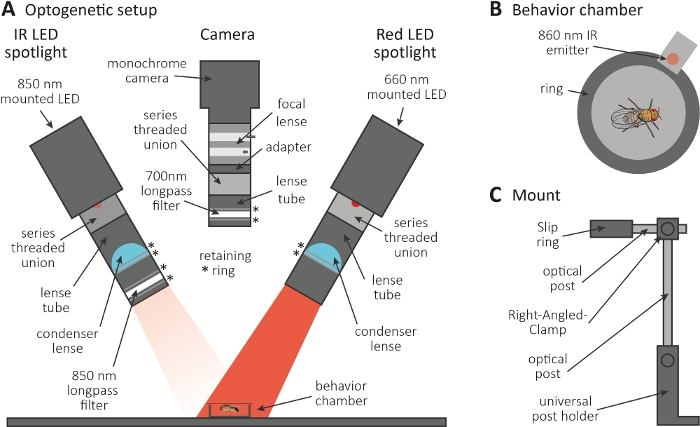
Figura 3: Configurazione optogenetica per indurre la toelettatura come lettura per la funzione assona e sinapsi. (A) Illustrazione dei componenti assemblati necessari per l'optogenetica. riflettori a LED a infrarossi (IR), fotocamera e faretto LED rosso (rispettivamente da sinistra a destra). I componenti, inclusa una descrizione dettagliata, sono elencati nella tabella dei materiali. (B) Illustrazione di vista superiore di una camera di comportamento che include un emettitore a irribondi per indicare l'attivazione del riflettore LED rosso. (C) Illustrazione di una singola configurazione di montaggio. Per i due faretti a LED e la fotocamera sono necessari in totale tre configurazioni di montaggio e la fotocamera. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Sopra, abbiamo descritto tre metodi per studiare la morfologia e la funzione degli assoni recisi e delle loro sinapsi. Il primo metodo consente l'osservazione ad alta risoluzione dei singoli assoni nel PNS. Richiede cloni generati dalla tecnica MARCM14,31. Qui, abbiamo eseguito croci per generare cloni MARCM di tipo selvaggio e wire alto (Figura 4A). Un semplice taglio al centro dell'ala induce lesioni assoni di neuroni ospitati distale (ad esempio, sul lato esterno dell'ala), mentre i neuroni prossimali (ad esempio, tra il sito di taglio e il torace) rimangono illesi. Questo approccio rende possibile osservare la morte degli assoni fianco a fianco degli assoni di controllo illesi nello stesso fascio di nervi (Figura 1A, Figura 4B). Qui, abbiamo usato un background genetico che ha dato come risultato un basso numero di cloni etichettati con GFP (ad esempio, due in ogni esperimento14). Vi presentiamo esempi di 1 e 7 giorni dopo l'infortunio di assoni di tipo selvaggio, per fornire esempi di assoni di controllo, assoni sottoposti a morte assonale, e frammenti assonali eliminati dalla glia circostante, rispettivamente. Inoltre, abbiamo ripetuto lesioni assonali in mutanti highwire dove abbiamo analizzato il risultato 7 giorni dopo la lesione.
Ali di controllo illese ospitano due cloni di tipo selvaggio, quindi due assoni di tipo selvaggio etichettati GFP(Figura 4B, tipo selvaggio, controllo illeso). Un giorno dopo aver tagliato il centro dell'ala con l'uso di micro forbici, la morte degli assoni è indotta in assoni etichettati GFP dove i corpi cellulari sono dissipati al sito di taglio, mentre gli assoni da corpi cellulari ospitati propizzano fungono da controllo interno all'interno dello stesso fascio di nervi (Figura 4B, tipo selvaggio, 1 lesione post giorno). Si noti la traccia dei detriti assonali nella parte superiore indicata dalla freccia. 7 giorni dopo la lesione assonale, i detriti assonali etichettati dalla GFP vengono eliminati dalla glia circostante, mentre gli assoni di controllo illesi gingarini rimangono nel fascio nervoso (Figura 4B, tipo selvaggio, 7 giorni dopo l'infortunio, freccia). Al contrario, gli assoni mutanti highwire che sono stati recisi per 7 giorni rimangono morfologicamente conservati, coerenti con i risultati precedenti11,14 (Figura 4B, filo alto, 7 giorni dopo lesioni, freccia). Questi risultati dimostrano la potente risoluzione visiva dell'ala della Drosophila. La morte ascia può essere osservata fianco a fianco dei controlli illesi nello stesso fascio nervoso. Mentre gli assoni di tipo selvatico subiscono la morte degli assoni entro 1 giorno dalla lesione e i detriti risultanti vengono eliminati entro 7 giorni, i mutanti ad alto filo carenti per la morte degli assoni rimangono morfologicamente conservati per 7 giorni.

Figura 4: Approccio allo studio della morte assonale degli assoni neuronali sensoriali etichettati con GFP nell'ala. (A) Croci schematiche per generare cloni di tipo selvaggio e filo alto nell'ala (p0 e Generazione F1, rispettivamente). Le femmine vergine sono a sinistra, i maschi a destra. Vedere Tabella dei materiali per i dettagli relativi ai genotipi. (B) Esempi di controllo e assoni con etichettatura GFP feriti. Il campo visivo è indicato nella figura1A. Da sinistra a destra: assoni di controllo di tipo selvaggio non feriti, assoni di tipo selvaggio 1 giorno dopo lesione, assoni di tipo selvaggio 7 giorni dopo lesioni, assoni mutanti highwire 7 giorni dopo la lesione, rispettivamente. Le frecce indicano gli assoni recisi, barra della scala n. 5 m. Fare clic qui per visualizzare una versione più grande di questa figura.
Il secondo metodo descrive come visualizzare interi fasci di assoni proiettando nel CNS dove formano sinapsi, che appartengono ai neuroni alloggiati in entrambe le antenne sinistra e destra (Figura 2A-C). Qui, abbiamo eseguito croci per generare cloni MARCM di tipo selvaggio e wire alto (Figura 5A). Gli assoni non levighi, etichettati GFP e le loro sinapsi possono essere visualizzati nel corso di giorni o settimane, in assenza di lesioni (Figura 5B, Tipo selvaggio, controllo illeso). In alternativa, gli animali possono essere sottoposti ad ablazione del segmento di antenna 3rd e gli assoni con etichetta GFP recisi e le loro sinapsi possono essere osservati durante un corso di tempo per ore o giorni. Ci siamo concentrati su 7 giorni dopo l'ablazione dell'antenna, perché in questo momento, gli assoni e le loro sinapsi hanno subito la morte degli assoni, e i detriti risultanti vengono eliminati dalla glia circostante. Se viene eseguita l'ablazione unilaterale dell'antenna giusta, il fascio di assone destro viene reciso e si smonta e i detriti risultanti vengono completamente eliminati 7 giorni dopo l'infortunio (Figura 5B, tipo selvaggio, ablazione unilaterale, 7 giorni dopo l'infortunio, frecce), coerente con i risultati precedenti13. In alternativa, entrambe le antenne destra e sinistra possono essere ablalate, che recidere entrambi i fasci di assoni, e 7 giorni dopo lesioni, assoni e le loro sinapsi scomparso (Figura 5B, tipo selvaggio, ablazione bilaterale, 7 giorni dopo la lesione, freccia). Al contrario, l'ablazione unilaterale delle antenne destra nei mutanti highwire si traduce in assoni recisi che rimangono conservati 7 giorni dopo l'infortunio, coerente con i risultati precedenti11,14 (Figura 5B, filo alto, ablazione unilaterale, 7 giorni dopo la lesione, freccia). Questi risultati dimostrano che gli assoni di tipo selvaggio subiscono la morte degli assoni e i detriti risultanti vengono eliminati entro 7 giorni, mentre i mutanti ad alto filo carenti per la morte degli assoni non subiscono la morte degli assoni e rimangono conservati morfologicamente per 7 giorni.
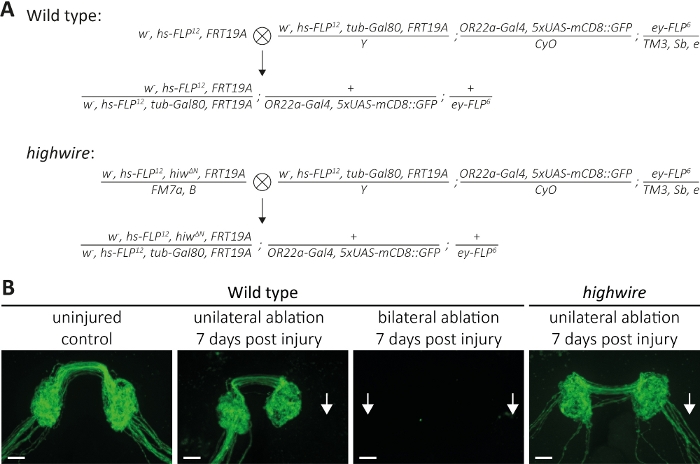
Figura 5: Approccio allo studio della morte degli assoni assoni etichettati da GFP degli assoni neuronali sensoriali etichettati con GFP nel cervello. (A) Croci schematiche per generare cloni di tipo selvaggio e filo alto nel cervello (p0 e Generazione F1, rispettivamente). Le femmine vergine sono a sinistra, i maschi a destra. Vedere Tabella dei materiali per i dettagli relativi ai genotipi. (B) Esempi di controllo e assoni con etichettatura GFP feriti. Da sinistra a destra: controlli di tipo selvaggio illeso, tipo selvaggio 7 giorni dopo l'ablazione unilaterale dell'antenna, tipo selvaggio 7 giorni dopo l'ablazione dell'antenna bilaterale e mutanti highwire 7 giorni dopo l'ablazione unilaterale dell'antenna, rispettivamente. Le frecce indicano fasci di assone recisi, barra di scala - 10 m. Fare clic qui per visualizzare una versione più grande di questa figura.
Il terzo metodo consente l'osservazione della conservazione funzionale degli assoni recisi e delle loro sinapsi nel SNC. Si basa sulla manipolazione di un sottoinsieme di neuroni JO ospitati nel segmento 2nd antennal che sono sufficienti per indurre la toelettatura antennale. Espressione di una channelrhodopsin dal rosso (CsChrimson) nei neuroni JO, combinata con il completamento dietetico di tutta la transretina, è sufficiente per suscitare un semplice comportamento di toelettatura post-sinaptica su esposizione alla luce rossa12,30. Qui, abbiamo eseguito croci per generare neuroni JO di tipo selvaggio, e i neuroni JO sovraesprimono dnmnat (dnmnatOE) (Figura 6A). Mosche di tipo selvaggio o mosche contenenti neuroni JO con morte assonale attenuata (dnmnatOE), entrambi ospitano un potente comportamento di toelettatura prima della lesione. Tuttavia, 7 giorni dopo l'infortunio (ad esempio, l'ablazione bilaterale del segmento 2nd antenna), la toelettatura non riesce ad essere suscitata dall'optogenetica nelle mosche di tipo selvatico a causa della degenerazione dell'assone e della sinapsi indotta da lesioni, mentre gli animali con la morte attenuata degli assoni continuano a essere sposi (Figura 6B, Filmato 1,2). La morte degli assoni attenuata è quindi in grado di preservare funzionalmente gli assoni recisi e le loro sinapsi per 7 giorni.

Figura 6: Approccio per visualizzare la funzione assonale e sinaptica dopo l'assiotomia. (A) Croci schematiche per generare il tipo selvaggio e i neuroni sensoriali JO sovraespresso (p0 e F1 generazione, rispettivamente). Le femmine vergine sono a sinistra, i maschi a destra. Vedere Tabella dei materiali per i dettagli relativi ai genotipi. (B) Ethogrammi individuali di comportamento di toelettatura indotti dall'optogenetica. Top: ethogrammi individuali di mosche di tipo selvatico prima e 7 giorni dopo l'infortunio (blu). In basso: ethogrammi individuali di mosche che sovraesprimono dnmnat (dnmnatOE) nei neuroni JO prima e 7 giorni dopo l'infortunio (rosso). Ogni contenitore indica almeno 1 comportamento di toelettatura entro 1 s. La linea nera indica la somma di tutte le collocazioni. (C) Quantificazione del comportamento di toelettatura. I dati sono mostrati come media : deviazione standard, p > 0.001 (ANOVA unidirezionale, confronto multiplo con il test post hoc di Tukey). Fare clic qui per visualizzare una versione più grande di questa figura.
Filmato 1: Rappresentante comportamento di toelettatura tipo selvaggio suscitato da optogenetica prima e 7 giorni dopo l'ablazione dell'antenna. Clicca qui per scaricare questo video.
Film 2: Comportamento rappresentativo di toelettatura suscitato dall'optogenetica nelle mosche sovraesprimendo dnmnat nei neuroni JO prima e 7 giorni dopo l'ablazione dell'antenna. Clicca qui per scaricare questo video.
Discussione
I protocolli qui descritti consentono l'osservazione robusta e riproducibile della morfologia, nonché la funzione degli assoni e delle loro sinapsi separate dai loro corpi cellulari in Drosophila. Il saggio dell'ala facilita l'osservazione della morte degli assoni fianco per lato degli assoni di controllo non feriti nel PNS14, mentre il saggio dell'antenna facilita l'osservazione di fasci integrali nervosi degli assoni etichettati Con GFP e delle loro sinapsi, per valutare sia la morfologia che la funzione nel cervello (CNS)12. Ci sono passaggi critici e alcuni vantaggi per ogni approccio allo studio della morfologia che devono essere presi in considerazione quando si progettano esperimenti.
Per osservare la morfologia degli assoni nel PNS nell'ala, gli esperimenti possono essere prontamente eseguiti, a causa della trasparenza dell'ala: permette di bypassare la dissezione e l'immunohistochimica. Tuttavia, a causa della mancanza di fissazione, le ali devono essere immagine subito dopo il montaggio14. Attualmente vengono utilizzati frequentemente due driver Gal4 distinti, ok371Gal4 o dpr1Gal4, ed entrambi i riferimenti offrono approcci distinti per quantificare la degenerazione14,26. Si raccomanda l'etichettatura sparse di alcuni neuroni, utilizzando "Mosaic Analysis with a Repressible Cell Marker (MARCM)"14,31 ,poichéla risoluzione della morfologia assonale è senza precedenti. Al contrario, l'osservazione delle sinapsi non è possibile nelle ali, si trovano nel cordone nervoso ventrale all'interno del torace delle mosche. Inoltre, ulteriori marcatori assonali non possono essere visualizzati con immunohistochimica: la cuticola cerosa rende impossibile la diffusione di fissativi e anticorpi nel tessuto sottostante.
Per osservare la morfologia degli assoni e delle sinapsi nel SNC, devono essere eseguite dissezioni cerebrali. Offrono il vantaggio di visualizzare ulteriori marcatori assonali e sinaptici con l'uso di immunostochimica, e le sinapsi possono essere osservate insieme agli assoni nello stesso campo visivo10,13. Una vasta collezione di driver di neuroni del neurone del recettore olfattivo (ORN) Gal4 è prontamente disponibile32e spesso OR22aGal4 è il fattore di scelta. Per l'ablazione dell'antenna, i corpi cellulari dei neuroni OR22a sono alloggiati nel segmento 3rd (Figura 2B). Una quantificazione basata sull'intensità della fluorescenza viene utilizzata per quantificare la degenerazione degli assoni o delle sinapsi13. Al contrario, gli esperimenti richiedono molto tempo a causa della dissezione del cervello e della colorazione degli anticorpi.
Per visualizzare la funzione assonale e sinaptica dopo l'assiotomia, l'optogenetica viene utilizzata per attivare la toelettatura antenne: serve come lettura per la conservazione funzionale degli assoni recisi e delle loro sinapsi12. Il circuito di toelettatura e i corrispondenti driver sensoriali, interneuroni Gal4 sono stati accuratamente descritti29,30. GMR60E02Gal4 etichetta un sottoinsieme dei neuroni sensoriali dell'organo di Johnston (JO), necessari e sufficienti per la toelettatura29,30. Per l'ablazione dell'antenna, i corpi cellulari dei neuroni JO sono alloggiati nel segmento 2nd dell'antenna (Figura 2B). Una configurazione optogenetica può essere facilmente costruita da zero, o una configurazione esistente regolata. È importante sottolineare che gli esperimenti devono essere eseguiti in una stanza buia e le mosche sono così visualizzate con un faretto a LED a infrarossi (IR). Quando si utilizza CsChrimson come canale, è fondamentale fornire al cibo tutto trans-retinale e un faretto LED rosso per attivare i neuroni JO29. In alternativa, i canali blu sensibili alla luce chiara e un faretto LED blu, o il canale e la temperatura TrpA1 possono essere utilizzati per l'attivazione neuronale29,33. La quantificazione del comportamento di toelettatura è già stata descritta12,29.
Quando questi saggi sono utilizzati per studiare specificamente la morte degli assoni, è importante notare che il fenotipo della conservazione morfologica o funzionale dovrebbe essere robusto nel tempo. Ci sono casi in cui la morte assonale porta ad un fenotipo coerente ma meno pronunciato nella conservazione morfologica34,35, e se tale fenotipo si traduce in conservazione funzionale rimane da determinare.
I fenotipi di morte ascia sono stati osservati anche nei neuroni durante lo sviluppo delle larve della Drosophila, dove i nervi sono stati schiacciati piuttosto che feriti11,23. Qui, ci siamo concentrati specificamente sui neuroni adulti della Drosophila che hanno completato lo sviluppo. In questo contesto, l'uso dell'interferenza dell'RNA36, o del tessuto specifico CRISPR/Cas937 può essere facilmente implementato. È importante sottolineare che le tecniche di cui sopra possono essere utilizzate in un contesto indipendente dalla morte assonale: facilitano la caratterizzazione dei fattori di manutenzione neuronale38, il trasporto assonale39, i mitocondri assonali dipendenti dall'etàcambiano 40e la morfologia dei mitocondri assonali41.
Divulgazioni
Gli autori dichiarano di non avere nulla da divulgare.
Riconoscimenti
Ringraziamo l'intero laboratorio Neukomm per i contributi. Questo lavoro è stato sostenuto da un premio Assistant Professor della Fondazione nazionale svizzera per la scienza nazionale (SNSF) (grant 176855), dalla Fondazione internazionale per la ricerca in paraplegia (IRP, grant P180), dalla SNSF Spark (grant 190919) e dal sostegno dell'Università di Losanna e il Dipartimento di Neuroscienze Fondamentali (Tat de Vaud) a LJN.
Materiali
| Name | Company | Catalog Number | Comments |
| Tweezers (high precision, ultra fine) | EMS | 78520-5 | Antennal ablation |
| MicroPoint Scissors (5-mm cutting edge) | EMS | 72933-04 | Wing injury |
| 1.5 mL microcentrifuge tube | Eppendorf | 30120086.0000 | |
| 35mm tissue culture dish | Sarstedt | 83.3900 | |
| Cover Slips, Thickness 1 | Thermo Scientific™ | BB02400600A113MNT0 | |
| Superfrost Microscope Slides | Thermo Scientific™ | AA00008032E00MNT10 | |
| High-Sensitivity USB 2.0 CMOS Camera, 1280 x 1024, Global Shutter | Thorlabs | DCC1240M | Camera setup |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 25mm 1/1.2" C mount Lens | Tamron | M112FM25 | |
| Adapter with External M27 x 0.5 Threads and Internal SM1 Threads | Thorlabs | SM1A36 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 700 nm | Thorlabs | FELH0700 | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 1" Long, Two Retaining Rings Included | Thorlabs | SM1M10 | |
| 850 nm, 900 mW (Min) Mounted LED, 1200 mA | Thorlabs | M850L3 | IR LED spotlight |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 850 nm | Thorlabs | FELH0850 | |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 660 nm, 940 mW (Min) Mounted LED, 1200 mA | Thorlabs | M660L4 | Red LED spotlight |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube | Thorlabs | KPS101 | LED control |
| T-Cube LED Driver, 1200 mA Max Drive Current | Thorlabs | LEDD1B | |
| 150 mm x 300 mm x 12.7 mm Aluminum Breadboard, M6 Double-Density Taps | Thorlabs | MB1530/M | Mount base |
| Ø12.7 mm Universal Post Holder, Spring-Loaded Locking Thumbscrew, L = 75 mm | Thorlabs | UPH75/M | Mount, 3x (IR LED, red LED, cam) |
| Ø1.20" Slip Ring for SM1 Lens Tubes and C-Mount Extension Tubes, M4 Tap | Thorlabs | SM1RC/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 150 mm | Thorlabs | TR150/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 40 mm | Thorlabs | TR40/M | |
| Right-Angle Clamp for Ø1/2" Posts, 5 mm Hex | Thorlabs | RA90/M | |
| M6 x 1.0 Stainless Steel Cap Screw, 16 mm Long, Pack of 25 | Thorlabs | SH6MS16 | screws for mount onto base |
| USB-6001 14-Bit 20 kS/s Multifunction I/O and NI-DAQmx | National Instruments | 782604-01 | Red LED spotlight controller |
| 20k Ohm 1 Gang Linear Panel Mount Potentiometer | TT Electronics/BI | P230-2EC22BR20K | fintuner for indicator |
| IR (860nm) emitter, 100 mA radial | Osram | 475-1365-ND | Red light indicator |
| cable | - | - | Misc |
| All-trans retinal | Sigma | R2625 | |
| Ethanol absolute | Vwr | 20821.296 | |
| Halocarbon Oil 27 | Sigma | H8773 | |
| Mowiol | Merk | 81381 | |
| Paraformaldehyde | Sigma | F8775 | |
| Phosphate buffered saline (PBS) | Sigma | P5493 | |
| Sylgard 184 silicone elastomer base | Dow Corning Corp | 4019862 | |
| Sylgard 184 silicone elastomer curing agent | Dow Corning Corp | 4019862 | |
| Triton X-100 | Sigma | T8787 | |
| Chicken anti-GFP antibodies | Rockland | 600-901-215 | Antibodies |
| Goat Dylight anti-Chicken | Abcam | ab96947 | |
| FM7a, B | BDSC | RRID:BDSC_785 | X chromosome |
| FRT19A[hs-neo] | BDSC | RRID:BDSC_1709 | |
| hiw[ΔN] | BDSC | RRID:BDSC_51637 | |
| hs-FLP[12] | BDSC | RRID:BDSC_1929 | |
| tub-Gal80[LL1] | BDSC | RRID:BDSC_5132 | |
| w[1118] | BDSC | RRID:BDSC_3605 | |
| 20xUAS-IVS-CsChrimson::mVenus | BDSC | RRID:BDSC_55135 | 2nd chromosome |
| 5xUAS-Gal4[12B] | Kyoto | RRID:Kyoto_108492 | |
| 5xUAS-HA::dnmnat | BDSC | RRID:BDSC_39702 | |
| 5xUAS-mCD8::GFP[LL5] | BDSC | RRID:BDSC_5134 | |
| ase-FLP[2d] | Freeman laboratory | Neukomm et al., 2014 (PNAS) | |
| CyO | BDSC | RRID:BDSC_2555 | |
| dpr1-Gal4 | BDSC | RRID:BDSC_25083 | |
| OR22a-Gal4 | BDSC | RRID:BDSC_9952 | |
| ey-FLP[6] | BDSC | RRID:BDSC_5577 | 3rd chromosome |
| GMR60E02-Gal4 | BDSC | RRID:BDSC_39250 | |
| TM3,Sb,e | BDSC | RRID:BDSC_3644 |
Riferimenti
- Matsuda, W., et al. Single Nigrostriatal Dopaminergic Neurons Form Widely Spread and Highly Dense Axonal Arborizations in the Neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Wedel, M. J. A Monument of Inefficiency: The Presumed Course of the Recurrent Laryngeal Nerve in Sauropod Dinosaurs. Acta Palaeontologica Polonica. 57 (2), 251-256 (2012).
- Mariano, V., Domínguez-Iturza, N., Neukomm, L. J., Bagni, C. Maintenance mechanisms of circuit-integrated axons. Current Opinion in Neurobiology. 53, 162-173 (2018).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nature reviews Neuroscience. 15 (6), 394-409 (2014).
- Neukomm, L. J., Freeman, M. R. Diverse cellular and molecular modes of axon degeneration. Trends in Cell Biology. 24 (9), 515-523 (2014).
- Gustavsson, A., et al. Cost of disorders of the brain in Europe 2010. European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 21 (10), 718-779 (2011).
- Waller, A. Experiments on the Section of the Glossopharyngeal and Hypoglossal Nerves of the Frog, and Observations of the Alterations Produced Thereby in the Structure of Their Primitive Fibres. Philosophical Transactions of the Royal Society of London. 140, 423-429 (1850).
- Rosell, A. L., Neukomm, L. J. Axon death signalling in Wallerian degeneration among species and in disease. Open Biology. 9 (8), 190118(2019).
- Mack, T. G., et al. Wallerian degeneration of injured axons and synapses is delayed by a Ube4b/Nmnat chimeric gene. Nature Neuroscience. 4 (12), 1199-1206 (2001).
- Osterloh, J. M., et al. dSarm/Sarm1 is required for activation of an injury-induced axon death pathway. Science. 337 (6093), New York, NY. 481-484 (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biology. 10 (12), 1001440(2012).
- Neukomm, L. J., et al. Axon Death Pathways Converge on Axundead to Promote Functional and Structural Axon Disassembly. Neuron. 95 (1), 78-91 (2017).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50 (6), 869-881 (2006).
- Neukomm, L. J., Burdett, T. C., Gonzalez, M. A., Zuchner, S., Freeman, M. R. Rapid in vivo forward genetic approach for identifying axon death genes in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (27), 9965-9970 (2014).
- Lu, T. Y., et al. Axon degeneration induces glial responses through Draper-TRAF4-JNK signalling. Nature Communications. 8, 14355(2017).
- Lunn, E. R., Perry, V. H., Brown, M. C., Rosen, H., Gordon, S. Absence of Wallerian Degeneration does not Hinder Regeneration in Peripheral Nerve. The European Journal of Neuroscience. 1 (1), 27-33 (1989).
- Adalbert, R., et al. A rat model of slow Wallerian degeneration (Wld(S)) with improved preservation of neuromuscular synapses. The European Journal of Neuroscience. 21 (1), 271-277 (2005).
- Martin, S. M., O'Brien, G. S., Portera-Cailliau, C., Sagasti, A. Wallerian degeneration of zebrafish trigeminal axons in the skin is required for regeneration and developmental pruning. Development. 137 (23), Cambridge, England. 3985-3994 (2010).
- Feng, Y., et al. Overexpression of Wld(S) or Nmnat2 in Mauthner Cells by Single-Cell Electroporation Delays Axon Degeneration in Live Zebrafish. Journal of Neuroscience Research. 88 (15), 3319-3327 (2010).
- Gilley, J., Coleman, M. P. Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons. PLoS Biology. 8 (1), 1000300(2010).
- Babetto, E., Beirowski, B., Russler, E. V., Milbrandt, J., DiAntonio, A. The Phr1 ubiquitin ligase promotes injury-induced axon self-destruction. Cell Reports. 3 (5), 1422-1429 (2013).
- Gerdts, J., Summers, D. W., Sasaki, Y., DiAntonio, A., Milbrandt, J. Sarm1-mediated axon degeneration requires both SAM and TIR interactions. The Journal of Neuroscience. 33 (33), 13569-13580 (2013).
- Gerdts, J., Brace, E. J., Sasaki, Y., DiAntonio, A., Milbrandt, J. SARM1 activation triggers axon degeneration locally via NAD+ destruction. Science. 348 (6233), New York, NY. 453-457 (2015).
- Bridge, P. M., et al. Nerve crush injuries--a model for axonotmesis. Experimental Neurology. 127 (2), 284-290 (1994).
- Maxwell, W. L., Bartlett, E., Morgan, H. Wallerian Degeneration in the Optic Nerve Stretch-Injury Model of Traumatic Brain Injury: A Stereological Analysis. Journal of Neurotrauma. 32 (11), 780-790 (2015).
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Current Biology. 22 (7), 590-595 (2012).
- Janelia Farm Adult Drosophila Brain Dissection. , Available from: https://www.janelia.org/project-team/flylight/protocols (2015).
- Cold Spring Harbor. Mowiol mounting medium. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Seeds, A. M., et al. A suppression hierarchy among competing motor programs drives sequential grooming in Drosophila. eLife. 3, 02951(2014).
- Hampel, S., Franconville, R., Simpson, J. H., Seeds, A. M. A neural command circuit for grooming movement control. eLife. 4, 08758(2015).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Vosshall, L. B., Wong, A. M., Axel, R. An olfactory sensory map in the fly brain. Cell. 102 (2), 147-159 (2000).
- Hampel, S., McKellar, C. E., Simpson, J. H., Seeds, A. M. Simultaneous activation of parallel sensory pathways promotes a grooming sequence in Drosophila. eLife. 6, (2017).
- Farley, J. E., et al. Transcription factor Pebbled/RREB1 regulates injury-induced axon degeneration. Proceedings of the National Academy of Sciences of the United States of America. 23 (6), (2018).
- Wang, H., et al. Rapid depletion of ESCRT protein Vps4 underlies injury-induced autophagic impediment and Wallerian degeneration. Science Advances. 5 (2), 4971(2019).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151-156 (2007).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. bioRxiv. 102, 636076(2019).
- Vagnoni, A., Hoffmann, P. C., Bullock, S. L. Reducing Lissencephaly-1 levels augments mitochondrial transport and has a protective effect in adult Drosophila neurons. Journal of Cell Science. 129 (1), 178-190 (2016).
- Vagnoni, A., Bullock, S. L. A cAMP/PKA/Kinesin-1 Axis Promotes the Axonal Transport of Mitochondria in Aging Drosophila Neurons. Current Biology. 28 (8), 1265-1272 (2018).
- Cao, X., et al. In vivo imaging reveals mitophagy independence in the maintenance of axonal mitochondria during normal aging. Aging Cell. 16 (5), 1180-1190 (2017).
- Smith, G. A., et al. Glutathione S-Transferase Regulates Mitochondrial Populations in Axons through Increased Glutathione Oxidation. Neuron. 103 (1), 52-65 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon