È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione microfluidica di liposomi sensibili alla temperatura contengono lysolipid
In questo articolo
Riepilogo
Il protocollo presenta i parametri ottimizzati per la preparazione di liposomi termosensibili utilizzando il dispositivo microfluidico a spina di pesce sfalsato. Questo permette anche co-incapsulazione di doxorubicina e verde indocianina nei liposomi e il rilascio fototermico innescato di doxorubicina per il rilascio di droga controllato / innescato.
Abstract
Il protocollo presentato consente una preparazione continua ad alto consumo di liposomi sensibili alla bassa temperatura (LTSL), che sono in grado di caricare farmaci chemioterapici, come doxorubicina (DOX). Per raggiungere questo obiettivo, una miscela di lipidi etanolici e una soluzione di solfato di ammonio vengono iniettati in un dispositivo microfluidico a spina di pesce sfalsato (SHM). Le soluzioni sono rapidamente mescolate dal SHM, fornendo un ambiente di solvente omogeneo per l'auto-assemblaggio dei liposomi. I liposomi raccolti vengono prima anuniti, quindi dializzati per rimuovere l'etanolo residuo. Un gradiente di pH solfato di ammonio viene stabilito attraverso lo scambio tampone della soluzione esterna utilizzando la cromatografia di esclusione di dimensioni. DOX viene quindi caricato a distanza nei liposomi con elevata efficienza di incapsulamento (> 80%). I liposomi ottenuti hanno dimensioni omogenee con diametro medio di 100 nm. Sono in grado di innescare la temperatura di rilascio a raffica di DOX incapsulato in presenza di ipertermia lieve (42 gradi centigradi). Indocyanine green (ICG) può anche essere co-caricato nei liposomi per il rilascio DOX a infrarossi vicino a infrarossi. L'approccio microfluidico garantisce una preparazione ad alta produttività, riproducibile e scalabile delle LLT.
Introduzione
La formulazione LTSL è un prodotto liposomico clinicamente rilevante che è stato sviluppato per fornire il farmaco chemioterapico doxorubicin (DOX)e consente un efficiente rilascio di farmaci a raffica a ipertermia lieve clinicamente raggiungibile (T 41 . La formulazione LTSL è composta da 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC), il lysolipido1-stearoyl-2-idrossi-sn -glycero-3-phosphatidylcho (MSPC; M sta per "mono") e PEGylated lipid 1,2-distearoyl-sn-glycero-3-phosethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000). Una volta raggiunta la temperatura di transizione di fase (Tm ) , i lincidi e dSPE-PEG2000 insieme facilitano la formazione dei pori della membrana, con conseguente rilascio di scoppio del farmaco2. La preparazione di LTSL utilizza principalmente un approccio bulk dall'alto verso il basso, vale a dire l'idratazione e l'estrusione delle pellicole lipidiche. Resta difficile preparare in modo riproducibile grandi lotti con proprietà identiche e in quantità sufficienti per le applicazioni cliniche3.
La microfluidica è una tecnica emergente per la preparazione dei liposomi, che offre dimensioni delle nanoparticelle regolabili, riproducibilità e scalabilità3. Una volta ottimizzati i parametri di produzione, la velocità effettiva potrebbe essere aumentata mediante parallelizzazione, con proprietà identiche a quelle preparate in scala di panca3,4,5. Uno dei principali vantaggi della microfluidica rispetto alle tecniche di massa convenzionali è la capacità di gestire piccoli volumi di liquidi con elevata controllabilità nello spazio e nel tempo attraverso la miniaturizzazione, consentendo un'ottimizzazione più veloce, operando in modo continuo e automatizzato6. La produzione di liposomi con dispositivi microfluidici è ottenuta da un approccio di nanoprecipitazioni dal basso verso l'alto, che è più efficiente in termini di tempo ed energia perché i processi di omogeneizzazione come l'estrusione e la sonicazione non sono necessari7. Tipicamente, una soluzione organica (ad esempio etanolo) di lipidi (e carico idrofobico) viene mescolata con un non solvente miscibile (ad esempio acqua e carico idrofilo). Come il solvente organico si mescola con il non solvente, la solubilità per i lipidi è ridotta. La concentrazione di lipidi alla fine raggiunge una concentrazione critica in cui viene attivato il processo di precipitazione7. Nanoprecipitati di lipidi alla fine crescono di dimensioni e si chiudono in un liposoma. I principali fattori che regolano le dimensioni e l'omogeneità dei liposomi sono il rapporto tra il non solvente e il solvente (cioè il rapporto di portata acquoso-organico; FRR) e l'omogeneità dell'ambiente solvente durante l'auto-assemblaggio dei lipidi in liposomi8.
La miscelazione efficiente dei fluidi in microfluidica è quindi essenziale per la preparazione di liposomi omogenei, e vari progetti di miscelatori sono stati impiegati in diverse applicazioni9. Il micromixer a spina di pesce sfalsato (SHM) rappresenta una delle nuove generazioni di miscelatori passivi, che consente un'elevata produttività (nella gamma di mL/min) con un fattore di diluizione basso. Questo è superiore ai tradizionali dispositivi di miscelazione idrodinamica microfluidica8,10. Lo SHM ha modellato scanalature a spina di pesce, che mescolano rapidamente fluidi per advezione caotica9,11. La breve scala cronologica di miscelazione di SHM (< 5 ms, inferiore alla tipica scala temporale di aggregazione di 10-100 ms) consente l'autoassemblaggio dei lipidi in un ambiente omogeneo, producendo nanoparticelle con distribuzione uniforme delle dimensioni3,12.
La preparazione di LTSL con microfluidica non è, tuttavia, così semplice rispetto alle formulazioni liposomiche convenzionali a causa della mancanza di colesterolo8, senza il quale i bistrati lipidici sono suscettibili all'interdigitalizzazione indotta dall'etanolo13,14,15. Fino ad ora, l'effetto dell'etanolo residuo si presenta durante la produzione microfluidica di liposomi non è stato ben compreso. La maggior parte delle formulazioni segnalate sono intrinsecamente resistenti all'interdigitazione (contenente colesterolo o lipidi insaturi)16, che a differenza delle LTSL sono sia saturi che privi di colesterolo.
Il protocollo qui presentato utilizza SHM per preparare i LTSL per la somministrazione di farmaci a rilascio di temperatura. Nel metodo presentato, abbiamo assicurato che i LTSL microfluidici-preparati sono nano-dimensioni (100 nm) e uniforme (dispersità < 0.2) da dispersione dinamica della luce (DLS). Inoltre, abbiamo incapsulato DOX usando il metodo del gradiente di solfato di ammonio transmembrana (noto anche come caricamento remoto)17 come convalida dell'integrità del bistrato lipidico LTSL. Il caricamento a distanza del DOX richiede che il liposoma mantenga un gradiente di pH al fine di ottenere un'elevata efficienza di incapsulamento (EE), che è improbabile che si verifichi senza un bistrato lipidico intatto. In questo metodo presentato, distintivo dai tipici protocolli di preparazione del liposoma microfluidico, è necessaria una fase di annealing prima che l'etanolo venga rimosso per abilitare la capacità di caricamento remoto; cioè per ripristinare l'integrità del bistrato lipidico.
Come accennato in precedenza, i carichi idrofili e idrofobici possono anche essere introdotti alle soluzioni iniziali per l'incapsulamento simultaneo dei carichi utili durante la formazione di LTSL. Come proof-of-concept, il verde indocianina (ICG), un coloranti fluorescente a infrarossi vicino alla FDA, che è anche un promettente agente fototermico, viene introdotto nella miscela di lipidi iniziali e co-caricato con successo nelle LSL. Un laser da 808 nm viene utilizzato per irradiare i LTS caricati da DOX/ICG e indurre con successo il rilascio a scoppio di DOX innescato dal riscaldamento fototermico entro 5 min.
Tutti gli strumenti e i materiali sono disponibili in commercio, pronti all'uso e senza bisogno di personalizzazione. Poiché tutti i parametri per la formulazione dei lPSL sono stati ottimizzati, seguendo questo protocollo, i ricercatori senza alcuna conoscenza preliminare della microfluidica potrebbero anche preparare i LTSL, che funge da base per un sistema di somministrazione di farmaci termosensibili.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Configurazione dell'attrezzatura
- Assemblare le pompe di siringhe e SHM come segue.
- Collegare la porta "To Computer" della pompa di siringa secondaria (Pompa 02, per soluzione acquosa) alla porta "To Network" della pompa della siringa master (Pompa 01, per soluzione lipidi etanolo) utilizzando Pump to Pump network cable (Figura 1, giallo).
- Collegare la porta "Al computer" della pompa master alla porta "RS232 Serial" del computer utilizzando il PC per pompare il cavo di rete (Figura 1, blu).
- Collegare i tubi a ciascuna delle prese e delle prese del SHM utilizzando un dado e ferrule. Convertire il terminale del tubo per entrambe le insenature in Luer femmina utilizzando un altro dado e ferrule e un assieme di unione. Il tubo più lungo delle insenature consente un più facile attaccamento alle siringhe (Figura 2).
- Impostare il software di controllo della pompa.
- Assegnare l'indirizzo della pompa della siringa master e della pompa della siringa secondaria a "Ad:01" e "Ad:02", rispettivamente, utilizzando il pulsante "Setup" della pompa della siringa. Questo deve essere fatto solo per la prima volta.
- Aprire il software di controllo della pompa sul computer. Le due pompe di siringhe devono essere rilevate automaticamente, seguite da un segnale acustico. In caso contrario, fare clic su Pompe e cercare pompe per aggiornare la connessione. (Figura 3).
- Assegnare diametro a 12,45 (mm) scegliendo "HSW Norm-Ject 5 cc (Dia-12.45)".
- Assegna Velocità a 0,25 mL/min per pompa 01 (soluzione lipidiarica anololo) e 0,75 mL/min per la pompa 02 (soluzione aquess). Le portate corrispondono a una portata totale (TFR) di 1 mL/min e aqueous-to-etanol flow rate ratio (FRR) di 3.
- Assegnare Volume a qualsiasi valore superiore a 5 mL.
NOTA: Il volume di infusione mirato è impostato su un volume superiore al volume liquido caricato considerando il volume vuoto del tubo. - Selezionare la modalità INF (infusione) per entrambe le pompe.
- Premere Set per confermare le impostazioni.
2. Preparare i lPL
- Preparare una miscela di lipidi LTSL10 o LTSL10-ICG (vedere la tabella 1).
- Ritirare 1 mL di miscela di lipidi e almeno 3 mL di (NH4)2SO4 soluzione utilizzando due siringhe di blocco 5 mL Luer.
- Installare le due siringhe sulle pompe di siringa in posizione eretta facendo scorrere la flangia della canna della siringa al fermo siringa della pompa e la flangia di tuffo della siringa al blocco pusher della pompa (Figura 4).
- Avvolgere l'estremità del nastro riscaldante sulla siringa con la soluzione acquosa. Avvolgere l'altra estremità del nastro riscaldante e la sonda di temperatura del termostato intorno alla siringa con la soluzione lipidi. È utile esercitarsi con siringhe vuote per facilitare il processo di assemblaggio (Figura 5A).
- Collegare le due siringhe agli adattatori Luer femminili delle corrispondenti prese dello SHM. Assicurarsi che le siringhe contenenti la miscela di lipidi e (NH4)2SO4 soluzioni siano collegate insolla e inserito, rispettivamente. Regolare la posizione dello stantuffo per rimuovere le bolle d'aria dalle siringhe (Figura 5B).
NOTA: Assicurarsi che le siringhe siano ancora posizionate saldamente sul fermo siringa delle pompe. - Riscaldare le siringhe al di sopra di 51 gradi centigradi utilizzando il nastro riscaldante utilizzando una sessione di riscaldamento da 10 s. Lasciare che il termostato aggiorni la temperatura delle siringhe. Ripetere questo passaggio nei passaggi seguenti per mantenere la temperatura durante l'infusione.
AMMONIMento: Spegnere il nastro riscaldante dopo 10 s per evitare l'superamento della temperatura e consentire al termostato di aggiornare la temperatura effettiva. Il nastro riscaldante deve anche essere maneggiato con cura in quanto la sua temperatura aumenta molto rapidamente. Riscaldamento continuo può danneggiare l'apparecchiatura e siringhe, a causa del ritardo di tempo del termostato per l'aggiornamento della temperatura misurata. - Una volta che la temperatura è superiore a 51 gradi centigradi, eseguire le pompe di siringhe premendo Run All nel software di controllo della pompa (Figura 3).
- Assicurarsi che il flusso di fluido sia privo di bolle d'aria e di eventuali perdite. Smaltire il volume iniziale (circa 0,5 mL) di liquido dalla presa come rifiuto.
NOTA: Questo volume di rifiuti iniziale non è definito e dipende dal volume interno dell'installazione, ovvero il volume per il fluido per viaggiare dalle siringhe attraverso il tubo e SHM alla presa. - Raccogliere il resto del liquido come campioni di liposoma in un tubo di microcentrifuga o fiala bijou.
- Mettere in pausa/arrestare l'infusione quando il liquido in una delle siringhe è quasi vuoto.
NOTA: Le pompe devono essere fermate manualmente, poiché le pompe potrebbero non rilevare con precisione la posizione quando le siringhe sono vuote. - Collocare le soluzioni liposomiche raccolte in un bagno d'acqua di 60 gradi per anneal per 1,5 h.
NOTA: Questo passaggio è essenziale per consentire il caricamento di farmaci nei liposomi. - Trasferire le soluzioni ai tubi di dialisi. Dialyze le soluzioni contro 1 L di 240 mM (NH4)2SO4 a 37 s per almeno 4 h per ottenere liposomi purificati.
NOTA: il protocollo può essere messo in pausa qui. I liposomi in questa fase sono a 5 mM di fosfolipidi. I liinfoani purificati possono essere conservati a 4 gradi centigradi. - Per pulire lo SHM per un uso ripetuto, lavare lo SHM in sequenza con acqua deionizzata, etanolo e secco con gas di azoto.
3. Caricamento remoto di DOX in LTSLs con gradiente di pH transmembrana
- Scambiare buffer esterno di LTSL a HEPES-buffered saline (HBS) utilizzando la cromatografia di esclusione di dimensioni (SEC) per stabilire un gradiente di pH transmembrana.
- Aggiungere un totale di 25 mL di HBS nella parte superiore di una colonna SEC per preparare la colonna. Lasciare che tutto eluente elute attraverso la colonna e smaltire l'eluato.
- Aggiungere 1 mL di liposomi dialisti, preparati dal punto 2.12, alla colonna e smaltire l'elute.
- Aggiungere 1,5 mL di HBS alla colonna ed eliminare l'elute.
- Aggiungere 3 mL di HBS alla colonna e raccogliere il 3 mL di elute.
NOTA: il protocollo può essere messo in pausa qui. I liposomi vengono raccolti in questa fase e sono a 1,67 mM di fosforiide. I liposomi scambiati buffer possono essere conservati a 4 gradi centigradi.
- Incubare i LTSL con doxorubicin (DOX) e purificare i LTSL.
- Aggiungi la soluzione DOX in 1:20 rapporto molare DA DOX a fosforolipilide in 1 mL di soluzione liposomi scambiata tampone (1,67 mmol) contenuta in una fiala bijou. Ciò può essere ottenuto aggiungendo una soluzione DOX di 1 mg/mL (83,4 ml).
- Mettere la fiala bijou in un bagno d'acqua di 37 gradi centigradi per 1,5 h per consentire il caricamento DOX nei liposomi.
- Mescolare 10 l dei liposomi con 170 luna di HBS e 20 -L di 1% (v/v) Triton X-100 soluzione in una piastra nera 96-bene. Ripetere per tre pozze. Questi pozzi corrispondono al contenuto DOX "prima della purificazione".
- In caso di preparazione del LTSL10-ICG, mescolare 40 - L dei liposomi con 160 L di DMSO in una piastra chiara 96-well. Ripetere per tre pozze. Questi pozzi corrispondono al contenuto ICG "prima della purificazione".
- Purificare la soluzione lipososo come descritto nel passaggio 3.1.
NOTA: per riutilizzare la colonna per una futura purificazione, pulire la colonna dal DOX gratuito aggiungendo prima 1 mL di soluzione NaOH diluita prima di eseguire il passaggio 3.1.1. DoX gratuito in rosso diventerà viola-blu ed eluire attraverso la colonna rapidamente. - Mescolare 30 l della soluzione di liposomi purificati con 150 gradi l di HBS e 20 -L di 1% (v/v) Soluzione Triton X-100 in una piastra nera 96-well. Ripetere per tre pozze. Questi pozzi corrispondono al contenuto DOX "dopo la purificazione".
- In caso di LTSL10-ICG, mescolare 40 l della soluzione di liposomi purificati con 160 L di DMSO in una piastra chiara di 96 pozze. Ripetere per tre pozze. Questi pozzi corrispondono al contenuto ICG "dopo la purificazione".
- Misurare l'intensità di fluorescenza DOX dei pozzi prima (passaggio 3.2.3) e dopo la purificazione (passaggio 3.2.5) utilizzando un lettore di microplacio (seziones .
- Calcolare l'efficienza di incapsulamento di DOX (DOX EE) prendendo il rapporto delle intensità di fluorescenza prima e dopo la purificazione.
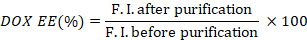
- Misurare l'assorbimento ICG dei pozzi prima e dopo la purificazione, utilizzando un lettore di micropla (600 a 1000 nm).
- Calcolare l'efficienza di incapsulamento di ICG (ICG EE) tenendo il rapporto tra assorbimento a 792 nm prima e dopo la purificazione, tenendo conto del fattore di diluizione (3 volte) durante la purificazione.

4. Dispersione dinamica della luce (DLS)
- Aggiungete 50 - L di liposomi (passaggio 2,12) a 450 -L di acqua deionizzata.
- Posizionare la cuvette all'interno dello strumento DLS ed eseguire la misurazione secondo le istruzioni del produttore.
- Registrare il diametro medio medio di z e la dispersione di tre misure per ogni campione.
5. Calorimetria di scansione differenziale (DSC)
- Concentrare 1 mL dei campioni di liposomi (passaggio 2.12) con un'unità di filtro centrifuga a 0,5 mL (concentrazione lipidica finale di 10 mM). Utilizzando un rotore ad angolo fisso, girare a 7500 x g per circa 15 min.
- Trasferire 20 -L di (NH4)2campioni di soluzione SO4 e liposomi su due rispettive pentole DSC. Sigillare le pentole con coperchi ermetici DSC utilizzando il kit di pressa campione DSC.
- Misurare il campione da 30 a 60 gradi centigradi ad una velocità di riscaldamento di 1 oC/min utilizzando un calorimetro a scansione differenziale.
- Analizzare i dati con il software appropriato. Prendere la temperatura di transizione di fase (Tm)come l'inizio della transizione di fase (picco di fusione), che viene misurata dall'intercetta x della tangente del punto di pendenza massima.
6. Rilascio di Doxorubicina
- Preriscaldare l'HBS a temperatura designata (37 o 42 gradi centigradi) utilizzando un bagno d'acqua. Preparare un bagno d'acqua ghiacciata per sgranocchiare i campioni.
- Aggiungere 100 l di liposomi puri carichi DOX (passaggio 3.2.5) in 1,9 mL di HBS in un tubo di microcentrifuga. Collocare il tubo nel bagno d'acqua della temperatura designata.
- Ritirare immediatamente 200 l di campioni dal tubo e posizionarlo rapidamente nel bagno d'acqua ghiacciata per placare qualsiasi successivo rilascio di droga. L'esempio corrisponde al punto temporale iniziale (t - 0).
- Ritirare 200 l di campioni nei momenti successivi (t : 5, 10, 15, 30, 60 min) e posizionarlo rapidamente nel bagno d'acqua ghiacciata per placare qualsiasi rilascio di droga.
- Mescolare 50 l di campione di ogni punto temporale con 150 gradi l di HBS in una piastra nera di 96 pozze. Misurare l'intensità di fluorescenza DOX utilizzando un lettore di piastre.
- Aggiungete 20 L dell'1% (v/v) Triton X-100 in pozzi selezionati casuali preparati al punto 6.5. Misurare l'intensità di fluorescenza DOX di questi pozze utilizzando un lettore di piastre. Questi valori corrispondono al punto di tempo completamente rilasciato (t ] e versione 100%.
- Calcolare e tracciare la percentuale di DOX rilasciata interpolando l'intensità della fluorescenza di ogni punto temporale (I(t)), rispetto al valore iniziale (I(0)) e completamente rilasciato (I(z)).
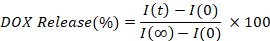
7. Riscaldamento laser e rilascio innescato
- Impostare la temperatura del bagno d'acqua a 37 gradi centigradi e lasciare che la temperatura si stabilizzi.
- Aggiungete 200 l di LTSL10-ICG caricato da DOX ([ICG] - 10 g/mL) a una piastra chiara da 96 pozze, quindi posizionatela nel bagno d'acqua, tenete il fondo immerso in acqua.
- Impostare la corrente del sistema laser su 2,27 A. Posizionare il collimatore del sistema laser a 5 cm verticalmente sopra la superficie della piastra di 96 pozzetti, che corrisponde a un flusso di energia di 0,5 W/cm2 [Figura 6].
AVVISO: Il sistema laser deve essere azionato in conformità con le misure di sicurezza laser pertinenti. - Accendere il laser e monitorare la temperatura ogni minuto utilizzando una sonda di temperatura in fibra ottica.
- A 5 e 10 min, prelevare 10 l di liposomi irradiati al laser dalla piastra chiara 96-well a e mescolare con 190 L di HBS per tre pozze in una piastra nera 96-po.
- Mescolare 10 l dei liposomi con 170 luna di HBS e 20 L della soluzione Triton X-100 dell'1% (v/v) per tre pozzetti in una piastra nera 96 pozze. Questi pozzi corrispondono al contenuto DOX "100% rilasciato". Misurare l'intensità fluorescente DOX e calcolare il rilascio DOX come descritto nel passaggio 6.7.
Access restricted. Please log in or start a trial to view this content.
Risultati
La preparazione di LTSL mediante microfluidica richiede la composizione lipidica di DPPC/MSPC/DSPE-PEG2000 (80/10/10, rapporto molare; LTSL10). Figura 7A (sinistra) mostra l'aspetto di LTSL10 preparato dal passaggio 2.9, come un liquido chiaro e non viscoso. La formulazione LTSL10 è sviluppata a partire dalla formulazione convenzionale, LTSL4 (DPPC/MSPC/DSPE-PEG2000, 86/10/4, rapporto molare) poiché LTSL4 forma un camp...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il protocollo presentato descrive la preparazione di liposomi sensibili alla bassa temperatura (LTSL) utilizzando un micromixer a spina di pesce sfalsato (SHM). La formulazione LTSL10 consente il rilascio di scoppio innescato dalla temperatura di doxorubicina entro 5 minuti ad una temperatura ipertermica clinicamente raggiungibile di 42 gradi centigradi. Indocyanina verde (ICG) può anche essere co-caricato per il riscaldamento fototermico innescato il rilascio di DOX. Il metodo si basa su: (i) auto-assemblaggio di fosfo...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Prostate Cancer UK (CDF-12-002 Fellowship) e l'Ingegneria e scienze fisiche research Council (EPSRC) (EP/M008657/1) per il finanziamento.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
Riferimenti
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon