È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un modello murino indotto da doxorubicina di cardiomiopatia dilatativa in vivo
In questo articolo
Erratum Notice
Riepilogo
È descritto un protocollo per stabilire un modello di cardiomiopatia dilatativa indotta da doxorubicina (DCM) nei topi tramite iniezione intraperitoneale a lungo termine di doxorubicina.
Abstract
La cardiomiopatia dilatativa (DCM) si riferisce a uno spettro di disturbi miocardici eterogenei caratterizzati da dilatazione ventricolare e prestazioni cardiache depresse in assenza di ipertensione, cardiopatie valvolari, congenite o ischemiche e che possono essere correlati a infezioni, anomalie autoimmuni o metaboliche o ereditarietà familiare. Può progredire in insufficienza cardiaca congestizia con una prognosi sfavorevole. La doxorubicina (Dox) è ampiamente impiegata come farmaco chemioterapico, ma il suo uso è limitato perché provoca cambiamenti simili a DCM del miocardio. La sua tossicità miocardica è attribuita allo stress ossidativo, all'infiammazione cronica e all'apoptosi cardiomiocitaria. Non è stato stabilito un modello di DCM che sfrutti questi sintomi di DCM indotti da Dox.
Introduzione
Una delle cause più comuni di insufficienza cardiaca, DCM è caratterizzata da dilatazione ventricolare e diminuzione della funzione cardiaca ed è la ragione più comune per il trapianto di cuore in tutto il mondo1. Al fine di indagare ulteriormente la sua patogenesi e trovare trattamenti efficaci, l'accesso a modelli animali maturi è particolarmente importante. Lo scopo degli esperimenti descritti è quello di stabilire un modello murino stabile di DCM che assomigli al DCM umano.
A causa della complessa patogenesi del DCM, ci sono molti metodi diversi per realizzare modelli animali corrispondenti. I modelli DCMspontanei 2 sono relativamente stabili, ma sono costosi e non facilmente disponibili. I modelli animali geneticamente modificati3 non sono ben consolidati e richiedono un uso più sperimentale. I modelli animali DCM indotti da infezione virale4 o difetti autoimmuni5 sono facili da ottenere, ma non sono del tutto rappresentativi del DCM. I modelli associati alla tossicità miocardica includono modelli DCM indotti da alcol e modelli animali DCM indotti da Dox.
Il modello di cardiomiopatia indotta da Dox è ottenuto mediante iniezione intraperitoneale di Dox6. Il modello sfrutta l'effetto collaterale cronico più grave di Dox: dopo l'esposizione a Dox, i pazienti sviluppano sintomi di DCM ad esordio tardivo con uniformità clinica7. Lo stress ossidativo indotto da Dox8 e il danno mitocondriale9, che portano all'apoptosi cardiomiocitaria, sono sintomi nella patogenesi del DCM. Esistono modelli di trattamento Dox acuti e cronici: una singola dose elevata di Dox (15 mg/kg) induce un modello a breve termine per la cardiomiopatia10,mentre iniezioni ripetitive di Dox a basso dosaggio (sei settimanali, 3 mg/kg) inducono un modello a lungo termine per la cardiomiopatia11. Sulla base dello studio presentato, i topi wild type iniettati per via intraperitoneale una volta alla settimana per un mese alla dose di 5 mg/kg mostrano morfologia e istologia del cuore coerenti con le caratteristiche del DCM entro la fine del trattamento, fornendo un modo ideale per stabilire un modello DCM.
Protocollo
Gli esperimenti sugli animali sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) del Nanjing Drum Tower Hospital.
1. Preparazione dei reagenti e degli animali
- Sciogliere la doxorubicina cloridrato (Pfizer, USA) in acqua sterilizzata. Vortice per ottenere una soluzione di Dox di 1 mg/mL e mantenere a 4 °C.
- Utilizzare topi C57BL/6 (8-10 settimane di età; 25-30 g di peso). Per questo studio, i topi sono stati acquistati dal Model Animal Research Center dell'Università di Nanchino e tenuti nella stanza degli animali del Nanjing Drum Tower Hospital.
- Le gabbie per topi prive di agenti patogeni sono state mantenute sotto un ciclo luce/buio di 12 ore a una temperatura costante di 23 °C. Tutti gli animali sono stati nutriti con una normale dieta chow e hanno ricevuto cibo e acqua ad libitum.
2. Istituzione del modello animale DCM
- Randomizzare i topi in un gruppo normale (n = 5) e dox (n = 5).
- Somministrare la soluzione di Dox per via intraperitoneale alla dose di 5 mg/kg utilizzando una siringa sterilizzata da 1 mL 1 volta a settimana per il gruppo Dox. Trattare i topi di controllo allo stesso modo con la stessa quantità di soluzione salina.
- Misurare il peso corporeo dei due gruppi settimanalmente. Di conseguenza, aggiustare la dose di iniezione in base al peso corporeo settimanalmente per un totale di 4 settimane, con una dose cumulativa di 20 mg/kg (Figura 1).
NOTA: È stato scelto un periodo di tempo di 4 settimane perché l'ecocardiografia a 4 settimane ha mostrato una differenza significativa nella funzione cardiaca tra i due gruppi.
3. Esame ecocardiografico
- Alla fine della quarta settimana, condurre un esame ecocardiografico dei topi.
- Anestetizzare i topi con il 2% di isoflurano per via intranasale. Se i topi non rispondono a un pizzico di pelle con una pinzetta dentata o stimolando le dita dei piedi e la coda, continuare con il protocollo.
- Posizionare il mouse su una piattaforma di manipolazione degli animali in posizione supina. Per mantenere l'anestesia, coprire il naso e la bocca dell'animale con un cono nasale e fornire il 2% di isoflurano.
NOTA: Per l'anestesia IP, iniettare il 4% di idrato di cloralio alla dose di 0,2 ml/20 g. - Rimuovere accuratamente la pelliccia del torace con un rasoio elettrico. Valutare la funzione cardiaca in vivo utilizzando l'ecocardiografia transtoracica.
- Eseguire l'ecocardiogramma LV sia nell'asse lungo parasternale che nell'asse corto ad un frame rate di 233 Hz. Le dimensioni sistolica e diastolica finale sono state definite come le fasi corrispondenti rispettivamente all'onda T ECG e all'onda R.
- Sui tracciati in modalità M, misurare il diametro medio sistolico finale LV (LVIDd), il diametro diastolico terminale LV (LVID), lo spessore del setto interventricolare (IVS) e lo spessore della parete posteriore LV (LVPW) da 3-5 battiti cardiaci. Calcola anche la frazione di eiezione (EF) e l'accorciamento della frazione (FS) in base all'ecocardiografia.
4. Colorazione istologica
- Dopo l'analisi ecocardiografica, sacrificare i topi con l'iniezione intraventricolare di cloruro di potassio al 10%.
- Perfondere il cuore con circa 30 ml di soluzione salina dopo la dissezione fino a quando il fegato e il polmone diventano pallidi.
- Asportare il cuore e lavarlo accuratamente in soluzione tampone fosfato per estrudere il sangue.
- Fissare il cuore in formalina al 4% a temperatura ambiente per 24 ore e trattare il tessuto in una scatola di paraffina in modo che la cera di paraffina si raffreddi e si solidifichi.
- Tagliare i cuori in fette spesse 5 μm per la colorazione patologica.
- Decerazione e sezioni reidratate contenenti muscolo papillare.
- Incubare i vetrini a 55 °C per 30 min. Quindi, incubare in xilene 2 volte per 2 minuti ciascuno; 100% etanolo 2x per 2 minuti ciascuno; 95% di etanolo 2x per 2 minuti ciascuno; 80% di etanolo per 2 min; 75% di etanolo per 2 min; e 50% di etanolo per 2 min.
- Macchiare con ematossilina ed eosina (H & E) e la macchia di Masson.
Risultati
Funzione cardiaca
La cardiomiopatia dilatativa è caratterizzata da progressiva dilatazione ventricolare e disfunzione contrattile. La Figura 2 mostra immagini ecocardiografiche rappresentative dei due gruppi. I topi trattati con Dox hanno mostrato una frazione di eiezione ventricolare sinistra marcatamente ridotta e un accorciamento frazionario ventricolare sinistro (Figura 3A,B). Il diametro LV è aumentato anche nella fase...
Discussione
Dox è un farmaco chemioterapico antitumorale periodico non specifico comunemente usato nella pratica clinica12. Il suo principale effetto collaterale è la cardiotossicità, caratterizzata da cardiomiopatia e successiva insufficienza cardiaca13. Il meccanismo sottostante include il danno della perossidazione lipidica miocardica, l'inibizione del reticolo sarcoplasmatico miocardico Ca2+-ATPasi e l'attivazione del sistema renninico-angiotensina locale miocardico, ...
Divulgazioni
Nessun conflitto di interessi dichiarato.
Riconoscimenti
Questo lavoro è stato supportato da Key Project Medical Science and Technology Development Foundation, Nanjing Department of Health (No.YKK16098).
Materiali
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | servicebio | CAS30525-89-4 | |
| C57BL/6 mice | Model Animal Research Center of Nanjing University | \ | |
| Doxorubicin hydrochloride | Pfizer | CAS25316-40-9 | |
| echocardiography | Visualsonics | \ | |
| Hematoxylin and Eosin staining kit | Solarbio | G1120 | |
| Masson staining kit | Solarbio | G1343 | |
| phosphate buffer solution | Sigma | P5368 | |
| potassium chloride | Sigma | CAS7447-40-7 | |
| sterilized syringe | Millipore | SLGP033RB |
Riferimenti
- Weintraub, R. G., Semsarian, C., MacDonald, P. Dilated cardiomyopathy. Lancet. 390 (10092), 400-414 (2017).
- Ichihara, S., et al. Attenuation of oxidative stress and cardiac dysfunction by bisoprolol in an animal model of dilated cardiomyopathy. Biochemical and Biophysical Research Communications. 350 (1), 105-113 (2006).
- Fountoulakis, M., et al. Alterations in the heart mitochondrial proteome in a desmin null heart failure model. Journal of Molecular and Cellular Cardiology. 38 (3), 461-474 (2005).
- Fairweather, D., Rose, N. R. Coxsackievirus-induced myocarditis in mice: a model of autoimmune disease for studying immunotoxicity. Methods. 41 (1), 118-122 (2007).
- Wang, Z. H., et al. A therapeutic anti-CD4 monoclonal antibody inhibits T cell receptor signal transduction in mouse autoimmune cardiomyopathy. Chinese Medical Journal. 120 (15), 1319-1325 (2007).
- Riad, A., et al. Toll-like receptor-4 deficiency attenuates doxorubicin-induced cardiomyopathy in mice. European Journal of Heart Failure. 10 (3), 233-243 (2008).
- Kankeu, C., Clarke, K., Passante, E., Huber, H. J. Doxorubicin-induced chronic dilated cardiomyopathy-the apoptosis hypothesis revisited. Journal of Molecular Medicine. 95 (3), 239-248 (2017).
- Zhao, L., et al. MicroRNA-140-5p aggravates doxorubicin-induced cardiotoxicity by promoting myocardial oxidative stress via targeting Nrf2 and Sirt2. Redox Biology. 15, 284-296 (2018).
- O'Connell, J. L., et al. Short-term and long-term models of doxorubicin-induced cardiomyopathy in rats: A comparison of functional and histopathological changes. Experimental and Toxicologic Pathology. 69 (4), 213-219 (2017).
- Yuan, Y. P., et al. CTRP3 protected against doxorubicin-induced cardiac dysfunction, inflammation and cell death via activation of Sirt1. Journal of Molecular and Cellular Cardiology. 114, 38-47 (2018).
- Sun, Z., et al. The TGF-beta pathway mediates doxorubicin effects on cardiac endothelial cells. Journal of Molecular and Cellular Cardiology. 90, 129-138 (2016).
- Minotti, G., Menna, P., Salvatorelli, E., Cairo, G., Gianni, L. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacological Reviews. 56 (2), 185-229 (2004).
- Vejpongsa, P., Yeh, E. T. Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. Journal of The American College of Cardiology. 64 (9), 938-945 (2014).
- Renu, K., V, G. A., P, B. T., Arunachalam, S. Molecular mechanism of doxorubicin-induced cardiomyopathy - An update. European Journal of Pharmacology. 818, 241-253 (2018).
Erratum
Formal Correction: Erratum: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo
Posted by JoVE Editors on 11/04/2021. Citeable Link.
An erratum was issued for: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo. A figure was updated.
Figure 1 was updated from:
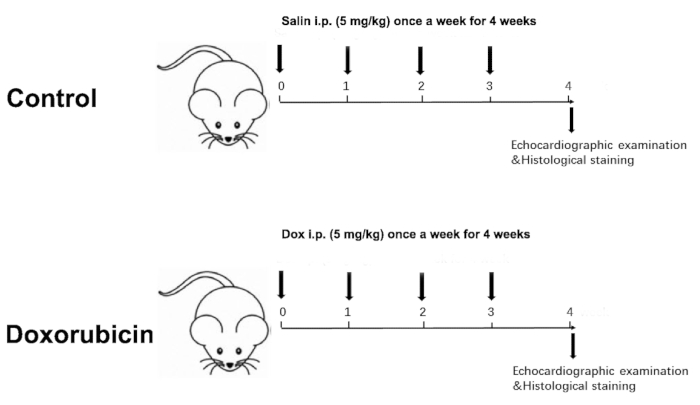
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
to:
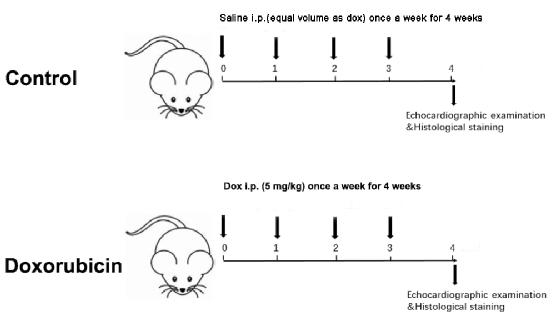
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon