È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione dell'ossidazione cellulare utilizzando una proteina fluorescente verde sensibile al comparto subcellulare
In questo articolo
Riepilogo
Questo protocollo descrive la valutazione dello stato di redox subcellulare specifico del compartimento all'interno della cella. Una sonda fluorescente redox-sensibile consente una comoda analisi ratiometrica nelle cellule intatte.
Abstract
Misurare l'equilibrio di ossidazione/riduzione intracellulare fornisce una panoramica dello stato di redox fisiologico e/o patofisiologico di un organismo. I thiol sono particolarmente importanti per illuminare lo stato di ripetizione delle cellule attraverso i loro rapporti dithiol ridotti e disulfide ossidati. Le proteine fluorescenti contenenti cisteina ingegnerizzate aprono una nuova era per i biosensori sensibili ai redox. Una di queste, la proteina fluorescente verde sensibile alla redox (roGFP), può essere facilmente introdotta nelle cellule con trasduzione adenovirale, consentendo di valutare lo stato di ripetizione dei compartimenti subcellulari senza interrompere i processi cellulari. Cistein e cistino ossidati di roGFP hanno massimali di eccitazione a 488 nm e 405 nm, rispettivamente, con emissione a 525 nm. La valutazione dei rapporti di queste forme ridotte e ossidati consente il comodo calcolo dell'equilibrio redox all'interno della cella. In questo articolo di metodo, le cellule umane di cancro al seno tripla-negativa (MDA-MB-231) sono state utilizzate per valutare lo stato di redox all'interno della cellula vivente. I passaggi del protocollo includono la trasduzione della linea cellulare MDA-MB-231 con adenovirus per esprimere il citosolico roGFP, il trattamento con H2O2e la valutazione del rapporto di cisteina e cistina con la citometria del flusso e la microscopia a fluorescenza.
Introduzione
Lo stress ossidativo è stato definito nel 1985 da Helmut Sies come "un disturbo nell'equilibrio proossidante-antiossidante a favore del primo"1, ed è stata condotta una pletora di ricerca per ottenere lo stato di ridonazione della malattia1,2,3. Da allora, la comprensione dello stress ossidativo è diventata più ampia. Testare le ipotesi di utilizzare antiossidanti contro malattie e/o invecchiamento ha dimostrato che lo stress ossidativo non solo provoca danni, ma ha anche altri ruoli nelle cellule. Inoltre, gli scienziati hanno dimostrato che i radicali liberi svolgono un ruolo importante per la trasduzione del segnale2. Tutti questi studi rafforzano l'importanza di determinare i cambiamenti nel rapporto riduzione-ossidazione (redox) delle macromolecole. L'attività enzimatica, gli antiossidanti e/o gli ossidanti e i prodotti di ossidazione possono essere valutati con vari metodi. Tra questi, i metodi che determinano l'ossidazione del tiolo sono probabilmente i più utilizzati perché riferiscono sull'equilibrio tra antiossidanti e proossidanti nelle cellule, così come gli organismi4. In particolare, i rapporti tra glutathione (GSH)/glutathione disulfide (GSSG) e/o cisteina (CyS)/cistine (CySS) sono utilizzati come biomarcatori per monitorare lo stato di redox degli organismi2.
I metodi utilizzati per analizzare l'equilibrio tra proossidanti e antiossidanti si basano principalmente sui livelli di proteine ridotte/ossidizzate o piccole molecole all'interno delle cellule. Le macchie occidentali e la spettrometria di massa sono utilizzate per valutare ampiamente i rapporti di macromolecole ridotte/ossidati (proteine, lipidi, ecc.), e i rapporti GSH/GSSG possono essere valutati con spettrofotometria5. Una caratteristica comune di questi metodi è la perturbazione fisica del sistema da parte della lisi cellulare e/o omogeneizzazione dei tessuti. Queste analisi diventano anche difficili quando è necessario misurare lo stato di ossidazione di diversi compartimenti cellulari. Tutte queste perturbazioni causano artefatti nell'ambiente di assaggio.
Le proteine fluorescenti redox-sensibili hanno aperto un'era vantaggiosa per valutare l'equilibrio redox senza causare disturbi nelle cellule6. Possono colpire diversi compartimenti intracellulari, permettendo la quantificazione delle attività specifiche del compartimento (ad esempio, secondo lo stato di ripetizione dei mitocondri e del citosol) per studiare il crosstalk tra organelli cellulari. Le proteine fluorescenti gialle (YFP), le proteine fluorescenti verdi (GFP) e le proteine HyPeR sono esaminate da Meyer e colleghi6. Tra queste proteine, GFP sensibile al redox (roGFP) è unica a causa delle diverse letture fluorescenti del suo CyS (ad es. 488 nm/em. 525 nm) e CySS (ex. 405 nm/525 nm) residui, che consentono l'analisi ratiometrica, a differenza di altre proteine sensibili ai redox come YFP7,8. L'output ratiometrico è utile perché controbilancia le differenze tra i livelli di espressione, le sensibilità al rilevamento e il fotosbiancamento8 . Comparti subcellulari di cellule (citosol, mitocondri, nucleo) o organismi diversi (batteri e cellule di mammiferi) possono essere presi di mira modificando roGFP7,9,10.
I test roGFP sono condotti utilizzando tecniche di imaging fluorescente, in particolare per esperimenti di visualizzazione in tempo reale. Le analisi citometriche a flusso dei roGP sono possibili anche per esperimenti con punti temporali predeterminati. L'articolo corrente descrive sia l'uso della microscopia fluorescente e della citometria di flusso per eseguire una valutazione ratiometrica dello stato di redox nelle cellule dei mammiferi che sovraesprimono roGFP (mirato al citosol) attraverso la trasduzione adenovirale.
Access restricted. Please log in or start a trial to view this content.
Protocollo
NOTA: questo protocollo è stato ottimizzato per le celle MDA-MB-231 confluenti 70%-80%. Per altre linee cellulari, il numero di cellule e la molteplicità di infezione (MOI) dovrebbero essere ottimizzati nuovamente.
1. Preparazione delle cellule (giorno 1)
- Mantenere la linea cellulare MDA-MB-231 in flaconi da 75 cm2 con 10 mL del mezzo Eagle (DMEM) modificato di Dulbecco, integrato con 10% di siero bovino fetale (FBS) a 37 gradi centigradi in un'atmosfera umidificata di CO2 del 5%.
NOTA: per tutte le incubazioni di attacco e trattamento vengono utilizzati DMEM integrati con 10% di FBS, 37 gradi centigradi e un'atmosfera umidizzata di CO2 del 5% per tutte le incubazioni di attaccamento e trattamento durante l'intero protocollo. - Preparare le cellule MDA-MB-231 per l'esperimento.
- Aspirare il mezzo all'interno del pallone, staccare le cellule con 2 mL di 0,25% soluzione trypsin-EDTA per 2 min e disattivare l'attività della trypsin con 6 mL di mezzo completo (DMEM con 10% FBS). Centrifugare le cellule a 150 x g per 5 min. Aspirate the supernatant e sospendere le cellule in 5 mL di mezzo completo.
- Mescolare una sospensione cellulare di volume uguale e 0.4% trypan blu. Prendere 10 l di questa miscela e contare le cellule con il contatore cellulare automatizzato.
NOTA: Un contatore Coulter o un emocitometro può essere utilizzato anche per il conteggio delle celle. - Semina le cellule in una piastra di 6 pozzetti per analisi della citometria a flusso e semina 150.000 cellule in 1 mL di mezzo per pozzo. Attendere 16 h per l'allegato della cella.
- Semina le cellule in uno scivolo a 4 camere per l'imaging fluorescente e ne semi 25.000 cellule in 0,5 mL di mezzo per pozzo. Attendere 16 h per l'allegato della cella.
NOTA: I pozzi di controllo dei semi oltre ai pozzi di trattamento. Utilizzare uno dei pozze di controllo per determinare il numero di cella (facoltativo: se il periodo di associazione per le celle è più breve del tempo di raddoppio, si può presumere che il numero di cella sia lo stesso della densità di semina) e l'altro per un controllo non infetto (0 MOI).
2. Trasduzione roGFP adenovirale (giorno 2 e 3)
AVVISO: Gli adenovirus possono causare malattie. Durante la trasduzione delle cellule, utilizzare punte filtrate e punte di decontaminazione, pipette Pasteur e tubi di microcentrifuga con 10% candeggina.
NOTA: Questo protocollo è stato dimostrato con il roGFP specifico del citosol, ma altri compartimenti cellulari (ad esempio, mitocondri o spazio intermembrano mitocondriale) possono essere mirati con questo stesso protocollo.
- Generare una curva di risposta alla dose affinché il MOI ottenga la massima efficienza di trasduzione calcolando il volume di adenovirus (mL) necessario per ogni valore MOI per la linea cellulare MDA-MB-231(Tabella 1):
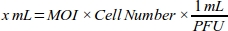
NOTA: il titer funzionale di ogni lotto di stock adenovirale, che si esprime come unità di formazione della placca (PFU) per mL, è fornito dalla società. Il MOI ottimale per la trasduzione differisce tra i tipi di cellule. Per la maggior parte delle cellule di mammiferi, l'intervallo MOI ottimale è compreso tra 10 e 300. Secondo la risposta cellulare, i valori di MOI dovrebbero essere ricalcolati (ad esempio, l'intervallo di MOI dovrebbe essere ridotto se le cellule hanno una risposta citototossica, o l'intervallo deve essere aumentato se le cellule hanno bassa efficienza di trasduzione). - Effettuare la diluizione 1:100 di 6 x10 10 PFU/mL adenoviral roGFP soluzione con supporto di coltura cellulare (DMEM con 10% FBS) per pipettaggio affidabile.
- Pipetta e aggiungere 0,0125 mL (12,5 l), 0,025 mL (25), 0,05 mL (50 ) di diluizione roGFP adenovirale in ogni pozzetto del pozzo 6 per trasdurre le 150.000 cellule con 50, 100 e 200 MOI rispettivamente per l'analisi del flusso1.
- Pipetta e aggiungere 0,0042 mL di diluizione adenovirale roGFP nei pozze scorrevoli a 4 camere per trasducire 25.000 cellule con 100 MOI per l'imaging a fluorescenza (Tabella 1).
NOTA: Nei pozzetti deve essere utilizzata una quantità minima di supporto per garantire la massima interazione tra il costrutto roGFP adenovirale e le cellule. Il contenuto del siero del mezzo di coltura potrebbe essere necessario diminuire per diverse linee cellulari perché alti livelli di siero possono influenzare negativamente l'efficienza della trasduzione in alcuni tipi di cellule. - Incubare cellule per 16-24 h in condizioni di manutenzione cellulare. Il giorno successivo (giorno 3), cambiare il mezzo di coltura medio-cellulare (DMEM con 10% FBS) per consentire il recupero cellulare per un ulteriore 24 h. Visualizzare le cellule al microscopio per valutare la loro morfologia; possono esprimere roGFP anche se hanno cambiamenti morfologici.
NOTA: Il giorno 3, le cellule dovrebbero iniziare ad esprimere roGFP; pertanto, l'efficienza della trasduzione può essere monitorata mediante microscopia a fluorescenza (filtri con ex. 488/em. 525). Per ottenere risultati di analisi coerenti, essere consapevoli e documentare i cambiamenti morfologici al microscopio a contrasto di fase e osservare la morfologia durante la valutazione dell'efficienza della trasduzione. - Costruire una curva di risposta alla dose utilizzando i campioni di MOI da 50, 100 e 200 preparati nel passaggio 2.3 e i risultati di efficienza della trasduzione ottenuti dall'analisi della citometria di flusso (passaggi 3.1 e 4.1). Valutare l'efficienza di trasduzione ottimale con la documentazione dei cambiamenti morfologici (passaggio 2.5) e la curva dose-risposta di MOI.
NOTA: Anche se più del 98% della popolazione cellulare a 100 MOI e 200 MOI express roGFP (vedi risultati rappresentativi), 200 il gruppo MOI ha mostrato cambiamenti sostanziali nella morfologia cellulare delle cellule MDA-MB-231. Di conseguenza, il MOI più efficace per le cellule MDA-MB-231 è stato determinato per essere 100 MOI. - Dopo che il MOI ottimale (qui, 100 MOI) è stato scelto per la linea cellulare MDA-MB-231, condurre esperimenti con materiali di prova (10 H2O2 e il suo veicolo 0.1% dell'acqua deionizzata).
- Preparare e semare le cellule in base alla sezione 1. Utilizzando il volume di trasduzione adenovirale per 100 MOI calcolato al passo 2.1, ripetere i passaggi 2.2.2.4 per 100 trasduzione adenovirale MOI delle cellule. Quindi incubare la piastra e i vetrini della camera secondo il punto 2.5.
3. Acquisizione del saldo CyS/CySS
- Citometria di flusso (giorno 4)
- Il giorno 4, incubare le cellule dal passo 2.7.1 con 10 sM H2O2 per 1 h.
NOTA: 10 M H2O2 è stato utilizzato come sostanza di prova e lo 0,1% di acqua deionizzata è stata utilizzata come trattamento del veicolo in questo protocollo. Altri agenti ossidanti possono essere utilizzati come controlli positivi qui. - Aspirare i supporti della piastra 6 del pozzo, sostituire con 750 - L di 0,25% soluzione trypsin-EDTA e attendere 2 min per il distacco delle cellule. Inattivare la trypsin con 2 mL di mezzo completo (DMEM con 10% FBS) e raccogliere il volume in tubi conici da 15 mL.
- Centrifugare i tubi a 150 x g per 5 min a 4oC. Scartare supernatante e sospendere le cellule in 500 - L di salina con buffer fosfato (PBS).
- Ripetere il passaggio 3.1.3
- Filtrare le sospensioni cellulari in tubi compatibili con la citometria di flusso utilizzando una rete da 40 m. Tenere i tubi sul ghiaccio e lontano dalla luce e seguire il passaggio 4.1 per l'analisi dei dati.
- Il giorno 4, incubare le cellule dal passo 2.7.1 con 10 sM H2O2 per 1 h.
- Immagini microscopiche (giorno 4)
- Il giorno 4, trattare le cellule con 10 M H2O2, acquisire le immagini immediatamente (punto temporale 0) e 1 h dopo il trattamento e seguire il passaggio 4.2 per l'analisi dei dati.
4. Analisi dei dati
- Quantificazione della citometria di flusso
- Impostare il metodo di citometria di flusso per 3 diverse analisi tramite software di acquisizione di campioni (vedere Tabella dei materiali):dispersione in avanti (FCS) sull'asse x e dispersione laterale (SSC) sull'asse y per valutare le dimensioni delle celle e la complessità delle celle (SSC può essere utilizzato per l'identificazione approssimativa di celle morte e vive); 488 nm/em. Filtro a banda 525 nm (fluorescein isothiocyanate [FITC]) sull'asse x e SSC sull'asse y per valutare CyS-roGFP; 405 nm/em. Filtro a banda 525 nm (Brilliant Violet 510 [BV510]) sull'asse x e SSC sull'asse y per valutare CySS-roGFP.
- Acquisisci 0 controllo MOI e visualizza le celle con il software di acquisizione dei campioni. Ripetere questo passaggio per i campioni rimanenti (50, 100, 200 gruppi MOI e successivamente 10 m H2O2 cellule trattate e celle trattate dal veicolo). Salvare i file per l'analisi dei dati.
- Aprire il software di analisi dei dati (vedere Tabella dei materiali)e aprire il file di esempio 0 MOI. Valutare la popolazione cellulare di interesse (Gate 1). Impostare le seguenti gatings per ridurre al minimo la fluorescenza in background per ex. 488 nm/em. 525 nm (Gate 2) ed ex. 405 nm/em. Filtri a passata da 525 nm (Gate 3) con le celle di controllo non infette (0 MOI).
- Aprire 50, 100 e 200 file di esempio MOI all'interno del software di analisi dei dati per valutare la curva dose-risposta. Analizzare le intensità di fluorescenza media con Gates 2 e 3 per ogni campione. Ripetere questo passaggio per i campioni di prova (10 : M H2O2 cellule trattate e cellule trattate con veicolo).
- Calcolare il rapporto di intensità media fluorescente tra forme ossidizzate e forme ridotte di roGFP con la seguente equazione.

- Valutazione dell'immagine
- Utilizzare un microscopio contenente filtri a fluorescenza per i filtri CyS-roGFP e CySS-roGFP (ad esempio, 488 nm/em. 525 nm e i filtri di 405 nm/em. 525 nm).
- In ogni pozzo della diapositiva a camera, scegliere 4 aree casuali per acquisire immagini, utilizzando l'obiettivo 4x per visualizzare aree più grandi.
NOTA: l'obiettivo 20x può essere utilizzato anche per i display delle immagini. - Aprire l'immagine con il software ImageJ11. Applicazione dell'analisi . Misurare i comandi per ogni immagine e usare l'equazione nel passaggio 4.1.5 per quantificare i dati.
NOTA: la quantificazione delle immagini è ratiometrica; pertanto, il protocollo non include la sottrazione dello sfondo. Tuttavia, per poter confrontare immagini, luminosità, contrasto e saturazione devono essere uguali per ogni immagine. La significatività statistica è stata valutata con l'analisi unidirezionale della varianza (ANOVA) e il test post hoc di Tukey.
Access restricted. Please log in or start a trial to view this content.
Risultati
Lo stato di redox di CyS/CySS è facilmente divformato con roGP trasdotti. La sonda fluorescente quantifica il rapporto tra le forme ridotte e ossidate (lunghezze d'onda di eccitazione rispettivamente 488 e 405 nm). I dati di fluorescenza possono essere ottenuti sia dalla citometria del flusso che dalla microscopia.
Un gran numero di cellule può essere acquisita in modo coerente e conveniente utilizzando la citometria di flusso. L'analisi è costituita da 3 passaggi principali: 1) selezionare...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'equilibrio tiol/disulfide in un organismo riflette lo stato di ripetizione delle cellule. Gli organismi viventi hanno glutathione, cisteina, tiol proteici e tioli a basso peso molecolare, tutti influenzati dal livello di ossidazione e riecheggiano lo stato di redox delle cellule4. I roGFP ingegnerizzati consentono la quantificazione non dirompente dell'equilibrio tiolo/disulfide attraverso i loro residui di CyS7. La proprietà ratiometrica di roGFP fornisce misurazioni af...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il costrutto e l'adenovirus ricombinante per l'espressione del roGFP specifico del citosol nelle cellule sono stati generati nel laboratorio di Paul T. Schumacker, PhD, Freiberg School of Medicine, Northwestern University e ViraQuest Inc., rispettivamente. Questo studio è stato sostenuto dal Centro per gli studi di risposta degli ospiti alla terapia del cancro p20GM109005 attraverso il NIH National Institute of General Medical Sciences Centers of Biomedical Research Excellence (COBRE NIGMS), National Institute of General Medical Sciences Systems Pharmacology and Toxicology Training Program grant T32 GM106999, UAMS Foundation/Medical Research Endowment Award AWD00053956, UAMS Year-End Chancellor's Awards AWD00053484. La struttura centrale della citometria a flusso è stata sostenuta in parte dal Center for Microbial Pathogenesis e l'Host Infiammatori Responses grant P20GM103625 attraverso il COBRE NIGMS. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali della NIH. ATA è stata sostenuta dalla borsa di studio Scientific and Technological Research Council of Turkey (TUBITAK) 2214-A.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
Riferimenti
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon