Method Article
Un modello di Drosophila per studiare la poliploidizzazione indotta dalle ferite
In questo articolo
Riepilogo
La poliploidizzazione indotta dalla ferita è una strategia di riparazione dei tessuti conservata in cui le cellule crescono di dimensioni invece di dividersi per compensare la perdita cellulare. Ecco un protocollo dettagliato su come utilizzare il moscerini della frutta come modello per misurare lo stratagemma e la sua regolazione genetica nella riparazione delle ferite epiteliali.
Abstract
La poliploiria è un fenomeno frequente il cui impatto sulla salute e sulla malattia dell'organismo è ancora poco compreso. Una cellula è definita come poliploide se contiene più della copia diploide dei suoi cromosomi, che è il risultato dell'endoreplicazione o della fusione cellulare. Nella riparazione dei tessuti, la poliploidizzazione indotta dalle ferite (WIP) è stata trovata per essere una strategia di guarigione conservata dai moscerini della frutta ai vertebrati. Il WIP presenta diversi vantaggi rispetto alla proliferazione cellulare, tra cui la resistenza alla crescita oncogenica e allo stress genotossico. La sfida è stata identificare perché sorgono cellule poliploidi e come funzionano queste cellule uniche. Fornito è un protocollo dettagliato per studiare il WIP nell'epitelio della mosca della frutta adulta in cui le cellule poliploidi vengono generate entro 2 giorni dopo una ferita da puntura. Sfruttando l'ampio kit di strumenti genetici di D. melanogaster, i geni necessari per avviare e regolare il WIP, incluso Il Myc, hanno cominciato ad essere identificati. Studi continui che utilizzano questo metodo possono rivelare come altre variabili genetiche e fisiologiche tra cui il sesso, la dieta e l'età regolano e influenzano la funzione del WIP.
Introduzione
Drosophila melanogaster è un sistema modello attraente per studiare i meccanismi cellulari e molecolari della riparazione delle ferite epiteliali. Come nei mammiferi, i meccanismi di riparazione dei tessuti utilizzati dipendono sia dal tessuto che dalla sua fase di sviluppo. La guarigione della ferita scarless si verifica nell'embrione di moscerini della frutta in cui si forma un'actomioina "stringa di borsa" al bordo iniziale epiteliale consentendo alla ferita di chiuderesenza soluzione di continuità 1,2. La guarigione post-embrionale della ferita in larve, pupe e moscerini della frutta adulti si traduce in rimodellamento della matrice extracellulare, formazione di cicatrici di melanina e crescita delle cellule epiteliali3,4,5,6. Le cellule epiteliali aumentano di dimensioni dalla fusione cellulare e dall'endociclo, un ciclo cellulare incompleto che bypassa la mitosi3,4,7,8. Di conseguenza, la perdita cellulare è compensata dalla crescita delle cellule poliploidi invece che dalla divisione cellulare. L'epitelio posteriore della mosca adulta, midgut, e follicolare si basano anche sulla crescita delle cellule poliploidi per compensare la perdita cellulare dopo danni aitessuti 9,10,11.
La poliploizia è un aspetto ben noto dello sviluppo dell'organismo nelle piante e negli insetti, ma negli ultimi anni è diventato più evidente che la poliploizia è una strategia di riparazione dei tessuti conservata nei vertebrati12. Il pesce zebra, che ha la capacità di rigenerare il suo cuore, si basa sulla crescita delle cellule poliploidi per guarire l'epicardiodanneggiato 13. La poliploilia contribuisce anche alla rigenerazione del fegato dei mammiferi e alla riparazione dell'epitelio del tubo renale dopo la lesioneacuta 14,15. In questi esempi, le cellule poliploidi sono generate da endoreplicazione tramite endociclo o endomitosi, che si traduce in una cella binucleata a causa di un blocco in citocinesi12. L'enigma è il motivo per cui le cellule poliploidi sorgono durante la riparazione della ferita e come la poliploisi influisce sulla funzione dei tessuti. Recenti studi hanno fornito nuove informazioni sulla questione se la poliploisi offre un vantaggio o uno svantaggio di guarigione. Nell'epicardio di pesce zebra, la poliploidia ha migliorato la velocità di guarigione dellaferita 13. Nel hindgut di D. melanogaster e nel fegato dei mammiferi, la poliploisia è stata trovata per essere protettiva contro la crescita oncogenica11,14. Nell'epitelio della mosca adulta, è stato recentemente scoperto che la poliploisia consente la riparazione delle ferite in presenza di stress genotossico16. L'endoreplicazione è resistente al danno del DNA, permettendo la guarigione delle ferite quando la proliferazione cellulare sarebbe altrimenticompromessa 17. Per i cardiomiociti nei cuori di topo e pesce zebra, tuttavia, la poliploizia rallenta la guarigione, con conseguente formazione di cicatricimigliorata 18,19. Pertanto, a seconda dell'organo e/o del tipo di cellula, la poliploisi può essere una strategia di riparazione del tessuto benefica o dannosa. L'accessibilità della genetica D. melanogaster accoppiata con l'analisi della risposta di poliploidizzazione indotta dalla ferita (WIP) lo rendono un sistema modello ideale per chiarire i meccanismi molecolari e cellulari che guidano questa strategia di guarigione delle ferite.
Qui, presentiamo un protocollo per l'analisi del WIP nell'epitelio di D. melanogaster adulto. Sono incluse le istruzioni per la lesione del mosceglio, la dissezione, l'immunostaining, il montaggio, l'imaging e l'analisi della re-epitelializzazione, della fusione cellulare e dell'endoreplicazione (ploidy). L'analisi dell'imaging e dello ploiy può anche essere adattata ad altri modelli per verificare se si verifica il WIP. Va notato che con un aumento del contenuto di DNA nucleare c'è spesso un corrispondente aumento delle dimensioni nucleari. Tuttavia, ci sono molti esempi in biologia in cui le dimensioni nucleari non riflettono un corrispondente cambiamento nello stratagemma20. Si dovrebbe prestare ancora più attenzione nell'interpretazione delle dimensioni nucleari nel contesto di un ambiente di ferita in cui le cellule spesso si diffondono o si estendono per coprire il sito della ferita. Pertanto, l'unica prova definitiva di cambiamento nello ploiy è misurare il contenuto di DNA con questo metodo (o altri, come il sequenziamento dell'intero genoma)21. Questo metodo aumenta l'idoneità dell'epitelio addominale D. melanogaster adulto come modello per studiare il ruolo e la regolazione della poliploisi nella riparazione delle ferite.
Protocollo
1. Messa in scena e ferimento di moscerini della frutta adulti
- Selezionare il ceppo D. melanogaster di scelta (ad esempio, ceppo epi-Gal4/ UAS, vedere Tabella dei materiali).
NOTA: Qui, il sistema Gal4/UAS viene utilizzato per abilitare l'espressione genica specifica epiteliale (epi-Gal4) di un gene o RNAi codificato a valle di UAS. Questo studio utilizza proteine fluorescenti della membrana (UAS-Cd8.mRFP), induttore mitotico (UAS-fzrRNAi, UAS-stg) e inibitore WIP (UAS-E2F1RNAi; UAS-RacDN). - Raccogliere due fiale di 10-15 moscerini della frutta femmina appena chiusi ciascuno e l'età su fiale di cibo fresco a 25 gradi centigradi fino a 3-5 giorni di età. Una fiala servirà come controllo illeso e l'altra fiala sarà ferita come descritto di seguito. Le mosche femminili devono essere mantenute con i maschi (5 USD/fiala).
- Per ferire le mosche, assemblare diversi supporti perno ciascuno con un singolo perno in acciaio inox da 0,10 mm. Assicurarsi che l'estremità tagliente del perno sia rivolta verso l'inizio. I perni possono facilmente piegarsi o scheggiarsi dopo aver forato la mosca e i perni agganciati o danneggiati devono essere scartati.
- Anestetizzare i moscerini della frutta femmina invecchiati su un pad CO2-flysotto uno stereomicroscopio e allinearli in una fila utilizzando un pennello. Indossando occhiali di sicurezza, tenendo il supporto perno in una mano e pinta nell'altra, utilizzare pine per posizionare una mosca con il suo addome ventrale rivolto verso l'alto.
- Foratura la femmina adulta vola all'interno della regione pleurita epiteliale di tergite A4 su entrambi i lati dei sterniti della linea mediana ventrale (Figura 1A). La puntura di questa regione ventrale fornisce uno spazio ottimale lontano dai siti di dissezione in cui i bordi del tessuto saranno strappati dalla lavorazione meccanica.
- Ritorno ferito vola alla fiala di cibo e l'età al giorno desiderato post infortunio (dpi). La guarigione epiteliale della ferita inizia da 1 dpi e termina di 3 dpi. L'endoreplicazione raggiunge i 2 dpi, ideale per il saggio EdU (sezione 4, Figura 2).
2. Volare dissezione addominale
NOTA: Durante questa fase, è importante evitare di toccare il tessuto addominale ventrale con gli strumenti di dissezione perché comprometterà l'integrità dell'epitelio.
- Ottenere tutti i materiali necessari per la dissezione: soluzione di Grazia, pinche, forbici a molla di Vanna, perni da 0,10 mm, piastre di dissezione, 9 piatti di dissezione in vetro, soluzione fissativa (4% paraformaldeide in 1x PBS), 1x PBS, salviette, pipette e punte per 30 m e guanti (vedi Tabella dei materiali).
- Confermare che le mosche sono state ferite con successo da voli feriti anesthetizing su un CO2-fly pad sotto uno stereomicroscopio e controllando la presenza della cicatrice della ferita (cioè, una macchia di melanina sull'addome, vedere Figura 1B). Scartare tutte le mosche del gruppo sperimentale che non sono state ferite con successo.
- Per iniziare la dissezione, riempire un pozzo di un piatto di dissezione di vetro 9 ben con la soluzione di Grace. Usa un paio di forcelle per afferrare una mosca femminile ferita dal lato dorsale del torace e sommergere la mosca nel pozzo contenente la soluzione di Grace.
- Utilizzando le forcelle nella mano opposta senza rilasciare il torace, forare la cuticola dorsale sotto tergite A6 e tirare il cuticolo dalla parte posteriore della mosca della frutta. Gli organi interni (ovaio e intestino) di solito escono in questa fase. In caso contrario, spingere delicatamente sul lato dorsale dell'addome con le forcelli per spremere gli organi rimanenti e scartare in un pozzo vuoto.
- Agganciare l'intero addome alla giunzione del torace sopra tergite A2 utilizzando le forcelle e trasferire l'addome in un pozzo vuoto contenente 100 dollari di soluzione di Grace.
- Ripetere i passaggi 2.3-2.5 fino a quando tutti gli addome volanti non vengono sezionati.
- Ridurre il volume della soluzione di Grace a 30 L nel pozzo contenente gli addominali sezionati.
- Filetto gli addominali si aprono posizionando l'addome sul lato dorsale con le forcerse in una mano e quindi inserendo la lama inferiore delle forbici a molla di Vanna nella cavità addominale con l'altra mano. Tagliare lungo la linea mediana dorsale fino a quando l'addome è completamente aperto, che può richiedere fino a tre tagli (Figura 1C, 1D).
- Impostare una piastra di sezione a secco con quattro perni da 0,10 mm per area di montaggio addominale. Ogni piastra di sezionazione da 35 mm può essere adattata fino a sette aree di montaggio. Pipetta 30 L della soluzione di Grace su ogni area di montaggio e trasferire un addome filettato ad ogni goccia.
- Fissare gli addominali filettati al piatto sui quattro angoli dorsali (Figura 1E). Assicurarsi che il tessuto si trovi piatto senza strappare o sovrastarlo del tessuto addominale.
- Per fissare il tessuto, pipetta fuori la soluzione di Grace e aggiungere 30 L della soluzione fissa all'addome appuntato.
CAUTION: Indossare i guanti durante la manipolazione della soluzione di fissazione, poiché la paraformaldeide è tossica. - Ripetere i passaggi 2.10-2.11 fino a quando tutti gli addominali filettati non sono appuntati sulla piastra di sezionazione.
- Posizionare un'etichetta a nastro sul fondo di ogni piatto per contrassegnare ogni controllo e gruppo sperimentale. Fissare i campioni per 30-60 min a temperatura ambiente (RT).
- Lavare la soluzione fissa mediante pipettatura su 1,5 mL di 1x PBS per ogni piastra. Smaltire la soluzione di fissazione e le materie plastiche in adeguati contenitori di rifiuti chimici liquidi o secchi secondo le linee guida istituzionali.
- Lavare le piastre 2x con 1,5 mL di 1x PBS e conservare il tessuto fisso coperto in 1,5 mL di 1x PBS in un contenitore di plastica con coperchio. Aggiungere uno strato di asciugamano di carta umida sul fondo del contenitore e conservare i campioni a 4 gradi centigradi fino a quando non sono pronti per l'immunostain entro 1 settimana dalla dissezione.
3. Immunofluorescenza
- Preparare al meglio i reagenti (c'è latabella dei materiali): soluzione tampone di lavaggio (0,3% Triton X 100, 0,3% BSA in 1x PBS). Il buffer di lavaggio residuo può essere salvato a 4 gradi centigradi e utilizzato per la durata del protocollo di colorazione di 2 giorni. Preparare una soluzione anticorpo primaria sufficiente per ogni analisi ( Figura2) utilizzando Anti-FasIII (1:50 mouse anti-Fasciclin-III) nel buffer di lavaggio con anti-Grh (1:300 affinità purificato coniglio anti-Grainyhead8) o anti-RFP (1:1.000 coniglio anti-RFP). Le soluzioni anticorpo primarie possono essere salvate a 4 gradi centigradi e riutilizzate più volte fino a quando il segnale non viene ridotto in modo significativo.
- Permeabilizzare il tessuto mediante pipettamento 1x PBS, aggiungendo 1,5 mL di tampone di lavaggio e incubando per almeno 30 min su uno shaker orbitale (80 rpm) a RT.
- Rimuovere il tampone di lavaggio e il tessuto macchiato durante la notte con 1,5 mL di soluzione di anticorpi primari, incubando su uno shaker orbitale (80 rpm) a 4 gradi centigradi. Raccogliere la soluzione di anticorpi primari e salvare in un tubo a 4 gradi centigradi per esperimenti futuri.
- Prima sciacquare rapidamente il campione con 1x PBS e poi lavare 3x con 1,5 mL di tampone di lavaggio. Per ogni lavaggio, incubare campioni a RT su uno shaker orbitale per almeno 30 min.
- Durante il lavaggio finale, preparare la soluzione anticorpo secondaria: 1:1.000 asino anti-coniglio Alexa 488 o 568 e 1:1.000 capra anti-mouse Alexa 488 o 568 (o fluorofori di scelta) nel tampone di lavaggio.
- Rimuovere il tampone di lavaggio e i tessuti macchiati con 1,5 mL di soluzione di anticorpi secondari. Coprire campioni con foglio di alluminio e incubare su uno shaker orbitale a RT per 3 h. In alternativa, i campioni possono essere incubati durante la notte a 4 gradi centigradi su uno shaker orbitale.
- Lavare i campioni scartando prima la soluzione di anticorpi secondari e quindi risciacquare rapidamente il campione con 1x PBS seguito da tre lavaggi con 1,5 mL di tampone di lavaggio. Per ogni lavaggio, incubare campioni a RT su uno shaker orbitale per almeno 30 min.
- Preparare la soluzione DAPI diluindo DAPI a 10 g/mL nel buffer di lavaggio. Dopo il lavaggio finale, campioni di macchie con soluzione DAPI da 1,5 mL incubano a RT per 30 min.
- Scartare la soluzione DAPI e risciacquare i campioni 2x in 1,5 mL di 1x PBS. Conservare il tessuto colorato in 1,5 mL di 1x PBS al buio, coperto con foglio di alluminio, a 4 gradi centigradi fino a quando non è pronto per essere montato su uno scivolo di vetro con coprisecchi. Il passo di montaggio deve essere eseguito entro 1 settimana.
4. Attività del ciclo cellulare (EdU Assay)
- Creare una soluzione di stock EdU da 10 mM dal kit Click-iT (vedi Tabella dei Materiali)sciogliendo la polvere EdU in dH20 e mescolando per 15 minuti fino a quando non è completamente dissolto. La soluzione di magazzino può essere aliquoted (250 L per tubo) e conservata a -80 gradi centigradi.
- L'alimentazione vola EdU diluendo prima il brodo EdU a 5 mM in dH2O. Aggiungere lievito secco fino a quando la soluzione è nuvolosa e un breve vortice per mescolare. Tagliare un tappo di tubo di 0,5 mL e posizionarlo sul fondo della fiala di cibo mosca. Spingere il tappo nel cibo, in modo che sia stabile.
- Anestetizzare le mosche e trasferire 3-5 giorni vecchie mosche nella fiala. Toccare le mosche a un bordo in modo che nessuno sia bloccato nel tappo.
- Pipette 75 L di soluzione lievito-EdU nel tappo. Le mosche devono essere alimentate ogni giorno con soluzione di lievito fresco EdU e trasferite in una fiala di cibo fresco con un tappo ogni due giorni per garantire che le mosche non si incastri nel fondo della fiala.
- Per trasferire le mosche, capovolgere a una nuova fiala con un tappo, mettere le mosche a dormire, toccare mosche da un lato, e aggiungere soluzione lievito-EdU fresco.
- Il terzo giorno, ferire le mosche e continuare ad alimentare lievito-EdU fino alla dissezione a 2 dpi (Figura 4A). Vedere la sezione 2 del protocollo per i metodi di dissezione e fissazione.
- Preparare i reagenti di colorazione EdU: buffer di lavaggio (0,3% Triton X 100, 0,3% BSA in 1x PBS), buffer di permeabilizzazione (0,5% Triton X 100 in 1x PBS), buffer di blocco (3% BSA in 1x PBS) e preparazione reagenti dal kit di analisi EdU (vedi Tabella dei materiali), tra cui 1x buffer di reazione e 1x di buffer di reazione additivo come indicato dal produttore.
- Lavare i campioni per 1 h, mescolando a RT in 1,5 mL di tampone di lavaggio.
- Aggiungere 1,5 mL di buffer di permeabilizzazione e incubare campioni per 20 min.
NOTA: Scongelare e preparare la soluzione di cocktail di reazione utilizzando un volume di 500 L/piastra. - Lavare rapidamente i campioni 1x con 1x PBS e quindi 3x rapidamente con 1 mL di buffer di blocco.
- Pipette fuori tutto il buffer di blocco rimanente e aggiungere 500 L di soluzione cocktail di reazione per piastra. Piastre swirl per garantire che i tessuti siano completamente coperti. Incubare in un cassetto al buio per 1 h a RT.
- Lavare rapidamente i campioni 1x con 1,5 mL di buffer di blocco.
- Macchia con 1,5 mL di soluzione DAPI a 1:5.000 in buffer di lavaggio per 30 min.
- Lavare rapidamente 2x con 1x PBS, avvolgere in un foglio e conservare al buio a 4 gradi centigradi fino a quando non è possibile montare i campioni entro 3 giorni.
5. Montare il tessuto colorato
- Ottenere tutti i materiali necessari per il montaggio: scivoli di vetro, coperture di vetro, smalto trasparente, supporto di montaggio, un paio di forno e salviette.
- Per montare il tessuto di mosca macchiato, rimuovere gli addominali dalla piastra di dissezione utilizzando le forcelle sotto lo stereomicroscopio. Trasferire il tessuto a 30 dollari di supporto di montaggio su un coperture di vetro afferrando delicatamente il tessuto con le forcelle dai fianchi dorsali, facendo attenzione a evitare di toccare l'area ventrale con le forcelle.
- Sotto lo stereomicroscopio orientare il tessuto addominale in modo che l'interno è rivolto verso il basso verso il coverslip (cioè, la cuticle/settile esterne sono rivolti verso l'alto). Tirare gli addominali orientati fino al bordo della gocciolina multimediale utilizzando le forcepi. La tensione superficiale contribuirà a mantenere piatto il tessuto (Figura 1F).
NOTA: È utile per l'imaging per organizzare gli addominali in una colonna o riga in questa fase. - Etichettare una diapositiva di vetro (cioè controllo o sperimentale) e raccogliere il coperture avvicinando lentamente il vetrate alle copertine. Capovolgere lo scorrimento e macchiare delicatamente con una salvietta per rimuovere il supporto di montaggio in eccesso.
- Sigillare i bordi del coperture con smalto chiaro e ripetere per tutti i restanti gruppi sperimentali. Conservare le diapositive in una casella di scorrimento a 4 gradi centigradi fino a quando non sono pronte per l'immagine.
6. Imaging ed elaborazione
- Immagine della zona della ferita addominale della mosca individuando prima la cicatrice della melanina con un microscopio confocale (Figura 1B), uno scanner a punti o un'illuminazione strutturata (ApoTome) con un olio 40x o un obiettivo secco.
- Controllare l'esposizione su ogni canale, assicurandosi che il segnale sia al di sotto della saturazione. Le impostazioni di imaging devono essere basate sul gruppo di campioni più luminoso. Ciò è particolarmente importante per l'analisi dello ploiy in quanto il canale DAPI deve rimanere nella gamma lineare per misurare con precisione il contenuto del DNA.
- Scatta un'immagine z-stack completa in tutti e tre i canali con una distanza ottimale di almeno 0,50 m tra le sezioni. Salvare le immagini acquisite e aprire il file nel programma di analisi delle immagini Fiji (noto anche come ImageJ).
- Per ogni immagine, create una proiezione z-stack utilizzando l'opzione somma delle sezioni per tutti i canali.
- Ruotare le immagini in base alle esigenze per assicurarsi che i nuclei siano allineati orizzontalmente tra le immagini (Figura 3A e Figura 4E).
- Ritaglia tutte le immagini in base a una selezione rettangolare di 300 m x 300 m centrati intorno al sito della ferita o al centro del controllo illeso. Identificare l'area disegnando un rettangolo e selezionando Modifica Proprietà Selection . Specificare. Verificare che le unità in scala siano in micron per assicurarsi che venga utilizzata la stessa casella di dimensioni per tutte le immagini da analizzare.
7. Analisi dell'endoreplicazione (ploidy)
- Utilizzando Fiji, selezionare la finestra del canale Grh e duplicare l'immagine. Quindi utilizzare lo strumento soglia per creare una maschera. Regolare manualmente la soglia facendo scorrere la barra superiore per ridurre al minimo lo sfondo senza causare la riduzione drastica dei nuclei (Figura 4D).
- Se nell'immagine di soglia si toccano i nuclei nel canale Grh, usate lo strumento pennello (2 pixel di larghezza) nello stesso colore dello sfondo, per disegnare una linea tra i nuclei. Fare clic per applicare 1x al termine per generare la maschera finale.
- Generare una mappa di area di interesse (ROI) utilizzando la funzione Analizza particelle: impostare la dimensione su 5 m-60 m per catturare la maggior parte dei nuclei senza includere lo sfondo.
- Regolare manualmente la mappa del ROI in base alle esigenze nel gestore del ROI. Eliminare tutte le selezioni che non sono nuclei e aggiungere all'elenco eventuali nuclei che non sono stati identificati delineando il nucleo con lo strumento di selezione a mano libera e aggiungendolo al gestore del ROI (Figura 4D).
- Selezionare il canale DAPI, quindi fare clic su Mostra tutto in Gestione ROI per applicare la mappa ROI generata nel canale Grh sul canale DAPI.
- Eliminare tutte le selezioni in cui il contorno dei nuclei epiteliali si sovrappone ai nuclei non epitelali (ad esempio, nuclei da muscolo o grasso) dalla mappa del ROI. Grainyhead macchia solo nuclei epiteliali, mentre DAPI macchia tutti i nuclei. Verificare che ogni selezione delineata contenga un solo nucleo ed eliminare o modificare le selezioni con più di un nucleo. Salvare l'elenco roI modificato.
- Misurare l'area e la densità integrata di ogni nuclei epiteliali nella mappa del ROI utilizzando gli strumenti di analisi nelle Figi. Esportare i valori in un foglio di calcolo.
- Misurare lo sfondo medio dell'immagine utilizzando lo strumento di selezione circolare. Disegnare tre cerchi che non si sovrappongono ad alcun nuclei in diverse aree dell'immagine DAPI. Aggiungere l'area e la densità integrata di ciascuno dei cerchi a un programma di fogli di calcolo per stabilire la luminosità dell'immagine di sfondo.
- Iniziare calcolando lo sfondo medio per area unitria per ogni immagine dividendo ogni valore di densità integrata dello sfondo per l'area corrispondente. Quindi media la densità integrata per unità di misura per l'immagine al fine di ottenere lo sfondo medio per area unitria.
- Successivamente, calcolare lo sfondo totale di ogni nucleo DAPI moltiplicando l'area del nucleo per lo sfondo medio per area unit. L'intensità DAPI normalizzata per ogni nucleo misurato può quindi essere calcolata sottraendo lo sfondo totale di ogni nucleo dalla sua densità integrata misurata.
- Mediare tutti i valori di intensità DAPI normalizzati dal controllo epiteliale illeso. I nuclei epiteliali non illesi sono stati precedentemente calcolati per avere un valore di ploiy di 2C e possono servire come riferimento per calcolare lo ploiato nei nuclei epiteliali dalle condizioni sperimentali8.
- Calcolare lo ploiy di ogni nucleo dividendo l'intensità DAPI normalizzata di ogni nucleo per il valore normalizzato dal controllo epiteliale non jediliato di riferimento (2C), quindi moltiplicare il valore per 2 per eguagliare lo ploidy normalizzato (valore C):
(Densità integrata nucleare - Densità integrata nucleare di fondo)/Densità integrata nucleare media (nuclei epiteliali non illesi - 2C) x 2 - ploiato nucleare epiteliale (C) - Nuclei grafici con valori ploiati come grafico a punti, istogramma o raggruppati in un grafico a barre di conseguenza (ad esempio, 2C [0.6-2.9C], 4C [3.0-5.9C], 8C [6.0-12.9C], 16C [13.0-24.9C]e >32C [>25.0C] (Figura 3F).
Risultati
Viene fornito un protocollo dettagliato per utilizzare D. melanogaster come modello per studiare la poliploidizzazione indotta dalle ferite (WIP). Questo modello di guarigione delle ferite offre molti vantaggi rispetto ai modelli di mammifero e altri modelli di volo di WIP. La poliploiria è stata facilmente indotta da una puntura meccanica con un perno di insetti e le cellule poliploidi sono state generate in un breve periodo di tempo (2-3 dpi) (Figura 1A, 1B)4. La sfida principale è la dissezione del tessuto addominale intatto senza perturbazioni all'epitelio. L'epitelio di D. melanogaster è facilmente accidentalmente urtato o graffiato con gli strumenti di dissezione taglienti. Pertanto, i passaggi di questo protocollo devono essere praticati prima dell'uso e dell'analisi.
In primo luogo, la lesione è stata limitata all'addome femminile ventrale, che fornisce una grande area di tessuto opaco piatta ideale per l'imaging. Le ferite da puntura sono state inflitte nell'epitelio pleurite, che si trova su entrambi i lati degli sterniti della linea mediana ventrale e mirati tra segmenti tergiti (T) T4-T5 (Figura 1A-C). Questo posizionamento della ferita fornisce una grande area visibile che non viene interrotta dalla dissezione. I passaggi impegnativi includono il taglio della forbice a molla addominale e i passaggi difissazione (Figura 1D, 1E). La fase di taglio a molla ha funzionato meglio quando gli addominali sono stati tagliati in un volume ridotto della soluzione di Grace (30 dollari l) per diminuire il movimento dei tessuti. Un taglio ben centrato lungo la linea mediana dorsale è stato necessario per fornire un'area sufficiente sui lembi dorsali addominali da appuntare sulla piastra di dissezione (Figura 1C). L'addome deve essere leggermente appuntato sui quattro angoli senza forza eccessiva(Figura 1E). Una spinta pin che è troppo difficile distorcerà il tessuto addominale e potrebbe anche spingere il tessuto nella piastra di dissezione. In questo caso, il tessuto deve essere scartato. Una volta che il tessuto addominale è stato fissato, è rimasto sulla piastra di dissezione fino a quando la colorazione immunofluorescenza è stata completata e gli addominali sono stati montati su un coperture di vetro per l'imaging (Figura 1F).
La guarigione delle ferite richiede la formazione di un foglio epiteliale continuo, che dipende dall'endoreplicazione e dalla fusionecellulare 4,16. La proteina di giunzione del setto FasIII, che etichetta le giunzioni tra cellule e celle, ha fornito un indicatore per verificare se si sono verificate perturbazioni di elaborazione durante la preparazione (Figura 1G, 1H). Gli addominali con grandi graffi (area non macchiata) che perturbano l'area della ferita devono essere scartati e non sono stati utilizzati per ulteriori analisi (Figura 1H).
Il passo successivo è stato quello di analizzare i campioni intatti per eventuali difetti nel WIP. Questo protocollo include analisi distinte per rilevare diversi aspetti della risposta WIP (Figura 2). La riparazione della ferita è stata completata quando una cellula centrale, grande e multinucleata ha coperto la crosta della ferita (Figura 3A). Qui la fusione cellulare è stata rilevata dalla colorazione per FasIII/Grh e quantificando il numero di nuclei+ epiteliali Grh- racchiusi nell'area delineata FasIII4. Sono stati rilevati difetti nella chiusura o nella ri-epitelializzazione quando sono state osservate lacune di >10 m nel foglio epiteliale (Figura 3B, freccia rossa). Questo è stato il caso, ad esempio, quando il WIP è stato inibito dall'attivazione del ciclo mitotico tramite l'espressione di stg, fzrRNAi, come recentemente riportato16. In questa condizione genetica, il 52% delle ferite non è stato in grado di formare un foglio epiteliale continuo sopra la crosta della ferita(Figura 3B, 3C).
Un altro metodo per misurare la riparazione delle ferite in questo modello è stato la visualizzazione della membrana epiteliale con espressione epi-Gal4 di UAS-mCD8-ChRFP4 (Figura 2, Figura 3D). Nel controllo, il 91% delle ferite epiteliali chiuse completamente da 3 dpi, ma inibendo il WIP bloccando l'endoreplicazione (E2f1RNAi) e la fusione cellulare (RacDN) contemporaneamente, come riportato in precedenza, ha causato il 92% delle ferite epiteliali a rimanere completamente aperte (Figura 3D, 3E)8,16. L'attivazione del ciclo cellulare mitotico mediante espressione di stg, fzrRNAi ha anche provocato un difetto di chiusura della ferita epiteliale. Tuttavia, visualizzando la membrana cellulare epiteliale, è possibile determinare l'entità del difetto di re-epitelializzazione. Il mutante WIP (E2f1RNAi, RacDN) le ferite da mosca erano più aperte delle ferite stg, fzrRNAi (Figura 3D, contorno rosso tratteggiato)16. Questo saggio di guarigione della ferita della membrana ha fornito maggiori informazioni sull'entità del difetto di riparazione della ferita. Di conseguenza, i difetti di riepintelializzazione potrebbero essere raggruppati come completamente aperti, parzialmente chiusi (ad esempio, >10 dislocazioni di zm) o completamente chiusi(Figura 3D, 3E).
Oltre alla fusione cellulare, le cellule epiteliali crescono di dimensioni mediante endoreplicazione, un ciclo cellulare incompleto che raddoppia il contenuto di DNA nucleare. L'endoreplicazione è stata analizzata sia dall'attività del ciclo cellulare che dalle misurazioni dirette del DNA nucleare(Figura 2 e Figura 4). In questo caso, l'attività del ciclo cellulare è stata rilevata dall'incorporazione dell'analogico di timidina, EdU (Figura 4A, 4B). D. melanogaster cellule epiteliali sono stati trovati per entrare nell'endociclo, un ciclo cellulare incompleto che oscilla tra le fasi S e G senza un intervento M fase4,12. La dieta adulta di D. melanogaster è stata integrata con EdU- cibo prima di lesioni e le mosche sono state mantenute su una dieta EdU- fino alla dissezione a 2 dpi (Figura 4A). EdU è stato quindi rilevato utilizzando il protocollo Click-iT del produttore. Questo saggio EdU è stato utilizzato per determinare dove, quando e quanti nuclei sono stati attivati per entrare nella fase S in risposta a una ferita. Utilizzando il sistema Gal4/ UAS, è stato recentemente scoperto che l'espressione specifica epiteliale di myc può bloccare (mycRNAi) o esacerbare (Myc overexpression) la competenza delle cellule epiteliali per entrare nella fase S. Di conseguenza, è stato dimostrato che Myc è sufficiente a indurre l'endoreplicazione nelle cellule postmitotiche, anche senza lesioni16,22.
Successivamente, lo ploiato epiteliale è stato determinato misurando direttamente il contenuto di DNA nucleare. I nuclei epiteliali sono stati identificati dalla colorazione dell'immunofluorescenza per il marcatore specifico epiteliale, Grh (Figura 4D). Nel software di imaging Delle Fiji, i nuclei epiteliali sono stati identificati sistemicamente e poi soglieti utilizzando la macchia nucleare di Grh. Nuclei sono stati quindi separati e i ROI sovrapposti alla SOMMA di stack immagine DAPI (Figura 4D, freccia verde). Tutti i nuclei sovrapposti sono stati eliminati manualmente prima che fosse misurata la densità integrata dei nuclei selezionati (Figura 4D, frecce rosse). Questo metodo semiautomatico permette di quantificare la distribuzione e lo ploiy della maggior parte dei nuclei in tutto l'epitelio addominale della mosca non lesa eriparato 8. Come recentemente riportato, i nuclei epiteliali che circondano la ferita erano composti da nuclei poliploidi del 44% con contenuto di DNA superiore a 3C a 3 dpi (Figura 4E, 4F)16. Come previsto dai risultati di EdU, il knockdown del myc ha portato a un blocco significativo nell'endoreplicazione, in quanto solo il 9% dei nuclei epiteliali erano poliploidi, mentre la sovraespressione di Myc ha provocato nuclei epiteliali 100% poliploidi intorno al sito della ferita (Figura 4F)16. Anche le dimensioni del nucleare epiteliale sono state visibilmente influenzate dall'espressione mic con nuclei ridotti o ingranditi presenti. Tuttavia, l'area nucleare non è una misura accurata degli effetti fisiologici e dello stratagemma, perché fattori come lo stiramento cellulare possono anche influenzare le dimensioni nucleari senza influenzare il contenuto di DNAnucleare 20.
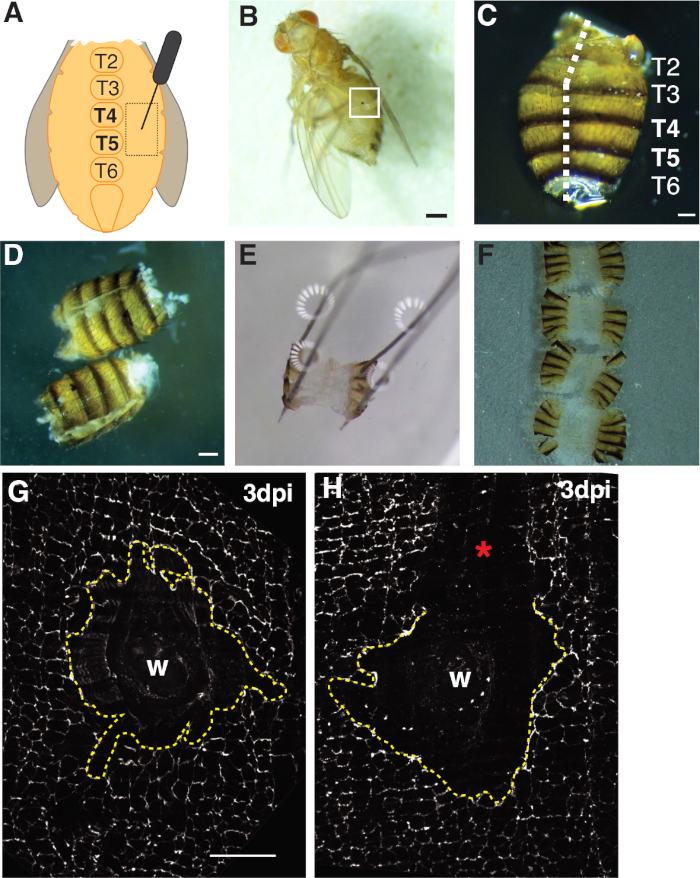
Figura 1: Ferimento addominale della mosca della frutta per adulti, dissezione e montaggio dei tessuti. (A) Diagramma del saggio di ferita addominale adulto. Le mosche devono essere ferite su entrambi i lati dell'addome a tergite 4 (T4). (B) Moscerini della frutta femminile adulti 3 dpi con crosta di melanina formata dalla guarigione della ferita (scatola bianca). Barra della scala - 50 m. (C) Addome adulto dissezionato, vista dorsale, con tergites etichettati. Gli addominali sono stati riempiti lungo la linea mediana del lato dorsale (linea tratteggiata bianca). Barra della scala - 50 m. (D) Addome adulti sezionati e filettati prima del pinning. Barra della scala : 50 m. (E) Appuntato addome adulto su una piastra di sezionazione. Un perno è stato posto in ciascuno dei quattro angoli dell'addome sul lato dorsale. Il tessuto è stato delicatamente aperto ma non allungato, per evitare lacerazione. (F) Gli addominali adulti sono stati montati e posizionati su un coperture di vetro con l'interno dell'addome rivolto verso il basso verso il coperture e cuticola orientato verso lo scivolo di vetro. (G) Colorazione FasIII dell'area della ferita intatta senza perturbazione di lavorazione e un sintizio centrale (linea gialla tratteggiata). Barra della scala - 50 m. (H) Immagine di un'area della ferita graffiata con una regione FasIII non macchiata che interrompe il sintizio. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
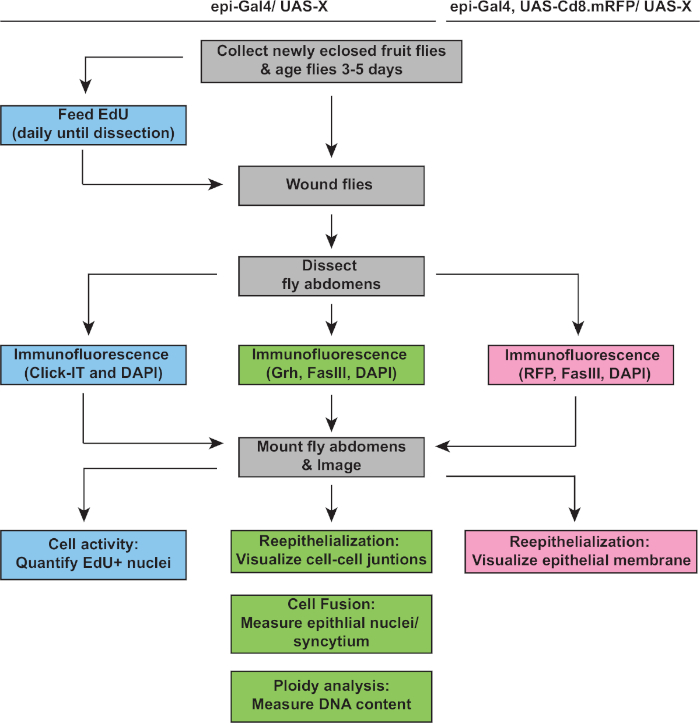
Figura 2: flusso di lavoro di analisi WIP. Il diagramma di flusso illustra i tre saggi descritti in questo studio e i passaggi sovrapposti e distinti per rilevare e misurare la risposta WIP. Il saggio EdU misura l'attività del ciclo cellulare (scatole blu), lo ploizza e la ri-epitelializzazione sono rilevati dall'immunostaining Grh/FasIII (scatole verdi) e l'espressione della RP della membrana consente di misurazione dell'estensione della chiusura delle ferite epiteliali (scatole rosa). I passaggi comuni sono in scatole grigie e genotipi di deformazione D. melanogaster sono elencati sopra. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
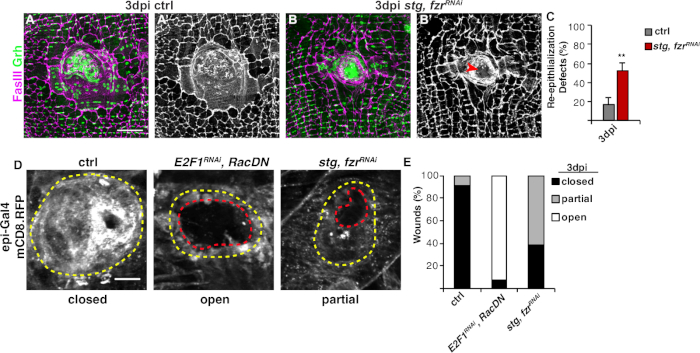
Figura 3: Metodi per rilevare la re-epitelializzazione durante il WIP. La ricompalicazione è stata turbata quando il WIP è stato geneticamente inibito. Immagini immunofluorescenti di controllo (A) e stg, fzrRNAi (B) a 3 dpi. I nuclei epiteliali e le giunzioni del setto erano macchiati rispettivamente con Grh (verde) e FasIII (magenta). (A' e B') La colorazione FasIII da sola ha mostrato che la ri-epitelializzazione è stata compromessa (freccia rossa) in epitelio stg, fzrRNAi. Barra di scala : 50 m. (C) Quantificazione dei difetti di riepintelializzazione (%) a 3 dpi (grigio): controllo (n : 8), stg, fzrRNAi (n s 6). Le barre di errore indicano un errore standard; la significatività statistica è stata misurata tramite il T-test di Student, "P < 0.01". La ri-epitelializzazione durante la riparazione della ferita potrebbe anche essere rilevata dall'espressione di una RFP legata alla membrana utilizzando epi-Gal4, UAS-mCD8-RFP. (D) Immagini immunofluorescenti del controllo, E2F1RNAi, RacDNe stg, fzrRNAi a 3 dpi. Barra della scala di 20 m. La crosta ferita (contorno giallo) e l'area della ferita epiteliale aperta (contorno rosso). (E) Quantificazione della chiusura della ferita in ctrl (n - 11), E2F1RNAi, RacDN (n - 13) e stg, fzrRNAi (n x 13). Adattato da Grendler et al.16. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
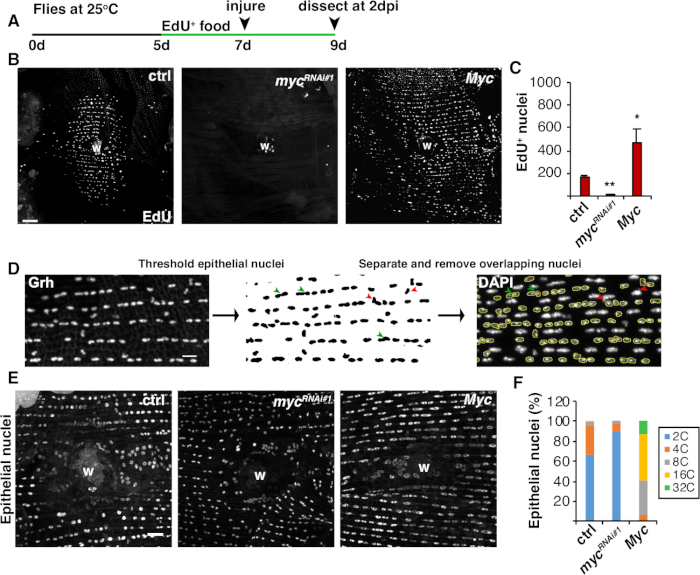
Figura 4: Metodi per rilevare l'endoreplicazione durante il WIP. (A) Cronologia del saggio EdU: la Drosophila adulta è stata nutrita con 75 L di 5 mM lievito-EdU ogni giorno 2 giorni prima dell'infortunio e continua fino a 2 dpi. (B) Immagini immunofluorescenti dell'etichetta EdU nei ceppi di mosca espressi con sistema epi-Gal4/ UAS a 2 dpi. Ferita crosta (W). Barra della scala : 50m.( C ) Numero medio di nuclei epiteliali EdU per mosca a 2 dpi: ctrl (n - 37), mycRNAi 1 (n - 10) e Myc (n - 8). Le barre di errore indicano un errore standard; la significatività statistica è stata misurata tramite il T-test di Student, il comando P < 0,05, P < 0,01. (D) Schematico di rilevamento e misurazione dello ploiato nucleare epiteliale. I nuclei epiteliali sono stati identificati e sogliati dalla macchia anti-Grh nelle Figi. I nuclei epiteliali sovrapposti sono stati separati (punte di freccia verde) o rimossi (punte di freccia rossa) se sovrapposti da nuclei non epitelici. Sono state misurate la densità integrata e l'area nucleare dell'immagine corrispondente dei nuclei macchiati DAPI. (E) La dimensione nucleare epiteliale (Grh) è stata alterata dall'espressione myc a 3 dpi. (F) Ploidy nucleare epiteliale (%) a 3 dpi: ctrl (n : 4), mycRNAi 1 (n x 6) e Myc (n : 3). Adattato da Grendler et al.16. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Presentato è un protocollo dettagliato su come sezionare e utilizzare l'epitelio addominale D. melanogaster adulto per studiare come i geni regolano il WIP alterando la re-epitelializzazione e l'endoreplicazione durante la riparazione dellaferita 16. Utilizzando questo metodo, il proto-oncogene Myc è stato recentemente identificato come un regolatore chiave del WIP. Myc è necessario per le cellule epiteliali per endoreplicare post lesione ed è sufficiente per le cellule epiteliali quiescenti per endocicare sia in epitelio mosca adulto e ghiandole accessorie16,22. È stato anche scoperto che il passaggio delle cellule epiteliali a un ciclo cellulare mitotico mediante espressione di stg, fzrRNAi è dannoso per la riparazione delle ferite. Studi continui con questo metodo identificherà altri geni necessari per regolare la re-epitelializzazione e l'endoreplicazione durante il WIP, rivelando sia somiglianze che differenze al modo in cui la poliploizia è regolata e funziona in una varietà di tessuti.
Questo modello e metodo offrono vantaggi unici, tra cui la facile induzione della poliploiria con una puntura meccanica e il fatto che le cellule poliploidi vengono generate entro giorni4. I protocolli di dissezione e preparazione dei tessuti si basano su tecniche di dissezione larvale23, ma l'addome della mosca adulta è più rigido e quindi facilmente perturbato. Di conseguenza, questo protocollo richiede pratica e precisione per isolare un tessuto intatto per studiare il WIP. Una volta sezionato, tuttavia, l'epitelio è chiaramente visibile e facilmente immagine, producendo un'istantanea del processo di guarigione della ferita. Questo metodo fornisce una grande quantità di informazioni sull'organizzazione epiteliale della mosca adulta, le dimensioni delle cellule e del sincizio e lo stratagemma delle cellule e dei singoli nuclei. Anche se l'imaging dal vivo non è ancora possibile all'interno del moscerini della frutta intatto a causa della sua cuticola opaca, questo protocollo potrebbe essere adattato per includere le condizioni di coltura ex vivo attualmente disponibili utilizzate in D. melanogaster per eseguire studi di imaging dal vivo a brevetermine 24.
In futuro, questo modello sarà ideale per studiare il crosstalk tra cellule e il contributo di altri tipi di cellule al WIP regolando l'espressione genica con il sistema Gal4/UAS in altri tipi di interesse cellulare. Domande simili possono anche essere risolte utilizzando una varietà di background genetici e mutanti. L'addome della mosca adulto sezionato contiene una varietà di tipi di cellule che possono essere facilmente visualizzabili utilizzando questo metodo, tra cui corpo grasso e onociti, fibre muscolari laterali, neuroni sensoriali, trachea, e emociti macrofagiosi-like. Inoltre, questo modello permetterà ai ricercatori di studiare come le variabili fisiologiche influenzano il WIP, tra cui sesso, dieta, infezione, età e fattori di stress ambientali. Mentre il protocollo utilizza la mosca femminile adulta a causa delle sue dimensioni più grandi, WIP si verifica anche nel moscerini della frutta maschile (Gjelsvik e Losick, inedito). Le cellule poliploidi sono state trovate per sorgere durante l'invecchiamento e la malattia associata all'età nel fegato dei mammiferi, cervello, occhio, e cuore12. Il modello di mosca della frutta consentirà ai ricercatori di studiare la poliploidizzazione in contesti fisiologici e di malattia perché i geni correlati alla malattia umana sono altamente conservati.
Divulgazioni
Nessuno.
Riconoscimenti
Al Boston College, vorremmo ringraziare il Dr. Eric Folker per l'uso della macchina fotografica del suo laboratorio e della configurazione del microscopio stereooscopio per la imaging e Bret Judson al Boston College Imaging Core per l'infrastruttura e il supporto. Ringraziamo anche le risorse della comunità fly: Bloomington Drosophila Stock Center (NIH P40OD018537), Vienna Drosophila Resource Center e TRiP Center presso la Harvard Medical School (NIH/NIGMS R01-GM084947) per la fornitura di stock transgenici utilizzati in questo studio. L'anticorpo FasIII del topo è stato ottenuto da Developmental Studies Hybridoma Bank supportato da NICHD del NIH e mantenuto presso l'Università dell'Iowa, Dipartimento di Biologia, Iowa City, IA. La ricerca riportata in questa pubblicazione è stata sostenuta dal National Institute of General Medical Sciences del National Institutes of Health sotto il numero di premio R35GM124691. Il contenuto è esclusivamente di competenza degli autori e non rappresenta necessariamente le opinioni ufficiali degli Istituti Nazionali di Sanità.
Materiali
| Name | Company | Catalog Number | Comments |
| 35 mm Petri dishes | Fisher Scientific | FB0875713 | For creating plates to dissect in |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | For preparing staining reagents in |
| AxioImager M2 with Apotome | Zeiss | NA | For imaging samples |
| Blowgun mini | Genesee Scientific | 54-104M | For anethesizing D. melanogaster strains |
| Bovine Serum Albumin, 30% | Sigma | A7284-500ML | For immuostaining |
| Carbon dioxide tank | various distributors | N/A | For anethesizing D. melanogaster strains |
| Click-iT EdU 594 Kit | Thermofisher | C10339 | For EdU assay |
| Coverslips | Thermofisher | 3406 | For mounting |
| DAPI | Sigma | D9542-10MG | For immuostaining |
| Dissecting Plates (use Sylgard 184 Sil Elastic Kit) | Ellsworth Adhesives | 184SIL | For creating plates to dissect in. Mix epoxy as directed, let dry overnight |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A21206 | For secondary immuostaining |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A10042 | For secondary immuostaining |
| Drosophila tubing and fittings | Genesee Scientific | 59-124C, 59-123, 59-140 | For anethesizing D. melanogaster strains |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | For dissecting |
| epi-Gal4 | Bloomington Drosophila Stock Center (b) | b38793 | Losick et al. Current Biology, 2013 |
| epi-Gal4, UAS-mCD8.RFP | Bloomington Drosophila Stock Center (b) | b38793, b27392 | Losick et al. Current Biology, 2013 |
| Excel | Microsoft | For performing ploidy calculations | |
| Fiji/ImageJ (image analysis software) | NIH | https://imagej.nih.gov/ij | For image analysis |
| Fly food | Archon Scientific | N/A | Corn Syrup/Soy food |
| Flystuff Flypad | Genesee Scientific | 59-114 | For anethesizing D. melanogaster strains |
| Glass dissecting dish | Fisher Scientific | 13-748B | For performing dissections in |
| Glass slides | Fisher Scientific | 12-518-104C | For mounting |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A11001 | For secondary immuostaining |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A11031 | For secondary immuostaining |
| Grace's Insect Medium, unsupplemented | Thermofisher | 11595030 | For dissecting in |
| Insect pins | Fine Science Tools | 26002-10 | For wounding and pinning fly abdomens flat |
| Mouse anti-Fasciclin III (Drosophila) Primary Antibody | Developmental Studies Hybridoma Bank | 7G10 | For immunostaining epithelial cell-cell junctions |
| Mouting media | Vector Laboratories | H-1000 | Anti-fade mounting media to prevent photo bleaching during imaging |
| Nail polish | Electron Microscopy Sciences | 72180 | For sealing slides |
| Ortibal shaker | Fisher Scientific | 02-217-988 | For immuostaining |
| Phosphate Buffered Saline, PH 7.4 | Sigma | P3813-10PAK | For staining |
| Pin holders | Fine Science Tools | 91606-07 | For wounding |
| Rabbit anti-Grainyhead Primary Antibody | N/A | N/A | For immunostaining epithelial nuclei. Protocol to make antibody can be found (Ref. #4 and 8) |
| Rabbit anti-RFP Primary Antibody | MBL | PM005 | For immunostaining mCD8-RFP fly epithelium |
| Stereomicroscope | Olympus | SZ51 | For dissecting and mounting fly tissue |
| Triton X-100 | Sigma | 10789704001 | For immuostaining |
| UAS-E2F RNAi, UAS-RacDN | VDRC (v) and Bloomington Drosophila Stock Center (b) | v108837, b6292 | Losick et al. Current Biology, 2013 |
| UAS-fzr RNAi, UAS-Stg | VDRC (v) and Bloomington Drosophila Stock Center (b) | v25550, b56562 | Grendler et al. Development, 2019 |
| UAS-Myc | Bloomington Drosophila Stock Center (b) | b9674 | Grendler et al. Development, 2019 |
| UAS-myc RNAi | Bloomington Drosophila Stock Center (b) | b36123 | Grendler et al. Development, 2019 |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | For dissecting |
Riferimenti
- Abreu-Blanco, M. T., Verboon, J. M., Liu, R., Watts, J. J., Parkhurst, S. M. Drosophila embryos close epithelial wounds using a combination of cellular protrusions and an actomyosin purse string. Journal of Cell Science. 125 (Pt 24), 5984-5997 (2012).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Galko, M. J., Krasnow, M. A. Cellular and genetic analysis of wound healing in Drosophila larvae. PLoS Biology. 2 (8), E239 (2004).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and cell fusion contribute to wound healing in the adult Drosophila epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Wang, Y., et al. Integrin Adhesions Suppress Syncytium Formation in the Drosophila Larval Epidermis. Current Biology. 25 (17), 2215-2227 (2015).
- Ramos-Lewis, W., LaFever, K. S., Page-McCaw, A. A scar-like lesion is apparent in basement membrane after wound repair in vivo. Matrix Biology. 74, 101-120 (2018).
- Lee, C. W., Kwon, Y. C., Lee, Y., Park, M. Y., Choe, K. M. cdc37 is essential for JNK pathway activation and wound closure in Drosophila. Molecular Biology of the Cell. 30 (21), 2651-2658 (2019).
- Losick, V. P., Jun, A. S., Spradling, A. C. Wound-Induced Polyploidization: Regulation by Hippo and JNK Signaling and Conservation in Mammals. PLoS One. 11 (3), e0151251 (2016).
- Tamori, Y., Deng, W. M. Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Developmental Cell. 25 (4), 350-363 (2013).
- Xiang, J., et al. EGFR-dependent TOR-independent endocycles support Drosophila gut epithelial regeneration. Nature Communications. 8, 15125 (2017).
- Cohen, E., Allen, S. R., Sawyer, J. K., Fox, D. T. Fizzy-Related dictates A cell cycle switch during organ repair and tissue growth responses in the Drosophila hindgut. Elife. 7, e38327 (2018).
- Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. Solving the Polyploid Mystery in Health and Disease. Trends in genetics: TIG. 35 (1), 6-14 (2019).
- Cao, J., et al. Tension Creates an Endoreplication Wavefront that Leads Regeneration of Epicardial Tissue. Developmental Cell. 42 (6), 600-615 (2017).
- Zhang, S., et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver. Developmental Cell. 44 (4), 447-459 (2018).
- Lazzeri, E., et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nature Communications. 9 (1), 1344 (2018).
- Grendler, J., Lowgren, S., Mills, M., Losick, V. P. Wound-induced polyploidization is driven by Myc and supports tissue repair in the presence of DNA damage. Development. 146 (15), 173005 (2019).
- Mehrotra, S., Maqbool, S. B., Kolpakas, A., Murnen, K., Calvi, B. R. Endocycling cells do not apoptose in response to DNA rereplication genotoxic stress. Genes & Development. 22 (22), 3158-3171 (2008).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gonzalez-Rosa, J. M., et al. Myocardial Polyploidization Creates a Barrier to Heart Regeneration in Zebrafish. Developmental Cell. 44 (4), 433-446 (2018).
- Webster, M., Witkin, K. L., Cohen-Fix, O. Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. Journal of Cell Science. 122 (Pt 10), 1477-1486 (2009).
- Knouse, K. A., Lopez, K. E., Bachofner, M., Amon, A. Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture. Cell. 175 (1), 200-211 (2018).
- Box, A. M., et al. Endocycles support tissue growth and regeneration of the adult Drosophila accessory gland. bioRxiv. , 719013 (2019).
- Karim, M. R., Moore, A. W. Morphological analysis of Drosophila larval peripheral sensory neuron dendrites and axons using genetic mosaics. Journal of Visualized Experiments. (57), e3111 (2011).
- Dai, W., Montell, D. J. Live Imaging of Border Cell Migration in Drosophila. Methods in Molecular Biology. 1407, 153-168 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon