Method Article
Visualizzazione della degenerazione sinaptica nella Drosophila adulta in associazione con la neurodegenerazione
In questo articolo
Riepilogo
L'obiettivo di questa procedura è quello di sezionare il tessuto del muscolo longitudinale dorsale (DLM) per valutare l'integrità strutturale delle giunzioni neuromuscolari DLM (NMJ) nei modelli di malattia neurodegenerativa utilizzando Drosophila melanogaster.
Abstract
La Drosophila funge da modello utile per valutare la struttura sinaptica e la funzione associata alle malattie neurodegenerative. Mentre molto lavoro si è concentrato sulle giunzioni neuromuscolari (NMJ) nelle larve di Drosophila, la valutazione dell'integrità sinaptica nella Drosophila adulta ha ricevuto molta meno attenzione. Qui forniamo un metodo semplice per la dissezione dei muscoli longitudinali dorsali (DLM), che sono necessari per la capacità di volo. Oltre al volo come lettura comportamentale, questa dissezione consente che le sinapsi DLM e il tessuto muscolare siano suscettibili all'analisi strutturale utilizzando anticorpi etichettati fluorescentemente per marcatori sinaptici o proteine di interesse. Questo protocollo consente la valutazione dell'integrità strutturale delle sinapsi nella Drosophila adulta durante l'invecchiamento per modellare la natura progressiva e dipendente dall'età della maggior parte delle malattie neurodegenerative.
Introduzione
La disfunzione sinaptica è tra i primi segni distintivi noti della maggior parte delle principali malattie neurodegenerative1,2,3,4,5,6. Tuttavia, si sa molto poco su come queste menomazioni strutturali e funzionali si riferiscono alle fasi successive della progressione della malattia. Drosophila ha dimostrato di essere un utile sistema di modello per comprendere la crescita e lo sviluppo delle sinapsi utilizzando LArval NMJs7,8,9. Tuttavia, il terzo stadio larvale instar dura solo pochi giorni, limitando la loro utilità nello studio della neurodegenerazione progressiva e dipendente dall'età. Un'alternativa alla valutazione dei NMJ larval consiste nell'esaminare le strutture sinaptiche nella Drosophila adulta,come le sinapsi formate sui dorsali longitudinali (DLM) necessarie peril volo 10,11,12,13,14,15,16. Queste sinapsi tripartite sono strutturalmente organizzate in modo simile alle sinapsi dei mammiferi17, fornendo un vantaggio unico per la valutazione di modelli di malattie neurodegenerative.
Qui descriviamo un metodo semplice per analizzare l'integrità strutturale degli NMJ adulti in un modello di neurodegenerazione della Drosophila. Precedenti metodi di dissezione DLM e studi hanno sottolineato l'importanza di preservare il tessuto muscolare per una varietà diapplicazioni 18,19,20,21,22,23. Il nostro protocollo fornisce un metodo completo per preservare sia il tessuto neuronale che quello muscolare per studiare le malattie neurodegenerative. Un altro componente importante dello studio di queste malattie è la capacità di comprendere la perdita neuronale in modo dipendente dall'età. Il lavoro precedente fornisce una comprensione critica e approfondita di come i DLM NMJ si formano durante la metamorfosi nella prima etàadulta 11,12,14,15,16,24. Il nostro protocollo stabilisce un metodo per costruire su questo lavoro per indagare DLM NMJs in modo dipendente dall'età in invecchiamento e malattie neurodegenerative.
Protocollo
1. Generazione di mosche transgeniche
- Per generare mosche transgeniche per questo esperimento, raccogliere OK371-Gal425 mosche femminili vergini e maschi di UAS-TDP-43M337V 26 (Figura 1A) anesthetizing mosche con CO2 su un pad per ordinare.
- Ordinare le mosche anetizzate nelle fiale con i media drosophila standard per la croce. Posizionare fiale etichettate a 25 gradi centigradi per far emergere la prossima generazione.
NOTA: Cancellare gli adulti dalle fiale prima che la progenie emerga per garantire il genotipo adeguato. - Una volta che la progenie emerge, raccogliere le mosche transgeniche in fiale e ordinare per sesso per iniziare l'invecchiamento per le condizioni sperimentali.
- Una volta raccolte le mosche, trasferire le mosche al cibo fresco ogni 2 giorni fino a quando le mosche non hanno 21 giorni.
2. Preparazione della dissezione
- Per preparare le dissezioni, ottenere la salina tamponata di fosfato a temperatura ambiente (1x PBS), un piatto di dissezione di 10 cm rivestito con un elastomero di silicone, forbici per la sesticazione del bordo dritto, una serie di forcelle di dissezione smussate, una piptta P200 e punte di pipetta, tubi microcentrifuge da 2,0 mL, forbici da ufficio standard, 70% etanolo, un piatto Petri da 6 cm e 32% di formaldeide diluito al 4% con 1x PBS.
- Etichettare i tubi per ogni genotipo o condizione e aggiungere 900 L di 1x PBS (temperatura della stanza) e 150 L di formaldeide del 32% per ogni tubo. Indossare guanti e occhiali di sicurezza durante la preparazione del fissativo di formaldeide 4%.
- Anestesizzare 6-u201210 mosche per gruppo direttamente dalla fiala con CO2 e immergere le mosche in un piatto Petri di 6 cm con 70% di etanolo. Premere le mosche verso il basso nell'etanolo utilizzando un pennello per garantire che i campioni siano completamente sommersi. Questo rimuoverà lo strato di olio sulla cuticola esterna.
3. Isolamento e fissazione del torace
- Prima di sezionare ogni esemplare, aggiungere circa 7 u201210 mL di 1x PBS al piatto di dissezione rivestito con elastomero di silicone. Questo volume dovrebbe garantire che i campioni di tessuto siano completamente sommersi.
- Trasferire una mosca al piatto di dissezione dal 70% di etanolo usando le fortip delle contunde e afferrando le ali o le gambe.
- Mettere a fuoco il campione nel piatto di dissezione sotto un microscopio sezionante. Successivamente immergere il campione in 1x PBS, e rimuovere con attenzione le ali utilizzando dumont smussato #5 di ali sottili.
- Utilizzando le forbici di dissezione a molla del bordo dritto Vannas, rimuovere le gambe creando una piccola incisione nel lato ventrale della cuticola. Nel punto 3.8, questa incisione permetterà alla formaldeide di penetrare il tessuto.
- Prendere le forbici in una mano e tenere le forcelle nell'altra per posizionare il lato ventrale della mosca verso l'alto. Tenendo il campione in posizione con le force e le forbici contundenti, rimuovere la testa e l'addome con le forbici di dissezione.
- Trasferire il torace isolato utilizzando la punta della pipetta modificata nel tubo etichettato, al punto 3.2.
NOTA: Impostare la pipetta su 40 L per evitare di aggiungere 1x PBS al fissativo. - Ripetere i passaggi 3.2-u20123.6 sopra per ogni provino.
- Fissare i campioni per 30 min a temperatura ambiente.
- Rimuovere la correzione utilizzando una pipetta Pasteur e scartarla nel contenitore di rifiuti appropriato sotto il cofano di fumi. Risciacquare i campioni tre volte con 1,5 mL di 1x PBS ciascuno utilizzando una pipetta Pasteur. Completate un quarto risciacquo utilizzando solo 750 L e lasciate i tessuti in 1x PBS.
NOTA: A questo punto, i campioni di tessuto possono rimanere a 4 gradi centigradi per un massimo di 3 giorni prima di procedere ai passaggi successivi.
4. Congelamento flash e bisezione torace
- Prima di iniziare le bisezioni, riempire una fiaschetta Dewar con azoto liquido indossando guanti crio-protettivi adeguati e occhiali di sicurezza. Ottieni un interruttore a lama, lame di piume, un paio di pinze fini, ghiaccio, 1x PBS ghiacciato e pinzette criogeniche.
- Preparare un secchio di ghiaccio per mantenere 1x PBS ghiacciato.
- Utilizzare l'interruttore a lama per afferrare la lama di piuma ad angolo e piegare la lama per rompere un piccolo pezzo. L'interruttore della lama può quindi bloccare la lama in posizione per l'uso come un piccolo bisturi.
NOTA: una lama deve durare per tutti i gruppi. Interruttore se la lama si rompe o diventa opaca. - Aggiungere una punta di pipetta pulita al P200 e rimuovere 1/5th della punta per il trasporto dei campioni.
- Preparare un nuovo tubo di microcentrifuge per ogni gruppo e aggiungere 200 L di 1x PBS per ogni tubo. Questo secondo tubo verrà utilizzato per raccogliere i prep DLM finali.
- Rimuovere tutti i 1x PBS dai tubi utilizzando una pipetta Pasteur.
- Indossando un equipaggiamento protettivo adeguato, immergere il tubo nel pallone di azoto liquido per 10 s con le pinzette criogeniche.
NOTA: I tubi devono essere chiusi strettamente per evitare che il tubo esplodi. - Togliere il tubo dall'azoto liquido e aggiungere circa 300 L di 1x PBS ghiacciato ai campioni con una pipetta Pasteur. Tenere i campioni sul ghiaccio.
- Aggiungere 1x PBS ghiacciato alla teglia da 10 cm rivestita con elastomero di silicone e erogare il primo torace con la pipetta modificata da 200 L.
- Posizionare il lato ventrale del torace verso l'alto. In una mano utilizzare una coppia noiosa di forceps per posizionare il torace e nell'altra utilizzare una bella coppia di forcemme per rimuovere alcuni del ganglio toracico per esporre la linea mediana del torace.
- Utilizzare la linea mediana del torace come guida per fare un taglio superficiale attraverso 1/3rd del torace con la lama.
- Rimuovere la lama dal torace e posizionare il torace ad un angolo di 45 gradi con le forceppo smussate. Reinserire la lama e tagliare verso il basso la linea mediana del torace. Questo si tradurrà in due emithoraces.
- Prendere un emithorax alla volta e rimuovere il tessuto in eccesso sotto la fibra muscolare DLM F (Figura 1B), la fibra più ventrale. Utilizzare la lama per fare con attenzione uno o due tagli per rimuovere il tessuto in eccesso senza danneggiare i DLM.
- Una volta isolato, trasferire l'emitorace al tubo corretto con 1x PBS.
- Ripetere i passaggi 4.6-u20124.14 fino a quando non vengono effettuati 10 emithoraces sezionati per gruppo.
5. Colorazione strutturale
- Dopo aver bisetico i campioni di torace, posizionare il tessuto nel buffer di blocco (1x PBS con 0,1% di siero di capra normale e 0,2% Triton X-100 a pH 7.4) per permeare il tessuto e prevenire la colorazione non specifica. Utilizzare una pipetta Pasteur per rimuovere l'eccesso di 1x PBS e aggiungere 1,5 mL di buffer di blocco a ciascun tubo. Bloccare i tessuti per almeno 1 h a 4 gradi centigradi.
- Preparare i campioni per la colorazione strutturale utilizzando un anticorpo coniugato fluorescente, perossidasi di rafano 488 (anti-HRP-488) con una diluizione di 1:200 e Phalloidin-647 ad una diluizione di 1:1000 nel buffer di blocco per macchiare i neuroni motori e il tessuto muscolare, rispettivamente. Fare abbastanza macchia per avere 150 L per tubo. Conservare la macchia a 4 gradi centigradi ricoperta di stagnola o in una scatola scura fino a quando non è pronta per la colorazione.
- Dopo il blocco, rimuovere il buffer di blocco in eccesso con una pipetta Pasteur in vetro.
- Prima di erogare la macchia strutturale, vortice la macchia. Aggiungere 150 L della macchia ad ogni tubo. Posizionare i campioni in una scatola scura sul rotatore a temperatura ambiente per 2 h.
- Rimuovere la macchia e lavare i tessuti quattro volte in 1,5 mL di spazio temp 1x PBS con 0,3% Triton X-100 per 5 min sul rotatore in una scatola scura. I campioni sono ora pronti per il montaggio su una diapositiva.
6. Tessuto di montaggio
- Dopo aver lavato i campioni in PBST, preparare un vetrerio al microscopio per montare il tessuto per la colorazione. Preparare forniture aggiuntive, tra cui slip di copertura in vetro, una pipetta P200, punte di pipetta da 200 L, forbici, rinforzi chiari, forcelle di bordo dritto, supporti di montaggio fluorescenti anti-dissolvenza, smalto per unghie e una scatola scura per coprire i vetrini.
- Etichettare il slide per identificare i campioni e pulire il scivolo con kimwipes per assicurarsi che non ci siano macchie.
- Per garantire che i campioni di emitorace non siano danneggiati dallo slittamento del coperchio, costruire un "ponte" utilizzando etichette di rinforzo. Prendere un'etichetta di rinforzo, tagliarla a metà e posizionare ogni metà a circa 15 mm di distanza. Questa distanza deve essere inferiore alla larghezza del coperchio. Ripetere questo passaggio quattro volte per completare un "ponte" alto 5 etichette.
- Prendere la pipetta P200 e modificare una punta tagliando 1/5th della punta per trasferire i campioni al scivolo. I campioni devono essere trasferiti sul scivolo al centro del ponte.
- Prendere il bordo di una salvietta di laboratorio e rimuovere eventuali PBST in eccesso. Utilizzando le forcepi, disporre i DLM in modo che tutti i campioni sono rivolti lato muscolare verso l'alto e cuticle lato verso il basso.
- Utilizzando una punta di pipetta P200 standard, applicare 70 L di supporto di montaggio sul faro, evitando le bolle d'aria. Erogare il supporto in un modello circolare all'interno dei rinforzi a partire dall'esterno verso il centro.
- Posizionare una copertura sopra i rinforzi.
- Utilizzare smalto per rivestire i bordi esterni intorno al perimetro del coverslip. Applicare generosamente per formare un sigillo completo del tessuto.
- Posizionare il scivolo su una superficie piana al buio, consentendo almeno 10 min di asciugare e prevenire il foto-sbiancamento o la perdita di fluorescenza. Le diapositive possono ora essere utilizzate per l'imaging immediatamente o in altro modo memorizzate in una cartella di diapositive a -20 gradi centigradi per una visualizzazione successiva.
7. Alternativa: Colorazione con anticorpi primari
NOTA: questa sezione è facoltativa e deve essere utilizzata direttamente tra le sezioni 4 e 5, se lo si desidera.
- Per macchiare il tessuto con anticorpi primari, immergere il tessuto nel buffer di blocco per almeno 1 h.
- Preparare l'anticorpo primario con una corretta diluizione nel buffer di blocco. Come minimo, preparare una miscela di anticorpi sufficiente per avere 150 L per gruppo. Si noti che i campioni vengono mantenuti fermi. Conservare a 4 gradi centigradi fino a quando non è pronto per l'uso.
- Rimuovere il buffer di blocco in eccesso con una pipette Pasteur. Vortice brevemente l'anticorpo primario e aggiungere 150 L di miscela di anticorpi a ciascun gruppo e posizionare i campioni a 4 gradi centigradi durante la notte.
- Il giorno successivo, rimuovere l'anticorpo primario e lavare il tessuto 4 volte con PBST per 5 min ciascuno su un rotatore.
- Preparare la macchia secondaria nel buffer di blocco. Aggiungere la macchia secondaria al campione e quindi mantenerla a temperatura ambiente per 2 h in una scatola scura sul rotatore.
NOTA: La colorazione secondaria può includere anche HRP e phalloidin. - Dopo l'incubazione di 2 h, rimuovere il tessuto secondario di lavaggio delle macchie 4 volte per 5 minuti con PBST e procedere al montaggio.
Risultati
La generazione di mosche transgeniche che esprimono la proteina di associazione al Tar umana di 43 kDa mutante (TDP-43M337V) è rappresentata dallo schematico (Figura 1A). Questo dimostra l'applicazione del sistema binario Gal4/UAS in Drosophila27. L'illustrazione raffigura un emitorace con sei fibre muscolari, A-u2012F che va dalla fibra A più dorsale alla più ventrale F (Figura 1B)11,12. Per valutare l'integrità sinaptica, gli NMJ sono stati macchiati con HRP e Phalloidin (Figura 1C-u2012E). I motoneuroni nei mutanti TDP-43M337V (Figura 1F) hanno poca o nessuna colorazione HRP entro il giorno 21, mentre WT (Oregon-R) rimane intatto (Figura 1C). Non esistono differenze visibili nella colorazione muscolare (Figura 1D,G). I cambiamenti nella morfologia lorda osservati nei mutanti TDP-43M337V dimostrano come l'integrità sinaptica possa essere implicata in un modello di malattia neurodegenerativa della sclerosi laterale amiotrofica (SLA) utilizzando il modello DLM adulto. Oltre alla colorazione strutturale, colorare i DLM NMJ può anche fornire una valutazione dell'integrità sinaptica con marcatori presinaptici (Figura 2A -u2012R) e post sinaptico (Figura 2S -u2012X). Insieme, questi risultati illustrano come questo protocollo di dissezione potrebbe essere applicato allo studio del tessuto DLM nelle malattie neurodegenerative.
Un aspetto chiave di questa dissezione è l'applicazione di azoto liquido per lampeggiare congelare il tessuto per rendere la bisezione più facile. L'utilità dell'azoto liquido è dimostrata nei moscerini WT con azoto liquido in cui il tessuto muscolare non ha danni o fibre rubate (Figura 3A-u2012C). Senza azoto liquido, il tessuto può essere più difficile da sezionare. Ad esempio, seguendo questo protocollo e saltando la fase di congelamento flash di azoto liquido, il tessuto può essere più suscettibile ai danni causati dagli strumenti di dissezione, come i neuroni danneggiati (Figura 3D) o le fibre muscolari danneggiate (Figura 3E). L'applicazione dell'azoto liquido aiuta a prevenire i danni ai tessuti che potrebbero verificarsi quando si lavora con il tessuto DLM indipendentemente dal genotipo del campione (Figura 3C e 3F).
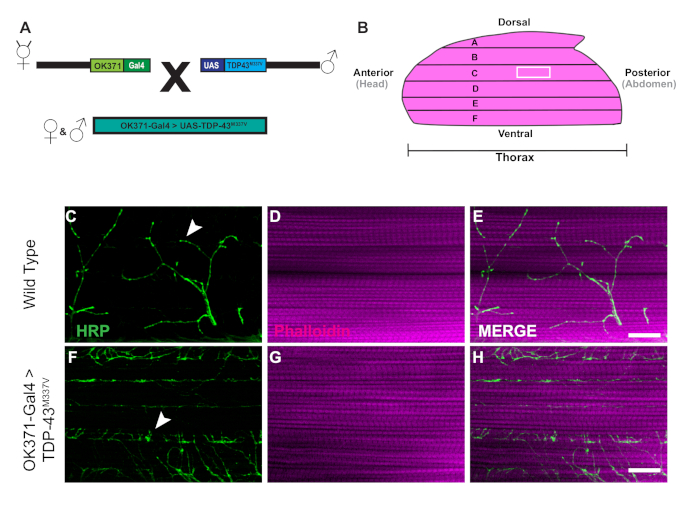
Figura 1: denervazione progressiva delle sinapsi DLM in un modello di Drosophila della SLA. (A) La generazione di mosche transgeniche alS che esprimono una forma mutante umana di proteina Tar-Binding di 43 kDa (TDP-43) sono mostrate nello schema. (B) L'illustrazione raffigura la forma e l'orientamento di un emitorace in una Drosophila adulta. Utilizzando il protocollo, possiamo osservare la progressiva perdita di integrità sinaptica delle sinapsi DLM NMJ attraverso la colorazione strutturale dei motoneuroni con HRP (verde) e tessuto muscolare con Phalloidin (magenta). Il nostro modello raffigura la perdita di integrità sinaptica in un modello adulto di SLA attraverso la generazione di mosche adulte che esprimono un mutante da TDP-43M337V umano nei motoneuroni (Figura 1F-u2012H) rispetto a WT (Figura 1C -u2012E) mosche in fibra muscolare C. Le frecce evidenziano esempi di una sinapsi WT (Figura 1C) e un esempio di perdita di integrità sinaptica. Barra della scala di 20 m con ingrandimento 63x. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
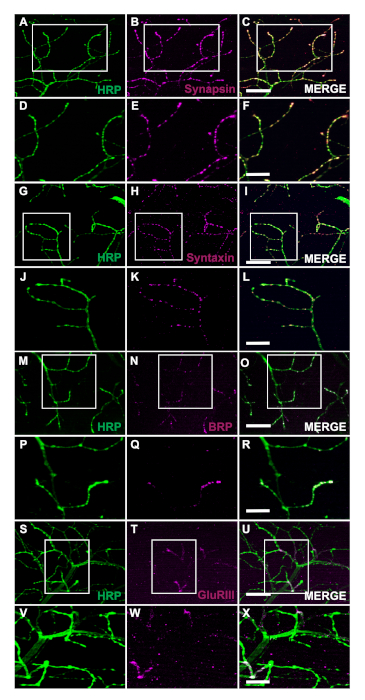
Figura 2: Valutazione dell'integrità sinaptica utilizzando marcatori presinaptici presso NMJ adulti. L'integrità sinaptica può anche essere valutata utilizzando marcatori presinaptici e post-sinaptici nelle mosche WT che hanno 14 giorni nella fibra muscolare C. I marcatori presinaptici Synapsin (B), Syntaxin (H) e Bruchpilot (BRP) (N) sono co-macchiati con HRP (A, G, M). La colorazione raffigura la localizzazione di questi marcatori ai terminali presinaptici (C, I, O). Con un ingrandimento più elevato, le immagini illustrano la localizzazione di Synapsin (E), Syntaxin (K) e BRP (Q) con HRP (D, Je P) in modo più dettagliato (Figura F, Le R). Mostriamo anche un marcatore post-aaaaptico Glutamate Receptor III (GluRIII) (T) co-macchiato con HRP (S). La co-colorazione dimostra l'utilità di questi marcatori (U). A ingrandimento più elevato le immagini rappresentative esemplificano la localizzazione (X) di GluRIII (W) e HRP (V) rispettivamente al tessuto muscolare post-sinaptico e ai terminali presinaptici. La barra della scala per i pannelli A, U2012C, G-I, M'u2012O, S'u2012U rappresentano 20 m con ingrandimento 63x. La barra della scala per i pannelli D-u2012F, 2J-2L, 2P-2R e 2V-2X rappresentano 10 m con ingrandimento 63x. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
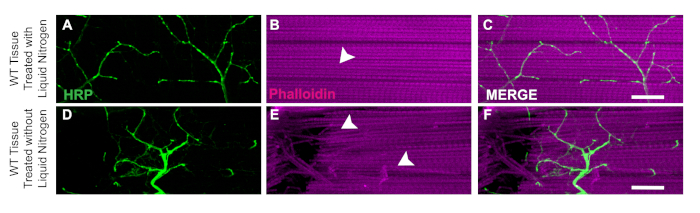
Figura 3: Utilità dell'azoto liquido per le dissezioni DLM. Per dimostrare l'utilità dell'azoto liquido per le dissezioni DLM, mostriamo un confronto tra le mosche del giorno 21 WT con e senza azoto liquido dalla fibra muscolare C. Con l'azoto liquido, Phalloidin (B) rimane intatto e non compromette la colorazione HRP (A, C). Senza azoto liquido, il tessuto muscolare diventa stringato e difficile da bisecarsi (E) e la colorazione HRP (D, F) viene compromessa a causa di un errore tecnico. Le frecce bianche mostrano un'area senza danni muscolari con azoto liquido (B) e tessuto muscolare danneggiato (E). Barra della scala: 20 m con ingrandimento 63x. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Utilizzando i metodi descritti in questo protocollo, forniamo un approccio semplice per la dissezione del tessuto DLM e dimostriamo come questo può essere applicato per valutare l'integrità sinaptica attraverso colorazione strutturale e marcatori sinaptici nella Drosophila adulta. Un passo critico nel protocollo che rende il tessuto DLM più facile da sezionare è il congelamento flash con azoto liquido. Senza questo passaggio, il tessuto è meno solido e più difficile da tagliare con precisione come osservato nella Figura 3. Questo protocollo si basa su precedenti metodi di dissezione per consentire la conservazione sia dei motoneuroni che del tessutomuscolare 18,19,20,21,22,23. Una limitazione di questo protocollo è che quando si effettua il taglio verso il basso la linea mediana per la bisezione, può essere difficile ottenere due preparati puliti per torace. Un modo per garantire almeno un emitorace per mosca, è intenzionalmente possibile tagliare su un lato del torace per ottenere una preparazione pulita. Con questa modifica, potrebbe anche essere necessario rimuovere ulteriore tessuto in eccesso dal taglio per pulire il campione con l'interruttore della lama. Per coloro che sono nuovi a questa tecnica, con la pratica continua, la precisione della bisezione aumenterà.
Il metodo qui descritto consente ai ricercatori di valutare facilmente l'integrità strutturale dei DLM NMJ adulti in qualsiasi momento durante la loro vita. Uno dei principali vantaggi di questo protocollo è la capacità di accedere all'integrità sinaptica nei modelli di malattia neurodegenerativa utilizzando marcatori sinaptici. Dimostriamo che questa applicazione può aiutare a visualizzare i cambiamenti nella morfologia lorda con colorazione strutturale (Figura 1C-u2012H). Inoltre, l'integrità sinaptica può essere valutata con la colorazione dei marcatori presinaptici, inclusi ma non limitati a Synapsin28 (Figura 2A ,u2012F), Syntaxin29 (Figura 2G ,u2012L) e BRP30 (Figura 2M -u2012R). Il tessuto muscolare post-sinaptico può anche essere valutato utilizzando l'anticorpo della sottounità Glutamate Receptor III31 (Figura 2S -u2012X), dimostrando l'utilità di questo protocollo.
I ricercatori possono anche utilizzare questo metodo di dissezione per integrare i dati funzionali per esaminare in modo completo l'integrità strutturale delle sinapsi associate a un'ampia varietà di malattie. Queste sinapsi consentono anche l'analisi funzionale attraverso registrazioni elettrofisiologiche32,33,34 e il test di volo10. Questo protocollo può anche fornire facilità di accesso al tessuto per molte applicazioni e saggi. Studi futuri, ad esempio, potrebbero utilizzare questo protocollo per quantificare le modifiche sinaptiche attraverso la quantificazione della densità e del numero di sinapsi15,16. Mentre il protocollo qui descritto esamina specificamente l'integrità sinaptica dei motoneuroni, i protocolli complementari per valutare la perdita delle cellule muscolari possono essere eseguiti anche con questa dissezione utilizzando la colorazione TUNEL35. Per esaminare la perdita neuronale, la dissezione del gangliotoracico 36 potrebbe essere utilizzata anche con la colorazione TUNEL. Ci aspettiamo che la dissezione qui descritta avrà più applicazioni per studi futuri che valutano le patologie legate all'età e le malattie neurodegenerative.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Questo lavoro è stato sostenuto dai National Institutes of Health (R01 NS110727) a D.T.B.
Materiali
| Name | Company | Catalog Number | Comments |
| 32% Formaldehyde | Electron Microscopy Sciences | 15714 | Tissue preservation |
| Alexa Fluor 568 goat anti mouse | Fisher Scientific | A11031 | Labels primary antibodies. Used at 1:200 concentration. |
| Alexa Fluor 568 goat anti rabbit | Fisher Scientific | A11036 | Labels primary antibodies. Used at 1:200 concentration. |
| anti- Bruchpilot (BRP) antibody | Developmental Studies Hybridoma Bank | NC82 | Stains the active zones in presynaptic neurons. Used at 1:25 concentration. |
| anti-GluRIII antibody | Gift from Aaron DiAntonio | N/A | Labels glutamate receptor subunits. Used at 1:1000 concentration. |
| anti-Synapsin antibody | Developmental Studies Hybridoma Bank | 3C11 | Labels the synaptic protein synapsin. Used at 1:50 concentration. |
| anti-Syntaxin antibody | Developmental Studies Hybridoma Bank | 8C3 | labels the synaptic protein syntaxin. Used at 1:10 concentration. |
| BenchRocker | Genesee Scientific | 31-302 | Rotating samples during staining |
| Blade Breaker | Fine Science Tools | 10053-09 | Used for holding feather blade |
| cover slips | Fisher Scientific | 12548A | For mounting tissue |
| cryogenic gloves | VWR | 97008-198 | protect hands from liquid nitrogen |
| cryogenic tweezers | VWR | 82027-432 | Hold 2.0 mL tube in liquid nitrogen |
| dewar flask-1900 mL | Thomas Scientific | 5028M54 | Hold liquid nitrogen |
| Feather Blades | Electron Microscopy Sciences | 72002-01 | Scalpel Blades |
| Fine Forecps x 2 | Fine Science Tools | 11252-20 | One fine pair for Clearing midline of thorax. The other pair can be dulled using a sharpening stone. |
| FITC-conjugated anti HRP | Jackson Laboratories | 123-545-021 | Stains Motor Neurons. Used at 1:100 concentration |
| freezer box (Black) | Fisher Scientific | 14100F | Protects samples from light |
| glass pasteur pipettes | VWR | 14637-010 | Used to transfer samples |
| glass slides | Fisher Scientific | 12550143 | For mounting tissue |
| mounting media (vectashield) anti-fade | VWR | 101098-042 | Mounting media retains fluorescent signaling |
| nail polish | Electron Microscopy Sciences | 72180 | Seals microscope slides |
| normal goat serum | Fisher Scientific | PCN5000 | Prevents non-specific binding of antibodies |
| paint brush | Genesee Scientific | 59-204 | Transferring flies |
| PBS | Fisher Scientific | 10-010-023 | Saline solution for dissecting and staining |
| Phalloidin 647 | Abcam | AB176759 | Stains F-Actin in muscle Tissue. Used at 1:1000 concentration |
| plastic petri dish (100 mm) | VWR | 25373-100 | Dissection dish |
| reinforcement labels | W.B. Mason | AVE05722 | Provides support for glass coverslip over the mounted tissue |
| sharpening block | Grainger | 1RDF5 | Keeping fine forceps sharp and also dulling separate pair |
| slide folder | VWR | 10126-326 | Sample storage |
| standard office scissors | W.B. Mason | ACM40618 | Cutting reinforcement labels |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | Coating for dissection dish |
| Triton-X-100 | Electron Microscopy Sciences | 22140 | Helps to permeabilize tissue |
| Vannas Disssection Sissors | Fine Science Tools | 1500-00 | Ued for removing fly legs and making an incision on thorax |
Riferimenti
- Casas, C., Manzano, R., Vaz, R., Osta, R., Brites, D. Synaptic failure: focus in an integrative view of ALS. Brain Plasticity. 1, 159-175 (2016).
- Lodato, M. A., et al. Aging and neurodegeneration are associated with increased mutations in single human neurons. Science. 359, 555-559 (2018).
- López-Erauskin, J., et al. ALS/FTD-linked mutation in FUS suppresses intra-axonal protein synthesis and drives disease without nuclear loss-of-function of FUS. Neuron. 100, 816-830 (2018).
- Munsie, L., et al. Retromer-dependent neurotransmitter receptor trafficking to synapses is altered by the Parkinson's disease VPS35 mutation p. D620N. Human Molecular Genetics. 24, 1691-1703 (2015).
- Oddo, S., et al. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Aβ and synaptic dysfunction. Neuron. 39, 409-421 (2003).
- Selkoe, D. J. Alzheimer's disease is a synaptic failure. Science. 298, 789-791 (2002).
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Current Opinion in Neurobiology. 17, 35-42 (2007).
- Jan, L., Jan, Y. Properties of the larval neuromuscular junction in Drosophila melanogaster. The Journal of Physiology. 262, 189-214 (1976).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Babcock, D. T., Ganetzky, B. An improved method for accurate and rapid measurement of flight performance in Drosophila. Journal of Visualized Experiments. , e51223 (2014).
- Fernandes, J., Bate, M., Vijayraghavan, K. Development of the indirect flight muscles of Drosophila. Development. 113, 67-77 (1991).
- Fernandes, J., VijayRaghavan, K. The development of indirect flight muscle innervation in Drosophila melanogaster. Development. 118, 215-227 (1993).
- Fernandes, J. J., Keshishian, H. Patterning the dorsal longitudinal flight muscles (DLM) of Drosophila: insights from the ablation of larval scaffolds. Development. 122, 3755-3763 (1996).
- Fernandes, J. J., Keshishian, H. Nerve-muscle interactions during flight muscle development in Drosophila. Development. 125, 1769-1779 (1998).
- Hebbar, S., Fernandes, J. J. Pruning of motor neuron branches establishes the DLM innervation pattern in Drosophila. Journal of Neurobiology. 60, 499-516 (2004).
- Hebbar, S., Fernandes, J. J. A role for Fas II in the stabilization of motor neuron branches during pruning in Drosophila. Developmental Biolology. 285, 185-199 (2005).
- Danjo, R., Kawasaki, F., Ordway, R. W. A tripartite synapse model in Drosophila. PloS One. 6, (2011).
- Hunt, L. C., Demontis, F. Whole-mount immunostaining of Drosophila skeletal muscle. Nature Protocols. 8, 2496-2501 (2013).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of Visualized Experiments. , e2438 (2010).
- Llamusi, B., et al. BSF and TBPH are mislocalized in the muscle sarcomere of a Drosophila myotonic dystrophy model. Disease Models & Mechanisms. 6, 184-196 (2013).
- Pantoja, M., Fischer, K. A., Ieronimakis, N., Reyes, M., Ruohola-Baker, H. Genetic elevation of sphingosine 1-phosphate suppresses dystrophic muscle phenotypes in Drosophila. Development. 140, 136-146 (2013).
- Schnorrer, F., et al. Systematic genetic analysis of muscle morphogenesis and function in Drosophila. Nature. 464, 287-291 (2010).
- Viswanathan, M. C., Blice-Baum, A. C., Schmidt, W., Foster, D. B., Cammarato, A. Pseudo-acetylation of K326 and K328 of actin disrupts Drosophila melanogaster indirect flight muscle structure and performance. Frontiers in Physiology. 6, 116 (2015).
- Hebbar, S., Fernandes, J. J. Glial remodeling during metamorphosis influences the stabilization of motor neuron branches in Drosophila. Developmental Biology. 340, 344-354 (2010).
- Mahr, A., Aberle, H. The expression pattern of the Drosophila vesicular glutamate transporter: a marker protein for motoneurons and glutamatergic centers in the brain. Gene Expression Patterns. 6, 299-309 (2006).
- Ritson, G. P., et al. TDP-43 mediates degeneration in a novel Drosophila model of disease caused by mutations in VCP/p97. Journal of Neuroscience. 30, 7729-7739 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Klagges, B. R., et al. Invertebrate synapsins: a single gene codes for several isoforms in Drosophila. Journal of Neuroscience. 16, 3154-3165 (1996).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proceedings of the National Academy of Sciences of the United States of America. 79, 7929-7933 (1982).
- Wagh, D. A., et al. a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila. Neuron. 49, 833-844 (2006).
- Marrus, S. B., DiAntonio, A. Preferential localization of glutamate receptors opposite sites of high presynaptic release. Current Biology. 14, 924-931 (2004).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological recordings from the giant fiber pathway of D. melanogaster. Journal of Visualized Experiments. , e2412 (2011).
- Maccioni, R., et al. Standardized phytotherapic extracts rescue anomalous locomotion and electrophysiological responses of TDP-43 Drosophila melanogaster model of ALS. Scientific Reports. 8, 16002 (2018).
- Siddiqi, O., Benzer, S. Neurophysiological defects in temperature-sensitive paralytic mutants of Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 73, 3253-3257 (1976).
- Wang, Z. H., Clark, C., Geisbrecht, E. R. Drosophila clueless is involved in Parkin-dependent mitophagy by promoting VCP-mediated Marf degradation. Human Molecular Genetics. 25, 1946-1964 (2016).
- O'Sullivan, A., et al. Multifunctional Wing Motor Control of Song and Flight. Current Biology. 28, 2705-2717 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon