Method Article
Un modello biomimetico per il cancro al fegato per studiare le interazioni tumore-stroma in un ambiente 3D con proprietà bio-fisiche tonnibili
In questo articolo
Riepilogo
Questo protocollo presenta un modello biomimetico 3D con compartimento stromale fibrotico di accompagnamento. Preparato con idrogel fisiologicamente rilevanti in rapporti che imitano le proprietà bio-fisiche della matrice extracellulare stromale, mediatore attivo delle interazioni cellulari, della crescita tumorale e della metastasi.
Abstract
Il carcinoma epatocellulare (HCC) è un tumore epatico primario che si sviluppa sulla scia della malattia epatica cronica. La malattia epatica cronica e l'infiammazione portano a un ambiente fibrotico che supporta e guida attivamente l'epatocarcinogenesi. La comprensione dell'epatocarcinogenesi in termini di interazione tra il micro-ambiente dello stroma tumorale e le cellule tumorali è quindi di notevole importanza. I modelli tridimensionali di coltura cellulare (3D) sono proposti come l'anello mancante tra gli attuali modelli di coltura cellulare 2D in vitro e i modelli animali in vivo. Il nostro obiettivo era quello di progettare un nuovo modello HCC biomimetico 3D con compartimento stromale fibrotico e vascucolatura. Idrogel fisiologicamente rilevanti come collagene e fibrinogeno sono stati incorporati per imitare le proprietà bio-fisiche dell'ECM tumorale. In questo modello le cellule LX2 ed HepG2 incorporate in una matrice di idrogel sono state seminate sull'inserto transmembrana invertito. Le cellule HUVEC sono state quindi seminate sul lato opposto della membrana. Sono state preparate tre formulazioni costituite da ECM-idrogel incorporati nelle cellule e le proprietà bio-fisiche sono state determinate dalla reologia. La vitalità delle cellule è stata determinata da un saggio di vitalità cellulare per 21 giorni. L'effetto della doxorubicina del farmaco chemioterapico è stato valutato sia nella co-coltura 2D che nel nostro modello 3D per un periodo di 72h. I risultati reologia mostrano che le proprietà bio-fisiche di un fegato fibrotico, cirrotico e HCC possono essere mimicked con successo. Nel complesso, i risultati indicano che questo modello 3D è più rappresentativo della situazione in vivo rispetto alle culture 2D tradizionali. Il nostro modello tumorale 3D ha mostrato una diminuzione della risposta alla chemioterapica, imitando la resistenza ai farmaci tipicamente osservata nei pazienti con HCC.
Introduzione
Il carcinoma epatocellulare (HCC) comprende il 90% di tutti i tumori primari delfegato 1,2. Con 810.000 decessi e 854.000 nuovi casi segnalati ogni anno, è attualmente classificato come il quinto cancro più comune al mondo con una delle più alte incidenze di mortalità1. Lo sviluppo dell'HCC è principalmente attribuito all'infiammazione associata a malattie croniche del fegato, vale a dire epatite virale, assunzione cronica eccessiva di alcol, sindrome metabolica, obesità e diabete1,3,4. L'infiammazione associata a queste condizioni patologiche si traduce in lesioni da epatociti e secrezione di varie citochine che attivano e reclutano cellule stellate epatiche e cellule infiammatorie per avviare la fibrosi5. Le cellule stellate epatiche sono note per il loro ruolo chiave nell'iniziazione, nella progressione e nella regressione della fibrosi epatica. Al momento dell'attivazione si differenziano in miofibroblasti come cellule con proprietà contrattili, pro-infiammatorie e pro-fibrinogene6,7,8. La fibrosi risultante a sua volta causa la disregolazione dell'attività enzimatica di rimodellamento della matrice extracellulare, creando un ambiente caratterizzato da una maggiore rigidità complessiva accompagnata dalla secrezione di fattori di crescita, che contribuisce ulteriormente alla patogenesi HCC9,10. È questo ciclo di feedback patogeno continuo tra epatociti e ambiente stromale, che alimenta l'iniziazione del cancro, le transizioni epiteliali a mesenchimali (EMT), l'angiogenesi, il potenziale metastatico e la risposta alteratadel farmaco 11,12,13. La comprensione dell'epatocarcinogenesi in termini di interazione tra il tumore e il micro-ambiente tumorale è, quindi, di notevole importanza non solo dal punto di vista meccanicistico ma anche dal punto di vista del trattamento.
I modelli di coltura cellulare bidimensionale (2D) in vitro sono utilizzati prevalentemente dall'80% dei biologi delle celluletumorali 14. Tuttavia, questi modelli non sono rappresentativi del vero micro-ambiente tumorale, che colpisce le risposte chemioterapeutiche14,15,16. Attualmente il 96% dei farmaci chemioterapici fallisce durante gli studiclinici 14. Questa elevata incidenza nei tassi di attrito dei farmaci può essere attribuita al fatto che i modelli di pre-screening in vitro disponibili non rappresentano pienamente la nostra attuale visione e comprensione della complessità hcc e del microambiente16. Al contrario, i modelli animali in vivo presentano un sistema immunitario compromesso e discrepanze nelle interazioni tra il tumore e il microambiente rispettoall'uomo 16,17. In media solo l'8% dei risultati ottenuti da studi sugli animali può essere tradotto in modo affidabile dal contesto precli clinicalo a quelloclinico 16,17. Pertanto, è chiaro che la valutazione dell'HCC richiede lo sviluppo di una piattaforma in vitro che ricapitola efficacemente la complessità non solo del tumore ma anche del microambiente. Le piattaforme integrerebbe i modelli di screening preclino in vitro attualmente disponibili e ridurrebbe la quantità di studi sugli animali infuturo 7,14.
Una di queste piattaforme sono modelli avanzati di coltura cellulare tridimensionale (3D). Una moltitudine di questi modelli 3D avanzati per studiare HCC sono emersi nell'ultimo decennio e sono state pubblicate varie recensioni. I modelli 3D disponibili per studiare HCC includono sferoidi multicellulari, organoidi, modelli basati su impalcature, idrogel, microfluidici e bio-stampa. Di questi, gli sferoidi multicellulari sono uno dei modelli più noti utilizzati nello studio dello sviluppo tumorale. Gli sferoidi sono un modello economico con bassa difficoltà tecnica e allo stesso tempo imitano efficacemente l'architettura tumorale in vivo18,19,20. Gli sferoidi multicellulari hanno contribuito a una vasta gamma di informazioni su HCC17,21,22. Tuttavia, il tempo di coltura standardizzato è carente in quanto gli sferoidi multicellulari sono tenuti in coltura tra 7 e 48 giorni. L'aumento del tempo della cultura è di notevole importanza. Eilenberger ha scoperto che le differenze nell'età degli sferoidi influenzano profondamente la diffusività e la tossicità della Sorafenib (un inibitore della chinasi utilizzato per il trattamento dei tumori del fegato)23. Mentre Wrzesinski e Fey hanno scoperto che gli sferoidi epatociti 3D richiedono 18 giorni per ristabilire le funzioni fisiologiche chiave del fegato dopo la tripsidenza e continuano a mostrare la funzionalità stabile fino a 24 giorni dopo questorecupero 24,25.
Alcuni dei modelli HCC 3D più avanzati includono l'uso di impalcature epatiche decellularizzate umane e impalcature biostampate. Mazza e colleghi hanno creato un'impalcatura 3D naturale per la modellazione HCC utilizzando fegati umani decellularizzati non adatti al trapianto26. Queste impalcature naturali potrebbero essere ripopolate con successo per 21 giorni con una co-coltura di stellete epatiche e cellule epatoblastoma, pur mantenendo l'espressione di componenti chiave della matrice extracellulare come collagene di tipo I, III, IV e fibronectina. Oltre alla modellazione delle malattie, questo modello offre anche il vantaggio del trapianto funzionale di organi e dello screening preclinale di farmaci e tossicità26. Con i progressi della bio-stampa 3D, le impalcature a matrice extracellulare 3D possono ora essere biostampate. Ma e colleghi, impalcature a matrice extracellulare biostampate con proprietà meccaniche variabili e microarchitettura biomimetica utilizzando idrogel ingegnere da matrice extracellulare decellularizzata27. Indubbiamente questi sono tutti eccellenti modelli HCC 3D. Tuttavia, l'indisponibilità di fegati umani e il costo necessario per l'acquisizione delle attrezzature e dei materiali necessari ingaliscono questi modelli in una posizione di svantaggio. Inoltre, questi metodi sono tutti tecnicamente avanzati che richiedono una formazione estesa che potrebbe non essere prontamente disponibile per tutti i ricercatori.
Sulla base della complessità di HCC e dei modelli 3D attualmente disponibili, abbiamo cercato di sviluppare un modello HCC 3D onnicomprensore. Abbiamo puntato a un modello in grado di ricapitolare sia il microambiente premalignante che quello tumorale incorporando valori di rigidità regolabili dell'idrogel. Inoltre, abbiamo incluso anche linee cellulari associate all'epatocellulare e allo stroma, che svolgono un ruolo chiave nella patogenesi dell'HCC. Questi includono cellule endoteliali, cellule stellate epatiche ed epatociti maligni, coltivati in un microambiente composto da idrogel fisiologicamente rilevanti. Con gli idrogel scelti, collagene di tipo I e fibrinogeno, incorporati in rapporti paragonabili ai cambiamenti bio-fisici osservati nella rigidità epatica durante l'iniziazione e la progressione dell'HCC. Inoltre, mirava a un modello che potesse essere mantenuto in cultura per un periodo di tempo prolungato. Abbiamo immaginato un modello modulare ed economico che può essere configurato con attrezzature di base, formazione ed esperienza minime e materiali prontamente disponibili.
Protocollo
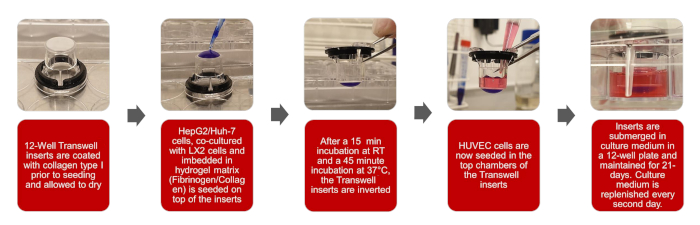
Figura 1: Rappresentazioni grafiche della creazione del modello HCC biomimetico 3D Fare clic qui per visualizzare una versione più ampia di questa figura.
NOTA: Il flusso di lavoro complessivo di questo protocollo è stabilito nelle illustrazioni della figura 1
1. Preparazione della soluzione di stock di fibrinogeno
- Preparare una soluzione stock di cloruro di calcio da 1 M (CaCl2),pesando 2,21 g cacl2 e aggiungendola all'acqua distillata da 20 mL (dH2O). La soluzione stock può essere conservata a temperatura ambiente (RT).
- Preparare una soluzione stock di aprotinina da 20 mL (1218,75 KIU/mL) pesando 5 mg di aprotinina e aggiungendola alla soluzione stock di20mL dH 2 O. Aliquot in aliquote da 1 mL e conservare a -20 °C.
- Preparare una soluzione di 10 mL di 80 mg/mL di soluzione di fibrinogeno.
- In un tubo da 50 ml aggiungere 7.849 mL di soluzione salina tamponata con fosfato (PBS), 2,051 mL di aprotinina (1218,75 KIU/mL) per una concentrazione finale di aprotinina di 250 KIU/mL e 100 μL CaCl2 (1M) per una concentrazione finale di CaCl2 di 10 mM.
- Pesare 800 mg di fibrinogeno.
- Pesare 200 mg di cloruro di sodio (NaCl) affinché la soluzione stock contenga il 2% con NaCl.
- Aggiungere il fibrinogeno e il NaCl in incrementi al tubo da 50 mL contenente pbs, aprotinina e CaCl2. Non mescolare o agitare vigorosamente in quanto ciò si tradurrà in gelifici fibrinogeni e grumi che si formano nella soluzione.
- Posizionare il tubo da 50 ml della soluzione di calcio fibrinogeno orizzontalmente su uno shaker e agitare a un ambiente basso di 300 giri/min.
- Una volta che la soluzione si è sciolta, filtrarla utilizzando un filtro siringa da 0,22 μm o un filtro superiore della bottiglia a seconda del volume. È importante sottolineare che non autoclavare la soluzione di fibrinogeno in quanto ciò distruggerà il fibrinogeno.
NOTA: Questa parte del protocollo può richiedere da 2 a 5 ore a seconda della quantità di soluzione stock, questo tempo dovrebbe essere preso in considerazione durante la configurazione sperimentale.
2. Inserti di rivestimento con collagene prima di seminare gli idrogel sugli inserti
- In una cappa di flusso laminare o in un cappuccio di coltura tissutale, utilizzando pinzette sterilizzate, rimuovere gli inserti dalla piastra e posizionarlo invertito sul coperchio della piastra.
- Preparare una soluzione di 100 mL di 20 mM di acido acetico glaciale aggiungendo 115 μL di acido acetico glaciale a 25 ml di dH 2 O eregolaread un volume finale di 100 mL con dH 2 O.Filtrarela soluzione utilizzando un filtro siringa da 0,22 μm. La soluzione stock può essere memorizzata su RT.
- Preparare 2 mL di una soluzione di collagene da 100 μg/mL da una soluzione di collagene da 5 mg/mL aggiungendo 40 μL della soluzione di collagene da 5 mg/mL a 1,960 mL della soluzione di stock di acido acetico glaciale da 20 mM preparata in 2,2.
- Rivestire gli inserti con la soluzione di collagene da 100 μg/mL preparata in 2.3 pipettando 100 μL della soluzione su ogni inserto. Lasciare asciugare l'aria all'interno della cappa a flusso laminare o della cappa di coltura tissutale per 2-3 ore.
- Una volta che gli inserti hanno asciugato lavare ogni inserto 3x con PBS. Aggiungere 1 mL di PBS ad ogni pozzo di una piastra di 12 pozza, posizionare gli inserti con rivestimento di collagene rivolto verso il basso nei pozzi, rimuovere il PBS dal pozzo e ripetere la procedura. Lasciare asciugare l'aria all'interno della cappa di flusso laminare da 1 a 2 ore.
ATTENZIONE: L'acido acetico è tossico per le cellule e gli inserti devono essere lavati accuratamente con PBS. - Aggiungere un distanziale stampato in 3D personalizzato sugli inserti, questo sarà necessario una volta che i gel sono appesi all'inserto per impedire loro di toccare il pozzo inferiore della piastra(Figura 2).

Figura 2: Distanziale stampato in 3D personalizzato Fare clic qui per visualizzare una versione più grande di questa figura.
- Coprire gli inserti invertiti con la parte inferiore della piastra e posizionarlo nell'incubatrice fino a quando le cellule non sono incorporate negli idrogel e pronte per essere seminate.
3. Cellule di semina incorporate in idrogel su inserti
NOTA: La tabella 1 fornisce una descrizione di 3 formulazioni con concentrazioni variabili di fibrinogeno che verranno preparate. La prima formulazione corrisponde al fegato durante l'insorgenza della fibrosi, due cirrosi e tre HCC, i valori di rigidità per ciascuna di queste formulazioni sono stati determinati con reologia durante l'ottimizzazione del protocollo.
| Formulazione | Concentrazione finale di fibrinogeni (mg/mL) | Concentrazione finale di collagene (mg/mL) | Cellule (coltura LX2 + HepG2 1:1) | Stadio del fegato | Valori di rigidità epatica della letteratura (kPa) | Valore di rigidità del modello di Reologia (kPa) | Formulazione | Fibrinogen da aggiungere (mL) | Collagene da aggiungere (mL) | 10 % DMEM (mL) | Trombina (μL) | Riferimenti |
| 1 | 10 | 2 | 2 x 106 celle/mL | Fibrosi | ≥2 | 3 | 1 | 1 | 0.8 | 0.2 | 4 | 28; 29; 30 |
| 2 | 30 | 2 | 2 x 106 celle/mL | Cirrosi | 6 | 2 | 0.75 | 0.8 | 0.45 | 3 | ||
| 3 | 40 | 2 | 2 x 106 celle/mL | Hcc | ≥10 anni | 10 | 3 | 0.25 | 0.8 | 0.95 | 1 | 28; 31; 32 |
Tabella 1: Descrizione delle formulazioni per le cellule di semina incorporate negli idrogel sugli inserti
- Preparare 1 M di soluzione di idrossido di sodio aggiungendo 3,99 g di NaOH a 100 mL di dH2O. La soluzione può quindi essere filtrata utilizzando un filtro siringa da 0,22 μm. Conservare la soluzione stock su RT.
- Mettere il collagene da 5 mg/mL e 10 mL di 1 M NaOH sul ghiaccio.
- Preriscaldare 50 mL PBS, 15 mL di tripina, 70 mL 10% DMEM e soluzione di stock di fibrinogeno, preparata nella sezione 1, a 37 °C per 20 minuti in un bagno d'acqua.
- Preparare le sospensioni cellulari.
- Lavare le cellule stellate epatiche (LX2) e il carcinoma epatico (HepG2) nelle fiasche di coltura T175 due volte con 10 mL di PBS.
- Tripinare le cellule con tripina di 6 mL per 4 min a 37 °C.
- Inattivare la tripina con 6 mL del 10% di DMEM.
- Raccogliere la sospensione cellulare in tubo da 15 ml e centrifugare per 3 min a 300 x g.
- Dopo la centrifugazione, aspirare il supernatante e rimescolare ogni linea cellulare in 5 mL del 10% DMEM.
- Contare le celle utilizzando un contatore di celle automatizzato: aggiungere 10 μL di ogni sospensione cellulare allo scivolo della camera di conteggio e inserire la diapositiva nel contatore della cella. Il conteggio delle celle viene visualizzato come celle/mL.
- Diluire le celle da ogni linea cellulare a 1 x 106 celle per ml utilizzando il numero di celle nel passaggio 3.4.6 in tubi da 15 ml chiaramente contrassegnati. Centrifugare le diluizioni per 3 min a 300 x g.
- Dopo la centrifugazione, aspirare il supernatante e aggiungere il 10% di DMEM a ciascun tubo da 15 ml secondo la tabella 1, i valori forniti nella tabella sono per 2 ml di ciascuna formulazione.
- Neutralizzare la quantità di collagene con 10 μL / mL NaOH (1 M) e aggiungere il collagene neutralizzato alla sospensione cellulare, il 10% di DMEM presente diventerà giallo, una volta che la sospensione viene mescolata accuratamente pipettando con una punta tagliata diventerà un rosa brillante.
- Aggiungere il fibrinogeno alla sospensione delle cellule collagene secondo la tabella 1, utilizzando una punta di pipetta tagliata, mescolare accuratamente la sospensione.
- Infine aggiungere trombina alla sospensione cellulare collagene-fibrinogeno, 0,1 TROMBINA KIU per ogni 10 mg di fibrinogeno.
- Rimuovere dall'incubatore gli inserti rovesciati pre-rivestiti preparati nella sezione 2 e utilizzando una punta di pipetta da 200 μL tagliata, pipetta 200 μL della sospensione preparata sugli inserti designati. Lasciare che i gel si retinino per 15 minuti all'interno della cappa di flusso laminare.
- Dopo 15 minuti, posizionare delicatamente la sezione inferiore della piastra sui gel e spostarli nell'incubatrice per consentire ai gel di scollegare a 37 °C per 45 minuti.
- Una volta che i gel sono stati retillati, invertire nuovamente gli inserti e aggiungere 2 mL di DMEM al 10% a ciascuno dei pozzali inferiori della piastra.
4. Semina di cellule endoteliali
- Preriscaldare 25 mL hanks soluzione salina bilanciata (HBSS), 10 mL tripina, 10 mL inibitore della tripsina e 50 mL mezzo di crescita endoteliale, a 37 °C per 20 minuti in un bagno d'acqua.
- Preparare la sospensione cellulare endoteliale (HUVEC).
- Lavare le cellule HUVEC nei contenitori di coltura T175 due volte con HBSS da 10 mL.
- Tripinare le cellule con tripina di 6 mL per 4 min a 37 °C. Inattivare la tripsina con inibitore della tripsina da 6 mL. Raccogliere la sospensione cellulare in 15 ml di tubo e centrifuga per 3 min a 200 x g.
- Dopo la centrifugazione aspirare il supernatante e sospendere le cellule in mezzo di crescita endoteliale da 5 mL.
- Contare le celle come descritto in precedenza nella 3.4.6 utilizzando un contatore di celle automatico.
- Utilizzando il conteggio delle cellule dal contatore cellulare, preparare la densità di semina di 1,0 x10 4 cellule/mL nel mezzo di crescita endoteliale.
- Seme 500 μL della sospensione cellulare HUVEC in ogni pozzo della parte superiore dell'inserto per avere un volume finale di 5,0 x 103 celle per inserto.
5. Manutenzione
- Sostituire il mezzo di crescita ogni secondo giorno, aspirare il mezzo di crescita trascorso sia dal pozzo che dall'inserto. Aggiungere 2 mL 10% DMEM ai pozzi contenenti il gel e 0,5 mL di mezzo di crescita endoteliale agli inserti contenenti le cellule HUVEC.
- Mantenere il modello per 21 giorni prima della sperimentazione.
6. Reologia
- Misurare i moduli di stoccaggio delle formulazioni in gel per indicare i valori di rigidità utilizzando un reometro, eseguendo sweep di frequenza da 0,1 a 20 Hz a 0,267% e 37 °C, con una forza assiale costante di 0,1N utilizzando una geometria in acciaio inossidabile a piastre parallele di 8 mm di diametro.
7. Vitalità e risposta alla droga
- Determinare la risposta e la vitalità del farmaco nelle co-culture 2D e nel modello 3D.
- Seminare cellule HepG2 (5,0 x 103 celle/mL) e LX2 (5,0 x 103 celle/mL) in un rapporto 1:1 per la co-coltura 2D in un fondo nero chiaro di 96 pozzi a una densità di semina di 1,0 x 104 celle/mL. Consentire alle celle di attaccarsi durante la notte.
- Impostare il modello 3D in modo che corrisponda a un ambiente cirrotico con un valore di rigidità di 6 kPa. Mantenere il modello per 21 giorni prima del trattamento con doxorubicina.
- Due ore prima del trattamento con doxorubicina, aspirare il mezzo di coltura sia dal modello 2D che 3D. Lavare entrambi i modelli due volte con PBS. Aggiungere il mezzo di fame (DMEM integrato con soluzione antibiotica antimicotica 1% v/v) alla cocoltura 2D (200 μL per pozzo) e al modello 3D (2 mL ai pozzi contenenti l'idrogel e 500 μL all'inserto).
- Somministrare doxorubicina sia al modello 2D che a quello 3D. I dosaggi sono i seguenti: 0,5, 1 e 1,5 mM corrispondenti rispettivamente ai valori IC25, 50 e 75. Trattare entrambi i modelli per 72 ore.
NOTA: La doxorubicina, un inibitore della topoisomerasi II, è uno dei primi farmaci chemioterapici utilizzati per l'HCC ed è anche uno degli agenti chemioterapici più attivi nel trattamento di HCC33,34. - Dopo 72 ore, mezzo di coltura aspirato sia dal modello 2D che 3D. Assicurarsi che qualsiasi supporto di coltura rimanente venga rimosso lavando entrambi i modelli due volte con PBS.
- Preparare AlamarBlue secondo le raccomandazioni del produttore e aggiungere ai pozzi del modello 2D e 3D. Aggiungere 150 μL per pozzo per la coltura 2D e 2 mL per pozzo e 500 μL per inserto per coltura 3D. Incubato durante la notte a 37°C.
- Dopo il trasferimento dell'incubazione 150 μL dell'AlamarBlue da ogni pozzo della configurazione 3D in una piastra nera chiara a 96 pondo. AlamarBlue può essere letto direttamente dalla piastra per il modello 2D.
- Leggi la fluorescenza con un lettore di micropiatta a lunghezza d'onda di eccitazione e lunghezza d'onda di emissione di 485 e 550 nm, rispettivamente.
- Calcolare la vitalità percentuale delle celle in entrambi i modelli utilizzando la formula seguente:
Risultati
Intervalli di concentrazione e volume di semina
L'ottimizzazione del protocollo per ottenere il protocollo di funzionamento finale si è verificata secondo il diagramma schematico presentato nella figura 3. Due idrogel fisiologicamente rilevanti, collagene di tipo I e fibrinogeno, sono stati identificati mediante una ricercabibliografica 35,36. A partire dal collagene della coda di ratto di tipo I, una gamma di concentrazioni (4, 3, 2 e 1 mg/mL) è stata seminata su inserti invertiti per determinare la loro capacità di aderire con successo all'inserto una volta invertito di nuovo. Tutte le concentrazioni all'interno di questo intervallo erano in grado di formare gel, tuttavia i gel di collagene apparivano appiattiti e avevano varie bolle d'aria intrappolate al loro interno a causa della manipolazione e della pipettazione, vedi figura 4 e figura 5. Per determinare il volume ottimale della semina per migliorare la qualità del gel di collagene, una gamma di volumi di semina (100, 150 e 200 μL), è stata seminata su inserti invertiti, vedere figura 5. Il volume di semina non ha avuto alcuna influenza sull'aspetto del gel o sulla presenza di bolle all'interno del gel. Di conseguenza, è stato deciso che 200 μL era il volume di semina ottimale producendo i gel più pieni. Fibrinogen è stato anche valutato per la sua capacità di produrre un gel in grado di aderire a un inserto per un periodo di tempo prolungato. Un intervallo di concentrazione (70, 50, 40, 30, 20, 10, 5, 1 mg/mL) è stato preparato e seminato ad un volume di 200 μL sul coperchio di una piastra da 12 pozzi, vedi figura 6. Entro 20 minuti dalla semina tutte le concentrazioni sono state in grado di formare con successo un gel. Tuttavia, le concentrazioni di 5 e 1 mg/mL sono state escluse in quanto i gel formati avevano una consistenza fluida e avevano iniziato a staccarsi dal coperchio dopo essere stati tenuti durante la notte a 37 °C.
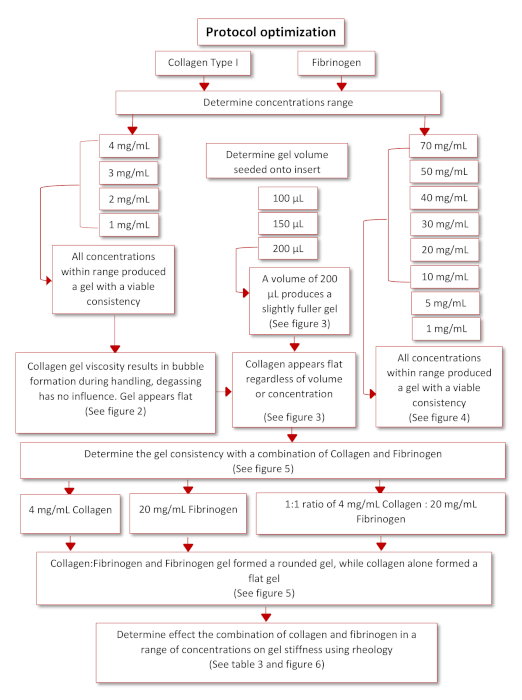
Figura 3: Diagramma schematico dell'ottimizzazione del protocollo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Gel di collagene 4 mg/mL contenenti 1,0 x 105 cellule/mL seminati su inserti che mostrano bolle presenti nel gel. L'inserto a sinistra è stato degassato sul ghiaccio per 15 minuti, mentre l'inserto a destra non è stato degassato. Il degassamento non ha avuto alcun effetto sulle bolle presenti nei gel. Clicca qui per visualizzare una versione più grande di questa figura.
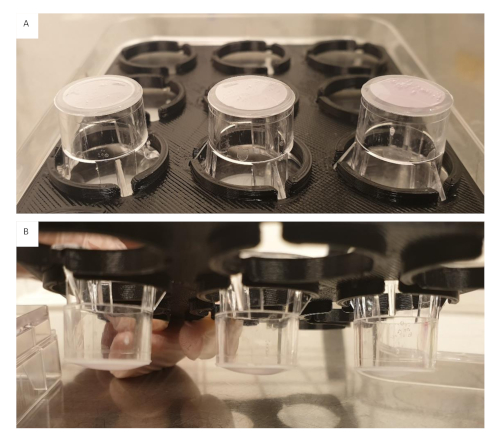
Figura 5: Gel di collagene 4 mg/mL contenenti 1,0 x 105 cellule/mL seminati su inserti in volumi variabili. (A) Inserire a sinistra 100 μL, al centro 150 μL e a destra 200 μL, subito dopo la semina. Le bolle nei gel erano ancora presenti. (B) Inserire a sinistra 200 μL, al centro 150 μL e a destra 100 μL, dopo 60 minuti di reticolamento. Tutti i gel indipendentemente dal volume appaiono ancora piatti. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Fibrinogeno (200 μL) in un intervallo di concentrazione compreso tra 70 e 1 mg/mL seminato sul coperchio di una piastra da 12 pozza. (A) Gel subito dopo la semina. (B) Gel 20 min dopo la semina. (C)Gel tenuti durante la notte. Tutti i gel appaiono ben arrotondati, i gel da 5 mg/mL e 1 mg/mL sono stati esclusi in quanto sembravano avere una consistenza più fluida 20 minuti dopo la semina e avevano iniziato a staccarsi dal coperchio dopo essere stati tenuti durante la notte. Clicca qui per visualizzare una versione più grande di questa figura.
Combinazione di collagene e fibrinogeno
Sulla base dei risultati delle gamme di concentrazione di collagene e fibrinogeno è stato valutato l'effetto della combinazione del collagene e del fibrinogeno. Sono stati inseriti tre inserti con il seguente collagene da 4 mg/mL, 20 mg/mL di fibrinogeno e una razione 1:1 di collagene (4 mg/mL) e fibrinogeno (20 mg/mL), vedi figura 7. Subito dopo aver seminato gli idrogel, abbiamo osservato che l'inserto con collagene da solo aveva ancora un aspetto piatto combinato con il verificarsi di bolle all'interno del gel. Gli inserti con fibrinogeno hanno prodotto un gel pieno e arrotondato, così come l'inserto con la combinazione di collagene e fibrinogeno. Dopo il collegamento incrociato a 37 °C per 60 min, tutti i gel si erano attaccati all'inserto e sono rimasti attaccati dopo l'incubazione notturna a 37 °C.

Figura 7: Effetto della combinazione di collagene e fibrinogeno. (A) Collagene 4 mg/mL seminato su inserto a sinistra, fibrinogeno 20 mg/mL seminato su inserto nel mezzo e collagene 4 mg/mL, fibrinogeno 20 mg/mL (1:1 razione) seminato su inserto a destra. Tutti i gel seminati ad un volume di 200 μL contenente 1,0 x 105 cellule/mL, tutti i gel sono stati reticolati per 60 min a 37 °C.(B)Collagene 4 mg/mL 60 min dopo il retillo, il gel è apparso piatto e ha avuto bolle. (C) Inserire sul fibrinogeno sinistro 20 mg/mL, il gel appare arrotondato, senza bolle presenti, inserire sul collagene destro 4 mg/mL, fibrinogeno 20 mg/mL gel, il gel è ben arrotondato senza bolle. (D) Collagene 4 mg/mL gel dopo essere stato tenuto durante la notte a 37 °C, il gel conteneva ancora una grande quantità di bolle, si è verificato un certo gonfiore del gel. (E) Fibrinogeno 20 mg/mL conservato durante la notte a 37 °C. (F) Collagene 4 mg/mL, fibrinogeno 20 mg/mL gel conservato durante la notte a 37 °C. Fare clic qui per visualizzare una versione più ampia di questa cifra.
Determinazione della densità di semina cellulare
Sulla base della precedente esperienza di lavoro con idrogel, è stato impostato un esperimento per determinare la densità ottimale di semina cellulare (dati non mostrati)37. Le cellule sono state incorporate in una combinazione di collagene e fibrinogeno nel seguente intervallo di concentrazione (7,5 x 105, 8,5 x 105, 9,5 x 105, 1,0 x 106, 1,5 x 106 e 2,0 x 106 celle/mL), 2,0 x 106 celle/mL sono risultati essere la densità di semina ottimale.
Reologia
Dieci formulazioni delle combinazioni fibrinogeno e idrogel di collagene sono state valutate per via reologia, cfr. L'obiettivo era quello di determinare quale di queste formulazioni potesse imitare la rigidità epatica osservata durante lo sviluppo dell'HCC. La letteratura ha fornito valori noti di rigidità epatica per ratti, topi e esseri umani durante la fibrosi, la cirrosi e l'HCC e l'obiettivo eraquello di avvicinarsi il più possibile a questi valori 28,29,30,31,32. Le dieci formulazioni di cui alla tabella 2 sono state preparate in triplice copia e il modulo di immagazzinamento di ciascuna di essi è stato determinato utilizzando un reometro, risultati riportati nella figura 8.
| Formulazione | Fibrinogeno (mg/ml) | Collagene (mg/ml) |
| 1 | 60 | 2 |
| 2 | 50 | 2 |
| 3 | 40 | 2 |
| 4 | 30 | 2 |
| 5 | 20 | 2 |
| 6 | 10 | 2 |
| 7 | 20 | 5 |
| 8 | 20 | 4 |
| 9 | 20 | 3 |
| 10 | 20 | 1 |
Tabella 2: Combinazioni di collagene e fibrinogeno in varie concentrazioni valutate con reologia per determinare i valori di rigidità
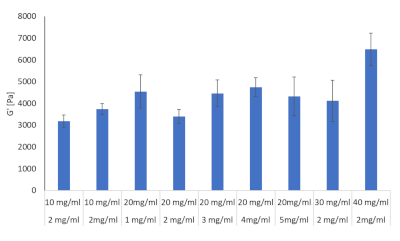
Figura 8: Valori di rigidità dell'idrogel per combinazioni di collagene e fibrinogeno in varie concentrazioni valutate con reologia. Il modulo di archiviazione e il modulo di perdita sono stati determinati a 37 °C e 1Hz per mezzo di un rheometro ibrido Discovery HR-2 (n = 3, barre di errore = SD). Clicca qui per visualizzare una versione più grande di questa figura.
Da queste dieci formule tre sono state scelte per procedere. Tra questi, 2 mg/mL di collagene di tipo I e 10 mg/mL di fibrinogeno corrispondente ai valori di rigidità epatica all'inizio della fibrosi, 2 mg/mL di collagene di tipo I e 30 mg/mL di fibrinogeno corrispondente alla cirrosi e 2 mg/mL di collagene di tipo I e 40 mg/mL di fibrinogeno corrispondente all'HCC, cfr.
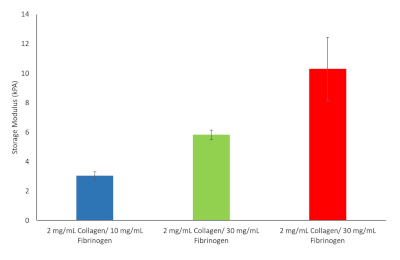
Figura 9: Valori di rigidità dell'idrogel per varie formulazioni di idrogel fibrinogeno/collagene scelte per continuare. Modulo di memorizzazione e modulo di perdita sono stati determinati a 37 °C e 1 Hz (n = 3, barre di errore = SD). Clicca qui per visualizzare una versione più grande di questa figura.
Vitalità, risposta ai farmaci e potenziale metastatico
I risultati del saggio AlamarBlue hanno mostrato una ridotta vitalità cellulare complessiva all'interno della cocoltura 2D, inferiore al previsto in base ai valori IC 25, 50 e 75 segnalati, rispetto al controllo non trattato, vedere figura 10. Questo può essere attribuito alle cellule LX2 nella nostra co-coltura che sono più sensibili al trattamento con doxorubicina. Tuttavia, nel nostro modello 3D abbiamo notato e aumentato la resistenza alla doxorubicina, confermando la diminuzione del potenziale chemioterapico spesso osservata nei sistemi modello 3D. La significatività statistica rispetto ai controlli è stata valutata utilizzando il test Student T (a due code), con P<0.05 considerato significativo.
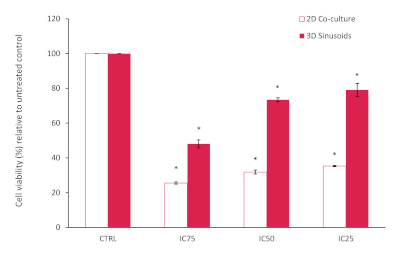
Figura 10: Percentuale di vitalità cellulare di un modello di cocoltura 2D rispetto al modello 3D dopo il trattamento con Doxorubicina a varie concentrazioni per un periodo di 72h. Risultati normalizzati rispetto al controllo non trattato (n=3, barre di errore = SD) (* = p<0.0001). Clicca qui per visualizzare una versione più grande di questa figura.
I costrutti di gel sono stati ispezionati visivamente ogni giorno utilizzando un microscopio leggero per seguire la crescita cellulare all'interno di diverse concentrazioni degli idrogel. Le cellule riempivano gli idrogel in modo omogeneo e compatto, dal giorno 7 gli sferoidi iniziarono ad assemblarsi all'interno della matrice.
Discussione
Questo protocollo descrive lo sviluppo di un metodo per creare un modello biomimetico per HCC. È stato stabilito un flusso di lavoro chiaro e sono stati identificati i passaggi critici coinvolti. Questi passaggi critici includono, preparazione della soluzione di stock di fibrinogeno, rivestimento degli inserti con collagene e semina delle cellule imbecilli nell'idrogel. Durante la preparazione della soluzione di stock di fibrinogeno è importante aggiungere il fibrinogeno in incrementi più piccoli a concentrazioni più elevate. Ciò non solo ridurrà il tempo necessario allo scioglimento del fibrinogeno, ma impedirà anche al fibrinogeno di gelare in modo incoerente e prematuro, come si vede nella figura 11. La preparazione del gel fibrinogeno richiede una notevole quantità di tempo e questo può influenzare il successo sperimentale complessivo. I risultati indicano che una volta che il gel fibrinogeno inizia a gelare in modo incoerente è meglio scartarlo. Gli inserti devono essere rivestiti con collagene, lavati con PBS e asciugati all'interno della cappa di flusso laminare prima di seminare le cellule incorporate negli idrogel. Il mancato rispetto dell'asciutto degli inserti comporterà la fuoriuscita degli idrogel sui bordi dell'inserto, con conseguente gel irregolare. Le irregolarità del gel influenzeranno in ultima analisi i risultati in cui la diffusione è un fattore.
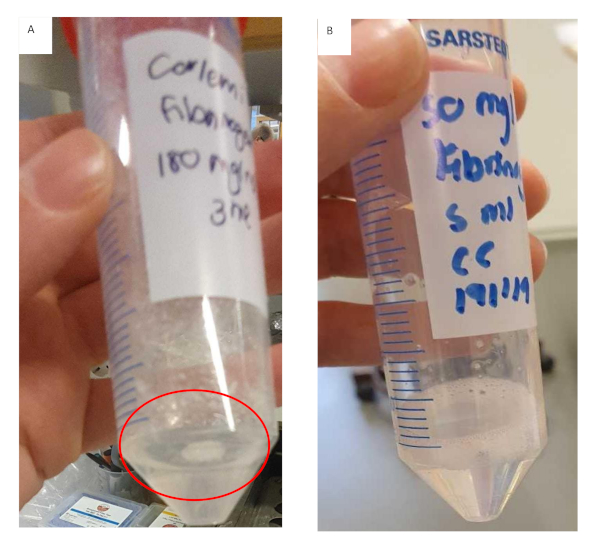
Figura 11: Preparazione del gel fibrinogeno per formulazioni di fibrinogeno/idrogel di collagene. (A) Soluzione di gel fibrinogeno che ha formato grumi e ha iniziato a gelare prematuramente con fibrinogeno non disciolto che aderisce al tubo. (B)Soluzione di gel fibrinogeno che si è completamente sciolta, la soluzione è chiara e leggermente più viscosa. Clicca qui per visualizzare una versione più grande di questa figura.
Si consiglia di lavorare il più velocemente possibile durante la semina della sospensione della cellula idrogel sugli inserti, poiché il componente fibrinogeno inizierà a incrociarsi con l'aggiunta di trombina. Preparare volumi di lavoro più piccoli alla volta quando si lavora con sospensioni in gel a concentrazioni più elevate per evitare che il gel si retichi durante la semina. Quest'ultimo avrà un effetto sulla distribuzione e sulla quantità di gel seminato su ogni pozzo. L'ordine di aggiunta dei componenti è fondamentale, in questo protocollo abbiamo fornito un flusso di lavoro semplificato per evitare che i gel si retinino prematuramente. A causa della viscosità delle sospensioni in gel idrogel che lavorano con una punta di pipetta tagliata si consiglia durante la miscelazione e la misurazione. Quando si mescola la sospensione assicurarsi che ciò avvenga in modo rapido e uniforme per creare una sospensione omogenea. La miscelazione irregolare si tradurrà in un gel eterogeneo che influenzerà negativamente i risultati, vedere figura 12.
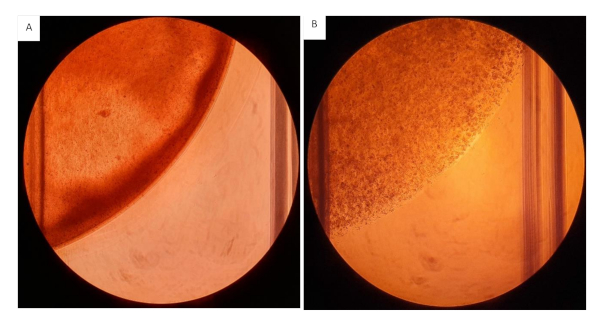
Figura 12: Gel di collagene/fibrinogeno seminati su 12 piastre di pozzo. Tutti i gel seminati ad un volume di 200 μL contenente 2 mg/mL collagene e 20 mg/mL fibrinogeno con 2,0 x 106 cellule/mL. (A) Gel idrogel con consistenza eterogenea, distribuzione irregolare visibile degli idrogel. (B)Idrogel miscelati in modo omogeneo. Clicca qui per visualizzare una versione più grande di questa figura.
A seguito dell'ottimizzazione del protocollo, il modello è stato valutato per determinare le proprietà bio-fisiche dei modelli. I dati reologico hanno dimostrato che il nostro modello, composto da componenti della matrice extracellulare fisiologicamente rilevanti vale a dire collagene di tipo I e fibrinogeno, è stato in grado di imitare le proprietà bio-fisiche di un fegato fibrotico, cirrotico e HCC28,29,30,31,32. Ricapitolare la rigidità epatica nei modelli 3D per HCC è di notevole importanza e viene spesso trascurato durante lo sviluppo del modello. L'aumento della rigidità epatica è correlato alla resistenza chemioteraptica, alla proliferazione, alla migrazione e alla dormienza all'interno dell'HCC38. Mentre l'attivazione di cellule stellate epatiche in HCC è associata ad una maggiore rigidità della matrice extracellulare, con diverse vie di segnalazione associate a queste cellule stellate epatiche che mostrano meccanosensibilità39.
L'inclusione di cellule associate allo stroma come cellule stellate epatiche e cellule endoteliali nello sviluppo di modelli 3D per HCC è diventata sempre più rilevante. Gli studi dimostrano che gli sferoidi multicellulari composti da stellete epatiche e cellule HCC hanno portato a una maggiore resistenza chemioterapica e migrazione invasiva, mentre imitano l'aspetto tumorale HCC in vivo, rispetto a un modello di topi PXT e campioni di tessuto HCCumano 17. Uno studio simile di Jung et al., 2017 ha trovato sferoide multicellulare costituito da carcinoma epatocellulare (Huh-7) e cellule endoteliali (HUVEC) ha promosso vascolarizzazione e aggressività22. Questi sferoidi mostravano vitalità a concentrazioni significativamente più elevate di doxorubicina e sorafenib rispetto agli sferoidi monocoltura Huh-722. La valutazione della fattibilità e della risposta del nostro modello alla doxorubicina, con valori di rigidità corrispondenti a quello di HCC e l'inclusione di cellule associate allo stroma (LX2 e HUVEC), ha mostrato una diminuzione simile in risposta alla chemioterapica rispetto a un modello di co-coltura 2D. Pertanto, imitando efficacemente la resistenza ai farmaci tipicamente osservata nei pazienti e in altri modelli HCC 3D.
Poiché si tratta di un sistema modulare, il modello può essere fortificato con l'aggiunta di altri componenti della matrice extracellulare, vale a dire la laminina e acido ialuronico. In alternativa, gli idrogel attuali utilizzati all'interno di questo modello possono essere sostituiti da idrogel sintetici come alginato di sodio o chitosano. Ulteriori modifiche al modello attuale possono essere la sostituzione delle linee cellulari con colture cellulari primarie per produrre un modello ancora più fisiologicamente rilevante o utilizzando combinazioni di altre linee tumorali e cellulari stromali.
Abbiamo quindi sviluppato con successo un modello 3D con proprietà bio-fisiche tonnibili per lo studio delle interazioni tumore-stroma in HCC. Abbiamo trovato il nostro modello più rappresentativo della situazione in vivo rispetto alle culture 2D tradizionali in risposta alla doxorubicina. Tuttavia, c'è ancora molto da fare, speriamo di caratterizzare ampiamente questo modello ed esplorare il modello come una possibile piattaforma metastatica per rispondere a domande più complesse e pressanti che rimangono nello studio HCC.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata attraverso sovvenzioni ottenute dalla Fondazione svedese per il cancro (Cancerfonden, CAN2017/518), dalla società svedese per la ricerca medica (SSMF, S17-0092), dalla fondazione O.E. och Edla Johanssons e dalla fondazione Olga Jönssons. Queste fonti di finanziamento non sono state coinvolte nella progettazione dello studio; raccolta, analisi e interpretazione dei dati; redazione della relazione; e nella decisione di sottoporre l'articolo alla pubblicazione. La stampa 3D di distanziali progettati su misura utilizzati in questo protocollo è stata eseguita presso la struttura di stampa 3D dell'Università di Uppsala presso il Settore Disciplinare di Medicina e Farmacia, U-PRINT@mcb.uu.se. Ringraziamo Paul O'Callaghan per il prezioso contributo dato al nostro progetto.
Materiali
| Name | Company | Catalog Number | Comments |
| AlamarBlue (Resazurin sodium salt) | Sigma | 211-500 | Prepare according to manufacturesr recommendations |
| Antibiotic Antimycotic Solution (100×), Stabilized | Sigma | A5955-100ML | |
| Aprotinin Protease Inhibitor | Thermo Fisher Scientific | 78432 | |
| Calcium chloride (CaCl2) | Sigma | C1016-2.5KG | Anhydrous, granular, ≤7.0 mm, ≥93.0% |
| CO2 Incubator | Kebo Biomed Sweden | ||
| Corning Black, clear flat bottom 96-well plate | Sigma | CLS3904-100EA | |
| Corning HTS Transwell-24 well permeable supports | Sigma | CLS3396-2EA | HTS Transwell-24 units w/ 0.4 μm pore polycarbonate membrane and 6.5 mm inserts, TC-treated, sterile, 2/cs |
| Discovery Hybrid Rheometer 2 | TA instruments, Sollentuna, Sweden | ||
| DMEM, high glucose, GlutaMAX supplement (LX2 and HepG2 cells) | Thermo Fisher Scientific | 61965059 | Supplemented with 10% v/v FBS and 1% v/v antibiotic antimycotic solution |
| Endothelial Cell Growth Medium (500 ml) (HUVEC) | Cell Applications, Inc | 211-500 | |
| Fetal Bovine Serum, qualified, One Shot format, New Zealand | Thermo Fisher Scientific | A3160902 | |
| Fibrinogen type I-S from bovine plasma | Sigma | F8630-10G | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| Hanks' balanced salt solution | Sigma | H9394-500ML | Modified, with sodium bicarbonate, without calcium chloride and magnesium sulfate |
| Labogene scanspeed 416 centrifuge | Labogene, Sweden | ||
| Laminar flow hood | Kebo Biomed Sweden | ||
| Mettler Toledo AG245 Analytical Balance | Mettler Toledo | ||
| Nikon TMS Light microscope | Nikon, Japan | ||
| Phosphate buffered saline tablet | Sigma | P4417-100TAB | Prepare according to manufacturers recommendation |
| Rat tail Collagen Type I 5 mg/mL | Ibidi | 50201 | |
| Sodium chloride (NaCl) | Sigma | S7653-1KG | |
| Sodium Hydroxide (NaOH) | Merck | B619298 | |
| TC20 Automated cell counter | BioRad | ||
| TC20 cell counter counting slides | BioRad | ||
| Thrombin from bovine plasma | Sigma | T9549 | Powder, suitable for cell culture, ≥1,500 NIH units/mg protein (E1%/280 = 19.5) |
| Trypsin (2.5%) 10x | Thermo Fisher Scientific | Dilute to 1x in PBS | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T6414-100ML | Solution, sterile-filtered |
Riferimenti
- Galle, P. R., et al. EASL Clinical practice guidelines: Management of hepatocellular carcinoma. Journal of Hepatology. 69, 182-236 (2018).
- Marquardt, J. U., Andersen, J. B., Thorgeirsson, S. S. Functional and genetic deconstruction of the cellular origin in liver cancer. Nature Reviews Cancer. 15, 653-667 (2015).
- Balogh, J., et al. Hepatocellular Carcinoma: A review. Journal of Hepatocellular Carcinoma. 3, 41-53 (2016).
- Perumpail, R. B., Womg, R. J., Ahmed, A., Harrison, S. A. Hepatocellular carcinoma in the setting of non-cirrhotic non-alcoholic fatty liver disease and the metabolic syndrome: US experience. Digestive Diseases and Science. 60, 3142-3148 (2016).
- Baglieri, J., Brenner, D. A., Kisseleva, T. The role of fibrosis and liver associated fibroblasts in the pathogenesis of hepatocellular carcinoma. International Journal of Molecular Sciences. 20, 1723 (2019).
- Arriazu, E., et al. Extracellular matrix and liver disease. Antioxidants & Redox Signaling. 21 (7), 1078-1097 (2014).
- Malarkey, D. E., Johnson, K., Ryan, L., Boorman, G., Maronpot, R. R. New insight into functional aspects of liver morphology. Toxicologic Pathology. 33, 27-34 (2005).
- Moreira, R. K. Hepatic stellate cells and liver fibrosis. Archive of Pathology and Lab Medicine. 131, 1728-1734 (2007).
- Hernandez-Gea, V., Toffanin, S., Friedman, S. L., Llovet, J. M. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma. Gastroenteroloy. 144, 512-527 (2013).
- Amicone, L., Marchetti, A. Microenvironment and tumor cells: two targets for new molecular therapies of hepatocellular carcinoma. Translational Gastroenterology and Hepatology. 3, 24 (2018).
- Rawal, P., et al. Endothelial cell-derived TGF-B promotes epithelial-mesenchymal transition via CD133 in Hbx-Infected Hepatoma cells. Frontiers in Oncology. 9 (308), 1-9 (2019).
- Yoo, J. E., et al. Progressive enrichment of stemness features and tumour stromal alterations in multistep hepatocarcinogenesis. PLoS One. 12 (3), 0170465 (2017).
- Landry, B. D., et al. Tumor-stroma interactions differentially alter drug sensitivity based on the origin of stromal cells. Molecular Systems Biology. 14, 8332 (2018).
- Le, B. D., et al. Three-dimensional hepatocellular carcinoma/fibroblast model on a nanofibrous membrane mimics tumor cell phenotypic changes and anticancer drug resistance. Nanomaterials. 8 (64), 1-11 (2018).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14, 6999-7010 (2017).
- Hoarau-Véchot, J., Rafii, A., Touboul, C., Pasquier, J. Halfway between 2D and animal models: Are 3D cultures the ideal tool to study cancer-microenvironment interactions. International Journal of Molecular Sciences. 19 (181), 1-24 (2018).
- Khawar, I. A., et al. Three Dimensional Mixed-Cell Spheroids Mimic Stroma-Mediated Chemoresistance and Invasive Migration in hepatocellular carcinoma. Neoplasia. 20, 800-812 (2018).
- Elliott, N. T., Yuan, F. A review of three-dimensional in vitro tissue models for drug discovery and transport studies. Journal of Pharmaceutical Sciences. 100 (1), 59-74 (2010).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: focus on tumor spheroid model. Pharmacology Therapy. 163, 94-108 (2016).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Jung, H. R., et al. Cell spheroids with enhanced aggressiveness to mimic human liver cancer in vitro and in vivo. Scientific Reports. 7, 10499 (2017).
- Eilenberger, C., Rothbauer, M., Ehmoser, E. -. K., Ertl, P., Küpcü, S. Effect of spheroidal age on sorafenib diffusivity and toxicity in a 3D hepg2 spheroid model. Scientific Reports. 9, 4863 (2019).
- Wrzesinski, K., Fey, S. J. After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver. Toxicology Research. 2 (2), 123-135 (2013).
- Wrzesinski, K., et al. Human liver spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation. Toxicology Research. 2 (3), 163-172 (2013).
- Mazza, G., et al. Decellularized human liver as a natural 3D-scaffold of liver bioengineering and transplantation. Scientific Reports. 5, 13079 (2015).
- Ma, X., et al. Rapid 3D bioprinting of decellularized extracellular matrix with regionally varied mechanical properties and biomimetic microarchitecture. Biomaterials. 185, 310-321 (2018).
- Mueller, S., Sandrin, L. Liver stiffness: a novel parameter for the diagnosis of liver disease. Hepatic Medicine: Evidence and Research. 2, 49-67 (2010).
- Wang, M. H., et al. In vivo quantification of liver stiffness in a rat model of hepatic fibrosis with acoustic radiation force. Ultrasound in Medicine & Biology. 35 (10), 1709-1721 (2009).
- Georges, P. C., et al. Increased liver stiffness of the rat liver precedes matrix deposition: implications for fibrosis. American Journal of Physiology - Gastrointestinal and Liver Physiology. 293, 1147-1154 (2007).
- Massironi, S., et al. et al. Liver stiffness and hepatocellular carcinoma: is it really useful. Journal of Hepatology. 58, 293 (2013).
- Singh, S., et al. Liver stiffness is associated with risk of decompensation, liver cancer, and death in patients with chronic liver diseases: A systematic review. Clinical Gastroenterology and Hepatology. 11, 1573-1584 (2013).
- Yang, T. S., Wang, C. H., Hsieh, R. K., Chen, J. S., Fung, M. C. Gemcitabine and doxorubicin for the treatment of patients with advanced hepatocellular carcinoma: a phase I-II trail. Annals of Oncology. 13, 1771-1778 (2002).
- Le Grazie, M., Biagini, M. R., Tarocchi, M., Polvani, S., Galli, A. Chemotherapy for hepatocellular carcinoma: the present and the future. World Journal of Hepatology. 9 (21), 907-920 (2017).
- Saneyasu, T., Akhtar, R., Sakai, T. Molecular cues guiding matrix stiffness in liver fibrosis. BioMed Research International. 2016, 1-11 (2016).
- Zuliani-Alvarez, L., Midwood, K. S. Fibrinogen-related proteins in tissue repair: how a unique domain with common structure controls diverse aspects of wound healing. Advances in Wound Care. 4 (5), 273-285 (2015).
- Smit, T., et al. Characterization of an alginated encapsulated LS180 spheroid model for anti-colorectal cancer compound screening. ACS Medicinal Chemistry Letters. 11 (5), 1014-1021 (2020).
- Schrader, J., et al. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology. 53 (4), 1192-1205 (2011).
- Lachowski, D., et al. Matrix stiffness modulates the activity of MMP-9 and TIMP-1 in hepatic stellate cells to perpetuate fibrosis. Scientific Reports. 9, 7299 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon