Method Article
Messa in funzione del radiatore e dosimetria per la valutazione dei parametri di α e β LQ, schema di dosamento delle radiazioni e deposizione della dose in vivo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La dosimetria delle radiazioni fornisce una tecnica per migliorare l'accuratezza degli esperimenti preclinici e garantire che le dosi di radiazioni erogata siano strettamente correlate ai parametri clinici. Questo protocollo descrive le misure da adottare in ogni fase durante gli esperimenti sulle radiazioni precliniche per garantire un'adeguata progettazione sperimentale.
Abstract
La dosimetria delle radiazioni è fondamentale per l'accurata erogazione e riproducibilità degli schemi di radiazione nei modelli preclinici per un'elevata rilevanza traslizionale. Prima di effettuare esperimenti in vitro o in vivo, deve essere valutata la produzione di dose specifica per l'irradiatore e i singoli progetti sperimentali. Utilizzando una camera di ionizzazione, un elettrometro e una configurazione dell'acqua solida, è possibile determinare l'uscita della dose di ampi campi all'isocentro. Utilizzando una configurazione simile con pellicole radiocromache al posto della camera di ionizzazione, è anche possibile determinare le intensità di dose per campi più piccoli a diverse profondità. I test di sopravvivenza clonogenici in vitro delle cellule tumorali in risposta al trattamento con radiazioni sono esperimenti economici che forniscono una misura della radio-sensibilità intrinseca delle linee cellulari adattando questi dati al tradizionale modello lineare-quadratico. I parametri del modello stimati da questi saggi, combinati con i principi delle dosi biologiche efficaci, consentono di sviluppare programmi di frazionamento variabili per il trattamento con radiazioni che forniscono dosi efficaci equivalenti negli esperimenti sugli animali portanti di tumore. Questo è un fattore importante da considerare e correggere nel confrontare i programmi di radioterapia in vivo per eliminare la potenziale confusione dei risultati dovuta alla varianza nelle dosi efficaci erogata. Nel complesso, questo articolo fornisce un metodo generale per la verifica dell'emissione di dosi irradiatori preclinici per animali e armadi, la valutazione in vitro della radiofisi sensibilità e la verifica dell'emissione di radiazioni in piccoli organismi viventi.
Introduzione
I tumori rappresentano collettivamente la seconda causa di morte negli Stati Uniti e in molti paesi in tutto il mondo1. La radioterapia è una pietra miliare del trattamento per molti sottotipi tumorali e viene somministrata a circa la metà di tutti ipazienti oncologici 2,3. Gli esiti dei pazienti per quasi tutti i tumori sono migliorati nel tempo poiché le apparecchiature utilizzate per esegnare dosi di radiazioni sono costantemente avanzate e sono stati sviluppati alcuni approcci efficaci di terapia multimodale4,5,6, ma i tassi di recidiva e mortalità per i pazienti con determinati tipi di tumori rimangono alti7,8,9. Pertanto, la radioterapia per il cancro continua ad essere un'area attiva della ricerca di base e clinica. Molti studi preclitici di radioterapia utilizzano l'uso di irradiatori su piccola scala per fornire dosi di radiazioni a modelli di cancro in vitro o animali. Con una moltitudine di potenziali esperimenti per condurre l'esplorazione di dettagli di radiobiologia meccanicistica o nuovi trattamenti, possono verificarsi insidie comuni che portano a conclusioni errate, scarsa riproducibilità e risorse sprecate. Queste insidie si suddividono in tre aree importanti: dosimetria irradiatore, caratterizzazione in vitro di linee cellulari modello e programma e impostazione del dosatore di irradiazione in vivo. Risultati accurati e riproducibili di esperimenti più avanzati sono difficili da ottenere senza previa attenzione a questi aspetti fondamentali della ricerca radioterapica.
Il protocollo qui descritto descrive una strategia generalizzata per evitare o mitigare questi problemi e attinge a diverse metodologie precedentemente sviluppate destinate all'uso indipendente. Questi metodi distinti sono stati fusi in modo che un ricercatore interessato ad iniziare o migliorare gli esperimenti di radioterapia preclinica potesse usarlo come un robusto layout sperimentale. Il quadro suggerito comprende una metodologia per la messa in commissione di irradiatori animali su piccola scala, per determinare le proprietà radiobiologiche di base delle linee cellulari del cancro modello e per progettare e somministrare in modo appropriato un programma di dosamento e frazionamento per i modelli tumorali in vivo.
Protocollo
Qualsiasi passo di questo protocollo che prevede l'uso di animali da laboratorio, inclusa la manipolazione e le procedure, è stato approvato dall'Institutional Animal Care and Use Committee presso la West Virginia University di Morgantown, West Virginia (Numero di protocollo: 1604001894).
1. Determinazione della produzione di dose
- Utilizzare questo protocollo, basato sul protocollo "In-phantom Method" dell'American Association of Physicists in Medicine Task Group (AAPM TG) 6110 e simile al protocollo di messa in servizio impostato da Xstrahl, per determinare l'uscita del fascio del piccolo irradiatore animale rispetto a particolare geometria nelle seguenti condizioni di configurazione.
- Impostare il radiatore in modo che dia radiazioni a 220 kVp e 13 mA, con un campo aperto (17 cm per 17 cm) posizionato all'isocentro o a 35 cm dalla sorgente. Inoltre, filtrare la trave con un filtro Cu da 0,15 mm con un'ampia messa a fuoco. Alcuni irradiatori cellulari contengono solo una sorgente radioattiva, questo protocollo può essere utilizzato solo per irradiatori a raggi X.
- Allineare i fantasmi dell'acqua solida nel seguente ordine: lastra di 1 cm, lastra di 2 cm con fessura della camera di ionizzazione, lastra da 2 cm, lastra da 1 cm. Impilando i fantasmi dell'acqua solida in questo ordine si posiziona la camera di ionizzazione a una profondità di 2 cm, consentendo anche 4 cm per il backscatter. Vedere la figura 1 per un ritratto grafico dell'impostazione della dosimetria.
NOTA: Per ospitare la grande pila abbastanza pesante di acqua solida, gli autori raccomandano l'acquisizione di un divano stampato in 3D personalizzato con supporto variabile per garantire che la pila fantasma sia livellata e alla giusta distanza dalla sorgente attraverso la superficie del materiale, non solo al centro.
- Utilizzare l'apparecchiatura di misura (ad esempio, camera di ionizzazione calibrata ADCL, elettrometro) e una spiegazione dei fattori di correzione utilizzati possono essere trovati rispettivamente nella tabella dei materiali e nella tabella 1.
NOTA: Che l'ADCL fornisce valori di Nk in un paio di punti per diversi strati a mezzo valore (HVL, misura della qualità del fascio). Il valore di Nk da utilizzare nel protocollo deve essere basato su un'interpolazione dei valori ADCL per l'HVL misurato dell'unità. Il produttore ha misurato l'HVL della nostra unità e l'abbiamo utilizzato nella nostra determinazione dell'uscita dell'intensità di dose. - Impostate la pila fantasma e inserite la camera di ionizzazione nel fantasma come specificato nel passaggio 1.1.2.
- Regolare la pila fantasma in modo che la sorgente alla distanza superficiale (SSD), o la distanza dalla sorgente di radiazione alla prima superficie, sia di 33 cm quando opportunamente livellata.
NOTA: Gli autori suggeriscono di creare un divano stampato in 3D personalizzato, abbastanza grande da supportare le dimensioni delle lastre di acqua solida. Inoltre quello, utilizzato in questo protocollo ha un componente regolabile per livellare lo stack fantasma.
- Regolare la pila fantasma in modo che la sorgente alla distanza superficiale (SSD), o la distanza dalla sorgente di radiazione alla prima superficie, sia di 33 cm quando opportunamente livellata.
- Prendi la media di tre esposizioni separate ai raggi X, letture di un minuto con la tensione di polarizzazione dell'elettrometro impostata a 300 V. Il risultato sarà definito M+.
NOTA: Le irradiazioni vengono eseguite con lo strumento impostato per fornire radiazioni a 220 kVp e 13 mA. Questo è lo stesso per i prossimi due passaggi (passaggi 1.5-1.6). Per la sicurezza dell'utente, assicurarsi che le porte rimangano chiuse durante i trattamenti. - Eseguire un altro set di tre esposizioni separate ai raggi X, letture di 1 minuto con la tensione di polarizzazione dell'elettrometro impostata a -150 V. Il risultato sarà definito ML.
- Eseguire un altro set di tre esposizioni separate ai raggi X, letture di 1 minuto con la tensione di polarizzazione dell'elettrometro impostata a -300 V. Il risultato sarà definito MH, o anche M-.
- Calcolare Ppol e Pione usando rispettivamente l'equazione 1 e l'equazione 2, come descritto di seguito:
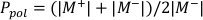 (Equazione 1)
(Equazione 1)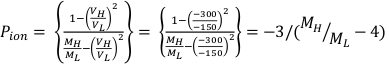 (Equazione 2)
(Equazione 2) - Misurare la temperatura, in Celsius, e la pressione, in kPa, all'interno dell'irradiatore utilizzando un termometro digitale calibrato e un barometro. Quindi, calcolare PTP come indicato di seguito nell'equazione 3.
NOTA: Questo calcolo presuppone che l'ADCL abbia utilizzato valori standard di temperatura e pressione di 22 °C e 101,33 kPa quando ha dichiarato il loro valore per il fattore di calibrazione del kerma dell'aria.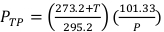 (Equazione 3)
(Equazione 3) - Calcolare la lettura corretta della camera, M, moltiplicando la lettura della camera grezza, MH, per Pelec, Ppol, Pione PTP. Questa equazione può essere trovata di seguito nell'equazione 4.
NOTA: Questo calcolo presuppone che l'ADCL abbia eseguito la calibrazione con la tensione di polarizzazione impostata su -300V, che è una pratica abbastanza comune.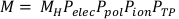 (Equazione 4).
(Equazione 4). - Moltiplicare ulteriormente la lettura corretta della camera per Nk, [(μen/p)waria]acqua, PQ, chame Psheath. Latona P è necessaria solo per le misurazioni ottenute in acqua. Pertanto, per questo protocollo Psheath è solo 1.
NOTA: Utilizzando le condizioni di questo protocollo, gli ultimi tre elementi danno un valore di 1,0731. Questo valore dipende dalla qualità del fascio, quindi l'HVL deve essere noto per determinarlo. Il valore di 1,0731 è specifico per la nostra unità ed è dato come esempio. Per determinare i valori di PQ,cham e [(μen/p)wair]acqua specifica dell'unità, utilizzare l'HVL misurato e interpolare dalla tabella VIIe dalla tabella VIIIe correggere la dimensione del campo di riferimento in base alla figura 3 e alla figura 4 del protocollo AAPM TG6110. Nel nostro caso, moltiplicare Nk per 1,0731 fornisce la dose all'acqua, Dw, in Gy per un tempo nominale di 1 min, supponendo che il valore DICL Nk sia dato in Gy/Coulumbs. - Determinare l'effetto finale dell'irradiatore utilizzato. Quando i raggi X vengono generati per la prima volta, l'uscita sale al suo valore pieno per un certo tempo finito. Allo stesso modo, quando la sorgente di raggi X è spenta, l'output diminuisce a zero in un certo tempo finito.
- Tenere conto del tempo per questa transizione o dell'effetto finale. Questo può essere fatto prendendo la media di tre letture con la tensione di polarizzazione dell'elettrometro impostata a -300 V, per una varietà di impostazioni del tempo. Eseguire questa questa tà per 6, 12, 18, 24, 30 e 60 secondi.
- Traccia le letture dell'elettrometro rispetto al tempo e trova la migliore linea retta. Il tempo totale, t, per un trattamento di 1 minuto può essere calcolato dall'equazione 5:
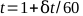 (Equazione 5).
(Equazione 5).
- Calcolare l'intensità di dose per un determinato irradiatore mediante l'equazione 6:
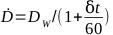 (Equazione 6)
(Equazione 6)
2. Creazione di una curva di calibrazione della pellicola radiocromatica
- Per un elenco dei materiali necessari, vedere Tabella dei materiali.
- Utilizzando un set quasi identico al protocollo precedente, posizionare il film a una profondità di 2 cm nella pila fantasma dell'acqua solida. L'ordine dei fantasmi dell'acqua solida è insignificante purché ci siano 2 cm di acqua solida sopra e 4 cm di acqua solida sotto per gli effetti di accumulo e backscatter.
- Utilizzando la dose determinata commissionata nel protocollo n. 1, determinare i tempi di trattamento per le dosi elencate nella tabella 2 utilizzando l'equazione 7:
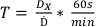 (Equazione 7)
(Equazione 7) - Preparare diversi pezzi di pellicola assicurando che ogni film sia della stessa dimensione e rimanga nello stesso orientamento dal trattamento all'acquisizione della scansione. Questo può essere fatto posizionando un piccolo taglio diagonale nell'angolo in basso a sinistra. Ogni film da questo punto in poi deve essere dello stesso lotto di pellicola.
NOTA: Preparare 3 repliche separate per ogni punto di dose da valutare. - Scansiona i pezzi tagliati utilizzando uno scanner fotografico a colori a 48 bit con tutte le correzioni disattivate. Assicurarsi che ogni pellicola sia posizionata al centro esatto del letto di scansione. I valori ottenuti sono le scansioni pre-esposizione utilizzate per determinare la densità otticanon esposta 11,12. Salvare tutte le immagini in . Formato di file Tiff per evitare la compressione dei dati chiave.
NOTA: Gli autori raccomandano di scansionare i film tre volte e di utilizzare la media ottenuta come valore singolo per un determinato film. - Iniziare l'irradiazione delle pellicole posizionando un pezzo di pellicola sopra 4 cm di acqua solida e posizionando i restanti 2 cm di acqua solida sopra, come descritto in precedenza in questa sezione.
- Regolare l'insieme fantasma in modo che la pellicola sia della stessa distanza dalla sorgente della camera di ionizzazione quando si determina l'uscita della dose. Questo è il punto isocentrico dell'irradiatore.
- Programmare il tempo di trattamento calcolato nel passaggio 2.3 sopra per una dose prescritta.
- Ripetere il trattamento per ciascuna delle dosi elencate nella tabella 2.
- Lasciare riposare i film per 24 ore protetti dalla luce.
- Acquisire le scansioni della pellicola post-esposizione nello stesso modo di cui sopra.
- Importa immagini nel software di analisi ImageJ ed esegui tutte le misurazioni sul canale rosso.
- Trascinare l'immagine in . Formato di file Tiff in ImageJ.
- Fare clic sul menu a discesa Immagine. Selezionare Colore dal menu a discesa Immagine. Selezionate i canali divisi dall'opzione Colore (Color).
- Usando solo il canale dell'immagine rossa, disegna un'area di interesse usando lo strumento rettangolo. Premere CTRL+M. Trascrivere il valore medio dalla finestra dei risultati.
- Ripetere i passaggi 2.12.1-2.12.4 per tutte le pellicole digitalizzate.
- Ottenere il valore del pixel in un quadrato centrale di 1 cm per 1 cm sia per le pellicole non esposte che per le pellicole esposte. Questi valori saranno denotati rispettivamente come PVU(D) e PV(D) e possono essere utilizzati per calcolare la densità ottica netta come descritto nell'equazione 8.
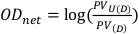 (Equazione 8) 13 la commissione per la
(Equazione 8) 13 la commissione per la
- Ripetere il passaggio 2.13 per ogni coppia di immagini di pellicole, sia pre-esposizione che post-esposizione.
- Tracciare un grafico della dose rispetto alla densità ottica netta e adattare la curva a un polinomio cubico nel formato y = ax3 + bx2 + cx + d. Un esempio è disponibile nella figura 2B.
3. Determinazione del valore α/β per specifiche linee cellulari tumorali tramite saggio clonogenico
NOTA: Il seguente protocollo è una versione modificata dei metodi descritti da Franken etal.14 e può essere visto nella figura 3.
- Far crescere le cellule fino a ~80% di confluenza. Evitare di utilizzare fonti di cellule troppo confluenti per questo esperimento, poiché è necessario che le celle si trovano nella fase di log della crescita cellulare. Per i risultati rappresentativi del saggio clonogenico visualizzati nella figura 3C, le cellule tumorali del seno MDA-MB-231 cerebrali sono state coltivate nel Modified Eagle Medium (DMEM) di Dulbecco integrate con siero bovino fetale al 10% e penicillina/streptomicina e sono state incubate a 37 °C e al 5% di anidride carbonica in un'incubatrice umidificata.
- Seminare le cellule alla densità desiderata per il test della colonia. Diluizioni accurate durante la semina sono fondamentali per determinare l'efficienza di placcatura del saggio. Assicurarsi di placcare più repliche.
- Procedere con questa fase se il trattamento con radiazioni precederà la placcatura cellulare(figura 3A). In alternativa, procedere al passaggio 3.4 se la placcatura cellulare precederà il trattamento con radiazioni.
- Eseguire il trattamento di radiazione desiderato sui contenitori di coltura. Eventuali trattamenti aggiuntivi (cioè trattamenti farmacologici) possono essere eseguiti in qualsiasi momento prima o dopo questo. Per i risultati rappresentativi della figura 3C, il trattamento con radiazioni si è verificato dopo la placcatura delle cellule, dettagliato al passaggio 3.4.
- Estrarre le celle utilizzando il metodo di tripsinizzazione preferito e creare una sospensione a cella singola. Rimuovere i mezzi di coltura e aggiungere l'enzima ricombinante (ad esempio, TrypLE Express) per staccare le cellule dal pallone. Incubare le cellule con l'enzima per circa 3 minuti fino a quando le cellule non sono state staccate come rilevato utilizzando un microscopio a luce. Neutralizzare l'enzima usando un volume uguale di mezzi di coltura cellulare. Centrifugare le cellule a 300 x g per 10 minuti e rimorsi alla concentrazione desiderata nel mezzo di coltura.
- Placcare le cellule alle densità desiderate in più repliche.
- Sostituire con supporti freschi dopo le prime 24 ore.
- Continuare a sostituire i supporti ogni 2-3 giorni.
- Continua a coltivare le cellule fino a quando le colonie di controllo non superano le 50 cellule per colonia, ~ 9-14 giorni. Le colonie di controllo sono quei gruppi di trattamento che non ricevono dosi di radiazioni. Anche per gli esperimenti che utilizzano trattamenti farmacologici, sarà necessario un altro gruppo di controllo con il dosamento dei farmaci, ma non sarà richiesto alcun trattamento con radiazioni.
- Procedere con questo passaggio quando si seminano cellule prima del trattamento con radiazioni ( Figura 3B).
- Estrarre le celle utilizzando il metodo di tripsinizzazione preferito e creare una sospensione a cella singola.
- Posizionare le celle alle densità desiderate in più repliche.
- Consentire alle cellule di aderire alla piastra durante la notte.
- Eseguire le dosi di radiazioni desiderate. Ulteriori trattamenti, come il dosamento dei farmaci, possono essere eseguiti in qualsiasi momento prima o dopo questo passaggio, purché le cellule si siano attaccate alle loro piastre di trattamento. Per i risultati rappresentativi nella figura 3C, 1250 cellule MDA-MB-231 cerebrali-tropiche sono state placcate prima del trattamento (fase 3.4). Quindi, le cellule sono state trattate con 15 nM doxorubicina 3 ore prima dell'irradiazione con 3 Gy di raggi X.
- Sostituire il supporto dopo le 24 h iniziali.
- Sostituire i supporti ogni 2-3 giorni.
- Coltura delle cellule trattate fino a quando le colonie del gruppo di controllo superano le 50 cellule, ~9-14 giorni. Le colonie di controllo sono quei gruppi di trattamento che non ricevono dosi di radiazioni. Anche per gli esperimenti che utilizzano trattamenti farmacologici, sarà necessario un altro gruppo di controllo con il dosamento dei farmaci, ma non sarà richiesto alcun trattamento con radiazioni.
- Rimuovere i supporti di coltura da pozzi o piatti e lavare con PBS.
- Fissare le cellule per 15 minuti in una soluzione 1:7 (v:v) di acido acetico glaciale e metanolo.
- Rimuovere la soluzione di fissazione.
- Dopo la fissazione, le cellule di macchia per 30 minuti, o 2 ore se il tempo è disponibile, a temperatura ambiente con una soluzione di 2,5-5,0 mg/mL di viola cristallino in una soluzione 4:1 (v:v) di acqua distillata e metanolo.
- Rimuovere la soluzione di colorazione e lavare le celle in un grande bagno d'acqua a temperatura ambiente.
NOTA: Non lavare sott'acqua corrente. - Contare il numero risultante di colonie in ogni gruppo di trattamento e calcolare la frazione di sopravvivenza di ogni piastra.
- Tracciare la frazione di sopravvivenza rispetto alla dose corrispondente erogata e adattare la curva con una vestibilità esponenziale.
- Per stimare il valore α/β, utilizzare un adattamento esponenziale del grafico precedente per stimare i valori per ciascuno dei parametri regolabili nell'equazione lineare-quadratica che si trova di seguito:
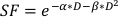 (Equazione 9)
(Equazione 9)
NOTA: L'irradiazione delle cellule può in genere essere effettuata all'isocentro senza alcuna collimazione a condizione che le dimensioni del campo siano abbastanza grandi da ospitare piastre di pozzo o piastre di Petri. Potenziali insidie in questo protocollo possono includere rese come nessuna formazione di colonie, migrazione cellulare significativa con crescita cellulare chiara ma nessuna vera crescita, o contaminazione dovuta al trattamento in una camera di irradiatore non sterile.
4. Determinazione della produzione di dose specifica per progetti sperimentali variabili
- Decidere la dimensione e la distanza del campo desiderate dalla sorgente.
NOTA: La collimazione altererà l'intensità di dose, indipendentemente dalle dimensioni o dalla distanza del collimatore dalla sorgente di raggi X. - Utilizzando i fantasmi dell'acqua solida per fornire accumulo e backscatter, posizionare un pezzo di pellicola nell'orientamento corretto che ritrae al meglio il design sperimentale.
NOTA: Per qualsiasi configurazione sperimentale l'acqua solida potrebbe non fornire la rappresentazione più accurata di un determinato progetto. Si consiglia invece di utilizzare i vasi dell'esperimento reale (ad esempio, piastra di Petri, piastre di pozzo, piccoli fantasmi animali, ecc.). - Irradiare le pellicole per 1 (N=3) e 2 (N=3) minuti.
- Lasciare riposare i film per 24 ore protetti dalla luce.
- Determinare la densità ottica netta di ciascuna pellicola seguendo le procedure della sezione 2. Utilizzare la curva di calibrazione della pellicola per determinare la dose dalla densità ottica netta.
- Determinare la dose a 1 minuto, D1, come intensità di dose in uscita, Ḋ, per questa configurazione sperimentale definita dall'equazione 10 come segue:
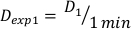 (Equazione 10)
(Equazione 10) - Allo stesso modo, caluclate la dose a 2 minuti dall'equazione 11 come segue:
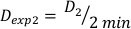 (Equazione 11)
(Equazione 11) - A causa dell'effetto finale, l'intensità di dose per i calcoli di cui sopra può essere leggermente diversa. Per questo motivo per calcolare Dexp per la progettazione sperimentale desiderata, utilizzare una media del singolo Dexp come indicato nell'equazione 12:
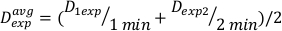 (Equazione 12)
(Equazione 12) - Utilizzando questa media, definire il tempo per il trattamento a qualsiasi dose desiderata per questa particolare impostazione nell'equazione 13:
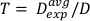 (Equazione 13)
(Equazione 13)
5. Trattamento dei topi che portano tumori in posizione anatomica di interesse
- Anestetizzare il topo con tecniche di anestesia sicure e umane approvate dalla IACUC dell'istituzione.
- Mettere l'animale anestetizzato in moderazione come indicato nel progetto sperimentale desiderato.
- Questo passaggio è facoltativo, se non disponibile procedere al passaggio 5.6. Ottenere un radiogramma, utilizzando una telecamera a portale integrata, del mouse senza collimazione utilizzando un filtro in alluminio.
- Ottenere un secondo radiogramma con collimazione in atto.
- Sovrapporre i radiogrammi in ImageJ per dimostrare il posizionamento del fascio.
- Utilizzando il valore predeterminato α/β, determinare lo schema di dose che fornisce l'approccio più ragionevole per rispondere a una domanda di ricerca (cioè, se si vogliono modellare gli effetti di una dose di 30Gy erogata in 10 frazioni di 3 Gy, ma si desidera dare solo quattro frazioni). Usando l'equazione 14, con un valore di α/β presunto di 10 (questo valore può essere determinato per le singole linee cellulari tumorali nel protocollo 3) e un LETTO simile a quello di 30 Gy/10 F, trattare con 24 Gy in 4 frazioni di 6 Gy.
- Trattare l'animale per il tempo prescritto dato per la dose desiderata.
6. Conferma istologica della deposizione di dose in vivo
- Seguendo il protocollo 5, raccogliere i tessuti di interesse entro 1 ora daltrattamento 15,16. Dopo la raccolta dei tessuti, procedere con il protocollo immunoistochimica preferito. Di seguito è riportato un esempio.
- Perfusare animale con ghiaccio freddo 4% paraformaldeide (PFA).
- Post-fix in PFA a 4 °C.
- Dopo la fissazione, fissare il tessuto in sequenza nel 10%, 20% e 30% di saccarosio per 24 ore ciascuno a temperatura ambiente.
- Incorporare il tessuto nella gelatina e fissare in sequenza in PFA al 4% e di nuovo in saccarosio al 10-30% per 24 ore ciascuno a temperatura ambiente.
- Tagliare il blocco e posizionare a -80 °C per 30 minuti.
- Affettare il tessuto in sezioni da 20 a 30 μm.
- Le diapositive immunostain come sezioni galleggianti libere in un pozzo asei piastre 17,18.
- Lavare tre volte e permeabilizzare per 30 minuti su uno shaker con l'1,83% di litosina nell'1% di Tritone e il 4% di siero di capra inattivato termicamente.
- Incubare sezioni con anticorpo anti-γH2AX per 24 ore, seguite da un'incubazione di 2 ore con l'anticorpo secondario desiderato.
- Vetrini con coverlips in vetro con supporti di montaggio preferiti.
- Immagine su un microscopio fluorescente.
Risultati
In seguito al protocollo 1, l'intensità di dose in Gy/min è specifica dell'irradiatore utilizzato. Tuttavia, indipendentemente dal tipo di irradiatore, con un'intensità di dose nota è possibile generare una curva di taratura utilizzando il protocollo 2 che produce pellicole simili e una curva di taratura simile a quella della figura 2A-B. Un saggio di successo del protocollo 3 produrrà colonie distinte e ben delimitate di cellule che macchiano omogeneamente viola. La stima del α/β può essere confrontata con valori di letteratura o altri gruppi di trattamento per interpretare la radio-sensibilità della linea cellulare data. Utilizzando la curva di calibrazione sviluppata in seguito al protocollo 2 e visualizzata nella figura 2B, il protocollo 4 produrrà due campioni di pellicola simili alla figura 2A che possono essere utilizzati per stimare i tempi di irradiazione sperimentale richiesti. Se per l'irradiatore utilizzato è disponibile una telecamera di imaging a portale di bordo, è possibile ottenere radiogrammi di piccoli animali con e senza collimazione. La sovrapposizione di queste immagini dimostrerà l'esatto posizionamento del fascio di radiazioni collimato rispetto al piccolo animale trattato come descritto nella figura 4A. Una deposizione di dose riuscita nel protocollo 5 può essere confermata dopo il protocollo 6. Un'indicazione che le radiazioni vengono depositate in un sistema in vivo o in vitro è attraverso l'individuazione di rotture di DNA a doppio filamento. Illustrato nella figura 4B, lo stesso mouse trattato esclusivamente attraverso l'emisfero destro nella figura 4A, dimostra la colorazione γH2AX positiva solo nell'emisfero trattato. In questa figura, i nuclei sono macchiati di DAPI per mostrare due cose; 1) il tutto è del cervello a cui è stato applicato l'anticorpo anti γH2AX durante l'analisi istologica e 2) l'emisfero non trattato del cervello rimane non macchiato.
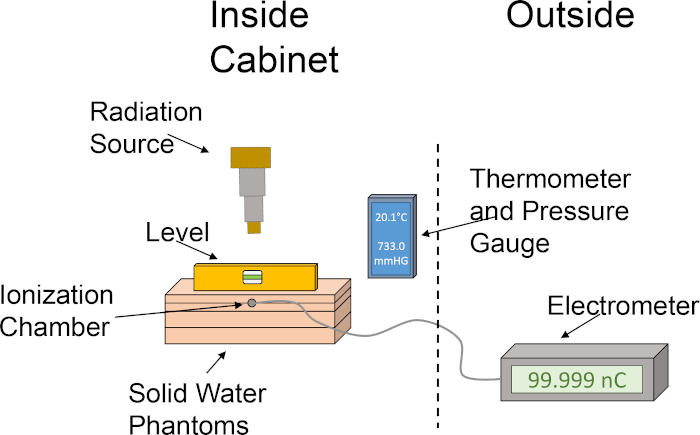
Figura 1: Configurazione approssimativa della camera di ionizzazione e del fantasma d'acqua impostato per la determinazione della produzione di dose. Il pittogramma illustra una configurazione di base che utilizza i vari componenti necessari per la dosimetria utilizzando una camera di ionizzazione e fantasmi di acqua solida all'interno dell'armadio dell'irradiatore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Generazione di una curva di calibrazione mediante pellicola radiocromatica. (A) Cambiamento rappresentativo del colore della pellicola radiocromatica con dose crescente. In alto a sinistra (0 cGy); in basso a destra (2000 cGy). (B) Potenziale curva di taratura della pellicola radiocromatica che confronta la densità ottica netta e la dose. Clicca qui per visualizzare una versione più grande di questa figura.
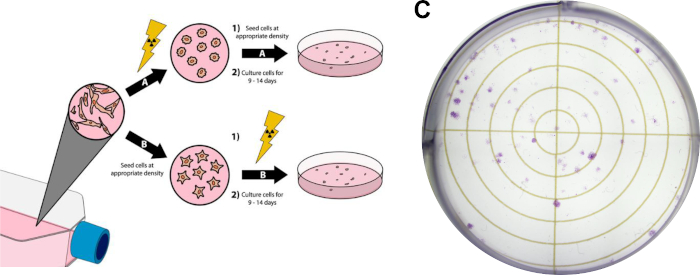
Figura 3: Saggio clonogenico delle cellule tumorali. Il trattamento con radiazioni delle cellule può essere effettuato prima della placcatura in sei piastre di pozzo / piastre dipetri (A), o dopo (B). Nel pannello(C), viene visualizzata un'immagine rappresentativa di un saggio clonogenico di successo con cellule tumorali mammarie MDA-MB-231 dopo aver seguito la sezione 3 del protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
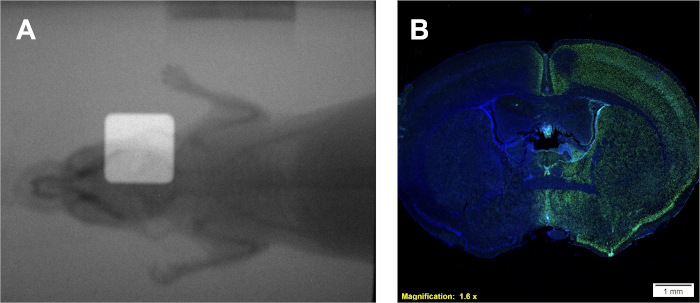
Figura 4: Uso di due radiogrammi sovrapposti per il posizionamento (se disponibile) e di colorazione immunoistochimica γH2AX positiva per la conferma della deposizione della dose. (A) Radiogrammi rappresentativi sovrapposti che raffigurano il posizionamento del fascio di radiazioni. (B) Risultati rappresentativi che indicano la deposizione della dose nell'emisfero destro, come dimostrato dall'aumento dell'intensità γH2AX. Clicca qui per visualizzare una versione più grande di questa figura.
| Fattore di correzione | Spiegazione | |
| Nκ | Fattore di calibrazione del kerma dell'aria | |
| [(μen/ρ)Waria] acqua | Razione dei coefficienti di assorbimento di energia di massa dell'acqua nell'aria; circa 1,05 | |
| Pq,Cham | Contabilità di correzione per lo stelo della camera che influisce sulla perterbazione della fluidità fotona per camera; circa 1.022 | |
| Fasena P | Contabilità di correzione per la camera di ionizzazione di protezione della suona; valore di 1, in quanto la camera è impermeabile | |
| Ppol | Fattore di correzione che rappresenta la polarità; determinato nel protocollo n. 1 | |
| Pione | Fattore di correzione che contabilizza la ricombinazione degli ioni; determinato nel protocollo n. 1 | |
| PTp | Fattore di correzione per temerpatura e pressione il giorno dell'esperimento; determinato nel protocollo n. 1 | |
Tabella 1: Fattori di correzione necessari per la determinazione dell'intensità di dose nel protocollo n. 1.
| Dose | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| * Necessario solo per dosi superiori a 10 per singoli esperimenti. | |
Tabella 2: Dosi da utilizzare nella generazione della curva di taratura della pellicola radiocromatica.
Discussione
Il protocollo di cui sopra descrive un approccio di facile utilizzo per la dosimetria delle radiazioni, la determinazione dei valori di α/β nelle linee cellulari tumorali e un breve esempio di approccio per l'irradiazione in un modello preclinico di metastasi cerebrale del cancro al seno. Questi metodi possono essere utilizzati per studiare qualsiasi modello di cancro e non si limitano solo alla metastasi cerebrale del cancro al seno. In questa sezione discuteremo le complessità pertinenti alla base degli esperimenti di radioterapia preclinica.
La dosimetria si comporta in due parti: 1) calibrare l'uscita con una camera dell'agricoltore, in modo da stabilire l'intensità di dose dell'unità a raggi X, e 2) preparare un pratico sistema di misurazione dosimetrica utilizzando pellicola radiocromatica. Per quanto riguarda la calibrazione dell'uscita, TG-61 fornisce un metodo riproducibile in acqua. Il protocollo qui utilizza l'acqua solida Gammex RMI 457, come raccomandato da XStrahl, il produttore dell'irradiatore. Sebbene l'analisi della dosimetria relativa (profili o curve di dose di profondità normalizzate alla dose massima) con acqua solida, accetti di essere migliore dell'1% con quella dell'acqua, vi è una differenza di circa il 3-4% in dose assoluta a causa di un coefficiente di assorbimento di energia di massa più elevato per l'acqua solida rispetto all'acqua. Tuttavia, poiché tutte le installazioni del sistema XStrahl utilizzano il protocollo dell'acqua solida per la calibrazione dell'uscita, non abbiamo corretto queste differenze. Conoscere l'uscita consente di calcolo del tempo di esposizione necessario per esegnire la dose desiderata. Posizionare il film nella stessa configurazione della camera dell'agricoltore ci consente di fornire dosi note al film. La scansione della pellicola fornisce quindi densità ottiche. La dose alla pellicola può quindi essere grata rispetto alla corrispondente densità ottica netta (differenza nella densità ottica dopo e prima dell'esposizione). Questo produce una curva di calibrazione della pellicola. Quando cambiamo le configurazioni sperimentali, l'intensità di dose in quella situazione potrebbe cambiare, poiché l'intensità di dose dipende dalle dimensioni, dalla profondità e dal materiale irradiato. Esporre la pellicola con la configurazione sperimentale ci fornisce una densità ottica netta e, utilizzando la curva di calibrazione della pellicola, possiamo quindi determinare la dose corrispondente. Dividendo questa dose per il momento in cui il film è stato irradiato, otteniamo l'intensità di dose. Questa dose può quindi essere utilizzata per calcolare il tempo di esposizione per fornire una dose desiderata per la data configurazione sperimentale. Il protocollo sopra descritto gestisce diverse sfumature associate alla dosimetria del film. Ad esempio, dopo l'esposizione, il film richiede circa 24 ore perché le reazioni chimiche nello strato attivo del film siano virtualmente complete. Non aspettare questa quantità di tempo porterà a una minore densità ottica.
Affinché ogni studio abbia dosimetria riproducibile, è importante conoscere e comprendere molti degli elementi chiave di un dato irradiatore. In particolare, è fondamentale conoscere e precisare ad altri ricercatori la fabbricazione e il modello dell'irradiatore utilizzato, il tipo di sorgente (raggi X, radioattivi, ecc.), l'energia, lo strato di mezzo valore, le dimensioni del campo, la fonte alla superficie e alla sorgente alle distanze isocentriche, le dimensioni del materiale irradiato, l'attenuazione prima e il backscatter dopo il materiale irradiato, la dose specifica dell'esperimento, lo schema di frazionamento, le apparecchiature dosimetriche esatte utilizzate e il protocollo dosimetrico utilizzato. Tutti questi punti di informazione sono ciò che descrive in modo coeso la qualità del fascio di un determinato irradiatore prima di fornire una dose a qualsiasi animale ocella 19. Un altro punto pertinente di informazione di questo protocollo e di altri è che l'intensità di dose raggiunta nel protocollo n. 1 è semplicemente la produzione dell'irradiatore utilizzato. Per ogni esperimento è importante definire l'intensità di dose per quella particolare impostazione (protocollo 4) rispetto ad una curva di taratura del film radiocromatico generata (protocollo 2).
La sperimentazione in vitro fornisce dettagli importanti sul comportamento radiobiologico delle linee cellulari tumorali. I test di sopravvivenza delle cellule clonogeniche in vitro stimano e quantificano accuratamente la radiofisività intrinseca di unalinea cellulare 20,favorendo la progettazione di programmi di frazionamento nei successivi esperimenti cellulari o su piccoli animali21. In particolare, questi saggi approssimano i valori per i parametri α e β che sono usati nel modello lineare-quadratico per prevedere la morte cellulare in risposta alla radioterapia secondo l'equazione:
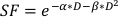 (Equazione 9)
(Equazione 9)
dove SF è la frazione sopravvissuta delle cellule clonogenicamente vitali, D è la dose di radiazioni in Gy e α e β sono parametrimontati 22. Il rapporto α/β fornisce una misura intrinseca della radio-sensibilità cellulare, con valori più elevati correlati con una maggiore sensibilità di una lineacellulare 22. Poiché questa relazione funzionale non è lineare rispetto alla dose, gli effetti biologici di uno schema di frazionamento della radioterapia non sono solo correlati alla dose totale erogata, ma anche al numero e alla dimensione delle frazioni23. La dose biologica efficace (BED) è una misura della dose biologica vera somministrata a un tessuto e consente il confronto diretto di diversi schemi di frazionamento24,25. L'equazione BED richiede solo una stima α/β, ed è visualizzata di seguito:
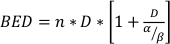 (Equazione 14)
(Equazione 14)
dove n è il numero di frazioni della dose D. I test di sopravvivenza delle cellule clonogeniche stimano α/β e facilitano il confronto diretto degli schemi di frazionamento della radioterapia attraverso l'equazione BED. Si possono trarre conclusioni errate in merito a una risposta di tessuti o organi alla radioterapia (o combinazioni di radioterapia con altre modalità) se il LETTO nei gruppi di trattamento non è equo all'interno o tra gli esperimenti. Ad esempio, 2 frazioni di 10 Gy rispetto a 4 frazioni di 5 Gy non producono lo stesso LETTO, e quindi questi schemi di dosing non possono essere confrontati direttamente in termini di risposta biologica. L'equazione BED, sebbene imperfetta a causa dei limiti intrinseci nel modello lineare-quadratico, stima in modo affidabile effetti equi per un'ampia gamma di condizionidi trattamento sperimentale 24,25.
I test di sopravvivenza delle cellule clonogeniche svolgono chiaramente un ruolo importante nello studio degli effetti della radioterapia nei modelli di cancro, ma la sperimentazione in vitro offre una serie di opzioni aggiuntive per esplorare ulteriormente i dettagli meccanicistici della radiobiologia delle cellule tumorali. Semplici modifiche del saggio di sopravvivenza delle cellule clonogeniche sono state utilizzate per determinare le modalità di azione per alcune chemioterapie radio-sensibilizzanti, come il paclitaxel o l'etoposide26,27. Ulteriori opzioni sperimentali in vitro includono studi di immunocitochimica per esaminare specifiche vie di riparazione cellulare, come i focolai di γ-H2AX e / o la colorazione 53BP1 per la riparazione della rottura del DNA a doppiofilamento 28. Questi esperimenti possono essere di particolare interesse quando si confronta la radioterapia come una singola modalità con terapie combinato, specialmente quando si sondano dettagli meccanicistici per una data linea cellulare. Altre opzioni sperimentali includono misurazioni della citochina per esaminare il ruolo innato della risposta infiammatoria di una cellula all'irradiazione o analisi del modo di morte cellulare (ad esempio, apoptosi, necrosi, catastrofe mitotica, ecc.) in diverse condizioni terapeutiche29,30,31. Questo tipo di sperimentazione può integrare o sostituire la sperimentazione animale e fornire una comprensione più completa della radiobiologia di una linea di cellule tumorali. Indipendentemente dalla scelta di ulteriori esperimenti da condurre, un saggio standard di sopravvivenza delle cellule clonogeniche come descritto nel protocollo 3 è un'importante valutazione radiologica iniziale di una linea cellulare.
I test clonogenici e la dosimetria delle radiazioni forniscono al ricercatore un mezzo per pianificare con precisione gli esperimenti per assomigliare più direttamente agli scenari clinici. Con l'aggiunta del cancro preclinico piccoli modelli di roditori, è possibile studiare la risposta alle sole radiazioni o nel contesto di un piano di trattamento in vivo. Prima di utilizzare gli animali, è importante determinare l'uscita relativa della dose dell'impostazione specifica se differisce dall'impostazione utilizzata per la determinazione dell'uscita della dose32,33. Quando si tratta di determinare un'intensità di dose per le dimensioni del campo di <10 mm, l'uso di una camera di ionizzazione diventa meno accurato a causa dell'allineamento all'interno di un piccolo campo e degli effetti di media del volumeparziale 33. L'uso di pellicola radiocromatica per determinare la produzione in combinazione con esperimenti immunoistochimici in vivo è stato utilizzato per determinare la deposizione di uscita e dose negliultimi 16,34,35,36,37,38.
Divulgazioni
Gli autori non hanno alcuna divulgazione da fare.
Riconoscimenti
Gli autori ringraziano le strutture di imaging per microscopio e modelli animali di WVU per l'uso delle loro apparecchiature supportate dal numero di sovvenzione P20GM103434. Inoltre, questo lavoro è stato supportato dal numero di sovvenzione P20GM121322 dall'Istituto Nazionale di Scienze Mediche Generali, dal numero di sovvenzione del National Cancer Institute F99CA25376801 e dal Mylan Chair Endowment Fund.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
Riferimenti
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5(2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001(2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104(2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. Radiobiology for the radiologist. Eighth edition. , Wolters Kluwer. (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96(2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251(2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204(2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134(2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon