Method Article
Estrazione della cromatina dal tessuto epatico chimerico congelato per l'analisi dell'immunoprecipitazione della cromatina
In questo articolo
Riepilogo
Questo protocollo si concentra sulla preparazione della cromatina da tessuti congelati a scatto ed è adatto per l'immunoprecipitazione della cromatina reticolante (X-ChIP) seguita da analisi quantitative PCR (X-ChIP-qPCR) o approcci di sequenziamento di nuova generazione (X-ChIP-seq).
Abstract
L'immunoprecipitazione della cromatina reticolante (X-ChIP) è una tecnica ampiamente utilizzata per valutare i livelli di segni istonici e l'occupazione dei fattori di trascrizione sulla cromatina dell'ospite e/o del patogeno. La preparazione della cromatina dai tessuti crea ulteriori sfide che devono essere superate per ottenere protocolli riproducibili e affidabili paragonabili a quelli utilizzati per la coltura cellulare. La rottura e la fissazione dei tessuti sono passaggi critici per ottenere una taglio efficiente della cromatina. La coesistenza di diversi tipi di cellule e cluster può anche richiedere tempi di taglio diversi per raggiungere la dimensione ottimale del frammento e ostacolare la riproducibilità del taglio. Lo scopo di questo metodo è quello di ottenere preparazioni di cromatina ospite affidabili e riproducibili da tessuto congelato (fegato) adatte sia per applicazioni ChIP-qPCR che di sequenziamento di nuova generazione (NGS). Abbiamo osservato che la combinazione di polverizzazione del tessuto azotato liquido seguita da omogeneizzazione porta ad una maggiore riproducibilità rispetto alla sola omogeneizzazione, poiché fornisce una sospensione costituita principalmente da singole cellule dissociate che possono essere efficacemente tagliate. Inoltre, la fase di fissazione deve essere eseguita sotto una leggera rotazione per fornire una reticolazione omogenea. Il materiale fisso è quindi adatto per l'isolamento di nuclei basati su tampone, per ridurre la contaminazione di DNA e RNA citoplasmatici di proteine e patogeni (quando applicabile), evitando gradienti di centrifugazione dispendiosi in termini di tempo. La successiva sonicazione completerà la lisi nucleare e taglierà la cromatina, producendo una gamma di dimensioni specifiche in base alle condizioni di taglio scelte. L'intervallo di dimensioni dovrebbe essere compreso tra 100 e 300 nt per le applicazioni NGS, mentre potrebbe essere superiore (300-700 nt) per l'analisi ChIP-qPCR. Tali adattamenti del protocollo possono migliorare notevolmente l'analisi della cromatina da campioni di tessuto congelato.
Introduzione
Dalla sua scoperta, la regolazione epigenetica nelle cellule di mammifero ha ottenuto un crescente riconoscimento1, considerando che la comprensione di tali meccanismi fornirebbe informazioni chiave non solo nella biologia cellulare, ma anche nella biologia delle malattie e dei tumori. Inoltre, gli agenti infettivi possono anche causare alterazioni epigenetiche dell'ospite2 mentre il meccanismo della cellula ospite può anche influenzare la cromatina di agenti patogeni, come i virus a DNA persistenti 3,4. Questa interazione ospite-patogeno sembra svolgere un ruolo nella persistenza dell'infezione. numero arabo
Attraverso un'associazione reversibile con il DNA, le proteine istoniche formano un complesso chiamato nucleosoma. I nucleosomi raggiungono a loro volta un livello superiore di organizzazione noto come cromatina. Il rimodellamento della cromatina è noto per regolare strettamente l'espressione genica, concedendo o negando l'accesso ai fattori di trascrizione (TF)5. Questi fattori possono innescare o bloccare il reclutamento della RNA polimerasi II (PolII) sui promotori genici, influenzando la sintesi dell'mRNA dal modello di DNA6. Le proteine istoniche contengono code7, che fiancheggiano entrambe le estremità della piega istonica, che possono essere soggette a modifiche post-traduzionali (PTM), consentendo una stretta regolazione della trascrizione genica da parte di cambiamenti strutturali della cromatina. La maggior parte dei PTM istonici si trova al N-terminale della coda, con acetilazione e metilazione che sono le PTM meglio studiate, sebbene siano state descritte anche fosforilazione8, ubiquitinazione9 e ribosilazione10 . La caratterizzazione e lo studio di tali proteine è quindi essenziale per ottenere una visione approfondita della regolazione genica.
Attualmente, esiste una manciata di metodi e strumenti consolidati disponibili per studiare le interazioni dirette DNA-proteina: Electrophoretic mobility shift assay (EMSA), Yeast one-hybrid assay (Y1H) e DNA footprinting11. Tuttavia, questi metodi si concentrano di per sé sulle interazioni singolo DNA-proteina e non sono applicabili per studi sull'intero genoma. Un'altra limitazione di queste tecniche è la mancanza di associazione istonica con i segmenti di DNA studiati. Pertanto, tali approcci non intendono riflettere la complessità del meccanismo trascrizionale in vivo e non tengono conto di importanti cambiamenti strutturali12 o di altri enzimi/cofattori richiesti13 che potrebbero influenzare (promuovere o inibire) il legame proteico al DNA.
L'idea che il fissaggio delle cellule con agenti come la formaldeide (FA) potesse fornire un'istantanea in vivo delle interazioni proteina-DNA, ha creato le basi per lo sviluppo di saggi di immunoprecipitazione della cromatina (ChIP)14. Questo, insieme alla disponibilità della tecnologia PCR quantitativa (qPCR) e di anticorpi altamente specifici, ha permesso lo sviluppo di saggi ChIP-qPCR. Successivamente, l'avvento delle tecniche di sequenziamento di nuova generazione (NGS), i cui costi stanno diventando sempre più accessibili, ha permesso di accoppiare gli esperimenti ChIP con gli approcci NGS (ChIP-seq), fornendo così ai ricercatori nuovi potenti strumenti che consentono di indagare sulla regolazione della cromatina. In questi saggi, le cellule isolate o in coltura vengono fissate con disuccinimidil glutarato (DSG) e/o FA, i nuclei vengono isolati, la cromatina viene quindi frammentata e precipitata dall'anticorpo di interesse. Successivamente, il DNA viene purificato e analizzato mediante approcci PCR o NGS. A differenza dell'impronta EMSA, Y1H e DNA, i saggi ChIP hanno la capacità di fornire un'istantanea globale dell'interazione proteina-DNA all'interno della cellula. Ciò offre flessibilità e consente l'analisi di più loci all'interno dello stesso campione. Tuttavia, a causa della natura del test, ChIP può, alla fine, rilevare non solo le interazioni dirette, ma anche quelle indirette, non offrendo la precisione dei metodi sopra menzionati, quando si è interessati alle interazioni dirette proteina-DNA.
I protocolli di preparazione della cromatina da materiale di coltura cellulare sono ben consolidati15 e altamente riproducibili, consentendo all'utente di ottenere cromatina adatta sia per gli approcci qPCR che NGS in 1-2 giorni lavorativi. Tuttavia, ottenere cromatina di alta qualità da interi tessuti rappresenta ancora una sfida a causa della necessità di dissociare le cellule all'interno del tessuto ottenendo al contempo una fissazione e un taglio ottimali della cromatina. Inoltre, la composizione e la morfologia di tipi distinti di tessuti variano, richiedendo quindi l'adeguamento dei protocolli esistenti16,17. L'uso di tessuti crioconservati offre ulteriori sfide rispetto ai campioni freschi. Ciò è dovuto alla difficoltà di ottenere una sospensione a cella singola senza un'estesa perdita di materiale. Ciò porta a una cesoiatura impropria, ostacolando le applicazioni a valle. Tuttavia, l'accesso a campioni di tessuto congelati piuttosto che alla controparte fresca non solo aumenta la flessibilità del lavoro, ma può anche rappresentare l'unica opzione per i ricercatori che lavorano con campioni che provengono da studi longitudinali o comparativi. Sono stati pubblicati alcuni protocolli di preparazione della cromatina per il tessuto congelato. Questi sono per lo più basati sullo scongelamento dei campioni seguito da tritatura, dissociazione manuale / meccanica o fasi di polverizzazione dell'azoto liquido18,19,20.
Qui descriviamo un metodo di preparazione della cromatina ottimizzato15 per campioni di fegato congelati non fissati, che combina la polverizzazione dei tessuti in azoto liquido con l'omogeneizzazione del pestello, per ottenere una tosatura della cromatina riproducibile adatta agli approcci X-ChIP volti ad analizzare sia i genomi virali che quelli dell'ospite.
Protocollo
Il prelievo di tessuto da topi chimerici epatici umani21 è stato eseguito in conformità con la direttiva dell'Unione Europea 86/609/CEE e approvato dal comitato etico della città e dello stato di Amburgo in conformità con i principi della Dichiarazione di Helsinki.
1. Preparazione dei reagenti
- Preparare la soluzione di glicina 1,25 M in acqua deionizzata. Filtro sterile con filtro da 0,22 μm delle dimensioni dei pori. Conservare a 4 °C.
- Preparare la soluzione di cloruro di sodio (NaCl) 5 M. Conservare a temperatura ambiente.
- Preparare la soluzione di CaCl 2: 300 mM CaCl2 e 10 mM Tris-HCl pH 8 in acqua deionizzata. Filtro sterile con filtro da 0,22 μm di dimensioni poro e conservare a RT.
- Preparare una diluizione Triton X-100 al 10% in acqua deionizzata. Negozio su RT.
- Preparare il tampone Tris-EDTA: 1 mM EDTA e 10 mM Tris pH 8 in acqua deionizzata. Conservare a 4 °C.
- Preparare i seguenti buffer in base alla quantità richiesta:
- Preparare il tampone A: 50 mM Hepes-KOH pH 7,5, 140 mM NaCl, 1 mM acido etilendiamminotetraacetico (EDTA), 10% glicerolo, 0,5% NP-40 e 0,25% Triton X-100 in acqua deionizzata. Filtro sterile con filtro da 0,22 μm delle dimensioni dei pori. Conservare a 4 °C.
- Preparare il tampone B: 10 mM Tris-HCl pH 8, 200 mM NaCl, 1mM EDTA, 0,5 mM acido egtazico (EGTA). Filtro sterile con filtro da 0,22 μm delle dimensioni dei pori. Conservare a 4 °C.
- Preparare il tampone C: 1% SDS, 10 mM EDTA e 50 mM Tris-HCl pH 8 in acqua deionizzata. Filtro sterile con filtro da 0,22 μm delle dimensioni dei pori. Negozio su RT.
- Preparare il tampone di diluizione della cromatina: 0,01% SDS, 1,1% Triton X-100, 1,2 mM EDTA, 16,6 mM Tris-HCl pH 8 e 166 mM NaCl in acqua deionizzata. Filtro sterile con filtro da 0,22 μm delle dimensioni dei pori. Conservare a 4 °C.
2. Preparazione del materiale
- Raccogliere ghiaccio secco, ghiaccio e azoto liquido.
ATTENZIONE: Maneggiare ghiaccio secco e azoto liquido con la cura necessaria per evitare ustioni. - Preraffreddare la centrifuga a 4 °C.
NOTA: Questo passaggio è importante per evitare la degradazione delle proteine e la de-reticolazione durante le fasi di lavaggio in quanto ciò ridurrà la qualità della cromatina. - Metti una piastra sterile sul ghiaccio secco e lascialo raffreddare.
NOTA: Assicurarsi che la piastra sia abbastanza grande da facilitare il processo di taglio. Si consiglia una piastra di Petri/capsula di coltura cellulare da 100 mm. - Estrarre l'aliquota necessaria di glicina 1,25 M e lasciarla raggiungere RT.
- Eliminare le aliquote necessarie del buffer A, B e PBS. Aggiungere proteasi e/o inibitori della deacetilasi e della fosfatasi per raggiungere una concentrazione di 1 volta e lasciarli sul ghiaccio.
- Togliere l'aliquota necessaria del buffer C lasciandola a RT. Non aggiungere la proteasi e/o gli inibitori della deacetilasi e della fosfatasi fino a quando specificato.
- Estrarre l'aliquota necessaria di RT PBS.
ATTENZIONE: Il tampone C contiene sodio dodecilsolfato (SDS). Adottare le misure di sicurezza appropriate durante la preparazione del tampone.
NOTA: SDS precipita sul ghiaccio e gli inibitori della proteasi e della deacetilasi non sono stabili a RT. - Pre-raffreddare la malta versando azoto liquido nella sua camera, seguendo rigorosamente le istruzioni del fornitore. Raffreddare il pestello di metallo in ghiaccio secco per almeno 5 minuti.
NOTA: E' possibile utilizzare una malta alternativa a quella proposta. Tuttavia, il dispositivo utilizzato in questo protocollo, grazie alla sua particolare costruzione, consente di lavorare con piccole quantità di tessuto senza perdite sostanziali durante il processo di polverizzazione. - Pre-raffreddare l'omogeneizzatore Dounce con il pestello A associato sul ghiaccio.
NOTA: Pestle A ha una vestibilità ampia con l'omogeneizzatore. Ciò consente di ottenere una sospensione monocellulare senza lisi cellulare significativa.
3. Crosslinking tissutale
- Tagliare circa 50 mg di tessuto congelato direttamente sul piatto su ghiaccio secco con l'aiuto di bisturi e pinzette.
NOTA: Si consiglia di mantenere il bisturi a RT, in quanto ciò faciliterà il processo di taglio. Evitare di applicare troppa pressione sul bisturi, in quanto ciò aumenterà il rischio di dispersione di pezzi di tessuto al di fuori dell'area di taglio. Da notare, 50 mg di tessuto (fegato in questo caso) dovrebbero produrre circa 5 milioni di cellule. Si noti che la lama calda scongela il tagliente. Considerando le dimensioni relativamente grandi del pezzo di tessuto, tuttavia, questo dovrebbe avere un effetto limitato. Quando vengono tagliati pezzi più piccoli, potrebbe essere utile utilizzare un bisturi freddo facendo attenzione ad evitare la dispersione del tessuto. - Mettere il tessuto tagliato in un tubo da 1,5 ml già raffreddato su ghiaccio secco. Evitare lo scongelamento dei tessuti.
- Spostare il tubo contenente il tessuto nella malta, lasciandolo riposare lì per 5 minuti.
NOTA: Lasciando riposare il campione nella malta si riduce la sua temperatura (da -80 °C a -196 °C). Questo aumenta la sua tenacità e rende più facile la fase di polverizzazione. - Applicare pressione sul campione con l'aiuto del pestello pre-raffreddato fino a quando non sono più visibili sbriciolate solide.
NOTA: È importante evitare il riscaldamento del pestello con forze di rotazione eccessive, poiché ciò scongela il campione. Dopo ogni polverizzazione del campione, pulire il pestello con etanolo al 70% (EtOH) e lasciarlo raffreddare di nuovo sul ghiaccio secco. - Rimuovere la provetta contenente il campione dalla malta e aggiungere 950 μL di PBS ghiacciato con gli inibitori necessari. Pipettare delicatamente su e giù fino a quando il campione non è completamente sospeso. Procedere immediatamente al punto 3.6.
- Trasferire la sospensione di tessuto sull'omogeneizzatore e applicare 20-30 colpi con pestello A per ottenere una sospensione più fine. Evitare la formazione di schiuma.
NOTA: La quantità di tratti deve essere ottimizzata in base alla consistenza del tessuto. Questo passaggio dissocia ulteriormente i piccoli gruppi di cellule ottenuti dopo la polverizzazione. Un'omogeneizzazione impropria può influire sull'efficienza di taglio. - Trasferire l'omogenato in un nuovo tubo da 1,5 ml, già prerefrigerato su ghiaccio.
- Centrifugare per 5 minuti a 1.300 x g a 4 °C e rimuovere con cura il surnatante.
- Risospendere completamente il pellet in 950 μL di RT PBS mediante pipettaggio delicato e aggiungere 63,6 μL di FA privo di MeOH al 16% per ottenere una concentrazione finale dell'1%. Procedere immediatamente al punto 3.10.
ATTENZIONE: FA è una sostanza chimica tossica. Maneggiarlo sotto una cappa aspirante con adeguate misure di sicurezza.
NOTA: la risospensione incompleta può provocare l'aggregazione cellulare durante la fase di fissazione. Ciò ostacola il processo di lisi e di taglio. - Ruotare di 10 minuti su RT. Procedere immediatamente al punto 3.11
NOTA: la rotazione è necessaria per evitare aggregati. La quantità di tempo necessaria per la fissazione deve essere ottimizzata, in base al target di interesse e al tipo di campione. È importante notare che tempi di fissazione eccessivi potrebbero ostacolare una corretta tosatura. - Aggiungere 113 μL di glicina 1,25 M a RT per ottenere una concentrazione finale di 125 mM e ruotare per 5 minuti.
NOTA: La glicina estingue la reazione fissativa evitando l'over-cross-linking. - Centrifugare a 1.300 x g per 3 minuti a 4 °C.
- Scartare il surnatante e risospendere il pellet con cautela pipettando 950 μL di PBS ghiacciato con gli inibitori necessari.
- Centrifugare a 1.300 x g per 3 minuti a 4 °C.
- Ripetere i passaggi 3.13-3.14 e procedere immediatamente alle fasi di isolamento della cromatina.
4. Isolamento della cromatina
- Aggiungere 950 μL di tampone A con gli inibitori necessari al pellet. Mescolare delicatamente mediante pipettaggio fino a completa risospensione del pellet e ruotare di 10 minuti a 4 °C.
NOTA: Questo passaggio lisa la sospensione fissa a singola cellula, senza lisi dei nuclei. Ciò consente di liberare il campione da proteine citosoliche e RNA. Prolungare il tempo di lisi potrebbe essere utile per le cellule difficili da lisi, aumentando, tuttavia, il tempo di manipolazione del tessuto. A questo punto è possibile controllare la preparazione al microscopio dopo la colorazione con tripano blu/DAPI per verificare la dimensione dei cluster e la presenza di singole cellule. Tuttavia, i singoli nuclei potrebbero non essere facili da apprezzare a causa del materiale tissutale fisso. - Centrifugare a 2.000 x g per 5 minuti a 4 °C e rimuovere accuratamente il surnatante.
- Aggiungere 950 μL di tampone B con gli inibitori necessari al pellet. Mescolare delicatamente mediante pipettaggio fino a completa risospensione del pellet e ruotare di 10 minuti a 4 °C.
NOTA: Questo passaggio elimina il tampone di lisi dalla preparazione dei nuclei per evitare ulteriori lisi indesiderate. - Centrifugare a 2000 x g per 5 minuti a 4 °C. Nel frattempo, aggiungere gli inibitori necessari (come il passaggio 2.5) al buffer C.
- Rimuovere con attenzione il surnatante.
- Aggiungere 300 μL di tampone RT C al pellet e pipettare energicamente.
- Vortice il campione per 15-30 s e ruotare brevemente il tubo per raccogliere le gocce sul coperchio.
NOTA: Questo passaggio è importante per liberare e lisare i nuclei fissi. Per preservare l'integrità del campione e allo stesso tempo evitare la precipitazione SDS, conservare il campione prima della sonicazione in una griglia di plastica mantenuta sul ghiaccio per mantenere una temperatura di 9-11 °C.
5. Frammentazione della cromatina
- Trasferire il campione in tre provette pulite certificate per sonicazione da 0,65 mL garantendo 100 μL di sospensione di nuclei lisati per provetta.
NOTA: È possibile utilizzare provette certificate per sonicazione da 1,5 ml con un volume massimo di 300 μL. È necessario un supporto specifico per quei tubi. 0,65 ml dovrebbero offrire una cesoiatura più omogenea a causa del minor volume del campione per provetta. - Sonicare la cromatina per 28 cicli ad alta intensità con l'impostazione 30 s ON e 30 s OFF. Assicurarsi che il bagno sonicatore sia adeguatamente raffreddato (ghiaccio o dispositivo di raffreddamento).
NOTA: questo passaggio richiede l'ottimizzazione in quasi tutti i casi. L'utente deve tenere presente che l'aumento del tempo di taglio fornirà frammenti più piccoli e più omogenei; Tuttavia, ciò può aumentare la possibilità di ridurre la qualità della cromatina. Scegliere il numero più basso di cicli che fornisce la dimensione del frammento richiesta. Durante l'ottimizzazione di questa fase, è utile eseguire la colorazione nucleare per verificare se il numero di cicli era sufficiente per lisare la maggior parte dei nuclei. - Trasferire la cromatina sonicata in un nuovo tubo da 1,5 mL precedentemente raffreddato su ghiaccio.
- Aggiungere 30 μL di soluzione Triton X-100 al 10% e vortice per 5-10 s.
NOTA: Triton X-100 lega la SDS impedendo ulteriori precipitazioni a 4 °C. L'importo finale di Triton X-100 dovrebbe essere sempre dell'1%. - Centrifugare a 16.000 x g per 15 minuti a 4 °C.
- Trasferire il surnatante in un tubo pulito da 1,5 mL pre-raffreddato su ghiaccio.
- NOTA: Il surnatante contiene la cromatina tranciata e dovrebbe apparire limpido. Il pellet contiene resti "non tagliabili" e dovrebbe rimanere piuttosto piccolo (per lo più marrone in caso di tessuto epatico). Cerca l'indicazione di una cesoiatura non riuscita: soluzione di cromatina che non è diventata più chiara e dimensioni del pellet simili a quelle del punto 4.5.
6. Purificazione del DNA
- Trasferire 10-25 μL di cromatina tranciata in una nuova provetta e aggiungere il tampone C per raggiungere un volume finale di 200 μL. Conservare il resto della cromatina a -80 °C fino a ulteriore utilizzo. Se necessario, la procedura può essere interrotta in questa fase e il campione conservato a -20 °C.
- Aggiungere 8 μL di 5 M NaCl e incubare almeno 6 ore a 65 °C in un blocco riscaldante sotto agitazione a 1000 giri/min.
NOTA: questo passaggio de-crosslink la cromatina. È più sicuro estendere la de-crosslinking durante la notte, quando possibile. La presenza di NaCl rende il processo più efficiente. - Lasciare raffreddare i campioni a RT per 5 minuti e aggiungere 2 μL di RNasi A.
- Incubare per 1 ora a 37 °C agitando a 1000 giri/min.
- Rimuovere i campioni dal blocco riscaldante e aggiungere 7 μL di 300 mM di CaCl 2 e2 μL di proteinasi K.
- Impostare il blocco riscaldante a 56 °C e incubare per 30 minuti agitando a 1000 giri/min. Nel frattempo preparare una provetta a separazione di fase per ogni campione centrifugandole a 16.000 x g per 1 minuto a 4 °C.
NOTA: Questi tubi speciali facilitano la separazione di fase durante l'estrazione del fenolo-cloroformio dell'acido nucleico. - Rimuovere i tubi dal blocco riscaldante e lasciarli equilibrare a RT per 3 minuti.
- Trasferire 400 μL del campione in una provetta a separazione di fase precedentemente centrifugata.
- Aggiungere 400 μL di soluzione di alcol fenolo-cloroformio-isoamilico (PCI) e vortice per 5 s.
ATTENZIONE: Il PCI è un composto altamente volatile e tossico. Si prega di maneggiarlo con le necessarie misure di sicurezza sotto una cappa aspirante. - Centrifugare a 16.000 x g per 5 minuti a 4 °C.
- Aggiungere 400 μL di cloroformio e vortice per 5 s.
ATTENZIONE: Il cloroformio è un composto altamente volatile e tossico. Si prega di maneggiarlo con le necessarie misure di sicurezza sotto una cappa aspirante.
NOTA: Questo passaggio elimina possibili residui di fenolo, che potrebbero interferire con le applicazioni PCR a valle. - Centrifugare a 16.000 x g per 5 minuti a 4 °C.
- Trasferire 400 μL della fase superiore in un nuovo tubo da 1,5 mL dove sono stati aggiunti 24 μL di 5 M NaCl e 0,75 μL di glicogeno. Brevemente vortice.
- Aggiungere 1.055 μL di 100% EtOH e vortice accuratamente. Garantire una corretta miscelazione.
- Incubare a -80 °C per 1 ora o a -20 °C durante la notte (ON).
NOTA: Questo passaggio fa precipitare il DNA tranciato; per massimizzare la resa si consiglia di scegliere l'incubazione ON. - Centrifugare a 16.000 x g per 30 minuti a 4 °C.
- Rimuovere con attenzione il surnatante facendo attenzione a non dislocare il pellet.
- Aggiungere 500 μL di EtOH freddo al 70%. Inclinare delicatamente il tubo per assicurarsi che il pellet sia lavato.
NOTA: Questo passaggio è essenziale per rimuovere i residui salini che potrebbero aver co-precipitato con gli acidi nucleici. I sali possono interferire con altre applicazioni a valle. - Centrifugare a 16.000 x g per 15 minuti a 4 °C.
- Rimuovere con cura l'intero surnatante e lasciare asciugare il pellet a RT.
NOTA: L'incubazione del tubo su un blocco riscaldante a 37 °C ridurrà il tempo necessario per l'asciugatura. - Aggiungere 50 μL di soluzione Tris-EDTA (TE-Buffer) e porre il tubo sul blocco riscaldante a 37 °C per 5-10 minuti agitando a 300 giri/min.
NOTA: Questo passaggio garantisce la dissoluzione del pellet. Il protocollo può essere messo in pausa qui e il campione può essere conservato a 4 °C per un massimo di 1 settimana o a -20 °C per una conservazione più lunga. - Eseguire l'analisi del DNA su gel di agarosio all'1%.
7. Analisi delle dimensioni del DNA
- Preparare un gel di agarosio all'1% mescolando 1 g di agarosio per 100 ml di tampone corrente (cioè Tris-acetato-EDTA (TAE) o Tris-borato-EDTA (TBE)). Riscaldare la sospensione fino a quando l'agarosio è completamente sciolto. Aggiungere 10 μL di EtBr per ogni 100 ml di soluzione di agarosio prima di versare la soluzione di gel.
ATTENZIONE: EtBr è un agente intercalante del DNA noto per essere cancerogeno. Si prega di maneggiarlo con le necessarie misure di sicurezza sotto una cappa aspirante.
NOTA: La colorazione EtBr (direttamente in gel o dopo la corsa) è fortemente consigliata. Altri coloranti che intercalano il DNA non hanno funzionato bene nelle nostre mani quando si lavora con gli strisci di DNA. I pozzetti di carico stretti offrono una risoluzione migliore rispetto a quelli più larghi. - Mescolare 10 μL del campione con 2 μL di colorante di caricamento 6x. Quindi, caricare 10 μL del campione nel gel ed eseguirlo fino a quando l'ultima banda del colorante di carico ha funzionato per 2/3 del gel. Assicurati di aggiungere una scala del DNA.
- Immagine del gel e verificare se la dimensione dello striscio rientra nell'intervallo per l'applicazione desiderata.
Se la cromatina supera il controllo di qualità, può essere utilizzata per applicazioni a valle.
Risultati
La preparazione della cromatina è un passo cruciale per ottenere un ChIP di successo. Al fine di preparare cromatina di buona qualità da campioni congelati, dovremmo garantire un'efficace rottura dei tessuti prima della fissazione per evitare la presenza di grumi di tessuto che potrebbero ostacolare una tosatura efficiente. Nella Figura 1 viene illustrata una pipeline riepilogativa del protocollo. La polverizzazione da sola non è sufficiente per dissociare completamente il tessuto poiché produce gruppi di cellule di dimensioni variabili e poche cellule singole (Figura 1a). Associando la prima fase di polverizzazione all'omogeneizzazione di Dounce, la quantità di grumi di tessuto è fortemente ridotta e i restanti sono più piccoli (Figura 1b). Dopo le fasi di fissazione e lisi, il numero di singoli nuclei visibili (Figura 1c) aumenta, mentre il tipico aspetto sferico viene perso. Dopo la sonicazione per 28 cicli, la colorazione nucleare (Hoechst 33258 / DAPI) non è più visibile. Questo è davvero un segno di tosatura riuscita (Figura 1d). Dopo la de-reticolazione di un'aliquota di cromatina e la visualizzazione del DNA su gel di agarosio, la tosatura di successo può essere riconosciuta dalla presenza di frammenti nell'intervallo di 100-300 bp. (Figura 2a) La quantità di DNA può variare in base alla composizione del pezzo di tessuto preparato. Tale cromatina può essere utilizzata con successo per ChIP-qPCR. Come mostrato nella Figura 2b , la cromatina potrebbe essere precipitata con successo con gli anticorpi H3K4me3, H3K27ac (modificazioni correlate ai geni attivi) e H3K27me3 (modificazione correlata ai geni silenziati). Le regioni promotrici del cromosoma 1 Open Reading Frame 43 (C1orf43), della subunità beta 2 del proteasoma 20S (PSMB2) e della gliceraldeide-3-fosfato deidrogenasi (mGapdh) sono risultate arricchite in H3K4me3 e H3K27ac rispetto a Homeobox C13 (HOXC13), Homeobox C12 (HOXC12) e le regioni promotrici del fattore di trascrizione della mielina 1 (mMyt1) del topo (Tabella 1). Questo perché C1orf43, PSMB2 e mGapdh sono trascritti costitutivamente nel fegato, mentre HOXC13, HOXC12 e mMyt1 sono silenziati. H3K27me3 mostra il comportamento opposto confermando il successo del test ChIP. Il fatto che il fegato di questi topi sia una chimera, ci ha permesso di analizzare sia la cromatina murina che quella umana. Inoltre, la stessa cromatina potrebbe essere utilizzata con successo per esperimenti ChIP-seq. Dopo la fase di sequenziamento, le letture sono state allineate a un indice composto da genomi murini e umani per ridurre la quantità di frammenti non allineati. Successivamente, le letture sono state separate in base alle specie e ulteriormente analizzate con EaSeq22 . L'intensità del segnale è stata quindi misurata nel sito di inizio della trascrizione (TSS) di ogni gene e il risultato è stato ordinato per l'intensità del segnale H3K4me3. La Figura 3a e la Figura 3c mostrano sia una marcata presenza di H3K4me3 che di H3K27ac presso il TSS per una porzione considerevole dei geni sia all'interno della cromatina di topo che umana. Inoltre, H3K27me3 è anticorrelato con H3K4me3/H3K27ac. H3K27me3 è presente su tutta la lunghezza del gene e non solo sul TSS, come previsto da questo PTM. La Figura 3b e la Figura3d mostrano il cluster HOXC/HoxC noto per essere arricchito per H3K27me3 e trascrizionalmente inattivo sia nel fegato di topo che in quello umano. La profilazione di H3K4me3 e H3K27ac mostra picchi per questi due PTM mentre l'intensità del segnale di H3K27me3 tende ad essere più bassa e più distribuita.
A causa della complessità della preparazione della cromatina, può verificarsi una sovrafissazione, il tempo di lisi o sonicazione può essere sub-ottimale, i grumi di grandi cellule possono persistere o una manipolazione inadeguata del campione potrebbe essere inadeguata. Questi sono tutti eventi che influenzano la qualità della preparazione. In alcuni casi, l'arricchimento dei frammenti di cromatina all'interno della dimensione corretta sarà ancora presente o sarà spostato a una dimensione superiore. In altri casi, potrebbe esserci una perdita di materiale a causa di lisi prematura o tosatura infruttuosa. La figura 4 mostra alcuni esempi di tali risultati negativi e subottimali. Le corsie 3 e 4 mostrano un arricchimento della dimensione del frammento tra 200 bp e 800 bp. Tuttavia, è chiaro che la dimensione del frammento va da 100 bp a >10.000 bp. Nelle corsie 5 e 6 è presente un arricchimento nella gamma 100-250 bp con una chiara perdita di materiale durante la preparazione. Questo potrebbe spiegare perché la sonicazione ha prodotto frammenti più piccoli. La corsia 7 mostra una preparazione leggermente non ottimale con l'aumento della gamma di frammenti, mentre la corsia 8 mostra una perdita quasi completa di materiale. Ciò può essere causato da lisi nucleare prematura o da insufficiente dissociazione tissutale con conseguente perdita dopo la fase 5.5.
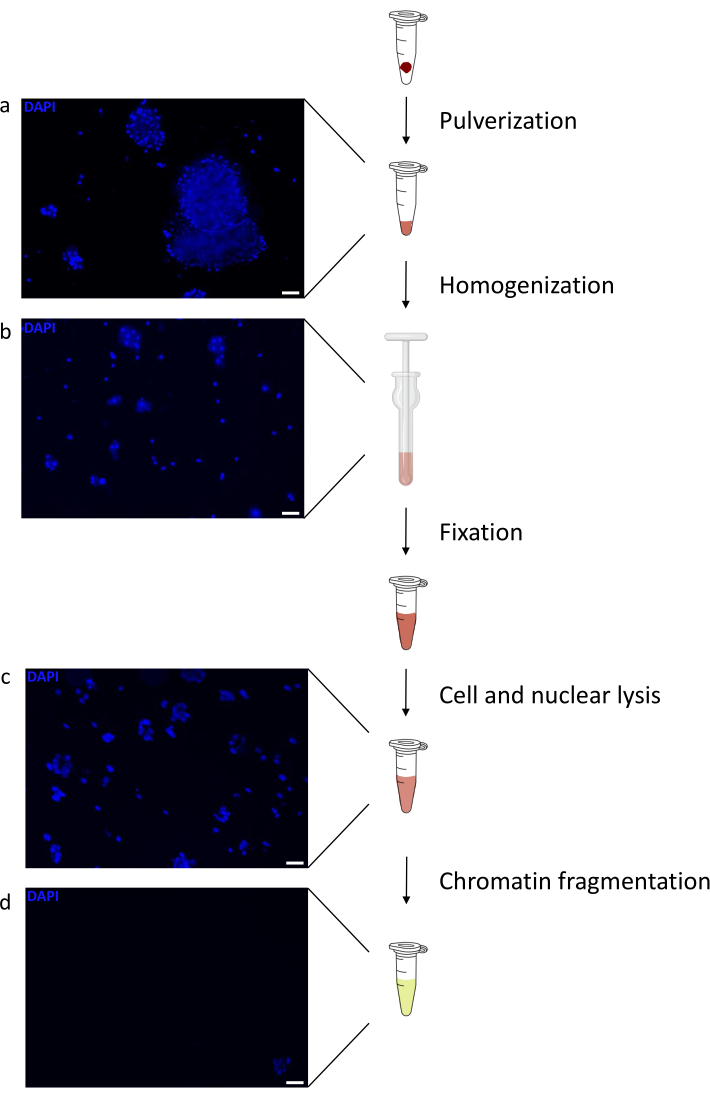
Figura 1: Panoramica del protocollo di preparazione della cromatina. Le immagini sono state scattate dopo la polverizzazione tissutale (a), l'omogeneizzazione manuale aggiuntiva (b), dopo la lisi nucleare (c) e dopo la sonicazione (prima della centrifugazione) (d). La colorazione nucleare è stata eseguita con Hoechst 33258/DAPI. Barra di scala = 200 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
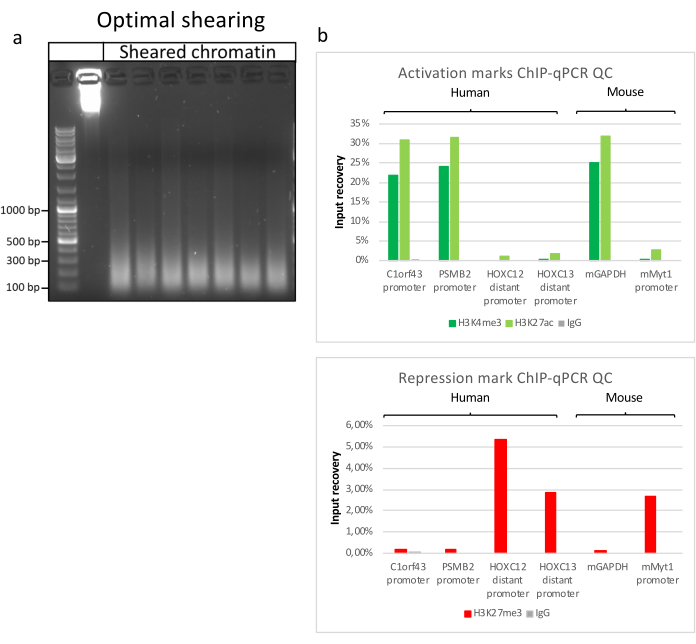
Figura 2: Taglio rappresentativo della cromatina e sua qualità valutata mediante ChIP-qPCR . Gel di agarosio all'1% con campioni di cromatina frammentati secondo protocolli provenienti da diversi preparati di cromatina. Viene aggiunto un controllo della cromatina non tagliata per garantire che non vi sia degradazione preventiva della cromatina/DNA (a). La cromatina tagliata è stata testata per la qualità eseguendo un test ChIP-qPCR. Gli anticorpi H3K4me3, H3K27ac e H3K27me3 sono stati utilizzati per precipitare la cromatina appena preparata. (b ) l'analisi della qPCR è stata eseguita su promotori umani (C1orf43 e PSMB2), promotori attivi murini (Gapdh) e promotori inattivi umani (HOXC13, HOXC12), murini (Myt1). Fare clic qui per visualizzare una versione ingrandita di questa figura.
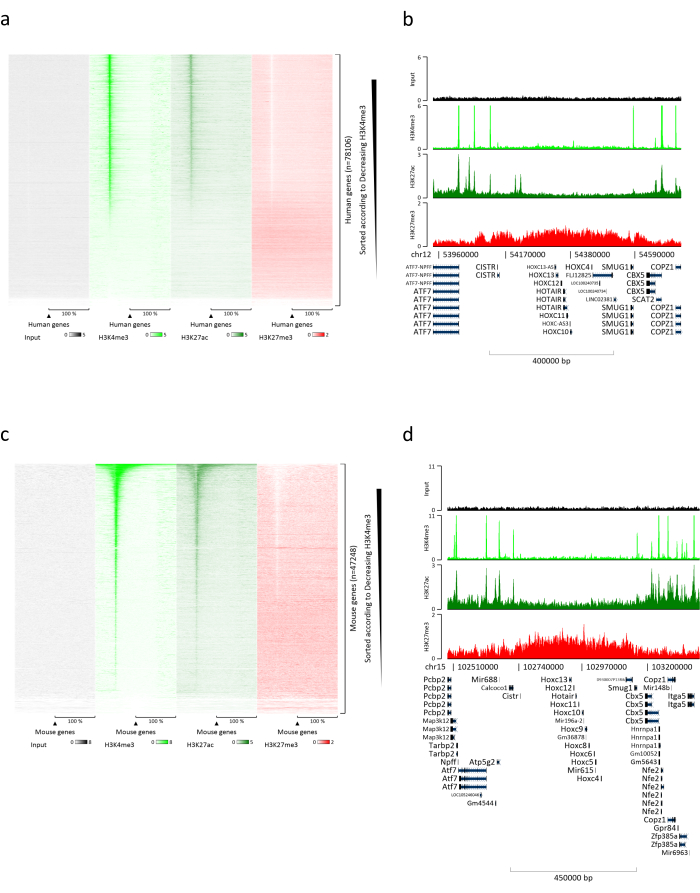
Figura 3: Analisi ChIP-seq rappresentativa. Le letture sono state allineate a un indice creato con genomi sia umani che murini (hg19 e mm10). Dopo l'allineamento, le letture umane e murine sono state separate e ulteriormente analizzate. Mappa termica dei geni umani in cui il segnale è stato quantificato al TSS e mostrato in ordine decrescente per l'intensità di H3K4me3 (a). Esempio di cluster genico umano di geni soppressi (cluster HOX) circondati da geni attivi (b). Mappa di calore dei geni murini in cui il segnale è stato quantificato al TSS e mostrato in ordine decrescente per l'intensità di H3K4me3 (c). Esempio di un cluster genico murino di geni soppressi (cluster Hox) circondato da geni attivi (d). Tutti i dati mostrati sono stati normalizzati da EaSeq per milione di letture. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Preparazioni di cromatina subottimali e fallite. Gel di agarosio all'1% con campioni di cromatina frammentati secondo il protocollo. La figura contiene cromatina non tagliata utilizzata come controllo (corsia 2), taglio non ottimale (corsia 3-4), taglio ottimale con perdita di materiale chiara (corsia 5-6), taglio subottimale (corsia 7) e perdita di materiale estesa (corsia 8). Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Nome del primer | Sequenza | |
| Promotore C1orf43 | Inoltrare | AGTGGGTGGAGAATGCAGAC |
| Inverso | GAGATTACCCCACCCCATTC | |
| Promotore PSMB2 | Inoltrare | CTTATTCAACCCCCGACAAA |
| Inverso | GATGAAGGACGGTGAGAGGA | |
| Promotore distale HOXC13 | Inoltrare | GAGCCCGAGATTCACTCAAC |
| Inverso | TTATGCCCAGTTTTGGGGTA | |
| Promotore distale HOXC12 | Inoltrare | AAAGCTTCCCACTGCAAAGA |
| Inverso | AAATCTGGGGGCGAACTACT | |
| Promotore mGAPDH | Inoltrare | GGTCCAAAGAGAGGGAGGAG |
| Inverso | GCCCTGCTTATCCAGTCCTA | |
| Promotore mMYT | Inoltrare | CAGCCCAATTCTAGCCACAT |
| Inverso | CCAAAGCAGGGGAGTAGGAG |
Tabella 1: elenco dei primer qPCR per i geni attivi e inattivi utilizzati per i saggi ChIP-qPCR.
Discussione
La preparazione della cromatina da tessuto congelato a scatto rimane una sfida a causa del numero di passaggi che devono essere ottimizzati per ottenere risultati riproducibili e affidabili. La maggior parte dei protocolli16,23 già pubblicati richiedono il tritamento dei tessuti prima della dissociazione manuale (raddoppiamento). Abbiamo cercato di evitare il più possibile passaggi che potrebbero provocare la degradazione delle proteine prima della fissazione del campione. La fase di polverizzazione è già utilizzata nelle preparazioni di fegato congelato24 e rende la dissociazione manuale più facile e riproducibile (vedi Figura 2a). Con l'uso di una malta specificamente progettata per provette da 1,5 ml (vedi Protocolli), la perdita del campione durante il processo di polverizzazione è ridotta, consentendo di elaborare piccole quantità di tessuto come campioni di biopsia epatica. In linea di principio è possibile utilizzare l'omogeneizzazione diretta dei tessuti senza alcuna fase di macinazione; Tuttavia, l'omogeneizzazione dei tessuti senza precedente polverizzazione ha una riproducibilità peggiore nella nostra esperienza e la comparsa di problemi per le applicazioni a valle era più elevata (dati non mostrati).
La maggior parte dei problemi incontrati nella preparazione della cromatina dai tessuti deriva dalla natura di questi campioni e dall'incapacità di verificare correttamente se i cluster cellulari sono abbastanza piccoli per la fissazione senza perdere qualità. Inoltre, controllare ogni aliquota in ogni fase richiederebbe molto tempo, aumentando la possibilità di degradazione delle proteine.
La fissazione (fase 3.9) è una parte fondamentale e cruciale della preparazione della cromatina. A causa della natura del tessuto, la fase di fissazione è stata ritardata fino a quando il tessuto non è stato omogeneizzato. Tale fase di fissazione posticipata ha il vantaggio di produrre una sospensione cellulare più omogenea. Tuttavia, riconosciamo che in caso di bersagli particolarmente sensibili alla manipolazione, potrebbe essere necessario eseguire la fissazione appena prima del punto 3.6. Ciò aiuterebbe a proteggere le proteine estremamente sensibili o PTM, sebbene possa aumentare le dimensioni dei cluster cellulari, che una volta fissati possono causare un taglio non omogeneo. La concentrazione della soluzione FA utilizzata nel protocollo è standard, tuttavia, può essere modificata per cercare di migliorare la fissazione complessiva. Il tempo di fissazione scelto qui riflette anche le condizioni standard comunemente utilizzate sul campo. In caso di maggiore concentrazione della soluzione fissante, il tempo di fissazione può essere ridotto, mentre in caso di quantità inferiore dovrebbe essere aumentato. L'operatore deve considerare che una modifica del tempo di fissazione può portare a una sovrafissazione del campione o dare spazio alla degradazione delle proteine. Nel caso in cui si miri a precipitare grandi complessi (o parte di essi) e TF, sarebbe vantaggioso eseguire una fissazione a doppio stadio utilizzando una soluzione DSG seguita da una FA25,26. DSG in questo caso stabilizzerebbe le interazioni proteina-proteina, mentre la formaldeide agisce principalmente sulle interazioni dirette DNA-proteina27.
L'operatore dovrebbe prendere in considerazione la possibilità di implementare un kit basato su colonne per la purificazione del DNA a partire dal punto 6.7 che è più veloce e non utilizza composti tossici. Tuttavia, ci sarà sempre una certa quantità di DNA non legato che andrà perso. Per questo motivo, suggeriamo di utilizzare la classica estrazione fenolo-cloroformio seguita dalla precipitazione di EtOH. Inoltre, prima di eseguire il gel di agarosio (passo 7.2) potrebbe essere utile misurare la concentrazione di DNA e caricare la stessa quantità per ogni pozzetto per avere un quadro più chiaro.
Una limitazione di questo protocollo deriva dal fatto che abbiamo esplorato e utilizzato questo protocollo utilizzando solo campioni di fegato derivati da topi chimerici epatici umani-epatici28. Di per sé il fegato è costituito da tessuto epiteliale e connettivo29. In caso di malattia, il tessuto fibrotico e il tessuto adiposo possono essere presenti30,31 creando ulteriori sfide durante la rottura del tessuto. Tuttavia, riconosciamo che il nostro protocollo non può essere utilizzato su ossa, muscoli e tessuto adiposo senza ottimizzare le fasi di dissociazione e sonicazione. Da notare è che ogni tessuto richiede un qualche tipo di ottimizzazione a causa dell'assenza di un protocollo adatto a tutti come per i campioni di coltura cellulare15. Crediamo, tuttavia, che con poca o nessuna ottimizzazione, questo protocollo potrebbe essere applicato con successo ad altri tessuti che condividono somiglianze con il fegato nella composizione, come polmone, intestino, stomaco, pancreas o tessuti renali.
Il nostro protocollo è stato utilizzato con successo anche per analizzare TFs e modificazioni istoniche sull'episoma del DNA covalentemente chiuso (cccDNA)32. Ciò apre la possibilità di applicare tale approccio per altri genomi virali che colpiscono il fegato come il citomegalovirus umano33 (hCMV) e gli adenovirus umani34 (HAdV). Non è escluso che sarebbe possibile analizzare altri virus a DNA che stabiliscono un'infezione persistente in altri tessuti come Kaposi Sarcoma Herpes Virus35 (KHSV), Herpes Simplex Virus 36 (HSV1/2) Polyoma virus, Epstein-Barr Virus37 (EBV).
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Lo studio è stato sostenuto dalla German Research Foundation (DFG) da una sovvenzione a Maura Dandri (SFB 841 A5) e dallo Stato di Amburgo con il Research Program (LFF-FV44: EPILOG).
Ringraziamo il Dr. Tassilo Volz, Yvonne Ladiges e Annika Volmari per l'aiuto tecnico e per la lettura critica del manoscritto. Il Dr. Thomas Günther e il Prof. Adam Grundhoff per aver fornito suggerimenti molto utili e i set di primer per l'analisi ChIP-qPCR.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22µm sterile syringe filter | Labsolute | 7699822 | |
| 1.5 mL Safeseal tubes | Sarstedt | 7,27,06,400 | |
| 6x orange loading dye | Thermofisher | R0631 | |
| Benchtop refrigerated centrifuge | |||
| Bioruptor NGS | Diagenode | ||
| Blade or Scalpel | |||
| Calcium chloride dihydrate | Carl Roth | HN04 | |
| Chloroform | Sigma Aldrich (Merck) | C2432 | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | |
| Deacetylase Inhibitor | Active Motif | 37494 | |
| Dounce tissue grinder set | Sigma Aldrich (Merck) | DWK885300-0001-1EA | |
| EDTA 500 mM solution | PanReac AppliChem | A4892 | |
| EGTA | Sigma Aldrich (Merck) | E4378 | |
| EtBr | Carl Roth | 2218 | Concentration 10mg/mL |
| Ethanol absolute | CHEMSOLUTE | 2273 | |
| Glycerol | Sigma Aldrich (Merck) | G9012 | |
| Glycin | Carl Roth | 0079 | |
| Glycogen | Roche | 10901393001 | Concentration: 20mg/mL |
| Heating block | |||
| HEPES | Sigma Aldrich (Merck) | H4034 | |
| LE Agarose | Biozym | 840000 | |
| Liquid nitrogen cooled mini mortar | Bel-Art | H37260-0100 | |
| MeOH free Formaldehyde 16% | Thermofisher | 28908 | |
| NP-40 | Roche | 11332473001 | |
| PBS 1x | Thermofisher | 10010015 | |
| Pefabloc SC-Protease-Inhibitor | Sigma Aldrich (Merck) | 11429868001 | |
| Phase Lock Gel - Heavy | QuantaBio | 2302830 | |
| Phenol:Chloroform:Isoamyl alcohol 25:24:1 | Sigma Aldrich (Merck) | P3803 | |
| Potassium chloride | Carl Roth | 6781 | |
| Potassium hydroxyde | Merck | 105033 | |
| Proteinase K | Lucigen | MPRK092 | Concentration: 50 µg/µL |
| RNAse A | Lucigen | MRNA092 | Concentration: 5 mg/mL |
| SDS 10% solution | PanReac AppliChem | A3950 | |
| Sodium carbonate anhydrous | Carl Roth | A135 | |
| Sodium chloride | Sigma Aldrich (Merck) | S7653 | |
| Sterile Petri dishes | Sarstedt | 83,39,02,500 | |
| Tris-HCl solution | Sigma Aldrich (Merck) | T2694 | |
| Triton-X100 | Sigma Aldrich (Merck) | X100 |
Riferimenti
- Waddington, C. H., Pantelouris, E. M. Transplantation of nuclei in newt's eggs. Nature. 172 (4388), 1050-1051 (1953).
- Silmon de Monerri, N. C., Kim, K. Pathogens hijack the epigenome: A new twist on host-pathogen interactions. American Journal of Pathology. 184 (4), 897-911 (2014).
- Knipe, D. M., et al. Snapshots: chromatin control of viral infection. Virology. 435 (1), 141-156 (2013).
- Tropberger, P., et al. Mapping of histone modifications in episomal HBV cccDNA uncovers an unusual chromatin organization amenable to epigenetic manipulation. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 5715-5724 (2015).
- Sproul, D., Gilbert, N., Bickmore, W. A. The role of chromatin structure in regulating the expression of clustered genes. Nature Reviews Genetics. 6 (10), 775-781 (2005).
- Fischle, W., Wang, Y., Allis, C. D. Histone and chromatin cross-talk. Current Opinion in Cell Biology. 15 (2), 172-183 (2003).
- Ling, X., Harkness, T. A., Schultz, M. C., Fisher-Adams, G., Grunstein, M. Yeast histone H3 and H4 amino termini are important for nucleosome assembly in vivo and in vitro: redundant and position-independent functions in assembly but not in gene regulation. Genes & Development. 10 (6), 686-699 (1996).
- Zhang, L., Eugeni, E. E., Parthun, M. R., Freitas, M. A. Identification of novel histone post-translational modifications by peptide mass fingerprinting. Chromosoma. 112 (2), 77-86 (2003).
- Wang, H., et al. Role of histone H2A ubiquitination in Polycomb silencing. Nature. 431 (7010), 873-878 (2004).
- Hassa, P. O., Haenni, S. S., Elser, M., Hottiger, M. O. Nuclear ADP-ribosylation reactions in mammalian cells: where are we today and where are we going. Microbiology and Molecular Biology Reviews. 70 (3), 789-829 (2006).
- Dey, B., et al. DNA-protein interactions: methods for detection and analysis. Molecular and Cellular Biochemistry. 365 (1-2), 279-299 (2012).
- Hager, G. L., McNally, J. G., Misteli, T. Transcription dynamics. Molecular Cell. 35 (6), 741-753 (2009).
- Nagy, Z., Tora, L. Distinct GCN5/PCAF-containing complexes function as co-activators and are involved in transcription factor and global histone acetylation. Oncogene. 26 (37), 5341-5357 (2007).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping protein-DNA interactions in vivo with formaldehyde: evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Gunther, T., Theiss, J. M., Fischer, N., Grundhoff, A. Investigation of viral and host chromatin by ChIP-PCR or ChIP-Seq analysis. Current Protocols in Microbiology. 40, 11-21 (2016).
- Cotney, J. L., Noonan, J. P. Chromatin immunoprecipitation with fixed animal tissues and preparation for high-throughput sequencing. Cold Spring Harbor Protocols. 2015 (4), 419(2015).
- Haim, Y., Tarnovscki, T., Bashari, D., Rudich, A. A chromatin immunoprecipitation (ChIP) protocol for use in whole human adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 305 (9), 1172-1177 (2013).
- Castellano-Castillo, D., et al. Chromatin immunoprecipitation improvements for the processing of small frozen pieces of adipose tissue. PLoS One. 13 (2), 0192314(2018).
- Savic, D., Gertz, J., Jain, P., Cooper, G. M., Myers, R. M. Mapping genome-wide transcription factor binding sites in frozen tissues. Epigenetics Chromatin. 6 (1), 30(2013).
- Perna, A., Alberi, L. A. TF-ChIP method for tissue-specific gene targets. Frontiers Cell Neuroscience. 13, 95(2019).
- Allweiss, L., et al. Proliferation of primary human hepatocytes and prevention of hepatitis B virus reinfection efficiently deplete nuclear cccDNA in vivo. Gut. 67 (3), 542-552 (2018).
- Lerdrup, M., Johansen, J. V., Agrawal-Singh, S., Hansen, K. An interactive environment for agile analysis and visualization of ChIP-sequencing data. Nature Structural & Molecular Biology. 23 (4), 349-357 (2016).
- Perna, A., Alberi, L. A. TF-ChIP Method for Tissue-Specific Gene Targets. Frontiers in Cellular Neuroscience. 13, 95(2019).
- Liang, N., Fan, R., Goni, S., Treuter, E. Preparation of Frozen Liver Tissues for Integrated Omics Analysis. Methods in Molecular Biology. 1951, 167-178 (2019).
- Liu, Z., et al. Proteomic and network analysis of human serum albuminome by integrated use of quick crosslinking and two-step precipitation. Scientific Reports. 7 (1), 9856(2017).
- Singh, A. A., et al. Optimized ChIP-seq method facilitates transcription factor profiling in human tumors. Life Science Alliance. 2 (1), 201800115(2019).
- Aoki, T., et al. Bi-functional cross-linking reagents efficiently capture protein-DNA complexes in Drosophila embryos. Fly. 8 (1), 43-51 (2014).
- Allweiss, L., Dandri, M. Experimental in vitro and in vivo models for the study of human hepatitis B virus infection. Journal of Hepatology. 64, 1 Suppl 17-31 (2016).
- Krishna, M. Microscopic anatomy of the liver. Clinics in Liver Disease. 2, Suppl 1 4-7 (2013).
- Tannapfel, A., et al. Histopathological diagnosis of non-alcoholic and alcoholic fatty liver disease. Virchows Archiv. 458 (5), 511-523 (2011).
- Schuppan, D., Afdhal, N. H. Liver cirrhosis. Lancet. 371 (9615), 838-851 (2008).
- Allweiss, L., et al. Therapeutic shutdown of HBV transcripts promotes reappearance of the SMC5/6 complex and silencing of the viral genome in vivo. Gut. , 322571(2021).
- Gerna, G., Kabanova, A., Lilleri, D. Human cytomegalovirus cell tropism and host cell receptors. Vaccines. 7 (3), (2019).
- Echavarria, M. Adenoviruses in immunocompromised hosts. Clinical Microbiology Reviews. 21 (4), 704-715 (2008).
- Frohlich, J., Grundhoff, A. Epigenetic control in Kaposi sarcoma-associated herpesvirus infection and associated disease. Seminars in Immunopathology. 42 (2), 143-157 (2020).
- Nicoll, M. P., Proenca, J. T., Efstathiou, S. The molecular basis of herpes simplex virus latency. FEMS Microbiology Reviews. 36 (3), 684-705 (2012).
- Thorley-Lawson, D. A., Hawkins, J. B., Tracy, S. I., Shapiro, M. The pathogenesis of Epstein-Barr virus persistent infection. Current Opinion in Virology. 3 (3), 227-232 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon