È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Assemblaggio a temperatura controllata e caratterizzazione di un bistrato di interfaccia a goccia
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio l'uso di un sistema di riscaldamento a temperatura controllata a retroazione per promuovere l'assemblaggio monostrato lipidico e la formazione di bistrati di interfaccia a goccia per lipidi con temperature di fusione elevate e misurazioni della capacità per caratterizzare i cambiamenti guidati dalla temperatura nella membrana.
Abstract
Il metodo di battiscopi di interfaccia a goccia (DIB) per assemblare bistrati lipidici (cioè DIB) tra goccioline acquose rivestite di lipidi nell'olio offre vantaggi chiave rispetto ad altri metodi: i DIB sono stabili e spesso di lunga durata, l'area bistrato può essere sintonizzata in modo reversibile, l'asimmetria del foglio illustrativo è prontamente controllata tramite composizioni di goccioline e reti tissutali di bistrati possono essere ottenute confinando con molte goccioline. La formazione di DIB richiede l'assemblaggio spontaneo di lipidi in monostrati lipidici ad alta densità sulle superfici delle goccioline. Mentre questo si verifica prontamente a temperatura ambiente per i comuni lipidi sintetici, un monostrato o un bistrato stabile sufficiente non riesce a formarsi in condizioni simili per i lipidi con punti di fusione sopra la temperatura ambiente, inclusi alcuni estratti lipidici cellulari. Questo comportamento ha probabilmente limitato le composizioni - e forse la rilevanza biologica - dei DIB negli studi di membrana modello. Per affrontare questo problema, viene presentato un protocollo sperimentale per riscaldare attentamente il serbatoio dell'olio che ospita goccioline DIB e caratterizzare gli effetti della temperatura sulla membrana lipidica. In particolare, questo protocollo mostra come utilizzare un apparecchio in alluminio termoduttivo e elementi riscaldanti resistivi controllati da un circuito di feedback per prescrivere temperature elevate, che migliora l'assemblaggio monostrato e la formazione di due livelli per un set più ampio di tipi di lipidi. Le caratteristiche strutturali della membrana, così come le transizioni di fase termotropiche dei lipidi che compongono il bistrato, sono quantificate misurando i cambiamenti nella capacità elettrica del DIB. Insieme, questa procedura può aiutare a valutare i fenomeni biofisici nelle membrane modello a varie temperature, compresa la determinazione di una temperatura di fusione efficace(TM)per miscele lipidiche multicomponente. Questa capacità consentirà quindi una più stretta replicazione delle transizioni di fase naturali nelle membrane modello e incoraggerà la formazione e l'uso di membrane modello da una fascia più ampia di costituenti della membrana, compresi quelli che catturano meglio l'eterogeneità delle loro controparti cellulari.
Introduzione
Le membrane cellulari sono barriere selettivamente permeabili composte da migliaia di tipi lipidici1,proteine, carboidrati e steroli che incapsulano e suddividono tutte le cellule viventi. Comprendere come le loro composizioni influenzano le loro funzioni e rivelare come le molecole naturali e sintetiche interagiscono, aderiscono, interrompono e traslocano le membrane cellulari sono, quindi, importanti aree di ricerca con implicazioni di vasta portata in biologia, medicina, chimica, fisica e ingegneria dei materiali.
Questi obiettivi di scoperta beneficiano direttamente di tecniche comprovate per assemblare, manipolare e studiare membrane modello , inclusi bistrati lipidici assemblati da lipidi sintetici o presenti in natura, che imitano la composizione, la struttura e le proprietà di trasporto delle loro controparti cellulari. Negli ultimi anni, il bistrato di interfaccia a goccia (DIB)metodo 2,3,4 per la costruzione di un bistrato lipidico planare tra goccioline d'acqua rivestite di lipidi nell'olio ha ricevutoun'attenzione significativa 5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,e ha dimostrato vantaggi pratici rispetto ad altri approcci per la formazione della membrana modello: il metodo DIB è semplice da eseguire, non richiede una fabbricazione o una preparazione sofisticata (ad es. "pittura") di un substrato per sostenere la membrana, produce costantemente membrane con longevità, consente misurazioni elettrofisiologia standard e semplifica la formazione di membrane modello con composizioni asimmetriche di volantini3. Poiché il bistrato si forma spontaneamente tra goccioline e ogni goccia può essere su misura in posizione e trucco, la tecnica DIB ha anche attirato notevole interesse nello sviluppo di sistemi di materiali ispirati alle cellule che si basano sull'uso di membrane stimolanti-reattive18,24,25,26,27,28,29,compartimentazione e trasportobilanciati 14,30,31e materiali tissutali17,23,32,33,34,35,36.
La maggior parte degli esperimenti pubblicati sulle membrane modello, comprese quelle con DIB, sono stati eseguiti a temperatura ambiente (RT, ~ 20-25 ° C) e con una manciata di lipidi sintetici (ad esempio, DOPC, DPhPC, ecc.). Questa pratica limita la portata delle domande biofisiche che possono essere studiate nelle membrane modello e, in base all'osservazione, può anche limitare i tipi di lipidi che possono essere utilizzati per assemblare DIB. Ad esempio, un lipide sintetico come il DPPC, che ha una temperatura di fusione di 42 °C, non assembla monostrati ben imballati o forma DIB a RT37. La formazione di DIB a temperatura ambiente si è dimostrata difficile anche per gli estratti naturali, come quelli provenienti da mammiferi (ad esempio, estratto lipidico totale cerebrale, BTLE)38 o batteri (ad esempio, estratto lipidico totale di Escherichia coli, ETLE)37, che contengono molti tipi diversi di lipidi e provengono da cellule che risiedono a temperature elevate (37 °C). Consentire lo studio di diverse composizioni offre quindi l'opportunità di comprendere i processi mediati dalla membrana in condizioni biologicamente rilevanti.
Aumentare la temperatura dell'olio può servire a due scopi: aumenta la cinetica dell'assemblaggio monostrato e può causare ai lipidi di subire una transizione di fusione per raggiungere una fase disordinata liquida. Entrambe le conseguenze aiutanonell'assemblaggio monostrato 39, un prerequisito per un DIB. Oltre al riscaldamento per la formazione di due strato, il raffreddamento della membrana dopo la formazione può essere utilizzato per identificare le transizioni termotropiche in singoli bistrati lipidici38, compresi quelli in miscele lipidiche naturali (ad esempio, BTLE) che possono essere difficili da rilevare usando la calorimetria. Oltre a valutare le transizioni termotropiche dei lipidi, variare con precisione la temperatura del DIB può essere utilizzato per studiare i cambiamenti indotti dalla temperatura nella struttura della membrana38 ed esaminare in che modo la composizione lipidica e la fluidità influenzano la cinetica delle specie attive della membrana (ad esempio, peptidi che formano pori e proteine transmembrana37), comprese le membrane modello di mammiferi e batteriche a una temperatura fisiologicamente rilevante (37 °C).
Nel presente documento verrà spiegata una descrizione di come assemblare un serbatoio di olio DIB modificato e utilizzare un regolatore di temperatura di feedback per consentire l'assemblaggio monostrato e la formazione di due livelli a temperature superiori a RT. Distinto da un precedente protocollo40, è inclusoun dettaglio esplicito per quanto riguarda l'integrazione della strumentazione necessaria per misurare e controllare la temperatura in parallelo all'assemblaggio e alla caratterizzazione del DIB nel serbatoio dell'olio. La procedura consentirà quindi all'utente di applicare questo metodo per la formazione e lo studio dei DIB in una serie di temperature in una varietà di contesti scientifici. Inoltre, i risultati rappresentativi forniscono esempi specifici per i tipi di cambiamenti misurabili sia nella struttura della membrana che nel trasporto ionica che possono verificarsi man mano che la temperatura è varia. Queste tecniche sono importanti aggiunte ai numerosi studi biofisici che possono essere progettati ed eseguiti efficacemente nei DIB, incluso lo studio della cinetica delle specie attive a membrana in diverse composizioni di membrana.
Protocollo
1. Preparazione dell'apparecchio riscaldato
- Raccogliere 2 pezzi di gomma isolante spessa 1 mm tagliati a 25 mm x 40 mm di larghezza e lunghezza, rispettivamente, 2 pezzi di gomma spessa 6 mm che sono anche 25 mm x 40 mm, un gruppo di fissaggio di base in alluminio preparato e un serbatoio di olio acrilico che si adatta alla finestra di visualizzazione dell'apparecchio di base in alluminio (vedi figure S1, S2 e S3 per i dettagli sulla fabbricazione e una vista esplosa del gruppo). Preparare prima l'apparecchio in alluminio attaccando alla parte inferiore dell'apparecchio una finestra panoramica in vetro con adesivo polimerizzabile UV e aderendo a 1 elemento riscaldante resistivo nella parte superiore di ogni flangia laterale da 25 mm x 25 mm dell'apparecchio.
- Posizionare i pezzi di gomma più sottili sullo stadio del microscopio in modo che il bordo lungo di ciascun pezzo sia tangenziale all'apertura dello stadio, come mostrato nella (Figura 1).
- Posizionare l'apparecchio di base in alluminio sopra i cuscinetti isolanti con la finestra di visualizzazione dell'apparecchio centrata sopra l'obiettivo. È necessario un corretto allineamento per l'imaging delle goccioline collegate.
- Posizionare un pezzo di gomma più spesso sopra ogni elemento riscaldante resistivo e utilizzare una clip da palco del microscopio per tenerlo in posizione. Questi pezzi proteggono gli elementi riscaldanti dai danni causati dalle clip del palco e isolano da cortocircuiti elettrici accidentali tra gli elementi riscaldanti e sia l'apparecchio in alluminio che lo stadio del microscopio.
- Piegare con cura l'estremità di misura di una termocopia per ottenere un angolo di 90 ° a ~ 4 mm dall'estremità.
- Inserire la punta piegata della termocopia nell'angolo in basso a sinistra dell'apparecchio in alluminio e fissarla delicatamente con la vite di bloccaggio.
- Posizionare il serbatoio acrilico nel pozzo dell'apparecchio in alluminio. Questo viene fatto prima di aggiungere olio di esadecano al pozzo (fase 1.8) dell'apparecchio in alluminio per ridurre al minimo il rischio di intrappolare bolle d'aria tra la finestra di visualizzazione e il fondo del serbatoio acrilico, che può ostacolare la vista delle goccioline.
NOTA: L'olio aggiunto al vano di visualizzazione dell'apparecchio in alluminio viene utilizzato per abbinare gli indici di rifrazione dell'acrilico e del vetro per un'immagine più chiara delle goccioline contenute all'interno del serbatoio acrilico. Pertanto, vale la pena notare che l'olio nel pozzo dell'apparecchio in alluminio non contatta il contenuto del serbatoio acrilico e non è necessaria una rigorosa pulizia dell'apparecchio in alluminio. - Distribuire ~ 1.000 μL di olio di esadecano nel pozzo dell'apparecchio in alluminio (cioè, tra le pareti del serbatoio acrilico e dell'apparecchio in alluminio), facendo attenzione a non riempire troppo. Il livello dell'olio nel pozzo dell'apparecchio in alluminio dovrebbe essere il più alto consentito per massimizzare l'area della superficie per il trasferimento di calore, senza consentire all'olio di riversarsi sui bordi dell'apparecchio sullo stadio del microscopio o sulla lente oggettiva.
- Distribuire ~1.000 μL di olio di esadecano nel serbatoio acrilico, pur rimanendo consapevoli di non riempire troppo.
NOTA: Il serbatoio acrilico deve sempre essere accuratamente pulito tra un esperimento e l'altro. L'utilizzatore deve impiegare un reggimento composto da risciacqui successivi con alcole etilico e acqua deionizzata seguita da essiccazione in una ciotola di essiccatore per oltre 12 ore.

Figura 1: Montaggio riscaldato dello stadio. Le immagini mostrano l'assemblaggio dell'apparecchio termicamente conduttivo e del serbatoio dell'olio per la formazione di DIB; i numeri sotto ogni immagine identificano il passaggio corrispondente del protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
2. Strumentazione per il controllo simultaneo della temperatura di feedback e caratterizzazione elettrica di un DIB
NOTA: Questo protocollo integra i seguenti strumenti per consentire il controllo della temperatura di feedback e la caratterizzazione elettrica simultanea di un DIB: un personal computer (PC) con due connessioni USB (Universal Serial Bus) disponibili, un amplificatore patch clamp abbinato a un sistema di acquisizione dati dedicato (DAQ-1), un generatore di forme d'onda, un secondo DAQ programmabile (DAQ-2) con moduli di ingresso di uscita e temperatura di tensione e un alimentatore / amplificatore. Le seguenti fasi descrivono le connessioni necessarie di questi strumenti (come illustrato nella figura 2a) necessarie per isolare la misurazione e il controllo della temperatura dall'elettrofisiologia simultanea di un DIB. Le sostituzioni di strumenti equivalenti possono essere effettuate secondo necessità.
- Stabilire connessioni di output e input ai moduli DAQ-2.
- Selezionare due coppie di terminali a vite sul modulo di uscita di tensione per connessioni di tensione differenziale e collegare i cavi del filo a queste posizioni. I terminali numerici dispari sono connessioni a terra comuni e i terminali numerici pari sono uscite non macinate, come mostrato nella (Figura 2c). Collegare ognuna di queste due coppie di fili di piombo a adattatori BNC a vite separati e quindi collegare ogni adattatore a un cavo BNC separato utilizzato per instradare i segnali di tensione ad altri strumenti.
NOTA: In questa configurazione, le connessioni differenziali ai terminali 0 e 1 sono assegnate per l'uscita di controllo della temperatura all'amplificatore di potenza, mentre un'altra coppia di connessioni ai terminali 6 e 7 sono designate per l'uscita di tensione da inviare alle goccioline tramite l'amplificatore patch clamp. - Facendo riferimento a (Figura 2c), selezionare un insieme di terminali di termocopia (ad esempio, i terminali 2 e 3 sono designati come coppia TC1) sul modulo di ingresso della termocopia e collegarvi i fili della termocopia.
- Selezionare due coppie di terminali a vite sul modulo di uscita di tensione per connessioni di tensione differenziale e collegare i cavi del filo a queste posizioni. I terminali numerici dispari sono connessioni a terra comuni e i terminali numerici pari sono uscite non macinate, come mostrato nella (Figura 2c). Collegare ognuna di queste due coppie di fili di piombo a adattatori BNC a vite separati e quindi collegare ogni adattatore a un cavo BNC separato utilizzato per instradare i segnali di tensione ad altri strumenti.
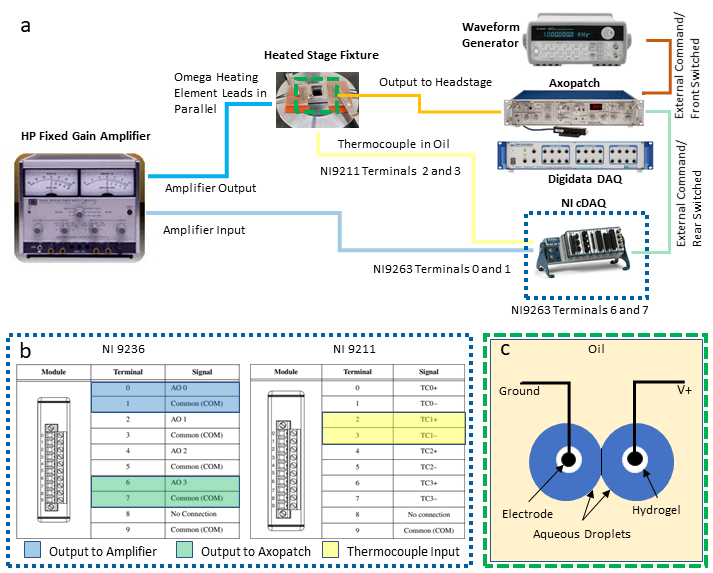
Figura 2: Collegamenti di cablaggio di sistema. Uno schema dei dispositivi e del cablaggio necessari per il sistema è illustrato in (a), mentre uno sguardo dettagliato alle connessioni DAQ-2 è fornito in (b). L'illustrazione in( c) mostra goccioline acquose su elettrodi rivestiti di idrogel immersi nell'olio per la formazione di DIB. I due elettrodi sono collegati alle connessioni a terra e non messa a terra (V+), rispettivamente, sull'unità headstage dell'amplificatore del morsetto patch. Clicca qui per visualizzare una versione più grande di questa figura.
- Dopo aver effettuato i collegamenti elettrici ai moduli DAQ-2, collegare lo chassis DAQ-2 a un PC tramite una connessione USB e connettersi a una fonte di alimentazione elettrica. Quindi confermare l'installazione di driver e software di successo prima dell'uso con un software commerciale.
- Configurare e collegare un amplificatore di potenza tra DAQ-2 ed elementi riscaldanti resistivi.
- Configura l'amplificatore per funzionare in modalità di amplificazione a guadagno fisso con un guadagno di 10X.
- Utilizzando un adattatore banana jack-BNC, collegare il cavo BNC proveniente dai terminali 0 e 1 sul modulo di uscita di tensione (Figura 2b) alle connessioni di ingresso sull'amplificatore di potenza.
- Utilizzando adattatori e cavi BNC aggiuntivi, collegare i terminali di uscita dell'amplificatore di potenza a entrambi i set di elementi riscaldanti, che sono cablati in parallelo tra loro e all'amplificatore per garantire che entrambi gli elementi mantengano la stessa caduta di tensione durante l'uso.
- Stabilire le connessioni necessarie per le apparecchiature di elettrofisiologia.
- Collegare un cavo BNC proveniente dai terminali 6 e 7 sul modulo di uscita di tensione (Figura 2b) ai connettori BNC Rear Switched External Command sul retro dell'amplificatore del morsetto patch.
- Collegare un secondo cavo BNC tra l'uscita del generatore di forme d'onda e il collegamento Front Switch External Command sul retro dell'amplificatore del morsetto patch.
NOTA: Queste due connessioni forniscono metodi alternativi per generare forme d'onda di tensione che vengono applicate agli elettrodi a goccia tramite l'amplificatore del morsetto patch. Il generatore di forme d'onda è particolarmente utile per generare tensioni triangolari della forma d'onda utilizzate per misurare la capacità della membrana. L'utente può decidere quali, se uno dei due, sono necessari per la propria applicazione. - Con un terzo cavo BNC, collegare l'uscita della corrente misurata situata sul pannello anteriore dell'amplificatore patch clamp a un connettore BNC di ingresso analogico disponibile sulla parte anteriore del DAQ-1.
- Con un quarto cavo BNC, collegare l'uscita della tensione di membrana misurata (sul retro dell'amplificatore del morsetto patch) a un connettore di ingresso analogico separato su DAQ-1. Ciò consente la digitalizzazione della tensione applicata attraverso gli elettrodi.
- Con i due elettrodi a goccia preparati e supportati su micromanipolatori come descritto nei passaggi 7-9 inrif.
NOTA: Il ruolo del headstage è quello di controllare la tensione tra gli elettrodi e misurare la corrente risultante, che viene convertita in una tensione proporzionale che viene esente dall'amplificatore del morsetto patch in DAQ-1. - Collegare DAQ-1 a un PC tramite una connessione USB e collegare i cavi di alimentazione corrispondenti sia all'amplificatore patch clamp che al DAQ-1.
- Accensione di tutte le apparecchiature di misura.
NOTA: Forse il dettaglio più importante in questa configurazione è garantire che le connessioni di uscita dell'amplificatore di potenza (mA-A) siano isolate elettricamente dall'unità headstage dell'amplificatore del morsetto patch, che utilizza un circuito sensibile per misurare le correnti di livello pA-nA in un DIB.
3. Controllo della temperatura di feedback dei bistrati dell'interfaccia a goccia
NOTA: I seguenti passaggi per il funzionamento del sistema di controllo della temperatura di feedback si basano su un'interfaccia utente grafica (GUI) personalizzata creata per implementare il controllo della temperatura di feedback proporzionale integrale (PI)40,41 (vedere File di codifica supplementari). Altri software e algoritmi di controllo possono invece essere utilizzati. Una copia di questo programma viene fornita al lettore con le informazioni supplementari per il documento, tuttavia l'utente è responsabile di configurarlo per le proprie attrezzature ed esigenze.
- Avviare il software DAQ-2 sul PC e aprire il file del programma di controllo della temperatura. Una volta aperta la GUI, aprire nuovamente il programma facendo clic sull'icona della cartella nell'angolo in basso a sinistra della GUI e selezionando il programma di controllo della temperatura (Figura 3).
- Immettere valori numerici appropriati per il guadagno di controllo proporzionale (KP) e il guadagno del controllo integrale (KI).
NOTA: I valori KP e KI rispettivamente di 0,598 e 0,00445 funzionano bene nella configurazione. Questi valori sono stati determinati iterativamente attraverso la simulazione utilizzando un modello di sistema che incorpora parametri ottenuti da risposte di riscaldamento a circuito aperto misurate (vedere figura 4). Durante il riscaldamento a circuito aperto,la potenza di riscaldamento prescritta è indipendente dalla temperatura misurata. Al contrario, il riscaldamento a circuito chiuso consiste nel regolare continuamente la potenza applicata ai riscaldatori in modo da aumentare la temperatura misurata alla temperatura desiderata. Questo è ottenuto qui usando uno schema di controllo PI. - Per testare lo schema di controllo della temperatura, immettere la temperatura del set point desiderata (sopra la temperatura ambiente) e quindi attivare il controllo della temperatura di feedback all'interno della GUI. Osservare il segnale di temperatura misurato sotto il controllo di feedback (a circuito chiuso), che viene visualizzato nella GUI per i minuti successivi. Se la temperatura misurata dell'olio supera notevolmente la temperatura desiderata, reagisce troppo lentamente ai cambiamenti o non riesce a convergere al set point desiderato, l'utente dovrà regolare i guadagni di controllo per ottenere le prestazioni desiderate a circuito chiuso.
NOTA: Il programma definisce un limite di saturazione per la potenza (e quindi la tensione) fornita agli elementi riscaldanti resistivi. Ad esempio, due elementi riportati nel presente documento consumano fino a 5 W di potenza ciascuno. Il loro cablaggio parallelo significa che il consumo energetico totale non deve superare i 10 W. Si consiglia all'utente di considerare la massima quantità di potenza che dovrebbe essere fornita ai dispositivi e sapere che questo limite può influire sulla velocità alla quale il sistema a circuito chiuso risponderà alle variazioni di temperatura desiderate. Elementi riscaldanti a potenza più elevata consentono un riscaldamento più rapido e temperature del set point più elevate, ma richiedono correnti fornite più elevate per il riscaldamento. - Con il sistema sintonizzato su prestazioni a circuito chiuso accettabili, inserisci la temperatura dell'olio desiderata per la formazione di DIB come set point nella GUI.
NOTA: Ad esempio, una temperatura del set point di 60 °C ha dato buoni risultati negli esperimenti con liposomi BTLE nelle goccioline acquose37. L'utente è indicato altrove2,40 per protocolli che spiegano l'assemblaggio DIB tra goccioline appese a elettrodi di tipo filo e configurazione di apparecchiature di elettrofisiologia utilizzando l'amplificatore patch clamp, DAQ-1 e il software di misurazione dell'elettrofisiologia. In particolare, il protocollo di Najem, etal. Oltre a questo passaggio, viene utilizzato un approccio leggermente diverso per la formazione di successo di monostrati e bistrati quando si utilizzano lipidi che richiedono il riscaldamento per promuovere la formazione di monostrato o bistrato. - Abbassare le punte degli elettrodi di cloruro d'argento/argento (Ag/AgCl) nell'olio fino a quando non toccano quasi il fondo del serbatoio acrilico. Questo posizionamento delle punte degli elettrodi è fondamentale per mantenere la goccia sull'elettrodo in olio riscaldato, dove sono state osservate correnti convettive nell'olio per staccare le goccioline dagli elettrodi rivestiti di idrogel(Figura 2c).
- Pipettare una goccia da 250 nL di soluzione lipidica acquosa contenente 2 mg/mL di BTLE, cloruro di potassio da 100 mM (KCl) e acido propanosolfonico (MOPS) da 10 mM 3-(N-morpholino) su ogni punta dell'elettrodo e lasciarli incubare nell'olio riscaldato per un minimo di 10 minuti per promuovere la formazione di monostrato.
- Coprire il headstage e l'apparecchio riscaldato con una gabbia faraday a terra.
- Portare le goccioline in contatto delicato lentamente
manipolare le posizioni orizzontali degli elettrodi fino a quando l'utente non vede le goccioline deformarsi dal contatto o iniziare a spostarsi a vicenda e attendere alcuni minuti fino all'inizio della formazione di due strato. Se dopo diversi minuti non si è formato un bistrato, le goccioline possono essere costrette insieme di più per facilitare la formazione di due strato. La formazione di un bistrato interfacciale assottigliato può essere confermata mediante ispezione visiva(Figura 5a)o misurando l'aumento dell'ampiezza di una corrente capacitiva forma d'onda quadra indotta da un generatore di forme d'onda che emette una tensione triangolare di 10 mV, 10 Hz22. Lasciare che il bistrato equilibra per un minimo di 10 minuti per raggiungere un'area interfacciale costante, alla formazione iniziale e prima della successiva caratterizzazione nel set point iniziale.
NOTA: Il tipo di olio può avere un impatto significativo sul diradamento bistrato, sullo spessore della membrana e sull'angolo di contatto tra goccioline. In generale, più piccola è la molecola di olio, più facilmente può rimanere nel nucleo idrofobico del bistrato occupato da catene lipidiche acili. La ritenzione dell'olio aumenta le tensioni e lo spessore sia monostrato che bistrato e diminuisce l'area e l'angolo di contatto tra goccioline. Queste metriche indicano uno stato di adesione più debole. Molecole più grandi e ingombranti esercitano l'effetto opposto. Ad esempio, lo squalene è una molecola più ingombrante degli alcani come l'esadecano, che consente di escluderlo facilmente tra i monostrati durante il diradamento del bistrato. Come tali, i DIB formati in squalene sono più sottili, mostrano aree di contatto e angoli più alti e mostrano energie liberepiù elevate di formazione 22,42 (una misura di adesione goccia-goccia).
4. Caratterizzazione dei comportamenti dipendenti dalla temperatura nei DIB
NOTA: Molti processi fisici possono essere studiati nelle membrane modello basate su DIB, incluso il modo in cui i cambiamenti di temperatura influenzano la struttura e le proprietà di trasporto della membrana. I seguenti passaggi devono essere eseguiti dopo una formazione di doppio strato riuscita alla temperatura desiderata.
- Misurare la capacità nominale della membrana abbassando la temperatura del bagno d'olio da un set point che consente la formazione di bistrati per identificare le transizioni di fase termotropiche dei lipidi nella membrana38.
- Fare clic con il pulsante destro del mouse sul grafico della temperatura nell'interfaccia utente grafica e cancellare i dati visualizzati. Ciò garantisce che sia disponibile spazio sufficiente nel buffer per le registrazioni successive.
- Utilizzando il generatore di forme d'onda collegato all'amplificatore del morsetto patch, applicare una forma d'onda di tensione triangolare (ad esempio, 10 mV, 10 Hz) attraverso gli elettrodi DIB e registrare la risposta di corrente indotta attraverso il bistrato.
- Raffreddare il bistrato riducendo la temperatura del set point in incrementi di 5 °C e aspettando un minimo di 5 minuti alla nuova temperatura stazionaria tra le variazioni di temperatura fino al raggiungere la temperatura desiderata. In alternativa, provare a raffreddare passivamente il bistrato spegnendo il sistema di controllo del feedback. Tenere presente, tuttavia, che gli esperimenti che implementano il raffreddamento passivo da 50 a 60 °C hanno portato a tassi più elevati di coalescenza.
- Dopo che il bagno d'olio e il bistrato si raffredo alla temperatura minima desiderata, fare di nuovo clic con il pulsante destro del mouse sul grafico della temperatura nella GUI ed esportare i dati sulla temperatura rispetto al tempo in un software per fogli di calcolo. Interrompere la registrazione corrente.
- Dalla corrente misurata, calcolare la capacità nominale della risposta di corrente d'onda quadrata rispetto al tempo durante il periodo di raffreddamento.
- Tracciare la capacità nominale (C) rispetto alla temperatura ( T )per osservarecome è cambiata la capacità della membrana. Individuare i cambiamenti nonmononici in C rispetto a T per identificare TM.
NOTA: La capacità nominale può essere calcolata dall'ampiezza della corrente di onde quadrate43 (| I|) utilizzando la relazione | Io| = C dv/dt, dove dv/dt è uguale a quattro volte il prodotto dell'ampiezza di tensione(| V|) frequenza (f) della tensione triangolare applicata. Da queste equazioni, C = | I|/(4| V|f).
- Analogamente, valutare la capacità specifica quasi statica (Cm) del bistrato a temperature fisse incrementando successivamente la temperatura del bagno d'olio e dell'area bistrato.
- Modificare la temperatura del set point in incrementi di 10 °C utilizzando la GUI e consentire al sistema di equilibrare alla nuova temperatura.
- Eseguire il passaggio 4.1.2 per avviare la misurazione della corrente capacitiva e della registrazione.
- Cambiare l'area del bistrato regolando attentamente le posizioni degli elettrodi utilizzando i micro manipolatori (cioè, separare gli elettrodi riduce l'area del bistrato). Consentire alla corrente ad onda quadra di raggiungere un'ampiezza dello stato stazionario e raccogliere immagini del DIB per consentire il calcolo dell'area della membrana rispetto al tempo utilizzando una fotocamera montata al microscopio per immagini il bistrato visto dall'apertura dello stadio del microscopio. Contemporaneamente, aggiungi un tag digitale nel software di registrazione corrente per contrassegnare il punto di tempo corrispondente per la raccolta di immagini.
NOTA: I micro manipolatori consentono il controllo preciso degli elettrodi e quindi un contatto delicato tra goccioline. La manipolazione grossolana delle goccioline può portare ad un esperimento fallito per coalescenza delle goccioline o causando la caduta di una goccia dall'elettrodo. Come discusso altrove22, l'area del doppio strato viene calcolata in base alla lunghezza di contatto tra goccioline, che appaiono come cerchi sovrapposti in un'immagine in basso. Le posizioni e le dimensioni delle goccioline, e la lunghezza della linea di contatto, possono essere calcolate utilizzando un software di elaborazione delle immagini o con altri strumenti di programmazione scientifica. - Ripetere il passaggio 4.2.1.2 almeno 4 volte per ottenere un totale di 5 immagini DIB e regioni in stato stazionario di corrente bistrato.
- Ripetere il passaggio 4.2.1 ad ogni temperatura desiderata.
- Nei punti di tempo taggati corrispondenti alle aree bistrato a stato stazionario per le immagini acquisite, analizzare le registrazioni correnti e le immagini DIB per estrarre i dati C e A per ogni temperatura.
- Tracciare i dati C rispetto a A per ogni temperatura e calcolare la pendenza di una regressione di primo ordine, che rappresenta il Cm del bistrato ad ogni temperatura22.
- Valori di plottaggio di Cm ottenuti dalla fase 4.2.4 rispetto a T.
- Esaminare i dati Cm rispetto a T per individuare variazioni non monotone per identificare le temperature di fusione, TM.
- Modificare la temperatura del set point in incrementi di 10 °C utilizzando la GUI e consentire al sistema di equilibrare alla nuova temperatura.
- Valutare la dinamica della formazione del canale ionio dipendente dalla tensione generando un ingresso del gradino di tensione cc attraverso il bistrato.
- Impostare Tensione iniziale sul valore del passo desiderato in mV (ad esempio, 100 mV).
- Impostare tensione finale e dimensione del passo su un valore superiore al passo desiderato (ad esempio, tensione finale di 110 mV e dimensioni del passo di 110 mV).
- Impostare un tempo di durata desiderato per l'input del passo in secondi (ad esempio, 90 s).
- Scegliere la polarità desiderata per l'ingresso del passo (ad esempio, positivo).
- Commutare l'amplificatore del morsetto patch per inviare al headstage la tensione di comando proveniente dal modulo di uscita GUI/tensione.
- Avviare le registrazioni correnti.
- Accendere la tensione e registrare la risposta di corrente indotta, che dovrebbe mostrare una risposta a forma di S a una tensione critica (ad esempio, ~ 70 mV per 1 μg / mL Mz in 2 mg / mL BTLE).
- Separatamente, le relazioni dinamica corrente-tensione per una membrana possono essere ottenute alle temperature desiderate per rivelare relazioni dipendenti dalla tensione, come i comportamenti del canale ionica.
- Commutare l'amplificatore del morsetto patch per inviare al headstage la tensione di comando proveniente dal generatore di forme d'onda e avviare le registrazioni di corrente.
- Sul generatore di forme d'onda, emettere una forma d'onda sinusoidale continua con ampiezza, offset e frequenza desiderati.
- Registrare la risposta di corrente indotta in uno o più cicli.
- Ripetere come desiderato per diverse ampiezze e frequenze e temperature dell'onda sine.
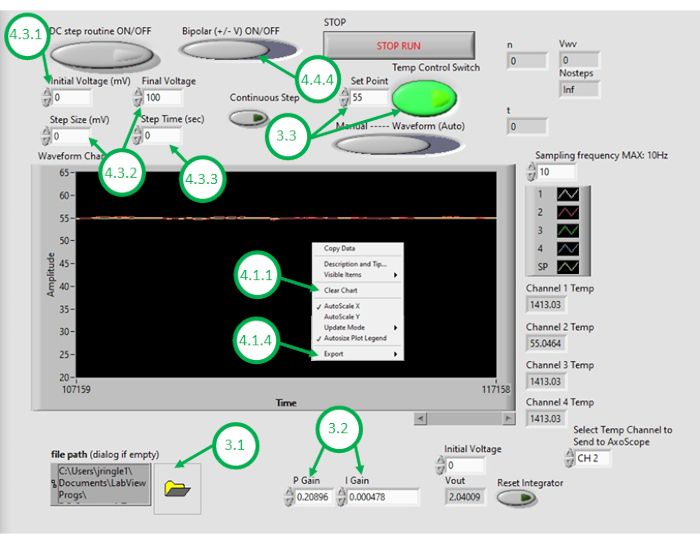
Figura 3: Interfaccia grafica per il controllo della temperatura. Questa figura evidenzia ed etichetta i passaggi critici necessari per utilizzare la GUI del programma per controllare la temperatura del bagno d'olio. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
La figura 1 mostra come l'apparecchio in alluminio e il serbatoio dell'olio acrilico sono preparati sullo stadio del microscopio per la formazione di DIB. I passaggi di assemblaggio 1.2-1.4 servono a isolare termicamente l'apparecchio dal palco per un riscaldamento più efficiente. I passaggi 1.5-1.7 mostrano come collegare correttamente la termocopia all'apparecchio e posizionare il serbatoio dell'olio, e i passaggi 1.8 -1.9 mostrano le posizioni consigliate per l'erogazione dell'olio in qu...
Discussione
Il protocollo qui descritto fornisce istruzioni per assemblare e far funzionare un sistema sperimentale per controllare la temperatura dell'olio e delle goccioline utilizzate per formare DIB. È particolarmente utile per consentire la formazione di DIB utilizzando lipidi che hanno temperature di fusione superiori a RT. Inoltre, variando con precisione la temperatura del serbatoio dell'olio, la temperatura del bistrato può essere manipolata per studiare gli effetti di temperature elevate su varie proprietà e caratterist...
Divulgazioni
Gli autori non hanno conflitti di interessi.
Riconoscimenti
Il sostegno finanziario è stato fornito dalla National Science Foundation Grant CBET-1752197 e dall'Air Force Office of Scientific Research Grant FA9550-19-1-0213.
Materiali
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
Riferimenti
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon