È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione funzionale della barriera a giunzione stretta intestinale e della permeabilità agli ioni nel tessuto nativo mediante la tecnica della camera di Ussing
In questo articolo
Riepilogo
L'epitelio intestinale conferisce non solo assorbimento dei nutrienti, ma protezione contro le sostanze nocive. La giunzione intercellulare apicale più epiteliale, cioè la giunzione stretta, regola la permeabilità paracellulare del soluto e degli ioni. Qui viene descritto un protocollo per la preparazione di fogli mucosi e la valutazione della selettività ionica di giunzioni strette utilizzando la tecnica della camera di Ussing.
Abstract
La tecnica della camera di Ussing fu inventata per la prima volta dallo scienziato danese Hans Ussing nel 1951 per studiare il trasporto transcellulare di sodio attraverso la pelle di rana. Da allora, questa tecnica è stata applicata a molti tessuti diversi per studiare i parametri fisiologici del trasporto attraverso le membrane. Il metodo della camera di Ussing è preferibile ad altri metodi perché è possibile utilizzare il tessuto nativo, rendendolo più applicabile a ciò che sta accadendo in vivo. Tuttavia, poiché viene utilizzato tessuto nativo, la produttività è bassa, il tempo è limitato e la preparazione dei tessuti richiede abilità e formazione. Queste camere sono state utilizzate per studiare specifiche proteine trasportatrici in vari tessuti, comprendere la fisiopatologia della malattia come nella fibrosi cistica, studiare il trasporto e l'assorbimento dei farmaci e soprattutto hanno contribuito alla comprensione del trasporto dei nutrienti nell'intestino. Dato l'intero processo di trasporto epiteliale di un tessuto, non solo le vie transepiteliali, ma anche le vie paracellulari sono importanti. Le giunzioni strette sono un fattore determinante della permeabilità paracellulare specifica del tessuto attraverso l'intestino. In questo articolo, la tecnica della camera di Ussing sarà utilizzata per valutare la permselectività paracellulare degli ioni misurando la conduttanza transepiteliale e i potenziali di diluizione.
Introduzione
Il metodo della camera di Ussing è stato sviluppato per la prima volta dallo scienziato danese Hans Ussing. Ussing lo ha usato per la prima volta per misurare la corrente di cortocircuito del trasporto di sodio attraverso la pelle di rana dopo che è stato osservato che naCl poteva essere trasportato attraverso la pelle contro un forte gradiente di concentrazione1. Il suo sistema consisteva nella pelle di rana montata tra due camere con accesso a entrambi i lati della pelle. Ogni camera conteneva la soluzione di Ringer che veniva fatta circolare e aerata. Due stretti ponti di suoneria di agar situati vicino alla pelle e collegati a elettrodi saturi di KCl-calomel hanno misurato la differenza di potenziale come letto da un potenziatore. Una seconda coppia di ponti di suoneria di agar era situata all'estremità opposta di ogni camera collegata a becher con KCl saturo saturo di AgCl per applicare una forza elettromotrice fornita da una batteria. Un divisore di potenziale è stato utilizzato per regolare la tensione in modo che la differenza di potenziale attraverso la pelle rimanesse zero, creando così condizioni di cortocircuito. È stato inoltre collegato un misuratore di microampere per leggere la corrente che passa attraverso la pelle (vedi la figura in ref.1 per il design originale della camera).
Negli ultimi 70 anni, questa tecnica è stata applicata a molti tessuti diversi, in particolare il tessuto intestinale, per studiare il trasporto di nutrienti e ioni. Ad esempio, il meccanismo della diarrea indotta dal colera è stato studiato montando l'ileo di coniglio in queste camere e si è scoperto che la diarrea indotta dalla tossina del colera è mediata da cAMP2. Inoltre, queste camere sono state utilizzate anche per studiare il meccanismo alla base del trasporto del glucosio tramite il cotrasportatore Na+-Glucosio 1 (SGLT1)3. Il nostro laboratorio si concentra sul trasporto transcellulare e paracellulare nelle cellule epiteliali intestinali. Utilizzando il metodo della camera di Ussing, il trasporto peptidico è stato valutato in Topi knockout claudin 15, che hanno alterato il trasporto paracellulare del sodio, utilizzando le camere di Ussing per misurare l'assorbimento della glicilsarcosina dipeptide non idrolizzabile. Si è scoperto che l'omeostasi luminale Na+ è importante per il trasporto peptidico accoppiato a protoni4. Inoltre, queste camere sono state utilizzate anche per studiare la secrezione di anioni nel cieco murino in risposta all'attivazione sottomucosa del recettore 1 attivato dalla proteinasi dalla serina proteasi tripsina5.
Le camere di Ussing sono state recentemente utilizzate anche per valutare le vie paracellulari nel tessuto epiteliale. Le vie paracellulari sono regolate da giunzioni strette, che sono complessi di proteine che si formano nel punto in cui due o più cellule si incontrano6. La funzione barriera e la selettività ionica (se anioni o cationi sono selettivamente in grado di passare attraverso la giunzione stretta) è determinata dalla presenza di proteine della famiglia della claudina; alcuni dei quali fungono da barriere (claudina 3 e 7), pori anionici (claudina 10a) o pori cationici (claudina 2, 10b e 15)7. Altri metodi sono stati utilizzati per valutare la via paracellulare, come il gavage orale di FITC accompagnato dalla concentrazione di FITC plasmatico8 o EDTA-Cr9; tuttavia, queste tecniche sono di risoluzione inferiore e non possono valutare la selettività ionica o una sezione specifica delle sezioni del tratto intestinale. Le camere di ussing, tuttavia, possono essere utilizzate per valutare il potenziale di diluizione degli ioni bersaglio e, quindi, determinare la selettività ionica delle giunzioni strette. Ad esempio, con NaCl, la selettività delle giunzioni strette per Na+ e Cl- può essere calcolata diluendo un lato della membrana (di solito il lato della mucosa) e misurando il cambiamento nella differenza di potenziale transepiteliale. Le permeabilità relative di Na+ e Cl- possono essere stimate dall'equazione di Goldman-Hodgkin-Katz10 e la selettività della giunzione stretta può essere stimata utilizzando l'equazione di Kimizuka-Koketsu11. Queste camere, quindi, hanno il vantaggio di misurare i parametri elettrofisiologici del tessuto e di conseguenza forniscono maggiori informazioni sul passaggio degli ioni attraverso le giunzioni strette rispetto ad altri metodi a bassa risoluzione.
Il metodo della camera di Ussing non è limitato solo al tratto intestinale, sebbene sia ampiamente utilizzato negli studi riguardanti l'intestino, ma ha anche molte altre applicazioni. Ad esempio, queste camere sono state utilizzate per studiare la fibrosi cistica, e in particolare il regolatore di conduttanza transmembrana della fibrosi cistica del canale del cloruro (CFTR)12. La fibrosi cistica è causata da una mutazione in CFTR13, che si traduce in una compromissione della secrezione di cloruro e del trasporto di liquidi da parte delle cellule epiteliali respiratorie e in un risultante strato mucoso più spesso e secco14. Lo studio del CFTR epiteliale delle vie aeree è stato eseguito con queste camere non solo per comprendere la malattia, ma anche per scoprire modi per trattare la malattia. Ad esempio, nei pazienti con mutazioni rare che causano la fibrosi cistica, l'analisi delle cellule epiteliali respiratorie del paziente è stata utilizzata per testare terapie come Orkambi e una co-terapia amplificatore15.
Le camere di ussing sono state utilizzate anche per studiare le vie di somministrazione del farmaco, ad esempio con il tessuto bioptico umano per studiare l'assorbimento del farmaco e la farmacocinetica16. L'assorbimento intestinale non è l'unica via di somministrazione del farmaco. Queste camere sono state utilizzate anche per studiare i sistemi di somministrazione nasale dei farmaci17. Studi di somministrazione di farmaci con camere di Ussing sono stati eseguiti anche per l'occhio. Nella cornea del coniglio, sono stati condotti studi di permeabilità e assorbimento con Labrasol, un farmaco progettato per aumentare l'assorbimento dei farmaci attraverso i tessuti18. Un altro studio ha esaminato l'effetto del benzilalconio cloruro sulla somministrazione transsclerale di farmaci nella sclera di coniglio19.
Il metodo della camera di Ussing è utile perché è possibile utilizzare il tessuto nativo. Come tale, è preferibile rispetto a modelli in vitro come le linee cellulari Caco-2. Tuttavia, la tecnica richiede abilità e tempo per preparare i campioni, quindi non è adatta per applicazioni ad alto rendimento. Le proprietà elettrofisiologiche dei monostrati cellulari possono essere studiate utilizzando inserti di coltura cellulare in queste camere. Recenti scoperte hanno permesso la coltura di organoidi che sono mini-organi coltivati in coltura dal prelievo di cellule staminali epiteliali o endoteliali20. La coltura organoide può essere manipolata per essere coltivata in un monostrato, rendendo così possibile il montaggio di organoidi in una camera di Ussing21. Gli organoidi di vari tessuti epiteliali ed endoteliali possono essere studiati, riducendo il numero di animali richiesti, poiché la coltura organoide può essere mantenuta a lungo termine. Ciò aumenterà anche la produttività poiché non saranno necessarie lunghe e laboriose fasi di dissezione e preparazione dei tessuti. In futuro, gli studi sulla camera di Ussing continueranno ad essere molto utili per studiare il trasporto dei tessuti e saranno particolarmente importanti nel campo della medicina personalizzata.
Il seguente protocollo dimostra l'applicazione del metodo della camera di Ussing per valutare la permselectivity e la funzione di barriera delle giunzioni strette nell'intestino tenue di topi Claudin 15 knockout (Cldn15-/-) e controlli wild type (WT) misurando il potenziale di diluizione di NaCl. Le giunzioni strette (TJ) si formano nel punto in cui due o più cellule si incontrano nel tessuto epiteliale ed endoteliale. Si ritiene che le giunzioni strette bicellulari (bTJ), in particolare le proteine della famiglia della claudina presenti all'interno del bTJ, determinino la funzione barriera e la permselettività di TJ7. I topi Cldn15-/- hanno un mega intestino tenue22 e una ridotta capacità di assorbimento dei nutrienti a causa della perdita di riciclaggio intestinale di Na+ che si verifica tramite claudina 154,23,24. I topi Cldn15-/- hanno compromesso l'omeostasi Na+, il che li rende un modello interessante per studiare la permselettività del TJ. Il seguente protocollo valuta la permeabilità del TJ al NaCl misurando il potenziale di diluizione del NaCl (PNa/PCl) nell'intestino tenue medio. In breve, il cambiamento nella differenza di potenziale di membrana che si verifica diluendo un lato della membrana (lato M o lato S, entrambi sono misurati nel protocollo sottostante) può essere utilizzato per calcolare la permeabilità di Na+ (PNa) e Cl- (PCl), e il potenziale di diluizione (PNa / PCl) mostrerà se la giunzione stretta ha una selettività cationica o anionica.
Gli esperimenti in questo protocollo sono stati condotti utilizzando una camera di Ussing personalizzata (Figura 1A), che consiste di due metà, tra le quali la preparazione intestinale è montata verticalmente, amplificatore a morsetto di tensione, registratore elettrico, elettrodi, ponti di sale, soluzione di Ringer, tampone HEPES (150 mM NaCl), tampone HEPES diluito (75 mM NaCl), preparazione intestinale (per i dettagli sulle apparecchiature vedere la Tabella dei materiali).
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti gli animali utilizzati in questi esperimenti sono stati mantenuti nella struttura di cura degli animali presso l'Università di Shizuoka e gli esperimenti sono stati condotti secondo le linee guida per la ricerca sugli animali stabilite dall'Università di Shizuoka. Tutti gli esperimenti sono stati condotti con l'approvazione del Comitato per la cura e l'uso degli animali presso l'Università di Shizuoka (permessi n. 205272 e n. 656-2303).
1. Preparazione degli elettrodi NaCl
NOTA: Gli elettrodi utilizzati in questi esperimenti sono costituiti da NaCl concentrato o KCl. Gli elettrodi KCl/calomelano sono acquistati in commercio. Prima di iniziare l'esperimento, assicurarsi che tutti gli elettrodi siano riempiti verso l'alto con una soluzione concentrata di NaCl o KCl.
- Preparare piccoli barattoli di vetro con coperchi di plastica (volume 20 ml).
- Praticare due fori nei coperchi di plastica, uno per il ponte di sale NaCl (diametro 2,5 mm) e l'altro per il filo d'argento (diametro 1 mm; Figura 1C, elettrodo NaCl).
- Riempire il barattolo di vetro con una soluzione di NaCl satura (circa 15 ml, fino a quando non è pieno).
- Inserire il filo d'argento (diametro 0,8 mm, 7 cm di lunghezza) nel barattolo, ma assicurarsi che la porzione di filo all'esterno del barattolo possa essere collegata tramite clip a coccodrillo (di piccole dimensioni) al sistema di amplificazione.
- Quando non in uso, avvolgere gli elettrodi e assicurarsi che i fori siano coperti, con parafilm per evitare l'essiccazione.
2. Preparazione di ponti di sale
NOTA: Preparare ponti di sale almeno un giorno prima dell'esperimento per fornire un tempo adeguato per solidificare. I ponti di sale possono essere usati ripetutamente, ma l'uso dopo 2 mesi non è raccomandato.
- Ponti di sale NaCl
- Preparare tubi in polietilene #7 (diametro esterno 2,3 mm, diametro interno 1,3 mm), ago da 19 G e siringa a serratura, 200 ml di soluzione naCl da 1 M, 2 g di agar, contenitore di plastica sigillabile per la conservazione del ponte di sale.
- Preparare un numero appropriato di ponti di sale tagliando i tubi alle dimensioni necessarie per l'installazione della camera di Ussing (ogni camera richiede due ponti di sale).
- Prima dell'iniezione di agar, fare una forma a U con i tubi e metterli in un becher di acqua tiepida (per creare una forma facile per l'installazione di ponti di sale).
- Produrre 200 mL di 1 M NaCl sciogliendo 11.688 g di NaCl in 200 mL in acqua deionizzata.
- Dividere 1 M NaCl in porzioni da 100 mL: Fare 100 mL di agar al 2% in 1 M NaCl (mescolare 2 g di agar in NaCl, riscaldare nel microonde per sciogliere).
- Utilizzando un ago da 19 G e una siringa di bloccaggio, riempire la siringa con una soluzione di NaCl/agar da 1 M. Iniziare delicatamente ad espellere la soluzione goccia a goccia e mentre lo si fa inserire l'ago in un'estremità del tubo e riempire fino a quando la miscela non esce dall'altro lato.
- Prelevare lentamente l'ago mentre si sta ancora esprimendo la soluzione e ripetere fino a quando non sono stati realizzati tutti i ponti di sale necessari. (Se la soluzione si solidifica nella siringa o nell'ago, riscaldarla brevemente in acqua calda fino a quando la soluzione non può essere nuovamente espressa.)
- Controllare i ponti di sale per assicurarsi che non ci siano bolle e conservare nella soluzione di NaCl 1 M rimanente in un contenitore sigillabile.
- Ponti di sale KCl
NOTA: i tubi più sottili vengono utilizzati per i ponti di agar KCl per evitare l'aumento della concentrazione di K + nel tampone, poiché le punte del ponte di sale possono dissolversi e K + può fuoriuscire nel buffer.- Preparare #3 tubi in polietilene (diametro esterno 1,0 mm, diametro interno 0,5 mm), ago da 23 G e siringa di tipo lock, 200 mL di soluzione da 1 M KCl, 2 g di agar, contenitore di plastica sigillabile per la conservazione del ponte di sale.
- Preparare un numero appropriato di ponti di sale tagliando il tubo alle dimensioni necessarie per l'installazione della camera di Ussing (ogni camera richiede due ponti di sale).
- Produrre 200 mL di 1 M KCl sciogliendo 14,91 g di KCl in 200 mL di acqua deionizzata.
- Dividere in due porzioni da 100 ml: fare 100 ml di agar al 2% in 1 M KCl (mescolare 2 g di agar in KCl, riscaldare in un microonde per sciogliere).
- Utilizzando un ago da 23 G e una siringa di bloccaggio, iniettare tubi con una miscela di agar 1 M KCl al 2% (assicurarsi che i tubi siano completamente riempiti e che non ci siano bolle) allo stesso modo dei ponti di sale NaCl.
- Controllare i ponti di sale per assicurarsi che non ci siano bolle e conservare nella restante soluzione di 1 M KCl in un contenitore sigillabile.
3. Preparazione della soluzione di Ringer e del buffer HEPES
NOTA: a seconda del tessuto montato nella camera di Ussing, i componenti della soluzione di Ringer possono differire. Le ricette qui presentate sono specifiche per l'intestino tenue e crasso.
- Rendere fresca la soluzione di Ringer il giorno degli esperimenti come descritto nella Tabella 1.
- Bolle la soluzione con il 95% di O2/5% di CO2 per fornire O2 al tessuto e una capacità tampone.
| Soluzione di Ringer (intestino tenue) | Soluzione di Ringer (intestino crasso) |
| NaHCO3 – 21,0 mM | NaHCO3 – 21,0 mM |
| K2HPO4 – 2,4 mM | K2HPO4 – 2,4 mM |
| KH2PO4 – 0,6 mM | KH2PO4 – 0,6 mM |
| NaCl – 119,0 mM | NaCl – 119,0 mM |
| MgCl2 – 1,2 mM | MgCl2 – 1,2 mM |
| CaCl2 – 1,2 mM | CaCl2 – 1,2 mM |
| Indometacina – 10 μM (Produrre 1 mM di stock in 21 mM di NaHCO3, aggiungere 10 mL di stock per 1 L di soluzione di Ringer) | Indometacina – 10 μM (Produrre 1 mM di stock in 21 mM di NaHCO3, aggiungere 10 mL di stock per 1 L di soluzione di Ringer) |
| 1 mM Di Glutammina (0,146 g/L) | 10 mM Glucosio |
Tabella 1: Ricetta della soluzione di Ringer. Per realizzare la soluzione di Ringer, mescolare tutti i componenti insieme con acqua deionizzata. La soluzione di Ringer è meglio fatta fresca prima degli esperimenti. Conservare in frigorifero o sul ghiaccio fino all'uso. Prima dell'uso, gas con il 95% di O2/5% di CO2.
- Preparare il tampone HEPES fresco il giorno dell'esperimento come descritto nella Tabella 2 mescolando gli ingredienti in acqua deionizzata.
- Non regolare al volume finale del tampone fino a dopo la regolazione del pH.
- Riscaldare il tampone HEPES a 37 °C e regolare il pH a 7,4 aggiungendo lentamente gocce di 1 M di soluzione tris durante l'agitazione.
- Regolare il volume finale aggiungendo la quantità appropriata di acqua deionizzata.
| HEPES Buffer | Tampone HEPES di diluizione |
| HEPES – 10 mM | HEPES – 10 mM |
| Glucosio – 10 mM (intestino crasso) | Glucosio – 10 mM (intestino crasso) |
| 1 mM Di Glutammina (0,146 g/L) (Intestino tenue) | 1 mM Di Glutammina (0,146 g/L) (Intestino tenue) |
| NaCl – 150 mM | NaCl – 75 mM + 150 mM mannitolo (per regolare le differenze di osmolalità) |
| MgCl2 – 1 mM | MgCl2 – 1 mM |
| CaCl2 – 2 mM | CaCl2 – 2 mM |
| Indometacina – 10 μM (Produrre 1 mM di stock in 21 mM di NaHCO3, aggiungere 10 mL di stock per 1 L di Soluzione di Ringer) | Indometacina – 10 μM (Produrre 1 mM di stock in 21 mM di NaHCO3, aggiungere 10 mL di stock per 1 L di Soluzione di Ringer) |
| Regolare a pH 7,40 (37°C) utilizzando 1 M Tris | |
Tabella 2: Ricetta tampone HEPES. Per produrre il tampone HEPES e il tampone HEPES di diluizione, sciogliere tutti gli ingredienti in acqua deionizzata. Le soluzioni devono essere regolate a pH con la soluzione 1 M Tris, quindi non aggiungere l'intero volume d'acqua (ad esempio, quando si fa 1 L, sciogliere tutti gli ingredienti in circa 800 ml di acqua). Quindi riscaldare la soluzione a 37 °C, regolare il pH a 7,4 e quindi regolare il volume finale.
4. Configurazione della camera di ussing
NOTA: Le camere di Ussing utilizzate in questo protocollo sono camere di perfusione continua su misura. Per valutare la funzione della barriera intestinale del topo o l'assorbimento dei nutrienti, si raccomandano camere con un'apertura di 4 o 5 mm di diametro25 (Figura 1A-C).
- Per ridurre l'effetto del bordo26 e aiutare a sigillare le camere, attaccare un film di paraffina perforato da 4 o 5 mm (circa 4 cm2) prima della configurazione (Figura 1B).
- Impostato in condizioni di circuito aperto per la misurazione del potenziale di diluizione. Impostare in modalità morsetto corrente. Impostare l'uscita come corrente e impostare l'impulso di corrente su ±20 μA.
- Quando si imposta in condizioni di cortocircuito per la misurazione della corrente di cortocircuito e della resistenza transmucosa, impostare in modalità morsetto di tensione. Impostare l'uscita come tensione e impostare l'impulso di tensione su ±5 mV.
- Assicurarsi che l'acqua a 37 °C circoli nella camicia d'acqua.
- Riempire ogni camera con la soluzione di Ringer o il buffer HEPES (la quantità dipende dal sistema utilizzato, le camere utilizzate qui richiedono 5 ml per ciascun lato) e assicurarsi che non vi siano perdite.
- Collegare ponti di sale ed elettrodi.
- Assicurarsi che la tensione sia 0 e la corrente di impulso stabile per garantire che i ponti di sale e gli elettrodi siano impostati correttamente.
- Lasciare che la temperatura del sistema e della soluzione di Ringer si equilibri per almeno 20 minuti.
- Dopo l'equilibrio, correggere la differenza di tensione asimmetrica tra gli elettrodi KCl e compensare la resistenza del fluido cambiandola a zero (controllare il manuale per il sistema di camere Ussing utilizzato per determinare il modo corretto).
5. Dissezione del tessuto intestinale
NOTA: Tutte le sperimentazioni animali devono essere effettuate nel rispetto delle normative stabilite dal paese e dall'università.
- Prima di prelevare il tessuto intestinale, preparare la soluzione di Ringer fresca e ghiacciata e la bolla con il 95% di O2 e il 5% di CO2 per 15 minuti (fase 3).
- Anestetizzare i topi secondo le linee guida che regolano l'uso degli animali nella ricerca. Per questo esperimento, i topi sono stati anestetizzati con il 2% -3% di isoflurano somministrato da un anestetizzatore. Controllare la corretta anestesia pizzicando le dita dei piedi e assicurandosi che non vi sia alcuna risposta al dolore.
- Fai un'incisione nell'addome con le forbici dal bacino al diaframma; individuare lo stomaco e tagliare l'estremità pilorica dello stomaco.
- Afferrare la porzione dello stomaco attaccata all'intestino tenue con una pinza e tirare delicatamente l'intestino tenue mentre si tagliano gli attacchi mesenterici. Fare attenzione a non tagliare o danneggiare il tessuto intestinale in alcun modo.
- Continua a sezionare l'intestino fino all'ano. Per la completa rimozione dell'intestino crasso, tagliare le ossa pelviche per rivelare la porzione distale dell'intestino crasso e rimuovere con cura il resto dell'intestino tagliando via gli allegati.
- Misurare la lunghezza dell'intestino e dividere in segmenti desiderati. Per questo esperimento, dividere l'intestino tenue in tre segmenti e utilizzare il segmento centrale.
- Posizionare i segmenti desiderati nella soluzione di Ringer ghiacciata e a bolle; quindi, aprire longitudinalmente ogni segmento tagliando lungo gli attacchi mesenterici. Tagliare via il grasso e il tessuto connettivo.
- Riportare i segmenti alla soluzione di Ringer ghiacciata e lavare accuratamente (anche nella soluzione ghiacciata, l'ossigenazione dell'epitelio luminale è importante per mantenere la funzione epiteliale).
6. Stripping dello strato muscolare e preparazione del foglio intestinale
NOTA: La rimozione della sierosa (strato muscolare) è importante per gli studi di trasporto utilizzando l'intestino. Se la sierosa rimane, il tessuto intestinale può essere soggetto a contrazioni muscolari casuali che distorceranno i dati elettrofisiologici e il trasporto potrebbe essere inibito. Il tessuto non cordpato si deteriora rapidamente se montato in camere di Ussing, poiché la sierosa è una barriera di diffusione significativa per il substrato e l'ossigeno. In alcuni casi speciali, potrebbe essere necessario mantenere lo strato muscolare, quindi la decisione spetta al ricercatore e al design sperimentale. I fogli intestinali possono essere preparati in due modi a seconda dello strato rimosso (Figura 2). Per questo esperimento sono necessari preparati per mucosa e sottomucosa (Figura 2, 2° pannello).
- Preparare piastre di dissezione (diametro 10 cm) ricoperte di gomma siliconica, spilli (piccoli aghi per agopuntura), carta da filtro perforata da 5 mm e quadrati di parafilm (2 cm x 2 cm; potrebbe non essere necessario per altri sistemi).
- Versare la soluzione di Ringer fresca, ghiacciata e a bolle nella piastra di dissezione (abbastanza per coprire il tessuto, circa 2-3 ml).
- Sotto uno stereomicroscopio, appuntare le estremità del tessuto intestinale (lato della mucosa verso il basso).
- Usando una pinza fine, sezionare senza mezzi termini lo strato muscolare dalla mucosa sottostante.
- Fare attenzione a non strappare o introdurre buchi nel tessuto.
- Una volta rimosso lo strato muscolare, tagliare un pezzo abbastanza grande per un'apertura di 5 mm di diametro. Quando si prepara l'intestino tenue, la rimozione dello strato muscolare sieroso deve essere eseguita entro 10 minuti, poiché l'ossigenazione luminale è difficile in queste condizioni.
- Carta da filtro perforata bagnata da 5 mm quadrata nella soluzione di Ringer e posizionare il tessuto intestinale su di esso con il lato della mucosa verso il basso, poiché i preparati sottomucosi si avvolgono spontaneamente con il lato della mucosa all'esterno.
- Assicurarsi che l'apertura sia completamente coperta dal tessuto intestinale e che non siano presenti rughe. Utilizzare una lavagna nera sotto la preparazione per esaminare se l'apertura è completamente coperta.
- Ripetere questa procedura per il numero richiesto di preparati mucosi (in questo esperimento sono necessari due preparati: un preparato verrà utilizzato per misurare il potenziale di diluizione e l'altro verrà utilizzato per misurare i parametri elettrici di base).
7. Montaggio di preparati intestinali in camere di Ussing
NOTA: l'impostazione dipenderà dal tipo di sistema di camera Ussing e dal sistema di registrazione utilizzato.
- Aspirazione della soluzione di Ringer/buffer HEPES dalla camera di Ussing.
- Smontare la camera di Ussing e posare la carta da filtro con il lato della mucosa della preparazione intestinale verso il basso sulla camera laterale della mucosa e regolare in modo che la finestra della camera si allinei con il foro della carta da filtro (Figura 1A, la marcatura nera intorno alla finestra della camera è utile per l'allineamento dei preparati).
- Posizionare con attenzione la camera laterale Serosal sulla camera laterale della mucosa e chiudere ermeticamente, ma assicurarsi che il foglio intestinale non si sia mosso durante la connessione.
- Riempire rapidamente entrambe le camere con la soluzione di Ringer o il buffer HEPES e posizionare bacchette gorgoglianti (soluzione di Ringer: 95% O2/5% CO2; Tampone HEPES: 100% O2) all'estremità opposta delle camere, lontano dalla membrana (gorgogliare troppo vicino alla preparazione potrebbe avere un effetto sulle misurazioni).
- Ricollegare i ponti di sale e verificare se la tensione è stabile e la corrente di impulso per assicurarsi che le connessioni siano a posto (Figura 1C).
- Ripetere per ogni preparazione intestinale.
- Lasciare che il sistema si equilibri per circa 15 minuti. Se si utilizza un sistema di registrazione, lasciare che la conduttanza e la differenza di potenziale Isc/ membrana si stabilizzino prima di iniziare gli esperimenti.
8. Esperimento di potenziale di diluizione (condizioni a circuito aperto)
- Lavare entrambi i lati della camera aspirando il tampone HEPES e aggiungendo 5 ml di tampone HEPES preriscaldato fresco su ciascun lato.
- Accendere il sistema di registrazione. Impostare l'intervallo a 250 mV, (il sistema utilizzato qui amplifica la tensione di uscita 10x), impostare le posizioni dei marcatori e impostare il sistema di registrazione su misura.
- Ruotare i sistemi a camera Ussing in modalità morsetto e iniziare a misurare. Una volta che il potenziale di membrana si è stabilizzato (~ 15-20 min), la valutazione può iniziare.
- Aspirare il tampone HEPES dal lato della mucosa e sostituirlo rapidamente con 5 ml di tampone HEPES a diluizione riscaldata contenente 75 mM NaCl.
- Una volta che il potenziale di membrana ha raggiunto il picco (5-10 min), rimuovere il tampone di diluizione dal lato "Mucosa" e sostituirlo con tampone HEPES.
- Se necessario, ripetere il passaggio 3 per il lato serosal, aggiungendo il tampone HEPES di diluizione al lato serosal.
- Per garantire che il tessuto sia vitale, aggiungere l'attivatore dell'adenilato ciclasi Forskolin (concentrazione finale 10 μM) sul lato sieroso.
- Una volta che la differenza di potenziale di membrana ha raggiunto un picco e ha iniziato a diminuire, l'esperimento è finito.
9. Misurazione della conduttanza elettrica transepiteliale e basale Isc (condizioni di cortocircuito)
- Lavare entrambi i lati della camera aspirando la soluzione di Ringer e aggiungendo 5 ml di soluzione di Ringer fresca a bolle su ciascun lato.
- Accendere il sistema di registrazione. Impostare l'intervallo su 2,5 V (il sistema utilizzato qui amplifica la tensione di uscita 10x), impostare le posizioni dei marcatori e impostare il sistema di registrazione su misura.
- Ruotare i sistemi di camere Ussing in modalità morsetto e iniziare a misurare; una volta che Isc e conduttanza si sono stabilizzati (~ 15-20 min), è possibile ottenere misurazioni di base.
- Per garantire che il tessuto sia vitale, aggiungere l'attivatore dell'adenilato ciclasi Forskolin (concentrazione finale 10 μM) sul lato sieroso.
- Una volta che la differenza di potenziale di membrana ha raggiunto un picco e ha iniziato a diminuire, l'esperimento è fatto.
10. Analisi dei risultati
- In condizioni di circuito aperto, calcolare la conduttanza transmucosa dal cambiamento di tensione in risposta agli impulsi di corrente secondo la legge di Ohm. Determinare la corrente di cortocircuito equivalente (Isc) dalla tensione transmucosa e dalla conduttanza applicando la legge di Ohm.
- Utilizzare il potenziale di diluizione di NaCl per calcolare la selettività ionica relativa (PNa/PCl) con l'equazione di Goldman-Hodgkin-Katz10.
- Stimare la selettività assoluta della giunzione stretta per ogni ione usando l'equazione di Kimizuka-Koketsu11.
- Calcola PNa/PCl usando l'equazione di Goldman-Hodgkin-Katz dai potenziali di diluizione e determina le permeabilità assolute PNa e PCl dall'equazione di Kimizuka-Koketsu come descritto da Yu et al.10 come segue:
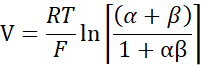

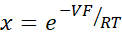

dove, V: Potenziale di diluizione (mV); α: Rapporto di attività. L'attività calcolata di NaCl nel tampone HEPES divisa per l'attività calcolata di NaCl nel tampone HEPES di diluizione (per questo esperimento è stata calcolata come 1,8966); e: Costante matematica, 2,71828; GM: Conduttanza transmucosa (mS/cm2); F: costante di Faraday (96.485,3329 C/mol); R: Costante di gas (8.314 J/mol K); T: Temperatura (310.15 K)
Access restricted. Please log in or start a trial to view this content.
Risultati
I risultati mostrati in questo documento sono risultati che facevano parte di un progetto più ampio che è stato completato (vedi rif.4,23,24).
La conduttanza elettrica transepiteliale dell'intestino tenue è diminuita nei topi Cldn15-/-.
La conduttanza transmucosa al basale (in condizioni di cortocircuito) de...
Access restricted. Please log in or start a trial to view this content.
Discussione
In questo esperimento, le camere di Ussing sono state utilizzate per misurare i parametri elettrici di base e il potenziale di diluizione di NaCl nell'intestino tenue di topi Cldn15-/- e WT. È molto importante quando si eseguono esperimenti con camera di Ussing verificare che la preparazione della membrana utilizzata negli esperimenti sia praticabile. Questo di solito viene fatto aggiungendo glucosio o l'attivatore dell'adenilato ciclasi forskolin e vedendo se c'è un aumento appropriato di ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno potenziali conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è supportato da 17K00860 (a HH) e 19K20152 (a NI). WH desidera ringraziare la Otsuka Toshimi Scholarship Foundation per il suo sostegno finanziario dal 2018 al 2021.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
Riferimenti
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907(2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032(2018).
- Schoultz, I., Keita, ÅV. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, John Wiley & Sons, Inc. 1-19 (2017).
- Östh, K. The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , Uppsala University. Dissertation thesis (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703(2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376(2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon