È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Funzionalizzazione delle vescicole extracellulari di derivazione piastrinica degli impianti Ti
In questo articolo
Riepilogo
Qui presentiamo un metodo per l'isolamento delle vescicole extracellulari (EV) derivate dai lisati piastrinici (PL) e il loro uso per il rivestimento delle superfici implantari in titanio (Ti). Descriviamo il metodo di rivestimento drop casting, il profilo di rilascio EV dalle superfici e la biocompatibilità in vitro delle superfici Ti rivestite con EV.
Abstract
Le vescicole extracellulari (EV) sono nanovescicole biologiche che svolgono un ruolo chiave nella comunicazione cellulare. Il loro contenuto include biomolecole attive come proteine e acidi nucleici, che presentano un grande potenziale nella medicina rigenerativa. Più recentemente, i veicoli elettrici derivati dal lisato piastrinico (PL) hanno mostrato una capacità osteogenica paragonabile alla PL. Inoltre, i biomateriali sono spesso utilizzati in ortopedia o restauro dentale. Qui, forniamo un metodo per funzionalizzare le superfici Ti con EV derivati da PL al fine di migliorare le loro proprietà osteogeniche.
I veicoli elettrici sono isolati dal PL mediante cromatografia di esclusione dimensionale e successivamente le superfici Ti vengono funzionalizzate con PL-EV mediante drop casting. La funzionalizzazione è dimostrata dal rilascio di veicoli elettrici e dalla sua biocompatibilità mediante il test di rilascio della lattato deidrogenasi (LDH).
Introduzione
I veicoli elettrici sono vescicole di membrana (30-200 nm) secrete da qualsiasi cellula e svolgono un ruolo chiave nella comunicazione cellula-cellula consegnando il loro carico. Contengono una varietà di biomolecole attive che possono includere acidi nucleici, fattori di crescita o lipidi bioattivi1. Per questi motivi, i veicoli elettrici sono stati valutati per il loro potenziale utilizzo in terapia. In termini di ortopedia e rigenerazione ossea, sono stati testati veicoli elettrici provenienti da diverse fonti. Tra questi, è stato dimostrato che i veicoli elettrici derivati dalle piastrine inducono un effetto di differenziazione sulle cellule staminali mantenendo un basso profilo citotossico2,3. Pertanto, sono necessarie ulteriori ricerche per esplorare la possibilità di combinare i veicoli elettrici con i biomateriali al fine di utilizzarli nella pratica clinica quotidiana.
I biomateriali a base di titanio sono ampiamente utilizzati come scaffold per interventi clinici di guarigione ossea grazie alle loro proprietà meccaniche, all'elevata biocompatibilità e alla durata a lungo termine4. Tuttavia, gli impianti Ti sono un materiale bioinerte e, pertanto, presentano una scarsa capacità di legame con il tessuto osseo circostante5. Per questo motivo, le modifiche del titanio sono in fase di studio al fine di migliorare le loro prestazioni ottenendo un microambiente più funzionale sulla sua superficie4,6,7. In questo senso, i veicoli elettrici possono essere ancorati al titanio da interazioni chimiche8 o fisiche9,10. Gli EV immobilizzati derivati da cellule staminali o macrofagi migliorano la bioattività di Ti promuovendo l'adesione e la proliferazione cellulare inducendo così un effetto osteogenico8,9,10.
Questo articolo si concentrerà su una strategia di drop casting per il rivestimento di superfici Ti con veicoli elettrici derivati da PL in dettaglio. Inoltre, valuteremo il profilo di rilascio dei veicoli elettrici dalla superficie rivestita nel tempo e confermeremo la sua biocompatibilità cellulare in vitro.
Protocollo
Il Lisato Piastrinico (PL) è ottenuto come precedentemente descritto in conformità alle linee guida istituzionali3 utilizzando come materiale di partenza i freschi buffy coat forniti dalla Biobanca IdISBa. Il loro utilizzo per il progetto in corso è stato approvato dal suo Comitato Etico (IB 1995/12 BIO).
1. Isolamento dei veicoli elettrici da PL
- Rimozione di corpi più grandi
- Scongelare PL a temperatura ambiente.
- Centrifuga PL a 1.500 x g per 15 min a 4 °C. Scartare il pellet in quanto contiene detriti cellulari.
- Raccogliere il surnatante ed eseguire due centrifugazioni consecutive a 10.000 x g per 30 minuti a 4 °C.
NOTA: il pellet corrisponde a veicoli elettrici più grandi come le microvescicole e, in questo caso, viene scartato. - Filtrare il surnatante prima attraverso la membrana porosa da 0,8 μm e poi attraverso la membrana porosa da 0,2 μm.
NOTA: questa procedura consente di rimuovere tutti i veicoli elettrici non desiderati. - Raggruppare il PL filtrato e conservare a -20 °C fino all'uso.
- Cromatografia ad esclusione dimensionale
- Equilibrare la colonna accoppiata all'apparecchiatura cromatografica alla portata desiderata con PBS filtrato.
NOTA: la portata utilizzata dipende dalle caratteristiche della colonna; in questo caso, è impostato su 0,5 ml/ min. - Caricare il PL lavorato (5 mL) con una siringa sull'apparecchiatura.
- Iniettare il PL nella colonna e iniziare a raccogliere 5 mL di frazioni in tubi da 15 mL.
- Raccogliere le frazioni arricchite ev e conservarle a -80 °C fino all'uso.
NOTA: Quando si esegue l'esperimento per la prima volta, caratterizzare tutte le frazioni per quantificazione proteica e immunodetezione per determinare quella arricchita con EVs3,11. In questo esperimento, viene raccolta la 9a frazione. - Lavare la colonna cromatografica con 30 mL di soluzione di NaOH allo 0,2% e conservarla in una soluzione di etanolo al 20% una volta raggiunto l'equilibrio.
- Equilibrare la colonna accoppiata all'apparecchiatura cromatografica alla portata desiderata con PBS filtrato.
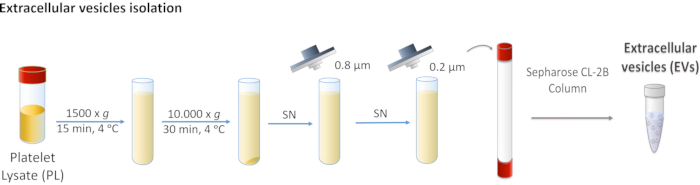
Figura 1: Diagramma schematico dell'isolamento delle vescicole extracellulari (EV) di lisato piastrinico (PL). Il PL viene centrifugato prima a 1.500 x g e poi a 10.000 x g per rimuovere corpi più grandi. Il surnatante viene filtrato attraverso filtri da 0,8 e 0,2 μm. Il PL elaborato viene caricato sulla colonna e i veicoli elettrici sono separati dalla cromatografia di esclusione delle dimensioni. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Caratterizzazione dei veicoli elettrici
NOTA: la caratterizzazione dei veicoli elettrici è necessaria per eseguire studi funzionali12. La microscopia elettronica o la caratterizzazione western blot sono state precedentemente riportate13. Questo rapporto si concentrerà sulle tecniche di caratterizzazione essenziali per la funzionalizzazione della superficie Ti.
- Analisi di tracciamento delle nanoparticelle (NTA)
- Diluire i veicoli elettrici (1:1000) in PBS filtrato da 0,2 μm.
NOTA: campioni troppo concentrati o troppo diluiti saranno fuori gamma per la determinazione dell'NTA e sarà necessario un aggiustamento. - Caricare 1 mL dei veicoli elettrici diluiti con una siringa all'apparecchiatura NTA e iniettarli nell'apparecchiatura NTA.
- Seguire il protocollo del produttore per la determinazione della concentrazione di particelle e della distribuzione dimensionale.
- Diluire i veicoli elettrici (1:1000) in PBS filtrato da 0,2 μm.
- Concentrazione di proteine
- Determinare la concentrazione utilizzando 1 μL della soluzione EV. Misurare l'assorbanza con uno spettrofotometro ad una lunghezza d'onda di 280 nm.
NOTA: gli EV dovrebbero presentare bassi livelli di proteine rispetto al numero di particelle. - Seguire le istruzioni del produttore per ottenere la lettura dell'assorbanza utilizzando lo spettrofotometro.
- Determinare la concentrazione utilizzando 1 μL della soluzione EV. Misurare l'assorbanza con uno spettrofotometro ad una lunghezza d'onda di 280 nm.
3. Funzionalizzazione della superficie in titanio
NOTA: In questo metodo vengono utilizzati dischi in titanio lavorati, grado IV c.p., diametro 6,2 mm e altezza 2 mm. I dischi possono essere manipolati con una pinzetta Ti, ma è importante non graffiare la superficie. Inoltre, il lato lavorato deve essere rivolto verso l'alto durante l'intero processo.
- Lavaggio dischi Ti
NOTA: il volume delle soluzioni utilizzate per il lavaggio Ti deve essere sufficiente a coprire i dischi Ti. Mettere i dischi Ti in un bicchiere di vetro e versare soluzioni su di essi. Quindi, rimuovere la soluzione decantando.- Lavare gli impianti Ti con acqua deionizzata (DI) e quindi scartare l'acqua.
- Lavare gli impianti Ti con etanolo al 70% e quindi decantare per rimuovere la soluzione.
- Posizionare gli impianti in acqua DI e sonicare a 50 °C per 5 minuti. Scartare l'acqua.
- Incubare gli impianti Ti in una soluzione naOH al 40% a 50 °C per 10 minuti con agitazione. Scartare la soluzione.
ATTENZIONE: la soluzione di NaOH si riscalda durante la preparazione. La soluzione è corrosiva e deve essere utilizzata all'interno di una cappa aspirante. - Sonicare gli impianti in acqua DI a 50 °C per 5 minuti, quindi rimuovere l'acqua.
- Eseguire diversi lavaggi con acqua DI (almeno 5) fino a raggiungere il pH neutro. Controllare il pH con gli indicatori di pH.
- Sonicare gli impianti in acqua DI a 50 °C per 5 minuti e rimuovere l'acqua.
- Incubare gli impianti Ti in una soluzione HNO3 al 50% a 50 °C per 10 minuti con agitazione. Rimuovere la soluzione.
ATTENZIONE: HNO3 è una sostanza corrosiva e ossidante e deve essere utilizzato all'interno di una cappa aspirante. - Sonicare gli impianti in acqua DI a 50 °C per 5 min. Rimuovere l'acqua.
- Eseguire diversi lavaggi con acqua DI (almeno 5) fino ad ottenere un pH neutro. Controllare il pH con gli indicatori di pH.
- Sonicare gli impianti in acqua DI a 50 °C per 5 min. Rimuovere l'acqua.
NOTA: A questo punto, l'esperimento può essere interrotto conservando gli impianti Ti in una soluzione di etanolo al 70%.
- Passivazione Ti
NOTA: Le fasi di passivazione Ti vengono eseguite coprendo completamente i dischi Ti con le diverse soluzioni nell'ordine elencato di seguito. I dischi Ti vengono posti in un becher di vetro e le soluzioni vengono delicatamente versate su di essi. I volumi utilizzati in tutte le fasi di lavaggio devono coprire completamente gli impianti e vengono rimossi tramite decantazione.- Incubare gli impianti Ti in una soluzione HNO3 al 30% per 30 minuti a temperatura ambiente sotto delicata agitazione. Rimuovere la soluzione.
- Eseguire diversi lavaggi con acqua DI (almeno 5) fino a raggiungere il pH neutro. Controllare il pH con gli indicatori di pH.
- Incubare gli impianti Ti durante la notte a temperatura ambiente in acqua DI.
- Asciugare gli impianti in condizioni di vuoto a 40 °C per 10 minuti.
- I veicoli elettrici rilasciano la fusione
NOTA: Per gli studi funzionali cellulari, è importante lavorare in un armadio di coltura cellulare.- Posizionare gli impianti Ti in una piastra a 96 pozzetti, con il lato lavorato rivolto verso l'alto.
NOTA: Se gli impianti sono capovolti, è possibile utilizzare un ago per riportarli indietro. - Scongelare la soluzione EV e mescolarli con agitazione. Usa un vortice per pulsare per 3 s.
- Deposita i veicoli elettrici sulla superficie Ti. In questo studio, gocce di 40 μL di soluzione EV vengono posizionate sul Ti per immobilizzare un massimo di 4 x 1011 EV per impianto in base alla concentrazione determinata da NTA.
- Posizionare le piastre contenenti il Ti in condizioni di vuoto a 37 °C fino a quando le gocce sono completamente asciutte (~2 h).
NOTA: Regolare il tempo in base al numero di impianti e all'acqua presente nella camera a vuoto.
- Posizionare gli impianti Ti in una piastra a 96 pozzetti, con il lato lavorato rivolto verso l'alto.
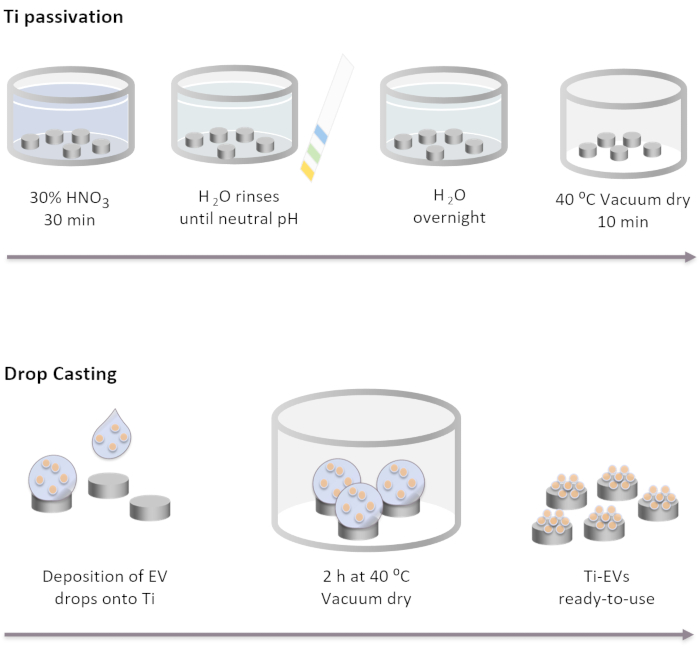
Figura 2: Diagramma schematico della passivazione ti e della funzionalizzazione dei veicoli elettrici mediante drop casting. Gli impianti Ti vengono passivati prima mediante incubazione per 30 minuti in una soluzione di HNO3 al 30 % a temperatura ambiente. Dopo diversi lavaggi con acqua DI, il pH raggiunge il neutro. Quindi, gli impianti Ti vengono incubati durante la notte a temperatura ambiente in acqua DI. Successivamente, gli impianti vengono asciugati in condizioni di vuoto a 40 °C. Per l'immobilizzazione dei veicoli elettrici, 40 μL di soluzione EV vengono depositati sugli impianti Ti. Successivamente, gli impianti vengono incubati a vuoto per 2 ore fino a quando i veicoli elettrici non sono fisicamente legati alla superficie. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Caratterizzazione della superficie Ti
- Studio di rilascio
- Incubare la superficie di Ti con 200 μL di PBS filtrato a 37 °C.
NOTA: PBS viene filtrato per evitare interferenze con la misurazione NTA. - Sostituire il PBS in diversi punti temporali e conservare a -80 °C.
NOTA: in questo studio sono stati analizzati i punti temporali di 2, 6, 10 e 14 giorni. - Analizzare il PBS memorizzato per gli studi sulle particelle da parte di NTA secondo le istruzioni del produttore.
NOTA: la concentrazione di particelle in PBS in momenti diversi è una rappresentazione del profilo di rilascio dei veicoli elettrici nel tempo.
- Incubare la superficie di Ti con 200 μL di PBS filtrato a 37 °C.
- Studi di biocompatibilità
NOTA: Le cellule staminali mesenchimali derivate dal cordone ombelicale umano (hUC-MSC) sono ottenute dalla Biobanca IdISBa in conformità con le linee guida istituzionali.- Mantenere hUC-MSC in DMEM basso glucosio integrato con 20% FBS fino all'uso. Cambia il mezzo due volte a settimana.
- Per la semina cellulare, lavare le cellule in palloni con 5 ml di PBS due volte.
- Tripsinizzare hUC-MSC aggiungendo 1 mL di soluzione di tripsina. Assicurarsi che copra completamente il monostrato di cellule. Rimuovere la soluzione di tripsina e posizionare il matraccio di coltura cellulare a 37 °C per 2 minuti circa. Visualizza il distacco cellulare al microscopio. Le celle staccate appariranno di forma rotonda e saranno in sospensione.
- Cellule risospese in DMEM a basso contenuto di glucosio con FBS impoverito all'1% di EV.
NOTA: preparare i supporti integrati con l'1% di FBS e quindi ultracentrifugare a 120.000 x g per 18 ore per rimuovere i veicoli FBS-EV. È importante rimuovere i veicoli elettrici per evitare interferenze con i veicoli elettrici piastrinici. - Determinare la concentrazione cellulare contando il numero di cellule con una camera neubauer14.
- Portare hUC-MSC a una concentrazione di 50.000 cellule/ml.
- Seminare 200 μL della soluzione cellulare sugli impianti Ti.
- Dopo 48 ore, raccogliere 50 μL di mezzo ed eseguire la determinazione citotossica utilizzando il kit di attività della lattato deidrogenasi (LDH), secondo il protocollo del produttore.
Risultati
Il metodo presentato in questo articolo consente di ottenere dischi in titanio funzionalizzati EV. I veicoli elettrici sono fisicamente legati alla superficie, il che consente un rilascio prolungato nel tempo. La quantità di veicoli elettrici rilasciati può essere misurata da NTA nei giorni 2, 6, 10 e 14. Le prime misurazioni, il giorno 2, mostrano che vengono rilasciati circa 109 veicoli elettrici, seguiti da un rilascio prolungato il giorno 6 (~ 108 veicoli elettrici); giorno 10 (~ 107
Discussione
Questo protocollo mira a fornire istruzioni chiare per la funzionalizzazione dei veicoli elettrici sulle superfici Ti. Il metodo presentato si basa su una strategia di drop casting, che è un tipo di funzionalizzazione di fisisorbimento. Esiste una scarsa bibliografia per quanto riguarda la funzionalizzazione dei veicoli elettrici sulle superfici Ti, anche se ci sono pochi studi che mostrano diversi vantaggi immobilizzando i veicoli elettrici su Ti10. Ad ogni modo, alcune delle strategie esplorate...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata dall'Instituto de Salud Carlos III, Ministerio de Economía y Competitividad, cofinanziato dal Fondo sociale europeo del FSE e dal Fondo europeo di sviluppo regionale del FESR (MS16/00124; CP16/00124; PI17/01605), la Direcció General d'Investigació, Conselleria d'Investigació, Govern Balear (FPI/2046/2017), e PROGRAMA JUNIOR del projecte TALENT PLUS, construyendo SALUD, generando VALOR (JUNIOR01/18), finanziato dalla tassa sul turismo sostenibile delle Isole Baleari.
Materiali
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
Riferimenti
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590 (2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725 (2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694 (2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571 (2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369 (2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541 (2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon