È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Tomografia a coerenza ottica basata sull'analisi dell'interazione fluido-struttura biomeccanica della progressione dell'aterosclerosi coronarica
In questo articolo
Riepilogo
È necessario determinare quali lesioni aterosclerotiche progrediranno nella vascolarizzazione coronarica per guidare l'intervento prima che si verifichi l'infarto miocardico. Questo articolo delinea la modellazione biomeccanica delle arterie dalla tomografia a coerenza ottica utilizzando tecniche di interazione fluido-struttura in un risolutore commerciale agli elementi finiti per aiutare a prevedere questa progressione.
Abstract
In questo articolo, presentiamo un flusso di lavoro completo per l'analisi biomeccanica della placca aterosclerotica nella vascolarizzazione coronarica. Con l'aterosclerosi come una delle principali cause di morte globale, morbilità e onere economico, sono necessari nuovi modi di analizzare e prevedere la sua progressione. Uno di questi metodi computazionali è l'uso dell'interazione fluido-struttura (FSI) per analizzare l'interazione tra il flusso sanguigno e i domini arteriosi / placca. Accoppiato con l'imaging in vivo, questo approccio potrebbe essere adattato a ciascun paziente, aiutando a distinguere tra placche stabili e instabili. Delineiamo il processo di ricostruzione tridimensionale, facendo uso della tomografia a coerenza ottica intravascolare (OCT) e dell'angiografia coronarica invasiva (ICA). L'estrazione delle condizioni al contorno per la simulazione, compresa la replica del movimento tridimensionale dell'arteria, viene discussa prima che l'impostazione e l'analisi siano condotte in un risolutore commerciale agli elementi finiti. La procedura per descrivere le proprietà iperelastiche altamente non lineari della parete arteriosa e la velocità / pressione pulsatile del sangue è delineata insieme alla configurazione dell'accoppiamento del sistema tra i due domini. Dimostriamo la procedura analizzando una placca non colpevole, leggermente stenotica, ricca di lipidi in un paziente a seguito di infarto miocardico. I marcatori stabiliti ed emergenti relativi alla progressione della placca aterosclerotica, come lo stress da taglio della parete e l'elicità normalizzata locale, rispettivamente, sono discussi e correlati alla risposta strutturale nella parete arteriosa e nella placca. Infine, traduciamo i risultati in potenziale rilevanza clinica, discutiamo i limiti e delineiamo le aree per l'ulteriore sviluppo. Il metodo descritto in questo documento mostra la promessa di aiutare nella determinazione dei siti a rischio di progressione aterosclerotica e, quindi, potrebbe aiutare a gestire la morte significativa, la morbilità e l'onere economico dell'aterosclerosi.
Introduzione
La malattia coronarica (CAD) è il tipo più comune di malattia cardiaca e una delle principali cause di morte e onere economico a livello globale1,2. Negli Stati Uniti, circa un decesso su otto è attribuito a CAD3,4, mentre la maggior parte dei decessi globali da CAD sono ora visti nei paesi a basso e medio reddito5. L'aterosclerosi è il driver predominante di queste morti, con rottura della placca o erosione che porta all'occlusione dell'arteria coronaria e all'infarto miocardico acuto (AMI)6. Anche dopo la rivascolarizzazione delle lesioni coronariche colpevoli, i pazienti hanno un rischio sostanziale di eventi cardiovascolari avversi maggiori ricorrenti (MACE) dopo AMI, in gran parte a causa della concomitante presenza di altre placche non colpevoli che sono anche vulnerabili alla rottura7. L'imaging intracoronarico offre l'opportunità di rilevare queste placche ad alto rischio8. Sebbene l'ecografia intravascolare (IVUS) sia il gold standard per la valutazione del volume della placca, ha una risoluzione limitata per identificare le caratteristiche microstrutturali della placca vulnerabile in contrasto con l'alta risoluzione (10-20 μm) della tomografia a coerenza ottica (OCT). Un cappuccio fibroso sottile e infiammato che sovrasta un grande pool lipidico ha dimostrato di essere la firma più importante di una placca vulnerabile9 ed è meglio identificato e misurato dall'OCT tra le modalità di imaging intracoronarico attualmente disponibili10. È importante sottolineare che OCT è anche in grado di valutare altre caratteristiche della placca ad alto rischio, tra cui: arco lipidico; infiltrazione dei macrofagi; presenza di fibroateroma a cappuccio sottile (TCFA), che è definito come nucleo ricco di lipidi con cappuccio fibroso sottile sovrastante (<65 μm); calcificazione chiazzata; e microcanali a placche. Il rilevamento OCT di queste caratteristiche ad alto rischio nelle placche non colpevoli post-AMI è stato associato a un aumento del rischio fino a 6 volte maggiore di futuro MACE11. Tuttavia, nonostante questo, la capacità dell'angiografia e dell'imaging OCT di prevedere quali placche coronariche progrediranno e alla fine si romperanno o si eroderanno è limitata, con valori predittivi positivi di solo il 20% -30%8. Questa limitata capacità predittiva ostacola il processo decisionale clinico attorno a quali placche non colpevoli trattare (ad esempio, mediante stenting)7,12.
Oltre ai fattori del paziente e alle caratteristiche biologiche della placca, le forze biomeccaniche nelle arterie coronarie sono anche importanti determinanti della progressione della placca e dell'instabilità13. Una tecnica che mostra la promessa di aiutare a valutare in modo completo queste forze è la simulazione dell'interazione fluido-struttura (FSI)14. Lo stress da taglio a parete (WSS), chiamato anche stress da taglio endoteliale, è stato un punto focale tradizionale per la ricerca biomeccanica coronarica15, con una comprensione generale che WSS svolge un ruolo eziologico nella formazione dell'aterosclerosi16. Prevalentemente simulate utilizzando tecniche di fluidodinamica computazionale (CFD), le regioni a basso WSS sono state associate all'ispessimento intimale17,al rimodellamentovascolare 18 e alla previsione della progressione della lesione19 e del futuro MACE20. Recenti progressi in queste analisi suggeriscono la topologia di campo vettoriale WSS sottostante21e le sue caratteristiche multidirezionali22, come un migliore predittore del rischio di aterosclerosi rispetto alla sola magnitudo WSS. Tuttavia, WSS cattura solo un assaggio del sistema biomeccanico complessivo sulla parete del lume e, proprio come le modalità di imaging, nessuna metrica biomeccanica può discernere in modo affidabile le caratteristiche aterosclerotiche ad alto rischio.
Ulteriori metriche stanno emergendo come potenzialmente importanti nella formazione dell'aterosclerosi. Le caratteristiche del flusso intraluminale23 sono uno di questi esempi, con flusso elicoidale, quantificato attraverso vari indici24, suggerito come svolgendo un ruolo ateroprotettivo sopprimendo i modelli di flusso disturbato25,26. Mentre le tecniche CFD possono analizzare queste caratteristiche di flusso e presentare una vasta gamma di risultati utili, non considerano le interazioni sottostanti tra il flusso sanguigno, la struttura delle arterie e il movimento generale del cuore. Questa semplificazione del sistema dinamico a parete rigida manca di risultati potenzialmente critici come lo stress fibroso del cappuccio. Mentre il dibattito sia a favore che contro la necessità di FSI su CFD continua27,28,29, molti confronti trascurano di includere l'impatto della funzione ventricolare. Questa limitazione può essere superata con FSI, che ha dimostrato che la flessione dinamica e la compressione esercitate sull'arteria attraverso l'influenza della funzione ventricolare possono avere un impatto significativo sullo stress strutturale della placca e dell'arteria, nonché sulle metriche di flusso come WSS30,31,32. Questo è importante in quanto le sollecitazioni strutturali sono anche una metrica chiave per analizzare e prevedere la rottura della placca33,34 e sono stati suggeriti per co-localizzare con regioni di aumento della placca14,35. La cattura di queste interazioni consente una rappresentazione più realistica dell'ambiente coronarico e dei potenziali meccanismi di progressione della malattia.
Affrontando questo, qui delineiamo il processo di sviluppo di una geometria specifica per il paziente dall'imaging OCT36 e l'impostazione e l'esecuzione di una simulazione FSI dell'arteria utilizzando un risolutore commerciale agli elementi finiti. Il processo per estrarre manualmente il lume, il lipide e la parete esterna dell'arteria è dettagliato prima della ricostruzione computazionale tridimensionale dell'arteria del paziente. Descriviamo la configurazione della simulazione, l'accoppiamento e il processo di confronto dei parametri di imaging OCT di base e di follow-up per determinare la progressione della lesione. Infine, discutiamo la post-elaborazione dei risultati numerici e come questi dati possano avere rilevanza clinica confrontando i risultati biomeccanici con la progressione/regressione della lesione. Il metodo complessivo è dimostrato su placche non colpevoli, lievemente stenotiche, ricche di lipidi nell'arteria coronaria destra (RCA) di un paziente maschio caucasico di 58 anni che ha presentato un infarto miocardico acuto non ST in contesto di ipertensione, diabete mellito di tipo 2, obesità (BMI 32,6) e una storia familiare di CAD prematura. L'angiografia coronarica e l'imaging OCT sono stati eseguiti durante il suo ricovero iniziale, e poi 12 mesi dopo come parte di una sperimentazione clinica in corso (studio COCOMO-ACS ACTRN12618000809235). Prevediamo che questa tecnica possa essere ulteriormente perfezionata e utilizzata per identificare le placche coronariche che sono ad alto rischio di progredire.
Protocollo
I seguenti dati deidentificati sono stati analizzati da un paziente reclutato nello studio randomizzato-controllato COCOMO-ACS in corso (ACTRN12618000809235; Numero di riferimento HREC del Royal Adelaide Hospital: HREC/17/RAH/366), con ulteriore approvazione etica concessa dai servizi di ricerca della Central Adelaide Local Health Network (CALHN) ai fini della simulazione biomeccanica (numero di riferimento CALHN 14179). Nella Figura 1 viene riepilogato il flusso di lavoro completo descritto nel protocollo seguente, che può essere applicato a qualsiasi software o codice compatibile con FSI.
1. Valutazione dell'immagine
- Abbina le immagini di follow-up di base e OCT utilizzando punti di riferimento anatomici come le biforcazioni e utilizzando immagini immediatamente prossimali alla biforcazione distale e distale alla biforcazione più prossimale. Le immagini corrispondenti tra questi punti di riferimento devono essere analizzate, come descritto nella Figura 2A.
- Sezione trasversale del lumen dello Strumento di personalizzazione di Office
- Caricare ogni immagine dello Strumento di personalizzazione di Office nel digitalizzatore di immagini e fare clic per contrassegnare i punti al centro del catetere e i limiti della scala (Figura 2B). Esporta questi punti per essere utilizzati in seguito.
- Segna manualmente il bordo del lumen, partendo dalla stessa posizione in ogni immagine, assicurandoti di catturare le curve del lumen nel modo più accurato possibile. Lascia un vuoto nell'artefatto del catetere poiché il processo di ricostruzione si interpolerà in questa regione in una fase successiva. Esporta questi file in .dat formato e ripeti questo per ogni immagine.
- PARETE ESTERNA OCT e lipidi
- Nel software DICOM, estrarre la parete esterna in regioni ad alta attenuazione utilizzando parti visibili della membrana elastica esterna per adattare manualmente un'ellisse per stimare la posizione della parete esterna, come descritto nella Figura 3. Fare clic e trascinare il pulsante sinistro del mouse per definire l'ellisse e la posizione in modo appropriato.
- Definire manualmente l'arco lipidico, calcolato in base al centroide del lume, e lo spessore del cappuccio fibroso, come descritto nella Figura 3,facendo clic e trascinando rispettivamente le misure dell'angolo e della distanza. Questi saranno utilizzati per analizzare la progressione della lesione insieme all'area del lume.
- Importare queste immagini sovrapposte nel digitalizzatore di immagini e selezionare manualmente i punti della parete esterna, utilizzando l'ellisse montata come guida nelle regioni ad alta attenuazione in cui la membrana elastica esterna non è visibile. Ripetere il passaggio 1.2.2 per selezionare ed esportare i punti in un formato .dat.
- Allo stesso modo per i lipidi, selezionare manualmente la superficie lipidica, partendo dalla stessa estremità del lipide in ogni caso. Utilizzate la guida ellissoidale della parete esterna (punto 1.3.1) per un arco posteriore coerente. L'esportazione punta a un file .dat e ripetere per tutte le immagini con lipidi presenti, lasciando uno spazio vuoto attraverso il manufatto del filo guida come descritto nel passaggio 1.2.2.
NOTA: La progressione della lesione viene analizzata confrontando tre metriche, vale a dire, area del lume, arco lipidico e spessore del cappuccio fibroso, che possono essere valutate direttamente dal visualizzatore DICOM. La tecnica per estrarre la parete esterna e il retro lipidico è necessaria a causa della limitata profondità di penetrazione dell'OCT. L'OCT è stato utilizzato in questa indagine a causa dell'attenzione alla relazione tra composizione della placca e forze biomeccaniche.
- Linea mediana basata sull'angiografia
- Carica la prima immagine angiografica nel digitalizzatore di immagini37. Selezionate i bordi del catetere per ridimensionare l'immagine nei passaggi successivi, quindi contrassegnate manualmente l'asse di mezzeria del catetere iniziando con il marcatore prossimale e spostandosi distalmente, con punti uniformemente distanziati, come mostrato nella Figura 4A. Esportare i dati in formato .dat e ripetere per il secondo piano angiografico.
NOTA: Generalmente, i piani con un angolo maggiore di 20° tra loro migliorano la robustezza della ricostruzione tridimensionale della linea mediana. Il catetere e il filo guida DELLO STRUMENTO DI PERSONALIZZAZIONE DI OFFICE devono essere visibili in ogni immagine.
- Carica la prima immagine angiografica nel digitalizzatore di immagini37. Selezionate i bordi del catetere per ridimensionare l'immagine nei passaggi successivi, quindi contrassegnate manualmente l'asse di mezzeria del catetere iniziando con il marcatore prossimale e spostandosi distalmente, con punti uniformemente distanziati, come mostrato nella Figura 4A. Esportare i dati in formato .dat e ripetere per il secondo piano angiografico.
2. Ricostruzione tridimensionale
- Proiezioni angiografiche
- Caricare i file di dati esportati nel passaggio 1.4. Utilizzare i primi due punti per scalare i dati a millimetri (i primi due punti vengono utilizzati con le specifiche del catetere note, 6F in questo caso). Sottrarre il punto dati prossimale dai punti rimanenti in ogni set di dati in modo che la curva inizi all'origine del sistema di coordinate.
- Generare matrici di rotazione per ogni vista angiografica, dove θ e Φ rappresentano rispettivamente gli angoli RAO/LAO e CAU/CRA. Usiamo gli angoli LAO e CRA come negativi. Le due matrici di rotazione nelle direzioni x (Rotx) e y (Roty), rispettivamente, sono:
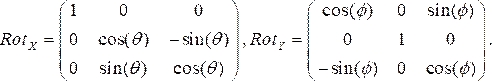 (1)
(1) - Moltiplicare insieme le matrici di rotazione e quindi moltiplicarle con le coordinate di ciascun punto dal passaggio 2.1.1. L'equazione risultante:
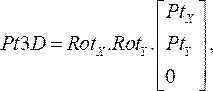 (2)
(2)
fornisce la posizione tridimensionale del punto del catetere sul rispettivo piano angiogramma (Pt3D) ruotando i punti bidimensionali che sono stati specificati da ciascuna immagine angiografica. - Calcola il vettore normale per ciascun piano angiografico moltiplicando le matrici di rotazione x e y per il vettore unitario nella direzione z. Dalla posizione prossimale a quella distale, proietta ogni punto normale al rispettivo piano e calcola il punto medio della distanza più breve tra le proiezioni. Ciò si traduce nel punto tridimensionale sul filo guida dello Strumento di personalizzazione di Office nello spazio.
- Utilizzando la funzione 'interparc', disponibile dallo scambio centrale di file MATLAB38, dividi l'asse di mezzeria tridimensionale in punti equamente distanziati. La spaziatura tra i punti deve essere uguale alla spaziatura tra le immagini dello Strumento di personalizzazione di Office, determinata dalla velocità di pullback. Queste sono le posizioni in cui verranno posizionate le sezioni trasversali dello Strumento di personalizzazione di Office.
- Rotazione della sezione trasversale dello Strumento di personalizzazione di Office
- Utilizzando il file di dati contenente il centro e la scala del catetere, convertire ogni sezione trasversale da pixel a mm utilizzando il secondo e il terzo punto nel file di ridimensionamento. Per centrare la sezione trasversale attorno alla posizione del catetere, sottraete il primo punto del file di ridimensionamento (il centro del catetere) da tutti i punti della sezione trasversale. Calcolare il vettore normale alla sezione trasversale (parallelo al catetere nell'arteria) sottraendo il punto dell'asse di mezzeria tridimensionale dal punto distale successivo lungo la curva del catetere.
- Ruotare la sezione trasversale dello Strumento di personalizzazione di Office per allinearla perpendicolarmente all'asse di mezzeria del catetere moltiplicando i punti dati scalati per la matrice di rotazione:
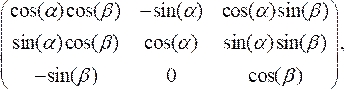 (3)
(3)
dove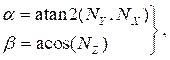 (4)
(4)
e NX, N Ye NZ sono le componenti x , y e z, rispettivamente, del vettore normale calcolato nella sezione 2.1. Aggiungete il punto dell'asse di mezzeria tridimensionale a tutti i punti ruotati nella sezione trasversale, ottenendo la posizione della sezione trasversale nello spazio tridimensionale (Figura 4B). - Ripetere i passaggi 2.2.1-2.2.2 per ogni sezione trasversale (lume, arteria e lipidi). Esportare le sezioni trasversali in un file di testo, che può essere importato nel software CAD (Computer Aided Design) per la creazione finale del corpo solido.
- Creazione di modelli solidi 3D
- In un software di modellazione 3D, importare e generare le sezioni trasversali un file alla volta. Importare i file di testo contenenti le sezioni trasversali nel software di modellazione 3D facendo clic sulla casella a discesa concettuale (Figura 5A-1) e selezionando la curva 3D (Figura 5A-2). Fare clic su Genera.
- Per creare un componente solido, selezionate tutte le curve in ordine e montatele insieme (Figura 5A-3), assicurandovi che sia selezionata l'opzione Aggiungi congelato (add frozen) per generare un nuovo solido. Eseguire questi passaggi per il lume, i lipidi e la parete esterna per creare solidi separati, assicurandosi di abilitare la topologia di unione.
NOTA: potrebbe essere necessario saltare una curva se si verifica una geometria problematica. In questa ricostruzione, ometti un piccolo lipide a metà sezione a causa delle sue dimensioni e del costo computazionale aggiunto e della complessità numerica associati alla sua inclusione. - Per sottrarre il lume e i lipidi dalla parete dell'arteria, creare un'operazione booleana dall'elenco a discesa crea e scegliere il corpo target come parete e i lipidi / lume come corpi utensili per sottrarre il lume e i lipidi dalla parete arteriosa (Figura 5A-4).
- Condividi la topologia tra la parete e i lipidi per garantire che i nodi mesh siano condivisi nei passaggi futuri. Per fare ciò, evidenziare manualmente la parete e i lipidi e fare clic con il pulsante destro del mouse per formare una nuova parte (Figura 5A-5).
NOTA: questo passaggio garantisce che i nodi mesh siano condivisi tra le superfici evitando regioni di contatto improprie o penetrazione mesh tra i due strati, aiutando notevolmente nella fase di soluzione. La geometria finale della linea mediana del catetere, dei lipidi, del lume e della parete arteriosa è visualizzata nella Figura 5B.
- Pre-elaborazione: condizioni al contorno
NOTA: Prima di impostare la simulazione, sono necessarie condizioni al contorno (BC) specifiche per il paziente. Qui è stato utilizzato lo spostamento estratto dall'angiografia, che viene applicato all'ingresso e all'uscita della simulazione e alla velocità/pressione del flusso sanguigno misurata da pazienti umani e descritta in letteratura39.- Spostamento
- Ripetere i passaggi 1.4 e 2.1, ma scegliendo solo i marcatori distale e prossimale, iniziando con l'immagine angiografica immediatamente precedente la diastole finale. Fallo per tutte le immagini angiografiche su un ciclo cardiaco.
- Adatta le spline di levigatura alle coordinate x, ye z dei due insiemi di punti. Ciò si traduce nello spostamento delle regioni di ingresso e di uscita. I risultati rappresentativi per gli spostamenti dei pazienti sono mostrati nella Figura 6A.
NOTA: L'analisi dello spostamento è stata avviata nell'immagine precedente la diastole finale per abbinare al meglio le fasi tra lo spostamento estratto e i profili di pressione e velocità applicati trovati nella sezione 3.1.2, la cui fase sistolica inizia a 0,1 s (corrispondente alla spaziatura tra le immagini angiografiche). Durante l'estrazione del movimento, assicurarsi che non vi sia alcun movimento di panoramica/immagine della tabella in tutto il set di immagini.
- Velocità/pressione sanguigna
- Creare profili che descrivano la velocità e la pressione pulsatile compilando funzioni definite dall'utente (UDF). Qui sono stati applicati profili transitori misurati da pazienti umani in letteratura 39, modellati come una serie di Fourier, matematicamente descritta da:
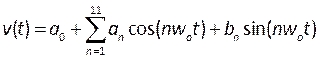 , (5)
, (5)
dove t è il tempo, w0 è la frequenza, T è il periodo del segnale, n è il numero di termini e a0-11, b1-11 sono coefficienti adattati ai profili descritti in letteratura. In questo caso, stiamo usando i primi 11 termini. - Nota : questi profili sono descritti nella Figura 6B e devono essere scritti in un file in formato C in un ambiente di sviluppo integrato come Microsoft Visual Studio. La pressione di uscita è un profilo piatto e la velocità di ingresso viene applicata come un profilo parabolico completamente sviluppato, descritto come sufficiente per riprodurre condizioni realistiche40. L'ulteriore sviluppo di questa procedura potrebbe includere la misurazione della velocità del sangue del paziente (ad esempio mediante ecocardiografia doppler41)e della pressione (utilizzando fili di pressione) come condizioni al contorno più realistiche. Inoltre, misurare contemporaneamente lo spostamento, la velocità del sangue e la pressione garantirebbe che le loro fasi siano accuratamente abbinate.
- Creare profili che descrivano la velocità e la pressione pulsatile compilando funzioni definite dall'utente (UDF). Qui sono stati applicati profili transitori misurati da pazienti umani in letteratura 39, modellati come una serie di Fourier, matematicamente descritta da:
- Spostamento
3. Arteria/strutturale
- Per impostare le proprietà del materiale per l'arteria e il lipide, immettere i dati di ingegneria e aggiungere un nuovo materiale chiamato arteria. Trascinate la densità e il modello Mooney-Rivlin a 5 parametri sul nuovo materiale e impostatene i parametri. Inserire una densità di 1.000 kg/m3 e i coefficienti iperelastici descritti nella Tabella 1,sulla base delle proprietà intima42 e lipidici43 in letteratura. Ripeti questo per il lipide.
NOTA: Il modello Mooney-Rivlin è descritto da44: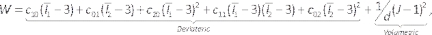 (6)
(6)
Dove c10, c01, c20, c11e c02 sono costanti materiali e d è il parametro di incomprimibilità (zero per materiale incomprimibile in questo caso). Qui Ix è l'invariante xesimo del tensore di deformazione e J è il determinante del gradiente di deformazione elastico. - Immettere il componente del modello, sopprimere il componente lumen/fluido facendo clic con il pulsante destro del mouse su Lumen/Fluido e selezionando Sopprimi (Figura 7A). Assegnare i materiali precedentemente definiti all'arteria e ai solidi lipidici selezionandoli dall'elenco a discesa dei materiali, verificando se le unità sono appropriate.
- La geometria ora deve essere mesh. Fare clic su mesh (Figura 7B), impostare la preferenza fisica su meccanica non lineare e specificare il dimensionamento della mesh. Qui è stata utilizzata la mesh adattiva con una dimensione target di 0,14 mm. Regolare le preferenze della mesh in base alle esigenze per ottenere valori di inclinazione della mesh ragionevoli e mirare ad almeno due o tre elementi della mesh attraverso spazi vuoti come il cappuccio fibroso. La generazione della mesh potrebbe richiedere del tempo a causa della geometria complessa.
NOTA: è necessario condurre uno studio sull'indipendenza delle mesh per garantire che i risultati non siano influenzati dalle caratteristiche della mesh. Ridurre gradualmente le dimensioni delle maglie e confrontare i risultati fino a quando la variazione non è inferiore a un limite impostato; in questo caso, usiamo il 2%45 (misurato al cappuccio fibroso della terza placca). Inoltre, per garantire la qualità della maglia, controllare l'inclinazione della maglia; un'elevata inclinazione delle maglie comporterà difficoltà numeriche durante la convergenza o risultati imprecisi. Per ridurre l'inclinazione, prova a ridurre le dimensioni delle maglie o regola il tasso di crescita, la dimensione massima e/o l'angolo di curvatura. I risultati del nostro test di indipendenza della rete sono delineati nella Tabella 2, con variazione percentuale dei risultati rispetto al dimensionamento della maglia media, che è stato utilizzato in questa analisi. - Fare clic su Impostazioni analisi (Figura 7C). Per le simulazioni FSI, attivare il time stepping off automatico e impostare il numero di sottopassaggi su uno (l'accoppiamento del sistema controllerà i sottopassaggi), impostare il tempo di fine della simulazione, in questo caso 0,8 s (frequenza cardiaca del paziente di 75 bpm). L'accoppiamento del sistema controllerà il tempo e i passaggi secondari.
- Nell'elenco a discesa Controlli risolutore impostare il tipo di risolutore su Programma controllato per utilizzare il metodo diretto o iterativo. I metodi diretti sono più robusti ma utilizzano una quantità significativa di memoria in più. Impostare il metodo Newton-Raphson su completo. (A causa della complessità della geometria e della non linearità nella simulazione, potrebbero essere necessari il metodo diretto e il metodo iterativo newton-raphson completo; tuttavia, questi aumentano significativamente il costo di calcolo.)
- Specificate il dominio di accoppiamento del sistema come parete interna dell'arteria inserendo un'interfaccia fluido-solido. Fatelo facendo clic con il pulsante destro del mouse e inserendo un'interfaccia fluido-solido nella scheda Transitorio (Figura 7D). Selezionare l'interno della parete dell'arteria per l'interfaccia. Questo passerà i dati tra la struttura e il fluido in questa posizione.
- Le condizioni al contorno di spostamento possono essere immesse come funzione di spostamento nella direzione x, ye z applicata all'ingresso e alle uscite. A tale scopo, fare clic con il pulsante destro del mouse nella scheda Transitorio e inserire gli spostamenti (Figura 7E). Duplicate lo spostamento per le direzioni x, ye z. Nell'elenco a discesa Direzione selezionare funzione e copiare gli spostamenti estratti nel passaggio 2.4.1.
NOTA: lo spostamento può essere immesso come funzione o come tabella di punti a seconda delle preferenze. - Per facilitare la risoluzione degli errori, nella scheda Soluzione inserire quattro residui di Newton-Raphson. Questi possono essere visualizzati se si verificano errori per trovare la geometria problematica o le posizioni della mesh.
NOTA: per inserire opzioni di post-elaborazione, ad esempio la sollecitazione principale massima, fare clic con il pulsante destro del mouse sulla scheda Soluzione e inserire i risultati appropriati (Figura 7F).
4. Sangue/fluido
- Accedere alla scheda Modello, controllare le unità e sopprimere l'arteria e la parte lipidica, lasciando il dominio del fluido, in modo simile al passaggio 3.2.
- Specifica le metriche della mesh e genera la mesh, controllando l'inclinazione e regolandola se necessario (abbiamo applicato una dimensione della mesh di 0,14 mm con una dimensione massima della parete di 0,12 mm). È buona norma utilizzare dimensioni e forma delle maglie simili, come avviene nella parte strutturale, sulle aree in cui si verifica l'interazione fluido-solido.
NOTA: come per il passaggio 3.3, è necessario eseguire un test di indipendenza della mesh per garantire che i risultati siano indipendenti dalle proprietà della mesh, come illustrato nella Tabella 2. Controllare la qualità della mesh e regolare le dimensioni dell'elemento, il tasso di crescita, il raffinamento o la curvatura secondo necessità per garantire che l'inclinazione rimanga bassa e che l'indipendenza della mesh sia raggiunta. - Create selezioni denominate per l'ingresso, l'uscita e la parete prima di accedere alla configurazione del fluido, facendo clic con il pulsante destro del mouse sulla rispettiva superficie e selezionando Inserisci selezione denominata .
- Accedere alla scheda Configurazione e assicurarsi che sia abilitata la doppia precisione. Impostare il tipo di Risolutore su Basato sulla pressione e assicurarsi che il Tempo sia impostato su Transitorio selezionando le rispettive caselle di controllo (Figura 8A).
- Abilitare il modello di turbolenza viscosa k-omega e abilitare il trasporto dello sforzo di taglio e le correzioni di Reynolds basse accedendo alla scheda Modelli viscosi (Figura 8B) e selezionando le rispettive caselle di controllo.
- Per abilitare modelli di viscosità non lineare con turbolenza, immettere il comando '/define/models/viscous/turbulence-expert/turb-non-newtonian?' nella console di comando (Figura 8C) e immettere 'yes' quando richiesto.
- In Materiali (Figura 8D), definire le proprietà del sangue inserendo la densità e selezionando la legge di potenza non newtoniana nell'elenco a discesa della viscosità. Fallo rinominando il fluido come sangue, impostando una densità di 1.050 kg / m3e impostando l'indice di coerenza non newtoniano della legge di potenza, k, a 0,035, l'indice della legge di potenza, n, a 0,6.
NOTA: Il modello di viscosità non newtoniana della legge di potenza è stato scelto sulla base della letteratura per descrivere la viscosità del sangue non lineare46, η, in termini di velocità di deformazione del fluido,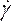 , come:
, come: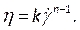 (7)
(7)
Esistono vari modelli di viscosità del sangue non newtoniani per catturare la natura di assottigliamento del taglio del sangue. Diverse pubblicazioni46,47,48, 49 hanno studiato l'efficacia di vari modelli di viscosità e dei loro coefficienti, che dovrebbero essere consultati per ulteriori informazioni nella scelta del modello appropriato. - Compila la nostra funzione definita dall'utente, precedentemente descritta nel passaggio 2.4.2, contenente la velocità e la pressione transitoria del sangue, controllando le righe di comando per eventuali errori (Figura 8C). Ora caricate la FDU entrando nella scheda Definita dall'utente (Figura 8E),selezionando Compilato e navigando nella directory della FDU prima di importarla e cliccando su Compila,e poi su Carica.
NOTA: il testo verrà visualizzato nella console (Figura 8C). Controlla attentamente per assicurarti che non vengano visualizzati errori o avvisi. Se la FDU viene caricata correttamente, i nomi delle FDU verranno visualizzati nella console (evidenziati nella Figura 8C). - Questi possono essere applicati all'ingresso e all'uscita. A tale scopo, selezionare la scheda Condizioni limite. Fate doppio clic su Ingresso (Figura 8F)e scegliete la FDU di ingresso dall'elenco a discesa del profilo. Ripetere questo passaggio per definire anche la pressione di uscita.
- Abilitare la mesh dinamica (selezionando la casella di controllo nella scheda Mesh dinamica mostrata nella Figura 8G), incluse le caselle di controllo Smoothing, Remeshing e 6° di libertà del risolutore, impostando il parametro di diffusione su 1,5 e le scale massime e minime appropriate per la mesh.
- Assicurarsi che le scale mesh massime e minime rientrino nei limiti della zona mesh e che l'inclinazione target sia impostata su 0,7. Le proprietà mesh possono essere visualizzate facendo clic sulla scheda Proprietà mesh.
- Create una nuova zona mesh dinamica facendo clic sul pulsante Crea, specificate la parete del lumen nell'elenco a discesa Regione (Region) e selezionate Accoppiamento sistema (System Coupling). Questa è l'interfaccia per passare i dati alla componente arteria della simulazione.
- Create zone mesh deformanti per il lumen di ingresso, uscita e interno con valori appropriati per la scala mesh. A tale scopo, fate clic su Crea (Create) nella scheda Mesh dinamica (Dynamic Mesh) e selezionate Deformazione (Deforming). Abilitare il remeshing e il smoothing e impostare le scale mesh in base ai limiti di ciascuna zona. Spesso, gli errori negativi del volume delle celle sono associati a questa mesh dinamica, quindi controlla attentamente e regola le scale della mesh, se necessario, per ogni regione.
- Assicurarsi che l'accoppiamento pressione-velocità sia impostato su accoppiato e impostare la formulazione transitoria e gli schemi di discretizzazione spaziale sul secondo ordine entrando nella scheda Metodi (Figura 8H) ed effettuando selezioni dai rispettivi elenchi a discesa.
- Nei controlli (Figura 8H), immettere un numero di courant pari a due e impostare i criteri di convergenza residua nella scheda Monitor (Figura 8I). Abbiamo usato un valore di 1e-5 per la continuità e 1e-6 per il resto.
NOTA: Il numero di Courant può essere stimato in base alla dimensione della maglia, dx,dimensione del passo temporale, dte velocità del sangue, v, utilizzando: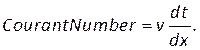 (8)
(8)
Immettere questo numero nella sezione Numero di courant nella scheda Controlli (Figura 8H). Qui applichiamo un numero Courant di due. Il numero di Courant è generalmente inferiore a uno; tuttavia, poiché viene utilizzato il risolutore di pressione-velocità accoppiato con metodi di soluzione implicita, il risultato è intrinsecamente più stabile e meno sensibile a questo valore; quindi, due è considerato accettabile. - Per definire una funzione personalizzata per i risultati, ad esempio LNH (Local Normalized Helicity), selezionare Funzioni di campo personalizzate nella scheda Parametri e personalizzazione (Figura 8J) e inserire una nuova funzione facendo clic con il pulsante destro del mouse e selezionando Nuovo. Utilizzare la finestra popup per definire se necessario. Immettere la formula utilizzando l'elenco a discesa delle variabili del risolutore. Come risultato rappresentativo, usiamo LNH50,51, una misura dell'allineamento tra la velocità, , e
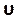 vorticità, ω, vettori, come funzione personalizzata descritta da:
vorticità, ω, vettori, come funzione personalizzata descritta da: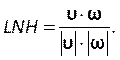 (9)
(9)
NOTA: in questa fase devono essere definite altre variabili personalizzate, come l'indice di taglio oscillatorio (OSI)52,53, una misura dell'inversione del flusso. - Nella scheda Esegui calcolo (Figura 8 KB),impostare il numero di passaggi temporali su 160 (una dimensione del passo di 0,005 s e un tempo di fine di 0,8 s), la dimensione del passo temporale di 5 ms e il numero di iterazioni su 300 per garantire che il risultato sia indipendente dal tempo.
NOTA: a seconda della complessità della simulazione, potrebbero essere necessarie iterazioni maggiori per passaggio. Possono essere necessari cicli cardiaci multipli per una completa convergenza numerica, qualcosa che notiamo come una limitazione; tuttavia, questo è spesso applicato nelle simulazioni di biomeccanica coronarica a causa del costo computazionale associato a queste simulazioni. - Verificare se la casella di controllo Campionamento dati per statistiche temporali è abilitata e assicurarsi che siano selezionate Statistiche parete e Sollecitazioni di taglio del flusso, nonché la funzione personalizzata definita in precedenza.
- Creare l'esportazione dei dati nella scheda Attività di calcolo e salvataggio automatico (Figura 8L), selezionando l'opzione CFD-Post Compatible per la post-elaborazione. Se si desidera elaborare i risultati in un software separato, regolare il tipo di esportazione secondo necessità. Selezionare tutte le regioni (parete, rete interna, ingresso, uscita) e i risultati da esportare.
- Infine, inizializzare la simulazione con lo schema ibrido entrando nella scheda Inizializzazione (Figura 8M), selezionando lo schema Ibrido, cliccando su Impostazioni,e aumentando il numero di iterazioni a 20. Fare clic su Inizializza.
5. Accoppiamento del sistema
- Assicurarsi che sia le configurazioni strutturali che quelle fluide siano collegate all'accoppiamento del sistema e aggiornate. A tale scopo, fate clic e trascinate la configurazione strutturale e fluida sull'accoppiamento del sistema per collegarle, come illustrato nella Figura 9A,assicurandovi che entrambe le configurazioni vengano aggiornate facendo clic con il pulsante destro del mouse e selezionando Aggiorna.
- In System Coupling, impostare l'ora di fine su 0,8 s e la fase temporale su 0,005 s. A tale scopo, selezionare Impostazioni analisi (Figura 9B-1) e immettendo l'ora di fine e la dimensione del passo temporale. Impostare le iterazioni massime su 10.
NOTA: Generalmente, tra 10 e 15 iterazioni è sufficiente se sia i componenti strutturali che quelli fluidi stanno convergendo bene. - Selezionare l'interfaccia a parete e solida rispettivamente dai componenti fluido e strutturale e aggiungere un trasferimento dati tenendo premuto Ctrl e selezionando le due interfacce fluido-struttura (Figura 9B-2); fare clic con il pulsante destro del mouse e creare un trasferimento di dati tra il fluido e i componenti strutturali (Figura 9B-3). Regolare il sotto-rilassamento o la rampa della forza trasferita dal fluido alla struttura per aiutare nella convergenza.
NOTA: a seconda della complessità del modello, delle condizioni al contorno e delle proprietà del materiale, per la convergenza numerica può essere necessaria una rampa di trasferimento dei dati o un sotto-rilassamento. Questi possono essere applicati al trasferimento dei dati del fluido (cioè, la forza trasferita dalla componente fluida alla parete dell'arteria). Queste opzioni sono disponibili all'interno dei trasferimenti di dati creati (Figura 9B-2). - Quando sei pronto per l'esecuzione, fai clic su Aggiorna. I dati di simulazione come la convergenza strutturale e fluida e la rispettiva convergenza del trasferimento dei dati vengono stampati nella console.
NOTA: si noti che le simulazioni FSI sono costose dal punto di vista computazionale, con questa simulazione che richiede 11 giorni su una macchina a 16 core (Intel Xeon Gold a 2,6 GHz che utilizza 180 Gb di memoria fisica (RAM)), con ulteriori variazioni nei tempi di simulazione a seconda della configurazione hardware e della complessità del modello. I residui rappresentativi del trasferimento dei dati sono mostrati nel grafico (Figura 9B-4) e i dati della soluzione vengono stampati nella console (Figura 9B-5). Nelle prime iterazioni, la convergenza dei residui di trasferimento dati potrebbe non essere completamente ottenuta fino a quando non viene raggiunto uno stato di equilibrio. Questo è descritto in modo più dettagliato nella didascalia della Figura 9B. - Al termine della simulazione, i risultati possono essere post-elaborati all'interno del software commerciale o in un software separato, a seconda del tipo di esportazione dei dati descritto nel passaggio 4.19.
Risultati
Vengono presentati risultati rappresentativi sia per i marcatori biomeccanici stabiliti che per quelli emergenti della progressione dell'aterosclerosi. Metriche consolidate come WSS e risultati derivati da WSS (tra cui lo sforzo di taglio della parete mediato nel tempo (TAWSS) e l'indice di taglio oscillatorio (OSI)) sono visualizzate nella Figura 10. Lo stress da taglio della parete durante il ciclo cardiaco è in gran parte guidato dalla velocità del sangue, tuttavia, la geometria dell'ar...
Discussione
L'uso di metodi FSI per analizzare la biomeccanica coronarica è ancora un campo in via di sviluppo sia dal punto di vista della modellazione numerica che dei risultati clinici. Qui abbiamo descritto lo schema di impostazione di un'analisi FSI specifica per il paziente, basata sui metodi degli elementi finiti / volume finito, utilizzando l'OCT e l'imaging angiografico. Mentre il metodo che descriviamo qui utilizza un risolutore commerciale agli elementi finiti, la procedura può essere applicata a qualsiasi software comp...
Divulgazioni
Gli autori non hanno conflitti da dichiarare per quanto riguarda la preparazione di questo articolo. S.J.N. ha ricevuto supporto alla ricerca da AstraZeneca, Amgen, Anthera, Eli Lilly, Esperion, Novartis, Cerenis, The Medicines Company, Resverlogix, InfraReDx, Roche, Sanofi-Regeneron e Liposcience ed è consulente per AstraZeneca, Akcea, Eli Lilly, Anthera, Kowa, Omthera, Merck, Takeda, Resverlogix, Sanofi-Regeneron, CSL Behring, Esperion e Boehringer Ingelheim. P.J.P. ha ricevuto supporto alla ricerca da Abbott Vascular, spese di consulenza da Amgen ed Esperion e onorari di relatori da AstraZeneca, Bayer, Boehringer Ingelheim, Merck Schering-Plough e Pfizer.
Riconoscimenti
Gli autori desiderano riconoscere il supporto fornito dall'Università di Adelaide, dal Royal Adelaide Hospital (RAH) e dal South Australian Health and Medical Research Institute (SAHMRI). Lo studio COCOMO-ACS è uno studio avviato dallo sperimentatore finanziato da sovvenzioni del National Health and Medical Research Council (NHMRC) dell'Australia (ID1127159) e della National Heart Foundation of Australia (ID101370). H.J.C. è supportato da una borsa di studio del Westpac Scholars Trust (Future Leaders Scholarship) e riconosce il sostegno dell'Università di Adelaide, della School of Mechanical Engineering e della borsa di studio del Department of Education, Skills and Employment Research Training Program (RTP). S.J.N. riceve una Principal Research Fellowship dal NHMRC (ID1111630). P.J.P. riceve una Future Leader Fellowship di livello 2 dalla National Heart Foundation of Australia (FLF102056) e una Borsa di studio per lo sviluppo della carriera di livello 2 dall'NHMRC (CDF1161506).
Materiali
| Name | Company | Catalog Number | Comments |
| ANSYS Workbench (version 19.0) | ANSYS | Commercial finite element solver | |
| MATLAB (version 2019b) | Mathworks | Commercial programming platform | |
| MicroDicom/ImageJ | MicroDicom/ImageJ | Open Source DICOM reader | |
| Visual Studio (version 2019) | Microsoft | Commercial Integrated Development Environment |
Riferimenti
- American Heart Association. Cardiovascular disease: A costly burden for America projections through 2035. American Heart Association. , (2017).
- Gheorghe, A., et al. The economic burden of cardiovascular disease and hypertension in low-and middle-income countries: A systematic review. BMC Public Health. 18 (1), 975 (2018).
- Virani, S. S., et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 141 (9), 139 (2020).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56 (2019).
- Cardiovascular diseases (CVDs). World Health Organisation Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2017)
- Calvert, J. W., Willis, M. S., Homeister, J. W., Stone, J. R. . Cellular and Molecular Pathobiology of Cardiovascular Disease. , 79-100 (2014).
- Baumann, A. A. W., Mishra, A., Worthley, M. I., Nelson, A. J., Psaltis, P. J. Management of multivessel coronary artery disease in patients with non-ST-elevation myocardial infarction: a complex path to precision medicine. Therapeutic Advances in Chronic Disease. 11, 1-23 (2020).
- Montarello, N. J., Nelson, A. J., Verjans, J., Nicholls, S. J., Psaltis, P. J. The role of intracoronary imaging in translational research. Cardiovascular Diagnosis and Therapy. 10 (5), 1480-1507 (2020).
- Narula, J., et al. Histopathologic characteristics of atherosclerotic coronary disease and implications of the findings for the invasive and noninvasive detection of vulnerable plaques. Journal of the American College of Cardiology. 61 (10), 1041-1051 (2013).
- Kim, S. -. J., et al. Reproducibility of in vivo measurements for fibrous cap thickness and lipid arc by OCT. JACC: Cardiovascular Imaging. 5 (10), 1072-1074 (2012).
- Prati, F., et al. Relationship between coronary plaque morphology of the left anterior descending artery and 12 months clinical outcome: the CLIMA study. European Heart Journal. 41 (3), 383-391 (2019).
- Nelson, A. J., Ardissino, M., Psaltis, P. Current approach to the diagnosis of atherosclerotic coronary artery disease: more questions than answers. Therapeutic Advances in Chronic Disease. 10, 1-20 (2019).
- Carpenter, H. J., Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. A review on the biomechanics of coronary arteries. International Journal of Engineering Science. 147, (2020).
- Wang, L., et al. Fluid-structure interaction models based on patient-specific IVUS at baseline and follow-up for prediction of coronary plaque progression by morphological and biomechanical factors: A preliminary study. Journal of Biomechanics. 68, 43-50 (2018).
- Shishikura, D., et al. The relationship between segmental wall shear stress and lipid core plaque derived from near-infrared spectroscopy. Atherosclerosis. 275, 68-73 (2018).
- Cameron, J. N., et al. Exploring the relationship between biomechanical stresses and coronary atherosclerosis. Atherosclerosis. 302, 43-51 (2020).
- Giannoglou, G. D., Soulis, J. V., Farmakis, T. M., Farmakis, D. M., Louridas, G. E. Haemodynamic factors and the important role of local low static pressure in coronary wall thickening. International Journal of Cardiology. 86 (1), 27-40 (2002).
- Stone, P. H., et al. Effect of endothelial shear stress on the progression of coronary artery disease, vascular remodeling, and in-stent restenosis in humans: In vivo 6-month follow-up study. Circulation. 108 (4), 438-444 (2003).
- Bourantas Christos, V., et al. Shear stress estimated by quantitative coronary angiography predicts plaques prone to progress and cause events. JACC: Cardiovascular Imaging. 13 (10), 2206-2219 (2020).
- Stone, P. H., et al. Role of low endothelial shear stress and plaque characteristics in the prediction of nonculprit major adverse cardiac events: The PROSPECT study. JACC: Cardiovascular Imaging. 11 (3), 462-471 (2018).
- Arzani, A., Gambaruto, A. M., Chen, G., Shadden, S. C. Wall shear stress exposure time: a Lagrangian measure of near-wall stagnation and concentration in cardiovascular flows. Biomechanics and Modeling in Mechanobiology. 16 (3), 787-803 (2017).
- Hoogendoorn, A., et al. Multidirectional wall shear stress promotes advanced coronary plaque development: comparing five shear stress metrics. Cardiovascular Research. 116 (6), 1136-1146 (2020).
- Chiastra, C., et al. Healthy and diseased coronary bifurcation geometries influence near-wall and intravascular flow: A computational exploration of the hemodynamic risk. Journal of Biomechanics. 58, 79-88 (2017).
- Gallo, D., Steinman, D. A., Bijari, P. B., Morbiducci, U. Helical flow in carotid bifurcation as surrogate marker of exposure to disturbed shear. Journal of Biomechanics. 45 (14), 2398-2404 (2012).
- De Nisco, G., et al. The atheroprotective nature of helical flow in coronary arteries. Annals of Biomedical Engineering. 47 (2), 425-438 (2019).
- De Nisco, G., et al. The impact of helical flow on coronary atherosclerotic plaque development. Atherosclerosis. 300, 39-46 (2020).
- Eslami, P., et al. Effect of wall elasticity on hemodynamics and wall shear stress in patient-specific simulations in the coronary arteries. Journal of Biomechanical Engineering. 142 (2), (2019).
- Malvè, M., García, A., Ohayon, J., Martínez, M. A. Unsteady blood flow and mass transfer of a human left coronary artery bifurcation: FSI vs. CFD. International Communications in Heat and Mass Transfer. 39 (6), 745-751 (2012).
- Chiastra, C., Migliavacca, F., Martínez, M. &. #. 1. 9. 3. ;., Malvè, M. On the necessity of modelling fluid-structure interaction for stented coronary arteries. Journal of the Mechanical Behavior of Biomedical Materials. 34, 217-230 (2014).
- Carpenter, H., Gholipour, A., Ghayesh, M., Zander, A. C., Psaltis, P. In vivo based fluid-structure interaction biomechanics of the left anterior descending coronary artery. Journal of Biomechanical Engineering. 143 (8), (2021).
- Tang, D., et al. 3D MRI-based anisotropic FSI models with cyclic bending for human coronary atherosclerotic plaque mechanical analysis. Journal of Biomechanical Engineering. 131 (6), (2009).
- Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. In vivo based biomechanics of right and left coronary arteries. International Journal of Engineering Science. 154, (2020).
- Pei, X., Wu, B., Li, Z. -. Y. Fatigue crack propagation analysis of plaque rupture. Journal of Biomechanical Engineering. 135 (10), (2013).
- Wang, L., et al. IVUS-based FSI models for human coronary plaque progression study: components, correlation and predictive analysis. Annals of Biomedical Engineering. 43 (1), 107-121 (2015).
- Fan, R., et al. Human coronary plaque wall thickness correlated positively with flow shear stress and negatively with plaque wall stress: an IVUS-based fluid-structure interaction multi-patient study. BioMedical Engineering OnLine. 13 (1), 32 (2014).
- Migliori, S., et al. Application of an OCT-based 3D reconstruction framework to the hemodynamic assessment of an ulcerated coronary artery plaque. Medical Engineering & Physics. 78, 74-81 (2020).
- DIGITIZE07. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/14703-digitize07 (2021)
- interparc. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/34874-interparc (2021)
- Davies Justin, E., et al. Evidence of a dominant backward-propagating "suction" wave responsible for diastolic coronary filling in humans, attenuated in left ventricular hypertrophy. Circulation. 113 (14), 1768-1778 (2006).
- Campbell, I. C., et al. Effect of inlet velocity profiles on patient-specific computational fluid dynamics simulations of the carotid bifurcation. Journal of Biomechanical Engineering. 134 (5), (2012).
- Chang, W. -. T., et al. Ultrasound based assessment of coronary artery flow and coronary flow reserve using the pressure overload model in mice. Journal of Visualized Experiments: JoVE. (98), (2015).
- Holzapfel, G. A., Sommer, G., Gasser, C. T., Regitnig, P. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Versluis, A., Bank, A. J., Douglas, W. H. Fatigue and plaque rupture in myocardial infarction. Journal of Biomechanics. 39 (2), 339-347 (2006).
- ANSYS Inc. ANSYS Academic Research Mechanical, Release 19.0, Mechanical APDL Theory Reference, Structures with Material Nonlinearities, Hyperelasticity, Mooney-Rivlin. ANSYS Inc. , (2019).
- Dong, J., Sun, Z., Inthavong, K., Tu, J. Fluid-structure interaction analysis of the left coronary artery with variable angulation. Computer Methods in Biomechanics and Biomedical Engineering. 18 (14), 1500-1508 (2015).
- Johnston, B. M., Johnston, P. R., Corney, S., Kilpatrick, D. Non-Newtonian blood flow in human right coronary arteries: Steady state simulations. Journal of Biomechanics. 37 (5), 709-720 (2004).
- Abbasian, M., et al. Effects of different non-Newtonian models on unsteady blood flow hemodynamics in patient-specific arterial models with in-vivo validation. Computer Methods and Programs in Biomedicine. 186, (2020).
- Soulis, J. V., et al. Non-Newtonian models for molecular viscosity and wall shear stress in a 3D reconstructed human left coronary artery. Medical Engineering & Physics. 30 (1), 9-19 (2008).
- Liu, B., Tang, D. Influence of non-Newtonian properties of blood on the wall shear stress in human atherosclerotic right coronary arteries. Molecular & Cellular Biomechanics: MCB. 8 (1), (2011).
- Morbiducci, U., Ponzini, R., Grigioni, M., Redaelli, A. Helical flow as fluid dynamic signature for atherogenesis risk in aortocoronary bypass. A numeric study. Journal of Biomechanics. 40 (3), 519-534 (2007).
- Morbiducci, U., et al. In vivo quantification of helical blood flow in human aorta by time-resolved three-dimensional cine phase contrast magnetic resonance imaging. Annals of Biomedical Engineering. 37 (3), (2009).
- Sughimoto, K., et al. Effects of arterial blood flow on walls of the abdominal aorta: Distributions of wall shear stress and oscillatory shear index determined by phase-contrast magnetic resonance imaging. Heart and Vessels. 31 (7), 1168-1175 (2016).
- Ku, D. N., Giddens, D. P., Zarins, C. K., Glagov, S. Pulsatile flow and atherosclerosis in the human carotid bifurcation. Positive correlation between plaque location and low oscillating shear stress. Arteriosclerosis. 5 (3), 293-302 (1985).
- Mazzi, V., et al. Wall shear stress topological skeleton analysis in cardiovascular flows: Methods and applications. Mathematics. 9 (7), 720 (2021).
- Moraes, M. C., Cardenas, D. A. C., Furuie, S. S. Automatic lumen segmentation in IVOCT images using binary morphological reconstruction. BioMedical Engineering OnLine. 12 (1), 78 (2013).
- Akyildiz, A. C., et al. The effects of plaque morphology and material properties on peak cap stress in human coronary arteries. Computer Methods in Biomechanics and Biomedical Engineering. 19 (7), 771-779 (2016).
- Tang, D., et al. Quantifying effects of plaque structure and material properties on stress distributions in human atherosclerotic plaques using 3D FSI models. Journal of Biomechanical Engineering. 127 (7), 1185-1194 (2005).
- Li, J., et al. Multimodality intravascular imaging of high-risk coronary plaque. JACC: Cardiovascular Imaging. , (2021).
- Bourantas Christos, V., et al. Utility of multimodality intravascular imaging and the local hemodynamic forces to predict atherosclerotic disease progression. JACC: Cardiovascular Imaging. 13 (4), 1021-1032 (2020).
- Liao, R., Luc, D., Sun, Y., Kirchberg, K. 3-D reconstruction of the coronary artery tree from multiple views of a rotational X-ray angiography. The International Journal of Cardiovascular Imaging. 26 (7), 733-749 (2010).
- Holzapfel, G. A., Gasser, T. C., Ogden, R. W. A new constitutive framework for arterial wall mechanics and a comparative study of material models. Journal of Elasticity and the Physical Science of Solids. 61 (1), 1-48 (2000).
- Gholipour, A., Ghayesh, M. H., Zander, A., Mahajan, R. Three-dimensional biomechanics of coronary arteries. International Journal of Engineering Science. 130, 93-114 (2018).
- Akyildiz, A. C., et al. Effects of intima stiffness and plaque morphology on peak cap stress. BioMedical Engineering OnLine. 10 (1), 25 (2011).
- Baranger, J., Mertens, L., Villemain, O. Blood flow imaging with ultrafast doppler. Journal of Visualized Experiments: JoVE. (164), (2020).
- Westra, J., et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow feserve: The FAVOR II Europe-Japan study. Journal of the American Heart Association. 7 (14), (2018).
- Torii, R., et al. The impact of plaque type on strut embedment/protrusion and shear stress distribution in bioresorbable scaffold. European Heart Journal - Cardiovascular Imaging. 21 (4), 454-462 (2020).
- Peirlinck, M., et al. Precision medicine in human heart modeling. Biomechanics and Modeling in Mechanobiology. , 1-29 (2021).
- Franke, K. B., et al. Current state-of-play in spontaneous coronary artery dissection. Cardiovascular Diagnosis and Therapy. 9 (3), 281 (2019).
- Alber, M., et al. Integrating machine learning and multiscale modeling-perspectives, challenges, and opportunities in the biological, biomedical, and behavioral sciences. NPJ Digital Medicine. 2 (1), 115 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon