Method Article
Produzione di nanoparticelle lipidiche caricate con siRNA utilizzando un dispositivo microfluidico
In questo articolo
Riepilogo
I metodi di produzione di nanoparticelle lipidiche (LNP) a base microfluidica hanno attirato l'attenzione nei sistemi di somministrazione dei farmaci (DDS), compresa la somministrazione di RNA. Questo protocollo descrive la fabbricazione, la produzione di LNP (LNP caricato con siRNA) e i processi di valutazione LNP utilizzando il nostro dispositivo microfluidico originale denominato iLiNP.
Abstract
Lo sviluppo di nanoparticelle lipidiche funzionali (LNP) è una delle principali sfide nel campo dei sistemi di somministrazione dei farmaci (DDS). Recentemente, i sistemi di rilascio dell'RNA basati su LNP, vale a dire gli LNP caricati con RNA, hanno attirato l'attenzione per la terapia dell'RNA. In particolare, i vaccini LNP caricati con mRNA sono stati approvati per prevenire COVID-19, portando così al cambio di paradigma verso lo sviluppo di nanofarmaci di prossima generazione. Per i nanofarmaci basati su LNP, la dimensione LNP è un fattore significativo nel controllo della biodistribuzione LNP e delle prestazioni LNP. Pertanto, una precisa tecnica di controllo delle dimensioni LNP è indispensabile per il processo di produzione LNP. Qui, riportiamo un protocollo per la produzione di LNP controllata dalle dimensioni utilizzando un dispositivo microfluidico, chiamato iLiNP. Anche gli LNP caricati con siRNA vengono prodotti utilizzando il dispositivo iLiNP e valutati mediante esperimento in vitro . I risultati rappresentativi sono mostrati per la dimensione LNP, inclusi LNP caricati con siRNA, potenziale Z, efficienza di incapsulamento del siRNA, citotossicità e attività di silenziamento genico bersaglio.
Introduzione
La nanoparticella lipidica (LNP) è uno dei nanovettori più utilizzati per i sistemi di rilascio dell'RNA. Recentemente, gli LNP caricati con mRNA sono stati approvati come vaccini per la prevenzione di COVID-191,2,3. In generale, la dimensione di LNP svolge un ruolo cruciale nelle prestazioni dei sistemi di biodistribuzione e somministrazione di farmaci (DDS), compreso il silenziamento genico o l'espressione proteica4,5,6. Pertanto, è necessario un preciso metodo di controllo delle dimensioni LNP per il processo di produzione LNP.
Per la produzione di LNP a grandezza controllata, i dispositivi microfluidici hanno attirato l'attenzione nel corso degli anni7. Nel 2018, il primo LNP caricato di siRNA approvato dalla Food and Drug Administration (FDA) (ad esempio, Onpattro) è stato sviluppato utilizzando il dispositivo microfluidico8,9. Nel metodo di produzione LNP a base microfluidica, una soluzione lipidica e una soluzione acquosa vengono introdotte separatamente nel dispositivo microfluidico e quindi miscelate nel microcanale. Per migliorare l'efficienza di miscelazione, il dispositivo mixer caotico è stato utilizzato per la produzione LNP10,11,12. Il caotico dispositivo mixer consente di produrre LNP di dimensioni specifiche.
Un semplice dispositivo microfluidico, chiamato produzione invasiva di nanoparticelle lipidiche (iLiNP), dotato di strutture deflettoriali, è stato sviluppato per controllare con precisione la dimensione LNP13,14. Rispetto al caotico dispositivo mixer, il dispositivo iLiNP è stato in grado di controllare la dimensione LNP variava da 20 a 100 nm a intervalli di 10 nm. Inoltre, il dispositivo iLiNP produceva LNP6 caricati con siRNA, LNP15 caricati con mRNA, LNP16 caricati con ribonucleoproteine e LNP simili a esosomi17. Lo scopo di questo documento è quello di introdurre il processo di produzione LNP caricato con siRNA del dispositivo iLiNP e descrivere il processo di valutazione LNP prodotto dal dispositivo iLiNP.
Protocollo
1. Fabbricazione del dispositivo iLiNP
NOTA: il dispositivo iLiNP è fabbricato utilizzando il metodo standard di litografia morbida18. Il protocollo di fabbricazione dettagliato è stato riportato in precedenza10,13.
- Fabbricazione di stampi SU-8
- Versare SU-8 3050 su un wafer di silicio da 3 pollici. Spin rivestire il wafer di silicio per ottenere uno strato su-8 di 100 μm di spessore.
- Cuocere il wafer di silicio ponendolo su una piastra elettrica a 65 °C per 5 minuti e 95 °C per 45 minuti.
- Dopo la cottura, posizionare il wafer di silicio sul palco di un sistema di litografia desktop senza maschera.
- Esporre il wafer di silicio alla luce UV a 365 nm per 1,5 s per una posizione.
NOTA: in questo esperimento è stato utilizzato un sistema di litografia desktop senza maschera. Il sistema espone automaticamente la luce UV in un'area di irradiazione divisa (una posizione) del microcanale. - Dopo l'irradiazione UV, cuocere il wafer di silicio sulla piastra elettrica a 65 °C per 1 minuto e 95 °C per 5 minuti.
- Raffreddare il wafer di silicio e quindi immergere in uno sviluppatore SU-8 per 15 minuti per rimuovere SU-8 non esposto.
- Trattare lo stampo SU-8 convapor di Tricloro (1H, 1H, 2H, 2H-perfluoroottil) silano utilizzando un essiccatore e una pompa per vuoto.
- Fabbricazione del dispositivo iLiNP
- Mescolare la base in silicone e l'agente polimerizzante polidimetilsilossano (PDMS) in un rapporto 10:1 (p/p).
- Degassare la miscela utilizzando una pompa per vuoto e un essiccatore.
NOTA: PDMS è stato degassato utilizzando una pompa per vuoto per 10 minuti a temperatura ambiente. - Versare il PDMS degassato sullo stampo SU-8 in una capsula di Petri da 100 mm fino a 0,5-1 cm di spessore, seguito dalla cottura in forno a 80 °C per 1 ora.
- Raffreddare lo stampo, quindi staccare il substrato PDMS dallo stampo SU-8 usando una pinzetta.
- Perforare tre fori (0,5 mm) nel substrato PDMS. Legare il substrato PDMS e un vetrino utilizzando un detergente al plasma di ossigeno per costruire un dispositivo iLiNP (vedere la Figura 1)13.
- Collegare tre capillari PEEK (I.D. 0,3 mm, O.D. 0,5 mm) alle prese e alle uscite del dispositivo iLiNP e polimerizzare con una supercolla.
NOTA: La lunghezza dei capillari PEEK è regolabile e dipende dall'esperimento.
2. Preparazione di soluzioni lipidiche
- Preparare soluzioni lipidiche/etanolo: 13,4 mM 1-palmitoil-2-oleoil-sn-glicero-3-fosfocolina (POPC), 10 mM 1,2-distearoil-sn-glicero-3-fosfocolina (DSPC), 20 mM 1,2-dioleoilossi-3-trimetilammonio propano (DOTAP), 5 mM 1,2-dimiristoil-rac-glicero-3-metossipolietilene glicole-2000 (DMG-PEG2k) e 20 mM di colesterolo. Conservare le soluzioni di riserva a -20 °C prima dell'esperimento.
- Per produrre gli LNP caricati con siRNA, mescolare dotap, DSPC, colesterolo e soluzioni DMG-PEG2k in un rapporto molare di 50/10/38.5/1.5. La concentrazione lipidica totale viene regolata a 8 mM.
3. Preparazione di soluzioni acquose
- Preparare soluzioni acquose: 154 mM NaCl (soluzione salina), tampone di acetato da 25 mM a pH 4,0 utilizzando acqua distillata priva di DNasi/RNasi.
- Filtrare le soluzioni attraverso filtri a membrana di dimensioni 0,2 μm o filtri a siringa.
4. Preparazione della soluzione siRNA/tampone
- Sciogliere 70 μg di siGL4 in 1 mL di tampone di acetato da 25 mM (pH 4,0).
NOTA: siGL4 è usato per il knockdown del gene luciferasi.
5. Configurazione del dispositivo iLiNP e produzione di LNP
NOTA: vedere la Figura 1 per gli schemi.
- Riempire 1 mL di siringhe di vetro con soluzioni lipidiche e acquose (rispettivamente dai passaggi 3.1 e 4.1 nelle singole siringhe).
NOTA: Regolare il volume della soluzione lipidica e acquosa in base alla quantità richiesta per l'esperimento di valutazione LNP. - Collegare le siringhe di vetro ai capillari peek utilizzando i connettori delle siringhe.
- Impostare la portata delle soluzioni lipidiche e acquose.
NOTA: Il rapporto di portata (FRR) della fase acquosa con la fase lipidica è compreso tra 3:1 e 9:1. - Introdurre le soluzioni lipidiche e acquose separatamente nel dispositivo iLiNP utilizzando pompe a siringa.
- Raccogliere le sospensioni LNP in un microtubo dall'uscita del dispositivo iLiNP (Figura 1).
6. Dialisi della sospensione LNP e misurazione delle dimensioni LNP
- Dializzare la sospensione di LNP utilizzando una membrana di dialisi (cutoff 12−14 kDa MW) a 4 °C durante la notte contro soluzione salina o D-PBS per POPC LNP e LNP caricati con siRNA, rispettivamente.
NOTA: POPC non viene sciolto in soluzione salina (vedere 2.1). La soluzione popc/etanolo viene diluita con soluzione salina nel dispositivo iLiNP. - Raccogliere le sospensioni LNP dializzate in microtubi.
- Pipetta 20-30 μL della sospensione LNP in una micro cella al quarzo.
- Misurare la dimensione LNP, la distribuzione delle dimensioni LNP e l'indice di polidispersità mediante diffusione dinamica della luce (DLS).
7. Misurazione del potenziale Z dell'LNP
NOTA: per la misurazione del potenziale Z, è stato utilizzato un analizzatore di particelle (vedere Tabella dei materiali) seguendo le istruzioni del produttore.
- Diluire la sospensione LNP ottenuta dallo stadio 6.1, 35 volte con tampone HEPES da 10 mM (pH 7.4).
- Pipetta da 700 a 1000 μL della sospensione LNP diluita in una cellula capillare.
- Misurare il potenziale Z secondo le istruzioni del produttore.
8. efficienza di incapsulamento del siRNA mediante test RiboGreen
NOTA: Il test Ribogreen viene eseguito per valutare l'incapsulamento del siRNA in LNP19. Il test Ribogreen può misurare la quantità di RNA all'interno e all'esterno di LNP con / senza tensioattivo (ad esempio, TritonX-100).
- Diluire 2 mg/mL di siGL4 con tampone HEPES da 10 mM (pH 7,4) a 500 ng/mL di soluzione siGL4.
- Preparare la serie di diluizione (0, 12.5, 25, 50, 100, 200 ng/mL) della soluzione siGL4 per creare una curva di calibrazione per i campioni Triton (+) e Triton (-).
- Diluire la sospensione LNP 100 volte con tampone HEPES da 10 mM (pH 7,4).
- Mescolare quanto segue per la soluzione tritone (+): 980 μL di 10 mM HEPES (pH 7,4), 20 μL di 10% p/v TritonX-100 e 1,25 μL di RiboGreen per 10 pozzetti di una micropiastra a 96 pozzetti.
- Mescolare quanto segue per la soluzione tritone (-): 1000 μL di 10 mM HEPES (pH 7,4) e 1,25 μL di RiboGreen per 10 pozzetti di una micropiastra a 96 pozzetti.
- Pipetta 100 μL della serie di diluizione della soluzione siGL4 e sospensioni LNP diluite nei pozzetti di una micropiastra nera a 96 pozzetti.
NOTA: la serie di diluizione della soluzione siGL4 e le sospensioni LNP diluite sono state erogate in quattro micro pozzetti per condizione. - Pipettare 100 μL della soluzione di rivelazione (TritonX-100 (+) o Triton (-)) nei pozzetti.
NOTA: la soluzione di rilevamento (TritonX-100 (+)) è stata erogata in due pozzetti per campione per condizione e la soluzione di TritonX-100 (-) è stata erogata nei restanti due pozzetti per condizione del campione. - Incubare la micropiastra per 5 minuti a temperatura ambiente.
- Misurare l'intensità di fluorescenza utilizzando un lettore di micropiastre a una lunghezza d'onda di 475 nm.
- Calcolare l'efficienza di incapsulamento del siRNA dalla seguente equazione19.
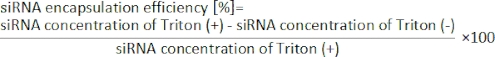
9. Coltura cellulare
- Preparare un terreno di crescita contenente DMEM, FBS al 10% inattivato dal calore, penicillina da 100 U / mL, streptomicina da 100 μg / mL e 400 μg / mL G418.
- Coltiva cellule HeLa che esprimono stabilmente lucciola e Renilla luciferasi (HeLa-dluc) in una capsula di coltura cellulare da 100 mm trattata tc contenente il terreno di crescita a 37 °C in un incubatore a CO2 al 5%.
10. Saggio di vitalità cellulare
- Seme 100 μL di una sospensione di cellule HeLa nel mezzo di crescita (6 x 103 cellule/pozzetto) in una micropiastra a 96 pozzetti.
NOTA: Le cellule sono state contate utilizzando una piastra contacellulare e un microscopio. - Incubare la micropiastra per 24 ore a 37 °C in un incubatore a CO2 al 5%.
- Diluire gli LNP caricati con siRNA con DMEM (FBS (-)) alle concentrazioni di 10 e 100 nM siRNA.
- Erogare 100 μL della sospensione LNP diluita caricata con siRNA per pozzetto.
- Incubare la micropiastra per 4 ore a 37 °C in un incubatore a CO2 al 5%.
- Rimuovere la sospensione LNP e aggiungere 100 μL di DMEM (FBS (+)).
- Incubare la micropiastra per 20 ore a 37 °C in un incubatore a CO2 al 5%.
- Misurare la vitalità della cella utilizzando un kit disponibile in commercio secondo il protocollo del produttore.
NOTA: D-PBS (-) è stato utilizzato come controllo negativo.
11. Test di knockdown del gene luciferasi
- Seme 75 μL di una sospensione di cellule HeLa nel mezzo di crescita (4,5 x 103 cellule/pozzetto) in una micropiastra a 96 pozzetti.
- Incubare la micropiastra per 24 ore a 37 °C in un incubatore a CO2 al 5%.
- Diluire gli LNP caricati con siRNA con DMEM (FBS (-)) alle concentrazioni di 10 e 100 nM siRNA.
- Erogare 75 μL della sospensione LNP diluita caricata con siRNA per un pozzetto.
- Incubare la micropiastra per 4 ore a 37 °C in un incubatore a CO2 al 5%.
- Rimuovere la sospensione LNP e aggiungere 75 μL di DMEM (FBS (+)).
- Incubare la micropiastra per 20 ore a 37 °C in un incubatore a CO2 al 5%.
- Misurare l'espressione della luciferasi utilizzando un kit disponibile in commercio secondo il protocollo del produttore.
NOTA: abbiamo usato D-PBS (-) come controllo negativo.
Risultati
La figura 2A,B mostra la distribuzione dimensionale POPC LNP prodotta in diverse condizioni di flusso. Il metodo di preparazione LNP basato su microfluidica può controllare le dimensioni degli LNP in base alle condizioni di flusso come la portata totale (TFR) e l'FRR. Rispetto ai tipici dispositivi microfluidici, tra cui il dispositivo mixer caotico e il dispositivo microfluidico di messa a fuoco del flusso, il dispositivo iLiNP ha consentito un controllo preciso delle dimensioni LNP che va da 20 a 100 nm (Figura 2). Gli LNP di piccole dimensioni si sono formati in condizioni di portata totale elevata. Inoltre, le dimensioni LNP formate al FRR di 5 erano inferiori a quelle del FRR di 3, indipendentemente dalla portata totale13.
Anche gli LNP caricati con siRNA sono stati preparati utilizzando il dispositivo iLiNP (Figura 3A). Per la preparazione LNP caricata con siRNA, DOTAP, un lipide cationico, è stato utilizzato per incapsulare efficacemente il siRNA negli LNP. Il dispositivo iLiNP ha prodotto LNP cationici caricati con siRNA di dimensioni 90 nm con distribuzione ristretta (Figura 3A, B). L'efficienza di incapsulamento del siRNA è stata del 95% a causa dell'interazione elettrostatica tra il lipide cationico e i siRNA caricati negativamente (Figura 3C).
La citotossicità e l'attività di silenziamento genico di LNP caricati con siRNA di dimensioni 90 nm sono state valutate come mostrato in Figura 4 e Figura 5. Gli LNP caricati con siRNA hanno mostrato citotossicità alla dose di 10 e 100 nM siRNA. Abbiamo anche confermato che il livello di espressione della luciferasi era diminuito a seconda della concentrazione di siRNA. Gli LNP caricati con siRNA hanno soppresso l'espressione dell'80% di luciferasi alla dose di 100 nM siRNA. L'effetto della dimensione LNP sull'attività di silenziamento genico è stato riportato in precedenza6,13,17.
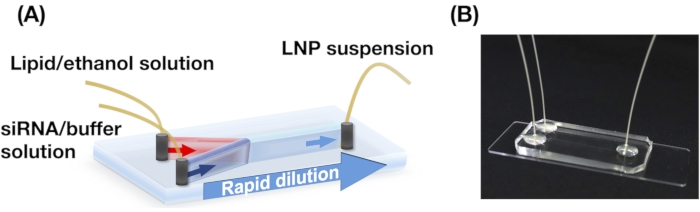
Figura 1: (A) Illustrazione schematica e (B) fotografia del dispositivo iLiNP. Il dispositivo iLiNP comprende PDMS e substrati di vetro. Il dispositivo iLiNP è collegato ai capillari PEEK con una supercolla. Le soluzioni lipidiche e siRNA/tampone vengono introdotte separatamente nel dispositivo iLiNP utilizzando pompe a siringa. La sospensione LNP viene raccolta in un microtubo. Fare clic qui per visualizzare una versione più grande di questa figura.
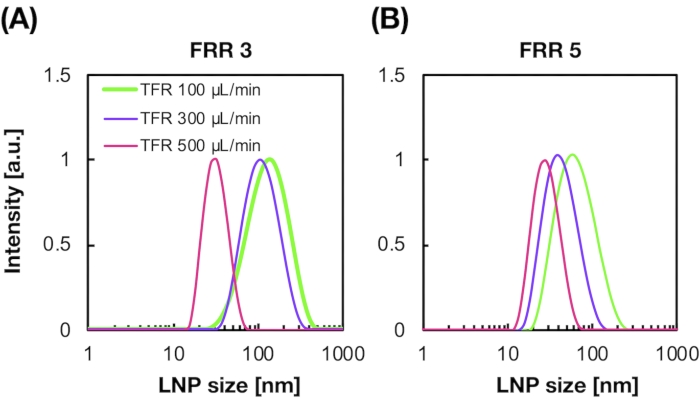
Figura 2: Distribuzioni dimensionali POPC LNP prodotte dal dispositivo iLiNP ai diversi rapporti di portata (FRR). La dimensione POPC LNP viene misurata mediante diffusione dinamica della luce (DLS). Gli LNP POPC vengono preparati modificando la portata totale e l'FRR: (A) 3 FRR e (B) 5 FRR. Gli LNP di piccole dimensioni si formano in condizioni di portata totale elevata. Inoltre, le dimensioni LNP formate al FRR di 5 erano più piccole di quelle al FRR di 3. Fare clic qui per visualizzare una versione più grande di questa figura.
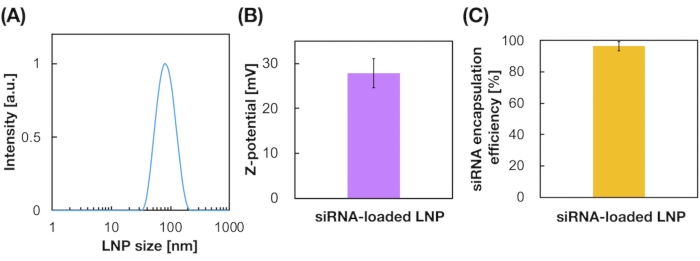
Figura 3: Caratterizzazione degli LNP caricati con siRNA. (A) Distribuzione dimensionale degli LNP caricati con siRNA. I siRNA (siGL4) sono incapsulati negli LNP dall'interazione elettrostatica tra il lipide cationico (DOTAP) e i siRNA caricati negativamente. (B) Potenziale Z dei LNP caricati con siRNA. La sospensione LNP è stata diluita con tampone HEPES da 10 mM (pH 7,4) prima della misurazione. I dati sono rappresentati come ± SD (Deviazione Standard). n = 3. (C) efficienza di incapsulamento del siRNA dei LNP basati su DOTAP. L'efficienza di incapsulamento è stata determinata dal test RiboGreen. I dati sono rappresentati come ± SD. n = 3. Fare clic qui per visualizzare una versione più grande di questa figura.
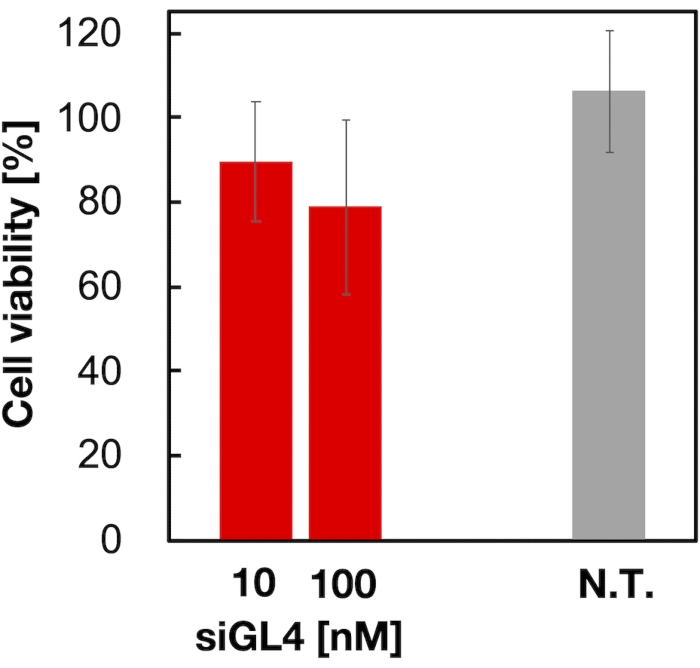
Figura 4: Citotossicità degli LNP caricati con siRNA. Gli LNP caricati con siRNA sono stati diluiti con DMEM (FBS (-)) per ottenere le concentrazioni di siGL4 di 10 e 100 nM. Le sospensioni LNP vengono aggiunte alle cellule HeLa-dLuc e incubate per 4 ore a 37 °C in un incubatore a CO2 al 5%. N.T.: Non trattati (D-PBS(-)). I dati sono rappresentati come la media ± SD. n = 3. Fare clic qui per visualizzare una versione più grande di questa figura.
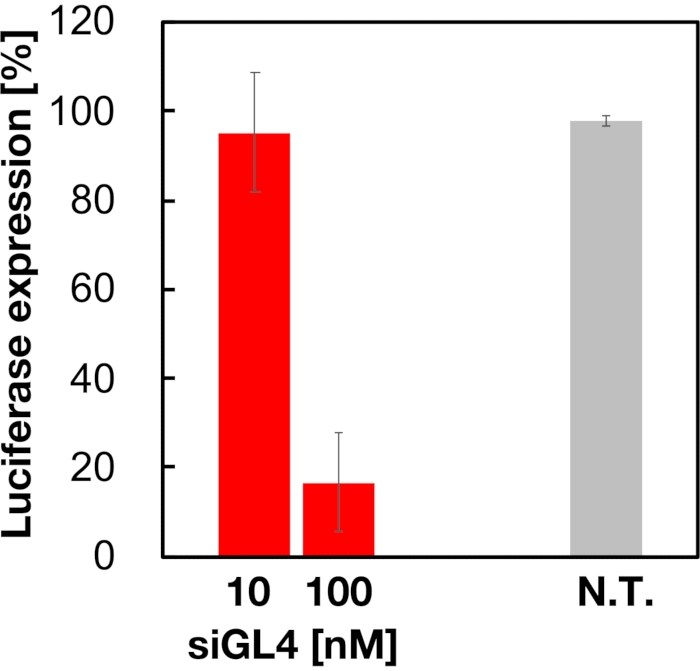
Figura 5: Attività di knockdown del gene luciferasi trattata con LNP caricati con siRNA. Gli LNP caricati con siRNA sono preparati allo stesso modo del test di vitalità cellulare. Il livello di espressione della luciferasi viene misurato utilizzando il sistema di analisi dual-glo luciferasi. N.T.: Non trattati (D-PBS(-)). I dati sono rappresentati come ± SD. n = 3. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La dimensione LNP influenza la biodistribuzione LNP, l'effetto antitumorale e le prestazioni di silenziamento genico. Pertanto, il metodo di controllo delle dimensioni LNP è una tecnica significativa per la produzione di nanofarmaci DDS, compresi i sistemi di rilascio dell'RNA. Lo scopo di questo documento è quello di introdurre il dispositivo iLiNP per la regolazione precisa delle dimensioni degli LNP e la sua applicazione alla produzione di LNP caricati con siRNA. Il dispositivo iLiNP è stato in grado di controllare la dimensione LNP compresa tra 20 e 100 nm (Figura 2)13. Quando le condizioni di flusso, come la portata totale e l'FRR vengono modificate per controllare la dimensione LNP, la sospensione LNP deve essere raccolta dopo circa 5-10 s per stabilizzare il flusso della soluzione. La sospensione LNP raccolta dall'uscita del dispositivo iLiNP è stata dializzata immediatamente contro la soluzione tampone per rimuovere l'etanolo e prevenire l'aggregazione LNP.
Il controllo delle dimensioni LNP è una delle principali sfide nel campo del DDS. Generalmente, il processo di produzione LNP convenzionale, come il metodo di idratazione del film lipidico, richiede un processo di regolazione delle dimensioni dopo la produzione LNP20. D'altra parte, il metodo di produzione LNP a base microfluidica può produrre LNP a dimensione controllata introducendo le soluzioni lipidiche e acquose nel dispositivo microfluidico6,11,13. Sebbene il processo di dialisi sia necessario per rimuovere l'etanolo dalla sospensione LNP, un processo continuo da parte del dispositivo microfluidico accoppiato con il sistema a flusso tangenziale promette l'automazione del processo di produzione LNP14. Secondo la letteratura, le dimensioni POPC LNP erano 50-60 nm e 30-60 nm, rispettivamente per il dispositivo microfluidico di messa a fuoco del flusso21 e il dispositivo mixer caotico10. Rispetto ad altri dispositivi microfluidici, il dispositivo iLiNP consente il controllo delle dimensioni LNP POPC in un ampio intervallo da 20 a 100 nm.
Il processo di fabbricazione del dispositivo iLiNP impiegato era la litografia morbida standard. Pertanto, il dispositivo iLiNP può essere prodotto in serie mediante tecnica di prototipazione rapida e prevenire la contaminazione incrociata delle soluzioni utilizzando un dispositivo monouso. Il dispositivo iLiNP può produrre LNP caricati con siRNA allo stesso modo del metodo di produzione POPC LNP. Per il metodo di produzione LNP che utilizza il dispositivo iLiNP, l'utente non richiede procedure complicate. Per questi motivi, il metodo di produzione LNP basato su microfluidico, incluso il dispositivo iLiNP, dovrebbe essere utilizzato come metodo di produzione LNP standard. Il protocollo di questo documento può essere adattato ad altri dispositivi microfluidici per la produzione di LNP. Inoltre, la produzione di LNP caricati con mRNA è abilitata anche cambiando la soluzione siRNA/buffer in una soluzione tampone contenente mRNA.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato da JST, CREST Grant Number JPMJCR17H1, Giappone, JST, PRESTO Grant Number JPMJPR19K8, Giappone, JST, SCORE, Giappone, le spese speciali per l'istruzione e la ricerca del Ministero dell'Istruzione, della Cultura, dello Sport, della Scienza e della Tecnologia, JSPS KAKENHI Grant Number JP19KK0140 e Iketani Science and Technology Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
Riferimenti
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon