È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un test cellulare basato su reporter per il monitoraggio dell'efficienza di giunzione
In questo articolo
Riepilogo
Questo protocollo descrive un minigene reporter assay per monitorare l'impatto delle mutazioni del sito di giunzione 5'-splicing sullo splicing e sviluppa snRNA U1 soppressore per il salvataggio dell'inibizione dello splicing indotta da mutazioni. I costrutti di snRNA U1 reporter e soppressore sono espressi in cellule HeLa e lo splicing viene analizzato mediante estensione di primer o RT-PCR.
Abstract
Durante l'espressione genica, la fase vitale dello splicing pre-mRNA comporta un riconoscimento accurato dei siti di giunzione e un assemblaggio efficiente di complessi spliceosomiali per unire gli esoni e rimuovere gli introni prima dell'esportazione citoplasmatica dell'mRNA maturo. L'efficienza dello splicing può essere alterata dalla presenza di mutazioni nei siti di giunzione, dall'influenza di fattori di splicing trans-agenti o dall'attività terapeutica. Qui, descriviamo il protocollo per un test cellulare che può essere applicato per monitorare l'efficienza di giunzione di un dato esone. Il test utilizza un reporter minigene plasmidico codificato plasmidico 3-esone/2-introne adattabile, che può essere espresso in cellule di mammifero mediante trasfezione transitoria. Dopo la trasfezione, l'RNA cellulare totale viene isolato e l'efficienza dello splicing dell'esone nell'mRNA reporter è determinata dall'estensione del primer o dalla reazione a catena semi-quantitativa della trascrittasi-polimerasi inversa (RT-PCR). Descriviamo come l'impatto delle mutazioni del sito di giunzione 5′ associate alla malattia può essere determinato introducendole nel reporter; e come la soppressione di queste mutazioni può essere ottenuta mediante co-trasfezione con il piccolo costrutto di RNA nucleare U1 (snRNA) che porta mutazioni compensatorie nella sua regione 5′ che le parti base con i siti di giunzione 5′-giunzione alle giunzioni esone-introne nei pre-mRNA. Pertanto, il reporter può essere utilizzato per la progettazione di particelle U1 terapeutiche per migliorare il riconoscimento dei siti di giunzione 5′ mutanti. L'inserimento di siti regolatori ad azione cis, come il potenziatore di splicing o le sequenze di silenziatori, nel reporter può anche essere utilizzato per esaminare il ruolo dell'U1 snRNP nella regolazione mediata da uno specifico fattore di splicing alternativo. Infine, le cellule che esprimono reporter possono essere incubate con piccole molecole per determinare l'effetto di potenziali terapie sullo splicing costitutivo pre-mRNA o su esoni portatori di siti di giunzione 5′ mutanti. Nel complesso, il test reporter può essere applicato per monitorare l'efficienza dello splicing in una varietà di condizioni per studiare i meccanismi fondamentali di splicing e le malattie associate allo splicing.
Introduzione
Lo splicing pre-mRNA è una fase di elaborazione essenziale che rimuove gli introni non codificanti e lega precisamente gli esoni codificanti per formare mRNA maturo. Il riconoscimento delle sequenze di consenso alle giunzioni esone-introne, denominate sito di giunzione 5′ e sito di giunzione 3′, da parte dei componenti del macchinario di giunzione avvia il processo di giunzione. La piccola ribonucleoproteina nucleare U1 (snRNP) riconosce il sito di giunzione 5′ mediante accoppiamento di basi dello snRNA U1 al pre-mRNA1. Le mutazioni geneticamente ereditate che alterano le sequenze del sito di giunzione 5′ sono associate a molte malattie2,3. Si prevede che la perdita di basepairing di SnRNA U1 con i siti mutanti di giunzione 5′ causi uno splicing aberrante, che può compromettere la traduzione del trascritto interessato. Un potenziale approccio terapeutico per correggere i difetti di splicing comporta la soppressione delle mutazioni da parte di snRNA U1 modificato che trasporta cambiamenti nucleotidici compensatori nella sua regione 5′ che le parti base con il sito di giunzione 5′. Tali snRNA U1 modificati, noti anche come snRNA U1 specifici dell'esone, sono risultati efficaci nell'invertire i difetti di splicing, con conseguente aumento dell'espressione proteica dall'mRNA salvato4,5,6,7,8.
Qui, descriviamo il test di complementazione U1 snRNP, un test di splicing cellulare basato su reporter che consente di valutare l'effetto delle mutazioni 5′-ss sullo splicing di un esone e può anche essere utilizzato per lo sviluppo di snRNA U1 modificati per consentire il salvataggio dell'inclusione di esoni. Forniamo anche protocolli per il monitoraggio delle trascrizioni del reporter spliced tramite estensione primer e RT-PCR e per determinare l'espressione di snRNA U1 modificati mediante estensione primer e RT-qPCR.
Protocollo
1. Reagenti e tamponi
NOTA: tutta la sterilizzazione con filtri a vuoto deve essere eseguita con membrana di polietersolfone (PES) da 0,2 μm in un armadio di biosicurezza.
- Preparare acqua priva di RNasi aggiungendo 1,0 ml di dietilpirocarbonato (DEPC) a 1,0 L di acqua deionizzata, mescolare per almeno 1 ora a temperatura ambiente (RT), autoclave due volte e quindi raffreddare a RT prima dell'uso.
- Preparare Dulbecco's Modified Eagle Medium (DMEM) mescolando un pacchetto di polvere DMEM (13,4 g), 3,7 g di bicarbonato di sodio, 100 ml di siero bovino fetale (FBS), penicillina e streptomicina a ~ 800 ml di acqua deionizzata sterile. La concentrazione finale di penicillina e streptomicina nel DMEM deve essere rispettivamente di 50 U/mL e 50 μg/mL. Regolare il pH a 7,4 e quindi portare il volume a 1,0 L con acqua deionizzata sterile. Sterilizzare per filtrazione e conservare a 4 °C.
- Preparare 10x soluzione salina tamponata con fosfato (10x PBS) aggiungendo 25,6 g di idrogeno eptaidrato disodico (Na2HPO4· 7H2O), 2 g di potassio diidrogeno fosfato (KH2PO4), 2 g di cloruro di potassio (KCl) e 80 g di cloruro di sodio (NaCl) a 800 ml di acqua deionizzata. Mescolare per sciogliere e portare il volume a 1,0 L. Sterilizzare per filtrazione e conservare a 4 °C.
- Preparare 0,5 M di etilene diammina acido tetra-acetico (EDTA) sciogliendo 186,1 g di Na2•EDTA•2H2O in ~800 mL di acqua deionizzata. Regolare il pH a 8,0 e quindi portare il volume a 1,0 L con acqua deionizzata sterile. Sterilizzare per filtrazione e conservare a 4 °C.
- Preparare 1 soluzione di tripsina-EDTA mescolando 100 mL di 10x tripsina (2,5%), 2 mL di 0,5 M EDTA e aggiungere 1x PBS fino a 1,0 L. Sterilizzare mediante filtrazione e aliquota in tubi conici da 50 mL. Conservare a 4 °C per 1-2 settimane o congelare a -20 °C per un uso a lungo termine.
- Preparare 2x formamide DNA/RNA loading dye mescolando 14,4 mL di formamide e 0,6 mL di 0,5 M EDTA per un volume finale di 15 mL. Aggiungere il blu di bromofenolo e la polvere di xilene cianolo ad una concentrazione finale dello 0,02% e conservare a 4 °C.
NOTA: La formammide è tossica e corrosiva. Leggere le schede di sicurezza dei materiali per ulteriori raccomandazioni di sicurezza. - Preparare 5 tamponi Tris/Borato/EDTA (5x TBE) mescolando 54,0 g di tris base, 27,5 g di acido borico e 20 ml di 0,5 M edTA in ~800 mL di acqua deionizzata. Mescolare per sciogliere e portare il volume a 1,0 L con acqua deionizzata.
- Preparare la soluzione di elettroforesi su gel di urea-poliacrilammide (urea-PAGE) mescolando 200 mL di 5x TBE, 250 mL di 40% 19:1 bis/acrilammide e 450,5 g di urea. Quindi aggiungere acqua deionizzata fino a 1,0 L. Mescolare fino a quando gli ingredienti sono completamente sciolti, quindi sterilizzare per filtrazione e conservare a 4 °C in una bottiglia di vetro ambrato.
NOTA: Bis/acrilammide è tossico. Leggere le schede di sicurezza dei materiali per ulteriori procedure di sicurezza. - Preparare il 10% di persolfato di ammonio (APS) sciogliendo 1 g di APS in 10 ml di acqua deionizzata e conservare a 4 °C.
2. Cotrasfezione di cellule HeLa con il reporter e plasmidi snRNA U1
NOTA: La trasfezione delle cellule Hela deve essere eseguita in condizioni sterili in un armadio di sicurezza biologica. La superficie esterna di tutti i materiali deve essere spruzzata con etanolo al 70% prima di essere introdotta nell'armadio di sicurezza biologica.
- Mantenere le cellule Hela in DMEM in un incubatore a 37 °C con il 5% di CO2 passando ogni 2-3 giorni quando le cellule sono confluenti all'80-90%.
- Per il passaggio delle cellule HeLa, aspirare il mezzo esaurito e quindi incubare le cellule con 3 ml di tripsina allo 0,25% contenente 1 mM di EDTA a 37 °C per 3 minuti.
- Dopo l'incubazione, aggiungere 7 ml di DMEM fresco. Trasferire la sospensione cellulare in un tubo da 10 ml, centrifugare a 1.000 x g per 5 min.
- Risospesso il pellet cellulare in 10 ml di DMEM fresco, quindi piallare le cellule su un nuovo piatto di coltura tissutale al 20% di confluenza.
- Per le trasfezioni transitorie, contare le cellule Hela con un vetrino emocitometrico pulito e preparare una sospensione con una densità di 2,5 x 105 cellule/mL.
- Seminare 1,0 mL di 2,5 x 105 cellule/mL di sospensione di cellule Hela in ciascun pozzetto di una piastra a 12 pozzetti e incubare durante la notte a 37 °C.
- Il giorno successivo, aspirare il mezzo speso e aggiungere 0,8 ml di DMEM fresco con siero.
- Preparare la soluzione I aggiungendo 0,2 μg di plasmide reporter Dup51 o Dup51p, 1,8 μg di pcDNA, pNS6U1 o pNS6U1-5a plasmide e 100 μL di mezzo di trasfezione in un nuovo tubo microcentrifuga da 1,5 mL.
- Preparare una miscela principale di Soluzione II per tutti i campioni da trasfettare aggiungendo 100 μL di mezzo di trasfezione e 4,0 μL di reagente di trasfezione per campione.
- Preparare la miscela di trasfezione aggiungendo 100 μL di Soluzione II in ogni tubo microcentrifuga contenente Soluzione I.
- Vortice le miscele di trasfezione per 15 s, centrifuga in una microcentrifuga da tavolo a 3.000 x g per 10 s a RT, e poi incubare a RT per 5 min.
- Aggiungere tutti i 200 μL della miscela di trasfezione in un pozzetto della piastra cellulare HeLa a 12 pozzetti per ottenere un volume finale di 1,0 ml per pozzetto e incubare la piastra a 37 °C per 48 ore.
- Dopo l'incubazione, estrarre l'RNA dalle cellule HeLa trasfettate con guanidina tiocianato e soluzione fenolica disponibili in commercio.
NOTA: Questo reagente contiene fenolo e questo passaggio deve essere eseguito in una cappa aspirante. L'uso di acqua trattata DEPC è raccomandato per la risospensione dell'RNA estratto.- Aspirare il mezzo esaurito e aggiungere 500 μL del reagente in ciascun pozzetto. Incubare a RT per 5 min.
- Omogeneizzare mediante pipettaggio su e giù. Quindi trasferire la soluzione in un nuovo tubo microcentrifuga da 1,5 ml.
- Aggiungere 100 μL di cloroformio e vortice per 15 s.
- Centrifuga a 12.000 x g per 15 min a RT.
- Trasferire 200 μL dello strato acquoso superiore contenente RNA in un nuovo tubo microcentrifuga da 1,5 mL.
- Aggiungere 2 μg di glicogeno e 200 μL di isopropanolo a ciascun campione di RNA. Mescolare invertendo i tubi.
- Raccogliere l'RNA precipitato per centrifugazione a 12.000 x g per 10 minuti a 4 °C.
- Rimuovere ed eliminare il surnatante senza disturbare il pellet di RNA.
- Lavare il pellet due volte aggiungendo 1,0 ml di etanolo al 70%, invertendo i tubi e centrifugando come descritto nel passaggio 2.13.7.
- Asciugare all'aria il pellet per ~ 10-20 minuti a RT e risospesciare l'RNA in 10-20 μL di acqua priva di RNasi.
- Determinare la concentrazione di RNA misurando l'assorbanza a 260 nm come descritto da Desjardins e Conklin9.
- Procedere con l'estensione del primer o conservare i campioni di RNA a -20 °C. L'RNA isolato può essere conservato a -20 °C per 6-12 mesi.
3. Etichettatura 32P degli oligonucleotidi
NOTA: Le fasi che comportano l'uso di oligonucleotidi marcati con 32P-ATP e 32P devono essere eseguite dietro uno scudo acrilico da persone addestrate con l'approvazione di entità istituzionali autorizzate. Il protocollo descritto di seguito può essere utilizzato per l'etichettatura di oligonucleotidi, Dup3r e U17-26-R, e marcatori per urea-PAGE. L'uso di acqua trattata DEPC è raccomandato per la risospensione degli oligonucleotidi e delle perle di esclusione delle dimensioni.
- In un tubo microcentrifuga da 1,5 mL, aggiungere oligonucleotide, T4 polinucleotide chinasi (T4 PNK), T4 PNK buffer e 32P-ATP come descritto nella Tabella 1. Aggiungere 32P-ATP per ultimo alla miscela; Questo è importante.
NOTA: per l'aggiunta di soluzioni radioattive, si consiglia l'uso di punte filtranti. - Incubare a bagnomaria a 37 °C per 30 min.
- Mentre le reazioni di marcatura sono in incubazione, risospese le perle di esclusione dimensionale con un peso molecolare di 25 kDa tagliato delicatamente vorticosamente per ~ 10 s.
NOTA: le perle di esclusione delle dimensioni devono essere preparate secondo le istruzioni del produttore e conservate come sospensione al 50% in etanolo al 25% a 4 °C. - Preparare le colonne trasferendo 600 μL delle perline risospese in una mini colonna monouso posta in un tubo di raccolta da 1,5 ml e riportando il materiale perline a 4 °C.
- Centrifugare a 2.000 x g per 1 minuto a RT ed eliminare il flusso attraverso.
- Lavare le perline aggiungendo 300 μL di acqua priva di RNasi alla colonna.
- Ripetere i passaggi 3.5. e 3.6. due volte e trasferire la minicolonna in un nuovo tubo centrifuga da 1,5 ml.
- Aggiungere la miscela di reazione chinasica alla colonna di perline di esclusione delle dimensioni e centrifugare a 5000 x g per 1 minuto a RT.
- Raccogli e salva il flusso attraverso, che ha l'oligonucleotide marcato 32P, e scarta tutte le punte e i tubi in una scatola di rifiuti acrilica.
- Aggiungere 20 μL di acqua priva di RNasi per diluire l'oligonucleotide marcato con 32P ad una concentrazione finale di 2,5 μM.
NOTA: Diluire i marcatori etichettati secondo necessità per il caricamento su gel di urea-PAGE. - Conservare l'oligonucleotide etichettato in una scatola di microtubi acrilici a -20 °C o procedere con l'analisi di estensione del primer.
4. Analisi delle trascrizioni del reporter giunte per estensione del primer
NOTA: Si consiglia di pulire superfici e apparecchiature con un reagente inattivante RNasi prima dell'uso.
- Aggiungere 2,0 μg di RNA estratto dalle cellule Hela in tubi microcentrifuga separati da 200 μL e aggiungere acqua priva di RNasi per aumentare il volume a 6,55 μL.
- Preparare master mix I con i 32P-Dup3r e dNTP diluiti come mostrato nella Tabella 2 e aggiungere 0,9 μL della miscela a ciascun tubo PCR contenente campioni di RNA.
- Incubare i tubi, prima a 65 °C per 5 min e poi sul ghiaccio per 1 min.
- Preparare Master Mix II con 5x First Strand Buffer, ditiotreitolo (DTT), inibitore della RNasi e trascrittasi inversa come mostrato nella Tabella 2.
- Aggiungere 2,55 μL della miscela a ciascun tubo contenente RNA e Master Mix 1; il volume totale della reazione deve essere di 10 μL. Tenere i tubi a RT per 10 minuti.
- Trasferire i tubi in un bagno secco o in un ciclo termico e incubare, prima a 50 °C per 60 minuti e poi a 70 °C per 15 minuti.
- Dopo l'incubazione, aggiungere 10 μL di colorante di carico di RNA 2x formamide a ciascun campione e conservare in una scatola acrilica a -20 °C o procedere con la separazione dei frammenti mediante urea-PAGE utilizzando un gel lungo 14 cm e la visualizzazione dell'immagine del gel come descritto di seguito nel passaggio 8.
- Eseguire la scansione densitometrica dell'immagine del gel con un software di analisi delle immagini e utilizzare le intensità di banda dei prodotti inclusi e saltati per calcolare la percentuale di inclusione dell'esone 2 come mostrato di seguito.

5. Analisi delle trascrizioni del reporter giunte mediante RT-PCR fluorescente
NOTA: L'analisi RT-PCR descritta di seguito utilizza esameri casuali per la sintesi del cDNA e una combinazione di oligonucleotidi Dup8f e Dup3r marcati con Cy5 non etichettati per l'amplificazione PCR dei prodotti spliced.
- Per la sintesi del cDNA, aggiungere 2,0 μg di RNA estratto dalle cellule Hela trasfettate in tubi microcentrifuga separati da 200 μL e aggiungere acqua priva di RNasi per portare il volume a 11,0 μL.
- Preparare il Master Mix I, contenente esameri casuali e dNTP come mostrato nella Tabella 3 e aggiungere 2,0 μL della miscela a ciascun campione. Incubare, prima a 65 °C per 5 minuti poi sul ghiaccio per 1 min.
- Preparare Master Mix II, contenente First Strand Buffer, inibitore della RNasi, DTT e trascrittasi inversa come mostrato nella Tabella 3 e aggiungere 7,0 μL della miscela a ciascun tubo contenente RNA e Master Mix I.
- Tenere i tubi a RT per 10 minuti, quindi incubare a 50 °C per 60 minuti e 70 °C per 15 minuti.
NOTA: le reazioni al cDNA completate possono essere conservate a -20 °C. - Per la PCR, trasferire 1,0 μL (100 ng/μL) di ciascun campione di cDNA a nuovi tubi PCR.
- Preparare una miscela principale composta da Dup8f, Cy5-Dup3r, dNTPs, tampone Taq, Taq polimerasi e acqua come descritto nella Tabella 4 e aggiungere 11,5 μL della miscela a ciascun tubo contenente cDNA.
- Eseguire la PCR utilizzando un termociclatore con una fase iniziale di denaturazione a 94 °C per 3 min; seguiti da 20 cicli di denaturazione (94 °C per 30 s), ricottura (65 °C per 30 s) ed estensione (72 °C per 15 s), e una fase di terminazione a 72 °C per 5 min.
- Aggiungere 12,5 μL di colorante 2x formamide DNA loading a ciascun tubo e riscaldare a 95 °C per 5 min.
- Conservare la reazione PCR a -20 °C o procedere con urea-PAGE come descritto di seguito nei passaggi 8.1-8.4.
- Dopo l'elettroforesi, rimuovere le lastre di vetro dall'apparato di elettroforesi e scansionare utilizzando un imager a fluorescenza per visualizzare il gel.
- Eseguire la scansione densitometrica dell'immagine del gel e utilizzare l'intensità della banda dei prodotti inclusi e saltati per calcolare la percentuale di inclusione dell'esone 2 come descritto nel passaggio 4.8.
6. Analisi dell'espressione della variante U1 snRNA mediante estensione del primer
- Aggiungere 2,0 μg di RNA estratto dalle cellule Hela in tubi microcentrifuga separati da 200 μL e aggiungere acqua priva di RNasi per aumentare il volume a 4,325 μL e quindi aggiungere dATP, come mostrato nella Tabella 5.
- Aggiungere 10.000 CPM dell'oligonucleotide 32P-U17-26-R a ciascun tubo.
NOTA: Per preparare una soluzione da 10.000 cpm/μL di 32P-U17-26-R (dalla Fase 3), diluire l'oligonucleotide marcato (diluizione 1:20), determinare cpm in 1,0 μL utilizzando un contatore di scintillazione e diluire ulteriormente con acqua deionizzata per preparare una soluzione di 10.000 cpm/μL in un nuovo tubo di microcentrifuga da 1,5 mL. - Incubare a 65 °C per 5 minuti e poi sul ghiaccio per 1 minuto.
- Preparare una miscela master con 5x First Strand Buffer, inibitore della RNasi, DTT e trascrittasi inversa come mostrato nella Tabella 5 e aggiungere 1,8 μL della miscela a ciascun campione.
- Incubare, prima a RT per 10 min e poi a 42 °C per 10 min.
- Dopo l'incubazione, aggiungere 10 μL di colorante 2x formamide RNA loading in ciascun campione e conservare in una scatola acrilica a -20 °C o procedere con la separazione dei frammenti mediante urea-PAGE utilizzando un gel lungo 38 cm (vedere Step 8).
7. Analisi dell'espressione della variante U1 snRNA mediante RT-qPCR
- Diluire lo stock di cDNA preparato come descritto sopra nei passaggi 5.1 - 5.4 ad una concentrazione di 0,2 ng/μL.
- Pipetta 5,0 μL di cDNA diluito in singoli pozzetti di una piastra qPCR a 96 pozzetti in triplice copia. Aggiungere acqua deionizzata invece di cDNA per il controllo no-template (NTC).
- Preparare due miscele di primer separate costituite dai primer avanti e indietro per gli snRNA U1 e U2 e dall'acqua come mostrato nella Tabella 6.
NOTA: le sequenze per primer specifici per snRNA U1 e U2 sono fornite nella Tabella 7. - Aggiungere 5,0 μL della miscela di primer snRNA U1 e U2 al campione e ai pozzetti NTC.
- Aggiungere 10,0 μL di miscela PCR in tempo reale a ciascun pozzetto.
- Sigillare le piastre con un film ottico, quindi centrifugare a 1.000 x g per 2 minuti a RT per raccogliere le reazioni sul fondo dei pozzetti.
- Eseguire qPCR con una fase iniziale di denaturazione a 95 °C per 10 min, seguita da 40 cicli di un protocollo in 2 fasi costituito da denaturazione (95 °C per 15 s) e ricottura/estensione (62 °C per 60 s) raccogliendo i valori del ciclo di quantificazione di soglia (Cq) degli ampliconi target.
- Completa la reazione qPCR controllando un singolo picco nella curva di dissociazione per le reazioni di snRNA U1 e U2.
- Dai valori Cq, calcolare delta Cq (ΔCq) per gli snRNA U1 e U2 rispetto al controllo pcDNA.
- Determinare l'espressione di snRNA U1 variante come quantità relativa (RQ) di U1 rispetto a U2 utilizzando il valore ΔΔCq come mostrato di seguito per tutti i campioni.

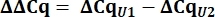
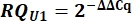
8. Configurazione e funzionamento dei gel Urea-PAGE
NOTA: l'assemblaggio delle lastre di vetro e dell'apparecchio di scorrimento in gel deve essere eseguito secondo le istruzioni del produttore. La fusione del gel urea-PAGE al 10% può essere eseguita secondo un protocollo precedentemente descritto da Summer et al.10. Le fasi che comportano la preparazione di marcatori e campioni e l'esecuzione e la visualizzazione di gel sono descritte di seguito. Opzionalmente, per evitare che il gel si attacchi alle lastre di vetro, la superficie interna può essere rivestita con soluzione siliconica aggiungendo 1 mL di soluzione sulla superficie e diffondendo uniformemente su tutta la superficie con il tessuto. Una volta asciutti, i piatti devono essere lavati con acqua deionizzata e asciugati di nuovo.
ATTENZIONE: L'acrilammide non polimerizzata è neurotossica e deve essere maneggiata con le protezioni raccomandate nella scheda di sicurezza del materiale.
- Preparare i campioni di estensione del primer e i marcatori riscaldando a 95 °C per 5 minuti e quindi centrifugando in una microcentrifuga da tavolo a 3.000 x g per 5 s a RT.
- Prima di caricare i marcatori e i campioni, sciacquare i pozzetti con 1x tampone TBE per rimuovere l'urea stabilizzata.
- Caricare 10 μL / campione / pozzetto e far funzionare il gel a 300-500 V per 2-3 ore o fino a quando lo xilene cianolo raggiunge il fondo.
NOTA: è possibile caricare circa 1.000 cpm del marcatore con etichetta 32P. - Dopo l'elettroforesi, rimuovere le lastre di vetro dall'apparato di elettroforesi.
- Separare accuratamente le due piastre in modo che il gel si trovi piatto su entrambe le superfici di vetro e trasferire il gel su una carta da filtro e coprirlo con un involucro di plastica.
- Asciugare sottovuoto il gel sulla carta da filtro a 80 °C per 30 minuti utilizzando un essiccatore di gel.
- Posizionare il gel essiccato in una cassetta per immagini al fosforo e conservare a RT durante la notte.
NOTA: lo schermo al fosforo deve essere cancellato utilizzando una scatola luminosa prima dell'uso. - Per visualizzare l'immagine gel, rimuovere lo schermo e scansionare utilizzando un imager al fosforo.
Risultati
Il reporter di splicing Dup51, un minigene di tre esoni-due introni, è stato derivato dal gene umano β-globina ed è stato descritto in precedenza (Figura 1A) 11,12 . Abbiamo creato un reporter mutante, Dup51p, introducendo mutazioni del sito di giunzione associate alla sindrome di Usher che si verificano nell'esone 3 del gene protocadherina 15 (PCDH15)13. La sequenza del sito di giunzione 5'-giunzi...
Discussione
Il test può essere adattato per l'analisi di splicing in linee cellulari diverse da HeLa, tuttavia, potrebbe essere necessario ottimizzare i fattori che influenzano l'efficienza della trasfezione, come la confluenza cellulare e la quantità di DNA. Il rapporto tra il costruttore reporter e U1 è un altro parametro critico che potrebbe dover essere determinato in base ai livelli di espressione osservati in altri tipi di cellule. La qualità dell'RNA estratto è fondamentale per l'analisi dello splicing; pertanto, l'uso d...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da fondi a S.S. dal National Institutes of Health (R21CA170786 e R01GM127464) e dall'American Cancer Society (Institutional Research Grant 74-001-34-IRG) e a S.S. e W.M. dal Valley Research Partnership Program (P1-4009 e VRP77). Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagent Grade Deionized Water | ThermoFisher Scientific | 23-751628 | |
| Diethyl pyrocarbonate (DEPC) | Sigma-Aldrich | D5758-25ML | |
| Dulbecco's Modified Eagle Medium (DMEM) powder packet | Gibco | 12100-046 | |
| Sodium Bicarbonate | ThermoFisher Scientific | S233-500 | |
| Fetal Bovine Serum (FBS), Australian Source, Heat Inactivated | Omega Scientific | FB-22 | |
| Penicillin-Streptomycin (P/S) | Sigma-Aldrich | P4458-100ML | |
| Sodium Hydroxide, Standard Solution 1.0N | Sigma-Aldrich | S2567-16A | |
| Hydrochloric Acid, Certified ACS Plus, 36.5 to 38.0% | ThermoFisher Scientific | A144-500 | |
| Disposable PES Bottle Top Filters | ThermoFisher Scientific | FB12566510 | |
| EDTA Disodium Salt Dihydrate | Amresco | 0105-2.5KG | |
| 2.5% Trypsin (10x), no phenol red | ThermoFisher Scientific | 15090046 | |
| Sodium Chloride | Fisher Bioreagent | BP358-212 | |
| Potassium Chloride | Fisher Bioreagent | BP366-1 | |
| Disodium Hydrogen Phosphate Heptahydrate | Fisher Bioreagent | BP332-1 | |
| Potassium Dihydrogen Phosphate | Fisher Bioreagent | BP362-1 | |
| Transfection medium - Opti-MEM™ I Reduced Serum Medium, no phenol red | ThermoFisher Scientific | 11058021 | |
| Transfection Reagent - Lipofectamine™ 2000 | ThermoFisher Scientific | 13778150 | |
| TRIzol™ Reagent | ThermoFisher Scientific | 15596018 | |
| Chloroform (Approx. 0.75% Ethanol as Preservative/Molecular Biology) | ThermoFisher Scientific | BP1145-1 | |
| Ethanol, Absolute (200 Proof), Molecular Biology Grade, Fisher BioReagents | ThermoFisher Scientific | BP2818-4 | |
| Isopropanol, Molecular Biology Grade, Fisher BioReagents | ThermoFisher Scientific | BP2618-212 | |
| Glycogen (5 mg/ml) | ThermoFisher Scientific | AM9510 | |
| Direct-zol RNA Miniprep Kit | Zymo Research | R2052 | |
| ATP, [γ-32P]- 6000Ci/mmol 150mCi/ml Lead, 1 mCi | PerkinElmer | NEG035C001MC | |
| T4 Polynucleotide Kinase | New England Biolabs | M0201L | |
| Size exclusion beands - Sephadex® G-25 | Sigma-Aldrich | G2580-10G | |
| Size exclusion mini columns | USA Scientific | 1415-0600 | |
| pBR322 DNA-MspI Digest | New England Biolabs | N3032S | |
| Low Molecular Weight Marker, 10-100 nt | Affymetrix | 76410 100 UL | |
| Rnase inactivating reagents - RNaseZAP™ | Sigma-Aldrich | R2020-250ML | |
| dNTP Mix (10 mM ea) | ThermoFisher Scientific | 18427013 | |
| RNaseOUT™ Recombinant Ribonuclease Inhibitor | ThermoFisher Scientific | 10777019 | |
| Reverse Transcriptase - M-MLV Reverse Transcriptase | ThermoFisher Scientific | 28025013 | used for primer extension |
| Taq DNA Polymerase | ThermoFisher Scientific | 10342020 | |
| Random Hexamers (50 µM) | ThermoFisher Scientific | N8080127 | |
| Real time PCR mix - SYBR™ Select Master Mix | ThermoFisher Scientific | 4472903 | |
| SuperScript™ III Reverse Transcriptase | ThermoFisher Scientific | 18080093 | used for cDNA preparation |
| Dithiothreitol (DTT) | ThermoFisher Scientific | 18080093 | |
| 5X First-Strand Buffer | ThermoFisher Scientific | 18080093 | |
| Formamide (≥99.5%) | ThermoFisher Scientific | BP228-100 | Review Material Safety Data Sheets |
| Bromophenol Blue sodium salt | Sigma-Aldrich | 114405-5G | |
| Xylene Cyanol FF | Sigma-Aldrich | 2650-17-1 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | ThermoFisher Scientific | BP152-5 | |
| Boric Acid (Crystalline/Electrophoresis) | ThermoFisher Scientific | BP168-500 | |
| Acrylamide: Bis-Acrylamide 19:1 (40% Solution/Electrophoresis) | ThermoFisher Scientific | BP1406-1 | Review Material Safety Data Sheets |
| Urea (Colorless-to-White Crystals or Crystalline Powder/Mol. Biol.) | ThermoFisher Scientific | BP169-212 | |
| Ammonium peroxodisulphate (APS) ≥98%, Pro-Pure, Proteomics Grade | VWR | M133-25G | |
| Sigmacote | Sigma-Aldrich | SL2-100ML | |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) ≥99%, Ultrapure | VWR | 0761-25ML | Review Material Safety Data Sheets |
| Adjustable Slab Gel Systems, Expedeon | VWR | ASG-400 | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 14.5cm | VWR | NGP-125NR | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 22.0cm | VWR | NGP-200NR | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 38.7cm | VWR | NGP-400NR | |
| GE Storage Phosphor Screens | Sigma-Aldrich | GE28-9564 | |
| Typhoon™ FLA 7000 Biomolecular Imager | GE Healthcare | 28-9610-73 AB | |
| Beckman Coulter LS6500 Liquid Scintillation Counter | GMI | 8043-30-1194 | |
| C1000 Touch Thermal Cycler | ThermoFisher Scientific | ||
| QuantStudio 6 Flex Real-Time PCR Systems | ThermoFisher Scientific |
Riferimenti
- Zhuang, Y., Weiner, A. M. A compensatory base change in U1 snRNA suppresses a 5' splice site mutation. Cell. 46 (6), 827-835 (1986).
- Scotti, M. M., Swanson, M. S. RNA mis-splicing in disease. Nature Review Genetics. 17 (1), 19-32 (2016).
- Ward, A. J., Cooper, T. A. The pathobiology of splicing. Journal of Pathology. 220 (2), 152-163 (2010).
- Scalet, D., et al. Disease-causing variants of the conserved +2T of 5' splice sites can be rescued by engineered U1snRNAs. Human Mutatation. 40 (1), 48-52 (2019).
- Yamazaki, N., et al. Use of modified U1 small nuclear RNA for rescue from exon 7 skipping caused by 5'-splice site mutation of human cathepsin A gene. Gene. 677, 41-48 (2018).
- Yanaizu, M., Sakai, K., Tosaki, Y., Kino, Y., Satoh, J. I. Small nuclear RNA-mediated modulation of splicing reveals a therapeutic strategy for a TREM2 mutation and its post-transcriptional regulation. Science Reports. 8 (1), 6937 (2018).
- Balestra, D., et al. Splicing mutations impairing CDKL5 expression and activity can be efficiently rescued by U1snRNA-based therapy. International Journal of Molecular Sciences. 20 (17), 20174130 (2019).
- Donadon, I., et al. Exon-specific U1 snRNAs improve ELP1 exon 20 definition and rescue ELP1 protein expression in a familial dysautonomia mouse model. Human Molecular Genetics. 27 (14), 2466-2476 (2018).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments. (45), e2565 (2010).
- Summer, H., Gramer, R., Droge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). Journal of Visualized Experiments. (32), e1485 (2009).
- Dominski, Z., Kole, R. Selection of splice sites in pre-mRNAs with short internal exons. Molecular Cell Biology. 11 (12), 6075-6083 (1991).
- Amir-Ahmady, B., Boutz, P. L., Markovtsov, V., Phillips, M. L., Black, D. L. Exon repression by polypyrimidine tract binding protein. RNA. 11 (5), 699-716 (2005).
- Le Guedard-Mereuze, S., et al. Sequence contexts that determine the pathogenicity of base substitutions at position +3 of donor splice-sites. Human Mutation. 30 (9), 1329-1339 (2009).
- Sharma, S., Wongpalee, S. P., Vashisht, A., Wohlschlegel, J. A., Black, D. L. Stem-loop 4 of U1 snRNA is essential for splicing and interacts with the U2 snRNP-specific SF3A1 protein during spliceosome assembly. Genes and Development. 28 (22), 2518-2531 (2014).
- Steitz, J. A., et al. . Functions of the abundant U-snRNPs. Structure and function of major and minor small nuclear ribonucleoprotein particles. , 115-154 (1988).
- Fortes, P., et al. Inhibiting expression of specific genes in mammalian cells with 5' end-mutated U1 small nuclear RNAs targeted to terminal exons of pre-mRNA. Proceedings of the National Academy of Sciences U.S.A. 100 (14), 8264-8269 (2003).
- Roca, X., et al. Widespread recognition of 5' splice sites by noncanonical base-pairing to U1 snRNA involving bulged nucleotides. Genes and Development. 26 (10), 1098-1109 (2012).
- Roca, X., Krainer, A. R. Recognition of atypical 5' splice sites by shifted base-pairing to U1 snRNA. Nature Structural Molecular Biology. 16 (2), 176-182 (2009).
- Taladriz-Sender, A., Campbell, E., Burley, G. A. Splice-switching small molecules: A new therapeutic approach to modulate gene expression. Methods. 167, 134-142 (2019).
- Hamid, F. M., Makeyev, E. V. A mechanism underlying position-specific regulation of alternative splicing. Nucleic Acids Research. 45 (21), 12455-12468 (2017).
- Martelly, W., et al. Synergistic roles for human U1 snRNA stem-loops in pre-mRNA splicing. RNA Biology. , 1-18 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon