È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
La fabbricazione e il funzionamento di un sistema di micro-elettroporazione a flusso continuo con rilevamento di permeabilizzazione
In questo articolo
Riepilogo
Questo protocollo descrive le tecniche di microfabbricazione necessarie per costruire un dispositivo di elettroporazione microfluidica lab-on-a-chip. La configurazione sperimentale esegue trasfezioni controllate a livello di singola cellula in un flusso continuo e può essere estesa a portate più elevate con controllo basato sulla popolazione. Viene fornita un'analisi che mostra la capacità di monitorare elettricamente il grado di permeabilizzazione della membrana cellulare in tempo reale.
Abstract
Le attuali innovazioni terapeutiche, come la terapia cellulare CAR-T, dipendono fortemente dalla somministrazione genica mediata da virus. Sebbene efficiente, questa tecnica è accompagnata da elevati costi di produzione, che hanno suscitato un interesse nell'utilizzo di metodi alternativi per la consegna genica. L'elettroporazione è un approccio elettrofisico non virale per la consegna intracellulare di geni e altri materiali esogeni. Dopo l'applicazione di un campo elettrico, la membrana cellulare consente temporaneamente la consegna molecolare nella cellula. Tipicamente, l'elettroporazione viene eseguita su macroscala per elaborare un gran numero di cellule. Tuttavia, questo approccio richiede un ampio sviluppo di protocolli empirici, che è costoso quando si lavora con tipi di cellule primarie e difficili da trasfettare. Il lungo sviluppo del protocollo, insieme alla necessità di grandi tensioni per ottenere sufficienti intensità di campo elettrico per permeabilizzare le celle, ha portato allo sviluppo di dispositivi di elettroporazione su microscala. Questi dispositivi di micro-elettroporazione sono fabbricati utilizzando tecniche di microfabbricazione comuni e consentono un maggiore controllo sperimentale con il potenziale di mantenere elevate capacità di produttività. Questo lavoro si basa su una tecnologia di elettroporazione microfluidica in grado di rilevare il livello di permeabilizzazione della membrana cellulare a livello di singola cellula in un flusso continuo. Tuttavia, questa tecnologia è stata limitata a 4 celle elaborate al secondo, e quindi un nuovo approccio per aumentare il throughput del sistema è proposto e presentato qui. Questa nuova tecnica, indicata come controllo di feedback basato sulla popolazione cellulare, considera la risposta di permeabilizzazione cellulare a una varietà di condizioni di impulso dell'elettroporazione e determina le condizioni di impulso di elettroporazione più adatte per il tipo di cellula in esame. Viene quindi utilizzata una modalità a throughput più elevato, in cui questo impulso "ottimale" viene applicato alla sospensione cellulare in transito. I passaggi per fabbricare il dispositivo, impostare e gestire gli esperimenti microfluidici e analizzare i risultati sono presentati in dettaglio. Infine, questa tecnologia di micro-elettroporazione è dimostrata fornendo un plasmide del DNA che codifica per la proteina fluorescente verde (GFP) nelle cellule HEK293.
Introduzione
Le attuali innovazioni terapeutiche nella ricerca biomedica, come la terapia cellulare CAR-T (Chimeric Antigen Receptor Engineered T cell) e l'editing genetico utilizzando CRISPR (clustered regularly interspaced short palindromic repeat DNA sequences) / Cas9, si basano fortemente sulla capacità di fornire materiale esogeno sia con successo che in modo efficiente nello spazio intracellulare1. Nella terapia CAR-T, il gold standard per eseguire la fase di consegna genica nella produzione di terapia cellulare è l'utilizzo di vettori virali2. Sebbene la consegna genica mediata da virus sia una modalità di consegna efficiente, presenta anche diversi inconvenienti. Questi includono i costi di produzione, la citotossicità, l'immunogenicità, il potenziale di mutagenesi/tumorigenesi e le limitazioni delle dimensioni dei geni da somministrare3. Queste limitazioni hanno portato alla ricerca e allo sviluppo di tecnologie di somministrazione alternative e non virali.
L'elettroporazione, un'alternativa alla consegna genica mediata da virus, si basa sull'applicazione di una forma d'onda di impulso elettrico ottimale per eseguire trasfezioni di DNA, RNA e proteine delle cellule. A seguito dell'applicazione di un campo elettrico esterno, la membrana cellulare viene brevemente compromessa, rendendo la cellula suscettibile alla consegna intracellulare di materiali esogeni altrimenti impermeabili4. Rispetto alla somministrazione mediata da virus, l'elettroporazione è vantaggiosa in quanto è generalmente sicura, facile da usare e ha bassi costi operativi. L'elettroporazione può trasportare sia piccoli che grandi carichi molecolari e può essere efficiente nel trasfettare le cellule indipendentemente dal lignaggio5. Per ottenere risultati desiderabili dopo l'elettroporazione, cioè una buona vitalità e una buona efficienza di elettro-trasfezione, una varietà di parametri sperimentali deve essere co-ottimizzata. Questi includono il tipo di cella6, la densità cellulare, la concentrazione della molecola7, le proprietà del tampone di elettroporazione (ad esempio, composizione molecolare, conducibilità e osmolarità)8, dimensione/geometria dell'elettrodo9 e forma d'onda dell'impulso elettrico (forma, polarità, numero di impulsi)10 (fare riferimento alla Figura 1 per un'illustrazione). Sebbene ciascuno di questi parametri possa avere un effetto significativo sui risultati degli esperimenti di elettroporazione, la forma d'onda dell'impulso è stata studiata in modo particolarmente dettagliato, poiché l'energia elettrica degli impulsi applicati è la radice del compromesso intrinseco tra la vitalità cellulare risultante e l'efficienza di elettro-trasfezione8.
Tipicamente, gli esperimenti di elettroporazione vengono eseguiti su macro-scala, dove le celle sono sospese in 100 microlitri di tampone tra una serie di grandi elettrodi a piastra parallela all'interno di una cuvetta di elettroporazione. Gli elettrodi sono comunemente fabbricati in alluminio con una distanza dell'elettrodo di 1-4 mm. Una volta che le celle vengono caricate manualmente tramite pipetta, la cuvetta è collegata elettricamente a un ingombrante generatore di impulsi elettrici in cui l'utente può impostare e applicare i parametri della forma d'onda dell'impulso per elettropolare la sospensione della cella. Sebbene l'elettroporazione su macroscala o di massa possa elaborare densità cellulari >106 celle/ml, questa funzione può essere dispendiosa quando si ottimizzano le impostazioni della forma d'onda dell'impulso elettrico. Ciò è particolarmente preoccupante quando si elettroporano tipi di cellule primarie in cui il numero di popolazioni cellulari può essere limitato. Inoltre, a causa della grande distanza tra gli elettrodi, il generatore di impulsi deve essere in grado di fornire grandi tensioni per ottenere intensità di campo elettrico >1kV / cm11. Queste alte tensioni causano una dissipazione di potenza resistiva attraverso il tampone elettrolitico con conseguente riscaldamento Joule, che può essere dannoso per la vitalità della cella risultante12. Infine, l'esecuzione dell'elettroporazione su una sospensione densa di cellule sarà costantemente gravata da una variabilità innata nell'efficienza di elettro-trasfezione risultante e nella vitalità cellulare. Ogni cellula in sospensione potrebbe sperimentare una diversa intensità del campo elettrico a causa delle cellule circostanti. A seconda che l'intensità del campo elettrico sperimentato sia aumentata o diminuita, la vitalità cellulare risultante o l'efficienza di elettro-trasfezione possono essere influenzate negativamente11. Questi aspetti negativi dell'elettroporazione su macro-scala hanno portato alla ricerca e allo sviluppo di tecnologie alternative che operano su micro-scala e consentono un migliore controllo a livello di singola cella.
Il campo dei BioMEMS, o sistemi biomedici micro-elettro-meccanici, deriva dai progressi tecnologici compiuti nel settore della microelettronica. In particolare, utilizzando processi di microfabbricazione per sviluppare micro-dispositivi per il progresso della ricerca biomedica. Questi progressi includono lo sviluppo di array di micro-elettrodi per il monitoraggio elettrico in vivo13, micro-elettrodi capacitivi per elettroporazione in situ 14, dispositivi miniaturizzati organ-on-a-chip 15, diagnostica microfluidica point-of-care 16, biosensori 17 e sistemi di somministrazione di farmaci 18, compresi dispositivi di nano e micro-elettroporazione 19,20,21 . Grazie alla capacità di progettare e produrre dispositivi alla stessa scala dimensionale delle celle biologiche, le tecnologie di nano e micro-elettroporazione sono vantaggiose rispetto alla loro controparte su macroscala22,23. Questi dispositivi di elettroporazione eliminano la necessità di applicazioni a impulsi ad alta tensione, poiché i set di elettrodi con spaziature da 10 a 100 secondi di micrometri sono tipicamente integrati. Questa caratteristica riduce drasticamente la corrente attraverso l'elettrolita, che a sua volta riduce l'accumulo di prodotti di elettrolisi tossici e gli effetti del riscaldamento Joule in questi sistemi. I canali su microscala assicurano inoltre che un campo elettrico molto più uniforme venga applicato in modo affidabile alle celle durante l'applicazione dell'impulso, con risultati più coerenti24. Inoltre, è anche normale che i dispositivi di microelettroporazione siano integrati in una piattaforma microfluidica che si presta per la futura integrazione in una tecnologia completamente automatizzata, una capacità altamente auspicabile nella produzione di terapie cellulari25. Infine, l'elettroporazione su microscala consente l'interrogazione elettrica degli eventi di elettroporazione. Ad esempio, il grado di permeabilizzazione della membrana cellulare può essere monitorato in tempo reale a livello di singola cellula26,27. Lo scopo di questo metodo è quello di descrivere la microfabbricazione, il funzionamento del sistema e l'analisi di un dispositivo microfluidico di microelettroporazione monocellulare in grado di misurare il grado di permeabilizzazione della membrana cellulare per ottimizzare i protocolli di elettroporazione, aumentando al contempo la produttività rispetto al precedente stato dell'arte.
L'esecuzione dell'elettroporazione a livello di singola cellula non è più una tecnica nuova, come è stato dimostrato per la prima volta da Rubinsky et al. nel 2001 con lo sviluppo di una tecnologia di elettroporazione a celle statiche28. Il loro micro-dispositivo è stato innovativo in quanto sono stati i primi a dimostrare la capacità di monitorare elettricamente l'evento di elettroporazione. Ciò ha ulteriormente portato allo sviluppo di tecnologie statiche di elettroporazione a cella singola in grado di rilevare elettricamente il grado di permeabilizzazione della membrana cellulare in modo parallelizzato per aumentare la produttività dei dispositivi. Tuttavia, anche con la parallelizzazione e l'elaborazione batch, questi dispositivi mancano gravemente del numero totale di celle che possono elaborare per unità di tempo29,30. Questa limitazione ha portato allo sviluppo di dispositivi flow-through in grado di eseguire microelettroporazione a livello di singola cella a portate molto maggiori31. Questa transizione del dispositivo, dall'ambiente statico a quello flow-through, limita la capacità di monitorare elettricamente il grado di permeabilizzazione della membrana cellulare in seguito all'applicazione dell'impulso di elettroporazione. Il metodo descritto in questo lavoro colma il divario tra queste due tecnologie, una tecnologia di micro-elettroporazione in grado di rilevare, pulsare e monitorare elettricamente il grado di permeabilizzazione della membrana cellulare delle singole cellule, in modo seriale a flusso continuo.
Questa tecnologia è stata recentemente descritta in Zheng et al. In quel lavoro, le capacità di questa tecnologia sono state introdotte con il completamento di uno studio parametrico, in cui sono state variate sia l'ampiezza che la durata dell'impulso di elettroporazione, e il conseguente segnale elettrico, indicativo della permeabilizzazione della membrana cellulare, è stato esplorato32. I risultati hanno mostrato che un aumento dell'intensità dell'impulso di elettroporazione (cioè aumento del campo elettrico applicato o aumento della durata dell'impulso) ha causato un aumento della permeabilizzazione della membrana cellulare misurata. Per convalidare ulteriormente il sistema, un indicatore fluorescente comune di elettroporazione riuscita, lo ioduro di propidio33, è stato aggiunto alla sospensione cellulare e un'immagine di fluorescenza è stata acquisita immediatamente dopo l'applicazione dell'impulso elettrico. Il segnale ottico, cioè l'intensità di fluorescenza dello ioduro di propidio all'interno della cellula, è stato fortemente correlato con la misura elettrica del grado di permeabilizzazione della membrana cellulare, verificando l'affidabilità di questa misura elettrica. Tuttavia, questo lavoro ha considerato solo la consegna della piccola molecola ioduro di propidio, che ha poco o nessun significato traducibile.
In questo lavoro, viene introdotta una nuova applicazione di questa tecnologia per migliorare la produttività del sistema, fornendo al contempo un vettore di DNA plasmidico biologicamente attivo (pDNA) e valutando l'efficienza di elettro-trasfezione delle cellule riplaccate e coltivate dopo l'elettroporazione. Sebbene il lavoro precedente superi le tecnologie di micro-elettroporazione esistenti che sono in grado di misurare elettricamente l'evento di elettroporazione, lo stato attuale del dispositivo richiede ancora lunghi tempi di transito della cella tra il set di elettrodi (~ 250 ms) per eseguire il rilevamento cellulare, l'applicazione dell'impulso e la misurazione della permeabilizzazione della membrana cellulare. Con un singolo canale, questo limita il throughput a 4 celle/s. Per combattere questa limitazione, viene introdotto un nuovo concetto di elettroporazione controllata da feedback basata sulla popolazione cellulare per eseguire l'elettro-trasfezione del pDNA. Utilizzando un tampone di elettroporazione a conducibilità ipofisiologica, questo sistema consente l'interrogazione elettrica di singole celle attraverso una moltitudine di applicazioni di impulsi di elettroporazione. Sulla base della risposta elettrica, viene quindi determinato un impulso di elettroporazione "ottimale". Viene quindi implementata una modalità "high-throughput" in cui la determinazione della permeabilizzazione della membrana cellulare viene annullata, la portata viene aumentata e il duty cycle dell'impulso di elettroporazione viene abbinato al tempo di transito della cella per garantire un impulso per cella in transito tra gli elettrodi. Questo lavoro fornirà ampi dettagli sulle fasi di microfabbricazione per la produzione del micro-dispositivo, il materiale / attrezzatura e la loro configurazione necessaria per eseguire la sperimentazione, e il funzionamento / analisi del dispositivo e la sua efficienza di elettro-trasfezione (eTE).
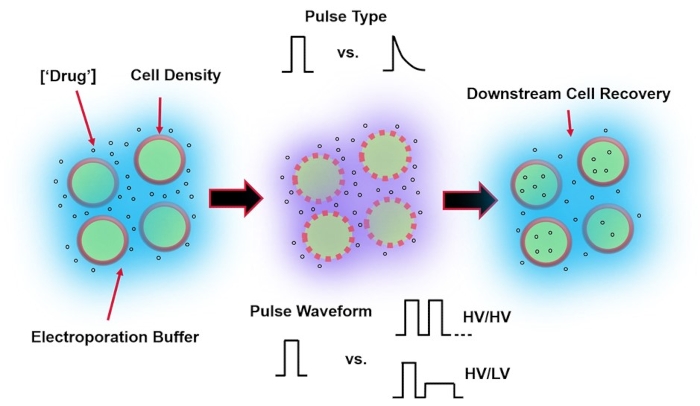
Figura 1: Fattori sperimentali che influenzano i risultati dell'elettroporazione. (Sinistra) Sospensione cellulare: i fattori importanti da considerare prima dell'inizio dell'elettroporazione includono: carico utile (in questo caso, pDNA), concentrazione, densità cellulare e proprietà del tampone di elettroporazione. Le proprietà del tampone di elettroporazione da considerare sono la conduttività, l'osmolarità e l'esatta composizione molecolare che contribuisce a questi valori. (Al centro) Applicazione dell'impulso - Il tipo di impulso esatto (onda quadra vs. decadimento esponenziale) e la forma d'onda dell'impulso (singolo impulso vs. treno di impulsi) devono essere ottimizzati per massimizzare sia la vitalità cellulare risultante che l'efficienza di elettro-trasfezione. I treni di impulsi comuni implementati nei processi di elettroporazione sono tipicamente composti da una serie di impulsi ad alta tensione (HV) o serie di impulsi che ruotano tra le grandezze di impulso HV e bassa tensione (BT). (Destra) Le fasi di elaborazione a valle del recupero cellulare, in particolare i terreni di coltura cellulare di recupero in cui le cellule vengono trasferite, dovrebbero essere ottimizzati. Non in primo piano (estrema sinistra), è possibile implementare ulteriori fasi di elaborazione delle celle a monte per l'ottimizzazione complessiva del processo di elettroporazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
NOTA: gli utenti devono esaminare tutte le schede di sicurezza per i materiali e i materiali di consumo utilizzati in questo protocollo. In ogni fase devono essere indossati DPI appropriati e durante la sperimentazione deve essere utilizzata una tecnica sterile. Le sezioni 1-7 illustrano la fabbricazione del dispositivo.
1. Fabbricazione del dispositivo - Design della maschera
NOTA: Fare riferimento alla Figura 2 per un'illustrazione del processo di microfabbricazione. Le fasi di microfabbricazione devono essere eseguite in un ambiente di camera bianca. Sono necessari DPI aggiuntivi (retina per capelli, rete per capelli facciale, maschera, tuta per camera bianca, copriscarpe).
- Installare un software CAD di scelta, progettare una "maschera" 2-dimensionale sia del canale microfluidico che degli elettrodi e salvare il progetto nel formato di file desiderato (ad esempio, .dxf, .dwg).
NOTA: fare riferimento alla Figura supplementare 1 per un esempio di schema di maschera 2-dimensionale. - Inviare a un fornitore di scelta per la stampa. Assicurarsi che le dimensioni dei progetti rientrino nelle capacità di risoluzione del fornitore.
2. Fabbricazione del dispositivo - Fotolitografia
NOTA: Le ricette di microfabbricazione fornite sono adottate dalle raccomandazioni del produttore dei fotoresist e devono essere utilizzate solo come punto di partenza34. I valori esatti per i tempi di cottura, i tempi di esposizione, ecc., Devono essere ottimizzati per ogni protocollo di fabbricazione. Si consiglia di utilizzare pinzette per wafer per la manipolazione sia di wafer di silicio che di vetrini.
- Fabbricazione di canali microfluidici
- Pulizia dei vetrini in silicone e vetro soda-calce: seguire i passaggi da 2.1.2 a 2.1.3 per eseguire la pulizia del wafer di silicio e della pulizia dei vetrini da 1" × 3" di vetro soda-calcico (entrambi indicati come "substrato").
- Immergere i substrati in un bagno di acetone, un bagno di isopropanolo (IPA) e un bagno d'acqua deionizzato per 10 minuti ciascuno. Eseguire questo lavaggio in 3 fasi in serie a temperatura ambiente.
- Rimuovere e asciugare la superficie utilizzando una fonte di azoto pressurizzato o gas filtrato ad aria. Mettere i substrati in un forno a 150 °C per un minimo di 30 minuti per consentire l'evaporazione dell'umidità residua.
- Fotolitografia SU-8 su wafer di silicio: Eseguire la fotolitografia sul wafer di silicio seguendo i passaggi 2.1.5-2.1.14.
NOTA: Per ottenere un'altezza del canale microfluidico di 20 μm, è stato utilizzato il fotoresist negativo serie SU-8 2000. Le velocità di rotazione esatte variano a seconda della formulazione di SU-8 (ad esempio, 2010, 2015, ecc.); tuttavia, le seguenti condizioni sono per la formulazione SU-8 201035. - Rimuovere il wafer di silicio dal forno a 150 °C e lasciarlo raffreddare a temperatura ambiente (RT).
- Fissare il wafer al mandrino del wafer spin coprter utilizzando il sistema di aspirazione del spin coater. Programma lo spinner. Passo 1 - 500 giri/min per 10 s ad un'accelerazione di 100 giri/min, Passo 2 - 1000 giri/min per 30 s ad un'accelerazione di 300 giri/min.
- Erogare 4 mL di SU-8 2010 photoresist al centro del wafer di silicio. Eseguire il programma. Una volta che il sistema si arresta, spegnere l'aspirapolvere.
- Utilizzando una pinzetta, trasferire il wafer di silicio rivestito SU-8 su una piastra calda a 95 °C per 4-5 minuti per cuocere morbidamente. Quindi rimuovere il wafer dalla piastra riscaldante e lasciarlo raffreddare a RT.
NOTA: seguire la procedura di avvio corretta per l'allineatore di maschere fotolitografiche specifico per laboratorio. - Fissare la fotomaschera con i disegni del canale microfluidico 2D sul supporto della maschera. Inserire il wafer di silicio, con il rivestimento SU-8 rivolto verso l'alto, sul mandrino del wafer.
- Impostare le impostazioni di esposizione per 150 mJ/cm2 e far funzionare la macchina.
ATTENZIONE: Non guardare direttamente la sorgente di luce UV per evitare potenziali danni agli occhi. - Posizionare il wafer di silicone rivestito SU-8 su una piastra calda a 95 °C per 4-5 minuti per la cottura post-esposizione.
- Immergere il wafer di silicio nella soluzione di sviluppo SU-8 (vedere la tabella dei materiali) per 3-4 minuti. Applicare una leggera agitazione. Rimuovere il wafer dalla soluzione e risciacquare la superficie con alcool isopropilico.
- Asciugare la superficie utilizzando una fonte di azoto pressurizzato o gas filtrato. Ispezionare le caratteristiche al microscopio utilizzando un filtro UV e assicurarsi che non vi siano difetti evidenti nei canali microfluidici.
- Mettere il wafer di silicio in un forno a 150 °C per un minimo di 30 minuti per una cottura dura.
- Lasciare raffreddare fino a RT e utilizzare la profilometria dello stilo per misurare l'altezza e la pendenza esatte delle pareti laterali del canale.
- Fotolitografia su vetrini
NOTA: L'esametildisilazano (HMDS) viene utilizzato come promotore di adesione per il fotoresist positivo S181836.- Rimuovere il vetrino dal forno a 150 °C e lasciarlo raffreddare a RT.
- Fissare il vetrino al mandrino dello spinner usando il vuoto e programmare lo spinner. Passo 1 - 500 giri/min per 10 s con un'accelerazione di 100 giri/min. Passo 2 - 3000 rpm per 30 sat un'accelerazione di 300 rpm/s.
- Erogare 3-4 goccioline di HMDS sulla superficie del vetrino. Eseguire il programma.
NOTA: Per ottenere un rivestimento superficiale di ~ 3 μm, è necessario utilizzare la serie di fotoresist positivi S1800. Le velocità di rotazione esatte variano a seconda della formulazione; le raccomandazioni riportate di seguito si riferiscono alla formulazione S181834. - Erogare 1 mL di fotoresist sulla superficie del vetrino. Assicurarsi di coprire la superficie.
- Eseguire il programma. Una volta che il sistema si arresta, spegnere l'aspirapolvere e rimuovere il vetrino.
- Posizionare il vetrino rivestito S1818 su una piastra calda a 120 °C per 4 minuti per una cottura morbida. Rimuovi e consenti di venire a RT.
- Fissare la fotomaschera con i disegni dell'elettrodo 2D sul supporto della maschera.
- Inserire e allineare il vetrino, con il rivestimento S1818 rivolto verso l'alto, sul mandrino del wafer. Impostare le impostazioni di esposizione per 250 mJ/cm2 ed eseguire la macchina.
NOTA: diversi modelli di allineatori a contatto possono essere più o meno adatti a substrati non circolari e di spessore variabile. - Immergi il vetrino nella soluzione di sviluppo MF-319 per 2 minuti. Applicare una leggera agitazione. Risciacquare la superficie del vetrino con acqua deionizzata.
- Asciugare la superficie utilizzando una fonte di azoto pressurizzato o gas filtrato e osservare le caratteristiche al microscopio utilizzando un filtro UV. Assicurati che non ci siano difetti evidenti nei modelli litografici.
- Posizionare il vetrino nel forno a 150 °C, assicurandosi che la superficie del substrato di interesse sia rivolta verso l'alto, per un minimo di 30 minuti per una cottura dura. Togliere dal forno e tenere al riparo dalla luce.
3. Fabbricazione del dispositivo: acido fluoridrico (HF) incidere
ATTENZIONE: Questa fase comporta la manipolazione e lo smaltimento dell'acido fluoridrico (HF), che può causare ustioni chimiche profonde e dolorose. Per proteggere il conduttore devono essere utilizzati DPI supplementari (visiera, guanti resistenti agli agenti chimici lunghi fino al gomito, grembiule resistente agli agenti chimici con maniche). Il neutralizzatore acido gluconato di calcio e il gel cutaneo devono essere tenuti in prossimità del banco di laboratorio. Questo passaggio non dovrebbe essere eseguito da solo. L'HF non deve mai essere conservato o erogato in contenitori di vetro poiché il contenitore sarà inciso dall'acido.
NOTA: L'HF incide uniformemente il vetro esposto (cioè il design dell'elettrodo) per formare una rientranza nel vetro, consentendo una migliore risoluzione del bordo del modello di elettrodi dopo la deposizione del metallo (sezione 4).
- Immergere il vetrino in una soluzione HF tamponata 10:1 per 1 minuto in un contenitore di politetrafluoroetilene. Trasferire e lavare i vetrini in acqua deionizzata. Ripetere il passaggio di lavaggio 3 volte.
- Asciugare la superficie utilizzando una fonte di azoto pressurizzato o gas filtrato. Mettere i substrati di vetro in un forno a 65 °C per una notte per rimuovere l'umidità residua. Coprire i substrati dalla luce.
4. Fabbricazione del dispositivo: deposizione fisica da vapore
NOTA: Questa fase prevede la deposizione di metallo sui substrati del vetrino per definire i modelli degli elettrodi. Gli elettrodi metallici comunemente usati sono cromo / oro e titanio / platino. L'oro e il platino non aderiscono al substrato di vetro, quindi è necessario uno strato di adesione del seme di cromo o titanio, rispettivamente, per promuovere l'adesione37.
- Seguire il protocollo specifico della camera bianca per far funzionare il sistema PVD interno. Questo lavoro utilizza un sistema di sputtering DC e sputter con 100 gas Argon SCCM ad una pressione di ~ 8 mTorr e 200 W di potenza.
- Sputter titanio per 8 minuti ad una velocità di ~100 Å / min. Sputter platino per 10 minuti ad una velocità di ~200 Å/min. Rimuovere i substrati dalla camera PVD.
5. Fabbricazione del dispositivo: decollo Photoresist
NOTA: Questo passaggio prevede la dissoluzione dello strato fotoresist in un bagno di acetone, lasciando gli elettrodi di platino aderenti modellati sui vetrini.
- Immergere i vetrini rivestiti di metallo in un bagno di acetone per ~ 10 min.
- Sonicare il bagno per introdurre agitazione per rompere il film metallico non aderito. Utilizzare una salvietta imbevuta di acetone per rimuovere eventuali residui, se necessario.
- Una volta rimosso tutto il fotoresist/metallo, lavare gli elettrodi con acqua deionizzata e metterli in un forno a 65 °C durante la notte per rimuovere l'umidità superficiale residua.
- Utilizzare la profilometria dello stilo per misurare il profilo degli elettrodi modellati.
6. Fabbricazione del dispositivo: litografia morbida
NOTA: Questa fase prevede lo stampaggio replica del canale microfluidico sulla struttura di rilievo principale SU-8 utilizzando un elastomero, polidimetilsilossano (PDMS).
- Silanizzazione di wafer di silicio
NOTA: questo è un passaggio facoltativo; tuttavia, aumenterà la durata della struttura di soccorso SU-8 che è stata fabbricata nella sottosezione 2.1. Questo passaggio deve essere eseguito in una cappa aspirante chimica.- Fissare il wafer sul fondo di una capsula di Petri e posizionare la capsula di Petri in un essiccatore.
- Circondare il perimetro del wafer di silicio con circa 50 μL di tricloro(1H,1H,2H,2H-perfluoroottil) silano. Collegare il vuoto (pompa per vuoto o linea di vuoto domestico) e funzionare per 20 minuti.
- Stampaggio replica PDMS
- In un contenitore usa e getta (ad esempio, pesare una barca, un bicchiere di plastica), mescolare la base di elastomero PDMS con un indurente con un rapporto di peso di 10:1 su una bilancia elettronica. Versare la soluzione PDMS sul wafer di silicio e posizionare la miscela sotto vuoto per rimuovere tutte le bolle d'aria.
- Polimerizzare a 65 °C per un minimo di 4 ore permettendo al PDMS di solidificarsi. Usando la punta di una lama di rasoio, ritagliare il PDMS stampato e staccarlo dal wafer di silicio.
- Utilizzando un punzone bioptico affilato, rimuovere PDMS dall'ingresso/uscita del dispositivo. Per questo dispositivo, sono stati utilizzati punzoni bioptici da 0,75 mm e 3 mm rispettivamente per gli ingressi e le uscite.
NOTA: Il punzone per biopsia utilizzato deve avere un diametro leggermente inferiore rispetto al diametro esterno del tubo di interconnessione per garantire una tenuta ermetica dei tubi nei serbatoi.
- Pulizia sonicazione del PDMS
- Immergere i dispositivi PDMS in IPA e posizionarli in un sonicatore per 30-45 minuti per rimuovere eventuali detriti PDMS dall'ingresso/uscita. PDMS può gonfiarsi nella soluzione IPA.
- Risciacquare con acqua deionizzata e porre in forno a 65 °C per una notte per consentire al PDMS di rigonfiarsi alle dimensioni normali.
NOTA: eventuali residui possono ostruire il dispositivo durante la sperimentazione. Grandi pezzi di detriti possono essere rimossi dalla superficie PDMS utilizzando un pezzo di scotch prima della sonicazione.
7. Fabbricazione del dispositivo: legame PDMS / attacco del filo
NOTA: Questa fase comporta il trattamento della superficie del PDMS e del substrato di vetro con un plasma di ossigeno per formare un legame irreversibile tra il PDMS e il vetro38. La ricetta fornita potrebbe dover essere adattata al sistema esatto utilizzato in laboratorio.
- Tagliare i dispositivi a misura e assicurarsi che la superficie del dispositivo PDMS sia pulita. In caso contrario, seguire i passaggi indicati nella sottosezione 6.3.
- Programmare il generatore di plasma. Impostare la potenza su 70 W, il tempo su 35 s, la pressione su 325 mTorr, la portata dell'ossigeno gassoso su 60 SCCM. Posizionare il PDMS e il vetro dell'elettrodo nel sistema con le funzionalità rivolte verso l'alto ed eseguire il programma.
- Rimuovere i dispositivi e allineare rapidamente le caratteristiche del canale agli elettrodi utilizzando uno stereoscopio. Applicare saldamente una pressione dal centro del PDMS verso i lati per rimuovere eventuali bolle d'aria indesiderate sull'interfaccia di incollaggio.
- Posizionare in un luogo caldo a 95 °C per almeno 2 minuti per finalizzare la procedura di incollaggio e lasciare raffreddare il dispositivo a RT.
- Tagliare 2 pezzi di filo solido da 22 G a ~ 6 "lunghezze e rimuovere l'isolante da entrambe le estremità.
- Incollare i fili ai cuscinetti degli elettrodi utilizzando resina epossidica conduttiva d'argento. Collocare i dispositivi completati in un forno a 65 °C durante la notte.
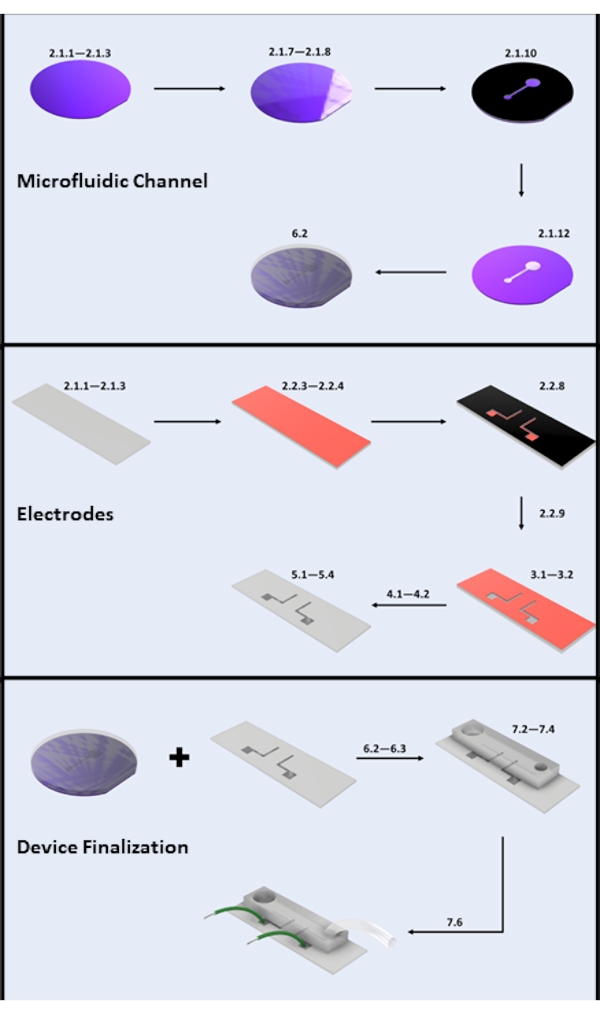
Figura 2: Fabbricazione di microdispositivi. (A) Fabbricazione di canali microfluidici - Fasi chiave: pulizia dei wafer di silicio (fasi 2.1.1-2.1.3), rivestimento fotoresistente e cottura morbida (fasi 2.1.7-2.1.8), esposizione ai raggi UV (fase 2.1.10), sviluppo (fase 2.1.12) e versamento PDMS (sottosezione 6.2). (B) Fasi chiave della fabbricazione degli elettrodi: pulizia del vetrino (fasi 2.1.1-2.1.3), rivestimento HMDS e rivestimento fotoresist (fasi 2.2.3-2.2.4), esposizione ai raggi UV (fase 2.2.8), sviluppo (fase 2.2.9), incisione HF (sezione 3), deposizione fisica da vapore (sezione 4) e decollo fotoresist (sezione 5). (C) Fasi chiave della finalizzazione del dispositivo: accesso all'ingresso/uscita e sonicazione (passaggio 6.2.3 e sezione 6.3), incollaggio PDMS e attacco del filo (sezione 7). Fare clic qui per visualizzare una versione ingrandita di questa figura.
8. Coltura cellulare e raccolta
NOTA: devono essere utilizzate colture cellulari standard e procedure di manipolazione sterili. Seguire il protocollo specifico del tipo di cellula per la coltura cellulare.
- Coltura cellulare
- Passaggio cellulare: coltura e passaggio delle cellule seguendo i passaggi 8.1.2-8.1.5.
- Coltura di cellule HEK293 in soluzione completa di DMEM (88% DMEM, 10% siero fetale bovino inattivato dal calore, 1% L-glutammina, 1% penicillina-streptomicina) in un matraccio T25 in un incubatore a 37 °C, 95% O2, 5% CO2. Cellule di passaggio nei tempi previsti quando raggiungono ~ 80% di confluenza.
- Aspirare il fluido utilizzando una pipetta o un sistema a vuoto e incubare le cellule in tripsina-EDTA allo 0,25% (pallone da 2 mL-T25) per 2 minuti a 37 °C. Neutralizzare la tripsina con il doppio del volume dei terreni di coltura.
- Trasferire la sospensione cellulare in un tubo conico da 15 mL e centrifugare le celle HEK293 a 770 x g per 2 minuti. Aspirare il surnatante utilizzando una pipetta o un sistema a vuoto
- Risospendere le cellule HEK293 in 1 mL di DMEM preriscaldato.
- Placcatura cellulare: placcare le celle seguendo i passaggi 8.1.7-8.1.8
- Placcare le cellule con una diluizione da 10:1 a 20:1 in un matraccio T25 (5 ml di DMEM) per continuare la coltura.
- Placcare le cellule con una diluizione da 5:1 a 20:1 in una piastra a 6 pozzetti (2 ml di DMEM per pozzetto) da raccogliere per esperimenti di elettroporazione.
NOTA: cellule HEK293 placcate 24 ore prima degli esperimenti di elettroporazione per ottenere ~ 70% di confluenza al prelievo cellulare (sottosezione 8.3). Un programma di raccolta incoerente può portare a variabilità nei risultati dell'elettroporazione.
- Tampone per elettroporazione
- Preparare il tampone per elettroporazione
NOTA: Fare riferimento a Sherba et al. per le specifiche sulla preparazione del tampone di elettroporazione8. La composizione tampone era 285 mM di saccarosio, 0,7 mM MgCl2, 1 mM KCl, 10 mM HEPES, 3 mM NaOH (pH: 7,4; osmolalità: 310 mOsm, conducibilità: 500 μS/cm). Il tampone per elettroporazione deve essere formulato in modo sterile e conservato a 4 °C per una durata di conservazione di ~ 1 mese. La formulazione del tampone per elettroporazione deve essere ottimizzata in base al tipo di cellula.
- Preparare il tampone per elettroporazione
- Raccolta cellulare e aggiunta di pDNA
- Seguire gli stessi passaggi del passaggio cellulare (8.1.2-8.1.4).
- Lavare le cellule in 1x PBS sterile, sospensione di cellule di trasferimento in un tubo conico da 15 mL e centrifugare le celle a 770 x g per 2 minuti.
- Lavare il pellet cellulare HEK293 nel tampone di elettroporazione e centrifugare a 770 x g per 2 minuti. Risospendere le cellule nel tampone di elettroporazione a ~ 5 milioni di cellule / ml.
NOTA: la densità delle celle deve essere ottimizzata per tipo di cella. - Aggiungere la codifica del pDNA per la proteina fluorescente verde (GFP) a una concentrazione finale di 20 μg/ml. Mescolare delicatamente la sospensione pDNA/cellula e trasferire la sospensione in una siringa da 1 cc per la sperimentazione.
9. Configurazione hardware/sperimentale
NOTA: Prima di raccogliere le celle per la sperimentazione, assicurarsi che la configurazione sperimentale sia completata per ridurre al minimo la quantità di tempo in cui le celle sono sospese nel tampone di elettroporazione. Accendi l'elettronica 20-30 minuti prima degli esperimenti per riscaldarti. Fare riferimento alla Figura 3 per uno schema della configurazione sperimentale per il funzionamento del modulo di rilevamento a cella singola.
NOTA: È stato sviluppato un circuito Op-Amp PA90 personalizzato per soddisfare sia la sensibilità richiesta per il rilevamento del livello a cella singola utilizzando l'amplificatore lock-in sia le alte tensioni richieste per applicare impulsi di elettroporazione sufficientemente forti. Fare riferimento alla scheda tecnica PA90 per le specifiche sui circuiti consigliati39.
- Inizializzare l'amplificatore lock-in con le impostazioni del preamplificatore corrente e impostarlo tramite l'algoritmo. Fare riferimento a Zheng et al. per le specifiche sulle impostazioni di lock-in32.
- Alimentatori, generatore di funzioni e amplificatore
- Alimentazione 1: impostata su -15 V per alimentare l'estremità negativa del circuito.
- Alimentatore 2 (generatore di funzioni): impostare l'uscita del segnale CC e impostare l'ampiezza su 2 V. Collegare all'ingresso dell'amplificatore 50x.
- Programma Generatore di impulsi di elettroporazione per l'onda quadra: imposta la larghezza dell'impulso desiderata (duty cycle) e l'ampiezza dell'impulso desiderata (Volt).
- Impostare l'uscita sulla modalità trigger (1 impulso). Collegare l'uscita all'ingresso dell'amplificatore 50x.
NOTA: Ricordare il guadagno 50x quando si programma l'ampiezza dell'impulso. Cioè, per ottenere un'intensità del campo elettrico di 1 kV / cm, è necessario un totale di 30 V, 30 V / 300 μm (distanza tra gli elettrodi), quindi l'uscita del generatore di funzioni deve essere impostata su 30/50 o 600 mV. - Verificare le uscite dell'amplificatore 50x utilizzando un oscilloscopio. Uscita 1-100 V dall'alimentatore 2 (9.2.2). Uscita 2-Ampiezza variabile per l'impulso di elettroporazione (9.2.4).
- Collegare una sonda 10x a un canale dell'oscilloscopio e al micro-dispositivo completato (dispositivo in prova, DUT) nel passaggio 7.6 in cui verrà applicato l'impulso di elettroporazione. Monitorare il sistema durante la sperimentazione per assicurarsi che gli impulsi vengano applicati.
- Assicurarsi che il lock-in USB sia collegato e registrato. Ricontrolla tutte le impostazioni di lock-in nel codice dell'algoritmo (soprattutto, la frequenza di uscita del lock-in).
- Microscopio/telecamera CCD
- Posizionare il microdispositivo sul palco del microscopio tramite un supporto per vetrino. Accendere la telecamera CCD e mettere a fuoco il canale microfluidico. Usa un obiettivo 4x o 10x.
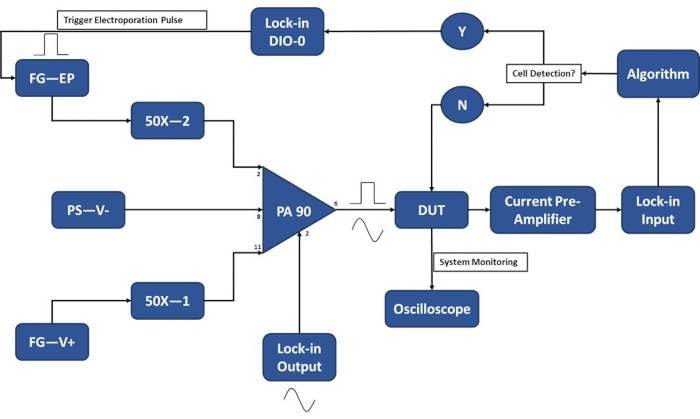
Figura 3: Schema di configurazione sperimentale-Rilevamento di singole celle. L'amplificatore operazionale ad alta potenza (PA-90) consente la sovrapposizione dell'impulso di elettroporazione ad alta tensione sul segnale CA di uscita lock-in necessario per il rilevamento a cella singola. Questo segnale di eccitazione passa attraverso il dispositivo di micro-elettroporazione (Device Under Test, DUT) dove la corrente viene poi amplificata dal preamplificatore di corrente e immessa nell'algoritmo. Il sistema monitora continuamente l'evento di rilevamento delle celle. All'ingresso della cella, un segnale digitale viene generato dall'amplificatore lock-in per attivare l'applicazione dell'impulso di elettroporazione alle celle in transito. Legenda: PA-90 (amplificatore operazionale ad alta potenza), DUT (dispositivo in prova), DIO (ingresso/uscita digitale), FG-EP (generatore di funzioni / impulso di elettroporazione), 50X (amplificatore 50X), PS-V- (alimentazione / tensione negativa per PA 90), FG-V+ (generatore di funzioni, tensione positiva per PA 90). Fare clic qui per visualizzare una versione ingrandita di questa figura.
10. Funzionamento sperimentale
- Innescamento del canale microfluidico
- Rimuovere tutte le bolle d'aria dalla siringa caricata con cellula. Collegare un ago da 30 G alla siringa caricata con cellule.
- Usando una pinzetta, fai scorrere il tubo tygon lungo la lunghezza dell'ago. Pre-riempire il serbatoio di uscita con mezzi di recupero (come il punto 8.1.2 senza gli antibiotici), ~40-50 μL.
- Usando il pollice, applicare delicatamente una pressione sullo stantuffo in modo tale che il fluido raggiunga lentamente la fine della linea del tubo.
- Fissare la siringa alla pompa della siringa. Accendere la pompa della siringa e assicurarsi che sia impostata per la perfusione in avanti.
- Programmare la pompa per il diametro corretto della siringa per garantire che le portate siano accurate. Fare riferimento al manuale della pompa per le specifiche sui diametri delle siringhe.
NOTA: Per evitare che le cellule si depositino nella siringa, fissare la pompa della siringa su un supporto a morsetto in modo che possa funzionare in posizione verticale con l'estremità della siringa rivolta verso il basso. - Impostare la portata della pompa a siringa, ~ 10-20 μL / min, e lasciare che la pompa funzioni fino a quando il fluido raggiunge la fine della linea di tubi. Fissare i tubi al dispositivo microfluidico.
- Ridurre la portata della pompa a siringa, ~5-10 μL/min, e lasciare che la pompa funzioni fino a quando tutta l'aria non viene espulsa dal dispositivo microfluidico e le celle attraversano l'uscita del dispositivo.
- Rimuovere le celle dall'uscita tramite l'aspirazione della pipetta. Riempire nuovamente il serbatoio di uscita con mezzi di recupero (come al punto 8.1.2 senza antibiotici), ~40-50 μL.
- Mappatura della permeabilizzazione della membrana a cella singola per elettroporazione
NOTA: Fare riferimento alla Figura 4 e alla Figura 5 per una migliore comprensione dei dati elettrici indicativi rispettivamente della permeabilizzazione della membrana cellulare e della mappatura della permeabilizzazione della membrana cellulare.- Impostare la portata della pompa a siringa su ~0,1-0,3 μL/min per garantire un flusso di singole celle attraverso il set di elettrodi. Il tempo di transito della cella tra gli elettrodi dovrebbe essere ~ 250 ms.
- Avviare il programma per computer facendo clic su Esegui. Assicurarsi che il sistema stia salvando i dati elettrici.
- Assicurarsi che il sistema rilevi in modo affidabile le celle per attivare le applicazioni a impulsi controllate dal computer. Regolare la soglia di rilevamento di conseguenza.
- Impostare i parametri di impulso per l'impulso iniziale di elettroporazione con energia elettrica più bassa. Fare riferimento alla Tabella 1 per i parametri di elettroporazione pulsata in questo studio.
- Accendere il canale di uscita per il generatore di impulsi di elettroporazione (passaggio 9.2.3.).
- Seguire un numero predeterminato di applicazioni di rilevamento/impulso cellulare (n = 100). Al termine di ogni condizione testata, aspirare le celle dalla presa del microdispositivo e ricostituire l'uscita con i mezzi di recupero.
- Iterare fino alla successiva condizione di impulso di elettroporazione. Ripetere l'operazione fino a testare tutte le condizioni dell'impulso di elettroporazione.
- Determinare il grado di permeabilizzazione della membrana cellulare per ogni applicazione di impulso testata. (La convalida post-processo è descritta nella sottosezione 11.1). Generare la mappa di permeabilizzazione della membrana cellulare (Figura 5).
- Determinare i parametri dell'impulso di elettroporazione per un feedback basato sulla popolazione ad alta produttività.
- Spegnere la pompa della siringa, rimuovere le celle dal serbatoio di uscita e riempire l'uscita con il mezzo di recupero.
- Elettroporazione controllata da feedback basata sulla popolazione - elevata produttività
NOTA: fare riferimento alla Figura 6 per uno schema che illustra il processo di feedback basato sulla popolazione.- Impostare la portata della pompa a siringa su ~1-3 μL/min per garantire un flusso di singole celle attraverso il set di elettrodi. Il tempo di transito della cella tra gli elettrodi dovrebbe essere ~ 25 ms.
- Impostare l'ampiezza dell'impulso sulla condizione "ottimizzata" (10.2.9), disattivare la modalità trigger e impostare la larghezza dell'impulso in modo che corrisponda al tempo di transito della cella.
- Impostare il ciclo di lavoro in modo tale che il tempo di accensione dell'impulso corrisponda alla condizione "ottimizzata". Fare riferimento alla Tabella 1.
- Impostare il generatore di funzioni del canale di uscita su ON, accendere la pompa a siringa e lasciare che il sistema funzioni fino a quando il numero desiderato di celle non è stato elettroporato.
- Al termine, spegnere sia la pompa a siringa che il generatore di funzioni.
- Trasferire le cellule dal serbatoio di uscita nel pallone/piastra di coltura cellulare di dimensioni appropriate riempito con mezzi di recupero preriscaldati e trasferire il pallone/piastra di coltura nell'incubatore.
11. Analisi
- Rilevamento della permeabilizzazione della membrana a livello di singola cellula
NOTA: Per garantire che l'impulso "ottimale" sia stato utilizzato durante il modulo ad alta produttività, è necessario eseguire un'analisi post-esperimento per verificare i dati elettrici esportati dalla sottosezione 10.2. Fare riferimento alla Figura 4 per una rappresentazione grafica del segnale elettrico rappresentativo della permeabilizzazione della membrana dovuta all'elettroporazione.- Caricare i dati in un software di analisi (MATLAB, Python, ecc.). Genera un grafico di Corrente rispetto al Tempo per ogni condizione pulsante.
- Determinare manualmente il grado di permeabilizzazione della membrana cellulare (Δ IP/ΔIC). Fare riferimento alla Figura 4. Generare la mappa di permeabilizzazione della membrana cellulare (Δ IP / ΔIC versus Electrical Energy, Figura 5) su tutte le condizioni di impulso testate. Verificare la condizione pulsante "ottimale".
- efficienza elettro-trasfezione (eTE)
- Dopo il periodo di incubazione di 24 ore, rimuovere le cellule elettroporate dall'incubatore.
- Eseguire una colorazione cellulare viva. Diluire DRAQ5 1:1000 fino ad una concentrazione finale di 5 μM nel recipiente di coltura cellulare. Mescolare delicatamente le cellule/la soluzione colorante e incubare a 37 °C per 5-30 minuti.
NOTA: in questo passaggio è possibile implementare una colorazione diversa. Assicurarsi che le proprietà fluorescenti non si sovrappongano al marcatore fluorescente che indica una corretta elettrotrasfezione (cioè, GFP è nella lunghezza d'onda verde e DRAQ5 è il rosso lontano). - Accendere un microscopio epifluorescente, una lampada e una fotocamera (vedere Tabella dei materiali).
- Rimuovere le cellule dall'incubatore e metterle a fuoco sul microscopio.
- Acquisire un'immagine a contrasto di fase (campo chiaro) del campo selezionato.
- Cattura immagini epifluorescenti dello stesso campo utilizzando i filtri FITC (GFP) e Far-Red (DRAQ5). Analizza i set di immagini manualmente o tramite un algoritmo.
NOTA: fare riferimento alla Figura 7 per le immagini rappresentative. - Contare il numero totale di celle GFP-positive in tutte le immagini. Contare il numero totale di celle colorate DRAQ5 in tutte le immagini. Calcolare l'eTE (rapporto tra cellule GFP positive e celle colorate con DRAQ5).
Access restricted. Please log in or start a trial to view this content.
Risultati
La figura 4 evidenzia i principi operativi alla base del rilevamento della permeabilizzazione della membrana a livello di singola cellula per un'ampiezza di impulso singolo. Dopo l'avvio dell'esperimento di elettroporazione, l'algoritmo di rilevamento cellulare determina una soglia ottimale per il rilevamento delle cellule tramite un metodo di rilevamento punto per punto, basato sulla pendenza. Il sistema monitora quindi continuamente (1) una variazione negativa significativa della corrente ...
Access restricted. Please log in or start a trial to view this content.
Discussione
La metodologia presentata all'interno di questo protocollo si concentra principalmente sulla microfabbricazione di un dispositivo microfluidico che viene poi integrato in una configurazione sperimentale di elettroporazione specializzata. Il termine "ricetta", che viene spesso utilizzato quando si descrivono le specifiche del processo di microfabbricazione, suggerisce l'importanza di seguire / ottimizzare ogni fase per fabbricare con successo un dispositivo funzionante. Tuttavia, alcune fasi critiche all'interno del proce...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori vorrebbero riconoscere il sostegno finanziario della National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) e della formazione universitaria del Dipartimento dell'Istruzione degli Stati Uniti in aree emergenti di precisione e medicina personalizzata (P200A150131) per finanziare lo studente laureato J.J.S. sulla borsa di studio.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
Riferimenti
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053(2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications - An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods - An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021).
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001).
- Substrate Preparation. MicroChemicals. , Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021).
- Lisinenkova, M., Hahn, L., Schulz, J. 4M 2006 - Second International Conference on Multi-Material Micro Manufacture. , Elsevier. 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive - alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX. , Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021).
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045(2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon