Method Article
Analisi semplificata e ad alta produttività della contrattilità a cella singola utilizzando elastomeri micropatterati
In questo articolo
Riepilogo
Questo lavoro presenta un protocollo flessibile per l'utilizzo della tecnologia FLECS (fluorescently labeled elastomeric contractible surfaces) in formato microwell per una quantificazione semplificata e hands-off delle forze contrattili a singola cellula basata sugli spostamenti visualizzati di micropattern proteici fluorescenti.
Abstract
La generazione della forza contrattile cellulare è un tratto fondamentale condiviso praticamente da tutte le cellule. Queste forze contrattili sono cruciali per il corretto sviluppo, funzionano sia a livello cellulare che tissutale e regolano i sistemi meccanici nel corpo. Numerosi processi biologici sono dipendenti dalla forza, tra cui motilità, adesione e divisione delle singole cellule, nonché contrazione e rilassamento di organi come cuore, vescica, polmoni, intestino e utero. Data la sua importanza nel mantenere una corretta funzione fisiologica, la contrattilità cellulare può anche guidare i processi patologici quando esagerata o interrotta. Asma, ipertensione, parto pretermine, cicatrici fibrotiche e vescica iperattiva sono tutti esempi di processi patologici guidati meccanicamente che potrebbero potenzialmente essere alleviati con un adeguato controllo della forza contrattile cellulare. Qui, presentiamo un protocollo completo per l'utilizzo di una nuova tecnologia di analisi della contrattilità basata su micropiastre nota come superfici elastomeriche contraibili marcate fluorescenti (FLECS), che fornisce un'analisi semplificata e intuitiva della contrattilità a singola cellula in modo massiccio. Qui, forniamo un protocollo graduale per ottenere due curve dose-risposta a sei punti che descrivono gli effetti di due inibitori contrattili sulla contrazione delle cellule muscolari lisce della vescica umana primaria in una procedura semplice che utilizza solo una singola micropiastra flecs, per dimostrare la tecnica corretta agli utenti del metodo. Utilizzando la tecnologia FLECS, tutti i ricercatori con laboratori biologici di base e sistemi di microscopia fluorescente hanno accesso allo studio di questo fenotipo cellulare funzionale fondamentale ma difficile da quantificare, abbassando efficacemente la barriera di ingresso nel campo della biologia della forza e dello screening fenotipico della forza delle cellule contrattili.
Introduzione
Le forze meccaniche generate dalle cellule sono essenziali per il corretto funzionamento in vari organi del corpo come l'intestino, la vescica, il cuore e altri. Questi organi devono generare modelli stabili di contrazione e rilassamento cellulare per mantenere lo stato omeostatico interno. La contrazione anormale delle cellule muscolari lisce (SMC) può portare all'insorgenza di vari disturbi, tra cui, ad esempio, la dismotilità intestinale, caratterizzata da modelli anormali di contrazione della muscolatura liscia intestinale1, nonché le condizioni urologiche della vescica iperattiva2 o iperattiva3. All'interno delle vie aeree, le SMC che presentano modelli di contrazione irregolari possono innescare iperreattività asmatica4, potenzialmente stringendo le vie aeree e diminuendo il flusso d'aria di ossigeno nei polmoni. Un'altra condizione fisica diffusa, l'ipertensione, è causata da fluttuazioni nella contrazione della muscolatura liscia all'interno dei vasi sanguigni5. Chiaramente, i meccanismi contrattili all'interno di cellule e tessuti possono portare a malattie che richiedono opzioni di trattamento. Poiché queste condizioni derivano inequivocabilmente dai comportamenti contrattili disfunzionali delle cellule, diventa logico e necessario misurare la funzione contrattile cellulare stessa, durante lo screening di potenziali candidati farmaci.
Riconoscendo la necessità di strumenti per studiare la forza contrattile cellulare, diversi metodi di analisi quantitativa della contrazione sono stati sviluppati da ricercatori accademici tra cui microscopia a forza di trazione (TFM)6, TFM7 micropatterato, saggi di gel galleggiante8 e test di micropost elastomerici9. Queste tecnologie sono state utilizzate in formato monopiatto e multiplo in numerosi studi e sono state persino proposte per misure di forza tridimensionale10,11,12,13,14. Mentre queste tecnologie hanno permesso una ricerca pionieristica nel vasto campo della biologia della forza cellulare, sono state tutte in gran parte limitate a laboratori in possesso di capacità e risorse specifiche, in particolare: capacità di fabbricare substrati TFM, capacità di applicare correttamente algoritmi complessi e non intuitivi per risolvere mappe di spostamento TFM e sistemi di microscopia relativamente precisi in grado di registrare immagini scattate prima e dopo la rimozione del campione dallo stadio (per la dissociazione cellulare). Pertanto, per un ricercatore non addestrato, la barriera all'ingresso per utilizzare questi metodi può essere piuttosto elevata data l'ampia serie di requisiti per applicare queste tecnologie. Inoltre, la risoluzione di imaging richiesta per molte tecnologie esistenti (obiettivi 40x o superiori) può limitare significativamente la produttività sperimentale, mentre le tecnologie di misurazione di massa potrebbero mascherare i contributi delle cellule anomale e impedire la scoperta di differenze contrattili più lievi. Da notare, per quanto ne sanno gli autori, solo l'approccio del saggio del gel galleggiante a bassa produttività e semi-quantitativo è maturato sufficientemente da diventare disponibile per i ricercatori (vedi Figura 1).

Figura 1: Schema generale del metodo flecs Technology. (A) Le cellule sono aderenti a micropattern proteici adesivi che sono incorporati covalentemente in un sottile strato elastomerico supportato da vetro. (B) Vista dall'alto di varie possibili forme di micropattern e un'esplosione di una cella che contrae una micropattern a forma di "X". (C) Sovrapposizione di micropattern fluorescenti e immagini a contrasto di fase di una cella contraente. (D) Immagini del corso temporale di una singola cella contraente. Barre di scala = 25 μm. Questa figura è stata adattata con il permesso di Pushkarsky et al15. Fare clic qui per visualizzare una versione più grande di questa figura.
A seguito dei recenti progressi nella microtecnologia, gli autori hanno sviluppato una tecnologia basata su micropiastre che consente misurazioni quantitative della contrazione monocellulare in centinaia di migliaia di cellule chiamate FLECS (superfici contrattibili elastomeriche marcate fluorescentemente)15,16,17,18,19,20 , in alternativa a TFM. In questo approccio, i micropattern proteici fluorescenti sono incorporati in film morbidi che si deformano e si restringono quando le cellule applicano forze di trazione a loro, in modo intuitivo e misurabile. È importante sottolineare che i micropattern proteici vincolano la posizione, la forma e l'area di diffusione delle cellule, portando a condizioni di test uniformi. Questi consentono misurazioni semplici basate solo sui loro cambiamenti dimensionali, che sono altamente risolti spazialmente anche in immagini con ingrandimento 4x. Il metodo include un modulo di analisi delle immagini basato su browser e consente un'analisi diretta della forza delle cellule contrattili senza richiedere delicate procedure di manipolazione o registrazione di marcatori fiduciari, in modo tale che dovrebbe essere azionabile da qualsiasi ricercatore con una struttura di coltura cellulare di base e un semplice microscopio fluorescente a basso ingrandimento (Figura 2 ). Questa tecnologia, che è pronta per lo scaffale e disponibile in commercio, è stata progettata pensando all'utente finale e mira a ridurre la barriera all'ingresso per qualsiasi scienziato di laboratorio per studiare la biologia della forza cellulare.

Figura 2: Schema del formato della piastra a 24 pozzetti per il saggio di contrattilità a cella singola. Questo formato è stato utilizzato negli esperimenti descritti nel presente documento e raffigurati nella parte video dell'articolo. Barre della scala = 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
In questo lavoro, presentiamo un protocollo per l'applicazione del formato a 24 piastre di pozzo della piattaforma flecs Technology per quantificare gli effetti dei farmaci modulanti la forza sulla contrattilità cellulare nelle cellule muscolari lisce della vescica primaria. Questo protocollo generico può essere adattato e modificato secondo necessità per tenere conto di varie altre scale temporali, tipi di cellule e condizioni di trattamento di interesse e ridimensionato per rispondere ad altre domande nella biologia della forza.
Protocollo
1. Giorno 1: Preparazione del piatto da 24 pozzetti
- Iniziare la procedura aggiungendo 20 mL del terreno di coltura cellulare in un tubo conico da 50 mL. In questo esperimento, viene utilizzato il mezzo a base di prosciutto F12 integrato con il 10% di siero bovino fetale (FBS).
- Ottenere una piastra a 24 pozzetti progettata per analizzare la contrattilità cellulare. Impostare la pipetta a 500 μL e ottenere un filtro cellulare per il passaggio cellulare.
NOTA: La targa è disponibile presso gli autori su richiesta. - Sollevare e tenere la piastra in una mano e procedere a sbucciare delicatamente il film plastico dalla parte superiore della piastra. Quindi riposizionare con cura il piatto.
- Accendere un aspiratore sottovuoto e aspirare lo strato superiore di soluzione salina tamponata con fosfato (PBS) dai pozzetti per evitare fuoriuscite. Rimuovere il PBS una riga alla volta. Una volta che i pozzetti non sono più completamente pieni, tenere la piastra in una mano e rimuovere con cura il resto del PBS dai pozzetti. Riempire rapidamente con 500 μL di terreno di coltura cellulare. Fare attenzione ad evitare il contatto tra l'aspiratore e il fondo del pozzo.
- Agitare delicatamente la piastra e toccare il lato per assicurarsi che l'intero fondo del pozzo sia coperto di soluzione. Una volta che tutti i pozzetti sono pieni di mezzo, impostare il piatto di lato.
2. Giorno 1: Semina cellulare
- Recuperare il pallone di coltura con passaggio 7 o più cellule primarie della muscolatura liscia della vescica umana (BSM) dall'incubatore a 37 °C. Al microscopio, controllare la morfologia cellulare e assicurarsi che le cellule siano cresciute ad almeno il 90% di confluenza ma meno del 100% di confluenza.
- Condurre il protocollo di dissociazione cellulare. All'interno di un armadio sterile di biosicurezza, tripsinare le cellule per 2,5 minuti fino a quando le cellule non si staccano prima di spegnerle con un mezzo integrato con siero (10% FBS).
- Una volta che le cellule sono dissociate, utilizzare un emocitometro per contare le cellule e diluire la sospensione cellulare a circa 50.000 cellule / mL in mezzo integrato con siero. È importante sottolineare che le cellule richiedono almeno il 2% di siero da attaccare ai micropattern.
- Prima della semina, filtrare rapidamente la sospensione cellulare attraverso un filtro cellulare da 40 o 100 μm in un tubo conico da 50 ml con una pipetta sierologica per rompere ciuffi di cellule in singole cellule.
- Aggiungere con attenzione 500 μL delle 50.000 celle/mL di sospensione cellulare in ciascuno dei 24 pozzetti sulla piastra utilizzando una pipetta P1000 erogando la soluzione a goccia in diverse posizioni nei pozzetti.
- Dopo la semina cellulare, lasciare riposare la piastra a temperatura ambiente per 1 ora per lasciare che le cellule si depositino direttamente sui micropattern senza essere influenzate dalle microcorrenti generate dall'evaporazione. Dopo 1 ora, posizionare la piastra in un'incubatrice a 37 °C durante la notte. Le cellule si auto-assemblano e si diffondono sui micropattern adesivi durante questo periodo e iniziano a esercitare livelli di contrazione basale.
3. Giorno 2: Aggiunta di farmaco di prova
NOTA: La concentrazione finale di dimetilsolfossido (DMSO) nei pozzetti contenenti cellule aderenti non può superare l'1% e il farmaco/DMSO non può essere aggiunto direttamente alle cellule, ma deve prima essere diluito e miscelato in una soluzione intermedia di mezzo cellulare.
- Creare una serie di diluizione del farmaco in sei fasi, otto volte, trasferendo 30 μL del farmaco di riserva in volumi consecutivi di DMSO da 210 μL e mescolando accuratamente tra ogni fase di trasferimento. In questo lavoro, una serie di diluizione in sei fasi, otto volte volte, di blebbistatina viene preparata in dosi che vanno da 40 μM a 1 nM, in DMSO.
- Per ogni soluzione farmacologica madre (dalla fase 3.1), mescolare 30 μL di farmaco in 470 μL di terreno di coltura cellulare. La soluzione intermedia produce una diluizione di DMSO di 16,7 volte.
- Trasferire 200 μL di ciascuna soluzione intermedia al pozzo appropriato sulla piastra a 24 pozzetti (che contiene già 100 μL di mezzo in ciascun pozzetto). Ciò produce un'ulteriore diluizione di sei volte del DMSO.
- I passaggi 3.2 e 3.3 producono collettivamente una concentrazione finale dell'1% di DMSO nei pozzi.
- Posizionare la piastra trattata in un incubatore a 37 °C per la durata appropriata. Per questo esperimento, viene utilizzata un'incubazione di 30 minuti.
- Immediatamente prima dell'imaging, aggiungere la soluzione di colorazione nucleare viva Hoechst 33342 a ciascun pozzetto (diluizione finale 1:10.000). Lasciarlo incubare per altri 15 minuti per etichettare i nuclei cellulari.
4. Giorno 2: Imaging della piastra del pozzo
- Accedi a un microscopio equipaggiato per visualizzare i canali sia per i nuclei cellulari (DAPI) che per le micropattern (TRITC).
- Per prima cosa immagina le celle solo con DMSO.
- Quindi concentrarsi e visualizzare sia i micropattern che i nuclei cellulari etichettati al fine di identificare le singole cellule e garantire che entrambi i canali siano perfettamente allineati per consentire l'analisi automatica delle immagini.
- Ripeti in più posizioni in ciascuno dei 24 pozzetti sul piatto. Le immagini possono essere scattate con obiettivo 4x (o facoltativamente superiore per accelerare l'imaging e acquisire punti dati massimi per immagine).
- Esporta le immagini come file TIF e aprile su un computer connesso al Web con ImageJ per analizzare i dati.
5. Post-esperimento: analisi delle immagini
NOTA: l'analisi delle immagini è stata eseguita utilizzando Biodock.ai portale e il software di imaging.
- Caricare le immagini acquisite su un computer.
- Assicurarsi che le corrispondenti coppie di immagini micropattern e nucleari siano denominate correttamente.
- Assicurarsi che i nomi delle immagini micropattern assumano tutti il formato "sharedCoreName_pt.tif".
- Assicurarsi che i nomi delle immagini dei nuclei assumano tutti il formato "sharedCoreName_dapi.tif".
- Converti immagini da TIF a PNG usando ImageJ.
- Una volta aperto ImageJ, caricarlo in un canale alla volta. Per questo esperimento, caricare prima le immagini di micropattern come stack in ImageJ.
- Utilizzando Image > Regola > luminosità/contrasto, regola la luminosità dell'immagine per enfatizzare i micropattern e ridurre lo sfondo al nero. Oltre a questo, appiana le immagini.
- Utilizzando Image > Type > 8-bit, convertire le immagini in 8-bit.
- Quindi esportare l'immagine in tipo PNG e selezionare la casella livello di sezione come nome file. Ora crea una nuova cartella PNG e salva i file PNG lì con lo stesso nome.
- Ripetere questo processo per le immagini dei nuclei.
- Carica coppie di immagini PNG nel software di elaborazione delle immagini per l'analisi.
- Creare e convalidare l'account. Gli autori hanno un account per consentire l'accesso aperto agli utenti accademici.
- Convalida l'account contattando gli autori.
- Accedere al software.
- Nella scheda Dati a sinistra, fai clic su Carica batch.
- Importa le immagini trascinando e rilasciando le coppie di immagini nella finestra che si apre e assegna un nome al batch. Fare clic su OK.
- Selezionare la casella accanto al nome del batch e fare clic su Analizza.
- Nella schermata successiva, scorrere verso il basso e selezionare la casella accanto a Analisi di contrattilità e fare clic su Seleziona. Più in basso nella pagina, seleziona 10x come ingrandimento utilizzato per l'imaging da un menu a discesa.
- Fai clic su Invia. Una volta che l'analisi dei dati legge Completato, fare clic sul nome del batch. Nella schermata successiva, fai clic su Scarica dati sul lato destro della pagina.
NOTA: i file scaricati conterranno immagini che sono state analizzate, risultati di riepilogo che riportano la contrazione media in ogni immagine e un'analisi dettagliata di ogni micropattern rilevato in qualsiasi immagine, riportando le loro dimensioni, posizioni, numero di celle aderenti e contrazione. - Tracciare i valori di contrazione rispetto alle concentrazioni di farmaco per generare una curva concentrazione-risposta e determinare le potenze relative dei diversi trattamenti.
- Fai clic su Invia. Una volta che l'analisi dei dati legge Completato, fare clic sul nome del batch. Nella schermata successiva, fai clic su Scarica dati sul lato destro della pagina.
Risultati
Le regioni delle immagini acquisite dai pozzi che sono stati trattati solo con DMSO e quelle che sono state trattate con blebbistatina da 40 μM sono mostrate fianco a fianco nella Figura 3. Si può chiaramente osservare che le cellule trattate solo con DMSO mostrano un livello significativo di contrazione basato sulle deformazioni molto prominenti dei micropattern a cui aderiscono le cellule muscolari lisce della vescica (BSMC) in quel pozzo. Al contrario, nell'immagine del pozzo trattato con blebbistatina da 40 μM, si osserva un significativo rilassamento cellulare7 poiché i micropattern a cui aderiscono i BSMC sono di dimensioni quasi indistinguibili dai micropattern a cui non aderiscono le cellule, indicando una contrazione minima. Queste immagini dimostrano la rappresentazione visiva intuitiva e chiara della contrattilità a singola cellula offerta dal metodo di micropatterning fluorescente. A differenza dei metodi basati su TFM, in cui il movimento omnidirezionale di numerose particelle fluorescenti distribuite casualmente sotto un monostrato cellulare denso ha lo scopo di trasmettere la forza contrattile relativa, qui, le geometrie contratte uniformi e marcate dei micropattern forniscono informazioni qualitative immediate e facilmente interpretabili sulla contrazione delle singole cellule. Questi possono essere quantificati direttamente applicando operazioni di oggetti binari standard sulle immagini.
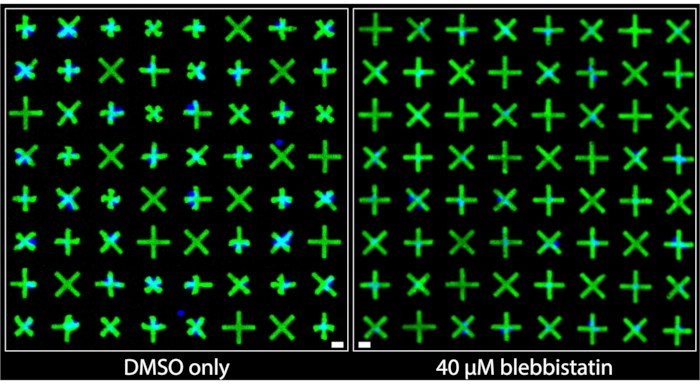
Figura 3: Confronti affiancati di immagini scattate di pozzi contenenti solo l'1% di trattamento DMSO (a sinistra) o contenenti 40 μM di blebbistatina (a destra). Si può chiaramente osservare che il trattamento con blebbistatina riduce significativamente la contrattilità delle singole cellule come indicato dai micropattern più grandi e non contratti. I nuclei blu indicano quali micropattern sono legati dalle cellule. Barra della scala = 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Applicando il modulo di analisi basato su browser per analizzare le coppie di immagini acquisite di micropattern e nuclei cellulari, si ottengono distribuzioni di contrattilità a singola cellula per ciascuna popolazione, come mostrato nella Figura 4. Descritta in dettaglio in un precedente rapporto sulla metodologia FLECS15, l'analisi funziona localizzando le posizioni e gli orientamenti di ogni micropattern a forma di "X", contando il numero di nuclei aderenti direttamente sul centro di ciascun micropattern, calcolando la lunghezza media di ciascun micropattern e calcolando la distanza in pixel della contrazione di ciascun micropattern rispetto alla lunghezza media dei micropattern vuoti (riferimento di contrazione zero). Pertanto, i micropattern vuoti hanno uno scopo importante per normalizzare i dati di contrazione. È importante sottolineare che le cellule che non si legano ai micropattern si accumuleranno sui bordi del pozzo a causa delle microcorrenti in cui non influenzeranno l'analisi delle immagini. Come si vede in questi grafici, la contrattilità imperturbabile della popolazione cellulare trattata solo con controlli DMSO si estende su un ampio intervallo fino a 20 pixel, con un centro trovato a circa 10 pixel. Nel frattempo, le cellule trattate con blebbistatina si contraggono significativamente meno e la loro distribuzione viene spinta verso il basso fino a un centro di poco più di 6 pixel. È importante sottolineare che ogni singolo micropattern trovato nell'immagine che si lega esattamente sulla cellula è rappresentato in queste distribuzioni. Ciò dimostra la capacità del metodo di trasmettere risposte cellulari differenziali ai trattamenti farmacologici.
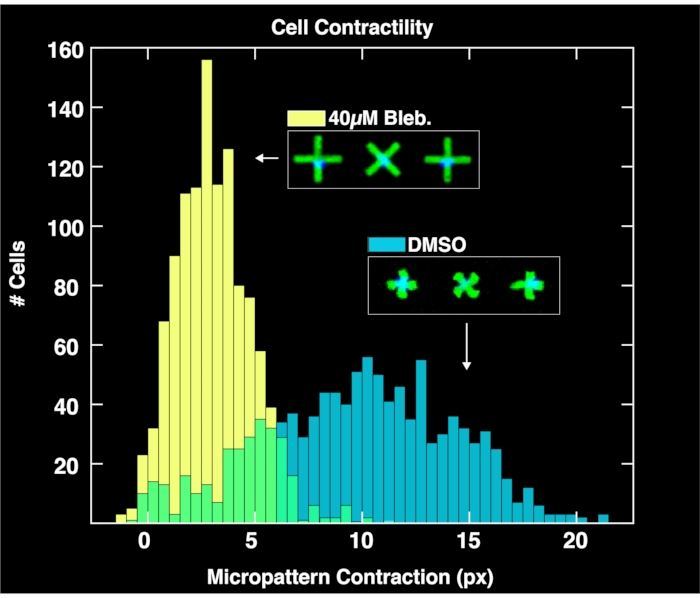
Figura 4: Istogrammi raffiguranti dati di contrattilità monocellulare ottenuti dall'analisi di immagini scattate di pozzi contenenti solo 1% dmSO (blu) o blebbistatina da 40μM. La distribuzione delle cellule trattate con DMSO è ampia e centrata su un valore di contrazione molto più grande (~ 10 pixel) rispetto alla distribuzione trattata con blebbistatina, dimostrando gli effetti quantitativi del trattamento delle cellule con blebbistatina. Fare clic qui per visualizzare una versione più grande di questa figura.
Utilizzando tutti i pozzetti su una singola piastra a 24 pozzetti e visualizzando almeno 3 siti per pozzetto, vengono generate simultaneamente curve dose-risposta a sei punti per due composti farmacologici. La Figura 5 mostra i dati concentrazione-risposta per le BSMC trattate con lo stesso intervallo di dosi di blebbistatina o citocalasina D (entrambi noti inibitori della contrattilità). Come evidente dai profili concentrazione-risposta, la citocalasina D è il più potente inibitore della contrazione tonica in queste cellule. Adattando una curva sigmoidale ai punti dati, è possibile calcolare i valori IC50 per ciascun farmaco. I nostri esperimenti indicano che l'IC50 è di 7,9 μM e 100 nM per blebbistatina e citocalasina D, rispettivamente, dopo circa 30 minuti di esposizione ai farmaci. È importante sottolineare che, nel complesso, questi valori sono coerenti con i rapporti precedenti, convalidando l'accuratezza quantitativa del metodo per determinare la potenza degli inibitori della contrazione7,21.
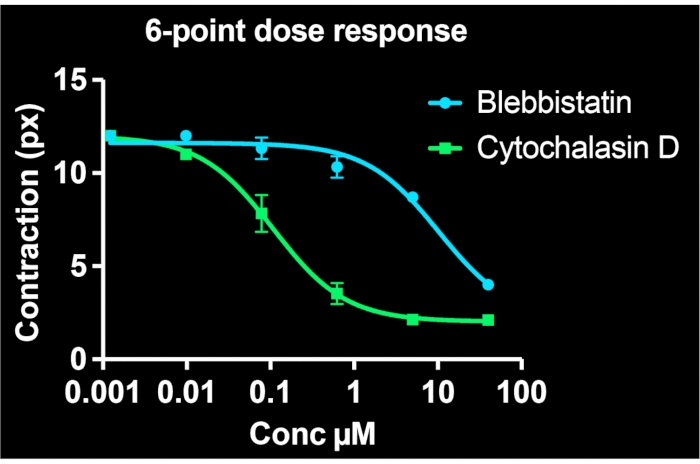
Figura 5: Curve concentrazione-risposta che descrivono gli effetti di blebbistatina e citocalasina D sulla contrattilità cellulare in singole cellule. Ogni punto dati comprende tre immagini per quella condizione. Una curva sigmoidale era adatta a ciascun set di dati. I risultati indicano che la citocalasina D è più potente, con un valore IC50 inferiore. Questi dati sono raccolti da una singola piastra FLECS a 24 pozzetti. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo metodo semplificato per misurare quantitativamente la contrazione in centinaia di migliaia di cellule alla volta in diverse condizioni di trattamento e utilizzando solo strumenti di microscopia standard fornisce un'alternativa accessibile al TFM tradizionale per i ricercatori per studiare la biologia della forza cellulare. Poiché la tecnologia presentata fornisce una visualizzazione visiva della contrazione cellulare analizzando i cambiamenti nei micropattern fluorescenti di forma regolare, l'entità della contrazione prodotta da una data cellula è intuitivamente compresa: più piccolo è il micropattern, maggiore è la forza contrattile esercitata dalla cellula.
In particolare, offrendo il controllo su fattori come la forma, l'area di diffusione e la molecola di adesione che comprende i micropattern (tutti fattori noti per regolare la contrattilità cellulare22,23,24), la tecnologia presentata elimina sistematicamente variabili aggiuntive che possono confondere le interpretazioni degli studi di contrazione cellulare.
In questo esperimento, è stata utilizzata una rigidità di 10 kPa nel gel e un micropattern di 70 μm (lunghezza diagonale) composto da collagene di tipo IV. Oltre a questi parametri, la molecola adesiva può essere sostituita con vari collageni, fibronectina, gelatina e altre matrici extracellulari (ECM). La rigidità del gel può essere regolata fino a 0,1 kPa e fino alla gamma MPa. La geometria del micropattern può essere progettata de novo per essere qualsiasi forma con una dimensione minima delle caratteristiche di ~ 5 μm. Questi parametri sono disaccoppiati e possono essere ottimizzati in modo indipendente per un particolare contesto biologico.
Questa tecnologia è stata ampiamente convalidata per essere compatibile con tipi di cellule altamente adesive e contrattili di un fenotipo mesenchimale tra cui vari tipi di cellule muscolari lisce (vescica umana primaria, intestinale, tracheale, bronchiale, uterina, aortica e arteriosa), cellule staminali mesenchimali e la loro progenie differenziata, vari fibroblasti (polmonari, dermici e cardiaci), miofibroblasti e cellule endoteliali. Inoltre, i macrofagi derivati dai monociti produrranno anche una grande forza fagocitica misurabile sui micropattern, in particolare se il micropattern è costituito da un'opsonina nota. Varie linee di cancro possono anche essere analizzate utilizzando il metodo.
Il metodo può porre alcune sfide per l'uso con cellule che sono relativamente piccole come le cellule T e i neutrofili, o tipi di cellule con un fenotipo prevalentemente epiteliale. La ragione principale di ciò è che il metodo si basa su una forte adesione e sulla completa diffusione delle cellule sul micropattern al fine di generare il segnale contrattile misurabile. Le cellule che si legano debolmente, si legano l'una all'altra o non si diffondono completamente non produrranno segnali contrattili misurabili. Questi comportamenti, che sono relativamente rari, possono essere mitigati regolando la dimensione del micropattern in modo che sia più piccola o utilizzando molecole adesive alternative all'interno dei micropattern che promuoveranno meglio l'adesione e la diffusione in quelle cellule.
Gli utenti della tecnologia devono valutare attentamente diverse possibili formulazioni di terreni di coltura cellulare per il loro particolare tipo di interesse cellulare, poiché diversi componenti, fattori di crescita, livelli sierici e sensibilità al pH possono guidare comportamenti variabili in cellule diverse. L'ottimizzazione del protocollo dovrebbe precedere il ridimensionamento di qualsiasi flusso di lavoro sperimentale e i componenti multimediali dovrebbero essere sempre freschi, sterili e coerenti con i lotti precedenti.
In definitiva, se la risoluzione a cella singola non è necessaria per gli obiettivi di un utente, o se il tipo di cella target ha una capacità di diffusione minima, allora il TFM tradizionale può essere ugualmente o più adatto per tali esperimenti. L'obiettivo e la speranza degli autori è che questo strumento fornisca un'ulteriore strada per i biologi cellulari per studiare la contrazione cellulare, in particolare nel contesto di screening fenotipici automatizzati ad alto rendimento.
Specifiche per usi futuri negli schermi di farmaci, possono essere utilizzate piastre a più alta produttività come una piastra FLECS a 384 pozzetti. In tali piastre, obiettivi 4x su molti microscopi possono catturare un intero singolo pozzo nel loro campo visivo, assicurando che tutte le risposte contrattili cellulari vengano catturate. Utilizzando un sistema di imaging ad alta produttività, un'intera piastra a 384 pozzetti può essere ripresa in circa 5 minuti, rendendo questo sistema notevolmente più veloce di altre opzioni e, quindi, adatto per la scoperta di farmaci fenotipici ad alto rendimento. In effetti, gli autori eseguono regolarmente screening settimanali di farmaci su ~ 50 384-wellplates (per un totale di oltre 19.000 pozzi) utilizzando l'automazione.
Divulgazioni
I.P. è un inventore di una famiglia di brevetti rilasciati che protegge i metodi e i sistemi della tecnologia FLECS. I.P., Y.W., J.Z., E.C. e R.H. sono tutti dipendenti di Forcyte Biotechnologies, Inc. R.D. è professore presso UCLA e cofondatore di Forcyte Biotechnologies, Inc. I.P., Y.W., J.Z. e R.D. detengono interessi finanziari in Forcyte Biotechnologies, Inc., che è il licenziatario esclusivo dei brevetti di cui sopra e sta commercializzando FLECS Technology.
Riconoscimenti
Il lavoro di laboratorio è stato condotto con il supporto dell'UCLA Molecular Shared Screening Resource (MSSR) dove Forcyte sponsorizza attività di ricerca, e del Magnify Incubator presso il California NanoSystems Institute (CNSI), dove Forcyte Biotechnologies, Inc. è una società residente. Gli autori concederanno l'accesso al modulo di analisi flecs Biodock.ai a tutti i ricercatori accademici su richiesta. L.H. e I.P. hanno contribuito ugualmente a questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| Bladder smooth muscle cell culture | Sciencell | #4310 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Cell culture media | Thermofisher | 11765054 | Ham's F12 medium supplemented with 10% FBS and 1% p/s |
| Cell strainer | Fisher Scientific | 7201432 | |
| Conical Tube | Fisher Scientific | 05-539-13 | |
| Culture flask | Fisher Scientific | FB012941 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| DMSO (Dimethyl sulfoxide) | Fisher Scientific | D1284 | |
| Eppendorf tubes | Fisher Scientific | 05-402-31 | |
| Fluorescent microscope | Molecular Devices | ImageXpress Confocal | |
| Forcyte-manufactured 24-well plate | Forcyte Biotechnologies | 24-HC4R-X1-QB12 | |
| Hoescht 3342 Live Nuclear Stain | Thermofisher | 62249 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP39920 |
Riferimenti
- Ohama, T., Hori, M., Ozaki, H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: How smooth muscle contraction is reduced. Journal of Smooth Muscle Research. 43 (2), 43-54 (2007).
- Peyronnet, B., et al. A comprehensive review of overactive bladder pathophysiology: On the way to tailored treatment. European Urology. 75 (6), 988-1000 (2019).
- Aldamanhori, R., Osman, N. I., Chapple, C. R. Underactive bladder: Pathophysiology and clinical significance. Asian Journal of Urology. 5 (1), 17-21 (2018).
- Sanderson, M. J., Delmotte, P., Bai, Y., Perez-Zogbhi, J. F. Regulation of airway smooth muscle cell contractility by Ca2+ signaling and sensitivity. Proceedings of the American Thoracic Society. 5 (1), 23-31 (2008).
- Brozovich, F. V., et al. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders. Pharmacological Reviews. 68 (2), 476-532 (2016).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Bell, E., Ivarsson, B., Merrill, C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proceedings of the National Academy of Sciences. 76 (3), 1274-1278 (1979).
- Tan, J. L., et al. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences. 100 (4), 1484-1489 (2003).
- Rokhzan, R., et al. high-throughput measurements of cell contraction and endothelial barrier function. Laboratory Investigation. 99 (1), 138-145 (2019).
- Park, C. Y., et al. High-throughput screening for modulators of cellular contractile force. Integrative Biology. 7 (10), 1318-1324 (2015).
- Kaylan, K. B., Kourouklis, A. P., Underhill, G. H. A high-throughput cell microarray platform for correlative analysis of cell differentiation and traction forces. Journal of Visualized Experiments. (121), e55362 (2017).
- Huang, Y., et al. Traction force microscopy with optimized regularization and automated Bayesian parameter selection for comparing cells. Scientific Reports. 9, 539 (2019).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLOS ONE. 6, 17833 (2011).
- Pushkarsky, I., et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering. 2 (2), 124-137 (2018).
- Pushkarsky, I. FLECS technology for high-throughput single-cell force biology and screening. ASSAY and Drug Development Technologies. 16 (1), 7-11 (2017).
- Koziol-White, C. J., et al. Inhibition of PI3K promotes dilation of human small airways in a rho kinase-dependent manner. British Journal of Pharmacology. 173 (18), 2726-2738 (2016).
- Orfanos, S., et al. Obesity increases airway smooth muscle responses to contractile agonists. American Journal of Physiology-Lung Cellular and Molecular Physiology. 315 (5), 673-681 (2018).
- Tseng, P., Pushkarsky, I., Carlo, D. D. Metallization and biopatterning on ultra-flexible substrates via dextran sacrificial layers. PLOS ONE. 9, 106091 (2014).
- Yoo, E. J., et al. Gα12 facilitates shortening in human airway smooth muscle by modulating phosphoinositide 3-kinase-mediated activation in a RhoA-dependent manner. British Journal of Pharmacology. 174 (4), 4383-4395 (2017).
- MacGlashan, D., Vilariño, N. Polymerization of actin does not regulate desensitization in human basophils. Journal of Leukocyte Biology. 85 (4), 627-637 (2009).
- Hocking, D. C., Sottile, J., Langenbach, K. J. Stimulation of integrin-mediated cell contractility by fibronectin polymerization. Journal of Biological Chemistry. 275 (14), 10673-10682 (2000).
- Tolić-Nørrelykke, I. M., Wang, N. Traction in smooth muscle cells varies with cell spreading. Journal of Biomechanics. 38 (7), 1405-1412 (2005).
- Ye, G. J. C., et al. The contractile strength of vascular smooth muscle myocytes is shape dependent. Integrative Biology. 6 (2), 152-163 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon