Method Article
Transezione del midollo spinale nei girini xenopus laevis
In questo articolo
Riepilogo
La trascrizione del midollo spinale del girino Xenopus laevis è un metodo di lesione rilevante per studiare la lesione e la rigenerazione del midollo spinale effettuando un taglio trasversale che recide completamente il midollo spinale a livello toracico.
Abstract
La lesione del midollo spinale (SCI) è un'afflizione permanente, che colpisce i nervi motori e sensoriali del sistema nervoso centrale (SNC), con conseguente paralisi sotto il sito della lesione. Ad oggi, non esiste una terapia di recupero funzionale per la SCI e vi è una mancanza di chiarezza riguardo ai molti complessi ed eventi dinamici che si verificano dopo la SCI. Molti organismi non mammiferi possono rigenerarsi dopo una grave SCI, come i pesci teleostei, gli anfibi urodele e gli stadi larvali degli anfibi anuri, compresi i girini Xenopus laevis . Si tratta di organismi modello in buona fede per studiare e comprendere la risposta alla SCI e i meccanismi alla base dei processi rigenerativi di successo. Questo tipo di ricerca può portare all'identificazione di potenziali bersagli per l'intervento terapeutico SCI. Questo articolo descrive come eseguire la transezione del midollo spinale del girino Xenopus laevis , tra cui allevamento, chirurgia, cure post-chirurgiche e valutazione del test funzionale. Questo metodo di lesione può essere applicato per chiarire le diverse fasi della rigenerazione del midollo spinale studiando i meccanismi cellulari, molecolari e genetici, nonché l'evoluzione istologica e funzionale dopo la SCI e durante la rigenerazione del midollo spinale.
Introduzione
La lesione del midollo spinale (SCI) è un'afflizione che colpisce circa 250.000-500.000 persone in tutto il mondo ogni anno1. Oltre a questa alta prevalenza, la SCI colpisce i nervi sensoriali e motori, generando paralisi sotto il sito della lesione e disconnessione di alcuni organi interni dal controllo del SNC. Il midollo spinale, una parte del SNC, non può rigenerarsi e, a causa della complessità dell'afflizione e della mancanza di una comprensione completa di tutti i processi coinvolti, non esistono ancora terapie efficienti che consentano il recupero funzionale.
Gli organismi non mammiferi, come i pesci teleostei, gli anfibi urodele e gli stadi larvali degli anfibi anuri, che possono rigenerare il midollo spinale dopo sci2,3,4 gravi, sono organismi modello eccellenti per studiare i processi che governano un evento rigenerativo di successo e comprendere il fallimento della rigenerazione dei mammiferi. Questa comprensione è di grande interesse in quanto potrebbe fornire approfondimenti originali per sviluppare nuovi bersagli terapeutici e possibili terapie per la SCI.
La rana anura, Xenopus laevis, è un eccellente organismo modello per studiare la SCI. Ha ottime capacità rigenerative durante gli stadi del girino, che si perdono progressivamente durante la metamorfosi, permettendo la sperimentazione negli stadi rigenerativi e non rigenerativi3,5. Il metodo di lesione stabilito per studiare la SCI nei girini xenopus laevis consiste nell'amputazione della coda, in cui viene rimossa l'intera coda, compresi tessuti come muscoli, notocorda e midollo spinale6. Questo approccio è stato determinante nella comprensione dei meccanismi generali dei processi rigenerativi4,7,8,9,10.
Poiché l'amputazione della coda coinvolge più tessuti oltre al midollo spinale, che è diverso da ciò che accade dopo la SCI umana, è necessario un paradigma di lesione più rilevante per lo studio della SCI. Ci siamo basati su studi utilizzati in passato11 per generare descrizioni complete dei paradigmi di lesione5,12,13,14 e diversi metodi per lo studio di SCI12,13,14,15,16,17,18 . Dopo la transezione del midollo spinale, la porzione caudale del midollo spinale può essere isolata per l'espressione di RNA e proteine e analisi ad alto rendimento14,19,20,21. Inoltre, le iniezioni intracelomiche di farmaci e piccole molecole, così come l'elettroporazione di cDNA, RNA o morfolino, prima o dopo la trasduzione del midollo spinale, consentono lo studio degli effetti di queste molecole nella prevenzione o nel trattamento della SCI o di eventi specifici che si verificano dopo sci e rigenerazione del midollo spinale13,14 . Inoltre, l'evoluzione della lesione e i processi rigenerativi possono essere studiati in tempi diversi dopo l'infortunio utilizzando approcci biochimici, molecolari, istologici e funzionali12,13,14,17,19,20,21,22,23.
Infine, tutte le suddette tecniche possono essere utilizzate in fasi non rigenerative, evidenziando uno dei vantaggi più importanti dell'utilizzo di Xenopus laevis come organismo modello per studiare la SCI, gli studi comparativi dei meccanismi rigenerativi e non rigenerativi nelle stesse specie13,19,20,21,22. Questo documento presenta un protocollo per la transezione del midollo spinale del girino Xenopus laevis, a partire dalla stadiazione e selezione dei girini rigenerativi Nieuwkoop e Faber (NF) stadio 50. Segue la descrizione delle procedure per la chirurgia del midollo spinale per produrre animali finti e transettati, la cura postchirurgica e infine l'analisi del recupero funzionale mediante la misurazione della distanza di nuoto del girino libero.
Protocollo
Questo protocollo fornisce informazioni sufficienti per eseguire con successo la transezione del midollo spinale. Da notare, ci sono eccellenti protocolli dettagliati di queste tecniche pubblicati altrove14, che possono integrare quello presentato qui. Tutte le procedure animali sono state approvate dal Comitato di Bioetica e Biosicurezza della Facoltà di Scienze Biologiche, Pontificia Universidad Católica de Chile.
1. Accoppiamento naturale delle rane
- Da tre a cinque giorni prima dell'accoppiamento, preintettare per via sottocutanea rane maschili e femminili con 50 unità di gonadotropina corionica umana (hCG). Usa la tecnica dell'"artiglio di ferro" per trattenere le rane; poiché le rane sono scivolose, usa una rete per circondare la rana, se necessario. Inserire la punta di un ago da 26 G x 1/2" posteriore alla linea laterale, spingendolo dorsalmente ad una profondità di 1 cm, tra la pelle e il muscolo.
- Prima dell'accoppiamento, iniettare il maschio con 300 unità e la femmina con 700 unità di hCG.
- Affinché avvenga l'accoppiamento, porre il maschio e la femmina in 2 L di 0,1x soluzione di Barth immediatamente dopo aver raffreddato la soluzione a 4 °C per 15 minuti per assomigliare alle condizioni primaverili e lasciare durante la notte a 18 °C.
- Sedici ore dopo, raccogli con cura gli embrioni con l'aiuto di una pipetta pasteur di plastica, con la punta tagliata, e mettili in piastre di Petri di 10 cm di diametro. Rimuovere la gelatina embrionale incubando gli embrioni con 25 ml di cisteina al 2% in acqua distillata (pH 7,8; assicurarsi che la soluzione copra gli embrioni) per 5 minuti con leggera agitazione. Lavare 3 volte con acqua distillata e 3 volte con 0,1x soluzione di Barth (8,9 mM NaCl; 102 μM KCl; 238,1 μM NaHCO3; 1 mM 4-(2- idrossietil)-1-piperazina acido etansolfonico (HEPES); 81,14 μM MgSO4; 33,88 μM Ca(NO3)2; 40,81 μM CaCl2, pH 7,6).
- Seleziona embrioni sani che hanno un colore brunastro e blastomeri che si dividono simmetricamente. Posizionare gli embrioni in piastre di Petri di 10 cm di diametro con 50 ml di soluzione di Barth 0,1x ad una densità non superiore a 100 embrioni per piatto.
2. Allevamento
- Durante la prima settimana, mantenere gli embrioni a 18 °C fino a quando non escono dal sacco vitellino. Durante questo periodo, cambiare la soluzione di Barth ogni giorno e rimuovere embrioni morti biancastri e girini che presentano qualsiasi alterazione anatomica visibile o girini senza alcun movimento di nuoto.
- Dopo la prima settimana, trasferire i girini in acqua priva di cloro in serbatoi di plastica ad una densità di 10 animali per litro. Coltiva girini a 20-21 °C con un ciclo buio di 12 ore di luce / 12 ore, con pietre di ossigeno disponibili in ogni vasca per aerare l'acqua e alimentate una volta al giorno con 0,5 mg per animale. Sostituire l'acqua una volta alla settimana e verificare quotidianamente la presenza di rifiuti accumulati e animali morti24.
3. Messa in scena
- Tre o quattro settimane dopo la fecondazione, mettere gli animali in una capsula di Petri; quindi, uno per uno, controlla la morfologia e l'aspetto degli arti anteriori e posteriori. Se necessario, anestetizzare gli animali mettendo gli animali in una capsula di Petri con 50 ml di tricaina mesilato allo 0,02% in soluzione di Barth 0,1x per una migliore manipolazione. Dopo non più di 2 minuti, posizionare gli animali in 0,1x soluzione di Barth per il recupero dall'anestesia.
- Cerca le seguenti caratteristiche anatomiche degli animali allo stadio 5025: arti anteriori che stanno appena apparendo e sono sferici (Figura 1); arti posteriori sporgenti e sferici (Figura 1).
NOTA: per questa procedura possono essere utilizzati animali dalle fasi 49 a 51 (Figura 1); per ulteriori informazioni sulle fasi, fare riferimento a Nieuwkoop e Faber's Normal Table of Xenopus laevis25.
4. Chirurgia: transezione del midollo spinale e animali finti
- Anestetizzare i girini allo stadio 50 mettendoli in una capsula di Petri con 50 ml di 0,02% di tricaina mesilato in soluzione di Barth 0,1x per 2 minuti.
- Con l'aiuto di un cucchiaio e di una pinza, posizionare il girino, lato dorsale verso l'alto, su un pezzo di garza bagnato nella metà superiore di una capsula di Petri di vetro.
- Eseguire un'incisione della pelle e dei muscoli dorsali a livello medio toracico (Figura 2A, B) utilizzando le forbici a molla per microdissezione.
- Per controllare gli animali finti, assicurarsi che la dimensione dell'incisione sia di soli ~ 0,2 mm (Figura 2C); non danneggiare il midollo spinale (Figura 2D,D').
- Per gli animali transettati, eseguire una seconda incisione di ~0,2 mm (Figura 2C) per transettare completamente il midollo spinale (Figura 2E,E').
5. Assistenza post-operatoria
- Dopo l'intervento chirurgico, trasferire i girini in un serbatoio contenente 0,5 L di 0,1x soluzione di Barth con 1x Penicillina-streptomicina, ad una densità di 10-12 animali per vasca. Mantenere il transetto e controllare gli animali finti in vasche separate.
NOTA: i girini si riprenderanno dall'anestesia in un paio di minuti. - Mantenere i girini con aerazione ad una temperatura di 20-21 °C.
- Cambiare la soluzione di Barth con antibiotici a giorni alterni fino alla fine dell'esperimento.
- Inizia a nutrire gli animali un giorno dopo l'intervento chirurgico, una volta al giorno.
- Elimina gli animali morti.
6. Test di nuoto
- Ottenere una scatola con illuminazione a LED dall'interno, ricoperta da un foglio di polistirolo trasparente, che consente il passaggio della luce.
- Installare una telecamera sulla scatola LED.
- Posizionare una capsula di Petri di 15 cm di diametro sopra la scatola, riempita con 100 ml di soluzione di Barth 0,1x.
- Un giorno dopo la traslazione, posizionare un girino nella capsula di Petri e lasciare per un periodo di adattamento di 5 minuti.
- Dopo l'adattamento, inizia a tracciare il video del comportamento di nuoto libero utilizzando il software di riferimento (vedi la Tabella dei materiali) per 5 minuti.
- Una volta completato il video, trasferisci il girino nel suo serbatoio.
- Ripeti il monitoraggio video 5, 10, 15 e 20 giorni dopo la trasduzione (Figura 3).
7. Considerazioni bioetiche
NOTA: La mortalità degli animali dopo un intervento chirurgico fittizio e la transezione è rispettivamente del 13% e del 30%. Inoltre, un minimo di 15-20 animali per gruppo è necessario per l'analisi statistica. Pertanto, inizia con 23 animali finti e 26 transettati.
- Anestetizzare gli animali con 0,02% di tricaina mesilato per 2 minuti per assicurare una riduzione dell'attività neuronale e motoria e del dolore prima dell'intervento chirurgico.
- Dopo l'intervento chirurgico, controllare gli animali per il recupero dall'anestesia. Inoltre, nutrire e controllare gli animali ogni giorno.
- Dopo aver terminato il test di nuoto, sacrificare gli animali con un sovradosaggio di tricaina mesilato (1% tricaina mesilato preparato in 30 mM di soluzione di bicarbonato di sodio).
Risultati
Il protocollo qui descritto consente lo studio della rigenerazione del midollo spinale in Xenopus laevis. Gli effetti di specifici trattamenti farmacologici e il contributo di una specifica espressione genica nella rigenerazione del midollo spinale possono essere valutati misurando i loro effetti sul recupero del nuoto. La distanza totale di nuoto viene tracciata rispetto ai giorni successivi all'infortunio per confrontare gli animali di controllo e trattati in un punto temporale specifico o in un periodo specificato. Il recupero della funzione motoria nel tempo è esemplificato nella Figura 3, che mostra la distanza di nuoto a 5, 10, 15 e 20 giorni dopo la transezione. A 5 giorni dalla transezione, gli animali nuotavano in media 0,7 m in 5 minuti, mostrando una ridotta capacità di nuoto. Questa capacità è aumentata con il passare dei giorni, poiché una media di 2,1 e 3,1 m / 5 min è stata osservata dopo 10 e 15 giorni dopo la transezione, rispettivamente, e il recupero completo delle capacità di nuoto è stato osservato a 20 giorni dopo la transezione, con una media di 5,7 m / 5 min.
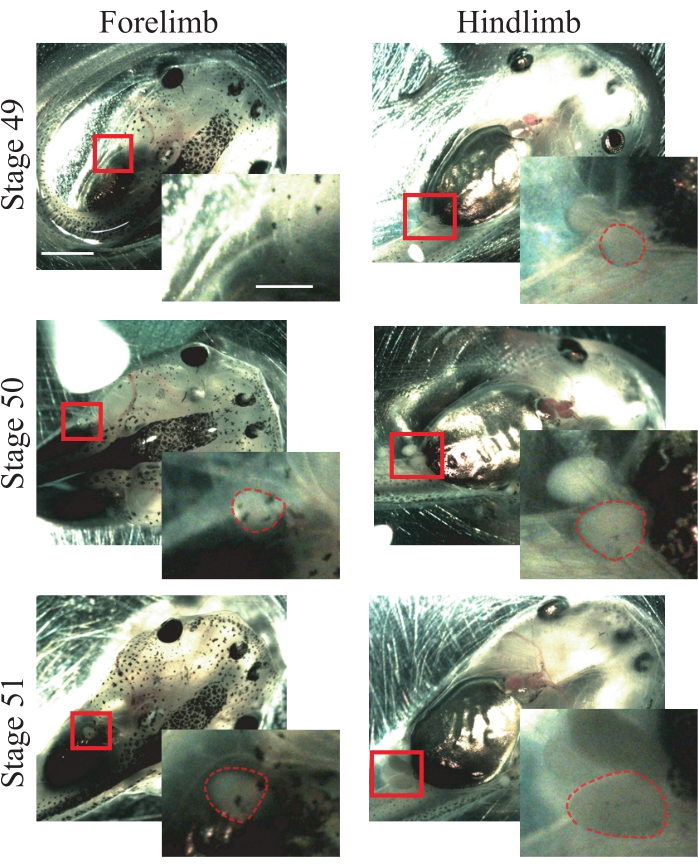
Figura 1: Stadiazione del girino xenopus. Immagini rappresentative degli stadi 49-51, che mostrano gli arti anteriori e posteriori per riferimento alla stadiazione animale. Barre di scala = 2 mm. Gli ingrandimenti della regione in scatola sono mostrati in basso a destra di ogni immagine. Barre di scala = 1 mm. Nella fase 49, gli arti anteriori non sono osservati, mentre gli arti posteriori stanno appena apparendo, mostrando una forma sferica. Lo stadio 50 presenta arti anteriori che stanno appena apparendo, mostrando una forma sferica e arti posteriori sporgenti con una forma sferica. Nella fase 51, gli arti anteriori presentano una forma sferica sporgente e gli arti posteriori una forma allungata sporgente. I contorni tratteggiati mostrano arti anteriori e posteriori. Fare clic qui per visualizzare una versione più grande di questa figura.
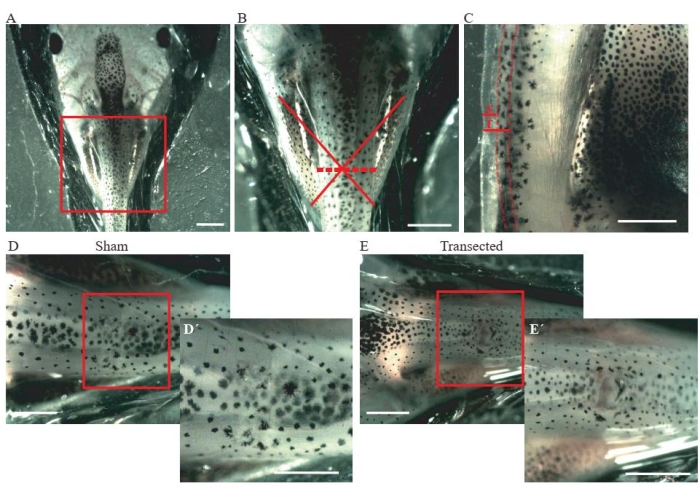
Figura 2: Transezione del midollo spinale. (A) Immagine rappresentativa che mostra il corretto posizionamento dell'animale, lato dorsale verso l'alto, per l'esecuzione dell'intervento chirurgico. Barra della scala = 2 mm. (B) L'ingrandimento di A mostra la posizione e l'entità della lesione. La croce rossa mostra la posizione esatta del sito della lesione a livello toracico del midollo spinale e la linea tratteggiata mostra l'entità della lesione. Barra della scala = 1 mm. (C) Immagine rappresentativa che mostra una vista laterale del livello toracico del midollo spinale. Viene mostrata l'estensione dell'incisione fittizia e della transezione. Le linee tratteggiate delineano i limiti del midollo spinale. Barra della scala = 1 mm. (D) Immagine rappresentativa che mostra un animale finto con un midollo spinale intatto. Barre della scala = 1 mm. (E) Immagine rappresentativa che mostra un animale transetto con un midollo spinale interrotto. Barre di scala = 1 mm. Gli ingrandimenti della regione in scatola sono mostrati in basso a destra di ogni immagine (D' ed E'). Barre della scala = 1 mm. Abbreviazioni: S = incisione fittizia; T = transezione. Fare clic qui per visualizzare una versione più grande di questa figura.
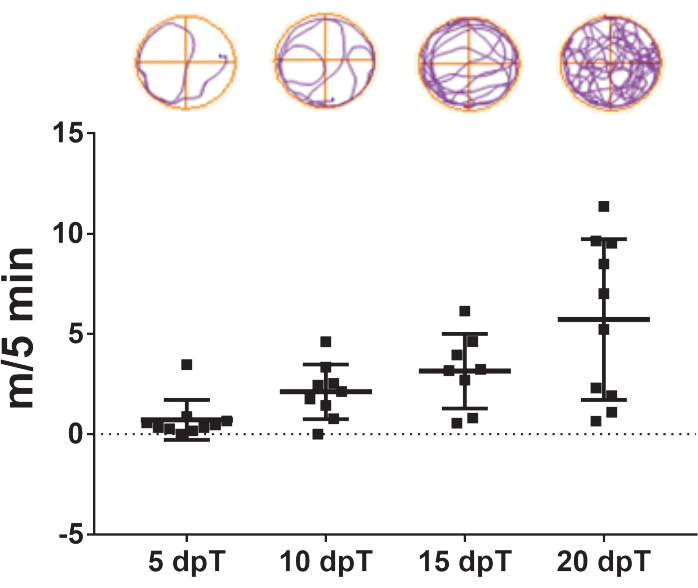
Figura 3: Recupero della funzione nuoto nel tempo. Dot plot rappresentativo della distanza di nuoto percorsa dagli animali transettati in 5 minuti a 5, 10, 15 e 20 giorni dopo la traslazione. Esempi di traiettorie di nuoto sono mostrati in alto. Dati presentati come ± SEM da 10 girini. Abbreviazioni: dpT = giorni dopo la transezione; SEM = errore standard della media. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo qui descritto è un metodo eccellente per eseguire SCI e valutare il recupero funzionale. Per la riproducibilità, è essenziale coltivare girini sani e scegliere animali di dimensioni simili. La mancanza di un'alimentazione adeguata genera stress nutrizionale, che si traduce in scarse capacità rigenerative26; pertanto, è necessario prestare particolare attenzione all'alimentazione dei girini. Quando i girini raggiungono lo stadio 50 dopo 3-4 settimane, possono essere allevati a temperature più elevate per accelerare il processo di crescita, 18-25 ° C è ottimale27. La qualità dell'acqua è importante, poiché gli animali sono sensibili alle condizioni dell'acqua e ai prodotti chimici. Le condizioni ottimali dell'acqua includono l'utilizzo di acqua filtrata a carbone, priva di cloro con i seguenti parametri: pH (6,5-7,5), cloruro (<0,02 mg / L), conducibilità dell'acqua (1,0 mS / cm ± 0,1 unità), rame (<0,3 mg / L); durezza carbonatica (KH: 5-10 dKH); durezza generale (GH: 6-16 dGH); nitrato (NO3: <20 mg/L); e nitrito (NO2: <0,1 mg/L)14,27,28. Inoltre, per evitare la contaminazione, i serbatoi di plastica devono essere puliti una volta alla settimana per l'allevamento di animali o a giorni alterni dopo l'intervento chirurgico lavando accuratamente con acqua priva di cloruri e una spugna; il detergente deve essere evitato.
Per un migliore tasso di sopravvivenza dopo l'intervento chirurgico, i girini non devono essere esposti all'anestesia per lunghi periodi (non più di 2 minuti). Inoltre, si consiglia di anestetizzare un girino alla volta. Poiché gli animali hanno bisogno di rimanere idratati, tenere gli animali immersi in soluzione tutto il tempo prima e dopo l'intervento chirurgico e versare la soluzione con un cucchiaio sopra il girino prima di iniziare l'intervento chirurgico. Assicurarsi che il danno sia abbastanza esteso da coprire l'intero midollo spinale ma non troppo esteso in quanto può indurre uno scarso recupero funzionale o la morte. Se la notocorda è danneggiata, l'animale sarà piegato e il recupero funzionale sarà influenzato. Se il danno si estende oltre la notocorda, la probabilità di morte aumenta14. Durante il test di nuoto, la registrazione è considerata corretta se il software identifica ogni animale con un'ombra blu; in caso contrario, la registrazione deve essere ripetuta. È importante evitare movimenti e cambi di aria o luce durante il processo di registrazione per evitare errori di registrazione.
Ci sono ancora molte domande aperte sui meccanismi cellulari e molecolari alla base del danno e della rigenerazione del midollo spinale. Il protocollo descritto in questo lavoro può essere utilizzato per studiare il contributo di diversi eventi cellulari, espressione genica e trattamenti sul recupero funzionale, determinati misurando le capacità di nuoto. Inoltre, molte altre tecniche possono essere applicate agli animali operati. Il midollo spinale può essere isolato per eseguire l'estrazione di proteine e/o mRNA14 per studiare i profili di espressione proteica e genica dopo danni e trattamenti19,20. Questo intervento chirurgico è stato anche la base per studiare la risposta cellulare del midollo spinale22 e il comportamento delle cellule progenitrici staminali neurali12,13,22 dopo la lesione del midollo spinale. Anche le cascate di segnalazione coinvolte nella rigenerazione del midollo spinale sono state studiate utilizzando il paradigma del danno al midollo spinale descritto nel presente documento23. In sintesi, il protocollo qui descritto è un modello eccellente per studiare le lesioni e la rigenerazione del midollo spinale ed è stato utilizzato per molti studi che hanno contribuito alle conoscenze esistenti sull'argomento.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato finanziato da assegni di ricerca di: PG Slater: FONDECYT N° 3190820; J. Larraín: FONDECYT N° 1180429, CARE Chile UC-Centro de Envejecimiento y Regeneración (PFB 12/2007).
Materiali
| Name | Company | Catalog Number | Comments |
| Air pump | Regent CALM | RC-006 | For oxygen diffuser stones function |
| ANY-maze software | Stoelting | Swimming behavior test | |
| Ca(NO3)2·4H2O | Sigma-Aldrich | 237124 | |
| CaCl2·2H2O | Sigma-Aldrich | 223506 | |
| Camera | Stoelting | 60528 | Swimming behavior test |
| Computer | Swimming behavior test (minimum recommended specifications: PC, Windows 7, Intel Core i3, 2 GB RAM, 10-GB drive disk, 1 available USB port, 1,366 × 768 monitor) | ||
| Cysteine | Sigma-Aldrich | C7352 | |
| Dissecting stereomicroscope | Nikon | SMZ745T | Surgery / staging |
| Glass Petri dishes | 100 x 20 mm | ||
| HEPES | Gibco | 11344-041 | |
| Human chorionic gonadotropin | It can be found in different formats in the pharmacy | ||
| KCl | Merck Millipore | 104936 | |
| LED light box | custom made | wood box: 55-cm length, 34-cm width, 9-cm height, LED lights, transparent polystyrene sheet) | |
| MgSO4·7H2O | Merck Millipore | 105886 | |
| Microdissection scissors for transection | Fine Science Tools | 15003-08 | Spring Scissors for surgery |
| MS-222 | Sigma-Aldrich | E10521 | Anesthetic; tricaine mesylate |
| NaCl | Merck Millipore | 106404 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Nasco Frog Brittle for Tadpole Xenopus | Nasco | SB09480(LM)MX | Food for Xenopus tadpoles stage 44 to 60 |
| Oxygen diffuser stones | Pentair | AA1 | Mantainance of animals |
| Pair of forceps | Fine Science Tools | Dumont n° 5 SF forceps | For surgery |
| Penicillin | Sigma-Aldrich | P7794 | |
| pH meter | |||
| Plastic Pasteur pipette | Sigma-Aldrich | Z331740 | For collecting embryos after mating |
| Plastic Petri dishes | Sigma-Aldrich | P5981 | 150 x 15 mm |
| Plastic tank/box with lid | 4.5 liter capacity; 20 cm × 17 cm × 15 cm or similar | ||
| Sterilized gauze | |||
| Streptomycin | Sigma-Aldrich | S1277 | |
| Tablespoon | |||
| Xenopus laevis specialized strains and lines | National Xenopus Resource European Xenopus Resource Centre Xenopus laevis Research Resource Centre | http://www.mbl.edu/xenopus https://xenopusresource.org/ https://www.urmc.rochester.edu/microbiology-immunology/xenopus-laevis.aspx | |
| Xenopus laevis wild type | Xenopus 1 Xenopus Express | https://xenopus1.com http://www.xenopus.com |
Riferimenti
- International perspectives on spinal cord injury. World Health Organization Available from: https://www.who.int/publications/I/item/international-perspectives-on-spinal-cord-injury (2013)
- Quiroz, J. F. D., Echeverri, K. Spinal cord regeneration: Where fish, frogs and salamanders lead the way, can we follow. Biochemical Journal. 451 (3), 353-364 (2013).
- Lee-Liu, D., Méndez-Olivos, E. E., Muñoz, R., Larraín, J. The African clawed frog Xenopus laevis: A model organism to study regeneration of the central nervous system. Neuroscience Letters. 652, 82-93 (2017).
- Phipps, L. S., Marshall, L., Dorey, K., Amaya, E. Model systems for regeneration: Xenopus. Development. 147 (6), (2020).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Beck, C. W., Christen, B., Slack, J. M. W. Molecular pathways needed for regeneration of spinal cord and muscle in a vertebrate. Developmental Cell. 5 (3), 429-439 (2003).
- Love, N. R., et al. Genome-wide analysis of gene expression during Xenopus tropicalis tadpole tail regeneration. BMC Developmental Biology. 11, 70 (2011).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Gargiolo, C., Slack, J. M. W. Cell lineage tracing during Xenopus tail regeneration. Development. 131 (11), 2669-2679 (2004).
- Lin, G., Chen, Y., Slack, J. M. W. Regeneration of neural crest derivatives in the Xenopus tadpole tail. BMC Developmental Biology. 7, 56 (2007).
- Filoni, S., Bosco, L., Cioni, C. Reconstitution of the spinal cord after ablation in larval Xenopus laevistle. Acta Embryologiae et Morphologiae Experimentalis. 5 (2), 109-129 (1984).
- Gaete, M., et al. Spinal cord regeneration in Xenopus tadpoles proceeds through activation of Sox2-positive cells. Neural Development. 7, 13 (2012).
- Muñoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Developmental Biology. 408 (2), 229-243 (2015).
- Edwards-Faret, G., et al. Spinal cord regeneration in Xenopus laevis. Nature Protocols. 12 (2), 372-389 (2017).
- Méndez-Olivos, E. E., Larraín, J. Cell transplantation as a method to investigate spinal cord regeneration in regenerative and nonregenerative xenopus stages. Cold Spring Harbor Protocols. 2018 (12), 943-947 (2018).
- Méndez-Olivos, E. E., Muñoz, R., Larraín, J. Spinal cord cells from pre-metamorphic stages differentiate into neurons and promote axon growth and regeneration after transplantation into the injured spinal cord of non-regenerative Xenopus laevis froglets. Frontiers in Cellular Neuroscience. 11, 398 (2017).
- de Vidts, S., Méndez-Olivos, E., Palacios, M., Larraın, J., Mery, D. Characterization of spinal cord damage based on automatic video analysis of froglet swimming. Biology Open. 8 (12), 2-11 (2019).
- Slater, P. G., Palacios, M., Larraín, J. Xenopus, a model to study wound healing and regeneration: Experimental approaches. Cold Spring Harbor Protocols. 2021 (8), 100966 (2021).
- Lee-Liu, D., et al. Genome-wide expression profile of the response to spinal cord injury in Xenopus laevis reveals extensive differences between regenerative and non-regenerative stages. Neural Development. 9, 12 (2014).
- Lee-Liu, D., Sun, L., Dovichi, N. J., Larraín, J. Quantitative proteomics after spinal cord injury (SCI) in a regenerative and a nonregenerative stage in the frog Xenopus laevis. Molecular and Cellular Proteomics. 17 (4), 592-606 (2018).
- Peñailillo, J., et al. Analysis of the early response to spinal cord injury identi fi ed a key role for mTORC1 signaling in the activation of neural stem progenitor cells. NPJ Regenerative Medicine. 6 (1), 68 (2021).
- Edwards-Faret, G., et al. Cellular response to spinal cord injury in regenerative and non-regenerative stages in Xenopus laevis. Neural Development. 16 (1), 2 (2021).
- Tapia, V. S., Herrera-Rojas, M., Larrain, J. JAK-STAT pathway activation in response to spinal cord injury in regenerative and non-regenerative stages of Xenopus laevis. Regeneration. 4 (1), 21-35 (2017).
- Ishibashi, S., Amaya, E. How to grow Xenopus laevis tadpole stages to adult. Cold Spring Harbor Protocols. 2021 (3), (2021).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin).: A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Williams, M. C., Patel, J. H., Kakebeen, A. D., Wills, A. E. Nutrient availability contributes to a graded refractory period for regeneration in Xenopus tropicalis. Developmental Biology. 473, 59-70 (2021).
- Vleminckx, K. . Xenopus: Methods and protocols. , (2018).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon