È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Optrode Array per la modulazione optogenetica simultanea e la registrazione neurale elettrica
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo il metodo di fabbricazione di un sistema optrode con fibre ottiche per l'erogazione della luce e un array di elettrodi per la registrazione neurale. Esperimenti in vivo con topi transgenici che esprimono channelrhodopsin-2 mostrano la fattibilità del sistema per la stimolazione optogenetica simultanea e la registrazione elettrofisiologica.
Abstract
Durante l'ultimo decennio, l'optogenetica è diventata uno strumento essenziale per lo studio della segnalazione neurale grazie alla sua capacità unica di modulazione o monitoraggio neurale selettivo. Poiché tipi specifici di cellule neuronali possono essere geneticamente modificati per esprimere proteine opsina, l'optogenetica consente la stimolazione ottica o l'inibizione dei neuroni selezionati. Ci sono stati diversi progressi tecnologici nel sistema ottico per l'optogenetica. Recentemente, è stato proposto di combinare la guida d'onda ottica per l'erogazione della luce con la registrazione elettrofisiologica per monitorare contemporaneamente le risposte neurali alla stimolazione o all'inibizione optogenetica. In questo studio, è stato sviluppato un array optrode impiantabile (fibre ottiche 2x2) con elettrodi multicanale incorporati.
Un diodo a emissione luminosa (LED) è stato impiegato come sorgente luminosa e un array di microlenti microfabbricati è stato integrato per fornire una potenza luminosa sufficiente sulla punta delle fibre ottiche. Il sistema optrode array comprende la parte monouso e la parte riutilizzabile. La parte monouso ha fibre ottiche ed elettrodi, mentre la parte riutilizzabile ha il LED e i circuiti elettronici per il controllo della luce e l'elaborazione del segnale neurale. Il nuovo design del sistema di array optrode impiantabile viene introdotto nel video di accompagnamento oltre alla procedura della chirurgia di impianto optrodo, alla stimolazione della luce optogenetica e alla registrazione neurale elettrofisiologica. I risultati degli esperimenti in vivo hanno mostrato con successo picchi neurali bloccati nel tempo evocati dagli stimoli luminosi dei neuroni eccitatori dell'ippocampo dei topi.
Introduzione
La registrazione e il controllo dell'attività neurale è essenziale per capire come funziona il cervello in una rete neurale e a livello cellulare. I metodi di registrazione elettrofisiologica convenzionali includono il patch clamp 1,2,3,4 utilizzando una micropipetta e la registrazione extracellulare utilizzando elettrodi microneurali 5,6,7,8. Come metodo di neuromodulazione, la stimolazione elettrica è stata spesso utilizzata per stimolare direttamente una regione focale del cervello attraverso la depolarizzazione diretta o indiretta delle cellule neuronali. Tuttavia, il metodo elettrico non può distinguere i tipi di cellule neuronali per la registrazione o la stimolazione perché le correnti elettriche si diffondono in tutte le direzioni.
Come tecnologia emergente, l'optogenetica ha inaugurato una nuova era nella comprensione di come funziona il sistema nervoso 9,10,11,12,13,14,15,16. L'essenza delle tecniche optogenetiche è quella di utilizzare la luce per controllare l'attività delle proteine opsina sensibili alla luce espresse da cellule geneticamente modificate. Pertanto, l'optogenetica consente la sofisticata modulazione o monitoraggio di cellule geneticamente selezionate in circuiti neurali complicati14,17. L'uso più ampio dell'approccio optogenetico ha richiesto la registrazione neurale simultanea per confermare direttamente la neuromodulazione ottica. Pertanto, un dispositivo integrato con funzioni di controllo e registrazione della luce sarebbe estremamente prezioso 16,18,19,20,21,22,23,24,25.
Ci sono limiti della stimolazione optogenetica convenzionale basata su laser, che richiede un sistema di erogazione della luce ingombrante e costoso 26,27,28,29,30. Pertanto, alcuni gruppi di ricerca hanno impiegato sonde al silicio basate su μLED per ridurre al minimo le dimensioni del sistema di erogazione della luce 31,32,33,34. Tuttavia, esiste il rischio di danni cerebrali termici causati dal contatto diretto con i μLED a causa della bassa efficienza di conversione energetica dei LED. Le guide d'onda luminose, come fibre ottiche, SU-8 e ossitruro di silicio (SiON), sono state applicate per evitare danni termici 30,35,36,37,38,39. Tuttavia, questa strategia presenta anche uno svantaggio a causa della sua bassa efficienza di accoppiamento tra le sorgenti luminose e le guide d'onda.
L'array di microlenti è stato precedentemente introdotto per migliorare l'efficienza di accoppiamento della luce tra LED e fibre ottiche40. È stato sviluppato un sistema optrode basato su tecnologie di sistemi microelettromeccanici (MEMS) per la stimolazione ottica e la registrazione elettrica su microscala40. L'array di microlenti tra un LED e fibre ottiche ha aumentato l'efficienza luminosa di 3,13 dB. Come mostrato nella Figura 1, un array di fibre ottiche 2x2 è allineato sull'array di microlenti 4x4 e il LED è posizionato sotto l'array di microlenti. Le fibre ottiche 2x2 sono montate invece di 4x4 per ridurre i danni cerebrali. Un array di elettrodi di tungsteno è posizionato adiacente all'array di optrodi utilizzando il silicio tramite fori per la registrazione elettrofisiologica (Figura 1B).
Il sistema è costituito da una parte superiore monouso e da parti inferiori staccabili. La parte superiore monouso, che comprende l'array di fibre ottiche, l'array di microlenti e l'array di elettrodi di tungsteno, è progettata per essere impiantata in modo permanente nel cervello per esperimenti in vivo . La parte inferiore comprende una sorgente luminosa a LED e una linea di alimentazione esterna, facilmente rimovibile e riutilizzabile per un altro esperimento animale. Una copertura in plastica collegabile protegge la parte monouso quando la parte rimovibile viene rimossa.
La fattibilità del sistema è verificata mediante l'impianto nel cervello di topi transgenici che esprimono channelrhodopsin-2 (ChR2) in neuroni Ca2+/calmodulina-dipendenti proteina chinasi II-positivi (caMKIIα::ChR2 mouse). Gli elettrodi di registrazione sono stati utilizzati per registrare le attività neurali dei singoli neuroni durante la stimolazione ottica dei neuroni.
Protocollo
Le procedure chirurgiche e di cura degli animali sono state approvate dall'Institutional Animal Care and Use Committee (IACUC) presso la Ewha Womans University (n. 20-029).
1. Preparazione di un array optrode (Figura 1 e Figura 2)
- Collegare le fibre ottiche con l'array di microlenti.
- Rimuovere il rivestimento di passivazione della fibra ottica e tagliarlo in pezzi lunghi 5 mm utilizzando una mannaia in fibra ottica di precisione.
- Immergere la fibra ottica nella resina UV trasparente e posizionare le fibre ottiche sull'array di microlenti.
- Polimerizzare la resina con una lampada UV.
- Collega l'array di microlenti all'alloggiamento stampato in 3D usando la resina epossidica.
- Allineare i fili di tungsteno rivestiti con perfluoroaltolsossi (PFA).
- Saldare i 4 pezzi di fili di tungsteno PFA lunghi 30 mm e 1 filo d'argento al connettore femmina a 5 pin e passo 1,27 mm. Utilizzare il filo d'argento come elettrodo di riferimento.
- Collegare il connettore femmina con passo di 1,27 mm al preamplificatore headstage.
- Posizionare con cura i fili di tungsteno attraverso il silicio attraverso i fori (Figura 1B) per aiutare l'allineamento fine degli elettrodi di tungsteno.
- Tagliare i fili di tungsteno allineati 1 mm più corti della lunghezza della fibra ottica.
- Collegare il connettore all'alloggiamento stampato in 3D utilizzando resina epossidica.
- Posizionamento LED
- Posizionare il LED nell'alloggiamento stampato in 3D.
- Collegare il LED al circuito di guida che genera la modulazione della larghezza di impulso (PWM).
NOTA: l'impulso PWM viene generato dal microcontrollore. - Dato il rumore indotto dal circuito di guida a LED, assicurarsi che gli elettrodi di registrazione siano distanti 50 mm dal circuito di guida a LED.
- Misurare l'intensità della luce all'estremità della punta della fibra ottica utilizzando un fotodiodo.
- Immergere gli elettrodi di tungsteno e le fibre ottiche in alcool per 15 min. Quindi immergere il sistema in acqua D.I sterile e sterilizzare con gas di ossido di etilene.
2. Chirurgia dell'impianto (Figura 3 e Figura 4)
NOTA: La tecnica sterile deve essere seguita durante l'intervento chirurgico.
- Preparare gli animali transgenici, che sono geneticamente modificati per esprimere proteine opsina sensibili alla luce nel tipo specifico di cellule neuronali.
NOTA: In questo studio41 è stato utilizzato un topo transgenico di sesso maschile di 2 mesi che esprime channelrhodopsin-2 (ChR2) in ca2+/calmodulina-dipendente proteina chinasi II-positiva (caMKIIα::ChR2 mouse). - Anestetizzare il topo con un cocktail ketamina-xilazina- una miscela di ketamina (100 mg/kg) e xilazina (10 mg/kg) - per somministrazione intraperitoneale.
- Controlla l'animale anestetizzato ogni 30 minuti monitorando il movimento dei baffi e la reazione al pizzico della zampa.
- Iniettare il cocktail ketamina-xilazina a metà della dose iniziale se è necessaria un'anestesia aggiuntiva.
- Rasare la pelle della testa e posizionare il mouse anestetizzato nella cornice stereotassica.
NOTA: Eseguire la preparazione chirurgica della pelle e drappeggiare l'animale. La preparazione della pelle comporta la depilazione seguita dalla pulizia della pelle con agenti antimicrobici.- Posizionare la testa all'interno della cornice stereotassica e inserire le barre auricolari nel meato.
- Centrare la testa del mouse nella cornice stereotassica allentando e stringendo ripetutamente le barre auricolari per un posizionamento esatto.
- Posizionare la barra incisiva in modo che gli incisivi superiori si aggancino sul bordo interno anteriore.
- Regolare la barra incisiva per impostare l'altezza della barra incisiva e stringere il morsetto del naso contro il muso.
- Accendere in anticipo la piastra riscaldante termica incorporata nel telaio stereotassico per mantenere la temperatura corporea a 37 °C durante le procedure chirurgiche.
- Mettere la sonda termica nel retto del topo per la regolazione omeotermica.
NOTA: il posizionamento della barra auricolare deve essere controllato afferrando e facendo oscillare delicatamente il muso. La barra auricolare deve essere regolata se il muso può essere spostato lateralmente di oltre ~ 4 mm.
- Coprire gli occhi con vaselina (vedi la Tabella dei materiali) per evitare secchezza.
- Iniettare l'1% di lidocaina nel cuoio capelluto. Sollevare la pelle della testa con una pinza, fissare uno spazio di iniezione e iniettare la lidocaina sotto il cuoio capelluto.
- Eseguire un'incisione sagittale utilizzando un bisturi e forbici fini. Tenere la pelle incisa con un microclamp per ampliare la visibilità dell'area chirurgica.
NOTA: La lunghezza dell'incisione è <1 cm sopra il bregma e il bordo caudale dell'osso interparietale. - Rimuovere il periostio con tamponi di cotone. Se c'è sanguinamento, cauterizzare il cranio usando un bovie per sigillare i vasi sanguigni.
- Pulire il cranio con soluzione salina e contrassegnare i siti craniotomici usando un braccio manipolatore: ippocampo anteriore-posteriore (AP) da -1,8 a -2,8 mm, mediale-laterale (ML) 0,5-2,5 mm e dorsale-ventrale (DV) da -1 a -2 mm.
NOTA: Considerando lo spessore del cranio del topo, inserire l'array optrode da -1,2 a -2,2 mm dall'area del cervello esposta. Data la via ippocampale, le cellule piramidali di CA3 inviano i loro assoni a CA1. Pertanto, le fibre ottiche sono 1 mm più lunghe degli elettrodi di registrazione, in modo che le fibre ottiche siano posizionate in CA3 e gli elettrodi di registrazione in CA1. - Praticare un foro sopra il cervelletto e inserire una vite per terra. Mettere la vite di terra profonda 0,5 mm con una vite di precisione fino a raggiungere la parte superiore del cervelletto.
NOTA: Garantire l'inserimento stretto della vite, che verrà utilizzata come elettrodo di terra e struttura di supporto per massimizzare la stabilità a lungo termine dell'impianto, in quanto aumenta la superficie tridimensionale per l'aderenza del cemento dentale. - Forare l'area contrassegnata e rimuovere un pezzo del cranio con una pinza.
- Piegare la punta dell'ago da 26 G in senso orario di 120° ed esporre l'area del cervello inserendo il lato smussato dell'ago rivolto verso l'alto. Fare attenzione a non danneggiare il cervello e i vasi sanguigni.
- Pulire il cervello esposto con soluzione salina per lavare via la polvere ossea e la materia estranea.
- Fissare l'array optrode nel braccio del manipolatore e avvicinarsi all'area esposta.
NOTA: quando si posiziona il dispositivo, ricalcolare nuovamente l'area di destinazione dal bregma può aumentare la precisione del posizionamento. - Inserire lentamente l'array optrode e collegare la vite di terra al filo d'argento collegato al sistema42.
NOTA: in questo processo, l'array deve essere fissato saldamente al braccio del manipolatore per ridurre al minimo l'oscillazione e prevenire danni cerebrali da micromotion durante l'inserimento. L'inserimento deve essere eseguito lentamente, con riposo per 10 minuti per tenere conto del gonfiore del cervello che potrebbe essere stato premuto dopo l'inserimento. La velocità di inserimento inferiore a 1 μm/s nel tessuto cerebrale è raccomandata per l'alta qualità del rapporto segnale-rumore e il numero di singole unità separabili42. - Se c'è sanguinamento, applicare una pressione diretta ai sanguinamenti con un batuffolo di cotone asciutto o usare la cauterizzazione. Non passare ai passaggi successivi fino a quando il sanguinamento non viene completamente interrotto.
- Inserire schiuma di gel tra il cervello esposto e il dispositivo per proteggere le sostanze chimiche dal contatto diretto con il cervello.
NOTA: La schiuma gel aiuta anche l'emostasi e mantiene il cervello umido. - Pulire il cranio con tamponi di cotone per rimuovere il più possibile l'umidità e procedere alla fase di fissazione successiva.
- Applicare con attenzione il cemento dentale sul cranio per fissare il dispositivo e coprire la schiuma gel. Prima che il cemento dentale sia completamente indurito, separare il cuoio capelluto se attaccato al cemento dentale. Tirare la pelle incisa con una pinza per coprire il cemento dentale indurito e suturare il cuoio capelluto. Quindi, rilasciare il dispositivo dal braccio del manipolatore.
NOTA: Assicurarsi che il cemento dentale non si attacchi alla pelle e copra solo la regione del cranio. Quando la pelle cresce, può spingere via il cemento e, alla fine, il dispositivo cadrà. Ciò causerà un problema critico per gli esperimenti in vivo a lungo termine.
3. Recupero e cura dell'impianto
- Estrarre il mouse dalla cornice stereotassica.
- Somministrare la soluzione di Carprofene utilizzando un ago da 26 G. Iniettare una volta prima dell'intervento chirurgico e 12 ore (la mattina successiva in caso di intervento chirurgico pomeridiano) e 24 ore dopo l'intervento chirurgico per ridurre il dolore.
NOTA: La concentrazione del farmaco nel flacone è di 50 mg/ml e viene conservata a 4 °C. Il carprofene è viscoso e deve essere diluito in acqua sterile 1:10. Se la sterilità viene mantenuta, la soluzione può essere conservata per un massimo di 4 settimane. Per mantenere la durata effettiva del farmaco, iniettare la soluzione di Carprofen a intervalli di 12 ore. - Posizionare il mouse sulla piastra riscaldante e verificare se si riprende bene dall'anestesia.
NOTA: L'animale non viene lasciato incustodito fino a quando non riacquista sufficiente consapevolezza. - Rimuovere i fili di sutura 7 - 10 giorni dopo l'intervento chirurgico.
- Lascia che l'animale si riprenda per 1 settimana. Monitorare l'assunzione di cibo e acqua durante il tempo di recupero. Somministrare l'analgesico e verificare la presenza di segni di disagio o dolore.
NOTA: Gli animali che hanno subito un intervento chirurgico non possono rimanere con gli altri animali fino a quando non si riprendono completamente.- Durante il periodo di recupero, pesare il mouse ogni giorno per verificare i cambiamenti di peso. Sacrificare il topo (vedere paragrafo 6) se c'è una perdita di peso del 20% rispetto agli animali di controllo abbinati all'età e al sesso.
4. Stimolazione optogenetica e registrazione elettrofisiologica
- Anestetizzare il mouse e posizionare il mouse anestetizzato nel frame stereotassico.
- Impostare i parametri di stimolazione.
- Impostare la ricetta dell'impulso luminoso su 4% duty cycle e 10 Hz di frequenza43. Impostare la stimolazione luminosa per 2 s (20 impulsi) durante la registrazione neurale.
- Utilizzare una corrente di 50 mA per pilotare un'intensità luminosadi 3 mW/mm 2 sulla punta della fibra ottica. Misurare la potenza luminosa utilizzando un fotodiodo e un misuratore di potenza e dividere la potenza luminosa per l'area della sfaccettatura della fibra ottica.
- Togliere il coperchio in plastica e fissare la parte superiore contenente il sistema di erogazione della luce con il LED e i circuiti riutilizzabili.
- Collegare il preamplificatore headstage al connettore a 5 pin impiantato.
- Aprire il software per registrare i segnali neurali.
- Impostare i filtri software. Utilizzare un filtro passa-banda a 0,1-20 kHz e un filtro notch a 60 Hz. Impostare la frequenza di campionamento dell'amplificatore su 20 kHz.
- Prima della registrazione, verificare se vengono rilevati i segnali di picco neurale.
NOTA: la cancellazione del rumore è importante perché i segnali neurali sono troppo piccoli. Se il livello di rumore è troppo alto, i segnali neurali possono essere oscurati dal rumore e diventare invisibili. Utilizzare una messa a terra appropriata e una schermatura delle onde elettromagnetiche per ridurre il rumore. - Dopo il controllo del segnale, registrare i segnali neurali senza stimolazione della luce per la registrazione al basale.
- Fornire luce LED e registrare contemporaneamente le risposte neuronali (Figura 5 e Figura 6).
NOTA: Una volta stimolato, il prossimo esperimento di stimolazione deve essere eseguito dopo un intervallo di almeno 5 minuti in modo che l'attività neuronale evocata dalla stimolazione precedente non influisca sull'esperimento successivo.
5. Analisi dei dati
- Carica i dati acquisiti utilizzando il programma MATLAB.
- Ottenere singole attività neurali utilizzando un algoritmo di ordinamento spike "Wave-Clus"44,45. Rileva i picchi in ciascun canale di una soglia di ampiezza come in Eq (1)45.
Soglia = 5 × mediana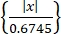 (1)
(1)
Dove x è il segnale filtrato passa-banda.- Per installare "Wave-Clus", fare riferimento al link per il download nella Tabella dei materiali.
- Per aprire l'interfaccia utente grafica (GUI), digitare wave_clus nel prompt dei comandi di MATLAB.
- Digitare Get_spikes funzione ('nomefile.ext') per l'estensione del file preparata per il rilevamento di picchi. Quindi, esegui Do_clustering ("filename_spikes.mat") per l'ordinamento dei picchi.
- Conta i picchi ordinati prima, durante e dopo la stimolazione luminosa con contenitori temporali specifici. Utilizzare i contenitori temporali da 0,2 s e 2 s per l'analisi.
- Traccia il numero di picchi da ciascun canale di registrazione.
NOTA: Media con errore standard dei mezzi (SEM) dei dati dai risultati di 8 esperimenti ripetuti è stata calcolata e tracciata.
6. Eutanasia
- Dopo tutti gli esperimenti, sacrifica il topo per inalazione di anidride carbonica (CO2).
- Senza precaricare la camera, posizionare il mouse nella camera trasparente di eutanasia, senza alimentazione di CO2 e/o perdite.
- Accendere il gas CO2 e spostare l'aria ad una velocità del 30 - 50% del volume di aria della camera di eutanasia al minuto.
NOTA: Un misuratore di portata deve essere collegato alla bombola del gas CO2 per garantire che la velocità di spostamento dell'aria sia del 30-50% del volume della camera di eutanasia al minuto. - Monitora il mouse sacrificato per mancanza di respirazione e cambia il colore degli occhi.
NOTA: Il tempo previsto per l'eutanasia è di solito entro 10-15 minuti. - Dopo aver osservato i segni di morte, rimuovere il topo dalla camera di eutanasia.
- Per completare la procedura di eutanasia, verificare la morte confermando l'arresto respiratorio e cardiaco.
Risultati
Il sistema optrode è fabbricato con successo per fornire una potenza luminosa sufficiente per attivare i neuroni bersaglio. L'allineamento fine degli elettrodi di tungsteno si ottiene attraverso il silicio microfabbricato attraverso i fori. L'intensità luminosa misurata è di 3,6 mW/mm2 sulla punta della fibra ottica quando viene applicata una corrente di 50 mA. I microlenti hanno aumentato l'efficienza luminosa di 3,13 dB. A causa dell'array di microlenti, che migliora l'accoppiamento della luce, la corrent...
Discussione
È stata verificata la fattibilità del sistema per la stimolazione optogenetica simultanea e la registrazione elettrofisiologica (Figura 6). I grandi picchi durante la stimolazione della luce sono artefatti fotoelettrici che si verificano contemporaneamente alla stimolazione della luce (Figura 6A). Questo è chiaro nella vista ingrandita della forma d'onda nel rettangolo tratteggiato rosso (Figura 6A). Come mostrato nella
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Questa ricerca è stata supportata dal Convergent Technology R&D Program for Human Augmentation attraverso la National Research Foundation of Korea (NRF), finanziato dal Ministero della Scienza e delle TIC (NRF-2019M3C1B8090805) e supportato da una sovvenzione della National Research Foundation of Korea (NRF) finanziata dal governo coreano (MSIT) (n. 2019R1A2C1088909). Ringraziamo il laboratorio di Seung-Hee Lee presso il Dipartimento di Scienze Biologiche, KAIST, Daejeon, Corea, per aver gentilmente fornito i topi transgenici.
Materiali
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
Riferimenti
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon