Method Article
Dispositivi elettronici organici flessibili per la terapia del campo elettrico pulsato del glioblastoma
In questo articolo
Riepilogo
Questo lavoro descrive lo sviluppo di elettrodi interdigitati flessibili per l'implementazione in modelli 3D di tumore cerebrale, vale a dire, coltura in vitro , modello ovo e modello murino in vivo . Il metodo proposto può essere utilizzato per valutare gli effetti dei campi elettrici pulsati sui tumori a diversi livelli di complessità.
Abstract
Il glioblastoma è difficile da debellare con le terapie oncologiche standard a causa del suo alto grado di invasività. I trattamenti bioelettrici basati su campi elettrici pulsati (PEF) sono promettenti per il miglioramento dell'efficienza del trattamento. Tuttavia, si basano su elettrodi rigidi che causano danni acuti e cronici, specialmente nei tessuti molli come il cervello. In questo lavoro, è stata utilizzata un'elettronica flessibile per fornire PEF ai tumori e la risposta biologica è stata valutata con microscopia fluorescente. Gli elettrodi d'oro interdigitati su un substrato sottile e trasparente di parylene-C sono stati rivestiti con il polimero conduttore PEDOT: PSS, risultando in un dispositivo conformabile e biocompatibile. Gli effetti delle PEF sui tumori e sul loro microambiente sono stati esaminati utilizzando vari modelli biologici. In primo luogo, monostrati di cellule di glioblastoma sono stati coltivati sopra gli elettrodi per studiare i fenomeni in vitro. Come fase intermedia, è stato sviluppato un modello in ovo in cui sferoidi tumorali ingegnerizzati sono stati innestati nella membrana embrionale di una quaglia. A causa dell'assenza di un sistema immunitario, questo ha portato a tumori altamente vascolarizzati. In questa fase iniziale dello sviluppo, gli embrioni non hanno un sistema immunitario e i tumori non sono riconosciuti come corpi estranei. Pertanto, possono svilupparsi rapidamente mentre sviluppano i propri vasi dal sistema vascolare embrionale esistente, che rappresenta un prezioso modello 3D del cancro. Infine, la somministrazione di elettrodi flessibili di PEF è stata valutata in un organismo completo con un sistema immunitario funzionale, utilizzando un modello murino singenico, ortoinnesto (intracranico). Gli sferoidi tumorali sono stati innestati nel cervello di topi transgenici multi-fluorescenti prima dell'impianto di dispositivi di elettrodi organici flessibili. Una finestra cranica sigillata ha permesso l'imaging multifotonico del tumore e del suo microambiente durante il trattamento con PEF per un periodo di diverse settimane.
Introduzione
Il glioblastoma multiforme (GBM) è un tumore altamente invasivo e quindi difficile da sradicare con trattamenti standard come la resezione, la radioterapia e la chemioterapia. Nonostante i trattamenti multimodali, la prognosi rimane molto sfavorevole e la maggior parte dei pazienti manifesta una progressione della malattia entro 1 anno dalla diagnosi 1,2. Recentemente, lo sviluppo di trattamenti bioelettrici ha mostrato un grande potenziale per migliorare le terapie esistenti. Queste terapie utilizzano la consegna di campi elettrici pulsati (PEF), tipicamente in una singola sessione di trattamento, per interrompere l'integrità della membrana cellulare e il microambiente dei tumori. Questa rottura della membrana cellulare, nota anche come elettroporazione, può essere reversibile o irreversibile a seconda dell'intensità del campo elettrico e del numero di impulsi. L'elettroporazione irreversibile (IRE) viene applicata come tecnica di ablazione tissutale non termica in cui gli impulsi elettrici causano danni fatali alle membrane cellulari che portano alla morte cellulare3. L'elettroporazione reversibile viene applicata nell'elettrochemioterapia (ECT), una tecnica consolidata che consiste nella somministrazione di PEF in combinazione con farmaci chemioterapici per migliorare l'assorbimento del farmaco nelle cellule tumorali4. Inoltre, studi recenti hanno dimostrato che l'elettroporazione del calcio è un'alternativa all'ECT ad alta efficienza per il trattamento del cancro, che è anche poco costoso e induce meno effetti collaterali5. Nonostante questi promettenti progressi, i PEF vengono generalmente applicati utilizzando elettrodi rigidi e metallici che sono noti per causare danni ai tessuti molli6. Il cervello è particolarmente sensibile a tali dispositivi invasivi in cui il disallineamento meccanico induce infiammazione e cicatrici astrogliali7.
In questo contesto, viene presentato un sistema flessibile di rilascio di PEF in combinazione con modelli 3D di tumori del glioblastoma, dalla microfabbricazione a un modello murino. Gli elettrodi conformi sono realizzati con processi standard di microfabbricazione a film sottile, compreso l'uso di materiali morbidi e biocompatibili come parylene-C, oro e PEDOT: PSS 8,9. Un design dell'elettrodo interdigitato viene utilizzato per coprire un'ampia superficie mantenendo un'adeguata trasparenza per l'imaging tra le dita dell'elettrodo10. Per il modello tumorale, sferoidi 3D di cellule di glioblastoma che esprimono un reporter di fluorescenza geneticamente codificato sono prodotti utilizzando una variazione del metodo della piastra a 96 pozzetti di sovrapposizione liquida11. Gli sferoidi vengono innestati nella membrana corioallantoica di un embrione di quaglia, risultando in un modello in ovo che è stato ampiamente utilizzato per studiare l'angiogenesi o la tossicologia dei farmaci12,13. I tumori possono essere innestati e vascolarizzati dalla vascolarizzazione dell'embrione in assenza di un sistema immunitario in questa fase dello sviluppo embrionale12. Gli elettrodi flessibili vengono quindi posizionati sopra il tumore vascolarizzato per studiare l'effetto della consegna di PEF sullo sferoide e sulla sua vascolarizzazione. Infine, questi effetti sono studiati su un organismo vivente completo, compreso il microambiente tumorale e il sistema immunitario, impiantando sferoidi ingegnerizzati nel parenchima cerebrale di modelli murini14. Gli elettrodi flessibili sono posizionati sopra il sito di inserimento e la craniotomia è sigillata con una finestra di vetro, consentendo l'imaging ripetuto a due fotoni per diverse settimane.
Questi metodi saranno utili per le persone interessate a vari settori che vanno dall'ingegneria microelettronica alle applicazioni oncologiche. Il protocollo di microfabbricazione può essere utilizzato e adattato per qualsiasi applicazione che richieda elettrodi metallici a film sottile rivestiti con PEDOT:PSS. Inoltre, i modelli biologici sviluppati per la valutazione di trattamenti elettrici antitumorali saranno di interesse generale per lo studio del differenziamento della risposta cellulare, vascolare e immunitaria ai materiali impiantati.
Protocollo
Tutte le procedure sperimentali sono state eseguite in conformità con la legislazione francese e in conformità con la Direttiva del Consiglio della Comunità Europea del 24 novembre 1986 (86/609/CEE) per la cura e l'uso di animali da laboratorio. La ricerca sugli animali è stata autorizzata dalla Direction Départementale des Services Vétérinaires des Bouches-du-Rhône e approvata dal comitato etico della Provence Cote D'Azur (Apafis # 22689-2019100414103054).
1. Microfabbricazione flessibile del dispositivo (Figura 1)
- Pulizia dei vetrini
- Sonicare vetrini in soluzione di sapone al 2% per 15 minuti. Risciacquarli con acqua.
- Sonicare nuovamente in una miscela di 80% di acetone puro e 20% di isopropanolo puro per 15 minuti.
ATTENZIONE: Questi solventi sono nocivi e infiammabili. Indossare dispositivi di protezione individuale (DPI) e maneggiarli sotto una cappa aspirante. - Risciacquare i vetrini con isopropanolo e asciugare con una pistola ad aria compressa.
NOTA: Assicurarsi che l'acetone non si asciughi sui substrati durante l'intero processo.
- Pattern di elettrodi d'oro (Figura 1A)
- Depositare uno strato di 3 μm di parylene-C (PaC) con un sistema di deposizione di parylene (Figura 1Aa).
- Posizionare i vetrini puliti nella camera di deposizione. Spruzzare il sapone sul refrigeratore, lasciarlo asciugare e inserirlo nella trappola fredda designata del sistema di deposizione. Questo antiadesivo facilita la rimozione del PaC dal refrigeratore dopo la deposizione.
ATTENZIONE: PaC è irritante e rappresenta un pericolo per la salute. Indossare guanti durante la manipolazione. - Pesare 6 g di PaC in una barca di alluminio e metterlo nel forno. Evacuare la macchina (P = 10 mTorr) e avviare la deposizione con i seguenti parametri: TChiller = -100 °C, TFurnace = 690 °C, TVaporizer = 175 °C eT Chamber = 135 °C.
- Quando la deposizione è terminata e la temperatura del vaporizzatore è inferiore a 40 °C, spegnere il refrigeratore, il vaporizzatore e il forno. Sfiatare la macchina e raccogliere i campioni.
- Posizionare i vetrini puliti nella camera di deposizione. Spruzzare il sapone sul refrigeratore, lasciarlo asciugare e inserirlo nella trappola fredda designata del sistema di deposizione. Questo antiadesivo facilita la rimozione del PaC dal refrigeratore dopo la deposizione.
- Attivare la superficie dei campioni mediante trattamento al plasma con ossigeno per 30 s (100 W, 50 sccm).
- Spin-coat i campioni trattati al plasma con un fotoresist negativo a 1.000 x g per 40 s. Porre i campioni su una piastra calda a 110 °C per 2 minuti (figura 1Ab).
ATTENZIONE: La soluzione fotoresistente è infiammabile e provoca irritazione; indossare DPI e maneggiarli sotto una cappa aspirante. - Posizionare un filtro i-line nella beamline dell'allineatore a contatto a banda larga UV ed esporre il fotoresist attraverso una maschera che presenta il design dell'elettrodo interdigitato (Figura 1Ac).
NOTA: Gli elettrodi interdigitati con uno spazio di 50 o 250 μm sono stati progettati utilizzando un editor di layout e le fotomaschere sono state ordinate da un'azienda che produce fotomaschere in poliestere mediante fotoplotting laser. - Cuocere i campioni di cui sopra a 110 °C su una piastra calda per 3 minuti e lasciarli raffreddare a temperatura ambiente per 5 minuti. Immergere i campioni in uno sviluppatore privo di ioni metallici per 3 minuti per rimuovere il fotoresist non esposto. Risciacquare i campioni con acqua e asciugarli con una pistola ad aria compressa (Figura 1Ad).
ATTENZIONE: la soluzione per sviluppatori è irritante; indossare DPI e maneggiare sotto una cappa aspirante. - Attivare la superficie dei campioni mediante trattamento al plasma con ossigeno per 60 s (100 W, 50 sccm).
- Depositare uno strato di adesione di 20 nm di cromo e uno strato di oro di 300 nm con un evaporatore termico come segue (Figura 1Ae).
- Sfiatare l'evaporatore e agganciare i campioni (rivolti verso il basso) sulla piastra rotonda superiore con viti metalliche. Riempi i crogioli dedicati, rispettivamente, con cromo e oro. Sigillare ed evacuare la macchina per raggiungere una pressione inferiore a 5·10-6 Torr. Avviare la rotazione del portacampioni.
- Selezionare il crogiolo contenente cromo e aumentare lentamente la corrente che lo attraversa fino a raggiungere una velocità di deposizione di 0,2 Å·s-1 . Aprire l'otturatore e attendere che si depositino 20 nm di cromo. Chiudere l'otturatore e scendere lentamente la corrente fino a 0 mA.
- Selezionare il crogiolo contenente oro e aumentare lentamente la corrente che lo attraversa fino a raggiungere un tasso di deposizione di 0,2 Å·s-1 . Aprire l'otturatore per far evaporare l'oro, attendere fino a quando non si depositano 10 nm d'oro, quindi aumentare la velocità di deposizione a 1,5 Å·s-1 fino a depositare circa 300 nm. Chiudere l'otturatore e ridurre lentamente la corrente fino a 0 mA.
- Lasciare raffreddare i campioni a temperatura ambiente per 15 minuti dopo la deposizione. Interrompere la rotazione del portacampioni, sfiatare la macchina e raccogliere i campioni.
- Immergere i campioni in un becher con acetone. Posizionare il becher su una piastra di agitazione impostata a 110 giri / min per 15 minuti per sollevare il fotoresist. Risciacquare i campioni con isopropanolo e asciugarli con una pistola ad aria compressa (Figura 1Af).
- Attivare la superficie dei campioni mediante trattamento al plasma con ossigeno per 30 s (100 W, 50 sccm).
- Depositare uno strato isolante di 3 μm di PaC con un sistema di deposizione di parylene (vedere punto 1.2.1) (Figura 1Ag).
- Depositare uno strato di 3 μm di parylene-C (PaC) con un sistema di deposizione di parylene (Figura 1Aa).
- Apertura del contorno (Figura 1B)
- Spin-coat i campioni con un fotoresist positivo a 600 x g per 35 s. Posizionare su una piastra calda a 110 °C per 2 minuti (Figura 1Ba).
ATTENZIONE: La soluzione fotoresistente è infiammabile e provoca irritazione; indossare DPI e maneggiare sotto una cappa aspirante. - Assicurarsi che non vi sia alcun filtro i-line nella beamline dell'allineatore di contatti a banda larga UV ed esporre il fotoresist attraverso una maschera che presenta il contorno del dispositivo con un allineatore a contatto a banda larga UV (Figura 1Bb).
- Immergere i campioni in uno sviluppatore privo di ioni metallici per 4 minuti per rimuovere il fotoresist esposto. Risciacquare i campioni con acqua e asciugarli con una pistola ad aria compressa (Figura 1Bc).
- Incidere il contorno attraverso i due strati di PaC con un incisore ionico reattivo (160 W, 22 min, O2: 50 sccm, CF4: 10 sccm) (Figura 1Bd).
- Rimuovere il fotoresist rimanente con acetone, risciacquare con isopropanolo e asciugare i campioni con una pistola ad aria compressa.
- Spin-coat i campioni con un fotoresist positivo a 600 x g per 35 s. Posizionare su una piastra calda a 110 °C per 2 minuti (Figura 1Ba).
- PEDOT:Rivestimento PSS (Figura 1C)
- Spin-coat una soluzione di sapone al 2% a 70 x g per 35 s (Figura 1Ca).
- Depositare uno strato sacrificale di 3 μm di PaC con un sistema di deposizione di parylene (vedi passo 1.2.1) (Figura 1Cb).
- Fotoresist positivo spin-coat a 600 x g per 35 s. Porre i campioni su una piastra calda a 110 °C per 2 minuti (Figura 1Cc).
- Assicurarsi che non vi sia alcun filtro i-line nella beamline dell'allineatore a contatto a banda larga UV ed esporre il fotoresist attraverso una maschera che presenta la superficie attiva degli elettrodi (Figura 1Cd).
- Immergere i campioni in uno sviluppatore privo di ioni metallici per 4 minuti per rimuovere il fotoresist esposto. Risciacquare i campioni con acqua e asciugarli con una pistola ad aria compressa (Figura 1Ce).
- Incidere il PaC con un incisore ionico reattivo per aprire la superficie attiva degli elettrodi (160 W, 24 min, O2: 50 sccm, CF4: 10 sccm). Verificare con un microscopio che non vi sia alcun PaC residuo sulla superficie attiva (Figura 1Cf).
- Rimuovere il fotoresist rimanente con acetone, risciacquare con isopropanolo e asciugare i campioni con una pistola ad aria compressa.
- Attivare la superficie dei campioni utilizzando il trattamento al plasma con ossigeno per 90 s (100 W, 50 sccm).
- Miscelare una dispersione commerciale di PEDOT:PSS polimerizzato chimicamente con 5 vol% di glicole etilenico (EG) e 0,1 vol% di acido dodecilbenzensolfonico (DBSA). Sonicate per 15 min. Aggiungere 1 wt% di (3-glicidilossipropil) trimetilsilossano (GOPS) e sonicare per 5 min. Filtrare la soluzione attraverso un filtro da 1,2 μm.
ATTENZIONE: EG è irritante e rappresenta un pericolo per la salute. DBSA è irritante e corrosivo. GOPS è corrosivo. Indossare DPI appropriati e maneggiare queste sostanze chimiche sotto una cappa aspirante.
NOTA: il volume totale dipende dal numero di campioni. Per 10 vetrini standard, preparare almeno 20 ml corrispondenti alle seguenti quantità: 18,78 ml di PEDOT:PSS, 1 mL di EG, 20 μL di DBSA e 200 μL di GOPS. - Spin-coat quattro strati di soluzione PEDOT:PSS a 150 x g per 35 s. Dopo la deposizione di ogni strato, cuocere i campioni a 110 °C per 60 s su una piastra calda e raffreddarli a temperatura ambiente per 5 minuti prima di centrifugare lo strato successivo (Figura 1Cg).
- Rimuovere lo strato di PaC sacrificale immergendo i campioni in acqua (Figura 1Ch).
- Cuocere i campioni a 140 °C per 1 ora.
- Immergere i campioni in acqua deionizzata per 30 minuti per rimuovere il sapone rimanente e i composti a basso peso molecolare nel film PEDOT:PSS e per staccare i campioni dal substrato di vetro (Figura 1Ci).
- Connessioni e imballaggio (Figura 1D)
- Depositare un sottile strato di vernice acrilica su un film di poliimmide rivestito di rame (Figura 1Da). Utilizzare un aerosol per ottenere uno strato omogeneo di vernice (Figura 1Db).
- Modellare la vernice acrilica con un laser (75 kHz, 7 W, 1 passaggio laser, 400 mm·s-1) per ottenere due cuscinetti di contatto rettangolari (5 mm x 15 mm; 1,5 mm di spazio) (Figura 1Dc).
- Incidere a umido il rame con cloruro ferrico saturo al 30% (p/v) (FeCl3) in acqua per 15 minuti a 40 °C (Figura 1Dd).
ATTENZIONE: FeCl3 è irritante e corrosivo; Maneggiarlo con i guanti sotto una cappa aspirante. - Rimuovere la vernice acrilica con acetone strofinandola leggermente con un panno (Figura 1De).
- Tagliare la pellicola di poliimmide modellata in forme rettangolari (15 mm x 30 mm) con un laser (15 kHz, 10 W, 30 passaggi laser, 130 mm·s-1) (Figura 1Df).
- Erogare la pasta d'argento con una macchina erogatrice a tre assi ad una pressione di tre bar con un ago di 330 μm di diametro (5 m·min-1) (Figura 1Dg).
ATTENZIONE: La pasta d'argento è irritante; maneggiare con i guanti. - Allineare e collegare la sonda PaC con la pellicola di poliimmide al microscopio binoculare usando una pinzetta (Figura 1Dh).
NOTA: i segni di allineamento possono essere modellati nel punto 1.5.2 per facilitare il posizionamento della sonda sui pad di contatto. - Cuocere in forno a 140 °C per 2 ore.
- Posizionare un nastro protettivo in poliimmide da 1 cm2 sui cuscinetti di contatto (Figura 1Di).
- Immergere l'interfaccia in cui la sonda PaC e la pellicola di poliimmide sono collegate in PDMS (Figura 1Dj).
- Cuocere in forno per 2 h a 50 °C.
- Rimuovere il nastro di protezione per aprire i cuscinetti di contatto (Figura 1Dk).
NOTA: la microfabbricazione di dispositivi in vitro è simile, ma i passaggi 1.2.1, 1.3 e 1.5 devono essere saltati.
2. Generazione della linea cellulare stabile GCaMP6f di Glioblastoma
- Produzione di lentivirus
- In un matraccio da 75 cm², coltivare una linea cellulare derivata da HEK 293T ottimizzata per la produzione di lentivirus in 10 ml di Modified Eagle's Medium (DMEM) di Dulbecco contenente 4,5 g· L-1 di glucosio, L-glutammina, piruvato di sodio e bicarbonato di sodio e integrato con il 10% di siero bovino fetale privo di tetracicline (FBS), 100 unità·mL-1 di penicillina e 100 μg·mL-1 di streptomicina per almeno 3 giorni fino alla confluenza dell'80%.
- Rimuovere il mezzo dal pallone. Risciacquare delicatamente le cellule con 10 ml di soluzione salina tamponata con fosfato (PBS).
- Aggiungere 1 mL di soluzione di tripsina/EDTA allo 0,25% e incubare il matraccio per 5 minuti a 37 °C.
ATTENZIONE: La soluzione di tripsina/EDTA rappresenta un pericolo per la salute; indossare DPI e maneggiare sotto una cappa aspirante. - Aggiungere 8 ml di terreno di coltura. Lavare delicatamente la sospensione cellulare.
- Contare le cellule e placcare 4 x 106 cellule in una capsula di Petri in 8 ml di terreno di coltura.
- Il giorno successivo, diluire 25 μg del plasmide contenente il gene GCaMP6f e un marcatore di selezione che conferisce resistenza alla puromicina in un volume totale di 600 μL di acqua. Aggiungerlo a un tubo di reagente di trasfezione. Vortice per 10 s a 3.000 giri / min e incubare il tubo a temperatura ambiente per 10 minuti per consentire la produzione di nanoparticelle.
- Aggiungere il contenuto del tubo a goccia sulla coltura di cellule T HEK 293 e dondolare delicatamente a mano. Incubare le cellule a 37 °C per almeno 4 ore.
- Sostituire i mezzi contenenti complessi di nanoparticelle con nuovi mezzi e riportare le celle a 37 °C.
- Tre giorni dopo, raccogliere il surnatante e centrifugare a 500 x g per 10 minuti per rimuovere i detriti cellulari. Raccogliere la fase liquida contenente particelle virali.
NOTA: La produzione del virus nel surnatante può essere confermata utilizzando un test quantitativo del titolo lentivirale e può essere conservata a -80 °C per almeno 2 anni.
- Trasduzione delle cellule di glioblastoma
- In un matraccio di 75 cm², colture di cellule di glioblastoma in 10 mL di DMEM contenenti 1 g· L-1 di glucosio, L-glutammina, piruvato di sodio e bicarbonato di sodio e integrato con FBS privo di tetracicline al 10%, 100 unità·mL-1 di penicillina e 100 μg·mL-1 di streptomicina per almeno 4 giorni.
- Scartare il terreno e aggiungere il surnatante ottenuto al punto 2.1.9 sulle cellule bersaglio.
- Aggiungere 5 μg·mL-1 di esadimetrina bromuro nel mezzo per migliorare la trasduzione. Incubare per 6 h a 37 °C. Sostituire il terreno con 10 ml di terreno fresco.
ATTENZIONE: Il bromuro di esadimetrina è irritante. Maneggialo con i guanti.
- Generazione di una linea cellulare stabile
- Due o tre giorni dopo la trasduzione, aggiungere 10 mL di DMEM contenente 1 g· L-1 di glucosio, L-glutammina, piruvato di sodio e bicarbonato di sodio, 10% FBS, 100 unità·mL-1 di penicillina, 100 μg·mL-1 di streptomicina e integrato con puromicina per uccidere le cellule non trasdotte. Cellule di coltura in questo mezzo per almeno 3 giorni.
ATTENZIONE: La puromicina è irritante; Maneggiarlo con i guanti.
NOTA: La sensibilità delle cellule alla puromicina deve essere testata prima della trasduzione coltivando cellule nel loro mezzo raccomandato contenente diverse concentrazioni di puromicina. Il giorno dopo, controlla le cellule con un microscopio. Scegli la concentrazione adeguata alla quale la maggior parte delle cellule sono morte ma poche sono ancora vive, per garantire che l'antibiotico non sia troppo tossico e possa uccidere anche le cellule trasfettate. - Rimuovere il mezzo e risciacquare le cellule con 10 ml di PBS.
- Aggiungere 1 mL di soluzione allo 0,25% di tripsina/EDTA e incubare il matraccio per 5 minuti a 37 °C.
- Aggiungere 8 ml di terreno di coltura. Lavare delicatamente la sospensione cellulare.
- Raccogliere 100 μL di sospensione cellulare e misurare la concentrazione cellulare con un contatore cellulare. Aspirare 50 μL di sospensione cellulare in un contatore di celle automatizzato portatile con un sensore da 60 μm.
- Seminare 1 cellula/pozzetto in una piastra da 96 pozzetti. Ad esempio, per una concentrazione di 1 x 10 3 cellule per ml, aggiungere 1 / (1 x 103), cioè 0,001 ml di sospensione cellulare per pozzetto. Semina ogni pozzo per aumentare le possibilità di successo. Completare con terreno di coltura per raggiungere un volume totale di 200 μL per pozzetto.
- Il giorno dopo, trovare ogni pozzetto contenente una cellula e controllarne la fluorescenza (λexc = 490 nm e λem = 530 nm). Segna i pozzetti contenenti una sola cella trasfettata. Continuare la crescita per alcuni giorni fino a quando il pozzo è quasi confluente.
- Scartare il mezzo e sciacquare le cellule con 200 μL di PBS. Aggiungere 100 μL di soluzione di tripsina/EDTA allo 0,25% e incubare la piastra a 96 pozzetti per 5 minuti a 37 °C.
- Aggiungere 100 μL di terreno e lavare delicatamente la sospensione cellulare. Trasferire la sospensione cellulare in una capsula di Petri. Aggiungere 5 ml di terreno e lasciare crescere le cellule per alcuni giorni fino a quando la capsula di Petri è quasi confluente.
- Scartare il mezzo e sciacquare le cellule con 5 ml di PBS. Aggiungere 1 mL di soluzione di tripsina/EDTA allo 0,25% e incubare la capsula di Petri per 5 minuti a 37 °C.
- Aggiungere 6 mL di terreno e lavare delicatamente la sospensione cellulare. Trasferire la sospensione cellulare in un matraccio T25. Continuare la crescita per alcuni giorni fino a quando il pallone è quasi confluente.
- Scartare il mezzo e sciacquare le cellule con 5 ml di PBS. Aggiungere 1 mL di soluzione di tripsina/EDTA allo 0,25% e incubare il matraccio T25 per 5 minuti a 37 °C. Aggiungere 7 mL di DMEM contenente 1 g· L-1 di glucosio, L-glutammina, piruvato di sodio e bicarbonato di sodio, e integrato con il 10% di FBS, 100 unità·mL-1 di penicillina e 100 μg·mL-1 di streptomicina. Lavare delicatamente la sospensione cellulare.
- Dividere la sospensione cellulare in quattro matraccio T25 (2 mL per pallone) e aggiungere 5 mL di terreno a ciascun pallone. Lasciare crescere le cellule per alcuni giorni fino a quando i palloni sono quasi confluenti.
- Ripetere il punto 2.3.12 per tre matramenti e conservare l'ultimo matraccio per il punto 3.1.3. Trasferire la sospensione cellulare in un tubo conico da 15 mL e centrifugare a 150 x g per 5 minuti. Scartare il surnatante e risospendere il pellet cellulare in 900 μL. Mescolare delicatamente le cellule per mantenere una sospensione cellulare omogenea.
- Trasferire la sospensione cellulare in flaconcini di conservazione criogenica. Aggiungere 100 μL di dimetilsolfossido. Porre i crioviali a -80 °C durante la notte. Trasferire le cellule congelate in azoto liquido per ulteriori esperimenti.
NOTA: L'efficienza della trasfezione può essere valutata aggiungendo 5 μM di sale di calcio ionomicina nel mezzo e controllando l'aumento indotto della fluorescenza al microscopio a fluorescenza (λexc = 490 nm e λem = 530 nm).
- Due o tre giorni dopo la trasduzione, aggiungere 10 mL di DMEM contenente 1 g· L-1 di glucosio, L-glutammina, piruvato di sodio e bicarbonato di sodio, 10% FBS, 100 unità·mL-1 di penicillina, 100 μg·mL-1 di streptomicina e integrato con puromicina per uccidere le cellule non trasdotte. Cellule di coltura in questo mezzo per almeno 3 giorni.
3.3D modelli
- Cultura sferoidale
- Preparare una soluzione di agarosio all'1% (p/v) in acqua deionizzata (DI).
- Aggiungere 100 g di polvere di agarosio in 100 ml di acqua DI e riscaldare la soluzione in un forno a microonde fino a quando tutta la polvere è sciolta. Mescolare regolarmente la soluzione per evitare grumi. Autoclavare la soluzione per 20 min a 120 °C.
- Una volta estratto dall'autoclave, aggiungere con attenzione 75 μL di soluzione di agarosio per pozzetto in una piastra da 96 pozzetti. Depositalo sul lato del pozzo per formare un menisco, risultando in un fondo rotondo non aderente. Lasciare solidificare per 15 minuti a temperatura ambiente.
- Staccare le celle (punto 2.3.12) dal matraccio ottenuto al punto 2.3.14.
- Aggiungere 10.000 cellule per pozzetto di cellule di glioblastoma e completare fino a raggiungere un volume totale di 150 μL per pozzetto con DMEM contenente 1 g· L-1 di glucosio, L-glutammina, piruvato di sodio e bicarbonato di sodio, e integrato con il 10% di siero bovino fetale (FBS), 100 unità·mL-1 di penicillina e 100 μg·mL-1 di streptomicina.
- Incubare le cellule a 37 °C senza muovere la piastra per 3 giorni. Quindi, sostituire metà del supporto con nuovi supporti ogni 2 giorni con una pipetta multicanale fino a ulteriori esperimenti. Tenere la punta della pipetta nella parte superiore del pozzetto per evitare danni all'agarosio o allo sferoide stesso.
NOTA: La dimensione degli sferoidi dipende dal numero di cellule seminate e dalla linea cellulare, quindi deve essere adattata a seconda degli esperimenti.
- Preparare una soluzione di agarosio all'1% (p/v) in acqua deionizzata (DI).
- Il modello in ovo
- Mettere le uova fecondate di quaglia giapponese (C. japonica) in un'incubatrice (37 °C e 57% di umidità) su vassoi con un rotatore automatico che gira le uova ogni 2 ore. Questo giorno è considerato Embryonic Day (ED) 0.
- Lavare i pesatori di plastica mettendoli in etanolo al 70% (p/v). Estrarre i battelli di pesatura e asciugarli sotto una cappa aspirante.
NOTA: Da questo punto, gli esperimenti non vengono eseguiti in condizioni sterili. Tuttavia, sono necessarie condizioni pulite per evitare lo sviluppo di muffe sugli embrioni. - Su ED3, aprire delicatamente le uova usando una pinzetta con punte sottili pre-lavate con etanolo al 70% (w / v). Versare l'embrione in un contenitore di pesatura di plastica, coprirlo con un altro battello di pesatura e metterlo in un'incubatrice umidificata standard a 37 °C per 3 giorni.
- Su ED6, praticare una piccola incisione nella membrana corioallantoica (CAM) con un ago da 23 G.
- Usando una pipetta, posizionare uno sferoide di 7 giorni sull'incisione e riportare l'embrione nell'incubatore per 3 giorni, fino a ulteriori esperimenti.
NOTA: Un colorante fluorescente può essere iniettato nell'occhio dell'embrione per visualizzare i vasi sanguigni. - Il giorno dell'esperimento, posizionare la sonda flessibile sopra il tumore vascolarizzato utilizzando un micromanipolatore.
- Le in vivo modello
NOTA: Questa parte del protocollo è adattata da quella precedentemente pubblicata in riferimento14. Sono stati utilizzati topi adulti fluorescenti multicolore AMU-Neuroinflam (B6.Cg-Tg(Thy1-CFP)23Jrs(Ly6a-EGFP)G5Dzk(Itgax-EYFP)1Mnz/FD); questi topi presentano l'etichettatura di una sottopopolazione di Thy1+ neuroni mediante espressione transgenica di ECFP, marcatura di LyzM periferico+ cellule infiammatorie mediante espressione transgenica di EGFP e marcatura di un sottotipo di microglia che esprime EYFP sotto il controllo di Cd11c+. In breve, gli animali sono leggermente sedati con isoflurano all'1,5% per 2 minuti prima di qualsiasi trattamento o iniezione. Prima dell'intervento, gli animali vengono anestetizzati con ketamina (120 mg/kg; IP) e xilazina (12 mg/kg; IP). Quindi, il gel di lidocaina al 3% viene applicato localmente per alleviare qualsiasi dolore alle orecchie associato alla fissazione del supporto stereotassico. Quindi, la soluzione di bupivacaina allo 0,25% viene somministrata al sito chirurgico per alleviare qualsiasi dolore dovuto alla craniotomia. Una volta che il topo è stato preparato per l'intervento chirurgico, è stata eseguita una craniotomia di 4 mm di diametro secondo il riferimento14. Con un ago da 26 G, è stato praticato un foro nella dura-mater nel mezzo della craniotomia e lo sferoide tumorale è stato iniettato con il sistema di iniezione descritto in riferimento14. Inoltre, come descritto qui, un elettrodo flessibile è stato posizionato sul GCamp6 o DsRed che esprime lo sferoide tumorale prima di sigillare la craniotomia con una finestra di vetro.- Posizionare una goccia di soluzione salina tamponata con fosfato di Dulbecco (DPBS) in modo che copra la craniotomia. Posizionare l'elettrodo flessibile sulla goccia di DPBS e posizionare delicatamente la parte posteriore della sonda con i cuscinetti di contatto sul dorso del mouse (Figura 4B).
NOTA: Utilizzare guanti sterili e una tecnica "solo punta". Cambiare i guanti se viene contattata una superficie non sterile. Fornire supporto termico durante questa procedura. - Toccare la goccia DPBS con un piccolo pezzo di carta per assorbire DPBS fino a quando la sonda può giacere piatta sulla dura e seguire la curvatura del cervello. Assicurarsi che un piccolo strato di DPBS rimanga sotto gli elettrodi senza fuoriuscire dal lato dell'elettrodo. Ciò garantisce una barriera contro lo spillover della colla durante le fasi successive.
NOTA: Sterilizzare tutte le apparecchiature prima dell'uso. - Posizionare una piccola goccia di adesivo siliconico sulla sonda e coprirla con un vetro di copertura rotondo da 5 mm. Spingere il vetro di copertura verso il basso fino a quando il silicone è distribuito uniformemente e la distanza tra il vetro di copertura e la sonda è minima. Spingere il vetro di copertura verso il basso per altri 30 secondi in modo che il silicone possa solidificarsi.
- Per fissare il vetro di copertura, applicare rapidamente la supercolla sui lati e spingerla verso il basso fino a quando la colla non si polimerizza fino a diventare solida.
- Usando uno stuzzicadenti, applicare la supercolla al collo della sonda facendo attenzione che la supercolla venga disegnata sotto il collo per fornire un supporto stabile per esso.
- Coprire il cranio con cemento dentale per costruire un cappuccio cronico. Prestare particolare attenzione a coprire solo i bordi del vetro di copertura.
- Sollevare la parte posteriore della sonda e applicare il cemento sotto il collo della sonda. Appoggiare la sonda sul cemento prima che si polimerizzi. Spingere delicatamente verso il basso il collo della sonda con una pinza smussata in modo che la sua superficie sia allo stesso livello di quella del vetro di copertura e non intralciante l'obiettivo del microscopio durante l'esperimento.
- Coprire la parte superiore del collo della sonda con non più di 1,5 mm di strato di cemento dentale per ottenere una presa salda sulla sonda. Costruire un pozzo di cemento che presenti una cresta di 1,5 mm ad una distanza di 1-2 mm attorno al vetro di copertura per creare un bacino per il fluido di immersione per l'imaging a due fotoni (Figura 4C).
- Dopo che il cemento si è indurito, applicare analgesici post-chirurgici di buprenorfina (0,05 mg/kg, 0,1 ml per 10 g di peso corporeo per via sottocutanea) e mantenere l'animale in un'atmosfera calda fino al suo risveglio. Ciò include la vicinanza a una lampadina a infrarossi e l'avvolgimento dell'animale in un tovagliolo di carta.
NOTA: posizionare un termometro a livello del mouse per monitorare la temperatura. - Caratterizzare l'impedenza nell'intervallo 1-10 kHz utilizzando un potenziostato.
- Lascia che l'animale si riprenda dall'intervento chirurgico per almeno 10 giorni. Somministrare farmaci antinfiammatori immediatamente dopo l'intervento chirurgico e continuare a monitorare lo stato dell'animale per fornire un'adeguata analgesia post-operatoria.
- Posizionare una goccia di soluzione salina tamponata con fosfato di Dulbecco (DPBS) in modo che copra la craniotomia. Posizionare l'elettrodo flessibile sulla goccia di DPBS e posizionare delicatamente la parte posteriore della sonda con i cuscinetti di contatto sul dorso del mouse (Figura 4B).
4. Erogazione e imaging del campo elettrico pulsato (PEF)
- Posizionare i campioni sotto un microscopio a fluorescenza. Nel caso di modelli 3D, i tumori possono essere osservati solo dall'alto.
NOTA: Per il modello in ovo , gli esperimenti sono stati eseguiti al microscopio a epifluorescenza (ma è possibile anche con un microscopio a due fotoni), mentre gli esperimenti sul modello in vivo sono stati eseguiti al microscopio a due fotoni (Figura 6). - Collegare un generatore di impulsi ai pad di contatto dei dispositivi, utilizzando connettori pogo pin (in vitro) o clip a coccodrillo (in ovo e in vivo) (Figura 4A). Impostare i parametri desiderati (numero di impulsi, tensione, durata dell'impulso, frequenza) e applicare i PEF facendo funzionare il generatore (Figura 4A). Misurare la fluorescenza simultaneamente per osservare gli effetti dei PEF in tempo reale.
Risultati
Questo protocollo consente l'applicazione a due modelli di glioblastoma in cui è integrato un sistema flessibile di erogazione della PEF. Seguendo le fasi di microfabbricazione e confezionamento, gli elettrodi flessibili sono caratterizzati in soluzione salina mediante spettroscopia di impedenza elettrochimica (EIS) per valutare e convalidare le loro prestazioni. Gli elettrodi rivestiti PEDOT:PSS mostrano le tipiche regioni dominate capacitive e resistive separate da una frequenza di taglio, mentre gli elettrodi non rivestiti mostrano solo un comportamento capacitivo (Figura 2).
Una variante del metodo della piastra a 96 pozzetti di sovrapposizione liquida viene utilizzata per far crescere tumori 3D fatti di cellule di glioblastoma trasfettate che esprimono stabilmente un reporter di calcio intracellulare fluorescente. La crescita degli sferoidi può essere osservata con un microscopio a campo luminoso (Figura 3; ED 0). Sono necessari almeno 2 o 3 giorni per ottenere sferoidi sferici e densi, a seconda della linea cellulare e del numero di cellule seminate.
Nel modello in ovo , gli sferoidi sono innestati nella membrana corioallantoica di un embrione di quaglia (Figura 3; ED 6). Il successo dell'innesto può essere valutato mediante microscopia a fluorescenza pochi giorni dopo, poiché le cellule viventi hanno calcio intracellulare e sono quindi fluorescenti (Figura 3; ED 9). La vascolarizzazione del tumore può essere osservata al microscopio a fluorescenza iniettando un colorante fluorescente nei vasi sanguigni (Figura 3; ED9). Tuttavia, potrebbe non essere sempre possibile visualizzare i vasi sanguigni all'interno del tumore poiché lo sferoide è molto denso. Gli elettrodi interdigitati flessibili sono posizionati sopra il tumore vascolarizzato (Figura 3; ED 9) e collegato ad un generatore di impulsi. La sonda deve essere posizionata delicatamente per evitare il sanguinamento dell'embrione; Altrimenti, il colorante fluorescente può diffondersi, il che ostacola qualsiasi osservazione mediante imaging. La corretta erogazione dell'impulso all'ambiente biologico può essere verificata misurando la corrente che attraversa il circuito. L'imaging di questi in modelli ovo consente il monitoraggio in tempo reale dell'effetto dei PEF sul calcio intracellulare in un tumore del glioblastoma 3D, nonché della vasocostrizione indotta sulla vascolarizzazione del tumore, evitando qualsiasi influenza di altri tipi di cellule incluso il sistema immunitario15.
Lo studio dell'effetto della PEF sul glioblastoma può essere eseguito anche in un modello più completo e predittivo. Infatti, il modello in vivo descritto sopra14 consiste nell'innesto di un tumore di glioblastoma 3D nel parenchima cerebrale di un topo (Figura 4). Il sito di iniezione del tumore è tappato da una hemi-bead reticolato in gel di destrano, per ricapitolare i vincoli biofisici fisiologici durante la crescita del tumore. Sebbene descritto nel riferimento14, vale la pena sottolineare nuovamente che è di fondamentale importanza che l'emiperlina destrano sia esattamente superincollata alla dura madre; Altrimenti, il tumore può sfuggire attraverso la dura aperta e coprire completamente il cervello, rendendo impossibile l'imaging. Per qualsiasi imaging cronico, la crescita tissutale che avviene quando la finestra cranica guarisce rappresenta una seria barriera, poiché il nuovo tessuto non è trasparente e rende le immagini nebbiose o non utilizzabili. Pertanto, dopo aver inserito e incollato l'emi-bead, le pareti laterali della finestra cranica aperta devono essere sigillate con un sottile strato di supercolla meticolosamente posizionato intorno alla parete della cavità, senza lasciare che la supercolla scivoli o fluisca sulla dura. Quando la sonda flessibile viene posizionata sopra il sito di iniezione del tumore, nessuna bolla può rimanere sotto la sonda, per due motivi. In primo luogo, l'imaging non può procedere quando sono presenti bolle. In secondo luogo, le bolle fungono da isolanti, modificando così le proprietà di stimolazione elettrica. Dopo aver preso le precauzioni sopra descritte, la craniotomia viene sigillata con una finestra di vetro cementata al cranio per consentire l'imaging cronico per settimane. Poiché il tumore è costituito da cellule che esprimono GCaMP o DsRed, l'iniezione può essere confermata con un microscopio a fluorescenza. L'impedenza elettrochimica degli elettrodi deve essere misurata per convalidare le prestazioni dopo l'impianto. Rispetto all'impedenza in soluzione salina, si prevede un aumento dell'impedenza in vivo a frequenze superiori a 100 Hz a causa della presenza di un ambiente biologico (Figura 5). Il parenchima neurale vascolarizzato e l'infiltrazione tumorale possono essere osservati e caratterizzati attraverso il substrato trasparente per settimane mediante microscopia a due fotoni (Figura 6). L'uso di animali transgenici che esprimono proteine fluorescenti in cellule di interesse (cellule immunitarie e neuroni) può, ad esempio, consentire la dimostrazione del processo infiammatorio minimo indotto dalla sola impiantazione di elettrodi (Figura 6A) o mostrare la presenza di microglia e monociti 26 giorni dopo l'impianto di un elettrodo stimolato dalla PEF impiantato sopra un tumore GBM in crescita (Figura 6B1 ). In quest'ultimo caso, sia le cellule derivate dai monociti periferici che le cellule microgliali residenti nel cervello sono state trovate intorno e all'interno del tumore (Figura 6B2). Il giorno della consegna della PEF, i pad di contatto degli elettrodi flessibili possono essere collegati al generatore di impulsi, direttamente sotto il microscopio a due fotoni. Nel complesso, questo modello può essere utilizzato per studiare l'effetto dei trattamenti bioelettrici nel tempo utilizzando vari tipi di cellule coinvolte nello sviluppo del tumore cerebrale, fino a una profondità di circa 500 μm.
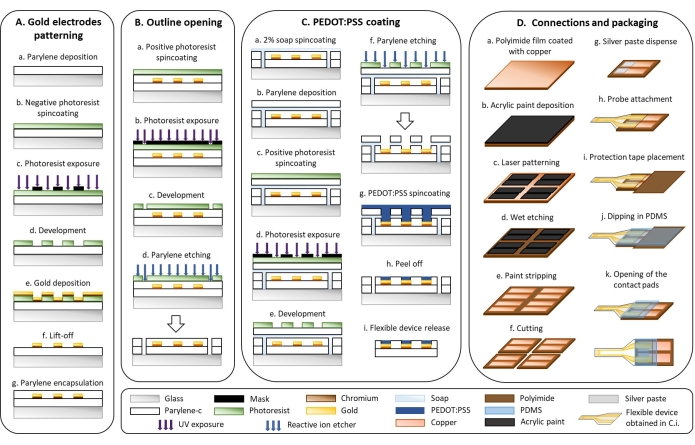
Figura 1: Microfabbricazione di elettrodi flessibili. (A) Pattern di elettrodi d'oro e substrato di parylene C. (B) Apertura schematica. (C) PEDOT:Rivestimento PSS. (D) Connessioni e imballaggio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
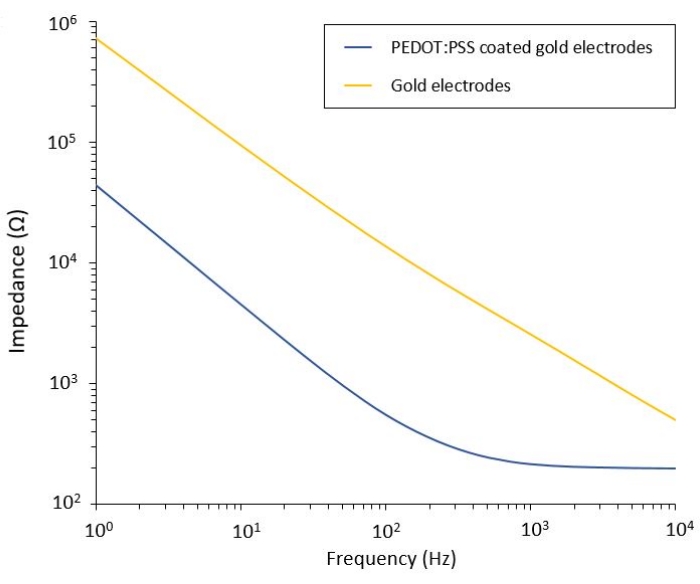
Figura 2: Spettroscopia di impedenza elettrochimica di elettrodi flessibili in oro e elettrodi freddi rivestiti PEDOT:PSS in una soluzione salina. Fare clic qui per visualizzare una versione ingrandita di questa figura.
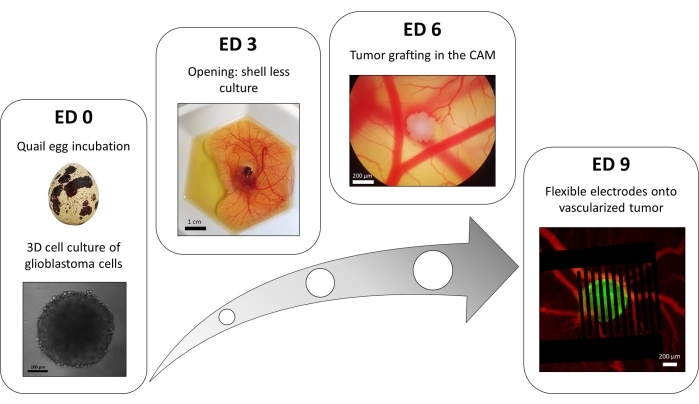
Figura 3: Il modello in ovo del glioblastoma. ED 0: Sferoide osservato con un microscopio a campo chiaro. ED 3: Coltura senza guscio di un embrione di quaglia 3 giorni dopo l'apertura. ED 6: Tumore impiantato nella CAM osservato con un microscopio a campo chiaro. ED 9: Dispositivo flessibile posto sul tumore vascolarizzato (tumore in verde e vasi sanguigni in rosso). Fare clic qui per visualizzare una versione ingrandita di questa figura.
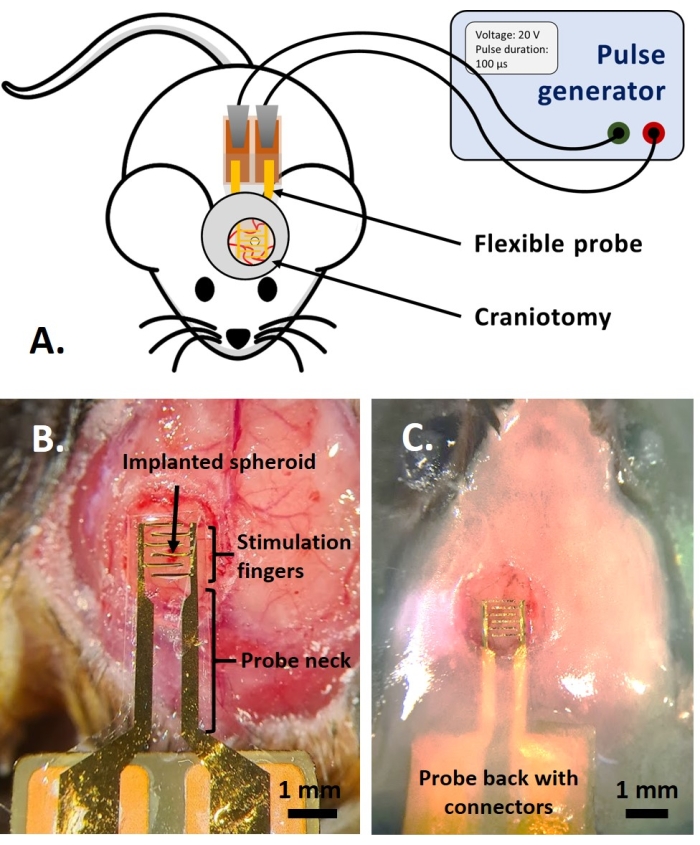
Figura 4: Applicazione in vivo. (A) Schema per esperimenti in vivo. (B) Posizionamento della sonda prima dell'applicazione del vetro di copertura e della resina acrilica. (C) Impianto della sonda completato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
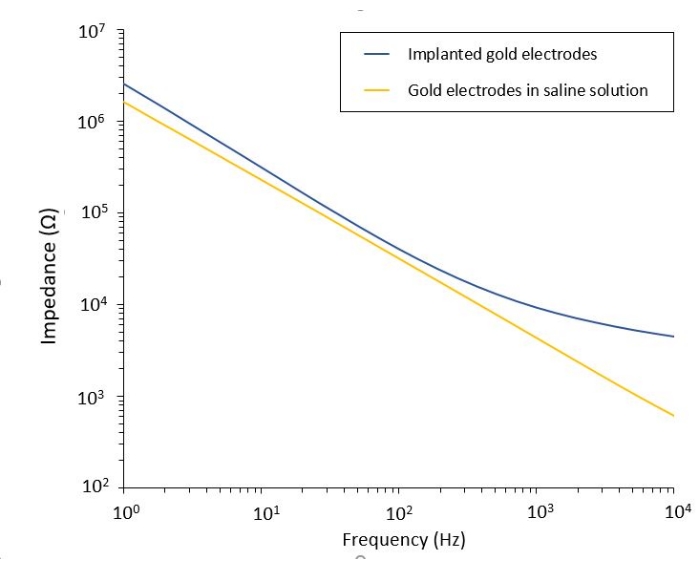
Figura 5: Spettroscopia di impedenza elettrochimica di elettrodi d'oro flessibili in una soluzione salina rispetto a una sonda impiantata. Fare clic qui per visualizzare una versione ingrandita di questa figura.
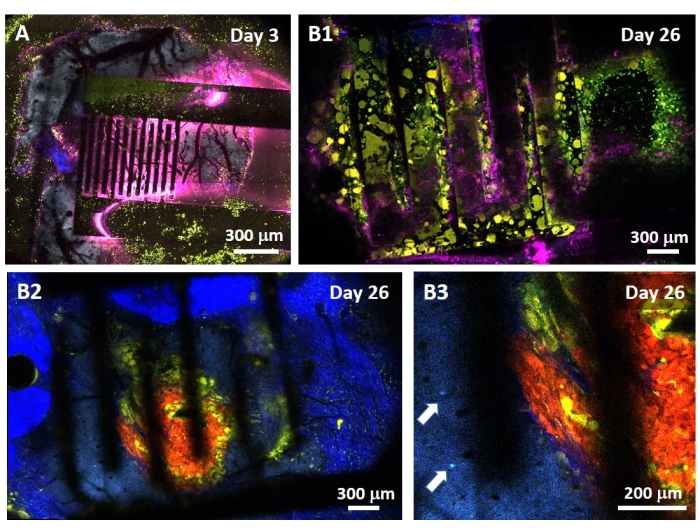
Figura 6: Imaging multispettrale intravitale a due fotoni attraverso elettrodi . (A) Immagine piastrellata della superficie cerebrale sana in un topo multifluorescente di controllo AMU-Neuroinflam 3 giorni dopo l'impianto dell'elettrodo. Il ciano mostra l'arborizzazione dendritica dei neuroni piramidali di livello 5, il verde mostra granulociti e monociti reclutati e il giallo mostra microglia attivata e cellule dendritiche. Il rosa mostra la diffusione infrarossa dovuta all'accumulo di calore. (B1) Immagine simile a quella di A, ma 26 giorni dopo l'impianto sferoidale tumorale a 200 μm di profondità all'interno della corteccia immediatamente seguita dall'impianto dell'elettrodo. Si noti l'accumulo di cellule immunitarie verdi e gialle. (B2) Immagine simile a quella di B1 ma 100 μm sotto la superficie degli elettrodi. Si noti la presenza di arborizzazione dendritica neuronale blu nella periferia della massa tumorale rossa stessa infiltrata da microglia gialle e cellule dendritiche. Il blu intenso mostra un secondo segnale armonico dal collagene peritumorale. (B3) Vista ingrandita di B2 che mostra la presenza di somi interneuronali (indicati da frecce) in prossimità del tumore. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
L'approccio descritto in questo lavoro consente a modelli di tumore cerebrale con un sistema integrato di rilascio di PEF di studiare l'effetto delle PEF a diversi livelli di organizzazione biologica. Il protocollo di microfabbricazione consiste in processi standard a film sottile, che forniscono un ampio grado di libertà nella progettazione degli elettrodi che può essere adattato all'applicazione specifica. A volte, un'ulteriore fase di ricottura termica può essere utile alla fine della fabbricazione, per ridurre la flessione degli elettrodi che si è verificata durante la produzione.
L'uso di una linea cellulare stabile di glioblastoma che esprime un indicatore fluorescente di calcio evita tutte le complicazioni legate alla consegna e alla ritenzione del colorante, specialmente nei tumori 3D che sono molto densi16. In effetti, un alto livello di espressione è osservato per un lungo periodo rispetto agli indicatori chimici fluorescenti standarddel calcio 17. Questo protocollo può essere applicato a varie linee cellulari, poiché è comunemente usato per l'imaging dell'attività neurale11. Qui sono state utilizzate linee cellulari umane e murine (U87 e Gl261 per l'impianto in topi immunodeficienti o immunocompetenti, rispettivamente). Infatti, studi recenti hanno dimostrato che la linea cellulare U87 è diversa da quella delle cellule originali in quanto molte mutazioni sono state acquisite in anni di coltura cellulare, influenzando la riproducibilità sperimentale18. Il metodo utilizzato per la preparazione dei tumori 3D è ad alto rendimento, riproducibile e consente la generazione di sferoidi di dimensioni specifiche a seconda della linea cellulare, del numero di cellule in fase di semina e del tempo di crescita19. Tuttavia, questi sferoidi sono densi, il che presenta uno svantaggio quando si esegue l'imaging al centro del tumore.
Il modello in ovo è utile come primo approccio per studiare l'effetto della PEF sui tumori 3D e sulla loro vascolarizzazione, senza interazioni con altri tipi cellulari presenti nel cervello. Questo modello è economico, veloce, ad alto rendimento e solleva meno problemi etici rispetto ai modelli animali. È importante mantenere l'integrità dell'embrione durante l'intero esperimento, in quanto potrebbe influire sulla sua sopravvivenza e sulla qualità dell'imaging. Prestare particolare attenzione durante l'apertura dell'uovo di quaglia, per evitare danni alla membrana embrionale. Anche l'innesto e il posizionamento degli elettrodi flessibili devono essere eseguiti con attenzione, per evitare sanguinamenti che potrebbero uccidere l'embrione. L'iniezione di colorante fluorescente nei vasi sanguigni consente la visualizzazione simultanea delle cellule tumorali e la vascolarizzazione con microscopia a fluorescenza. L'iniezione intraoculare deve essere eseguita con attenzione per evitare fuoriuscite di colorante nel liquido embrionale, che potrebbe causare una fluorescenza residua sullo sfondo che degrada la qualità dell'imaging. Questo modello può essere utilizzato anche per seguire l'assorbimento del farmaco, in quanto consente l'accesso al sistema circolatorio. Tuttavia, gli esperimenti sono limitati dal tempo di sopravvivenza di 12 giorni dell'embrione, consentendo così 7 giorni di osservazione, che è significativamente più breve del modello in vivo 21.
Il modello di tumore cerebrale in vivo può essere monitorato per 4-5 settimane prima che gli animali raggiungano un endpoint sperimentale etico determinato da un'improvvisa perdita di peso del 20%. È ben tollerato e rimane in posizione se la coda di collegamento dell'elettrodo non è troppo lunga. Altrimenti, gli animali tendono a graffiare il connettore ribaltabile, che alla fine potrebbe essere strappato, impedendo così la successiva connessione allo stimolatore. Questo periodo di 4 settimane è comunque prezioso per coprire le diverse fasi dello sviluppo del glioblastoma. Quando si confrontano le densità delle cellule tumorali nello stesso volume di interesse a diversi intervalli di tempo, si può osservare l'evoluzione della cinetica di crescita del tumore. In particolare, una maggiore crescita tumorale è stata osservata al momento del passaggio immunitario22. Uno studio simile in presenza di un elettrodo stimolante informerebbe sull'effetto della PEF sul tasso di proliferazione tumorale e sulla sensibilità tumorale all'eliminazione immunitaria. Rispetto al modello in ovo , il modello in vivo può essere visto come un valido modello preclinico per studiare l'impatto delle cellule immunitarie sulla progressione tumorale e il loro contributo all'effetto terapeutico della PEF. Questo protocollo è adattato da un articolo precedente con l'aggiunta di un dispositivo elettrodo flessibile sul tumore prima di posizionare una finestra cranica14. Sia i trattamenti bioelettrici acuti che cronici dei tumori possono essere caratterizzati da osservazioni dirette e successive con microscopia a due fotoni, dato che ci si aspetta che la stimolazione iniziale induca la morte cellulare e inneschi una disregolazione duratura della risposta immunitaria.
Le connessioni della sonda flessibile sono facilmente accessibili al microscopio a due fotoni. I parametri di stimolazione elettrica possono quindi essere regolati in tempo reale in base all'effetto osservato sul tessuto neurale e / o sulle cellule bersaglio, in modo simile a come un medico eseguirebbe procedure interventistiche mentre osserva le immagini MRI o TC del suo paziente. Un'ultima considerazione è l'importanza di un'attenta sigillatura dell'elettrodo sul cervello con supercolla e colla siliconica per prevenire la ricrescita dei tessuti.
In conclusione, il protocollo qui descritto rappresenta un modello innovativo per studiare l'effetto della terapia PEF con elettrodi polimerici organici flessibili per modelli tumorali di glioblastoma. I due modelli presentano diversi livelli di complessità tali che gli effetti cellulari, vascolari o immunitari possono essere separati per una migliore comprensione dei meccanismi d'azione. Gli elettrodi conformi e superficiali riducono il danno iatrogeno consentendo allo stesso tempo la rottura del microambiente tumorale, innescando vasocostrizione o disregolazione del calcio15 intracellulare.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Il lavoro qui riportato è stato sostenuto dall'Agenzia nazionale francese per la ricerca (ANR-18-CE19-0029). Gli autori ringraziano calorosamente S.M. Bardet per il suo contributo alla generazione di una linea cellulare GCaMP6f stabile e D. O'Connor per il suo aiuto con il modello in ovo .
Materiali
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
Riferimenti
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon