Method Article
Un approccio di analisi delle comete ad alto rendimento per la valutazione del danno al DNA cellulare
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il saggio della cometa è un mezzo popolare per rilevare danni al DNA. Questo studio descrive un approccio per eseguire diapositive in varianti rappresentative del saggio della cometa. Questo approccio ha aumentato significativamente il numero di campioni diminuendo il tempo di esecuzione del test, il numero di manipolazioni dei vetrini e il rischio di danni ai gel.
Abstract
Le cellule sono continuamente esposte ad agenti provenienti dagli ambienti interni ed esterni, che possono danneggiare il DNA. Questo danno può causare una funzione cellulare aberrante, e quindi il danno al DNA può svolgere un ruolo critico nello sviluppo, presumibilmente, di tutte le principali malattie umane, ad esempio il cancro, le malattie neurodegenerative e cardiovascolari e l'invecchiamento. L'elettroforesi su gel a singola cellula (cioè il saggio della cometa) è uno dei metodi più comuni e sensibili per studiare la formazione e la riparazione di una vasta gamma di tipi di danni al DNA (ad esempio, rotture di filamenti singoli e doppi, siti alcalino-labili, legami incrociati DNA-DNA e, in combinazione con alcuni enzimi di riparazione, purine ossidate e pirimidine), sia in vitro che in vivo . Sistemi. Tuttavia, la bassa produttività del campione del test convenzionale e il laborioso lavoro del campione sono fattori limitanti per la sua più ampia applicazione possibile. Con il "punteggio" delle comete sempre più automatizzato, il limite è ora la capacità di elaborare un numero significativo di diapositive di comete. Qui è stata sviluppata una variante ad alto rendimento (HTP) del test cometa (HTP comet assay), che aumenta significativamente il numero di campioni analizzati, diminuisce il tempo di esecuzione del test, il numero di manipolazioni individuali dei vetrini, i requisiti di reagenti e il rischio di danni fisici ai gel. Inoltre, l'ingombro del serbatoio di elettroforesi è significativamente ridotto a causa dell'orientamento verticale delle guide e del raffreddamento integrale. Qui è riportato anche un nuovo approccio per raffreddare i vetrini di analisi delle comete, che facilita convenientemente ed efficacemente la solidificazione dei gel della cometa. Qui è stata descritta l'applicazione di questi dispositivi a metodi rappresentativi di analisi cometa. Queste semplici innovazioni supportano notevolmente l'uso del saggio della cometa e la sua applicazione ad aree di studio come la biologia dell'esposizione, l'ecotossicologia, il biomonitoraggio, lo screening / test di tossicità, insieme alla comprensione della patogenesi.
Introduzione
Le cellule sono esposte continuamente ad agenti provenienti dagli ambienti interni ed esterni, che possono danneggiare il DNA 1,2. Questo danno può causare la funzione cellulare aberrante3, e quindi il danno al DNA può svolgere un ruolo critico nello sviluppo di molte delle principali malattie umane, ad esempio il cancro, le malattie neurodegenerative e cardiovascolari e l'invecchiamento4. Il saggio della cometa (chiamato anche elettroforesi su gel a singola cellula) è un metodo sempre più popolare per rilevare e quantificare il danno al DNA cellulare.
Nella sua forma più semplice, il saggio alcalino della cometa (ACA) rileva le rotture del filamento (SB; sia singole che doppie), insieme ai siti apurinici/apirimidinici e ai siti alcalino-labili (SLA) che diventano entrambi rotture a singolo filamento in condizioni alcaline5. Il test della cometa a pH neutro può valutare le rotture franche di un singolo e doppio filamento6. Inoltre, l'ACA, in combinazione con un certo numero di enzimi di riparazione del DNA, può rilevare una gamma considerevole di tipi di danni al DNA, ad esempio purine ossidate (identificate mediante l'uso di 8-ossoguanina DNA glicosilasi umana 1; hOGG17); pirimidine ossidate (utilizzando Endonucleasi III; EndoIII) e dimeri di pirimidina ciclobutano (utilizzando l'endonucleasi T4 V; T4endoV)8. Il saggio della cometa può anche essere utilizzato per valutare le lesioni del DNA indotte da agenti reticolanti, come il cisplatino 9,10,11. Come indicato dal nome formale del test, cioè elettroforesi su gel a singola cellula, il test si basa sul fatto che le cellule in analisi sono una sospensione a singola cellula; Più comunemente, queste sono cellule in coltura, ma possono essere isolate dal sangue intero 12,13, o il sangue intero stesso può essere usato 14,15. In alternativa, una sospensione monocellulare può essere generata da tessuti solidi.
A parte alcune eccezioni, in particolare i rapporti CometChip del laboratorio Engleward 16, il protocollo complessivo di analisi delle comete non è cambiato radicalmente da quello originariamente descritto dagli inventori del saggio (Östling e Johansson17 e Singh etal.18). Il saggio della cometa comporta numerose fasi (Figura 1). Molti di questi passaggi comportano il trasferimento dei sottili gel di agarosio contenenti cellule, un vetrino alla volta e, quindi, comportano un rischio di danno o perdita del gel, compromettendo il successo dell'esperimento. Di conseguenza, il test della cometa può richiedere molto tempo, in particolare se viene eseguito un numero significativo di vetrini. In genere, un massimo di 40 vetrini vengono eseguiti in un grande serbatoio di elettroforesi (33 cm x 59 cm x 9 cm), che si trova all'interno di un vassoio ancora più grande contenente ghiaccio umido per il raffreddamento. È stato recentemente riportato che la durata del test può essere ridotta a 1 giorno diminuendo la durata della fase di lisi e non asciugando i vetrini prima della colorazione19.
I presenti autori hanno precedentemente riportato un nuovo approccio al saggio di cometa alcalina ad alta produttività (HTP ACA), in cui più (lotti di 25) vetrini da microscopio per comete possono essere manipolati simultaneamente durante il processo di analisi della cometa20,21,22. Questo approccio brevettato riduce al minimo il rischio di danneggiamento o perdita dei gel contenenti campioni eliminando la necessità di manipolare i vetrini del microscopio singolarmente e può essere applicato a tutte le varianti del test della cometa, che utilizzano vetrini da microscopio. I rack contenenti vetrini proteggono i gel durante le manipolazioni e, di conseguenza, l'elaborazione del campione è più rapida ed efficiente. Le guide possono anche essere sottoposte a elettroforesi nei rack, tenuti nell'orientamento verticale, anziché orizzontale. Questo, e il raffreddamento integrale, riducono significativamente l'ingombro del serbatoio di elettroforesi e rimuovono la necessità di ghiaccio umido. Nel complesso, ciò rappresenta un miglioramento significativo rispetto alla procedura convenzionale. L'attrezzatura utilizzata è illustrata nella figura 2. I protocolli qui descritti, utilizzando questo nuovo approccio, dimostrano l'applicazione rappresentativa alle cellule in coltura e al sangue intero14 per il rilevamento di siti alcali-labili (SLA), legami incrociati tra filamenti di DNA (ICL) e substrati di vari enzimi di riparazione del DNA.
Protocollo
Nel presente studio sono stati utilizzati campioni di sangue disponibili in commercio. Presso la nostra istituzione, l'approvazione dell'Institutional Review Board non è necessaria per l'uso di sangue disponibile in commercio.
1. Preparazione dei materiali per il saggio della cometa
- Preparazione dei vetrini del microscopio
- Versare l'agarosio normale all'1% (p/v) [sciolto in acqua bidistillata (ddH 2 O)] in un tubo da 50 ml e nel microonde per sciogliere l'agarosio nel ddH2O. Conservare a 37 °C per evitare la solidificazione prima di rivestire i vetrini. In caso di solidificazione, scartare e preparare fresco.
- Il microscopio prestrato si trasforma immergendo i vetrini nel tubo da 50 mL contenente l'1% (p/v) di agarosio con punto di fusione normale.
- Pulire rapidamente il retro delle diapositive dopo aver immerso le diapositive.
NOTA: La mancata pulizia corretta del retro dei vetrini aumenterà il rumore di fondo dei vetrini durante la fase di analisi al microscopio. - Etichettare la diapositiva rivestita con un pennarello permanente nell'angolo inferiore destro della sezione smerigliata (Figura 3A). Questo mostra quale lato della diapositiva è pre-rivestito.
- Lasciare che l'agarosio si indurtenga e si asciughi per una notte a temperatura ambiente.
- Avvolgere i vetrini secchi in carta velina e conservarli in una scatola.
2. Preparazione dei campioni
- Cellule in coltura
NOTA: In primo luogo, trattare le cellule con gli agenti dannosi prima di iniziare il test della cometa. Quindi, eseguire le operazioni seguenti.- Se le cellule sono aderenti, tripsinizzare le cellule per rilasciarle dal pallone di coltura cellulare o dalle piastre di Petri della coltura cellulare, alla confluenza appropriata delle cellule. Neutralizzare la tripsina aggiungendo mezzi contenenti siero.
- Trasferire le cellule in un tubo da 50 ml, centrifugare (ad esempio, per HaCaTs, centrifugare a 300 x g per 5 minuti a temperatura ambiente), rimuovere delicatamente il surnatante e aggiungere 1 mL di PBS al pellet cellulare.
- Eseguire il conteggio delle celle.
- Trasferire 30.000 cellule in una provetta da microcentrifuga da 1,5 ml e centrifugare a 7.607 x g per 5 minuti a 4 °C.
- Rimuovere delicatamente il surnatante e conservare il pellet cellulare sul ghiaccio al buio prima di eseguire il test della cometa.
NOTA: Le cellule devono essere regolarmente testate per la contaminazione da Mycoplasma prima di eseguire il test della cometa per prevenire, tra gli altri effetti, la formazione di danni al DNA artefattuale e una risposta alterata al danno al DNA, come riportato altrove23. Le condizioni di centrifugazione possono essere modificate, se necessario, a seconda del tipo di cella utilizzata.
- Preparazione di cellule in coltura per il saggio di riparazione
- Cellule di coltura nel pallone di coltura cellulare o nelle piastre di Petri.
- Lavare le cellule con 1 mL di PBS due volte prima di trattare le cellule con agenti dannosi (ad esempio, per le cellule BE-M17, trattare con 50 μM di H 2 O2per 20 minuti) su ghiaccio per evitare che si verifichi la riparazione durante il trattamento.
- Lavare delicatamente le cellule con 1 mL di PBS due volte per rimuovere eventuali residui di agenti dannosi.
- Reintrodurre il terreno di coltura cellulare e lasciare che le cellule si riparino per durate variabili (ad esempio, 0 min, 30 min, 2 h, 6 h, 24 h e 30 h) in un incubatore umidificato (37 °C, 5% CO2).
- In ogni momento, raccogliere 30.000 cellule in terreno di coltura cellulare contenente dimetilsolfossido (DMSO) al 10% e conservarle a -80 °C.
- Prima di eseguire il saggio della cometa, scongelare rapidamente le cellule a 37 °C a bagnomaria e centrifugarle a 7.607 x g per 5 minuti a 4 °C.
- Rimuovere il surnatante e conservare il pellet cellulare su ghiaccio prima di eseguire il test (cioè dal punto 3).
- Preparazione di sangue intero
NOTA: Il seguente metodo beneficia del fatto che (i) è un approccio minimamente invasivo per ottenere un campione di sangue, (ii) non richiede l'isolamento di PBMC prima del test della cometa e (iii) consente di conservare i campioni di sangue (con un volume < 250 μL) a -80 °C, per un massimo di 1 mese (sebbene prove più recenti suggeriscano che è possibile una conservazione più lunga), senza necessità di crioconservanti e senza rischi o formazione di danni arteficiosi14. L'approvazione etica, o equivalente, può essere necessaria prima di ottenere campioni di sangue da pazienti o animali. In alternativa, possono essere utilizzati campioni di sangue disponibili in commercio come nel presente studio. Presso la nostra istituzione, l'approvazione dell'Institutional Review Board non è necessaria per l'uso di sangue disponibile in commercio.- Utilizzando una pipetta, trasferire campioni di sangue intero (<250 μL) (Tabella dei materiali) in una provetta di raccolta contenente un volume minimo contenente 0,4 mg di EDTA (per 250 μL di sangue).
- Congelare i campioni di sangue a -80 °C prima di eseguire il test della cometa HTP.
- Scongelare campioni di sangue conservati (<250 μL) a temperatura ambiente, senza riscaldamento.
- Trasferire 5 μL di sangue intero in provette da microcentrifuga prima di eseguire il test della cometa (vedere punto 3).
3. Lisi cellulare
NOTA: Eseguire tutte le procedure su ghiaccio.
- Utilizzare 12.000 cellule o 2,5 μL di sangue intero per gel.
- Preparare l'agarosio a basso punto di fusione allo 0,6% (p/v) sciolto in PBS utilizzando un forno a microonde e metterlo a bagnomaria a 37 °C per evitare che si solidifichi.
- Etichettare l'estremità smerigliata dei vetrini pre-rivestiti con il nome dello sperimentatore, la data e le informazioni sul trattamento utilizzando un pennarello o una matita indelebile.
- Posizionare una piastra di raffreddamento su una panca piana e inserire i due gruppi di raffreddamento congelati nel cassetto scorrevole sotto la superficie metallica (come mostrato nella figura 4)21.
- Posizionare i vetrini sulla piastra di raffreddamento e lasciare che i vetrini pre-raffreddano per 1-2 minuti prima di aggiungere le celle contenenti agarosio a basso punto di fusione allo 0,6% (p/v) (punto 3.7).
NOTA: Lasciare i vetrini sulla piastra di raffreddamento per più di 1-2 minuti può causare la formazione di condensa sulla superficie del vetrino a causa dell'umidità ambientale. Ciò può rendere i gel di agarosio a basso punto di fusione meno stabili sui vetrini. - Disperdere il pellet (fase 2.2.7) mediante vortice. Assicurarsi che tutto il surnatante sia stato rimosso dal pellet. Riporre immediatamente le provette di campionamento (contenenti le celle pellettate) sul ghiaccio.
NOTA: Quando si posizionano le provette contenenti campioni nella centrifuga, metterle con la cerniera rivolta verso l'esterno in modo che il pellet venga raccolto su questo lato del tubo. A volte è difficile vedere il pellet ed è facile spostarlo mentre si rimuove il surnatante. La centrifugazione con il coperchio del tubo in questo orientamento consentirà di sapere dove sarà il pellet cellulare. - Risospendere il pellet cellulare con 200 μL di agarosio a basso punto di fusione allo 0,6% (agarosio LMP) e mescolare pipettando su e giù senza creare bolle. Quindi, trasferire rapidamente 80 μL di cellule contenenti agarosio LMP su un vetrino refrigerato e posizionare rapidamente un vetrino di copertura sul gel.
- Lasciare riposare il gel sulla piastra di raffreddamento per 1-2 minuti.
- Nel frattempo, preparare una soluzione di lavoro da 500 mL di tampone di lisi (Tabella 1) e versarla nella capsula di lisi (Figura 2).
- Una volta che i gel sono stati impostati, rimuovere rapidamente i coprivetrini tenendo delicatamente il vetrino tra pollice e indice e facendo scorrere il coprislip dal gel.
- Posizionare i vetrini contenenti campioni all'interno del portavetri (tutti i segni neri di "punti" sui vetrini devono essere rivolti nella stessa direzione quando sono posizionati in un supporto) (Figura 3B), quindi posizionare il portavetri all'interno del piatto di lisi (Figura 2).
- Chiudere il coperchio della capsula di lisi e conservare la capsula di lisi in frigorifero per una notte a 4 °C o 30 minuti a temperatura ambiente, a seconda di quale si adatti meglio all'orario19 dell'operatore.
4. Elettroforesi
- Rimuovere con attenzione il portavetrini dal piatto di lisi. Fare attenzione a non disturbare i gel.
- Posizionare delicatamente il portavetrini in una piastra di lavaggio precaricata con ddH 2 Oghiacciato e lasciarlo per 30 minuti assicurandosi che i vetrini siano completamente coperti con ddH2O.
- Inserire un pacco di raffreddamento congelato all'interno del cassetto scorrevole sotto il serbatoio di elettroforesi per mantenere la temperatura ottimale del tampone.
- Aggiungere con cautela la soluzione di lavoro per elettroforesi ghiacciata (Tabella 1) al serbatoio di elettroforesi e trasferire il supporto del vetrino nel serbatoio dell'elettroforesi. Orientare i vetrini in modo tale che le loro parti trasparenti con i gel contenenti cellule (cioè NON le estremità smerigliate / etichettatura) puntino verso il catodo (elettrodo rosso).
- Lasciare riposare i vetrini nel serbatoio di elettroforesi per 20 minuti in modo che il DNA si rilassi e si rilassi. Tenere l'alimentatore spento durante questo passaggio.
- Se necessario, inserire una nuova confezione di raffreddamento congelata per massimizzare il raffreddamento.
- Eseguire l'elettroforesi per 20 minuti a 1,19 V/cm, o qualsiasi condizione sia stata ottimizzata.
NOTA: L'ottimizzazione delle condizioni di funzionamento dell'elettroforesi e del volume del tampone è raccomandata per ogni laboratorio24. L'uso di un solo supporto di vetrini durante l'elettroforesi non causa alcun effetto delle diapositive sulla resistenza del tampone di elettroforesi e gli autori non hanno visto un effetto significativo nella tensione o nella corrente quando il numero delle diapositive è cambiato. - Spegnere l'alimentazione, rimuovere con attenzione il portavetrini dal serbatoio dell'elettroforesi e lasciarlo scaricare su carta velina per 30 s.
- Inserire il portascorrimento nel piatto contenente il tampone di neutralizzazione (Tabella 1). Lasciare agire per 20 min.
- Rimuovere il portascorrimento dal piatto di neutralizzazione, posizionarlo nel piatto di lavaggio contenenteddH 2O ghiacciato e lasciarlo per 20 minuti.
- Rimuovere il portavetrini dall'acqua e lasciare asciugare i vetrini in un'incubatrice a 37 °C per 1 ora, o a temperatura ambiente durante la notte, o non asciugare, a seconda del programma dell'operatore19.
NOTA: se non vi è asciugatura nel punto 4.11, eseguire la fase di colorazione da 5.2.
5. Colorazione con ioduro di propidio (PI)
- Trasferire il portavetrini in una pirofila contenente ddH2O ghiacciato per reidratare i vetrini e lasciare agire per 30 minuti.
- Inserire il portavetrino in una capsula colorante contenente 2,5 μg/mL di soluzione di ioduro di propidio.
NOTA: lo ioduro di propidio è sensibile alla luce, quindi maneggialo in un'area oscurata. È anche tossico. - Chiudere il coperchio del piatto colorante e incubarlo per 20 minuti al buio a temperatura ambiente.
- Trasferire il portascorrimento in un piatto separato e lavarlo con ddH2O ghiacciato per 20 minuti.
- Rimuovere il portascorrimento dalla parabola e asciugarlo completamente al buio, in un'incubatrice a 37 °C o a temperatura ambiente, a seconda del programma o delle preferenze dell'operatore.
- Una volta che i vetrini sono completamente asciutti, rimuoverli dal portavetri e conservarli in una scatola di diapositive al buio fino al momento dell'analisi delle immagini.
NOTA: Le diapositive rimarranno leggibili indefinitamente e potranno essere ricolorate se necessario.
6. Saggio di cometa alcalina modificata dall'enzima
NOTA: Il saggio della cometa alcalina modificata dall'enzima impiega una fase di trattamento enzimatico dopo la lisi ma prima dell'elettroforesi. L'attività dell'enzima provoca rotture nel DNA nei siti che sono substrati per l'enzima. Prima di eseguire questo test, è necessario ottimizzare la concentrazione enzimatica e la durata dell'incubazione enzimatica.
- Dopo la lisi cellulare (fase 3), lavare due volte i vetrini con ddH2O ghiacciato per 20 minuti ciascuno.
- Rimuovere il portascivolo dall'acqua e trasferire i vetrini su un vassoio rivestito con carta assorbente.
- Aggiungere 80 μL dell'enzima alla concentrazione ottimizzata (ad esempio, 3,2 U/mL di hOGG1 per le cellule BE-M17, diluito in tampone di reazione enzimatico) e coprire con un vetrino di copertura per distribuire l'enzima sul campione contenente gel.
- Incubare i vetrini a 37 °C per la durata ottimizzata (ad esempio, 45 minuti per hOGG1).
- Dopo l'incubazione, rimuovere delicatamente i coperchi e trasferire i vetrini sul supporto.
NOTA: Non lavare i vetrini dopo il trattamento enzimatico; Eseguire direttamente l'elettroforesi dal punto 4.3.
7. Saggio di cometa alcalina modificata con reticoli di DNA (ICL)
NOTA: Il concetto di questa variante dell'ICL-ACA è che la presenza di ICL nel DNA ritarderà la migrazione elettroforetica del DNA danneggiato, indotta in seguito all'esposizione a un insulto generato ossidativamente. In questo caso, più corta è la coda della cometa, maggiore è il numero di ICL25,26,27,28.
- Trattare le cellule con un reagente che induce ICL (ad esempio, cisplatino; vedere Fascicolo supplementare).
- Esporre le cellule trattate con uno dei seguenti agenti per indurre rotture di filamento sufficienti a creare una coda di cometa di dimensioni adeguate (~ 20% DNA della coda): perossido di idrogeno (50 μM H 2 O 2 per 30 minuti), radiazioni ionizzanti (2-5 Gy) o ultravioletti B (UVB) (0,5 J / cm2).
- Inoltre, produrre un controllo positivo della rottura del filamento trattando un lotto di cellule con lo stesso agente e dose, come usato nella fase 7.2 (cioè, nessun trattamento con agente induttore ICL).
- Centrifugare le cellule a 7.607 x g per 5 minuti, scartare il surnatante, lavare il pellet cellulare tre volte con 1 mL di PBS e processare come per il saggio della cometa alcalina (fasi 3-5).
- Calcola i livelli di cross-linking tra filamenti di DNA usando la formula seguente.
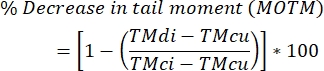
NOTA: MOTM (Mean Olive Tail Moment) è un punto finale del saggio cometario ampiamente utilizzato quando si descrive il saggio della cometa modificata ICL, ed è definito come il prodotto della lunghezza della coda e della frazione di DNA totale nella coda (cioè momento della coda = lunghezza della coda x % del DNA nella coda)29; TMdi: momento di coda dei campioni trattati sia con agente reticolante che con H 2 O2(o altro induttore del frantumatore); TMcu: momento di coda di campioni non trattati con un agente reticolante e non trattati con H 2 O 2 (nessun trattamento) e TMci: momento di coda di campioni non trattati con un agente reticolante ma trattati con H 2 O2.
8. Punteggio delle comete e analisi dei dati
NOTA: Il termine "cometa" deriva dalle immagini delle cellule danneggiate se visualizzate al microscopio dopo che il saggio è stato eseguito (Figura 5). In condizioni di elettroforesi, il DNA nelle cellule non danneggiate in gran parte non migra, ma rimane in uno sferoide definito come "testa" della cometa. Tuttavia, la presenza di rotture di filamento consente al DNA della cellula di migrare fuori dalla testa e formare una "coda", portando così ad un aspetto simile a una cometa (Figura 5). Più DNA nella coda, più danni sono presenti.
- Accendere il microscopio a fluorescenza con il filtro PI (rosso) (λ = 536/617 nm) e il software di valutazione del saggio cometario.
- Aggiungere una goccia d'acqua usando una pipetta Pasteur al gel e coprire con un vetrino.
- Posiziona i vetrini nel microscopio a fluorescenza e "segna" le comete.
NOTA: Il punteggio è un mezzo con cui vengono valutate le comete, per determinare la quantità di danni presenti in ogni cometa. In generale, questo può essere ottenuto utilizzando due approcci, a seconda delle preferenze scelte dall'utente, o ad occhio (misurando la dimensione delle comete su una scala da zero a quattro) o utilizzando software liberamente o disponibile in commercio30. Generalmente, entrambi gli approcci valutano le dimensioni della coda della cometa, sebbene sia possibile determinare una varietà di endpoint relativi alla cometa. Se si utilizza il software, fare clic sul centro della testa della cometa e attendere che il software rilevi automaticamente la cometa, quindi valuta il punto finale scelto (Figura 5). - Punteggio 50 comete per gel e 100 comete per campione (cioè, ogni campione corrisponde a diversi trattamenti dannosi per il DNA o alle loro repliche).
- Replicare gli esperimenti (n = 2) o triplicare gli esperimenti (n = 3).
NOTA: Se vengono intrapresi solo n=2 esperimenti replicati, l'analisi statistica non può essere eseguita, ma se n=3, eseguire il test di normalità D'agostino. La maggior parte dei dati del saggio delle comete non supera un test di normalità. In questo caso, utilizzare un test non parametrico (test di Kruskal-Wallis con test di confronto multiplo di Dunn e significatività dei test di Mann-Whitney impostata a p < 0,05).
Risultati
Ottimizzazione della tensione di elettroforesi per l'HTP ACA
Cheratinociti umani (HaCaTs; Tabella dei materiali) sono stati irradiati con diverse dosi di radiazione ultravioletta A (UVA) (5 o 10 J/cm2; Figura 6A), UVB (0,5 o 1 J/cm2; Figura 6B), o trattati con 50 μM H 2 O2(Figura 6C) per indurre danni. Sono state testate tre diverse tensioni dell'elettroforesi per determinare la tensione ottimale per l'elettroforesi. I risultati di tutti e tre i trattamenti dannosi per il DNA hanno rivelato che, mentre tutte le tensioni hanno generato risposte lineari alla dose, la risposta più sensibile è stata ottenuta con 1,19 V / cm. Gli HaCaTs hanno mostrato il più alto danno al DNA basale utilizzando 1,19 V / cm durante l'elettroforesi rispetto a 1 V / cm e 1,09 V / cm (Figura 6A-C). Inoltre, utilizzando 1,19 V/cm, si osserva la maggiore percentuale di DNA della coda, a seguito di tutti i trattamenti dannosi (Figura 6)31.
Rilevazione di danni al DNA nel sangue intero umano utilizzando Fpg modificato HTP ACA
Il sangue umano (Table of Materials) è stato irradiato con diverse dosi di 10 J/cm2 UVA per indurre danni. Quattro diverse concentrazioni di Fpg (1, 2, 4 o 8 U / mL) sono state utilizzate per determinare la concentrazione ottimale per il trattamento enzimatico in HTP ACA. I risultati hanno mostrato che i livelli ottimali di danno al DNA sono stati rivelati con 4 U / mL Fpg (Figura 7A). Immagini rappresentative di comete da campioni di sangue irradiati UVA (Figura 7B).
Rilevazione del DNA ICL in una linea cellulare rappresentativa del cancro ovarico utilizzando l'ACA HTP modificato ICL
Una linea cellulare di cancro ovarico (SKOV-3; Tabella dei materiali) è stato trattato con combinazioni di 200 μM di cisplatino e/o successivo trattamento con 50 μM H 2 O2per 30 minuti su ghiaccio. Nessun danno apprezzabile è stato notato nelle celle non esposte (Figura 8A). L'esposizione a H2O2 da sola ha generato un MOTM significativo (Figura 8B). Al contrario, le cellule in cui ICL è stata indotta hanno mostrato una diminuzione del MOTM (Figura 8C)28.
Formazione e riparazione del DNA ICL indotto da cisplatino in una linea cellulare rappresentativa di cancro ovarico
L'ACA HTP modificato da ICL è stato utilizzato per determinare il decorso temporale per la formazione e la riparazione del DNA ICL indotta dal cisplatino in una linea cellulare di cancro ovarico (A2780; Tabella dei materiali). Le cellule sono state trattate con 100 μM di cisplatino per 1 ora e quindi incubate in terreni privi di cisplatino (terreno RPMI 1640 integrato con siero bovino fetale (FBS) al 10% (v/v)) per un successivo ciclo di tempo. In vari momenti, l'ACA HTP modificato da ICL è stato eseguito per stabilire i livelli di ICL (Figura 9) 28. Nessuna ICL è stata rilevata prima del trattamento con cisplatino. Tuttavia, dopo un singolo trattamento con 100 μM di cisplatino, i livelli di ICL sono aumentati in modo significativo, raggiungendo il picco a 12 ore, dopo di che i livelli sono diminuiti a zero dopo 30 ore.
Correlazione tra DNA ICL e livelli di DNA platino
Tre cellule tumorali ovariche sono state trattate con cisplatino 100 μM per indurre diversi livelli di DNA-ICL, prima dell'analisi mediante ACA HTP modificato da ICL e spettrometria di massa accoppiata induttivamente (ICP-MS; vedere il file supplementare per i dettagli). Come mostrato nella Figura 10, diversi livelli di DNA-ICL sono stati indotti nelle tre linee cellulari, insieme a diversi livelli di Pt nel DNA. È stata osservata una correlazione positiva (R2 = 0,9235) tra i livelli di DNA ICL e le concentrazioni di platino, indicando l'associazione tra i livelli di DNA platino e la corrispondente ICL28.
Riparazione dell'escissione di base nelle cellule BE-M17 infettate da micoplasma e non infette
Le cellule BE-M17 infettate da micoplasma e non infette sono state trattate con 50 μM H 2 O 2 per 30 minuti e incubate con terreno completo (terreno di Eagle modificato di Dulbecco integrato con FBS al 10% (v / v) ) per durate diverse (0 min, 30 min, 1 h,2h, 6 h, 24 h o 30 h) durante le quali le cellule sono state autorizzate a ripararsi. In ogni punto temporale, le cellule sono state raccolte e congelate a -80 ° C, in un mezzo contenente DMSO al 10%, prima di eseguire l'ACA HTP modificato da hOGG1 (fase 6). Dopo 30 minuti, i livelli di SB/ALS erano diminuiti al 21% di TD (percentuale di DNA della coda) nelle cellule non infette, mentre le cellule infette mostravano il 49% di TD (Figura 11A). Dopo ~ 15 ore, i livelli di SB / ALS erano tornati al basale sia nelle cellule infette che in quelle non infette. Per le purine ossidate, il BE-M17 non infetto ha inizialmente mostrato un piccolo aumento del danno, prima di tornare al basale entro 30 ore (Figura 11B). Al contrario, le cellule infette hanno mostrato un aumento sostenuto e significativo delle purine ossidate, che sono rimaste elevate e non sono tornate ai livelli basali anche dopo 30 ore (Figura 11B)23.
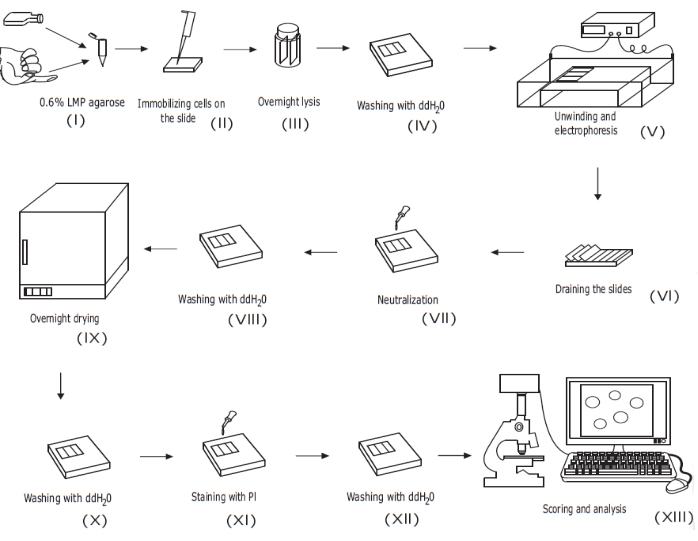
Figura 1: Panoramica della procedura convenzionale di analisi delle comete alcaline. (i) Una sospensione unicellulare di cellule in coltura o un campione di sangue intero viene miscelata con agarosio LMP allo 0,6% (p/v). ii) La miscela cellula/agarosio viene applicata su vetrini da microscopio prepatinati e coperta con vetrino di copertura fino a solidificazione. (iii) Le cellule vengono lisate utilizzando un tampone di lisi ad alto pH durante la notte, formando corpi nucleoidi, prima (iv) lavaggio con ddH2O. (v) Il DNA cellulare si svolge nel tampone di elettroforesi ad alto pH. La presenza di rotture del filamento consente al DNA di rilassarsi e distendersi, e sotto elettroforesi, il DNA viene estratto dal corpo nucleoide, formando una coda. I vetrini vengono quindi (vi) drenati, asciugati, (vii) neutralizzati e (viii) lavati con ddH2O prima che (ix) vengano asciugati durante la notte. I vetrini vengono quindi (x) reidratati con ddH2O, (xi) colorati, (xii) lavati e infine (xiii) valutati e analizzati, in genere utilizzando microscopia fluorescente e software di analisi delle immagini. Questa cifra è riprodotta da una precedente pubblicazione20. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: I materiali che compongono il sistema di elettroforesi di comete ad alto rendimento. Vengono mostrati il serbatoio di elettroforesi HTP, i rack HTP e le stoviglie per la lisi, il lavaggio, la neutralizzazione e la colorazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
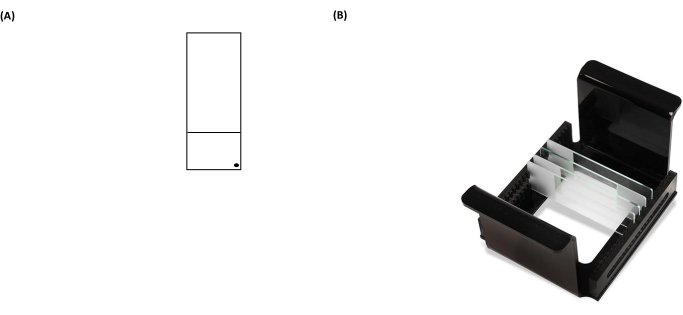
Figura 3: Immagini rappresentative di un vetrino per analisi cometaria e di un rack HTP (portavetrini per microscopio). (A) Per un corretto orientamento, la faccia pre-rivestita del vetrino del microscopio è riconosciuta da un punto nero nell'angolo destro di un vetrino da microscopio. (B) L'immagine del rack HTP illustra come le diapositive sono mantenute in uno stretto orientamento verticale, con linguette sul supporto per fissare il suo orientamento all'interno del serbatoio di elettroforesi. Ogni supporto può ospitare fino a 25 scivoli. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Rappresentazione della piastra di raffreddamento con vetrini campione e confezioni congelatrici in posizione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Screenshot di comete rappresentative scattate durante il punteggio. HaCaTs (A) senza trattamento e (B) trattati con 1 J/cm2 UVB prima di eseguire HTP ACA. La maggior parte dei pacchetti software può calcolare una varietà di endpoint cometari, ma i più comuni sono il DNA % della coda (preferito) o il momento della coda basato su queste immagini (blu: inizio della testa, verde: centro della testa e viola: fine della coda). La barra della scala è di 10 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
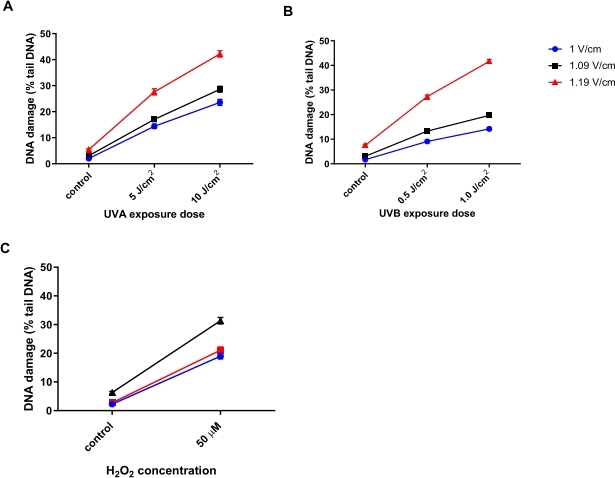
Figura 6: Grafici rappresentativi che illustrano l'effetto della tensione di elettroforesi sul DNA percentuale della coda, determinato utilizzando l'HTP ACA. Le cellule sono state esposte a (A) 5 o 10 J / cm 2 UVA, (B) 0,5 o 1,0 J / cm 2 UVB, o (C) 50 μM H 2 O 2 prima dell'HTP ACA, con la tensione di elettroforesi a 1, 1,09 o 1,19 V / cm. I dati rappresentano la media di 200 determinazioni da n = 2 esperimenti duplicati31. Fare clic qui per visualizzare una versione ingrandita di questa figura.
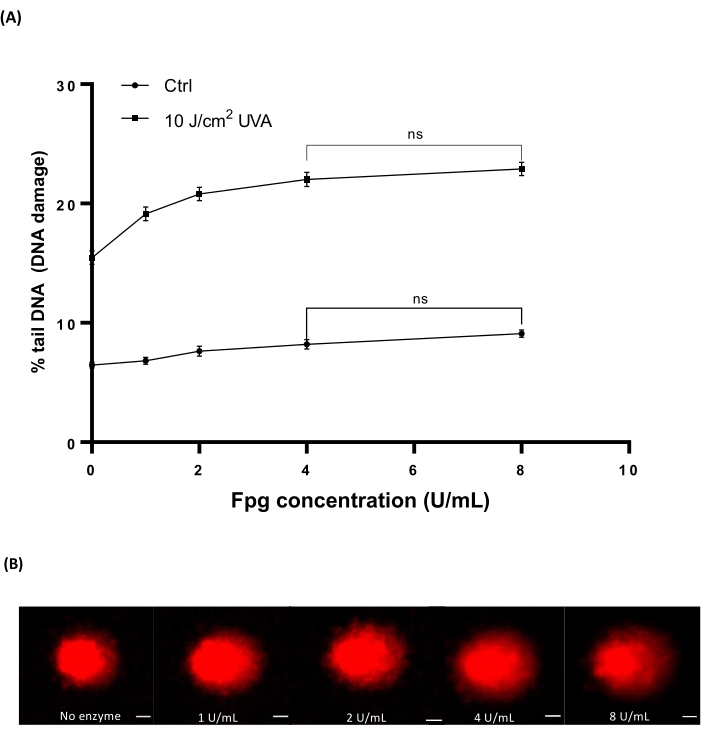
Figura 7: Grafico rappresentativo e immagini cometarie del sangue umano analizzate dall'HTP modificato Fpg ACA. I campioni di sangue umano sono stati irradiati con 10 J/cm2 UVA o sham irradiati («ctrl») su ghiaccio prima della fase di lisi. Diverse concentrazioni di Fpg (1, 2, 4 o 8 U / ml) sono state utilizzate per il trattamento enzimatico prima dell'elettroforesi. (A) I dati rappresentano la media ± SEM di 300 determinazioni da n = 3 esperimenti. (B) Immagini rappresentative delle comete per ogni concentrazione di Fpg in 10 J/cm2 campioni di sangue irradiato con raggi UVA. La barra della scala è di 10 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
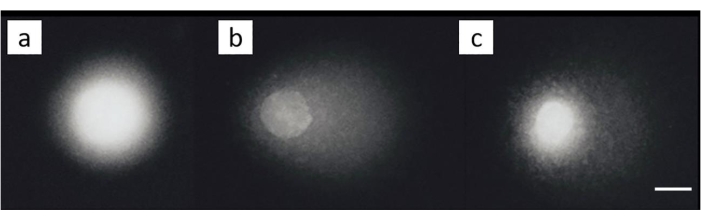
Figura 8: Immagini rappresentative delle comete che illustrano la rilevazione di ICL dopo il trattamento con cisplatino. (A) cellule di controllo senza alcun trattamento, (B) cellule trattate solo con H 2 O 2 (50 μM), (C) cellule trattate con H 2 O 2(50 μM) e cisplatino (200 μM), che illustrano che la coda è più corta che in (B), a causa della presenza di ICL 28. La barra della scala è di 10 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
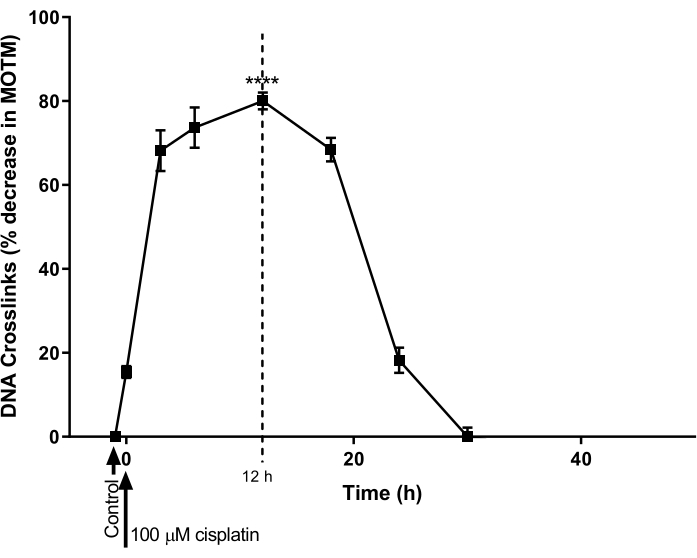
Figura 9: Dimostrazione della cinetica della formazione e riparazione di ICL indotta dal cisplatino. Le cellule A2780 sono state trattate con 100 μM di cisplatino nel terreno di coltura per 1 ora. Il mezzo contenente cisplatino è stato quindi rimosso e le cellule sono state coltivate per vari punti temporali, prima dell'analisi da parte dell'ACA HTP modificato da ICL. I dati rappresentano la media ± SEM da n = 3 esperimenti28. P < 0,0001. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 10: Correlazione tra DNA ICL e concentrazione di platino. DNA ICL sono stati determinati dall'ACA HTP modificato da ICL e i livelli di platino sono stati misurati da ICP-MS (con Single Quad-Kinetic Energy Discrimination, SQ-KED), in tre linee cellulari di cancro ovarico. R2 = 0,9235. Vedere Supplementary File per la metodologia ICP-MS per quantificare i livelli di platino nel DNA28. Fare clic qui per visualizzare una versione ingrandita di questa figura.
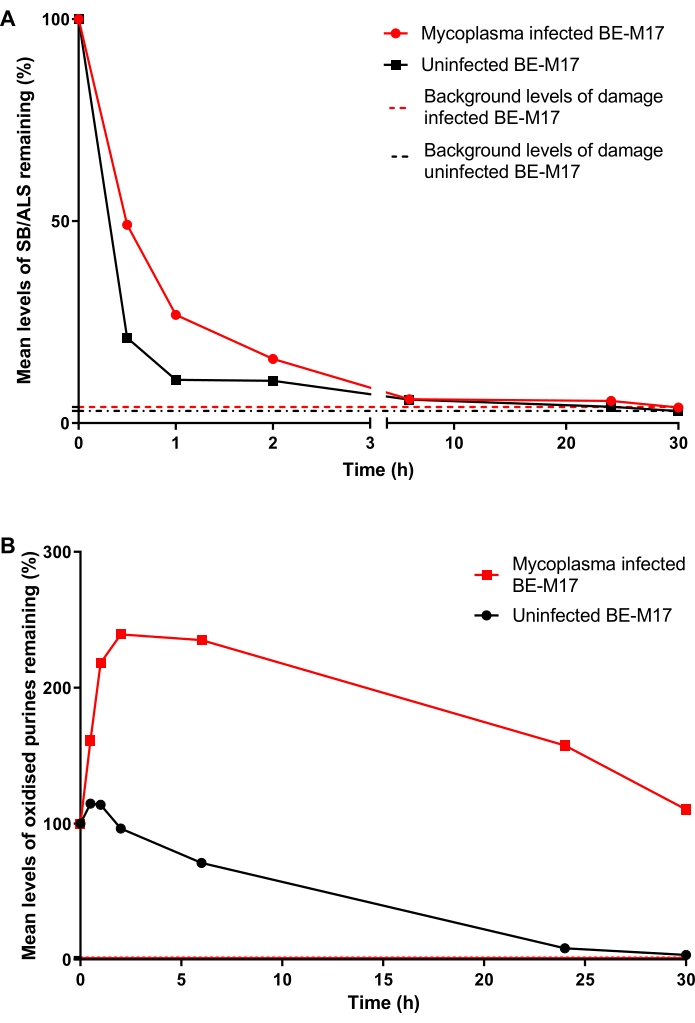
Figura 11: Un grafico rappresentativo che illustra il danno e la riparazione del DNA, determinato dal saggio della cometa modificata da hOGG1, nelle cellule BE-M17 infettate da Mycoplasma rispetto a quelle non infette. Dopo il trattamento con 50 μM H 2O 2 per 30 minuti, le cellule sono state autorizzate a riparare per durate diverse (0, 30 min, 1 h,2 h, 6 h, 24 h o 30 h). L'HTP ACA modificato da hOGG1 è stato utilizzato per misurare (A) SB / ALS e (B) purine ossidate in cellule BE-M17 infette (punti dati rossi) e non infette (punti dati neri). I dati rappresentano la media di 200 determinazioni da n = 2 esperimenti duplicati. Questa cifra è riprodotta con il permesso di una precedente pubblicazione23. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Reagente | Soluzione Stock | Soluzione di lavoro | |
| Tampone di lisi | 100 mM Na 2 EDTA, 2,5 m NaCl e 10 mM Tris base in ddH2O; regolare il pH a 10 con 10 M NaOH | Triton X-100 all'1% in soluzione madre di lisi | |
| Tampone per elettroforesi | 10 M NaOH e 200 mM Na 2 EDTA in ddH2O | 300 mM NaOH e 1 mM Na2EDTA; pH > 13 | |
| Buffer di neutralizzazione | 0,4 m Tris Base in ddH2O; regolare il pH a 7,5 con HCl | ||
| Tampone di colorazione | 1 mg/mL di ioduro di propidio | 2,5 μg/mL di ioduro di propidio in ddH2O | |
Tabella 1: Composizione dei reagenti utilizzati in HTP ACA. Vengono mostrate le concentrazioni di stock e di lavoro di lisi, elettroforesi, neutralizzazione e tamponi di colorazione.
File supplementare. Clicca qui per scaricare questo file.
Discussione
Questo studio dimostra la versatilità fornita dall'attuale apparecchiatura, che può essere utilizzata per ottenere un elevato rendimento con una varietà di varianti rappresentative e comuni del saggio della cometa (cioè alcaline, enzima-modificate, sangue e ICL e altre varianti saranno anche adatte). Inoltre, l'approccio attuale porta con sé diversi vantaggi 20,21: (a) il tempo di esecuzione del saggio è ridotto a causa della manipolazione di più vetrini in parallelo (il tempo di manipolazione diminuisce del60%); b) il rischio di danni ai gel, e quindi il rischio per l'esperimento sono diminuiti; c) il fabbisogno di reagenti è diminuito (ad esempio, il volume del serbatoio di elettroforesi è inferiore a quello del serbatoio convenzionale); d) il numero di diapositive eseguite è aumentato. Un serbatoio può fornire un aumento del 20% del numero di slitte eseguite rispetto a un singolo serbatoio convenzionale; Tuttavia, più serbatoi di elettroforesi possono essere azionati o slavizzati (cioè più serbatoi controllati da un singolo alimentatore), in parallelo dallo stesso alimentatore, e richiedono comunque un ingombro da banco inferiore a un singolo serbatoio convenzionale con vassoio per il ghiaccio; e (e) l'ingombro del serbatoio è ridotto grazie all'orientamento verticale delle guide e al raffreddamento integrato (consente di risparmiare spazio in laboratorio); il serbatoio HTP comprende una base di raffreddamento in ceramica ad alte prestazioni con un cassetto scorrevole che può contenere un pacco di raffreddamento congelato per mantenere la temperatura ottimale del buffer senza dover eseguire il processo in una cella frigorifera.
Inoltre, la piastra di raffreddamento da noi sviluppata ospita 26 vetrini di comete, consente una rapida solidificazione dell'agarosio a basso punto di fusione sui vetrini di analisi della cometa e facilita un facile recupero dei vetrini dopo che il gel di agarosio è solidificato. Le innovazioni di cui sopra rendono il processo di analisi della cometa più semplice e più facile.
Sebbene siano stati sviluppati altri approcci ad alta produttività (ad esempio, test cometa a 12 gel, CometChip o 96 formati mini-gel)25, molti scienziati preferiscono utilizzare i vetrini convenzionali per microscopio (che includono i vetrini pre-rivestiti disponibili in commercio o altri vetrini specializzati). L'approccio attuale può ospitare tutti i tipi di vetrini da microscopio, consentendo agli esperimenti che utilizzano questi vetrini di essere scalati attraverso un'elaborazione e una gestione più veloci dei vetrini. Come notato sopra, il sistema di comete HTP porta molti vantaggi, ma c'è una limitazione notevole: l'approccio attuale fornisce solo un aumento del 20% del numero di campioni eseguiti, rispetto a un serbatoio orizzontale convenzionale (sebbene l'elaborazione dei vetrini sia molto più veloce). I formati CometChip e 96 mini-gel eseguono un numero maggiore di campioni. Ad oggi, non sappiamo se l'approccio attuale possa ospitare i formati CometChip o 96 mini-gel, anche se prevediamo che lo farà. Come notato sopra, il numero di campioni può essere ulteriormente aumentato schiavizzando i serbatoi a un singolo alimentatore. Come con tutti gli approcci, c'è ancora la possibilità di perdere o danneggiare i gel durante il caricamento dei campioni e l'analisi al microscopio, ma questo è più dovuto all'errore dell'operatore, e le possibilità di questo sono ridotte al minimo con l'approccio attuale.
L'uso del sistema cometario HTP può aiutare notevolmente ad analizzare il danno al DNA, facilitando l'uso del saggio cometario in una vasta gamma di applicazioni, come l'epidemiologia molecolare, la scienza riproduttiva maschile, gli studi di genotossicologia e la tossicologia ambientale. Ciò è particolarmente vero per quegli utenti che desiderano avere tutti i vantaggi di una migliore produttività e facilità d'uso, senza allontanarsi dai familiari, economici e convenzionali vetrini per microscopi.
Divulgazioni
Il Dr. Cooke e il Dr. Karbaschi sono inventori di tre brevetti concessi relativi alle tecnologie qui descritte.
Riconoscimenti
Il lavoro riportato in questa pubblicazione è stato, in parte, sostenuto dal National Institute of Environmental Health Sciences del National Institutes of Health con il numero di premio: 1R41ES030274. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente il punto di vista ufficiale del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| 22 x 22 mm glass coverslips | Fisher Scientific, Hampton, NH, USA | 631-0124 | |
| A2780 | ECACC, Louis, MO, USA | 93112519 | |
| Concentrated nitric acid (OptimaTM grade) | Fisher Scientific Fair Lawn, NJ, USA | A467-250 | |
| Fluorescence microscope equipped with a camera | Zeiss, Jena, Germany | ||
| Fresh human whole blood | Zen Bio Inc | SER-WB10ML | Commercial human whole blood sample |
| GraphPad Prism | GraphPad Software, San Diego, California | Data analysis software | |
| HTP Comet Assay system | Cleaver Scientific | COMPAC- 50 | |
| Human Keratinocyte (HaCaTs) | American Type Culture Collection (ATCC), Manassas, VA, USA | Discontinued | Can be purchased from another company ADDEXBIO TECHNOLOGIES Cat# T0020001 |
| Hydrogen peroxide (H2O2) 30% in water | Fisher Scientific, Hampton, NH, USA | BP2633-500 | |
| ICP-MS iCAP RQ ICP-MS system | Thermo Scientific, Waltham, MA, USA | IQLAAGGAAQFAQKMBIT | |
| Image and Data Analysis software | Perceptive Instrument, Bury St Edmunds, England, UK | 125525 | Free image analysis softwared is available e.g., ImageJ |
| Internal Standard Mix | SPEX Certiprep, Metuchen, NJ, USA | CL-ISM1-500 | Bismuch (isotope monitored 209 Bi)-concnetration of 10 µg/mL in 5% HNO3 |
| Low melting point Agarose | Invitrogen Waltham, MA, USA | P4864 | |
| Na2EDTA (disodium ethylenediaminetetraacetic acid) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| NaCl (Sodium chloride) | Sigma Aldrich, St. Louis, MO, USA | S7653 | |
| NanoDrop One | Thermo Scientific, Waltham, MA, USA | 701-058108 | Nanodrop for measuring DNA concentration |
| Nanopure Infinity Ultrapure Water System (Barnstead Nanopure) | Thermo Scientific, Waltham, MA, USA | D11901 | Ultrapure water (16 MΩ cm-1) |
| NaOH (sodium Hydroxide) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| Normal melting point Agarose | Fisher Scientific, Hampton, NH, USA | 16520100 | For pre-coating slides |
| OCI-P5X | University of Miami, Miami, FL, USA | N/A | Live Tumor Culture Core facility provided the cells |
| Platinum (Pt) reference standard | SPEX Certiprep, Metuchen, NJ, USA | PLPT3-2Y | (1000 µg/mL in 10% HCl) containing Bismuch |
| Propidium Iodide (1.0 mg/mL in water) | Sigma Aldrich, St. Louis, MO, USA | 12-541BP486410ML | |
| QIAamp DNA Mini Kit | Qiagen Valencia, CA, USA | 51304 | DNA extraction Kit |
| Single-frosted glass microscope slides | Fisher Scientific, Hampton, NH, USA | 12-541B | |
| SKOV3 | ECACC, Louis, MO, USA | 91091004 | |
| Slide box | Fisher Scientific, Hampton, NH, USA | 03-448-2 | Light proof, to protect cells from the formation adventitious damage (according to the widely held view) and prevent fading of the fluorescent dye |
| Slide Chilling plate | Cleaver Scientific, Rugby, England, UK | CSL-CHILLPLATE | |
| Treatment dish | Cleaver Scientific, Rugby, England, UK | STAINDISH4X | |
| Tris-base | Sigma Aldrich, St. Louis, MO, USA | 93362 | |
| Triton X-100 | Fisher Scientific, Hampton, NH, USA | BP151-500 | |
| Trypsin EDTA (0.5%) | Invitrogen Gibco, Waltham, MA, USA | 15400054 | |
| Vertical Slide Carrier | Cleaver Scientific, Rugby, England, UK | COMPAC-25 |
Riferimenti
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Evans, M. D., Cooke, M. S. Factors contributing to the outcome of oxidative damage to nucleic acids. Bioessays. 26 (5), 533-542 (2004).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutatation Research. 567 (1), 1-61 (2004).
- Miyamae, Y., et al. Detection of DNA lesions induced by chemical mutagens using the single-cell gel electrophoresis (comet) assay. 2. Relationship between DNA migration and alkaline condition. Mutatation Research. 393 (1-2), 107-113 (1997).
- Angelis, K. J., Dusinská, M., Collins, A. R. Single cell gel electrophoresis: detection of DNA damage at different levels of sensitivity. Electrophoresis. 20 (10), 2133-2138 (1999).
- Duarte, T. L., Cooke, M. S., Jones, G. D. Gene expression profiling reveals new protective roles for vitamin C in human skin cells. Free Radical Biology & Medicine. 46 (1), 78-87 (2009).
- Karbaschi, M., et al. Rescue of cells from apoptosis increases DNA repair in UVB exposed cells: implications for the DNA damage response. Toxicology Research. 4 (3), 725-738 (2015).
- Wu, J. H., Jones, N. J. Assessment of DNA interstrand crosslinks using the modified alkaline comet assay. Methods in Molecular Biology. 817, 165-181 (2012).
- Merk, O., Speit, G. Detection of crosslinks with the comet assay in relationship to genotoxicity and cytotoxicity. Environmental and Molecular Mutagenesis. 33 (2), 167-172 (1999).
- Spanswick, V. J., Hartley, J. M., Hartley, J. A. Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay. Methods in Molecular Biology. 613, 267-282 (2010).
- Saha, D. T., et al. Quantification of DNA repair capacity in whole blood of patients with head and neck cancer and healthy donors by comet assay. Mutation Research. 650 (1), 55-62 (2008).
- Giovannelli, L., Pitozzi, V., Riolo, S., Dolara, P. Measurement of DNA breaks and oxidative damage in polymorphonuclear and mononuclear white blood cells: a novel approach using the comet assay. Mutatation Research. 538 (1-2), 71-80 (2003).
- Al-Salmani, K., et al. Simplified method for the collection, storage, and comet assay analysis of DNA damage in whole blood. Free Radical Biology & Medicine. 51 (3), 719-725 (2011).
- Akor-Dewu, M. B., et al. Leucocytes isolated from simply frozen whole blood can be used in human biomonitoring for DNA damage measurement with the comet assay. Cell Biochemistry and Function. 32 (3), 299-302 (2014).
- Ge, J., et al. CometChip: a high-throughput 96-well platform for measuring DNA damage in microarrayed human cells. Journal of Visualized Experiments: JoVE. (92), e50607 (2014).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochemical and Biophysical Reseach Communications. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research. 175 (1), 184-191 (1988).
- Karbaschi, M., et al. Evaluation of the major steps in the conventional protocol for the alkaline comet assay. International Journal of Molecular Sciences. 20 (23), 6072 (2019).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Scientific Reports. 4 (1), 7200 (2014).
- Karbaschi, M., Cooke, M. S. Chilling apparatus. USA patent. , (2020).
- Cooke, M. S., Karbaschi, M. Method and apparatus for performing electrophoresis. USA patent. , (2019).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutatation Research. 845, 403054 (2019).
- Møller, P., et al. Minimum Information for Reporting on the Comet Assay (MIRCA): recommendations for describing comet assay procedures and results. Nature Protocols. 15 (12), 3817-3826 (2020).
- Almeida, G. M., Duarte, T. L., Steward, W. P., Jones, G. D. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair (Amst). 5 (2), 219-225 (2006).
- Moneef, M. A., et al. Measurements using the alkaline comet assay predict bladder cancer cell radiosensitivity. British Journal of Cancer. 89 (12), 2271-2276 (2003).
- Bowman, K. J., et al. Comet assay measures of DNA damage are predictive of bladder cancer cell treatment sensitivity in vitro and outcome in vivo. International Journal of Cancer. 134 (5), 1102-1111 (2014).
- Abdulwahed, A. M. S. . Investigation of DNA Damage and Genomic Organization in the Cellular Response to Platinum Chemotherapy. , (2020).
- Olive, P. L., Banáth, J. P., Durand, R. E. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay. Radiation Research. 122 (1), 86-94 (1990).
- Kumaravel, T. S., Vilhar, B., Faux, S. P., Jha, A. N. Comet Assay measurements: a perspective. Cell Biology and Toxicology. 25 (1), 53-64 (2009).
- Ji, Y. . Formation and Repair of Environmetally-induced damage to Mitochondrial and Nuclear Genomess. , (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon