È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Dispositivo microfluidico per la separazione di cellule di cancro al seno non metastatiche (MCF-7) e non tumorali (MCF-10A) mediante dielettroforesi AC
In questo articolo
Riepilogo
Le cellule del cancro al seno presentano proprietà dielettriche diverse rispetto alle cellule epiteliali mammarie non tumorali. È stato ipotizzato che, sulla base di questa differenza di proprietà dielettriche, le due popolazioni possano essere separate ai fini dell'immunoterapia. Per supportare questo, modelliamo un dispositivo microfluidico per ordinare le celle MCF-7 e MCF-10A.
Abstract
I dispositivi dielettroforetici sono in grado di rilevare e manipolare le cellule tumorali in modo privo di etichette, economico, robusto e accurato utilizzando il principio della polarizzazione delle cellule tumorali nel volume del campione applicando un campo elettrico esterno. Questo articolo dimostra come una piattaforma microfluidica può essere utilizzata per lo smistamento continuo ad alto rendimento di cellule di cancro al seno non metastatico (MCF-7) e cellule epiteliali mammarie non tumorali (MCF-10A) utilizzando la dielettroforesi idrodinamica (HDEP) dalla miscela cellulare. Generando un campo elettrico tra due elettrodi posti fianco a fianco con uno spazio di dimensioni micron tra loro in un chip microfluidico HDEP, le cellule epiteliali mammarie non tumorali (MCF-10A) possono essere allontanate, esibendo DEP negativo all'interno del canale principale, mentre le cellule di cancro al seno non metastatico seguono il loro decorso inalterate quando sospese nel mezzo cellulare a causa della conduttività superiore alla conduttività della membrana. Per dimostrare questo concetto, sono state eseguite simulazioni per diversi valori di media conduttività ed è stato studiato lo smistamento delle celle. È stato condotto uno studio parametrico ed è risultata una conduttività della miscela cellulare adatta a 0,4 S/m. Mantenendo fissa la conducibilità del mezzo, è stata stabilita un'adeguata frequenza CA di 0,8 MHz, dando la massima efficienza di ordinamento, variando la frequenza del campo elettrico. Utilizzando il metodo dimostrato, dopo aver scelto la conduttività e la frequenza della media di sospensione della miscela cellulare appropriata dell'AC applicata, è possibile ottenere la massima efficienza di selezione.
Introduzione
Un tumore maligno che si sviluppa dentro e intorno al tessuto mammario è una causa frequente di cancro al seno nelle donne di tutto il mondo, causando un problema di salute critico1. I tumori al seno prima delle metastasi possono essere trattati chirurgicamente se rilevati in una fase precoce, ma se ignorati, possono avere gravi implicazioni sulla vita del paziente diffondendosi ai polmoni, al cervello e alle ossa. I trattamenti offerti nelle fasi successive, come le radiazioni e le terapie a base chimica, hanno gravi effetti collaterali2. Studi recenti hanno riportato che una diagnosi precoce di cancro al seno riduce il tasso di mortalità del 60%3. Quindi, è imperativo lavorare verso metodi di diagnosi precoce personalizzati. A tal fine, ricercatori che lavorano in diversi campi della scienza e della tecnologia hanno utilizzato la microfluidica per sviluppare dispositivi per la diagnosi precoce del cancro al seno4. Questi metodi includono microcromatografia ad affinità cellulare, selezionatori di microcellule attivati magneticamente, cattura e separazione delle cellule tumorali basate sulle dimensioni e dielettroforesi su chip (DEP)5,6. Queste tecniche microfluidiche riportate in letteratura consentono una manipolazione cellulare precisa, il monitoraggio in tempo reale e lo smistamento di campioni ben definiti, che fungono da passaggio intermedio in molte applicazioni diagnostiche e terapeutiche5. L'integrazione di questi meccanismi di selezione con la microfluidica offre una manipolazione flessibile e affidabile delle cellule bersaglio 7,8,9,10. Uno dei principali vantaggi di tale integrazione è la capacità di lavorare con campioni di fluido in volumi da nano a microlitri e anche di essere in grado di manipolare le proprietà elettriche del fluido campione. Regolando la conduttività del fluido sospeso all'interno di dispositivi microfluidici, le cellule biologiche possono essere ordinate in base alle loro dimensioni e alle differenze nelle loro proprietà dielettriche11,12.
Tra queste tecniche, il DEP su chip è spesso preferito in quanto è una tecnica di selezione cellulare label-free che sfrutta le proprietà elettriche dei campioni biologici. È stato segnalato che il DEP manipola campioni biologici come DNA 13, RNA 14, proteine 15, batteri 16, cellule del sangue17, cellule tumorali circolanti (CTC) 18 e cellule staminali 19. I dispositivi microfluidici che impiegano DEP per la selezione di campioni biologici sono stati ampiamente riportati nella letteratura20. Sono stati segnalati dispositivi microfluidici DEP (rDEP) basati su serbatoi per la selezione di cellule di lievito vitali e non vitali che proteggono le cellule dagli effetti avversi delle reazioni elettrochimiche21,22. Piacentini et al. hanno riportato un selezionatore di cellule microfluidiche castellate che separava i globuli rossi dalle piastrine con un'efficienza del 97% 23. Sono stati segnalati anche dispositivi DEP su chip con orifizi asimmetrici ed elettrodi incorporati per ordinare celle vitali e non vitali24. Valero e Demierre et al. hanno modificato la selezionatrice di cellule microfluidiche castellate introducendo due array di microelettrodi su entrambi i lati del canale25,26. Ciò ha aiutato a focalizzare le celle al centro del canale. Zeynep et al. hanno presentato un dispositivo microfluidico basato su DEP per separare e concentrare le cellule di cancro al seno MCF7 dai leucociti27. Hanno riportato un'efficienza nell'estrazione di cellule MCF7 dai leucociti tra il 74% e il 98% con una frequenza di 1 MHz e una tensione applicata compresa tra 10-12 Vpp. La tabella supplementare 1 rappresenta un confronto qualitativo e quantitativo tra i dispositivi di selezione microfluidica basati su DEP in base al loro design, alla configurazione degli elettrodi e ai parametri operativi (frequenza e tensione applicate).
Più recentemente, i ricercatori hanno cercato di misurare le differenze nel comportamento dielettrico delle cellule epiteliali del seno (MCF-10A) e delle cellule di cancro al seno non metastatico (MCF-7) all'interno di un chip microfluidico28,29. Jithin et al. hanno anche caratterizzato le risposte dielettriche di diverse linee cellulari tumorali utilizzando una tecnica di sonda coassiale aperta con frequenze comprese tra 200 MHz e 13,6 GHz30. Queste differenze nelle risposte dielettriche delle linee cellulari MCF-7 e MCF-10A possono essere sfruttate per separarle in fase di esecuzione e possono portare allo sviluppo di dispositivi personalizzati di diagnosi precoce.
In questo articolo, simuliamo l'ordinamento controllato delle cellule di carcinoma mammario non metastatico (MCF-7) e delle cellule epiteliali mammarie non tumorali (MCF-10A) utilizzando la dielettroforesi AC. La regione di cambiamento nel campo elettrico influenza lo smistamento all'interno del chip microfluidico. La tecnica proposta è facile da implementare e consente l'integrazione della tecnica di selezione in vari layout di chip microfluidici. Sono state effettuate simulazioni di fluidodinamica computazionale (CFD) per studiare la separazione delle cellule di carcinoma mammario non metastatico e delle cellule epiteliali mammarie non tumorali variando la conduttività del mezzo fluido in cui le cellule sono state sospese. In queste simulazioni, è dimostrato che, mantenendo costante la conducibilità e modificando la frequenza applicata, la separazione delle cellule tumorali e delle cellule sane può essere controllata.
Protocollo
NOTA: Il protocollo qui utilizza COMSOL, un software di simulazione multifisica, per simulare l'ordinamento controllato delle cellule di cancro al seno non metastatiche (MCF-7) e delle cellule epiteliali mammarie non tumorali (MCF-10A) utilizzando la dielettroforesi AC.
1. Progettazione del chip e selezione dei parametri
- Aprire il software multifisico e selezionare Modello vuoto. Fare clic con il pulsante destro del mouse su Definizioni globali e selezionare Parametri. Importare i parametri indicati nella Tabella 1 nelle definizioni globali come file di testo o immettere i valori singolarmente.
- Selezionare Aggiungi componente dalla scheda Home e aggiungere un componente 2D. Fare clic con il pulsante destro del mouse sulla geometria e importare il file del modello facendo doppio clic sul file.
- Scegliete un materiale vuoto e utilizzate le proprietà del materiale della Tabella 1.
- Selezionare Aggiungi fisica dalla scheda Home e digitare AC/DC. Sotto il nodo AC/DC, scegli correnti elettriche come Fisica sotto il sottonodo di campi e correnti elettriche.
- Fare clic con il pulsante destro del mouse su Corrente elettrica e scegliere i sottonodi Conservazione corrente, Isolare e Potenziale elettrico per isolare le pareti del canale per assegnare potenziale agli elettrodi.
- Selezionare Aggiungi fisica dalla scheda Home e, sotto il nodo Flusso fluido , scegliere Fisica flusso strisciante sotto il sottonodo di Flusso monofase. Fare clic con il pulsante destro del mouse su Flusso monofase ed eseguire il rendering dei limiti del chip come muri utilizzando il sottonodo Wall .
- Fare clic con il pulsante destro del mouse su Flusso monofase e aggiungere due sottonodi di ingresso e un sottonodo di uscita.
- Assegnate gli ingressi utilizzando il sottonodo di ingresso e utilizzate normal in Velocità flusso (Flow Velocity ) come condizione al contorno. Assegnare la presa utilizzando il sottonodo di uscita.
- Selezionare Aggiungi fisica dalla scheda Home e, sotto il nodo Flusso fluido , scegliere Fisica del flusso di tracciatura delle particelle sotto il sottonodo di Ricalco delle particelle.
- Fare clic con il pulsante destro del mouse sul nodo Tracciatura particelle e aggiungere la parete dei sottonodi, i sottonodi delle proprietà delle due particelle, due sottonodi di ingresso, un sottonodo di uscita, due sottonodi della forza di dielettroforesi e un sottonodo della forza di trascinamento.
- Impostare le proprietà delle particelle per le celle MCF-7 e MCF-10A utilizzando il sottonodo Proprietà particelle . Scegliere le proprietà delle particelle dai parametri nella sezione Definizione globale .
- Aggiungete il sottonodo Forza trascinamento (Drag Force ) per assegnare la forza dielettroforetica a entrambi i tipi di celle.
- Aggiungete Proprietà particella in questo caso dalla sezione dei parametri. Aggiungere il sottonodo Shell per modellare le cellule dei mammiferi.
- Dalla scheda Home, scegliete Aggiungi trama e selezionate Mesh fine. Scegliete Crea mesh dalla scheda Home per creare una mesh.
- Dalla scheda Home, fai clic su Aggiungi studio per aggiungere tre passaggi di studio. La fase 1 dello studio consiste nella simulazione di una risposta in frequenza; utilizzare un sottonodo Dominio di frequenza .
- Per simulare il flusso strisciante, scegliere un nodo Studio stazionario . Aggiungere due passaggi dipendenti dal tempo per simulare condizioni con forza dielettroforetica e senza forza dielettroforetica.
- Per la condizione senza dielettroforetico, scegliere Selezione fisica e variabili, selezionare la casella Modifica configurazione modello per la fase di studio e disattivare la fase dielettroforetica. Per condizioni dielettroforetiche, non disabilitare. Salvare il file e premere Compute per eseguire la simulazione.
NOTA: Il chip microfluidico progettato per lo smistamento delle cellule di carcinoma mammario non metastatico (MCF-7) e delle cellule epiteliali mammarie non tumorali (MCF-10A) ha due ingressi separati per il flusso della miscela cellulare e per la focalizzazione del flusso idrodinamico, rispettivamente, con larghezze di 20 μm e 40 μm, rispettivamente, come mostrato nella Figura supplementare 1 e nella Figura supplementare 2. - Assegnare la frequenza (f0) sotto il sottonodo Dominio della frequenza e la tensione utilizzando il sottonodo Potenziale elettrico agli elettrodi piallatori (295 μm di larghezza) posti lungo la parete laterale superiore della camera di selezione. All'uscita, utilizzare la condizione della parete "freeze" per visualizzare le particelle ordinate.
2. Modello matematico e analisi computazionale
- Verificare i parametri operativi per separare le cellule di carcinoma mammario non metastatico e le cellule epiteliali mammarie non tumorali all'interno del dispositivo microfluidico impostando uno studio fluidodinamico computazionale (CFD).
NOTA: a tale scopo è stato utilizzato un software multifisico (moduli AC/DC, Microfluidics e Particle Tracking). Le equazioni che governano e il background teorico sono riportati in dettaglio nel file supplementare 1. Il modello è stato testato utilizzando le proprietà dielettriche delle cellule di carcinoma mammario non metastatico (MCF7) e delle cellule epiteliali mammarie non tumorali (MCF-10A) riportate in letteratura31,32, che sono riassunte nella Tabella 1. - Eseguire le simulazioni CFD introducendo linee cellulari di carcinoma mammario non metastatico (MCF7) e epiteliale mammario non tumorale (MCF-10A) con un rapporto di 1:1 all'ingresso della miscela cellulare.
- Inizialmente, eseguire uno studio sull'indipendenza della mesh per ottimizzare la dimensione della mesh per le simulazioni33.
NOTA: è stato eseguito uno studio sull'indipendenza della rete per trovare la soluzione migliore per i parametri operativi. È stato scelto un set di cinque diverse dimensioni di maglia per quantificare la migliore dimensione possibile dell'elemento per la convergenza della soluzione. È stato osservato che, quando il numero totale di elementi che definiscono una maglia era 635 (maglia più grossolana), come mostrato nella figura supplementare 3A, l'efficienza di selezione era al minimo, con alcune delle celle MCF7 che si spostavano verso l'uscita inferiore, come illustrato nella figura supplementare 3B. Quando la dimensione della maglia è stata aumentata a fine, anche il numero di elementi che definiscono la maglia è aumentato a 2.288. L'efficienza di selezione era al massimo in questo caso, con entrambe le celle MCF7 e MCF-10A che si muovevano verso le rispettive uscite. È stata simulata anche la mesh più fine, con il numero di elementi che definiscono la mesh che è aumentato a 3.188. L'efficienza di smistamento è rimasta inalterata oltre questo punto. Quindi, possiamo tranquillamente dire che la dimensione della maglia fine funziona meglio nel nostro caso. - Risolvi due serie di studi CFD.
- Per il primo set, fare clic con il pulsante destro del mouse su Studio 1 e aggiungere il sottonodo Sweep parametrica . Premete il segno + per aggiungere la conducibilità fluida "σm" come variabile sweep. Eseguire uno studio parametrico di sweep per la conducibilità del fluido σm compresa tra 0,01 S/m e 2,5 S/m, mantenendo costante la frequenza applicata, f (Hz), ad un valore di 800 kHz.
- Per il secondo set, condurre uno studio Parametric Sweep variando la frequenza CA applicata da 100 kHz a 100 MHz mantenendo la conduttività del fluido, σ m, fissata a 0,4 S /m per ciascun caso. Questo valore di σm è stato scelto in base ai risultati del primo studio CFD poiché è stata osservata una separazione massima tra MCF-7 e MCF-10A a questo valore.
- La forza della forza di dielettroforesi (DEP), FDEP (-), esercitata su una particella sferica dielettrica in un mezzo conduttivo è data dall'equazione 1T34:
FDEP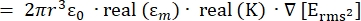 [1]
[1]
Utilizzare l'equazione 1 sotto il sottonodo della forza dielettroforetica. Nell'equazione 1, r mostra il raggio della particella su cui è applicato FDEP; K (-) è noto come fattore di Clausius-Mossotti; εm(-) mostra la permittività dielettrica del mezzo; e E(V/m) è il valore quadratico medio della radice del campo elettrico. - Usa l'equazione 2 per una particella sferica sotto il sottonodo della forza dielettroforetica.
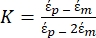 [2]
[2]
Nell'equazione 2,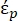 (-) mostra la permittività complessa della particella su cui è applicata la forza DEP;
(-) mostra la permittività complessa della particella su cui è applicata la forza DEP; 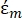 (-) mostra la permittività complessa del fluido che circonda la particella. La permittività
(-) mostra la permittività complessa del fluido che circonda la particella. La permittività 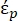 complessa e
complessa e 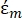 sono definiti come segue35:
sono definiti come segue35: - Usate l'equazione 3 per una particella sferica sotto il sottonodo della forza dielettroforetica:
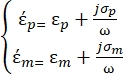 [3]
[3]
Nell'equazione 3, εp (-) mostra la parte reale della permittività complessa della particella; εm (-) mostra la parte reale della permittività complessa del fluido che circonda la particella; σp (S/m) mostra la conducibilità delle particelle; σ m (S/m ) mostra la conducibilità del mezzo che circonda la particella; e ω (Hz) è la frequenza del campo elettrico applicato.
NOTA: Il segno di Re(K) determina la polarità delDEP F. Se il segno di Re(K) è negativo, allora la particella sperimenta una forza dielettroforetica negativa (nDEP); al contrario, se il segno di Re(K) è positivo, implica una forza dielettroforetica positiva (pDEP). Per il fattore di Clausius-Mossotti (K), la variazione rientra nell'intervallo da -1 a 1.
- Inizialmente, eseguire uno studio sull'indipendenza della mesh per ottimizzare la dimensione della mesh per le simulazioni33.
- Utilizzare una forma modificata dell'equazione 3 per modellare cellule biologiche come le cellule di mammifero, che sono più complesse e hanno una struttura multistrato.
K (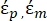 ) =
) = 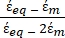 [4]
[4]
Nell'equazione 4, (-) incorpora sia la permittività complessa del citoplasma, (-), sia la permittività complessa della membrana cellulare,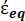
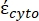
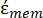 (-), ed è data come segue:36
(-), ed è data come segue:36 - Usa l'equazione 5 per risolvere ""
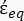 :
: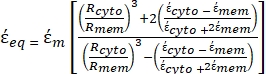 [5]
[5]
Nell'equazione 5, R cyto (m) e Rmem (m) mostrano rispettivamente il raggio del citoplasma cellulare e della membrana cellulare. - Quindi, utilizzare l'equazione 4 per tracciare Re(K) in funzione del campo elettrico applicato sia per il cancro che per le cellule sane. Calcolare la parte reale del fattore di Clausius-Mossotti (CM), Re(K), per quantificare la forza dielettroforetica (DEP) che la particella sperimenta.
- Fare clic con il pulsante destro del mouse sul nodo Risultati, aggiungere il sottonodo Valutazione particelle e nella sezione espressione digitare fpt.deff1.K per tracciare il fattore CM per la particella 1 e fpt.deff2.K per la particella 2.
NOTA: Tutti i passaggi del protocollo elencati nel testo principale possono essere visualizzati nel video del protocollo (Video 1).
Risultati
Studiare i parametri operativi ottimali per un efficace ordinamento basato su DEP delle cellule epiteliali mammarie non metastatiche (MCF-7) e non tumorali (MCF-10A)
Per ottenere una separazione di successo del carcinoma mammario non metastatico (MCF-7) e delle cellule epiteliali mammarie non tumorali (MCF-10A) con proprietà dielettriche divergenti quando sottoposte a dielettroforesi, i loro fattori K dovrebbero essere distinti mantenendo la frequenza applicata fissa37,38...
Discussione
Dispositivi microfluidici sono stati descritti in precedenza per la coltura cellulare, l'intrappolamento e lo smistamento 47,52,53. La fabbricazione di questi dispositivi in camera bianca è un processo costoso ed è imperativo quantificare l'output e l'efficienza di un dispositivo microfluidico proposto attraverso simulazioni CFD. Questo studio presenta la progettazione e le simulazioni di un dispositivo microfluidico AC-dielet...
Divulgazioni
Gli autori non dichiarano potenziali conflitti di interesse.
Riconoscimenti
Questo studio è stato sostenuto dalla Commissione per l'istruzione superiore del Pakistan.
Materiali
| Name | Company | Catalog Number | Comments |
| COMSOL | COMSOL | multiphysics simulation software |
Riferimenti
- Liang, L., et al. Microfluidic-based cancer cell separation using active and passive mechanisms. Microfluidics and Nanofluidics. 24 (4), 26 (2020).
- Damiati, S., Kompella, U. B., Damiati, S. A., Kodzius, R. Microfluidic devices for drug delivery systems and drug screening. Genes. 9 (2), 103 (2018).
- Pashayan, N., et al. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nature Reviews Clinical Oncology. 17 (11), 687-705 (2020).
- Panesar, S., Neethirajan, S. Microfluidics: Rapid diagnosis for breast cancer. Nano-micro Letters. 8 (3), 204-220 (2016).
- Chen, J., Li, J., Sun, Y. Microfluidic approaches for cancer cell detection, characterization and separation. Lab on a Chip. 12 (10), 1753-1767 (2012).
- Beech, J. P., Holm, S. H., Adolfsson, K., Tegenfeldt, J. O. Sorting cells by size, shape and deformability. Lab on a Chip. 12 (6), 1048-1051 (2012).
- Kang, Y., Li, D. Electrokinetic motion of particles and cells in microchannels. Microfluidics and Nanofluidics. 6 (4), 431-460 (2009).
- Schmid, L., Weitz, D. A., Franke, T. Acoustic microfluidic fluorescence-activated cell sorter. Lab on a Chip. 14 (19), 3710-3718 (2014).
- Yu, B. Y., Elbuken, C., Shen, C., Huissoon, J. P., Ren, C. L. An integrated microfluidic device for the sorting of yeast cells using image processing. Scientific Reports. 8, 3550 (2014).
- Asiaei, S., Darvishi, V., Davari, M. H., Zohrevandi, D., Moghadasi, H. Thermophoretic isolation of circulating tumor cells, numerical simulation and design of a microfluidic chip. Journal of Thermal Analysis and Calorimetry. 137 (3), 831-839 (2019).
- Song, Y., Li, M., Pan, X., Wang, Q., Li, D. Size-based cell sorting with a resistive pulse sensor and an electromagnetic pump in a microfluidic chip. Electrophoresis. 36 (3), 398-404 (2014).
- Giraud, G., et al. Dielectrophoretic manipulation of ribosomal RNA. Biomicrofluidics. 5 (2), 024116 (2011).
- Valero, A., Braschler, T., Demierre, N., Renaud, P. A miniaturized continuous dielectrophoretic cell sorter and its applications. Biomicrofluidics. 4 (2), 022807 (2010).
- Allahrabbi, N., Chia, Y. S. M., Saifullah, M. S. M., Lim, K. M., Lanry Yung, L. Y. A hybrid dielectrophoretic system for trapping of microorganisms from water. Biomicrofluidics. 9 (3), 034110 (2015).
- Vykoukal, D. M., Gascoyne, P. R. C., Vykoukal, J. Dielectric characterization of complete mononuclear and polymorphonuclear blood cell subpopulations for label-free discrimination. Integrative Biology: Quantitative Biosciences from Nano to Macro. 1 (7), 477-484 (2009).
- Shim, S., et al. Antibody-independent isolation of circulating tumor cells by continuous-flow dielectrophoresis. Biomicrofluidics. 7 (1), 11807 (2013).
- Jeon, H. J., Lee, H., Yoon, D. S., Kim, B. M. Dielectrophoretic force measurement of red blood cells exposed to oxidative stress using optical tweezers and a microfluidic chip. Biomedical Engineering Letters. 7 (4), 317-323 (2017).
- Song, H., et al. Continuous-flow sorting of stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15 (5), 1320-1328 (2015).
- Tsai, S. L., Chiang, Y., Wang, M. H., Chen, M. K., Jang, L. S. Battery-powered portable instrument system for single-cell trapping, impedance measurements, and modeling analyses. Electrophoresis. 35 (16), 2392-2400 (2014).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 011503 (2018).
- Patel, S., et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis. Biomicrofluidics. 6 (3), 34102 (2012).
- Yildizhan, Y., Erdem, N., Islam, M., Martinez-Duarte, R., Elitas, M. Dielectrophoretic separation of live and dead monocytes using 3D carbon-electrodes. Sensors. 17 (11), 2691-2704 (2017).
- Piacentini, N., Mernier, G., Tornay, R., Renaud, P. Separation of platelets from other blood cells in continuous-flow by dielectrophoresis field-flow-fractionation. Biomicrofluidics. 5 (3), 34122 (2011).
- Zhao, K., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Valero, A., et al. Tracking and synchronization of the yeast cell cycle using dielectrophoretic opacity. Lab on a Chip. 11 (10), 1754-1760 (2011).
- Demierre, N., Braschler, T., Muller, R., Renaud, P. Focusing and continuous separation Of cells in a microfluidic device using lateral dielectrophoresis. International Solid-State Sensors, Actuators and Microsystems Conference. 430 (98), 1777-1780 (2007).
- Arslan, Z. C., Yalçın, Y. D., Külah, H. Label-free enrichment of MCF7 breast cancer cells from leukocytes using continuous flow dielectrophoresis. Electrophoresis. 43 (13-14), 1531-1544 (2022).
- Turcan, I., Olariu, M. A. Dielectrophoretic manipulation of cancer cells and their electrical characterization. ACS Combinatorial Science. 22 (11), 554-578 (2020).
- Park, J., et al. Sequential cell-processing system by integrating hydrodynamic purification and dielectrophoretic trapping for analyses of suspended cancer cells. Micromachines. 11 (1), 47 (2020).
- Hussein, M., et al. Breast cancer cells exhibits specific dielectric signature in vitro using the open-ended coaxial probe technique from 200 MHz to 13.6 GHz. Scientific Reports. 9, 4681 (2019).
- Fornes-Leal, A., Garcia-Pardo, C., Frasson, M., Pons Beltrán, V., Cardona, N. Dielectric characterization of healthy and malignant colon tissues in the 0.5-18 GHz frequency band. Physics in Medicine and Biology. 61 (20), 7334-7346 (2016).
- Çetin, B., Li, D. Dielectrophoresis in microfluidics technology. Electrophoresis. 32 (18), 2410-2427 (2011).
- Khan, S., Khulief, Y. A., Al-Shuhail, A. A. Effects of reservoir size and boundary conditions on pore-pressure buildup and fault reactivation during CO2 injection in deep geological reservoirs. Environmental Earth Sciences. 79, 294 (2020).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cellsand the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), 054109 (2014).
- Lo, Y. J., et al. Measurement of the Clausius-Mossotti factor of generalized dielectrophoresis. Applied Physics Letters. 104, 083701 (2014).
- Lo, Y. J., Lei, U. Measurement of the real part of the Clausius-Mossotti factor of dielectrophoresis for Brownian particles. Electrophoresis. 41 (1), 137-147 (2020).
- Ohta, A. T., et al. Optically controlled cell discrimination and trapping using optoelectronic Tweezers. IEEE Journal of Selected Topics in Quantum Electronics. 13 (2), 235-242 (2007).
- Sun, T., Morgan, H. Single-cell microfluidic Impedance cytometry. Microfluidics and Nanofluidics. 8 (4), 423-443 (2010).
- Weng, P. Y., et al. Size-dependent dielectrophoretic cross-over frequency of spherical particles. Biomicrofluidics. 10 (1), 1909-1921 (2016).
- Lu, Y. W., Sun, C., Kao, Y. C., Hung, C. L., Juang, J. Y. Dielectrophoretic cross-over frequency of single particles: Quantifying the effect of surface functional groups and electrohydrodynamic flow drag force. Nanomaterials. 10 (7), 1364 (2020).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32 (18), 2523-2529 (2011).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 11503-11525 (2018).
- Gascoyne, P. R. C., Shim, S. Isolation of circulating tumor cells by dielectrophoresis. Cancers. 6 (1), 545-579 (2014).
- Liang, W., et al. Determination of dielectric properties of cells using ac electrokinetic-based microfluidic platform. Micromachines. 11 (5), 513-537 (2020).
- Frusawa, H., et al. Frequency-modulated wave dielectrophoresis of vesicles and cells periodic U-turns at the crossover frequency. Nanoscale Research Letters. 13 (169), 2583-2589 (2018).
- Wei, M. T., Junio, J., Ou-Yang, D. H. Direct measurements of the frequency-dependent dielectrophoresis force. Biomicrofluidics. 3 (1), 12003 (2009).
- Mustafa, A., Pedone, E., Marucci, L., Moschou, D., Lorenzo, M. D. A flow-through microfluidic chip for continuous dielectrophoretic separation of viable and non-viable human T-cells. Electrophoresis. 43 (3), 501-508 (2021).
- Wang, L., et al. Dual frequency dielectrophoresis with interdigitated sidewall electrodes for microfluidic flow-through separation of beads and cells. Electrophoresis. 30 (5), 782-791 (2021).
- Alazzam, A., Mathew, B., Alhammadi, F. Novel microfluidic device for the continuous separation of cancer cells using dielectrophoresis. Journal of Separation Science. 40 (5), 1193-1200 (2017).
- Yang, L., Banada, P. P., Bhunia, A. K., Bashir, R. Effects of dielectrophoresis on growth viability and immuno-reactivity of listeria monocytogenes. Journal of Biological Engineering. 2, 6 (2008).
- Matbaechi, H., Soltani, P., Hölzel, R., Wenger, C. Dielectrophoretic immobilization of yeast cells using CMOS integrated microfluidics. Micromachines. 11 (5), 501-518 (2020).
- Mustafa, A., Pedone, E., La Regina, A., Erten, A. A., Marucci, L. Development of a single layer microfluidic device for dynamic stimulation, culture and imaging of mammalian cells. bioRxiv. , (2022).
- Mustafa, A., et al. Enhanced dissolution of liquid microdroplets in the extensional creeping flow of a hydrodynamic trap. Langmuir. 32 (37), 9460-9467 (2016).
- Chang, H. F., Chou, S. E., Cheng, J. Y. Electric-field-induced neural precursor cell differentiation in microfluidic devices. Journal of Visualized Experiments. (170), e61917 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon