Method Article
Modello sperimentale per valutare la risoluzione della polmonite
In questo articolo
Erratum Notice
Riepilogo
Questo manoscritto descrive la creazione di un modello infettivo di polmonite nei topi e la rispettiva caratterizzazione della risoluzione delle lesioni insieme ai metodi per la crescita dei batteri e l'instillazione intratracheale. Viene inoltre descritto un nuovo approccio che utilizza la citometria a flusso ad alta dimensione per valutare il panorama immunitario.
Abstract
La sindrome da distress respiratorio acuto (ARDS) provoca danno polmonare acuto, caratterizzato da rapido danno alveolare e grave ipossiemia. Questo, a sua volta, porta a un'elevata morbilità e mortalità. Attualmente, non esistono modelli preclinici che ricapitolino la complessità dell'ARDS umana. Tuttavia, i modelli infettivi di polmonite (PNA) possono replicare le principali caratteristiche fisiopatologiche dell'ARDS. Qui, descriviamo un modello di PNA indotto dall'instillazione intratracheale di Streptococcus pneumoniae e Klebsiella pneumoniae vivi in topi C57BL6. Al fine di valutare e caratterizzare il modello, dopo aver indotto la lesione, abbiamo effettuato misurazioni seriali del peso corporeo e del lavaggio broncoalveolare (BAL) per misurare i marcatori di danno polmonare. Inoltre, abbiamo raccolto polmoni per la conta cellulare e i differenziali, la quantificazione delle proteine BAL, il citospin, la conta delle unità formanti colonie batteriche e l'istologia. Infine, è stata eseguita la citometria a flusso ad alta dimensione. Proponiamo questo modello come strumento per comprendere il panorama immunitario durante le fasi di risoluzione precoce e tardiva del danno polmonare.
Introduzione
La sindrome da distress respiratorio acuto (ARDS) rimane una sindrome letale e invalidante comune che colpisce circa il 10% dei pazienti in unità di terapia intensiva (ICU) e fino al 23% degli individui sottoposti a ventilazione meccanica, portando a un tasso di mortalità ospedaliera del 35%-46%1. Inoltre, la recente pandemia di COVID-19 ha nuovamente sottolineato l'importanza di studiare l'ARDS. I casi positivi al COVID-19 hanno rappresentato un aumento della mortalità per ARDS, evidenziando la limitazione delle terapie farmacologiche2.
Nell'uomo, l'ARDS è caratterizzata dalla rapida insorgenza di ipossiemia (PaO2/FiO2 < 300) e dall'evidenza di edema polmonare bilaterale non idrostatico dovuto a eccessiva permeabilità alveolo-capillare e alveolite3. Sebbene l'ARDS sia stata tradizionalmente descritta come un modello di danno polmonare acuto (ALI) secondario a una varietà di insulti, la polmonite batterica e virale (PNA) rimane tra le cause più comuni. Sono stati descritti tre principali stadi fisiopatologici, vale a dire gli stadi essudativo, proliferativo e fibrotico, mentre le due principali caratteristiche cardinali dell'ARDS sono l'infiammazione disregolata e la disgregazione alveolocapillare4. Durante questi processi, il danno alveolare è prodotto dal rilascio di citochine infiammatorie (ad esempio, fattore di necrosi tumorale [TNF-α], interleuchina [IL-1β, IL-6, IL-8, ecc.]), un afflusso di neutrofili e macrofagi infiammatori e l'inondazione di liquidi ricchi di proteine. In definitiva, questi eventi portano a danni alveolari irregolari e bilaterali 5,6,7,8.
Sebbene siano stati compiuti progressi significativi nella comprensione delle lesioni e delle infiammazioni polmonari precoci, i meccanismi alla base della risoluzione della PNA sono meno noti e dovrebbero essere al centro di future indagini meccanicistiche. L'obiettivo principale di questo documento di metodo è fornire ai ricercatori un modello di risoluzione delle lesioni della polmonite infettiva in grado di replicare le principali caratteristiche fisiopatologiche dell'ARDS. Proponiamo che questo modello aiuti a comprendere meglio i meccanismi biologici alla base della risoluzione e della riparazione dell'infiammazione polmonare, fungendo così da piattaforma per terapie di salvataggio.
I principali stadi fisiopatologici che si verificano durante l'ARDS possono essere replicati in modelli animali preclinici di ALI, che dovrebbero includere un'evidenza istologica di risposta infiammatoria, danno tissutale, disfunzione fisiologica, alveolite e alterazione della barriera alveolo-capillare9. Un modello murino che induce PNA e ALI è vantaggioso grazie alla sua elevata riproducibilità, alla rapida riproduzione e alla disponibilità di molteplici strumenti per eseguire studi meccanicistici e molecolari. Non esiste un unico modello che riassuma pienamente tutte le caratteristiche dell'ARDS9 umano.
I modelli di PNA nei topi consentono la replicazione dei principali meccanismi fisiopatologici prodotti dall'ARDS infettiva nell'uomo, come la rapida insorgenza, l'evidenza di danno tissutale in istologia, la compromissione della barriera alveolo-capillare, l'evidenza di risposta infiammatoria e la disfunzione fisiologica, producendo una modesta mortalità10 . I modelli infettivi possono essere indotti dalla somministrazione locale o sistemica del patogeno, con la somministrazione intranasale, intratracheale ed endovenosa che sono le vie di somministrazione più frequenti. La via intratracheale consente l'inoculazione diretta dell'agente infettivo nei polmoni, diminuendo l'aerosolizzazione e ottimizzando la somministrazione11,12.
La metodologia per un modello murino preclinico di PNA mediante instillazione intratracheale di Streptococcus pneumoniae (Spn) o Klebsiella pneumoniae (Kp) vivi è descritta qui. Questi modelli rappresentano un buon surrogato dell'ARDS prodotto dal PNA batterico, possedendo diversi vantaggi, tra cui: cause prevalenti di PNA-ARDS umana (acquisita in comunità e in ospedale); elevata riproducibilità; la mortalità e le lesioni possono essere facilmente titolate (modellando diversi gradi di infiammazione polmonare) per esibire una robusta risposta infiammatoria, che porta ad alveolite e disfunzione alveolocapillare; la valutazione delle fasi precoci e tardive del danno polmonare e la sua risoluzione; e la valutazione di strategie terapeutiche nei diversi stadi della PNA-ARDS.
Protocollo
Tutti i protocolli sugli animali descritti in questo studio sono stati approvati dall'Institutional Animal Care and Use Committee (ACUC) presso la Johns Hopkins University, School of Medicine per il protocollo animale MO21M160. Inoltre, gli esperimenti sono stati eseguiti seguendo le normative istituzionali, statali e federali per la ricerca sugli animali.
ATTENZIONE: La replica di tutti i protocolli descritti di seguito richiede di essere eseguita in un armadio di biosicurezza di livello 2 (BSL-2), seguendo tutte le linee guida istituzionali BSL-2 nell'ambito dell'armadio di biosicurezza.
1. Placcatura di stock batterici da circuiti commerciali
NOTA: Questo protocollo può essere utilizzato per la coltivazione di stock batterici per Spn (ATCC 49619) e Kpn (ATCC 43816), a partire dai culti-loop ottenuti dal fornitore (vedere la Tabella dei materiali per i dettagli).
- Riscaldare una piastra di agar di sangue di pecora al 5% per 15 minuti a 37 °C in un'incubatrice. A questo scopo può essere utilizzato un incubatore cellulare.
- Sotto il cappuccio, rimuovere la guaina dall'ansa di inoculazione batterica e stenderla con cura, strisciando nella piastra di agar, seguendo uno schema a zig-zag. Ripetere questo passaggio utilizzando una piastra separata come duplicato. È possibile striare fino a cinque piastre con lo stesso anello.
- Incubare le piastre per una notte a 37 °C per una crescita ottimale dei batteri. Passaggio dei batteri ogni giorno per 3 giorni. Riscaldare le piastre di agar sanguigno per 15 minuti a 37 °C, prelevare da 15 a 20 colonie dalla prima piastra di agar utilizzando un anello di inoculazione monouso e distribuirle in una nuova piastra di agar preriscaldata. Etichettare la targhetta in modo appropriato.
2. Crescita e conservazione dei batteri per un uso futuro
- Dopo 3 giorni, prelevare fino a 30 colonie dalla piastra di agar sanguigno con un anello a strisce e metterle direttamente in un pallone da 250 ml contenente brodo Todd Hewitt (brodo TH). Incubare a 37 °C, agitando a 250 giri/min, con CO2 al 5% per circa 4 ore.
- Prendere aliquote ogni 15 minuti per misurare l'OD620nm fino a raggiungere 0.3, che equivale a circa 3 x 108 unità formanti colonie (CFU) per mL.
- Aliquotare immediatamente 1 mL del nuovo stock di batteri in fiale criogeniche da 2 mL. Congelare rapidamente le fiale appena aliquotate in azoto liquido per 5 minuti. Conservare aliquote di batteri in un congelatore a -80 °C (le fiale possono essere utilizzate fino a 6-8 mesi prima che perdano potenza).
- Dopo 7 giorni di congelamento, le aliquote possono essere utilizzate per studi sugli animali. Pertanto, determinare la nuova concentrazione dei batteri.
3. Scongelamento dei batteri per l'instillazione intratracheale
- Scaldare una piastra di agar sanguigno per 10 minuti a 37 °C in uno shaker. Estrarre una delle nuove fiale di riserva dal congelatore e scongelarla agitando delicatamente in un bagno d'acqua a 37 °C per circa 2 minuti. Evitare di toccare l'O-ring o il tappo con l'acqua calda.
- Piastra su una piastra di agar sanguigno per contare manualmente le colonie batteriche. Eseguire una diluizione di 1 x 10-6 e impiattare 200 μl dall'ultima diluizione in una piastra di agar sanguigno preriscaldata. Fallo in duplicati.
- Incubare le piastre per una notte a 37 °C per una crescita ottimale dei batteri. Il giorno successivo, applicare la seguente formula per determinare la nuova concentrazione batterica: UFC/mL = (numero di colonie x fattore di diluizione) / volume di pasta piatta
4. Instillazione intratracheale di batteri vivi
NOTA: Questo protocollo è stato ottimizzato per instillare un volume di 50 μL per via intratracheale. Le scorte batteriche possono essere conservate fino a 6-9 mesi. Per garantire la presenza di CFU batteriche in ogni fiala, assicurarsi di impiattarla prima di ogni esperimento, calcolare le CFU di riserva batterica come descritto sopra e utilizzare il brodo TH per le diluizioni successive.
ATTENZIONE: Sotto la cabina di biosicurezza, eseguire una procedura di sopravvivenza dei roditori utilizzando strumenti chirurgici sterili.
- Anestetizzare il topo iniettando per via intraperitoneale 100 mg/kg di ketamina e 2,5 mg/kg di acetilpromazina. Ripetere per il numero di topi iniettati alla volta.
NOTA: I topi possono essere esposti all'isoflurano per facilitare la manipolazione degli animali. Tuttavia, un conduttore esperto in grado di iniettare anestetici intraperitoneali senza causare un significativo disagio all'animale può evitare l'esposizione all'isoflurano. Il numero di topi da iniettare dipende dall'esperienza del chirurgo. - Dopo che tutti i topi sono sotto anestesia appropriata, confermare l'anestesia con un pizzico di coda. Posizionare il topo anestetizzato su una superficie pulita e sterilizzata, appendere l'animale per gli incisivi e fissare delicatamente gli arti anteriori con del nastro adesivo (Figura 1A).
NOTA: Per garantire il benessere degli animali, fornire lubrificazione corneale in tutti gli animali anestetizzati. Il collirio carbossimetilcellulosa può essere utilizzato, applicando una goccia per occhio. - Radere la regione del collo e disinfettare l'area con clorexidina e alcol al 70%. Utilizzando le forbici chirurgiche, praticare un'incisione superficiale del collo sulla linea mediana di 1 cm per visualizzare la trachea (Figura 1B). Una piccola incisione dovrebbe essere sufficiente, ma se si nota un'abbondanza di tessuto adiposo, sezionare attentamente il tessuto adiposo verticalmente per visualizzare la trachea.
NOTA: Utilizzare guanti e strumenti sterili con la tecnica delle sole punte. Il rischio di infezione è minimo se la procedura viene eseguita in condizioni sterili. - Usando una pinza, intuba ogni topo. Tirare delicatamente la lingua verso l'esterno e introdurre un angiocatetere da 20 G attraverso la bocca, facendo avanzare il catetere nella trachea. Applicare una leggera pressione sulla trachea per facilitare l'intubazione.
NOTA: Poiché la trachea è anteriore al corpo del topo, piegare leggermente la punta del catetere, in quanto ciò aiuterà a ottenere l'angolo per intubare correttamente il topo. L'incisione del collo viene eseguita principalmente a scopo di visualizzazione; In alternativa, l'operatore può intubare la trachea alla cieca. - Dopo l'intubazione, collegare il mouse a un respiratore per confermare l'intubazione. I normali parametri del ventilatore utilizzati in questa procedura sono 200 μL di volume sistolico e 200 colpi al minuto. Aumentare e/o diminuire brevemente la velocità del ventilatore per una conferma rapida e semplice.
- Dopo aver confermato l'intubazione, scollegare il topo dal respiratore e instillare con cautela 50 μl di agente batterico attraverso l'angiocatetere utilizzando un puntale di caricamento del gel pipettato da 200 μl. Per i topi di controllo, iniettare 50 μL di brodo TH sterile.
- Dopo aver instillato l'agente batterico, collegare nuovamente il mouse al respiratore per facilitare la ripresa della respirazione. Lasciare il mouse sul respiratore per 30-60 s. Dopo aver iniettato tutti i topi, monitorare la loro respirazione. Se c'è uno schema di respirazione lento, collega nuovamente i topi al respiratore.
- Chiudere l'incisione aggiungendo una piccola goccia di colla sulla pelle. Unire le pieghe della pelle e applicare una leggera pressione fino a quando la colla non si asciuga.
- Posiziona i topi su un termoforo per il recupero e monitorali attentamente fino a quando non riprendono sufficiente coscienza. Trasferisci i topi nella gabbia una volta completamente recuperati. Per la gestione del dolore/angoscia post-operatoria, i topi possono essere trattati con buprenorfina, con una dose di 0,05-0,1 mg/kg per via sottocutanea (SC).
NOTA: Gli animali con perdita di peso superiore al 20% o che sperimentano un disagio significativo dopo la procedura come letargia, incapacità di raggiungere acqua o cibo, respirazione affannosa, risposta ridotta agli stimoli esterni o diminuzione della prontezza mentale devono essere soppressi.
5. Lavaggio broncoalveolare e prelievo polmonare
- Sopprimere il topo mettendolo in un contenitore chiuso contenente il 5% di isoflurano. Continuare l'esposizione all'isoflurano per 1 minuto dopo che il topo ha smesso di respirare. Eseguire la toracotomia per confermare l'eutanasia.
NOTA: Confermare l'eutanasia mediante esame visivo e fisico. Il cuore deve aver smesso di battere e i topi non respirano. Le mucose devono essere bianche o pallide. - Appoggiare il topo in posizione supina su una tavola chirurgica pulita e appenderlo per gli incisivi. Spruzzare la pelle del topo con etanolo al 70%. Usando le forbici chirurgiche, praticare una piccola incisione superficiale del collo sulla linea mediana per visualizzare la trachea del topo.
- Incannulare la trachea con un catetere da 20 G. Aggiungere con cautela 1 mL di soluzione salina tamponata con fosfato (PBS) priva di calcio per via intratracheale, utilizzando una siringa da 1 mL. Lasciare che la polmoni si espanda completamente, quindi aspirare il fluido utilizzando la stessa siringa. Ripetere questo passaggio per un totale di 2 ml.
- Trasferire il BAL in un'aliquota da 2 mL. Eseguire questo passaggio due volte per un volume finale di 2 mL. Non lavare i polmoni con più di 1 ml alla volta, a causa dell'alto rischio di interruzione dello spazio alveolare.
- Apri la cavità toracica ed esponi il polmone, il cuore e la trachea usando forbici e pinze. Sezionare con cura il diaframma e rimuovere la gabbia toracica. Assicurati di non pizzicare il tessuto polmonare.
- Sezionare l'aorta addominale per consentire il dissanguamento. Perfondere il tessuto polmonare praticando una piccola incisione di circa 2 mm nel ventricolo destro utilizzando le forbici e iniettare 5 ml di PBS freddo utilizzando un catetere da 20 G. Il PBS dovrebbe perfondere il polmone. Se viene eseguita un'adeguata perfusione, il tessuto polmonare diventerà bianco pallido e il PBS lascerà il compartimento intravascolare attraverso l'aorta addominale.
- Con attenzione, estrarre i polmoni e sezionarli dalla trachea per eseguire l'istologia o un'ulteriore elaborazione in sospensione di una singola cellula.
- In caso di trattamento per istologia, inserire con cautela un catetere da 20 G per gonfiare i polmoni fino a 25 cm H2O con soluzione di formalina (tampone neutro al 10%). Una volta che i polmoni sono insufflati, passare una corda di sutura 3.0 lunga circa 5 cm sotto la trachea e legarla saldamente due volte per garantire che la formalina rimanga nel tessuto polmonare. Sezionare delicatamente il polmone dal resto dei tessuti e metterlo in una provetta conica da 15 mL contenente 10 mL di soluzione di formalina.
6. Trattamento di lavaggio broncoalveolare
- Centrifugare il BAL a 500 x g a 4 °C per 5 min. Rimuovere il surnatante privo di cellule in una provetta separata e conservare a -80 °C.
NOTA: Ulteriori analisi possono essere eseguite nel surnatante BAL, inclusa la quantificazione delle proteine (ad esempio, il saggio BCA13) o la misurazione di specifici biomarcatori o citochine (saggi ELISA e saggi multipli con piattaforme come MSD e Luminex). - Lisi i globuli rossi aggiungendo 100 μL di tampone lisanti per 1 minuto. Neutralizzare la reazione di lisi aggiungendo 1 mL di PBS. Centrifugare il BAL a 500 x g a 4 °C per 5 minuti e rimuovere il surnatante.
- Risospendere le cellule in PBS (100-300 μL; in base alla dimensione del pellet cellulare). Eseguire una conta cellulare con colorazione blu di tripano allo 0,4% mediante conta cellulare manuale o automatizzata. Utilizzare il pellet rimanente per la colorazione con citometria a flusso e/o la crioconservazione (risospendendolo in soluzione crioconservante) in azoto liquido per ulteriori test.
7. Trattamento polmonare per sospensione di una singola cellula
- Sezionare delicatamente il polmone dal resto dei tessuti e metterlo in una provetta conica da 15 mL contenente 5 mL di PBS freddo. Rimuovere il polmone dal PBS e asciugarlo con un tovagliolo di carta.
- Preparare un cocktail per la digestione aggiungendo 1 mg di DNasi e 5 mg di collagenasi in 1 ml di terreno di Eagle's modificato di Dulbecco a basso contenuto di glucosio (DMEM). Trasferire il polmone in una provetta C contenente 1 ml di cocktail digestivo.
- Trasferire la provetta C al dissociatore tissutale e seguire il protocollo standardizzato per la lavorazione del tessuto polmonare14.
- Aggiungere 10 ml di PBS freddo nella provetta C e mescolare correttamente. Filtrare la sospensione a cella singola utilizzando un filtro cellulare da 70 μm sopra una provetta conica da 50 mL. Eseguire la filtrazione due volte.
- Centrifugare la sospensione a 500 x g a 4 °C per 5 min. Decantare accuratamente il surnatante e aggiungere 1 mL di tampone lisanti per 1 minuto a temperatura ambiente. Aggiungere 10 ml di PBS freddo per fermare la reazione di lisi e rimuovere il surnatante.
- Centrifugare la sospensione a 500 x g a 4 °C per 5 min. Decantare accuratamente il surnatante e aggiungere 10 ml di PBS freddo.
- Eseguire un conteggio delle cellule con colorazione blu di tripano mediante conteggio manuale o automatizzato delle cellule. Utilizzare un pellet cellulare per la colorazione con citometria a flusso e/o crioconservare in azoto liquido per ulteriori test.
Risultati
Le procedure sopra descritte hanno permesso di modellare i meccanismi fisiopatologici alla base del danno polmonare indotto dalla polmonite batterica nei topi. Per iniziare a modellare, i topi C57BL/6 wild-type (WT) sono stati ottenuti dal Jackson Laboratory e allevati presso la struttura per animali dell'istituto. Topi maschi WT C57BL/6, di 8 settimane, sono stati sottoposti a inoculazione intratracheale di brodo TH (controllo), 3 x 106 CFU di Spn vivo o 200 CFU di Kpn vivo. Dopo l'infezione, i topi sono stati monitorati per 6 e 10 giorni rispettivamente per Spn e Kpn. Sebbene i gruppi infetti mostrassero un peso corporeo inferiore rispetto al controllo non infetto, il gruppo Spn ha recuperato il peso corporeo verso il basale, mentre i topi infetti da Kpn hanno mostrato un recupero lento dopo 6 giorni dall'infezione (Figura 2A). Durante la durata dello studio, nessun topo ha richiesto di sottoporsi all'eutanasia a causa del peso corporeo superiore al 20% e non c'erano prove di dolore e angoscia.
Abbiamo misurato il danno polmonare su diversi intervalli. La concentrazione della proteina BAL e la conta totale delle cellule sia per il BAL che per i polmoni erano notevolmente più elevate nei gruppi infetti (Figura 2). Sezioni istologiche rappresentative che mostrano il processo infiammatorio in entrambi i modelli sono state ottenute al giorno 2, 4 e 6 dopo l'inoculazione (Figura 3), mostrando evidenza di infiammazione alveolare persistente nei topi infetti da Kpn (Figura 4), anche al giorno 10. I topi infetti da Kpn hanno continuato la lesione entro il giorno 10 (Figura 2 e Figura 4), mentre i topi infetti da Spn hanno risolto l'infiammazione polmonare entro il giorno 6 (Figura 2 e Figura 3).
Le sospensioni polmonari a singola cellula sono state utilizzate per discriminare il panorama immunitario mediante citometria a flusso ad alta dimensione al giorno 6 dopo l'infezione nel modello Spn , utilizzando un pannello a 18 colori in smistamento cellulare attivato da fluorescenza (FACS). Utilizzando l'inclusione del vicino stocastico t-distribuito (t-SNE), è possibile visualizzare le differenze complessive nella composizione delle cellule immunitarie, notevoli per un aumento del numero di granulociti (CD45+, CD11b+, CD24+, MHC-II-), macrofagi interstiziali (CD45+, CD11b+, MHC-II-, CD24-), monociti (CD45+, CD11b+, MHC-II-, CD24-, CD64-), cellule B (CD45+, CD19+) e cellule T (CD45+, CD3+), comprese le cellule natural killer (CD45+, CD3+, NK1.1+), come mostrato nella Figura 5. Le strategie di gating sono mostrate nella Figura 6.
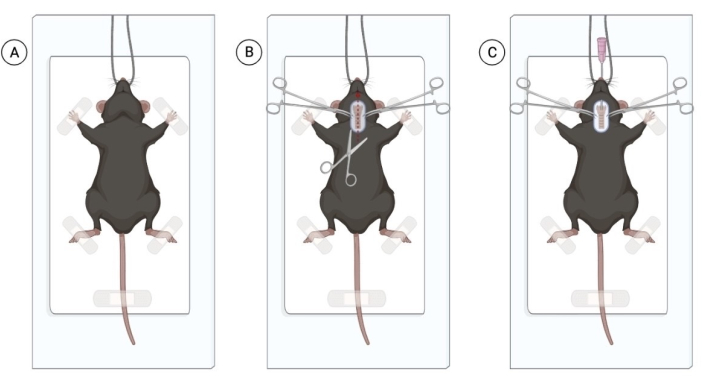
Figura 1: Procedura chirurgica per l'instillazione intratracheale di batteri vivi. (A) Posizione del topo nell'area chirurgica sterile, appeso per gli incisivi. (B) Area di incisione ed esposizione alla trachea. (C) Processo di intubazione inserendo il catetere da 20 G. Figura creata con Biorender.com. Clicca qui per visualizzare una versione più grande di questa figura.
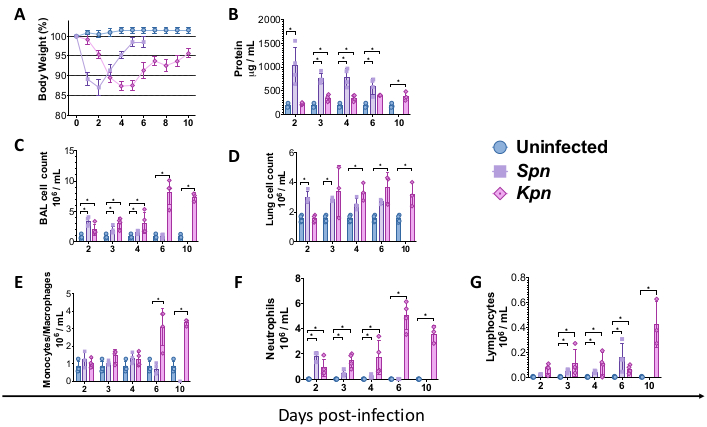
Figura 2: Profili di danno polmonare acuto (ALI) dopo modelli di polmonite. (A) Peso corporeo nel tempo rispetto al basale, controllo rispetto a Kpn e Spn (n = 4, per gruppo). (B) Quantificazione delle proteine totali BAL mediante saggio BCA (n = 4, per gruppo). (C) Conta totale delle cellule BAL nel controllo (n = 3), Kpn (n = 4) e Spn (n = 3). (D) Conta totale delle cellule polmonari nel controllo (n = 3), Kpn (n = 4) e Spn (n = 3). (E-G) Differenziale delle cellule BAL mediante conteggio istologico manuale del citospin BAL nel controllo (n = 3), Kpn (n = 4) e Spn (n = 3). I test statistici sono stati eseguiti con il t-test individuale, confrontando il controllo non infetto con i gruppi infetti. *p < 0,05. I dati vengono visualizzati utilizzando l'errore standard (SE) per ogni grafico. L'asse y è i giorni dopo l'infezione per tutti i pannelli. Abbreviazioni: BAL = lavaggio broncoalveolare; Spn = Streptococcus pneumoniae; Kpn = Klebsiella pneumoniae. Clicca qui per visualizzare una versione più grande di questa figura.
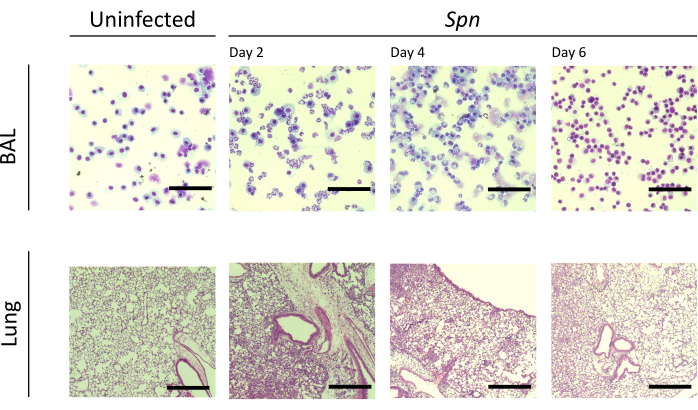
Figura 3: Risultati istopatologici polmonari durante l'infezione da Spn . Colorazione con ematossilina ed eosina (H&E) di sezioni istologiche di un BAL rappresentativo e di una sezione polmonare dopo l'infezione intratracheale di Spn e nei giorni 2, 4 e 6. Ingrandimento BAL = 100x; ingrandimento polmonare = 10x. Abbreviazioni: BAL = lavaggio broncoalveolare; Spn = Streptococcus pneumoniae. Clicca qui per visualizzare una versione più grande di questa figura.
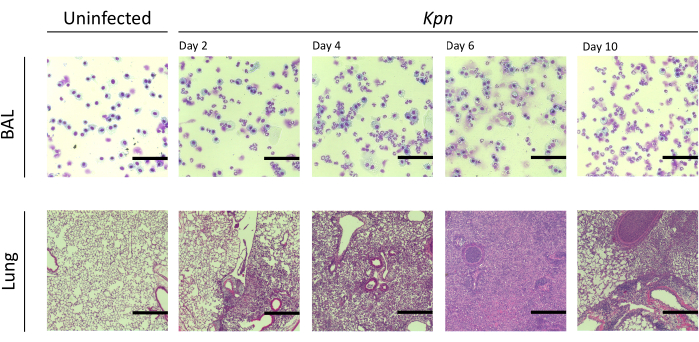
Figura 4: Risultati istopatologici polmonari durante l'infezione da Kpn . Colorazione con ematossilina ed eosina (H&E) di sezioni istologiche di una sezione rappresentativa di BAL e polmone dopo l'infezione intratracheale di Kpn nei giorni 2, 4, 6 e 10. Le immagini mostrano un ingrandimento ad alta potenza (barra della scala = 50 μm). Abbreviazioni: BAL = lavaggio broncoalveolare; Kpn = Klebsiella pneumoniae. Clicca qui per visualizzare una versione più grande di questa figura.
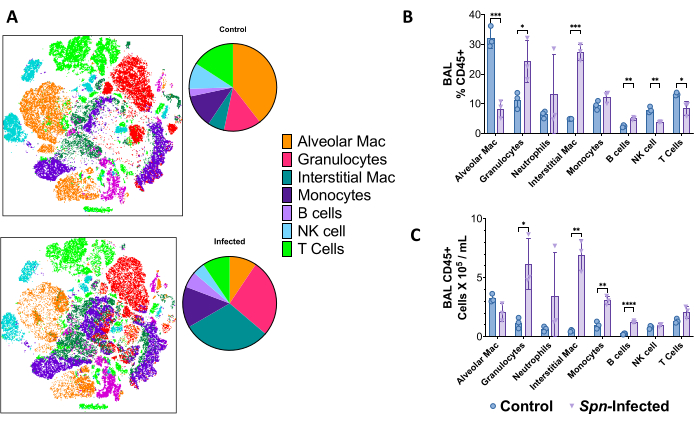
Figura 5: Panorama delle cellule immunitarie mediante citometria a flusso multicolore dopo 6 giorni di infezione da Spn . (A) L'inclusione del vicino stocastico distribuito in T (t-SNE) è stata utilizzata per visualizzare le popolazioni di cellule immunitarie (CD45+) del polmone confrontando il gruppo di controllo non infetto con quello infetto. (B) Riepilogo delle frequenze delle cellule immunitarie sul totale delle cellule CD45+ nel polmone. (C) Conteggio totale delle cellule di ogni singola popolazione. I confronti statistici sono stati effettuati mediante t-test tra il controllo e gli infetti. *p < 0,05, **p < 0,01, ***p < 0,001. I dati vengono visualizzati utilizzando l'errore standard (SE) per ogni grafico. Abbreviazioni: BAL = lavaggio broncoalveolare; Spn = Streptococcus pneumoniae. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Strategie di gating per identificare la sottopopolazione di cellule immunitarie nei polmoni al basale e dopo la polmonite. BAL e la sospensione di cellule polmonari sono state sottoposte a colorazione per citometria a flusso multicolore. I detriti sono stati prima isolati utilizzando SSC-A e FSC-A e le singole celle sono state controllate con due strategie (SSC-W vs. SSC-H e FSC-W vs. FSC-H). Le cellule vive sono state identificate utilizzando un discriminatore vivo/morto rispetto a SSC-A. Le popolazioni cellulari successive sono state identificate da marcatori precedentemente identificati 15. Abbreviazione: BAL = lavaggio broncoalveolare. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Modelli murini sperimentali di PNA offrono una piattaforma per valutare i meccanismi cellulari e molecolari alla base del danno e della risoluzione dell'ARDS. Le componenti fisiopatologiche che possono essere valutate includono le vie infiammatorie precoci, la clearance batterica, i cambiamenti dinamici del paesaggio immunitario, la risoluzione dell'infiammazione, la fibroproliferazione e la riparazione epiteliale e vascolare16. Tuttavia, quando si pianifica di replicare questo modello di danno polmonare indotto da polmonite, è necessario considerare diversi aspetti, tra cui l'età, il sesso, il ceppo del topo, i fattori intrinseci dell'ospite (ad esempio, lo stato immunocompromesso), l'agente patogeno specifico e la carica batterica utilizzati e l'esperienza del personale che esegue la procedura.
La PNA è tra le principali cause di ARDS. Abbiamo scelto di utilizzare Spn e Kpn vivi, che sono cause prevalenti di PNA acquisita in comunità e in ospedale nell'uomo, rispettivamente17. Suggeriamo di ottimizzare i modelli batterici di PNA titolando le dosi di batteri vivi per ottenere il profilo di mortalità e risoluzione delle lesioni desiderato che meglio si adatta all'ipotesi dello sperimentatore. Abbiamo ottimizzato l'inoculazione intratracheale di batteri di 3 x 106 CFU per Spn e 200 CFU per Kpn nei topi, che ha causato infiammazione alveolare, rottura della barriera alveolocapillare e disfunzione d'organo (Figura 2). Tuttavia, i lotti batterici provenienti da fonti diverse o anche all'interno di anse duplicate possono mostrare diversi gradi di infiammazione e lesioni, anche quando si utilizza lo stesso ceppo e CFU.
Pertanto, per replicare i risultati presentati in questo manoscritto, i ricercatori dovrebbero iniziare con la concentrazione di batteri qui descritta; Tuttavia, potrebbe essere necessario aumentare o diminuire la dose per ottenere un profilo del modello simile. Pertanto, ogni nuovo lotto di batteri utilizzato deve essere ottimizzato per il suo potenziale effetto di risoluzione delle lesioni. Presentiamo un robusto modello di PNA con due diversi risultati di risoluzione, uno auto-risolutivo (Spn) e l'altro lento/non risolutivo (Kpn) che possono fungere da piattaforme per i ricercatori per valutare i meccanismi immunologici e testare gli interventi terapeutici, in particolare al o dopo il picco di infezione (ad esempio, 2 giorni dopo l'infezione).
L'età, il sesso, la tensione e i fattori genetici influenzano la cinetica dei modelli di risoluzione delle lesioni16. Ad esempio, il sesso rende la risoluzione accelerata nelle femmine rispetto ai maschi18; Pertanto, un aumento della carica batterica porta ad un aumento della mortalità e a una risoluzione ritardata nei maschi rispetto alle femmine. L'invecchiamento è un altro fattore da considerare quando si titolano le CFU dei batteri utilizzati. I topi anziani hanno mostrato una mortalità del 100% quando abbiamo utilizzato la dose di Spn specificata (non mostrata qui). I topi giovani sono più frequentemente utilizzati nei modelli di PNA pneumococcico (da 6 a 14 settimane), mentre i topi anziani (19-26 mesi) mostrano una risposta immunitaria alterata e sono utilizzati per studiare il ruolo dell'invecchiamento nel PNA11. Abbiamo dovuto ridurre la CFU fino al 300% per raggiungere la sopravvivenza negli animali anziani (non mostrato qui). In questo studio sono stati utilizzati topi maschi C57BL/6 (8-12 settimane) e sono stati seguiti da 6 a 10 giorni dopo l'infezione. Differenze significative nella suscettibilità possono essere riscontrate anche tra i ceppi; ceppi consanguinei come BALB/C e C57BL6/J hanno risposte diverse all'infezione11,19.
L'inoculo diretto dei batteri per via intratracheale consente una somministrazione più precisa dell'inoculo (fino al 99%) nei polmoni12, rappresentando un'alternativa per sierotipi meno virulenti e diminuendo l'aerosolizzazione dei batteri11. Tuttavia, si può sostenere che si tratta di una procedura invasiva. L'intubazione può essere impegnativa, richiede un'anestesia sistemica e può portare a traumi tracheali con conseguente edema e stridore delle vie aeree. I topi possono sviluppare un riflesso vasovagale che porta all'apnea, per la quale è necessario disporre di un piccolo ventilatore per topi per fornire un supporto aggiuntivo al ventilatore quando necessario. L'esperienza del chirurgo che esegue la procedura è una componente fondamentale per garantire il successo dell'intubazione11. Nel nostro studio, nessun topo ha avuto bisogno di essere soppresso a causa di un'appropriata gestione del dolore e di una perdita di peso corporeo non superiore al 20%. Non sono stati osservati segni di dolore e angoscia come letargia, incapacità di raggiungere l'acqua o il cibo, respirazione affannosa o diminuzione della prontezza mentale. Un metodo alternativo di somministrazione diretta di batteri ai polmoni è l'aspirazione orofaringea, anche se la risoluzione del danno polmonare sembra avvenire più velocemente e alcuni batteri possono terminare nello stomaco e nel tratto gastrointestinale20.
I modelli preclinici di PNA consentono ai ricercatori di valutare il panorama immunitario. I compartimenti broncoalveolare e interstiziale possono essere valutati per i cambiamenti dinamici nelle cellule immunitarie16. Inoltre, le cellule possono essere coltivate e stimolate ex vivo per determinare la loro produzione specifica di citochine e chemochine. Qui, ci concentriamo sull'esplorazione del panorama delle cellule immunitarie nel polmone e nel BAL utilizzando la citometria a flusso multicolore. Il sequenziamento dell'RNA di una singola cellula può anche essere eseguito per comprendere le firme trascrittomiche specifiche della cellula nelle diverse fasi di risoluzione della lesione.
I modelli PNA-ARDS generano effetti sistemici che possono essere rilevati precocemente misurando il peso corporeo durante il decorso della malattia10. Sebbene non misuriamo direttamente gli effetti sistemici dell'ARDS, la disfunzione d'organo può essere valutata anche mediante la misurazione del sangue dei profili chimici e il prelievo di diversi tessuti come milza, reni e fegato per l'istologia. Gli effetti sistemici del PNA-ARDS pneumococcico sono stati precedentemente descritti da altri gruppi che utilizzano lo stesso ceppo batterico21.
Qui viene descritto un modello sperimentale di PNA che assomiglia ad alcuni dei principali risultati fisiopatologici alla base dell'ARDS umana. Sebbene non esistano modelli ideali che ricapitolino completamente la complessità e l'eterogeneità dell'ARDS9 umana, questi modelli sono rilevanti e riproducibili per lo studio dei meccanismi di danno e riparazione polmonare, fungendo anche da piattaforma per l'identificazione di nuovi potenziali bersagli farmacologici che si concentrano sull'accelerazione della risoluzione dell'infiammazione polmonare e sulla promozione della riparazione polmonare.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato supportato dalla sovvenzione NIH R01 HL131812 e R01HL163881.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-200 µL Round 0.5 mm Thick Gel-Loading Pipet Tips | Corning | 4853 | |
| 2 mL Cryogenic vials | Corning Incorporated | 431420 | 2 mL self standing, round bottom, red cap, polypropylene |
| 2 mL Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Fisherscientific | 05-402-24C | Shape: Round, Length (Metric): 38mm, Diameter (Metric) Outer: 10mm, Capacity (Metric): 2mL |
| 70 µm Cell Strainer | Falcon | 352350 | White, Sterile, Individually Packaged |
| 96-well Clear Round Bottom | Falcon | 353077 | TC-treated Cell Culture Microplate, with Lid, Individually Wrapped, Sterile |
| Acepromizine Maleate Injection, USP 500 mg/50 mL (10mg/mL) | Phoenix | NDC 57319-604-04 | EACH mL CONTAINS: acepromazine maleate 10 mg, sodium citrate 0.36%, Citric acid 0.075%, benzyl alcohol 1% and water for injection. |
| Ammonium-Chloride-Potassium (ACK) Lysing Buffer | Quality Biological | 118-156-721 | 4 x 100mL |
| Anti-mouse I-A/I-E | Biolegend | 107628 | APC/Cyanine7 anti-mouse I-A/I-E [M5/114.15.2]; Isotype: Rat IgG2b |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| BD Trypticase Soy Agar | BD-Biosciences | 90001-276 | 5% Sheep Blood Prepared Media Stacker Plates, BD Diagnostics |
| Biotix Disposable Reagent Reservoirs | Biotix | 89511-194 | |
| Bovine Serum Albumin | Sigma-Aldrih | A4503 | |
| CD103 | Invitrogen | 509723 | Integrin alpha E) Armenian Hamster anti-Mouse, FITC, Clone: 2E7 |
| CD11b | Invitrogen | RM2817 | PE-Texas Red, Clone: M1/70.15, Invitrogen |
| CD11c | BD Biosciences | 565872 | Hamster anti-Mouse, APC-R700, Clone: N418, BD Horizon |
| CD19 | Biolegend | 152410 | APC anti-mouse CD19 [1D3/CD19]; Isotype: Rat IgG2a, κ |
| CD24 | BD Biosciences | 563450 | Rat anti-Mouse, Brilliant Violet 711, Clone: M1/69 |
| CD4 | BD Biosciences | 563790 | BUV395; Clone: GK1.5 |
| CD45 | Biolegend | 103157 | Brilliant Violet 750 anti-mouse CD45 [30-F11]; Isotype: Rat IgG2b, κ; |
| CD8a | BD Biosciences | 612759 | Rat anti-Murine, Brilliant Ultraviolet 737, Clone: 53-6.7 |
| Cell Counting Slides | Bio-rad | 1450017 | For TC20 Cell Counter |
| Cell strainer 70 µL Nylon | Falcon | 198718 | REF 352350 |
| Collagenase Type1 | Worthington Biochemical Corporation | LS004197 | |
| Culti-Loop Streptococcus pneumoniae | Thermo Scientific | R4609015 | ATCC 4961 |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrih | DN25 | |
| Disposable inoculation loops/needles | Fisherbrand | 22-363-603 | Color blue; Volume 1 µL |
| DMEM (Dulbecco’s Modified Eagle’s Medium) | Corning | 10-014-CV | |
| Fc Block | BD Biosciences | 553142 | CD16/CD32 Rat anti-Mouse, Unlabeled, Clone: 2.4G2 |
| Formalin solution | Sigma-Aldrih | HT501640 | Formalin solution, neutral buffered, 10% |
| Gauze Sponges, Covidien | Curity | 2146- | |
| gentleMACS C Tubes | MACS Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | MACS Miltenyi Biotec | 130-093-235 | SN: 4715 |
| Hema 3 Manual Staining System and Stat Pack | Thermo Scientific | 23123869 | |
| Isoflurane Liquid Inhalation | Henry Schein | 1182097 | |
| IV CATHETER JELCO 20GX1.25" | Hanna Pharmaceutical Supply Co., Inc | 405611 | |
| Ketamine HCl Injection | Henry Schein | 1049007 | Ketamine HCl Injection MDV 100mg/mL 10mL 10/Box |
| Klebsiella pneumoniae | ATCC | 43816 | subsp. pneumoniae (Schroeter) Trevisan |
| Loctite 409 | Electron Microscopy Sciences | 7257009 | |
| Ly-6C | Biolegend | 128036 | Brilliant Violet 605 anti-mouse Ly-6C [HK1.4]; Isotype: Rat IgG2c |
| Ly-6G | BD Biosciences | 740157 | Rat anti-Mouse, Brilliant Violet 510, Clone: 1A8, BD Optibuild |
| MiniVent Type 845 | Hugo Sachs Elektronik- Harvard Apparatus | 4694 | D-79232 March (Germany) |
| NK-1.1 | BD Biosciences | 553165 | Mouse anti-Mouse, PE, Clone: PK136, BD |
| Phase Hemacytometer | Hausser Scientific | 1475 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | 1X without calcium and magnesium, |
| Round Bottom | Sarstedt | 55.476.305 | |
| Round-Bottom Polystyrene Test Tubes | Falcon | 352235 | With Cell Strainer Snap Cap, 5mL |
| SealRite 1.5 mL Natural Microcentrifuge Tube | USA Scientific | 1615-5500 | Free of detectable Rnase, DNase, DNA and pyrogens. |
| Shandon EZ Single Cytofunnel | Epredia | A78710003 | |
| Siglec-F | BD Biosciences | 562681 | Anti-Mouse, Brilliant Violet 421, Clone: E50-2440 |
| Silk Black Braided 30"(75 cm) Sterile, nonabsorbable surgical suture U.S.P. | Ethicon | K-834 | 0 (3.5 metric) |
| Stainless-Steel Slide Clip | Epredia | 59910052 | |
| Sterile Single Use Vacuum Filter Units | Thermo Scientific | 1660045 | |
| Syringe sterile, single use, 1 mL | BD-Biosciences | 309628 | |
| TC20 Automatic Cell Counter | Bio-Rad | 508BR05740 | |
| TipOne 200 ul yellow pipet tip refill | USA Scientific | 1111-0706 | |
| TODD HEWITT BROTH | RPI | T47500 | |
| TPX Sample Chamber | Epredia | A78710018 | |
| TPX Single Sample Chamber, Caps and Filter Cards | Epredia | 5991022 | |
| Trypan Blue | Bio-rad | 1450022 | |
| U-100 Insulin Syringes | BD-Biosciences | 329461 | |
| Wet-Proof Multi-Heat Electric Heat Pad | Cullus | Model PR7791AB | 120 volst AC; 45 watts; Listed 562B/E26869 |
Riferimenti
- Bellani, G., et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 315 (8), 788-800 (2016).
- Hariri, L., Hardin, C. C. Covid-19, angiogenesis, and ARDS endotypes. The New England Journal of Medicine. 383 (2), 182-183 (2020).
- Ferguson, N. D., et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Medicine. 38 (10), 1573-1582 (2012).
- Tomashefski Jr, J. F. Pulmonary pathology of the adult respiratory distress syndrome. Clinics in Chest Medicine. 11 (4), 593-619 (1990).
- Martin, T. R. Lung cytokines and ARDS: Roger S. Mitchell lecture. Chest. 116 (1 Suppl), 2S-8S (1999).
- Colletti, L. M., et al. Role of tumor necrosis factor-alpha in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. The Journal of Clinical Investigation. 85 (6), 1936-1943 (1990).
- Donnelly, S. C., et al. The association between mortality rates and decreased concentrations of interleukin-10 and interleukin-1 receptor antagonist in the lung fluids of patients with the adult respiratory distress syndrome. Annals of Internal Medicine. 125 (3), 191-196 (1996).
- Miller, E. J., Cohen, A. B., Matthay, M. A. Increased interleukin-8 concentrations in the pulmonary edema fluid of patients with acute respiratory distress syndrome from sepsis. Critical Care Medicine. 24 (9), 1448-1454 (1996).
- Matute-Bello, G., et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals. American Journal of Respiratory Cell and Molecular Biology. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 66 (2), e1-e14 (2022).
- Borsa, N., Pasquale, M. D., Restrepo, M. I. Animal models of pneumococcal pneumonia. International Journal of Molecular Sciences. 20 (17), 4220(2019).
- Rubins, J. B., et al. Dual function of pneumolysin in the early pathogenesis of murine pneumococcal pneumonia. The Journal of Clinical Investigation. 95 (1), 142-150 (1995).
- Thermo Scientific, Pierce BCA Protein Assay Kit. , https://www.thermofisher.com/order/catalog/product/23225 Forthcoming.
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. Journal of Visualized Experiments. (29), e1266(2009).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 61 (2), 150-161 (2019).
- Aeffner, F., Bolon, B., Davis, I. C. Mouse models of acute respiratory distress syndrome: a review of analytical approaches, pathologic features, and common measurements. Toxicologic Pathology. 43 (8), 1074-1092 (2015).
- Torres, A., et al. Pneumonia. Nature Reviews Disease Primers. 7 (1), 25(2021).
- Xiong, Y., et al. Estradiol resolves pneumonia via ERβ in regulatory T cells. JCI Insight. 6 (3), e133251(2021).
- D'Alessio, F. R., et al. Enhanced resolution of experimental ARDS through IL-4-mediated lung macrophage reprogramming. American Journal of Physiology. Lung Cellular and Molecular Physiology. 310 (8), L733-L746 (2016).
- D'Alessio, F. R. Mouse models of acute lung injury and ARDS. Methods in Molecular Biology. 1809, 341-350 (2018).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology. Lung Cellular and Molecular Physiology. 317 (5), L717-L736 (2019).
Erratum
Formal Correction: Erratum: Experimental Model to Evaluate Resolution of Pneumonia
Posted by JoVE Editors on 6/13/2023. Citeable Link.
An erratum was issued for: Experimental Model to Evaluate Resolution of Pneumonia. A figure was updated.
Figure 2 was updated from:

to:

Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon