È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Bioreattore di perfusione multi-stream integrato con frazionamento in uscita per colture cellulari dinamiche
In questo articolo
Riepilogo
Questo documento presenta un metodo per costruire e gestire un sistema di coltura cellulare a perfusione multicanale a basso costo per misurare la dinamica dei tassi di secrezione e assorbimento dei soluti nei processi cellulari. Il sistema può anche esporre le cellule a profili di stimolo dinamici.
Abstract
Alcune funzioni cellulari e tissutali operano all'interno della scala temporale dinamica da minuti a ore che sono scarsamente risolte dai sistemi di coltura convenzionali. Questo lavoro ha sviluppato un sistema di bioreattori a perfusione a basso costo che consente di perfondere continuamente il terreno di coltura in un modulo di coltura cellulare e frazionato in un modulo a valle per misurare la dinamica su questa scala. Il sistema è costruito quasi interamente da parti disponibili in commercio e può essere parallelizzato per condurre esperimenti indipendenti in piastre di coltura cellulare multi-pozzo convenzionali contemporaneamente. Questo articolo video illustra come assemblare la configurazione di base, che richiede solo una singola pompa a siringa multicanale e un collettore di frazioni modificato per perfondere fino a sei colture in parallelo. Vengono inoltre presentate varianti utili sul design modulare che consentono dinamiche di stimolazione controllate, come impulsi di soluto o profili simili a farmacocinetici. È importante sottolineare che, poiché i segnali dei soluti viaggiano attraverso il sistema, vengono distorti a causa della dispersione del soluto. Inoltre, viene descritto un metodo per misurare le distribuzioni del tempo di residenza (RTD) dei componenti della configurazione della perfusione con un tracciante utilizzando MATLAB. Gli RTD sono utili per calcolare come i segnali dei soluti sono distorti dal flusso nel sistema multi-compartimento. Questo sistema è altamente robusto e riproducibile, quindi i ricercatori di base possono facilmente adottarlo senza la necessità di strutture di fabbricazione specializzate.
Introduzione
Molti importanti processi biologici si verificano in colture cellulari e tissutali sulla scala temporale da minuti a ore 1,2,3. Mentre alcuni di questi fenomeni possono essere osservati e registrati in modo automatizzato utilizzando la microscopia time-lapse4, la bioluminescenza1 o altri metodi, gli esperimenti che coinvolgono la raccolta di campioni di surnatante di coltura per l'analisi chimica vengono spesso eseguiti manualmente in colture cellulari statiche. Il campionamento manuale limita la fattibilità di alcuni studi a causa dell'inconveniente di punti temporali di campionamento frequenti o fuori orario. Ulteriori carenze dei metodi di coltura statica includono esperimenti che coinvolgono esposizioni controllate e transitorie a stimoli chimici. Nelle colture statiche, gli stimoli devono essere aggiunti e rimossi manualmente, e i profili di stimolo sono limitati ai cambiamenti di passo nel tempo, mentre i cambiamenti medi aggiungono e rimuovono anche altri componenti del mezzo, che possono influenzare le cellule in modo incontrollato5. I sistemi fluidici possono superare queste sfide, ma i dispositivi esistenti pongono altre sfide. I dispositivi microfluidici comportano i costi proibitivi di attrezzature specializzate e formazione da produrre e utilizzare, richiedono metodi microanalitici per elaborare i campioni e le cellule sono difficili da recuperare dai dispositivi dopo la perfusione6. Pochi sistemi macrofluidici sono stati creati per i tipi di esperimenti qui descritti 7,8,9,10, e sono costruiti con più parti personalizzate realizzate internamente e richiedono più pompe o collettori di frazioni. Inoltre, gli autori non sono a conoscenza di alcun sistema di coltura cellulare a perfusione macrofluidica disponibile in commercio diverso dai bioreattori a serbatoi agitati per la coltura in sospensione, che sono utili per la bioproduzione, sebbene non siano progettati per modellare e studiare la fisiologia.
Gli autori hanno precedentemente riferito sulla progettazione di un sistema di bioreattori a perfusione a basso costo composto quasi interamente da parti11 disponibili in commercio. La versione base del sistema consente di conservare più colture in una piastra di pozzo in un incubatore a CO2 e di fondere continuamente con il mezzo di una pompa a siringa, mentre i flussi del mezzo effluente provenienti dalle colture vengono automaticamente frazionati in campioni nel tempo utilizzando un collettore di frazioni con una modifica personalizzata. Pertanto, questo sistema consente il campionamento automatizzato del surnatante del terreno di coltura e l'input continuo del soluto alle colture nel tempo. Il sistema è macrofluidico e modulare e può essere facilmente modificato per soddisfare le esigenze di nuovi progetti di esperimenti.
L'obiettivo generale del metodo qui presentato è quello di costruire, caratterizzare e utilizzare un sistema di coltura cellulare a perfusione che consenta esperimenti in cui vengono misurati i tassi di secrezione o assorbimento di sostanze da parte delle cellule nel tempo e / o le cellule sono esposte a segnali di soluto precisi e transitori. Questo articolo video spiega come assemblare la configurazione di base, che è in grado di perfondere fino a sei colture cellulari contemporaneamente utilizzando una singola pompa a siringa e un collettore di frazioni modificate. Nella Figura 1 sono inoltre presentate due varianti utili sul sistema di base che utilizzano pompe e parti aggiuntive per consentire esperimenti che espongono le cellule a segnali transitori di concentrazione di soluto, inclusi brevi impulsi e profili farmacocinetici12.
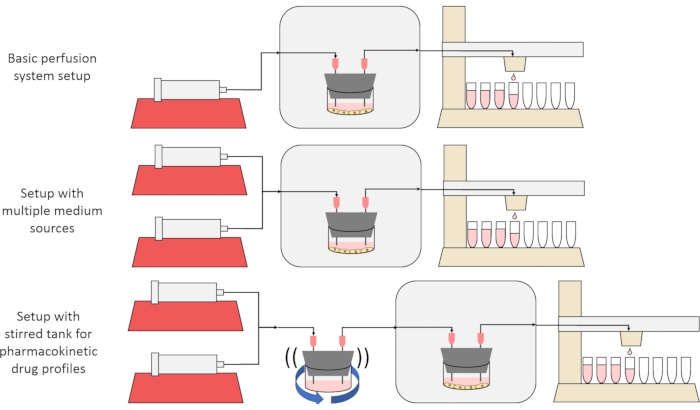
Figura 1: Tre variazioni sul progetto del sistema di perfusione. (In alto) Il sistema di perfusione di base. (Al centro) Il sistema di perfusione con un rubinetto di arresto per più sorgenti medie. (In basso) Il sistema di perfusione con un serbatoio agitato per imitare un volume di distribuzione ben miscelato. Fare clic qui per visualizzare una versione più grande di questa figura.
A causa della dispersione e della diffusione all'interno del flusso, i segnali del soluto diventano distorti o "imbrattati" mentre viaggiano attraverso il sistema di flusso. Questa distorsione può essere quantificata mediante l'uso di distribuzioni temporali di residenza (RTD)13. Questo articolo spiega come eseguire esperimenti traccianti sui componenti del sistema di perfusione (Figura 2) e fornisce script MATLAB per generare RTD dai dati misurati. Una spiegazione dettagliata di questa analisi può essere trovata nel precedente articolo11 degli autori. Ulteriori script MATLAB adattano funzioni appropriate agli RTD ed estraggono parametri fisici ed eseguono la convoluzione del segnale utilizzando RTD per prevedere come l'input del segnale di soluto da parte dell'utente si propagherà e si distorcerà attraverso il sistema di perfusione14.
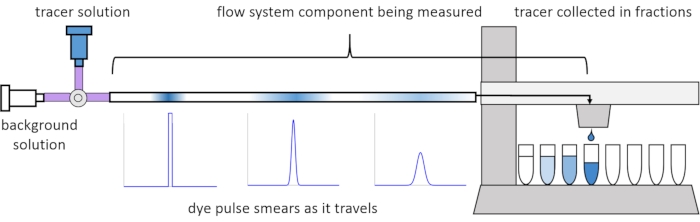
Figura 2: Distribuzioni del tempo di residenza. Gli RTD dei componenti del sistema di flusso, come questa lunghezza del tubo, vengono misurati immettendo un impulso di tracciante nel sistema e misurando come "spalma" nel momento in cui esce nelle frazioni raccolte. Questa cifra è stata modificata da Erickson et al.11. Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparare le parti per la perfusione della piastra del pozzo
- Preparare i tubi
- Tagliare due lunghezze di tubi in silicone (diametro interno 1,6 mm) per ogni coltura cellulare da perfusare. Assicurarsi che il pezzo utilizzato come tubo a monte sia abbastanza lungo da raggiungere dalla pompa della siringa alla coltura cellulare all'interno dell'incubatore e che il pezzo a valle possa raggiungere dalla coltura cellulare alla posizione più estesa del collettore di frazione.
- Dai a ogni pezzo di tubo un'etichetta unica su entrambe le estremità con nastro adesivo.
- Preparare i tappi per il piatto del pozzo
- Ottenere un tappo in silicone per ogni pozzetto della piastra del pozzo da perfusare, con un diametro appropriato per adattarsi comodamente ai pozzetti con una tenuta ermetica.
- Tagliare il materiale in eccesso dal fondo del tappo in modo che si inseriscano nei pozzetti lasciando spazio all'interno per l'aria al di sopra del livello di liquido previsto.
- Spingere due aghi smussati da 18 G attraverso ciascun tappo, nella parte superiore e fuori dal basso per fungere da ingresso e uscita per il flusso attraverso il pozzo, diametralmente opposti l'uno all'altro per massimizzare la distanza tra le loro punte all'interno del pozzo.
- Regolare le altezze degli aghi all'interno del pozzetto tappato, poiché l'altezza dell'ago di uscita determinerà l'altezza stabile del livello del liquido nel pozzo durante la perfusione.
NOTA: Se la perfusione viene avviata con l'ago di uscita sopra il livello del liquido, il liquido si accumulerà nel pozzo fino a quando il livello raggiunge l'ago. Se la perfusione viene avviata con l'ago di uscita al di sotto del livello del liquido, il livello del liquido rimarrà stabile a meno che le bolle d'aria non fluiscano nel pozzo, il che causerà l'abbassamento dell'altezza del liquido fino a quando non avrà la stessa altezza dell'ago di uscita.
- Raccogli parti aggiuntive
- Ottenere una siringa sterile per ogni coltura cellulare da perfusare che sia abbastanza grande da contenere abbastanza terreno per l'intera perfusione, più una quantità aggiuntiva di mezzo per riempire inizialmente il tubo.
- Per ogni coltura da perfusare, procuratevi un connettore Luer femmina-barbo e due connettori Luer maschio-barbo, oltre a due cappucci Luer femmina e due maschi.
- Pulire e sterilizzare le parti
- Se le parti sono state utilizzate in precedenza, pulirle perfondendole con 0,1 N NaOH, seguito da un risciacquo con acqua deionizzata.
- Con l'autoclave o in altro modo, garantire la sterilità di tutte le parti sopra elencate.
2. Tagliare al laser il distributore multitesta e collegarlo a un collettore di frazioni
- Ricreare il modello di dispenser multi-testa dalla Figura 3 in un programma di progettazione assistita da computer o scaricare il file DXF del modello fornito (File supplementare 1).
- Utilizzare una taglierina laser per tagliare il design da un foglio acrilico da 1/8.
- Rimuovere le tre viti che fissano la testa di erogazione alla base mobile del collettore di frazione.
- Allineare i tre fori più piccoli nel distributore multitesta con i fori delle viti nella base mobile e riavvitare le viti attraverso i fori da collegare.
- Regolare la tenuta delle tre viti per angolare il dispenser multitesta su e giù fino a quando la fila di fori di erogazione non è allineata con i tubi di raccolta sottostanti.
- Posizionare con attenzione le punte delle pipette da 300 μL attraverso i fori desiderati per fungere da punte di erogazione.
NOTA: il collettore di frazioni può essere utilizzato senza il distributore multitesta per perfondere una singola coltura cellulare.
3. Misurare gli RTD dei componenti ed eseguire la convoluzione del segnale
- Impostare pompe e siringhe per l'impulso tracciante come mostrato nella Figura 2.
- Ottenere due pompe a siringa monocanale o multicanale.
- Scegli una soluzione di sfondo per rappresentare il mezzo che verrà utilizzato nel sistema di flusso durante gli esperimenti di coltura cellulare. Assicurarsi che la soluzione in background abbia proprietà di trasferimento di massa simili al supporto. In molti casi, l'acqua deionizzata è una scelta appropriata.
- Scegli una sostanza tracciante per rappresentare il soluto che sarà di interesse durante gli esperimenti di coltura cellulare. Assicurarsi che il tracciante abbia proprietà di trasferimento di massa simili al soluto di interesse e che la sua concentrazione possa essere misurata. In molti casi, il colorante alimentare è una scelta appropriata.
- Sciogliere la sostanza tracciante nella soluzione di fondo per creare la soluzione tracciante.
- Riempire una siringa con una soluzione di fondo e caricarla in una pompa a siringa. Riempire un'altra siringa con una soluzione tracciante e caricarla nella seconda pompa della siringa.
- Collegare entrambe le siringhe a due delle tre porte di un rubinetto a quattro vie utilizzando i connettori Luer.
- Chiudere il rubinetto alla soluzione di sfondo e pompare la soluzione tracciante nel rubinetto fino a quando non inizia a gocciolare dalla porta aperta. Arrestare la pompa e non regolare ulteriormente la siringa.
NOTA: è importante che la barra mobile della pompa della siringa venga spinta verso l'alto contro gli stantuffi della siringa prima dell'inizio delle parti temporizzate dell'esperimento. Ciò consentirà al flusso di iniziare immediatamente all'avvio della pompa. In caso contrario, la pompa potrebbe essere avviata, ma il flusso non inizierà effettivamente fino a quando la barra in movimento non raggiungerà la posizione dello stantuffo. - Chiudere il rubinetto alla soluzione tracciante e pompare la soluzione di fondo nel rubinetto fino a quando tutta la soluzione di tracciante residua non è stata scaricata dalla porta aperta. Arrestare la pompa e non regolare ulteriormente la siringa.
- Impostare il componente del sistema di flusso di interesse e il collettore di frazioni
- Impostare il componente del sistema di flusso desiderato per l'analisi RTD. Assicurarsi che il componente da misurare finisca con un pezzo di tubo a valle di lunghezza e flessibilità adeguate per raggiungere il collettore di frazioni durante il funzionamento.
- Inserire l'estremità del tubo a valle in un distributore di punta della pipetta nel distributore a più teste in modo che sia collegato in modo avvolgente.
- Collegare la porta aperta del rubinetto a quattro vie all'ingresso del componente da misurare. Pompare la soluzione di fondo attraverso il componente fino a quando non è completamente riempito come sarebbe durante un esperimento di coltura cellulare, e inizia a gocciolare fuori dalla punta di erogazione del collettore di frazione. Arrestare la pompa.
- Iniettare l'impulso tracciante, raccogliere frazioni e misurare il tracciante
- Impostare la pompa per la soluzione tracciante sulla portata desiderata. Chiudere il rubinetto alla soluzione di sfondo e avviare il flusso della soluzione tracciante. Allo stesso tempo, avviare il collettore di frazioni.
- Continuare il flusso della soluzione tracciante per un breve periodo di tempo per approssimare un input di impulso del tracciante. Una durata dell'impulso di 10 minuti è risultata funzionare bene per gli RTD ad una portata di 1 mL/h.
NOTA: se l'impulso tracciante è troppo breve, il tracciante non sufficiente entrerà nel flusso per essere misurabile. Se l'impulso è troppo lungo, non si avvicinerà più a un impulso e cambierà la forma dell'RTD. - Al termine del periodo di impulso della soluzione tracciante, arrestare la pompa della soluzione tracciante. Chiudere rapidamente il rubinetto alla soluzione tracciante e avviare il flusso della soluzione di fondo alla stessa portata.
- Consentire alla soluzione di fondo di fluire e alle frazioni di essere raccolte fino a quando tutto il tracciante non è passato attraverso il sistema e nelle frazioni raccolte.
- Arrestare il sistema e misurare la concentrazione del tracciante nelle frazioni. Includere solo le frazioni che sono state dispensate completamente. Se la raccolta viene interrotta in parte attraverso la raccolta di una frazione, non includere tale frazione.
- Calcola la distribuzione del tempo di residenza (RTD) dai dati misurati in MATLAB
NOTA: Una spiegazione scritta dell'analisi eseguita da questo script MATLAB può essere trovata nella precedente pubblicazione11 degli autori e le discussioni sulla teoria sono ampiamente disponibili nella letteratura13.- Produrre un file .xlsx contenente i dati di concentrazione nel formato del foglio di calcolo example_tracer_data.xlsx fornito nel file supplementare 2. Immettere i valori di concentrazione del tracciante nelle frazioni (qualsiasi unità) in ordine cronologico da sinistra a destra nella riga 2. Immettere il tempo trascorso dall'inizio dell'impulso alla fine dell'ultima frazione nella cella A5 e immettere la lunghezza dell'impulso tracciante in minuti nella cella A8.
- Salva il file .xlsx nella directory MATLAB.
- Apri lo script RTD_From_Data.m, dal file supplementare 3, nell'editor MATLAB.
- Sostituire il nome del file di .xlsx tra parentesi nella prima riga della sezione Carica dati dello script con il nome del nuovo file di dati .xlsx, seguendo le istruzioni scritte all'interno del file di script. Eseguire lo script.
- Assicurarsi che lo script esegua correttamente l'analisi RTD13, producendo un grafico dell'RTD e restituendo il valore dell'integrale numerico sull'RTD uguale a 1. Trova il vettore temporale (t) e il vettore dei valori RTD associati (Et) salvati dallo script nella directory MATLAB.
- Adattare una funzione del modello all'RTD in MATLAB
- Apri lo script Fit_RTD_Function.m nell'editor MATLAB dal file supplementare 4.
- Scegli una delle tre funzioni del modello commentate per adattarsi all'RTD: il modello di dispersione assiale13, che si adatta agli RTD per il flusso laminare in tubi cilindrici; il modello CSTR13, che si adatta a serbatoi ben agitati; e il modello n-CSTR15, che si adatta approssimativamente a piastre di pozzo più grandi. Per adattarlo a un altro modello non incluso qui, aggiungilo allo script nello stesso formato.
- Rimuovete i commenti nella sezione dello script contenente il modello scelto per il montaggio.
- Modificare i valori delle ipotesi iniziali per i parametri in quelli appropriati per l'RTD.
- Eseguire lo script per produrre un grafico della funzione fit sovrapposta ai dati RTD e per stampare i valori dei parametri fit per la funzione. Se l'adattamento è molto scarso o si verificano errori, modificare le ipotesi iniziali del parametro ed eseguire nuovamente lo script.
- Eseguire la convoluzione del segnale in MATLAB
- Scegli un segnale e un RTD o due RTD da convolvere.
- Apri lo script Signal_Convolution.m, dal file supplementare 5, nell'editor MATLAB.
- Per ciascuno dei due segnali da convolvere (cioè un segnale e un RTD, o due RTD), definire un vettore di punti temporali uniformemente distanziati nelle unità desiderate e un vettore corrispondente di valori del segnale in quei momenti.
NOTA: i vettori dei due segnali devono avere lo stesso numero di elementi e le stesse dimensioni dei passi temporali. Questo è il motivo per cui è utile avere l'RTD come funzione continua che può essere campionata per un numero arbitrario di punti in qualsiasi intervallo di tempo. - Inserisci i due segnali in MATLAB ed esegui lo script per ottenere i vettori di tempo e segnale del segnale di uscita.
4. Impostare il sistema di perfusione di base con le cellule in una piastra di pozzo
- Preparare il piatto del pozzo
- Assicurarsi che la coltura della piastra del pozzo abbia la profondità media appropriata per l'esperimento di perfusione. Eseguire eventuali cambiamenti finali del mezzo, stimolazioni o altri passaggi come desiderato prima di iniziare la perfusione. Se le celle di sospensione vengono perfuse, centrifugare la piastra per assicurarsi che siano sul fondo.
- In condizioni sterili, inserire i tappi con aghi nelle colture di piastre del pozzo con gli aghi tirati su. Dopo che il tappo è in posizione, abbassare gli aghi all'altezza desiderata per la perfusione, poiché l'altezza dell'ago di uscita determina il livello di liquido stabile.
- Tappare gli aghi con tappi Luer maschi e tenere l'intera piastra del pozzo in un'incubatrice fino all'uso.
- Preparare le siringhe e i tubi a monte
- In condizioni sterili, riempire una siringa per ogni coltura da perfusare con un mezzo sufficiente per la durata desiderata della perfusione, più un mezzo aggiuntivo sufficiente per riempire il tubo a monte.
- Fissare il tubo a monte alla siringa utilizzando un connettore Luer femmina-barbo. All'altra estremità del tubo, inserire un connettore Luer maschio-barbo.
- Espensare il mezzo dalla siringa fino a quando il tubo a monte non è interamente riempito con il mezzo.
- Tappare l'estremità aperta del tubo con un cappuccio Luer femmina.
NOTA: tutte le siringhe replicate devono avere esattamente lo stesso volume a questo punto. Se i loro volumi non sono uguali, i loro stantuffi saranno in posizioni diverse e non si adatteranno tutti bene a una singola pompa a siringa multicanale.
- In condizioni sterili, inserire un connettore Luer maschio-barbo in un'estremità del tubo a valle e tapparlo con un cappuccio Luer femmina.
- Portare con cura tutti i tubi preparati, le siringhe e la piastra del pozzo nell'incubatore che verrà utilizzato per la perfusione.
- Posizionare la pompa della siringa e il collettore di frazione nelle posizioni desiderate vicino all'incubatore. Posizionare la pompa della siringa sopra o vicino all'incubatore e posizionare il collettore di frazioni accanto all'incubatore, vicino al porto.
- Raggruppare le estremità coperte di tutti i tubi a monte e a valle e spingerli dall'esterno dell'incubatore verso l'interno attraverso la porta.
- Caricare le siringhe nella pompa della siringa e inserire le estremità aperte dei tubi a valle nelle punte delle pipette di erogazione del distributore multitesta del collettore di frazione.
- All'interno dell'incubatore, tirare il più possibile l'allentamento dei tubi a monte nell'incubatore per massimizzare la lunghezza del tubo attraverso il quale il mezzo che scorre può ricevere calore e CO2 dall'aria dell'incubatore. Tenendoli in posizione, estrarre i tubi a valle dall'incubatore, quanto basta in modo che siano in grado di raggiungere il punto più esteso sul collettore di frazione mantenendo le estremità coperte all'interno dell'incubatore.
- Per ogni pozzetto collegato, scollegare rapidamente gli aghi e i tubi a monte e a valle per quel pozzo e collegarli insieme ai loro connettori Luer.
- Una volta collegate tutte le parti, far scorrere brevemente la pompa della siringa a una velocità relativamente elevata per assicurarsi che tutti i flussi scorrano correttamente.
- A questo punto, se si desidera iniziare l'esperimento con i tubi a valle pieni del mezzo, continuare a far funzionare la pompa fino a quando tutti non saranno riempiti. Altrimenti, arrestare la pompa.
- Impostare la portata della pompa della siringa e la frequenza di raccolta delle frazioni e avviare entrambe le macchine contemporaneamente per iniziare l'esperimento. Raccogli le frazioni per la durata dell'esperimento desiderata.
5. Impostare il sistema di perfusione con un rubinetto di arresto per più sorgenti medie
- Eseguire tutti i passaggi secondari del passaggio 4.1 precedente.
- Preparare i due mezzi da utilizzare nella perfusione, etichettando il mezzo che verrà erogato prima come 1 e l'altro come mezzo 2.
- Per ogni coltura da perfusare, riempire una siringa con un mezzo sufficiente 1 per la durata della sua erogazione, più un volume sufficiente per riempire inizialmente il sistema di perfusione. Riempire una seconda siringa con un mezzo sufficiente 2 per la durata della sua erogazione.
- Collegare entrambe le siringhe a due delle tre porte di un rubinetto a quattro vie.
NOTA: potrebbe essere necessaria una lunghezza del tubo per collegare le siringhe ai rubinetti. - Preparare il rubinetto e le siringhe in modo simile ai passaggi 3.1.7-3.1.8 di cui sopra chiudendo il rubinetto sul mezzo 1 ed erogando il mezzo 2 nel rubinetto fino a quando non inizia a gocciolare fuori dalla porta aperta.
- Chiudere il rubinetto sul mezzo 2 ed erogare il mezzo 1 nel rubinetto fino a quando tutto il mezzo residuo 2 non è stato scaricato dalla porta aperta.
- Collegare il tubo a monte alla porta del rubinetto aperto utilizzando un connettore Luer femmina-barbo. All'altra estremità del tubo, inserire un connettore Luer maschio-barbo.
- Espensare il mezzo 1 dalla siringa fino a quando il tubo a monte non è interamente riempito con il mezzo.
- Procedere con i passaggi 4.3-4.11 di cui sopra, caricando entrambe le siringhe in pompe a siringa separate e solo il mezzo di erogazione 1.
- Impostare la portata della pompa della siringa per il mezzo 1 e la frequenza di raccolta delle frazioni e avviare entrambe le macchine contemporaneamente per iniziare l'esperimento.
- Quando la sorgente del mezzo deve essere sostituita, arrestare rapidamente la pompa della siringa per il mezzo 1, ruotare il rubinetto chiuso al mezzo 1 e avviare la pompa della siringa per il mezzo 2. Se lo si desidera in seguito, riportare la sorgente al medio 1 in modo simile.
- Raccogli le frazioni per la durata dell'esperimento desiderata.
6. Impostare il sistema di perfusione con un serbatoio agitato per imitare la farmacocinetica
- Ottenere dati farmacocinetici per il farmaco di interesse e assicurarsi che consista in un picco di concentrazione seguito da un decadimento esponenziale.
- Dopo aver impostato il picco sul tempo 0 e aver rimosso i punti dati prima del picco, utilizzare lo script Stirred_Tank_Fit.m (file supplementare 6) per adattare l'equazione RTD del serbatoio agitato ai dati. Immettere v (la portata di perfusione desiderata) e i dati da inserire come coppia di vettori direttamente nello script, insieme a t e C rispettivamente per i valori temporali e i valori di concentrazione. Eseguire lo script per stampare il parametro V, che è il volume del serbatoio agitato richiesto.
- Pianificare un layout per il sistema di perfusione in modo da includere due pompe a siringa e uno shaker a piastre a monte dell'incubatore.
- Misurare gli RTD dei componenti del sistema di perfusione oltre il rubinetto di arresto ed eseguire la convoluzione del segnale degli RTD con varie durate e concentrazioni di impulsi farmacologici per trovare un profilo farmacocinetico appropriato. Utilizzare l'equazione RTD del serbatoio agitato adatta in questo calcolo.
- Procedere con i passaggi 5.1-5.8 precedenti.
- Utilizzare una piastra aggiuntiva del pozzo di dimensioni appropriate come serbatoio agitato per la configurazione. Ogni pozzo può servire come serbatoio agitato per una coltura perfusa. Riempire il pozzetto con il volume richiesto di mezzo, V, e tappare il pozzetto con gli aghi inizialmente tirati verso l'alto, quindi spinti sul fondo del pozzo e tappare gli aghi.
- Caricare le siringhe nelle pompe a siringa e collegare rapidamente il tubo dalle siringhe agli aghi di ingresso tappati dei serbatoi agitati. Quindi collegare le prese del tubo a monte della coltura cellulare agli aghi di uscita dei serbatoi agitati.
- Procedere con i passaggi 5.9-5.10.
- Al momento desiderato, passare al mezzo di erogazione 2 contenente il farmaco, come descritto nel passaggio 5.11. Tornare al mezzo 1 quando l'infusione del farmaco è completa.
- Procedere con il passaggio 5.12.
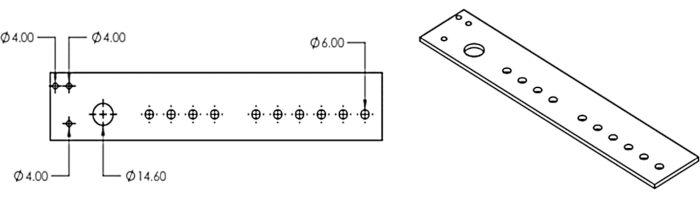
Figura 3: Il distributore multitesta. Design per il dispenser multitesta tagliato al laser. Questa cifra è stata modificata da Erickson et al.11. Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Il sistema di perfusione con più sorgenti medie della sezione 5 del protocollo è stato utilizzato per misurare le dinamiche di espressione di un gene reporter guidato dal fattore nucleare kappa-light-chain-enhancer del fattore di trascrizione delle cellule B attivate (NF-κB) nelle cellule del rene embrionale umano 293 (HEK293) in risposta a un impulso di 1,5 ore del fattore di necrosi tumorale alfa (TNF-α). Le cellule HEK293 sono state stabilmente trasdotte utilizzando vettori lentivirali con un costrutto genico cont...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo lavoro descrive l'assemblaggio e il funzionamento di un sistema di coltura cellulare a perfusione con più sorgenti medie dimostrate con un esempio specifico in cui sono state misurate le dinamiche dell'espressione genica guidata da NF-κB in risposta a un impulso transitorio di TNF-α. Gli RTD dei componenti del sistema di perfusione sono stati misurati e modellati e la convoluzione del segnale è stata utilizzata per prevedere sia l'esposizione delle cellule all'impulso TNF-α sia la distribuzione TNF-α nelle f...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questa ricerca è stata condotta con il supporto di Grant Nos. R01EB012521, R01EB028782 e T32 GM008339 del National Institutes of Health.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
Riferimenti
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153(2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305(2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673(2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213(2021).
- Saltzman, W. M. Drug Delivery: Engineering Principles for Drug Therapy. , Oxford University Press. (2001).
- Fogler, H. S. Elements of Chemical Reaction Engineering. 4th edn. , Prentice Hall PTR. Boston. (2006).
- Conesa, J. A. Chemical Reactor Design: Mathematical Modeling and Applications. , Wiley. (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615(2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon