Method Article
Sviluppo di modelli di Drosophila melanogaster per l'imaging e il controllo optogenetico della funzione cardiaca
In questo articolo
Riepilogo
Il presente protocollo descrive la generazione di Drosophila melanogaster che esprime le opsine eNpHR2.0 o ReaChR nel cuore per l'imaging OCT e la stimolazione cardiaca optogenetica. Sono riportate istruzioni dettagliate per l'imaging OCT di Drosophila e la modulazione del battito cardiaco, compresa la simulazione di arresto cardiaco ripristinabile, bradicardia e tachicardia in animali vivi in diversi stadi di sviluppo.
Abstract
L'utilizzo di Drosophila melanogaster (moscerino della frutta) come organismo modello ha assicurato progressi significativi in molte aree della scienza biologica, dall'organizzazione cellulare e dalle indagini genomiche agli studi comportamentali. A causa delle conoscenze scientifiche accumulate, negli ultimi anni, la Drosophila è stata portata nel campo della modellazione delle malattie umane, compresi i disturbi cardiaci. Il lavoro presentato descrive il sistema sperimentale per il monitoraggio e la manipolazione della funzione cardiaca nel contesto di un intero organismo vivo utilizzando la luce rossa (617 nm) e senza procedure invasive. Il controllo sul cuore è stato ottenuto utilizzando strumenti optogenetici . L'optogenetica combina l'espressione di opsine transgeniche sensibili alla luce e la loro attivazione ottica per regolare il tessuto biologico di interesse. In questo lavoro, è stato utilizzato un sistema personalizzato di tomografia a coerenza ottica integrata (OCT) e di stimolazione optogenetica per visualizzare e modulare il funzionamento del cuore di D. melanogaster al 3 ° stadio di sviluppo larvale e precoce della pupa. Il doppio sistema genetico UAS/GAL4 è stato impiegato per esprimere halorhodopsina (eNpHR2.0) e channelrhodopsin (ReaChR), in particolare nel cuore di mosca. Vengono forniti dettagli sulla preparazione di D. melanogaster per l'imaging OCT vivo e la stimolazione optogenetica. Un software di integrazione sviluppato in laboratorio ha elaborato i dati di imaging per creare presentazioni visive e caratteristiche quantitative della funzione cardiaca della Drosophila . I risultati dimostrano la fattibilità di iniziare l'arresto cardiaco e la bradicardia causati dall'attivazione di eNpHR2.0 e di eseguire la stimolazione cardiaca all'attivazione di ReaChR.
Introduzione
Alla fine del 2010, la rivista Nature Methods ha selezionato l'optogenetica come Metodo dell'Anno1. L'utilizzo di strumenti genetici (opsine transgeniche) regolate dalla luce per controllare i tessuti biologici di interesse con precisione e velocità senza precedenti ha aperto una porta a nuove applicazioni. Ad oggi, la maggior parte dei risultati appartiene alle neuroscienze. La tecnologia è stata introdotta come un nuovo metodo di controllo preciso dei singoli neuroni2 ed è avanzata alle scoperte nell'area delle funzioni cognitive dell'organismo vivo3. Fin dall'inizio, i neuroscienziati hanno dimostrato la capacità di modulare il comportamento dell'intero organismo. L'espressione e l'attivazione della luce dell'opsina ChR2 nei topi neuroni dopaminergici hanno causato la loro attivazione e sono stati sufficienti a guidare il condizionamento comportamentale4. L'inibizione optogenetica di un sottogruppo di neuroni contenenti halorhodopsin NpHR2.0 consegnati al focolaio epilettico del cervello dei roditori ha determinato l'attenuazione delle crisi elettroencefalografiche5.
Le applicazioni optogenetiche in cardiologia si stanno sviluppando a un ritmo costante6. ChR2 è stato espresso con successo in colture cellulari di cardiomiociti e nei topi; La stimolazione cardiaca è stata condotta mediante lampi di luce blu (eseguiti utilizzando una fibra impiantata in animali vivi)7. Nel pesce zebra, ChR2 è stato espresso e utilizzato per identificare la regione cardiaca che fa il passo; L'attivazione di NpHR ha indotto l'arresto cardiaco8. Il pacing cardiaco optogenetico ha il potenziale unico per lo sviluppo di nuove terapie di stimolazione e risincronizzazione9. Recentemente sono stati segnalati anche tentativi di stabilire un sistema di terminazione dell'aritmia autogena10.
La ricerca approfondita e lo sviluppo di nuovi trattamenti terapeutici richiedono l'applicazione di vari sistemi modello, dalla coltura cellulare ai mammiferi. Il cuore di un vertebrato è un organo molto complesso. I cardiomiociti (CM) comprendono un terzo di tutte le cellule cardiache; Altre cellule includono neuroni, cellule muscolari lisce vascolari e cellule non eccitabili (cioè cellule endoteliali, fibroblasti e cellule immunitarie). La ricerca sulla coltura cellulare CM limita la traduzione dei risultati ottenuti in applicazioni mediche umane. Le manipolazioni genetiche degli organismi modello di mammiferi sono limitate e richiedono molto tempo. I modelli di invertebrati più piccoli hanno molti vantaggi; Il loro sistema cardiovascolare trasporta tutti gli elementi istologici essenziali. Drosophila melanogaster (moscerino della frutta) è un sistema modello genetico semplice e potente per studiare il ruolo dei geni associati alle malattie umane, comprese le malattie cardiache11,12,13. Come animali di breve durata, i moscerini della frutta rappresentano un'eccellente opportunità per modellare i cambiamenti della funzione cardiaca dipendenti dall'età o dalla malattia che possono essere rintracciati per tutta la vita14,15,16,17. Il tubo cardiaco del moscerino della frutta si trova sul lato dorsale del suo corpo entro 200 μm dalla superficie della cuticola, consentendo alla luce visibile al vicino infrarosso di raggiungere il tubo cardiaco. Questa caratteristica anatomica consente la stimolazione ottica non invasiva del cuore di Drosophila utilizzando strumenti optogenetici esistenti.
Per monitorare il cuore di Drosophila, è stato sviluppato un sistema di imaging personalizzato per la tomografia a coerenza ottica (SD-OCT) con un modulo di eccitazione LED a luce rossa integrato18. I cambiamenti morfologici e ritmici in un cuore di moscerino della frutta relativamente semplice possono essere facilmente analizzati con questa tecnologia di imaging biomedico non invasiva 12,19,20,21. Con prestazioni di sezionamento ottico migliorate e risoluzione spaziale su scala micron, OCT è stato utilizzato con successo per studiare la struttura e monitorare la funzione del cuore di Drosophila in diversi stadi di sviluppo, tra cui la larva 3rd instar e la pupa18 precoce. Questo sistema consente inoltre il monitoraggio simultaneo e la stimolazione delle condizioni cardiache della Drosofila nell'animale intatto. Una vista schematica del sistema dello Strumento di personalizzazione di Office è illustrata nella Figura 1. Il sistema SD-OCT utilizza un diodo superluminescente (SLD) come sorgente luminosa (lunghezza d'onda centrale: 850 nm ± 10 nm, FWHM: 165 nm, vedi Tabella dei materiali). Utilizzando una lente obiettivo 10x, il sistema di imaging OCT può raggiungere una risoluzione assiale di ~4,4 μm in aria e ~3,3 μm in tessuto e una risoluzione laterale di ~2,8 μm, sufficiente per risolvere i dettagli fini delle strutture cardiache della mosca 18,22. I segnali di interferenza della luce riflessa dal braccio di riferimento e dal braccio campione vengono rilevati utilizzando uno spettrometro con una telecamera a scansione lineare da 2048 pixel (velocità massima di linea: 80 kHz, vedere Tabella dei materiali). La sensibilità del sistema misurata è ~ 95,1 dB. Ogni scansione dello Strumento di personalizzazione di Office in modalità B genera un'immagine in sezione trasversale nel piano dell'immagine xz. Le immagini ripetute in modalità B vengono acquisite nella stessa posizione per creare immagini in modalità M che catturano il cuore pulsante per oltre ~ 30 s 18,22,23. Il frame rate per l'imaging M-mode è ~ 125 fotogrammi / s, sufficiente per catturare le dinamiche del battito del cuore del moscerino della frutta.
Per la regolazione optogenetica della funzione cardiaca della Drosophila , un modulo di illuminazione con una sorgente luminosa a LED da 617 nm è integrato con il braccio campione del sistema SD-OCT. La luce di stimolazione è focalizzata su un punto di ~ 2,2 mm di diametro sulla superficie del campione, nella stessa posizione del punto di messa a fuoco dell'imaging. Un software personalizzato viene utilizzato per controllare la modalità di illuminazione (intensità della luce, larghezza dell'impulso e duty cycle), regolare la frequenza di stimolazione dell'impulso luminoso e sincronizzare l'illuminazione del modulo LED e l'acquisizione dell'imaging OCT M-mode22.
Recenti pubblicazioni hanno descritto il sistema transgenico Drosophila costituito da opsine ChR2, ReaChR ed eNpHR2.0 regolate spaziotemporalmente utilizzando il sistema genetico UAS / GAL4. I risultati ottenuti hanno dimostrato la capacità di iniziare l'arresto cardiaco e la bradicardia causati dall'attivazione della luce rossa di eNpHR2.0 e la stimolazione cardiaca ad alta frequenza causata dall'attivazione della luce blu di ChR2. Esperimenti di stimolazione simili sono stati eseguiti con un'altra channelrhodopsin, ReaChR, inducibile dall'illuminazione a luce rossa22,23,24. L'espressione di opsina in tutti gli esperimenti descritti è stata guidata da 24B-GAL4, dove l'espressione di opsina è stata osservata in una vasta gamma di tessuti, inclusi cardiomiociti e cellule muscolari circostanti. Nel presente studio, 24B-GAL4 è stato sostituito da un driver Hand-GAL4 per ottenere l'espressione delle opsine eNpHR2.0 e ReaChR specifiche per il cuore.
Nel complesso, i risultati sperimentali presentati dimostrano arresto cardiaco ripristinabile e condizioni cardiache inducibili di bradicardia e tachicardia. Viene fornito un protocollo dettagliato con istruzioni dettagliate sulla creazione di modelli transgenici di Drosophila e sulla conduzione simultanea di esperimenti di imaging OCT e stimolazione optogenetica in animali vivi.
Protocollo
Per il presente studio, la linea transgenica eNpHR2.0 w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2, linea transgenica ReaChR w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO, e driver GAL4 cuore-specifico contenente il frammento regolatore del gene della mano w[1118]; Sono stati utilizzati P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] (questo driver stock sarà indicato come Hand-GAL4). y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 è stato utilizzato come linea reporter GFP. Le scorte di Drosophila menzionate sono state ottenute dal Bloomington Drosophila Stock Center (BDSC, vedi Tabella dei materiali) e mantenute a temperatura ambiente o a 18 °C su terreni standard di farina di mais. I modelli di Drosophila sviluppati in questo studio sono disponibili su richiesta per il lavoro collaborativo.
1. Incroci genetici della Drosophila e preparazione dei media
- Cambiare il terzo bilanciatore cromosomico TM3 Sb[1 ] in TM6 Sb Tb, creando w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM6 Sb Tb (Hand-GAL4/TM6 Sb Tb). Si veda la figura supplementare 1 per lo schema di attraversamento. Impostare le croci in flaconcini con supporti regolari di farina di mais.
NOTA: La presenza di un marcatore Tb consente agli utenti di distinguere larve e pupe contenenti opsina transgene e il driver GAL4 da animali contenenti opsina ma nessun driver25. - Tenere gli incroci genetici in un incubatore a 25 °C, 70% di umidità su terreni contenenti tutta la retina trans (ATR) appositamente formulati (vedi Tabella dei materiali) al buio per 5 giorni per la raccolta delle larve e 6 giorni per la raccolta delle pupe.
- Combinare cinque femmine vergini Hand-GAL4 /TM6 Sb Tb e due o tre maschi provenienti da stock di UAS-opsina (eNpHR2.0 o ReaChR) per flaconcino. Vedere il diagramma incrociato per eNpHR2.0 e ReaChR opsin rispettivamente nella Figura 2A e nella Figura 2B.
- Il giorno successivo, preparare le fiale contenenti ATR.
- Preparare alimenti semidefiniti secondo le istruzioni del BDSC26. Invece di saccarosio e glucosio, aggiungere solo saccarosio (5,14 g/100 ml). Raffreddare a ~60 °C con agitazione costante.
- Preparare flaconcini di mosca stretti e aggiungere 50 μL di soluzione di etanolo ATR da 100 mM a ciascun flaconcino.
- Utilizzando una pipetta sierologica, smaltire il cibo per mosche in flaconcini di mosca stretti, 5 ml per flaconcino. Vortice alla massima velocità per 10 s.
- Collegare i flaconcini e avvolgerli nel tessuto scuro per proteggerli dalla luce. Lasciare asciugare i flaconcini per almeno 12 ore (durante la notte).
- Il giorno successivo, trasferire le mosche che depongono costantemente le uova dal passaggio 1.3. ai flaconcini con alimento contenente ATR (Fase 1.4.4.). Proteggere i rack con flaconcini dalla luce.
- Dopo 24-48 ore (a seconda del numero di uova deposte), scartare i genitori per evitare la sovrappopolazione della fiala.
- Raccogliere la progenie non-Tb e usarli per l'imaging cardiaco.
NOTA: Le differenze fenotipiche negli stadi larvale e pupale sono dimostrate nella Figura 2C. Il riepilogo e la sequenza temporale approssimativa delle fasi di preparazione del campione sono mostrati nella Figura 3.
2. Controllo optogenetico del cuore di Drosophila
- Prelevare la larva/pupa UAS-opsin/Hand-GAL4 dalla fiala (Passo 1.7.), mettere su un fazzoletto e rimuovere delicatamente il supporto dalla superficie del corpo usando un pennello per pittura.
- Preparare il vetrino del microscopio e posizionare un piccolo pezzo di nastro biadesivo nel mezzo.
- Usando un pennello o una pinzetta sottile, posizionare delicatamente la larva/pupa sulla superficie del nastro con il lato dorsale verso l'alto e perpendicolare al lato lungo del vetrino. Applicare una leggera pressione per attaccare la larva / pupa alla superficie del nastro.
- Impostare il vetrino sul palco di imaging, larva / pupa rivolta verso il basso.
- Accendere la sorgente luminosa OCT tramite il software di controllo laser (vedere Tabella dei materiali). Aprire il software di controllo SD-OCT personalizzato, quindi fare clic sulla finestra Anteprima .
- Impostare i parametri di scansione nel software SD-OCT.
NOTA: l'obiettivo è quello di allineare il campione per un'immagine ottimale del cuore pulsante, quindi selezionando l'intervallo X e l'intervallo Y copre la regione del cuore. In questa fase, sia il numero di scansioni A che di scansioni B sono 400. L'intervallo nelle direzioni x e y è ~490 μm e ~537 μm, mostrando rispettivamente le due sezioni trasversali ortogonali del cuore (xz e yz). - Utilizzare micromanipolatori per controllare la fase del campione per mettere a fuoco il cuore della mosca. Regolare la posizione focale per ridurre al minimo il riflesso della luce dalla superficie della cuticola della mosca. Prendi in considerazione l'applicazione di olio minerale sulla superficie della larva / pupa per ridurre al minimo la riflessione.
NOTA: L'olio può aumentare il rischio di movimento degli animali compromettendo le proprietà adesive del nastro. - Assicurarsi che il cuore di mosca possa essere completamente visualizzato nella finestra dell'immagine senza distorsioni, essendo bloccato dal tessuto e da ombre e riflessi non trascurabili; in caso contrario, tornare al passaggio 2.7.
- Impostare i parametri di scansione per l'acquisizione dell'immagine OCT in modalità M.
NOTA: il numero di scansioni A è ridotto rispetto al passaggio 2.7. per il frame rate più veloce per catturare le dinamiche di battito del cuore di mosca (diversi Hz). Il numero di scansioni B indica il numero di fotogrammi ripetuti per l'imaging M-mode, che può essere regolato in base al tempo di registrazione e alla memoria di sistema disponibile. In questo esperimento, 128 scansioni A possono consentire una velocità di ~ 125 fotogrammi / s e vengono registrate 4.000 scansioni B ripetute, fornendo una registrazione continua di ~ 32 s. - Acquisisci cinque serie di dati di controllo senza impulsi di stimolazione della luce rossa per calcolare la frequenza cardiaca a riposo (RHR).
- Progettare l'impulso luminoso per la stimolazione della stimolazione nel software di controllo OCT personalizzato. In "Impostazioni", aggiungi le sequenze di impulsi luminosi progettate per controllare la frequenza dell'impulso, la larghezza dell'impulso, la durata della stimolazione e il tempo di attesa in base ai diversi protocolli di stimolazione.
NOTA: L'RHR viene misurato dall'esperimento di controllo senza illuminazione della luce e utilizzato per calcolare la frequenza alla quale la luce deve essere pulsata per gli esperimenti di tachipacing e bradypacing22. - Aprire il software del controller della luce (vedere Tabella dei materiali) per generare impulsi di luce rossa. Scegli la modalità Pulse in "Mode Selection". Fai doppio clic sulla figura per le impostazioni "Profilo impulso" e scegli Modalità follower. Mantenere l'intensità OFF come 0 e impostare la percentuale di intensità ON al momento del calcolo della densità di potenza effettiva.
NOTA: gli impulsi luminosi di stimolazione vengono attivati da un segnale proveniente dal software di controllo dello Strumento di personalizzazione di Office in base alle impostazioni del punto 2.12. - Acquisisci video in modalità M del cuore pulsante della Drosophila con la stimolazione della luce facendo clic su Acquisisci nel software di controllo OCT. Ripetere le misurazioni 5x.
3. Analisi delle immagini
- Apri il software di segmentazione del cuore di mosca sviluppato su misura.
- Fare clic su Seleziona file e quindi selezionare il file da analizzare nella GUI che appare.
- Immettere i limiti verticali e orizzontali della regione del cuore in pixel nelle caselle di testo superiori. Fare clic su Ridimensiona. Utilizzando il cursore in basso, assicurarsi che l'intera regione del cuore sia visibile e che riempia l'intera casella per l'intera collezione. In caso contrario, ripetere questo processo e regolare i limiti.
- Fare clic su Prevedi per prevedere la regione del cuore. Il programma passerà ora attraverso ogni fetta della collezione e selezionerà la regione del cuore, impiegando circa 3 minuti.
- Clicca su HR Plot una volta completata la previsione. Si aprirà una nuova finestra che mostra un grafico dell'area del cuore nel tempo. Assicurarsi che siano selezionate le aree di picco o valle corrette. Scegli Pulse e poi HR per generare una figura finale e i parametri funzionali verranno salvati contemporaneamente nei file .csv.
Risultati
D. melanogaster animali che esprimono opsine sensibili alla luce rossa eNpHR2.0 o ReaChR nel tubo cardiaco sono stati generati ottenendo progenie dall'incrocio tra ciascuna linea transgenica UAS-opsin e il driver Hand-GAL4 . La specificità tissutale del driver GAL4 è stata verificata mediante imaging dell'espressione GFP (Figura 4). La larva 3rd instar di Drosophila e le prime fasi di sviluppo della pupa sono state utilizzate per dimostrare gli effetti dell'attivazione di eNpHR2.0 e ReaChR tramite luce rossa. Progettato ~ 617 nm impulsi di luce rossa, erogati da LED, hanno illuminato la larva / pupa e attivato l'eNpHR2.0 e ReaChR nel cuore. Sebbene la lunghezza d'onda massima di risposta riportata di NpHR sia ~ 580 nm e di ReaChR sia ~ 600 nm, l'illuminazione della luce di 617 nm può penetrare più in profondità con una maggiore erogazione di energia luminosa verso il tessuto cardiaco che esprime opsina22.
Montata sul vetrino del microscopio con il lato dorsale verso il basso nella configurazione del microscopio invertito, la larva / pupa è stata illuminata da un fascio di luce a LED diretto al segmento del corpo A7. Esempi di immagini della sezione trasversale del corpo sono mostrati nella Figura 5A e nella Figura 6A. Il cuore appare come una forma circolare contrazione e dilatazione nelle registrazioni video composte da 4.000 fotogrammi (Video supplementari 1-6). Per imitare diverse condizioni cardiache, sono stati progettati quattro tipi di impulsi luminosi. Un singolo impulso della durata di 10 s dopo 5 secondi di attesa ha generato un arresto cardiaco ripristinabile indotto da eNpHR2.0, come mostrato nella Figura 5B. Per il ritmo cardiaco a frequenze più lente della frequenza cardiaca a riposo (RHR), mediata da eNpHR2.0, sono state utilizzate due sequenze di impulsi luminosi con frequenze di stimolazione pari a RHR/2 e RHR/4 della durata di 8 s con un tempo di attesa di 6 s in mezzo (Figura 5C). Il ciclo di lavoro di ciascuna sequenza di impulsi luminosi era del 90%. Questo regime di stimolazione della luce ha causato una condizione cardiaca che ricorda la bradicardia. Il modello di stimolazione per aumentare la frequenza cardiaca dovuta all'attivazione di ReaChR consisteva in tre sequenze di impulsi luminosi a frequenze di RHR + 0,5 Hz, RHR + 1 Hz e RHR + 1,5 Hz, rispettivamente, con una larghezza di impulso di 20 ms (Figura 5D). Questo regime di impulsi aveva lo scopo di causare una condizione cardiaca tachicardica. La densità di potenza luminosa è stata di 7,49 mW/mm2 durante tutti gli esperimenti. Per gli esperimenti di controllo, non è stata impostata alcuna illuminazione luminosa.
Ogni variante sperimentale è stata registrata cinque volte. I video M-mode del cuore di mosca sono stati elaborati in maschere 2D utilizzando FlyNet 2.027. Questo software segmenta automaticamente la regione cardiaca per produrre i set di dati sulla funzione cardiaca. Il programma fornisce una maschera del cuore in ogni fotogramma, che può essere ulteriormente corretta manualmente, se necessario, per generare una quantificazione accurata dei parametri funzionali del cuore pulsante, come la frequenza cardiaca (HR), la dimensione diastolica finale (EDD) e la dimensione sistolica finale (ESD), l'accorciamento frazionario (FR), l'area diastolica finale (EDA), l'area sistolica finale (ESA), ecc. La frequenza cardiaca viene misurata analizzando l'area cardiaca nel tempo. Il video di controllo senza impulsi luminosi viene utilizzato per stabilire una frequenza cardiaca di base (ad esempio, RHR) per ciascun animale.
La Figura 5B e la Figura 6B mostrano un arresto cardiaco lungo 10 s causato dall'attivazione manuale > eNpHR2.0 utilizzando luce rossa (617 nm) rispettivamente nella larva e nella pupa. Quando la luce rossa fu accesa, il cuore della Drosofila smise di battere e rimase in questo stato fino alla fine dell'illuminazione della luce. La funzione cardiaca è stata ripristinata dopo che la luce rossa è stata spenta. Gli animali che non avevano espresso opsina (controllo "no opsin") non rispondevano all'illuminazione a luce rossa (figura supplementare 2A e figura supplementare 3A). Gli esperimenti di controllo con animali Hand>eNpHR2.0 in cui l'illuminazione a luce rossa di 10 s non era accesa (controllo "senza luce") hanno mostrato che il cuore batteva normalmente (Figura supplementare 4A e Figura supplementare 4C).
Utilizzando animali Hand>eNpHR2.0, sono stati applicati impulsi di luce rossa a frequenze inferiori al RHR. La frequenza di contrazione cardiaca è stata ridotta in seguito ai segnali luminosi; questa frequenza cardiaca più lenta imita un tipo di aritmia cardiaca, la bradicardia (Figura 5C e Figura 6C per larva e pupa, rispettivamente). La stimolazione cardiaca più lenta non è stata osservata negli esperimenti di controllo "no opsin" (Figura supplementare 2B e Figura supplementare 3B) e in "nessuna luce" (Figura supplementare 4A e Figura supplementare 4C).
L'aumento della frequenza cardiaca può essere ottenuto attivando l'opsina Hand>ReaChR con treni a impulsi a luce rossa a una frequenza superiore all'RHR dell'animale dato. Una serie di tre treni di impulsi luminosi a diverse frequenze di stimolazione (ad esempio, RHR + 0,5 Hz, RHR + 1 Hz, RHR + 1,5 Hz) sono stati applicati su larve e cuori di pupe Hand>ReaChR. I dati ottenuti mostrano chiaramente un aumento della frequenza cardiaca dopo gli impulsi luminosi (Figura 5D e Figura 6D per larva e pupa, rispettivamente). La condizione cardiaca dimostrata in questi esperimenti imita la tachicardia. Gli esperimenti di controllo negativo sono mostrati nella Figura supplementare 2C, nella Figura supplementare 3C e nella Figura supplementare 4B,D.
Nel complesso, i risultati dimostrano la fattibilità di un controllo optogenetico non invasivo e specifico del ritmo cardiaco in varie fasi di sviluppo in modelli animali transgenici di D. melanogaster.
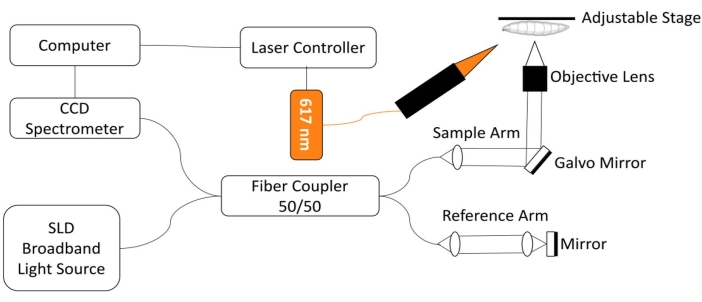
Figura 1: Sistema di imaging OCT integrato con modulo LED 617 nm per il controllo optogenetico della funzione cardiaca di Drosophila. Fare clic qui per visualizzare una versione ingrandita di questa figura.
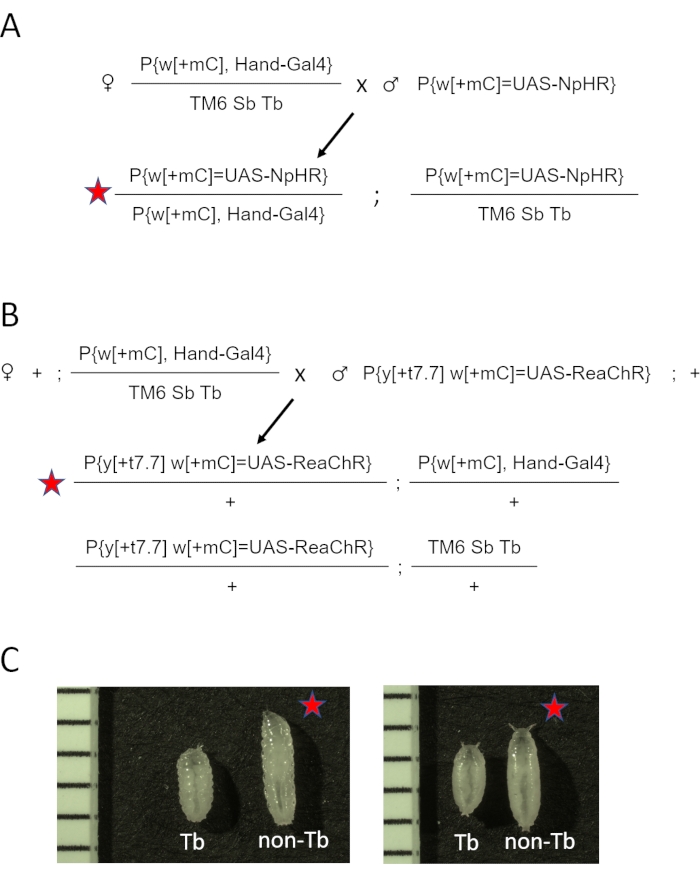
Figura 2: Generazione di animali D. melanogaster che esprimono opsina nel cuore. (A) Diagramma incrociato genetico. Le femmine Hand-GAL4/TM6 SbTb sono state incrociate con maschi portatori di eNpHR2.0. La progenie Hand-GAL4/eNpHR2.0 risultante (contrassegnata dalla stella rossa) è stata raccolta per l'imaging OCT e Hand-GAL4/TM6 Sb Tb è stata scartata in base al loro aspetto fenotipico. (B) Diagramma incrociato genetico. Le femmine Hand-GAL4/TM6 SbTb sono state incrociate con maschi portatori di ReaChR. La progenie Hand-GAL4/ReaChR risultante (contrassegnata dalla stella rossa) è stata raccolta per l'imaging OCT e Hand-GAL4/TM6 Sb Tb è stata scartata in base al loro aspetto fenotipico. (C) Differenze fenotipiche tra la progenie della Tb Hand-GAL4/opsin (stella rossa) e della Tb Hand-GAL4/TM6. Gli animali portatori della mutazione del gene Tb sul cromosoma TM6 hanno una forma del corpo "tubby" rispetto alla normale larva o alla pupa non Tb. Il pannello di sinistra mostra le larve; Il pannello di destra mostra le prime pupe. Le immagini includono anche un righello con segni di 1 mm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
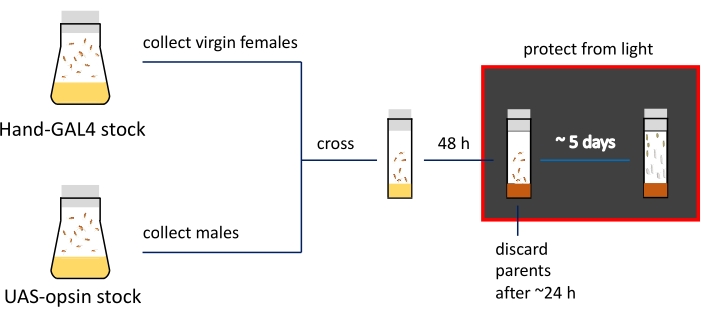
Figura 3: Presentazione schematica e sequenza temporale delle procedure di preparazione delle immagini. Le scorte parentali sono conservate in bottiglie da mosca; Le femmine e i maschi vergini sono incrociati in fiale strette piene di cibo normale (indicato dal colore giallo). Le mosche che depongono attivamente le uova vengono trasferite su supporti contenenti ATR (mostrati in flaconcini marroni). Le fiale con progenie in via di sviluppo devono essere tenute all'oscuro da questo passaggio. Le larve del 3 ° stadio e la pupa precoce vengono raccolte dalle pareti della fiala per l'imaging. Fare clic qui per visualizzare una versione ingrandita di questa figura.
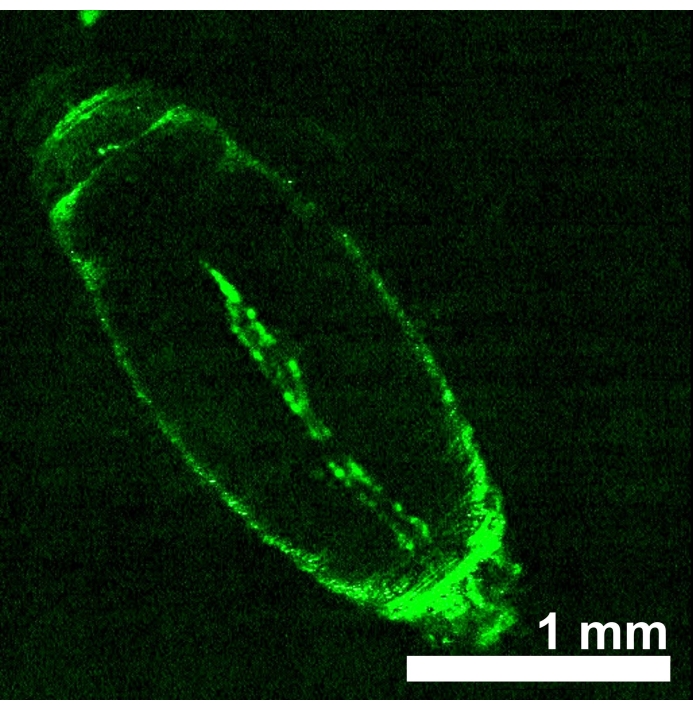
Figura 4: Pupa precoce di D. melanogaster che esprime UAS-GFP (BDSC 6658) guidata da Hand-GAL4 (BDSC 48396). Il modello di fluorescenza conferma la specificità cardiaca del driver Hand-GAL4 . Fare clic qui per visualizzare una versione ingrandita di questa figura.
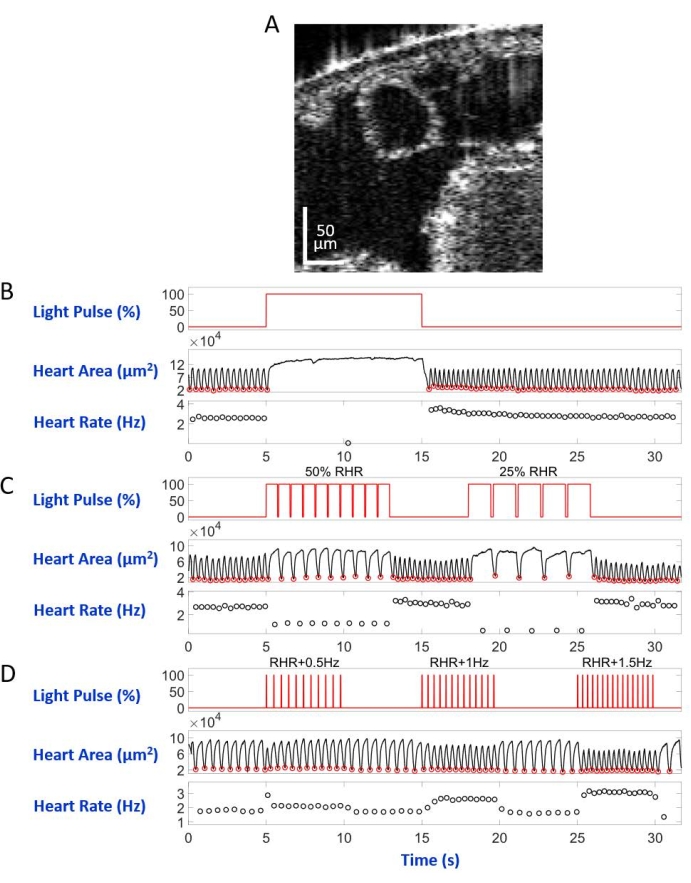
Figura 5: Simulazione di arresto cardiaco, bradicardia e tachicardia nella larva di D. melanogaster. (A) Immagine PTOM di una sezione trasversale del corpo larvale. Il cuore appare come un cerchio sotto la superficie del corpo. (B) Presentazione grafica dell'arresto cardiaco ripristinabile. Il pannello superiore mostra la temporizzazione (asse X) dell'illuminazione a luce rossa (asse Y, percentuale del livello di potenza della sorgente luminosa). Il pannello centrale indica la variazione dell'area cardiaca (asse Y, micrometri quadrati) nel tempo (asse X). Il pannello inferiore mostra la variazione della frequenza cardiaca (asse Y, hertz) nel tempo (asse X). (C) Presentazione grafica della bradicardia ripristinabile mediata da eNpHR2.0. Il pannello superiore mostra impulsi dell'illuminazione a luce rossa, inducendo due periodi di bradicardia: 50% della RHR e 25% della RHR. L'area cardiaca e le variazioni della frequenza cardiaca sono mostrate rispettivamente sui pannelli centrale e inferiore. (D) Presentazione grafica della stimolazione cardiaca mediante ReaChR attivato. Il pannello superiore mostra una serie di impulsi di luce rossa di 20 ms che si verificano alle frequenze RHR + 0,5 Hz, RHR + 1 Hz e RHR + 1,5 Hz. Le contrazioni cardiache seguono le frequenze degli impulsi luminosi, come mostrato sui pannelli centrale e inferiore. Fare clic qui per visualizzare una versione ingrandita di questa figura.
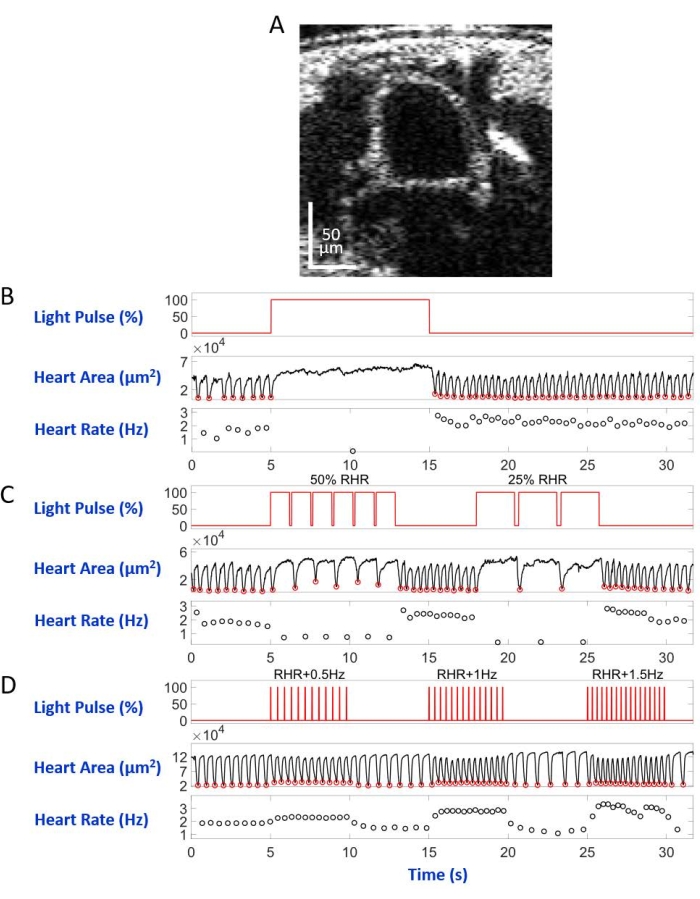
Figura 6: Simulazione di arresto cardiaco, bradicardia e tachicardia nella pupa di D. melanogaster. (A) Immagine OCT della sezione trasversale del corpo pupale. Il cuore appare come un cerchio sotto la superficie del corpo. (B) Presentazione grafica dell'arresto cardiaco ripristinabile. Il pannello superiore mostra la temporizzazione (asse X) dell'illuminazione a luce rossa (asse Y, percentuale del livello di potenza della sorgente luminosa). Il pannello centrale indica la variazione dell'area cardiaca (asse Y, micrometri quadrati) nel tempo (asse X). Il pannello inferiore mostra la variazione della frequenza cardiaca (asse Y, hertz) nel tempo (asse X). (C) Presentazione grafica della bradicardia ripristinabile mediata da eNpHR2.0. Il pannello superiore mostra impulsi dell'illuminazione a luce rossa, inducendo due periodi di bradicardia: 50% della RHR e 25% della RHR. I pannelli centrale e inferiore mostrano rispettivamente l'area cardiaca e le variazioni della frequenza cardiaca. (D) Presentazione grafica della stimolazione cardiaca mediante ReaChR attivato. Il pannello superiore mostra una serie di impulsi di luce rossa di 20 ms alle frequenze RHR + 0,5 Hz, RHR + 1 Hz e RHR + 1,5 Hz. Le contrazioni cardiache seguono le frequenze dell'impulso luminoso, come mostrato sui pannelli centrale e inferiore. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Incroci genetici per sostituire il cromosoma bilanciatore TM3 Sb con TM6 Sb Tb. Le femmine vergini Hand-GAL4 w+/ TM3 Sb sono state incrociate con maschi nub-GAL4NP3537 tub-GAL80ts w+/ TM6 Sb Tb. Sono stati selezionati Hand-GAL4 w+/ TM6 Sb Tb, incluse femmine e maschi vergini (screening per occhi pigmentati combinati con la forma del corpo tubby). Le mosche selezionate sono state auto-incrociate per stabilire uno stock stabile. Clicca qui per scaricare questo file.
Figura supplementare 2: Negli esperimenti di controllo, il ritmo cardiaco della larva wild-type (wt) non cambia con l'illuminazione a luce rossa. (A) Nessun arresto cardiaco è stato osservato durante l'illuminazione a luci rosse nella larva di wt. Il pannello superiore mostra le immagini del cuore M-mode. La linea rossa indica i tempi di illuminazione. I pannelli centrale e inferiore mostrano l'area cardiaca e le frequenze cardiache durante il tempo di imaging di 32 s. (B,C) Gli impulsi di luce rossa non modificano le frequenze cardiache nella larva wt. I pannelli superiori mostrano le immagini del cuore M-mode. La linea rossa indica i tempi di illuminazione. I pannelli centrale e inferiore mostrano l'area cardiaca e le frequenze cardiache durante il tempo di imaging di 32 s. Clicca qui per scaricare questo file.
Figura supplementare 3: Negli esperimenti di controllo, il ritmo cardiaco della pupa wild-type (wt) non cambia quando si accende la luce rossa. (A) Nessun arresto cardiaco è stato osservato durante l'illuminazione a luci rosse nella larva di wt. Il pannello superiore mostra le immagini del cuore M-mode. La linea rossa indica i tempi di illuminazione. I pannelli centrale e inferiore mostrano l'area cardiaca e le frequenze cardiache durante il tempo di imaging di 32 s. (B,C) Gli impulsi di luce rossa non cambiano le frequenze cardiache nella pupa wt. I pannelli superiori mostrano le immagini del cuore M-mode. La linea rossa indica i tempi di illuminazione. I pannelli centrale e inferiore mostrano l'area cardiaca e le frequenze cardiache durante il tempo di imaging di 32 s. Clicca qui per scaricare questo file.
Figura supplementare 4: Le larve e le pupe di D. melanogaster che esprimono Hand> eNpHR2.0 o Hand>ReaChR non mostrano cambiamenti significativi della FC durante l'imaging OCT senza illuminazione a luce rossa. (A) La frequenza cardiaca della larva Hand>eNpHR2.0. (B) La frequenza cardiaca della larva Hand>ReaChR . (C) Le frequenze cardiache della pupa Hand>eNpHR2.0. (D) Le frequenze cardiache della pupa Hand>ReaChR . Clicca qui per scaricare questo file.
Video supplementare 1: L'attivazione di eNpHR2.0 provoca un arresto cardiaco nella larva di D. melanogaster. Clicca qui per scaricare questo video.
Video supplementare 2: L'eNpHR2.0 attivato provoca un arresto cardiaco nella pupa di D. melanogaster. Clicca qui per scaricare questo video.
Video supplementare 3: Bradicardia ripristinabile mediata da eNpHR2.0 nella larva di D. melanogaster. Clicca qui per scaricare questo video.
Video supplementare 4: Bradicardia ripristinabile mediata da eNpHR2.0 nella pupa di D. melanogaster. Clicca qui per scaricare questo video.
Video supplementare 5: Stimolazione cardiaca mediante ReaChR attivato nella larva di D. melanogaster. Clicca qui per scaricare questo video.
Video supplementare 6: Stimolazione cardiaca mediante ReaChR attivato nella pupa di D. melanogaster. Clicca qui per scaricare questo video.
Discussione
Rispetto ai nostri precedenti rapporti in cui l'espressione di opsine era guidata non solo nel cuore ma anche nei tessuti muscolari circostanti, il presente lavoro riferisce utilizzando un driver specifico per il cuore, Hand-GAL4. Questa nuova configurazione genetica dell'opsina Hand> utilizzata per la regolazione del cuore optogenetica conferma ulteriormente i risultati precedentemente riportati e stabilisce un migliore modello di ricerca cardiovascolare sulla Drosophila .
La preparazione dei media è essenziale per il successo degli esperimenti. Le proteine Opsin richiedono un ligando, all-trans retinico (ATR), per funzionare28. Le mosche non producono abbastanza ATR, quindi ATR deve essere integrato al mezzo di mosca. In questo studio, il cibo istantaneo precedentemente riportato è stato sostituito con mezzi semidefiniti29. La nuova ricetta dei supporti contenenti ATR è stata introdotta per garantire una distribuzione uniforme di ATR. ATR non è solubile in acqua; quando lo stock di ATR da 100 mM a base di etanolo viene aggiunto ai mezzi a base d'acqua, viene disperso vorticando le fiale contenenti mezzi semidefiniti caldi. Inoltre, la concentrazione di ATR precedentemente riportata è stata ridotta da 10 mM per eNpHR2.0 e 3 mM per ReaChR22 a una concentrazione finale di 1 mM per entrambi. Questa concentrazione è sufficiente per garantire il corretto funzionamento di eNpHR2.0 e ReaChR.
Una componente vitale del successo sperimentale è la migliore elaborazione dei dati con FlyNet 2.027. Il laboratorio ha continuato a sviluppare questo software per migliorare sia l'efficienza computazionale che l'accuratezza dell'algoritmo automatizzato di segmentazione del cuore di mosca. Le maschere in sezione trasversale prodotte da questo software vengono utilizzate per ricavare dati fisiologici di Drosophila come l'accorciamento frazionario e la velocità della parete cardiaca. Questo approccio ha consentito un'analisi efficiente dei dati con una supervisione umana minima, rendendo più rapida e affidabile la caratterizzazione della funzione cardiaca per grandi set di dati di imaging del cuore di mosca.
L'infarto miocardico rimane la principale causa di morte e l'ischemia miocardica contribuisce a due terzi di tutti i casi di insufficienza cardiaca, che sta rapidamente emergendo tra le principali cause di mortalità e morbilità negli Stati Uniti30. Lo sviluppo di nuove terapie e dispositivi medici richiede una profonda conoscenza dei meccanismi dei disturbi cardiaci a livello fisiologico e biochimico. Questi obiettivi possono essere raggiunti con l'aiuto di organismi modello. D. melanogaster si è affermato come uno dei modelli più affidabili ed efficienti 31,32,33,34,35. Questo lavoro ha generato i modelli simulati di disturbi cardiaci della Drosophila indotti da un approccio optogenetico non invasivo. Lo sviluppo di tecnologie di stimolazione cardiaca ottica non invasive fornisce una base per lo sviluppo di un'alternativa ai tradizionali dispositivi elettrici di stimolazione cardiaca. L'utilizzo dell'OCT per osservare la funzione cardiaca in tempo reale consente agli studi di caratterizzare accuratamente la fisiologia cardiaca pertinente nei modelli di Drosophila per indagini avanzate, incluso lo screening dei farmaci candidati. L'imaging OCT ha una profondità di penetrazione di ~ 1 mm, che funziona bene per gli studi sul cuore di Drosophila, ma ne limita l'uso per caratterizzare la funzione cardiaca in modelli animali più grandi. Inoltre, tradurre direttamente la ricerca sulla Drosophila in modelli di mammiferi rappresenta una sfida. Nuovi strumenti optogenetici devono essere sviluppati per migliorare la sensibilità delle opsine e tradurli in vari sistemi modello, tra cui zebrafish, topi, ratti e organoidi cardiaci umani, per la ricerca cardiovascolare.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano Andrey Komarov, Yuxuan Wang e Jiantao Zhu per la loro assistenza nell'analisi dei dati e ringraziano i membri del laboratorio Zhou per le loro preziose discussioni. Il lavoro nel laboratorio del Dr. Zhou è stato sostenuto da un fondo iniziale della Washington University di St. Louis, dalle sovvenzioni del National Institutes of Health (NIH) R01-EB025209 e R01-HL156265 e dal Clayco Foundation Innovative Research Award.
Materiali
| Name | Company | Catalog Number | Comments |
| All-trans retinal | Cayman Chemicals | 18449 | |
| Bacto Peptone | Gibco | 02-10-2025 | |
| BioLED Light Source Control Module, 4-channel | Migtex Systems | BLS-SA04-US | Part of the optogenetic stimulation module |
| Broadband Light Source Module | Superlum | cBLMD-T-850-HP | Part of the SD-OCT imaging system |
| Cobra-S 800 OCT Spectrometers | Wasatch Photonics | CS800-840/180-80-OC2K-U3 | Part of the SD-OCT imaging system |
| Delicate Task Wipers | Kimberly-Clark Professtional | 34155 | tissues |
| Drosophila agar | Genesee Scientific | 66-103 | |
| Drosophila culture bottles | Genesee Scientific | 32-131 | |
| FlyNet 2.0 Software | Z-Lab | Custom software for fly heart segmentation and heart function analysis developed in the Zhou lab | |
| High-Power LED Collimator Sources | Migtex Systems | BLS-LCS-0617-03-22 | Part of the optogenetic stimulation module |
| Inactive dry yeast | Genesee Scientific | 62-106 | |
| Microscope slides | AmScope | BS-72P | |
| Narrow plugs for Drosophila culture | Genesee Scientific | 59-200 | |
| Narrow vials for Drosophila culture | Genesee Scientific | 32-116SB | |
| Permanent double-sided tape | Scotch | ||
| Plugs for Drosophila bottles | Genesee Scientific | 59-194 | |
| Propionic Acid | Sigma | P1386-1L | |
| SD-OCT control software | Z-Lab | Custom software for image acquisition and pacing control developed in the Zhou lab | |
| SD-OCT imaging and optogenetic pacing system | Z-Lab | Imaging and optogenetic pacing system developed in the Zhou lab (~$50k BOM) | |
| Sucrose | Carolina | 89-2871 | |
| w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2 | Bloomington Drosophila Stock Center (BDSC) | stock # 41752 | eNpHR2.0 transgenic line |
| w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO | Bloomington Drosophila Stock Center (BDSC) | stock # 53748 | ReaChR transgenic line |
| w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] | Bloomington Drosophila Stock Center (BDSC) | stock # 48396 | Heart specific GAL4 driver containing Hand gene regulatory fragment |
| y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 | Bloomington Drosophila Stock Center (BDSC) | stock #6658 | GFP reporter line |
| Yeast extract | Lab Scientific bioKEMIX | 978-907-4243 |
Riferimenti
- Nature Methods. Method of the Year 2010. Nature Methods. 8, 1(2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Tsai, H. -C. Phasic firing in dopaminergic neurons is sufficient for behavioral conditioning. Science. 324 (5930), 1080-1084 (2009).
- Wykes, R. C., et al. Optogenetic and potassium channel gene therapy in a rodent model of focal neocortical epilepsy. Science Translational Medicine. 4 (161), (2012).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nature Reviews Cardiology. 18 (5), 349-367 (2021).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Arrenberg, A. B., Stainier, D. Y. R., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Nussinovitch, U., Gepstein, L. Optogenetics for in vivo cardiac pacing and resynchronization therapies. Nature Biotechnology. 33 (7), 750-754 (2015).
- Nyns, E. C. A., et al. An automated hybrid bioelectronic system for autogenous restoration of sinus rhythm in atrial fibrillation. Science Translational Medicine. 11 (481), (2019).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342 (1), 1-11 (2004).
- Wolf, M. J., Amrein, H., Izatt, J. A., Choma, M. A., Reedy, M. C., Rockman, H. A. Drosophila as a model for the identification of genes causing adult human heart disease. Proceedings of the National Academy of Sciences of the United States of America. 103 (5), 1394-1399 (2006).
- Yu, L., Lee, T., Lin, N., Wolf, M. J. Affecting rhomboid-3 function causes a dilated heart in adult Drosophila. PLOS Genetics. 6 (5), 1000969(2010).
- Cooper, A. S., Rymond, K. E., Ward, M. A., Bocook, E. L., Cooper, R. L. Monitoring heart function in larval Drosophila melanogaster for physiological studies. Journal of Visualized Experiments. (33), e1596(2009).
- Zhu, Y. C., Yocom, E., Sifers, J., Uradu, H., Cooper, R. L. Modulatory effects on Drosophila larva hearts: Room temperature, acute and chronic cold stress. Journal of Comparative Physiology. B, Biochemical, Systemic, and Environmental Physiology. 186 (7), 829-841 (2016).
- Zhu, Y. C., Uradu, H., Majeed, Z. R., Cooper, R. L. Optogenetic stimulation of Drosophila heart rate at different temperatures and Ca2+ concentrations. Physiological Reports. 4 (3), 12695(2016).
- Malloy, C., et al. Using optogenetics to assess neuroendocrine modulation of heart rate in Drosophila melanogaster larvae. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology. 203 (10), 791-806 (2017).
- Men, J., et al. Drosophila preparation and longitudinal imaging of heart function in vivo using optical coherence microscopy (OCM). Journal of Visualized Experiments. (118), e55002(2016).
- Choma, M. A., Izatt, S. D., Wessells, R. J., Bodmer, R., Izatt, J. A. In vivo imaging of the adult Drosophila melanogaster heart with real-time optical coherence tomography. Circulation. 114 (2), 35-36 (2006).
- Li, A., et al. Changes in the expression of the Alzheimer's disease-associated presenilin gene in drosophila heart leads to cardiac dysfunction. Current Alzheimer Research. 8 (3), 313-322 (2011).
- Li, A., et al. Silencing of the Drosophila ortholog of SOX5 in heart leads to cardiac dysfunction as detected by optical coherence tomography. Human Molecular Genetics. 22 (18), 3798-3806 (2013).
- Men, J., Li, A., Jerwick, J., Li, Z., Tanzi, R. E., Zhou, C. Non-invasive red-light optogenetic control of Drosophila cardiac function. Communications Biology. 3 (1), 1-10 (2020).
- Alex, A., Li, A., Tanzi, R. E., Zhou, C. Optogenetic pacing in Drosophila melanogaster. Science Advances. 1 (9), 1500639(2015).
- Stanley, C. E., Mauss, A. S., Borst, A., Cooper, R. L. The effects of chloride flux on Drosophila heart rate. Methods and Protocols. 2 (3), 73(2019).
- Lindsley, D. L., Zimm, G. G. The Genome of Drosophila melanogaster. , Elsevier. (1992).
- Bloomington Drosophila Stock Center. , Available from: https://bdsc.indiana.edu/information/recipes/germanfood.html (2022).
- Dong, Z., et al. FlyNet 2.0: Drosophila heart 3D (2D + time) segmentation in optical coherence microscopy images using a convolutional long short-term memory neural network. Biomedical Optics Express. 11 (3), 1568-1579 (2020).
- Deisseroth, K. Optogenetics. Nature Methods. 8 (1), 26-29 (2011).
- Backhaus, B., Sulkowski, E., Schlote, F. W. A semi-synthetic, general-purpose medium for Drosophila melanogaster. Drosophila Information Service. 60, 210-212 (1984).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56(2019).
- Wolf, M. J., Rockman, H. A. Drosophila, genetic screens, and cardiac function. Circulation Research. 109 (7), 794-806 (2011).
- Choma, M. A., Suter, M. J., Vakoc, B. J., Bouma, B. E., Tearney, G. J. Physiological homology between Drosophila melanogaster and vertebrate cardiovascular systems. Disease Models & Mechanisms. 4 (3), 411-420 (2011).
- Ocorr, K., Vogler, G., Bodmer, R. Methods to assess Drosophila heart development, function and aging. Methods [Supplement to Methods in Enzymology]. 68 (1), 265-272 (2014).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Rotstein, B., Paululat, A. On the morphology of the Drosophila heart. Journal of Cardiovascular Development and Disease. 3 (2), 15(2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon