È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Nozioni di base sull'istologia e rilevamento della morte cellulare nel tessuto delle api
In questo articolo
Riepilogo
I metodi immunoistochimici sono utili nella ricerca sulle api per rilevare e valutare il livello di apoptosi e necrosi nell'intestino medio e nelle ghiandole ipofaringee delle api adulte.
Abstract
Le api mellifere (Apis mellifera L.) all'interno dell'alveare (lavoratrici nutrici e altre api dell'alveare) e all'esterno dell'alveare (raccoglitrici) sono esposte ai cambiamenti climatici e climatici, vari pesticidi, agenti patogeni e malnutrizione, entrando principalmente attraverso la bocca e colpendo principalmente i tratti digestivi delle api adulte. Per comprendere e prevenire gli effetti di tali fattori di stress esterni e interni sulle api, un utile metodo di ricerca è il metodo immunoistochimico. Viene descritto un protocollo di base per preparare l'intestino medio (ventricolo) e le ghiandole ipofaringee (HPG) delle api adulte per l'analisi istologica. Viene descritta una metodologia dettagliata per valutare il livello di danno cellulare e distinguere la necrosi dalla morte cellulare programmata (apoptosi) come processo naturale di rigenerazione dei tessuti. Vengono presentati i risultati del trattamento delle api adulte con acido ossalico e pesticidi (insetticida e acaricida) e la determinazione della morte cellulare nel ventricolo e negli HPG. Vengono inoltre discussi i pro e i contro della metodologia.
Introduzione
Le api mellifere (Apis mellifera L.) sono, tra gli altri impollinatori selvatici, i più importanti impollinatori delle piante agricole. Nel corso di migliaia di anni, l'ambiente mutevole ha influenzato le api ad adattare la loro morfologia, fisiologia, comportamento e tolleranza a diversi agenti patogeni e parassiti. Pertanto, le api hanno sviluppato una gamma molto diversificata di specie e sottospecie in tutto il mondo1. Questi risultati sono coerenti con i risultati precedenti, che c'è una variazione genetica nella struttura del tratto digestivo dell'ape, ma suggeriscono anche che le alterazioni dell'intestino medio sono dovute a fattori ambientali 2,3.
Il tratto digestivo dell'ape ha tre parti principali: foregut, midgut (ventricolo) e hindgut4. Il ventricolo è un organo essenziale per la digestione del polline e del nettare/miele; Nell'intestino posteriore, il controllo osmotico avviene attraverso l'assorbimento di acqua e ioni2. Le ghiandole ipofaringee (HPG) delle operaie delle api si trovano nella testa e sintetizzano e secernono componenti della pappa reale per nutrire la covata, la regina e i membri della colonia. Le loro dimensioni cambiano con l'età e le attività e dipendono da una corretta alimentazione (polline di qualità). Gli operatori infermieri di età compresa tra 6 e 18 giorni eseguono l'allevamento della covata e la dimensione degli HPG aumenta di 5,6. Nelle api bottinatrici, gli HPG degenerano e secernono solo enzimi importanti per convertire gli zuccheri complessi in quelli semplici (α-glucosidasi, leucina arilamidasi, invertasi) nel miele7.
Le api sono esposte a diversi fattori di stress biotici e abiotici8 e il tratto digestivo può essere influenzato da diversi stimolanti negativi. La prima barriera che protegge l'organismo dagli agenti patogeni è la membrana peritrofica nel midgut, che consiste nella mucosa intestinale per proteggersi dagli agenti patogeni4. Lo sviluppo e la funzione degli HPG dipendono dalla dieta, dall'età e dalla condizione della colonia9 e sono influenzati da insetticidi, acaricidi 10 e agenti patogeni11,12,13. I residui di acaricidi nell'alveare dovuti al trattamento di controllo della varroa e ai pesticidi dall'ambiente colpiscono le api bottinatrici e le api nutrici14,15. La più grande minaccia per le colonie di api è l'acaro Varroa destructor, sia come vettore di virus che contribuiscono alla perdita di colonie16 sia come consumatore del corpo grasso dell'ospite (un importante organo vitale nelle api), che di conseguenza influenza il corpo dell'individuo e le funzioni della colonia17.
Tuttavia, gli habitat intensivi dei terreni agricoli possono fornire un approvvigionamento alimentare a breve termine per le api mellifere. Pertanto, i regimi agroambientali dovrebbero migliorare la disponibilità di fiori di miele nei paesaggi agricoli18. Per valutare la morfologia di diverse sottospecie 6,19,20,21 o gli effetti subletali di questi fattori a livello cellulare o tissutale, in particolare midgut e HPG, i metodi istologici e immunoistochimici sono pratici e sufficientemente accurati per essere utilizzati nella ricerca istologica nelle api mellifere.
Protocollo
1. Istologia di base per la ricerca sulle api
- Dissezione del tessuto delle api
NOTA: Per la dissezione delle api operaie, utilizzare un microscopio da dissezione con una sorgente luminosa a LED. L'ingrandimento più utile è ~ 20x.- Manipolazione e dissezione
- Prendere con cautela un'ape operaia con una pinza e metterla sul ghiaccio (o nel congelatore a -20 ° C) per 2 minuti per immobilizzarla22. Appuntare l'ape sulla piastra di Petri diagonalmente attraverso la parte posteriore superiore del torace due volte, da sinistra a destra e da destra a sinistra.
- Versare soluzione salina per insetti per coprire il corpo. Posizionare la capsula di Petri al microscopio, mettere a fuoco e regolare.
- Preparare gli strumenti (vedere la tabella dei materiali).
- Dissezione del midgut
- Inizia con l'addome inserendo un punto delle forbici sotto il tergite A5 (Figura 1) al centro del lato destro del corpo dell'ape. Tagliare al tergite A2.
- Tenere la lama interna delle forbici parallela al lato del corpo per evitare di danneggiare gli organi interni. Girare le forbici a sinistra e fare un taglio; Girate a destra e fate un altro taglio. Apri delicatamente la parte sinistra dell'addome e fissala. Ripetere sull'altro lato.
- Usando una pinza con una mano, tirare delicatamente lo stomaco delle api verso l'alto e con le forbici nell'altra mano, tagliare alla fine dell'esofago. Tirare lo stomaco e l'intestino medio lontano dall'addome e tagliare il retto. Utilizzare una pipetta con soluzione salina di insetti e rimuovere eventuali feci o parti del tessuto.
- Dissezione di HPG
- Immobilizzare un'ape operaia sul ghiaccio come descritto al punto 1.1.1. Tagliare la testa e posizionarla sulla piastra più piccola con le antenne rivolte verso l'alto. Fissare la testa con due perni: uno attraverso l'occhio composto sinistro e il secondo attraverso l'occhio composto destro.
- Effettuare un taglio attraverso il primo occhio composto sul lato interno dei perni, continuare fino al labbro, quindi eseguire un altro taglio sull'altro lato attraverso il secondo occhio composto (Figura 2).
- Tagliare le antenne. Togliere la maschera e tagliare dove ancora attaccato. Prendi la pinza e rimuovi con attenzione le ghiandole insieme al cervello e parte degli occhi composti.
- Manipolazione e dissezione
- Fissazione, disidratazione e incorporazione di paraffina
NOTA: Indossare guanti protettivi.- Posizionare il tessuto in flaconi di penicillina, riempiti per 3/4 con formalina al 10%. Conservare in frigorifero a 4 °C.
- Dopo 24 ore, disidratare il tessuto in una serie di alcoli: 70%, 80%, 90%, 100%, per 1 ora ciascuno, 100% 2-propanolo per 1 ora, 100% 2-propanolo per 12 h e infine 100% 2-propanolo per 1 ora.
- Posizionare il tessuto in istocassette; marcarli e porli nelle camere di vetro con 2-propanolo e paraffina (1:1) in un incubatore a 60 °C per 24 ore.
- Spostare le istocassette in un'altra camera con paraffina (I.) per altre 24 ore. Ripetere la procedura con paraffina fresca altre due volte (II. e III.), entrambe per 24 ore.
- Infine, preparare la stazione di montaggio e iniziare a incorporare il tessuto nella cera.
- Aprire ogni istocassetta e rimuovere il coperchio. Riempire lo stampo con la cera e mettere con cura il tessuto con una pinza calda nel mezzo dello stampo.
- Posizionare l'istocassetta sullo stampo e coprirla leggermente con la cera. Posizionare immediatamente lo stampo sulla superficie fredda della stazione di montaggio per alcuni secondi, quindi posizionarlo sulla piastra fredda per alcuni minuti fino a quando la cera non si indurisce e si separa dallo stampo insieme e dall'istocassetta.
- Conservare i campioni finiti in una scatola, lontano da polvere e calore.
- Tagliare sezioni sottili di 4 μm su un microtomo: prima, due sezioni attaccate l'una all'altra e poi una separatamente. Trasferite le sezioni con una pinza e lasciatele galleggiare su acqua distillata (42 °C), quindi raccoglietele su vetrini puliti accostando due sezioni sul lato sinistro del vetro dell'obiettivo e la terza sul lato destro, rimanendo nettamente separate. Lasciare i vetrini segnati durante la notte sul dispositivo di riscaldamento e infine conservarli in una scatola dedicata per i campioni istologici.
- Deceratura e reidratazione
NOTA: Indossare guanti protettivi.- Preparare nove vasetti Coplin e mettere le sezioni in una serie di agenti chiarificatori (I., II., III.) per 5 minuti ciascuno.
- Mettere in 2-propanolo, etanolo 96% (I., II.), alcool 90% e 80% e acqua distillata per 3 minuti ciascuno.
- Tintura con ematossilina ed eosina
NOTA: Indossare guanti protettivi.- Preparare sei barattoli Coplin.
- Per la colorazione dell'ematossilina e dell'eosina (H & E), mettere le sezioni decerate e reidratate in ematossilina per 5 minuti, quindi posizionarle con cura sotto l'acqua corrente del rubinetto per 2 minuti. Quindi metterli in acqua distillata per 1 minuto e eosina per 4 minuti (per eosin, il barattolo Coplin non è necessario).
- Posizionare i vetrini in etanolo al 96% per 1 minuto, quindi 2-propanolo per 2 minuti e infine nell'agente di compensazione per 2 minuti.
- Aggiungere il mezzo di montaggio e un bicchiere di copertura e lasciarli asciugare. Osservare al microscopio ottico.
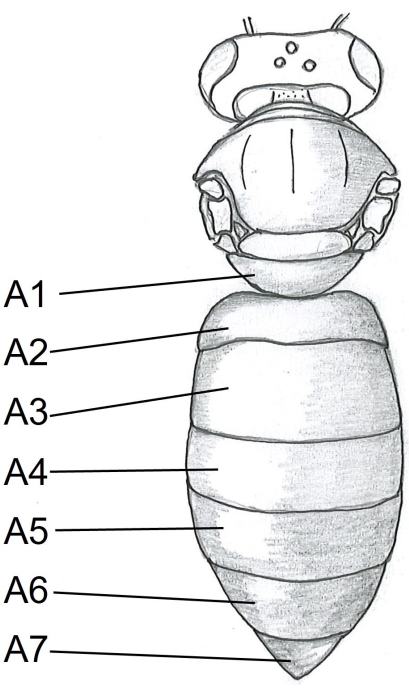
Figura 1: Vista dorsale del corpo delle api. A1-A7 tergiti. Le istruzioni dettagliate sulla dissezione delle api possono essere trovate in Carreck et al.24. Fare clic qui per visualizzare una versione ingrandita di questa figura.
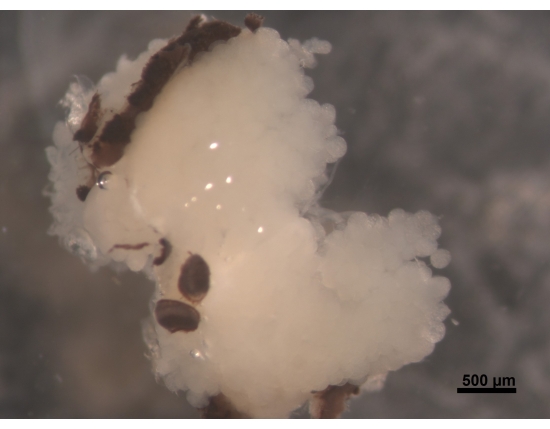
Figura 2: Vista dorsale degli HPG, parti degli occhi composti attaccati al cervello (non visibili). Una giovane ape operaia di età compresa tra 5 e 6 giorni ha HPG paffuti e bianchi crema. Gli acini si trovano sul cervello e riempiono l'area della testa con rami che raggiungono la parte posteriore del cervello. Nelle api bottinatrici, queste ghiandole sono notevolmente rimpicciolite e lasciano solo sottili resti filiformi. Per questo motivo, è meglio rimuovere le ghiandole insieme al cervello per rendere più facile in ulteriori procedure per evitare di perdere il tessuto. Barra di scala = 500 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Rilevamento della morte cellulare nelle sezioni di tessuto
- Kit di rilevamento dell'apoptosi (Saggio A)
NOTA: seguire il protocollo del produttore (vedere la tabella dei materiali).- Preparare i barattoli Coplin.
- Dopo la deceratura e la reidratazione (vedere punto 1.3), immergere i vetrini in una soluzione di NaCl allo 0,85% e quindi in soluzione salina tamponata con fosfato (PBS) (5 min).
- Mettere i vetrini in paraformaldeide al 4% 2 x 15 min.
- Posizionare i vetrini in piano nel contenitore e aggiungere 100 μL di una soluzione di proteinasi K (20 μg/ml), quindi lasciarli per 10-30 minuti.
- Posizionare le diapositive in PBS (5 min).
- Posizionare i vetrini in paraformaldeide al 4% in PBS (5 min).
- Immergere le diapositive in PBS (2 x 5 min).
- Posizionare i vetrini nel contenitore, aggiungere 100 μL di tampone di equilibrio e lasciarli per 5-10 minuti.
- Aggiungere 100 μL di miscela di reazione TdT. Metti gli asciugamani di carta all'interno del contenitore, intorno ai vetrini, inumidisci gli asciugamani con acqua e poi coprili con pellicola trasparente. Incubare i vetrini per 60 minuti a 37 °C.
- Riporre i vetrini nello scaffale di colorazione e immergerli in 2x citrato salino-sodico (SSC) per 15 minuti.
- Immergere le diapositive 3 x 5 minuti in PBS, poi in perossido di idrogeno allo 0,3% per 3-5 minuti, e poi di nuovo in PBS, 3 x 5 min.
- Anche in questo caso, posizionare i vetrini in piano nel contenitore, aggiungere 100 μL di Streptavidina HRP (perossidasi di rafano) e lasciare agire per 30 minuti (coprire con pellicola trasparente).
- Immergi le diapositive 3 x 5 minuti in PBS.
- Posizionare i vetrini nel contenitore e aggiungere 100 μL di soluzione di 3,3'-diaminobenzidina (DAB). Cerca uno sfondo marrone chiaro.
- Rimettere i vetrini sul rack e lavarli più volte in acqua (doppia distillazione).
- Montare le guide sotto i vetrini nel mezzo di montaggio e lasciare asciugare in piano.
- Osservare al microscopio ottico.
- Kit di rilevamento dell'apoptosi (Saggio B)
NOTA: seguire il protocollo del produttore (vedere la tabella dei materiali).- Preparare i barattoli Coplin.
- Preparare la proteinasi K (20 μg/mL diluita in PBS).
- Dopo aver decerato e reidratato le sezioni (punto 1.3), posizionare i vetrini in PBS per 5 minuti.
- Posizionare i vetrini in piano nel contenitore e aggiungere la proteinasi K (20 μg/ml, 60 μL per campione di 5 cm²).
- Lavare i vetrini 2 x 2 minuti in acqua distillata.
- Estinzione in perossidasi endogena (in perossidasi idrogena al 3%) a temperatura ambiente.
- Risciacquare i vetrini 2 x 5 minuti con PBS o acqua.
- Posizionare i vetrini in piano nel contenitore e applicare il tampone di equilibrio (75 μL/5 cm2) per 10 s a temperatura ambiente.
- Pulire accuratamente intorno al tessuto.
- Aggiungere l'enzima TdT (desossinucleotidil transferasi terminale) a ciascuna sezione e incubare in camera umidificata per 1 ora a 37 °C. Metti gli asciugamani di carta all'interno del vassoio, intorno alle diapositive, inumidisci gli asciugamani con acqua e coprili con pellicola trasparente.
- Dopo l'incubazione, mettere i campioni nello scaffale e lasciarli in tampone di arresto/lavaggio (10 min).
- Riscaldare l'anti-digoxigenina coniugata a temperatura ambiente.
- Lavare i vetrini in PBS (3 x 1 min).
- Pulire accuratamente intorno al tessuto.
- Aggiungere due gocce di coniugato anti-digossigenina-perossidasi (65 μL/5 cm²) alle sezioni e incubare per 30 minuti in un contenitore umidificato.
- Dopo il lavaggio in PBS 4 x 2 min, preparare il substrato di perossidasi di forza di lavoro e picchiettare delicatamente il liquido in eccesso e aspirare intorno alla sezione.
- Coprire le sezioni con substrato di perossidasi (75 μL/5 cm²) e colorare per 5 minuti. Posizionare un vetrino sotto il microscopio e determinare il tempo di colorazione ottimale.
- Lavare i vetrini in uno stendibiancheria in acqua distillata (3 x 1 min).
- Incubare i vetrini in acqua distillata per 5 min.
- Controcolorazione con ematossilina per 2 min.
- Posizionare lo scivolo sotto l'acqua corrente del rubinetto per 3 minuti.
- Lavare il vetrino in acqua distillata.
- Montare le guide sotto i vetrini nel mezzo di montaggio e lasciare asciugare in piano.
- Osservare al microscopio ottico.
- Kit di rilevamento dell'apoptosi (Saggio C)
NOTA: seguire il protocollo del produttore (vedere la tabella dei materiali).- Preparare i barattoli Coplin.
- Decerare e reidratare le sezioni di tessuto (vedere punto 1.3).
- Incubare il tessuto con la proteinasi K (15-30 min a 37 °C).
- Riposizionare i vetrini sul rack e risciacquarli 2 volte in PBS.
- Coprire con 50 μL di «miscela di reazione TUNEL». Introdurre gli asciugamani di carta bagnati all'interno del contenitore, coprirli con pellicola trasparente e lasciarli per 60 minuti a 37 °C.
- Risciacquare 3 volte con PBS.
- Posizionare i vetrini nel contenitore e asciugare l'area intorno al campione di tessuto.
- Aggiungere 50 μL di Converter-AP al campione e incubare in un contenitore umidificato per 30 minuti a 37 °C.
- Risciacquare 3 volte in PBS.
- Aggiungere 50-100 μL di soluzione di substrato e lasciare per 10 minuti al buio.
NOTA: Osservare la colorazione al microscopio ottico. - Risciacquare i vetrini 3 volte con PBS.
- Contromacchia trasferendo le sezioni in ematossilina per 2 minuti e poi risciacquare accuratamente con acqua corrente del rubinetto per 5 minuti.
- Montare le guide sotto i vetrini in un mezzo di montaggio acquoso e lasciarle asciugare piatte.
- Osservare al microscopio ottico. Valutare le cellule colpite (positive) contando da 70 a 100 cellule in ciascun campione dell'intestino medio o HPG al microscopio ottico.
Risultati
Rilevamento della morte cellulare nel midgut
Le api operaie appena emerse (Apis mellifera carnica) dall'apiario sperimentale dell'Istituto agricolo sloveno di Lubiana sono state trattate individualmente con acido ossalico (OA) al 3%. L'OA è spesso usato in apicoltura per il controllo del distruttore di Varroa . Dopo il trattamento, le api operaie (tre per ogni gruppo) sono state immobilizzate sul ghiaccio. Il midgut è stato sezionato e fissato in formalina a...
Discussione
Negli organismi viventi, la morte cellulare è definita come apoptosi o necrosi25 e può essere accompagnata da autofagia26. La differenza tra cellule apoptotiche e necrotiche è che l'apoptosi è una forma di morte cellulare programmata e appare nelle cellule normali, mentre la necrosi si verifica a causa di condizioni letali (ad esempio, incidente, malattia)27,28. L'apoptosi può essere rilevata utilizzando kit di...
Divulgazioni
L'autore non ha conflitti di interesse.
Riconoscimenti
Riconosco con gratitudine il sostegno dell'Agenzia di ricerca slovena, sovvenzione n. P4-133.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-Propanol | |||
| ApopTag Peroxidase kit (ApopTag Peroxidase In Situ Apoptosis Detection) | Sigma-Aldrich | S7100 | Assay B, https://www.sigmaaldrich.com/SI/en/product/mm/s7100?gclid=CjwKCA jw7vuUBhBUEiwAEdu2pPanI9SE j81ZTl-nLHEoxXAv7ViKwPA_QRx H7fciMRNcYwR7lbPQbhoCqcQQA vD_BwE; Positive controls included in S7101 |
| Covers | |||
| DeadEnd Colorimetric TUNEL system | Promega | G7360 | Assay A, https://worldwide.promega.com/products/cell-health-assays/apoptosis-assays/deadend-colorimetric-tunel-system/?catNum=G7360 |
| Dissecting microscope (for bee dissection) | Zeiss | ||
| Distilled water | |||
| Embedding cassette | |||
| EnVision System alkaline phosphatase kit | Dako | ||
| Eosin Y Solution | Sigma-Aldrich | alcoholic | |
| Ethanol | 95% (or less pure), 90%, 80% | ||
| Faramount mounting medium, aqueous | Dako | mounting medium | |
| Flattening table | Leica | HI1220 | |
| Forceps (for bee dissection) | Fine science tools | 11294-00 | Standard #4 |
| Formalin 10% | Formaldehyde | ||
| Hematoxylin | Sigma-Aldrich | ||
| HistoChoice Clearing Agent | Sigma-Aldrich | clearing agent | |
| Hydrogen peroxidase 3% | |||
| Incubator | BioRad | ||
| Insect pins (for bee dissection) | Entosphinx | 44594 | Insect pins stainless steel – white, size 2 |
| ISCDDK, AP (In Situ Cell Death Detecteion Kit, Alkaline Phosphatase) | Roche | 11684809910 | Assay C, https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/362/737/11684809910b ul.pdf |
| KH2PO4 | |||
| Lab clock | |||
| Light microscope | Leica | ||
| Microscope slides | Box with the slides must be preserved in a plastic wrap to prevent dust | ||
| Microtome | Leica | ||
| Modular tissue embedding station | Leica | ||
| Na2HPO4 | |||
| NaCl | |||
| Paraformaldehyde 4% | |||
| Paraplast | Leica | ||
| Pasteur pipettes | 1.5 mL; 3 mL | ||
| PBS | |||
| Petri dish (for bee dissection) | Filled with condensation silicon (Xantoprene L blue and Universal liquid plus activator) | ||
| Proteinase K | Merck | 21627 | |
| Ringers' solution (for bee dissection) | 7.5 g NaCL, 2.38 g Na2HPO4, 2.72 g KH2PO4, 1 L distilled water | ||
| Scissors (for bee dissection) | Fine science tools | 1406-09, 14061-09 | Straight and curved, 9 cm |
| Universal liquid plus activator (for bee dissection) | Kulzer | ||
| Watchmaker’s forceps (for bee dissection) | Fine science tools | 91100-12 | |
| Water bath | Leica | ||
| Watercolor brush | 2x | ||
| Xantoprene L blue (for bee dissection) | Kulzer |
Riferimenti
- Ruttner, F. . Naturgeschichte der Honigbienen. , (1992).
- Jordan, R. Kleine Bienenkunde. Österreichischer Agrarverlag Wien München. , 41-45 (1964).
- Snodgrass, R. E. The Anatomy of the Honey Bee. The Hive and the Honey Bee. , 111-113 (1975).
- Snodgrass, R. E. . The Anatomy of the Honey Bee. , (2004).
- Hrassnigg, N., Crailsheim, K. Adaptation of hypopharyngeal gland development to the brood status of honeybee (Apis mellifera L.) colonies. Journal of Insect Physiology. 44 (10), 929-939 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Characteristics of hypopharyngeal glands in honeybees (Apis mellifera carnica) from a nurse colony. Slovenian Veterinary Research. 52 (2), 67-74 (2015).
- Kubo, T. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera L.) with age and/or role. Journal of Biochemistry. 119 (2), 291-295 (1996).
- Sammataro, D., Yoder, J. A. . Honey bee colony health: Challenges and sustainable solutions. , 302 (2012).
- Crailsheim, K., Stolberg, E. Influence of diet, age and colony condition upon intestinal proteolytic activity and size of the hypopharyngeal glands in the honeybee (Apis mellifera L.). Journal of Insect Physiology. 35 (8), 595-602 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Heat shock proteins and cell death in situ localisation in hypopharyngeal glands of honeybee (Apis mellifera carnica) workers after imidacloprid or coumaphos treatment. Apidologie. 41 (1), 73-86 (2010).
- Gregorc, A., Bowen, I. D. The histochemical characterisation of cell death in honeybee larvae midgut after treatment with Paenibacillus larvae, Amitraz and Oxytetracycline. Cell Biology International. 24 (5), 319-324 (2000).
- Higes, M., et al. Apoptosis in the pathogenesis of Nosema ceranae (Microsporidia: Nosematidae) in honey bees (Apis mellifera). Environmental Microbiology Reports. 5 (4), 530-536 (2013).
- Kurze, C., et al. Infection dynamics of Nosema ceranae in honey bee midgut and host cell apoptosis. Journal of Invertebrate Pathology. 154, 1-4 (2018).
- Johnson, R. M. Honey bee toxicology. Annual Review of Entomology. 60 (1), 415-434 (2005).
- Gashout, H. A., Guzman-Novoa, E., Goodwin, P. H. Synthetic and natural acaricides impair hygienic and foraging behaviors of honey bees. Apidologie. 51 (6), 1155-1165 (2020).
- McMenamin, A. J., Genersch, E. Honey bee colony losses and associated viruses. Current Opinion in Insect Science. 8, 121-129 (2015).
- Ramsey, S. D., et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proceedings of the National Academy of Sciences USA. 116 (5), 1792-1801 (2019).
- Requier, F., et al. Honey bee diet in intensive farmland habitats reveals an unexpectedly high flower richness and a major role of weeds. Ecological Applications. 25 (4), 881-890 (2015).
- Santos, C., Serrão, J. Histology of the ileum in bees (Hymenoptera, Apoidea). Brazilian Journal of Morphological Sciences. 23 (3), 405-413 (2006).
- Suwannapong, G., Saichon, C., Benbow, M. Histochemical comparison of the hypopharyngeal gland in Apis cerana Fabricius, 1793 workers and Apis mellifera Linnaeus, 1758 workers. Psyche: A Journal of Entomology. , (2010).
- Ceylan, A., Sevin, S., Özgenç, &. #. 2. 1. 4. ;. Histomorphological and histochemical structure of the midgut and hindgut of the Caucasian honey bee (Apis mellifera caucasia). Turkish Journal of Veterinary and Animal Sciences. 43 (6), 747-753 (2019).
- Human, H., et al. Miscellaneous standard methods for Apis mellifera research. Journal of Apicultural Research. 52 (4), 1-53 (2013).
- Gregorc, A., Smodiš Škerl, M. I. Toxicological and immunohistochemical testing of honeybees after oxalic and rotenone treatments. Apidologie. 38 (3), 296-305 (2007).
- Carreck, N. L., et al. Standard methods for Apis mellifera anatomy and dissection. Journal of Apicultural Research. 52 (4), 1-40 (2013).
- Bowen, I. D., Bowen, S. M., Jones, A. H. . Mitosis and apoptosis: Matters of Life and Death. , (1998).
- Eisenberg-Lerner, A., et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death and Differentiation. 16 (7), 966-975 (2009).
- Bowen, I. D., Mullarkey, K., Morgan, S. M. Programmed cell death in the salivary gland of the blow fly Calliphora vomitoria. Microscopy Research Techniques. 34, 202-207 (1996).
- D'Arcy, M. S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 43 (6), 582-592 (2019).
- Matylevitch, N. P., et al. Apoptosis and accidental cell death in cultured human keratinocytes after thermal injury. American Journal of Pathology. 153 (2), 567-577 (1998).
- Perry, S. W., Epstein, L. G., Gelbard, H. A. Simultaneous in situ detection of apoptosis and necrosis in monolayer cultures by TUNEL and trypan blue staining. BioTechniques. 22 (6), 1102-1106 (1997).
- Cuello-Carrion, F. D., Ciocca, D. Improved detection of apoptotic cells using a modified in situ TUNEL technique. Journal of Histochemistry and Cytochemistry. 47 (6), 837-839 (1999).
- Gregorc, A., Bowen, I. D. Programmed cell death in the honeybee (Apis mellifera L.) larvae midgut. Cell Biology International. 21 (3), 151-158 (1997).
- Gregorc, A., Pogačnik, A., Bowen, I. D. Cell death in honey bee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie. 35 (5), 453-460 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon